Пероральна фармацевтична композиція у вигляді множинної дозованої форми з модифікованим вивільненням і спосіб її одержання
Формула / Реферат
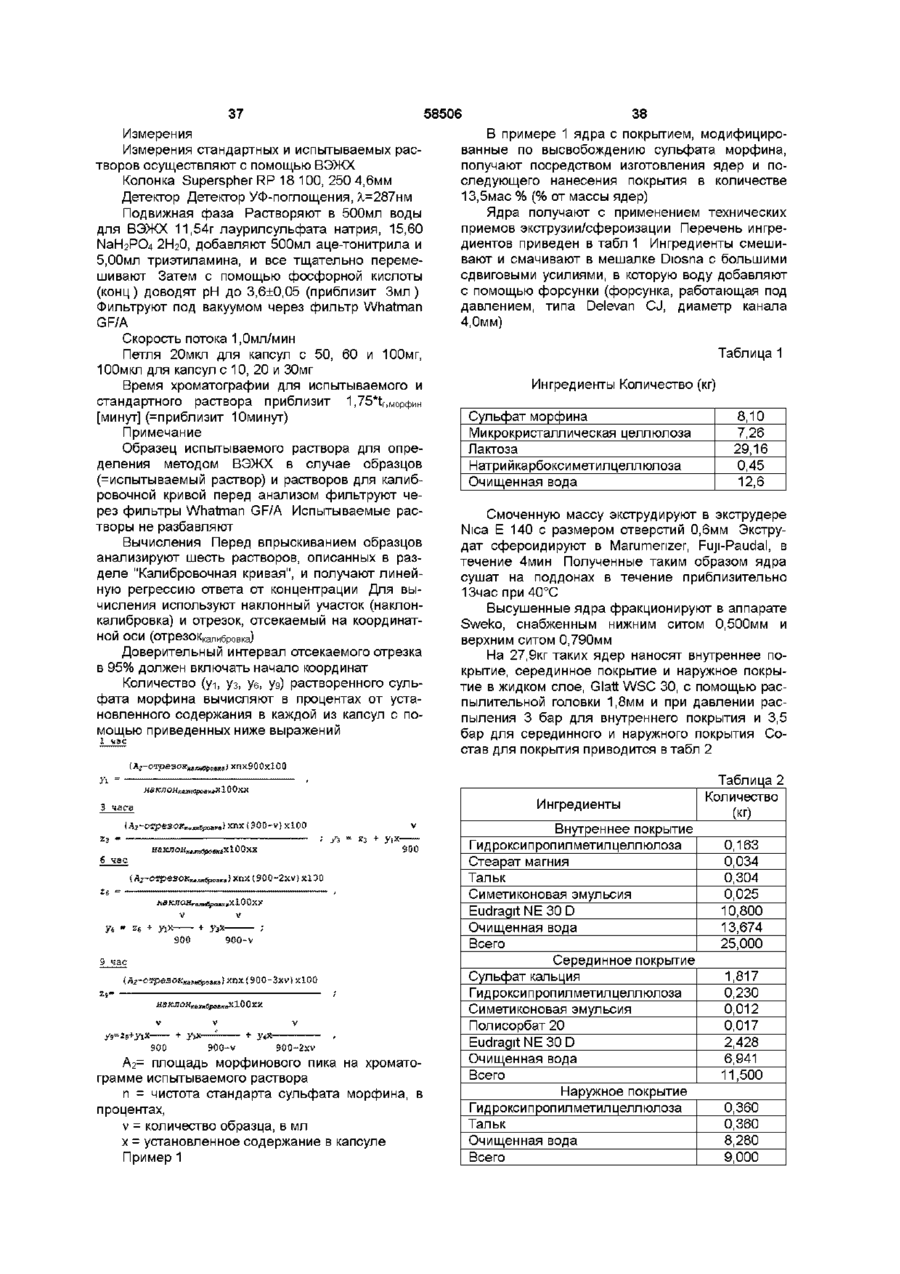
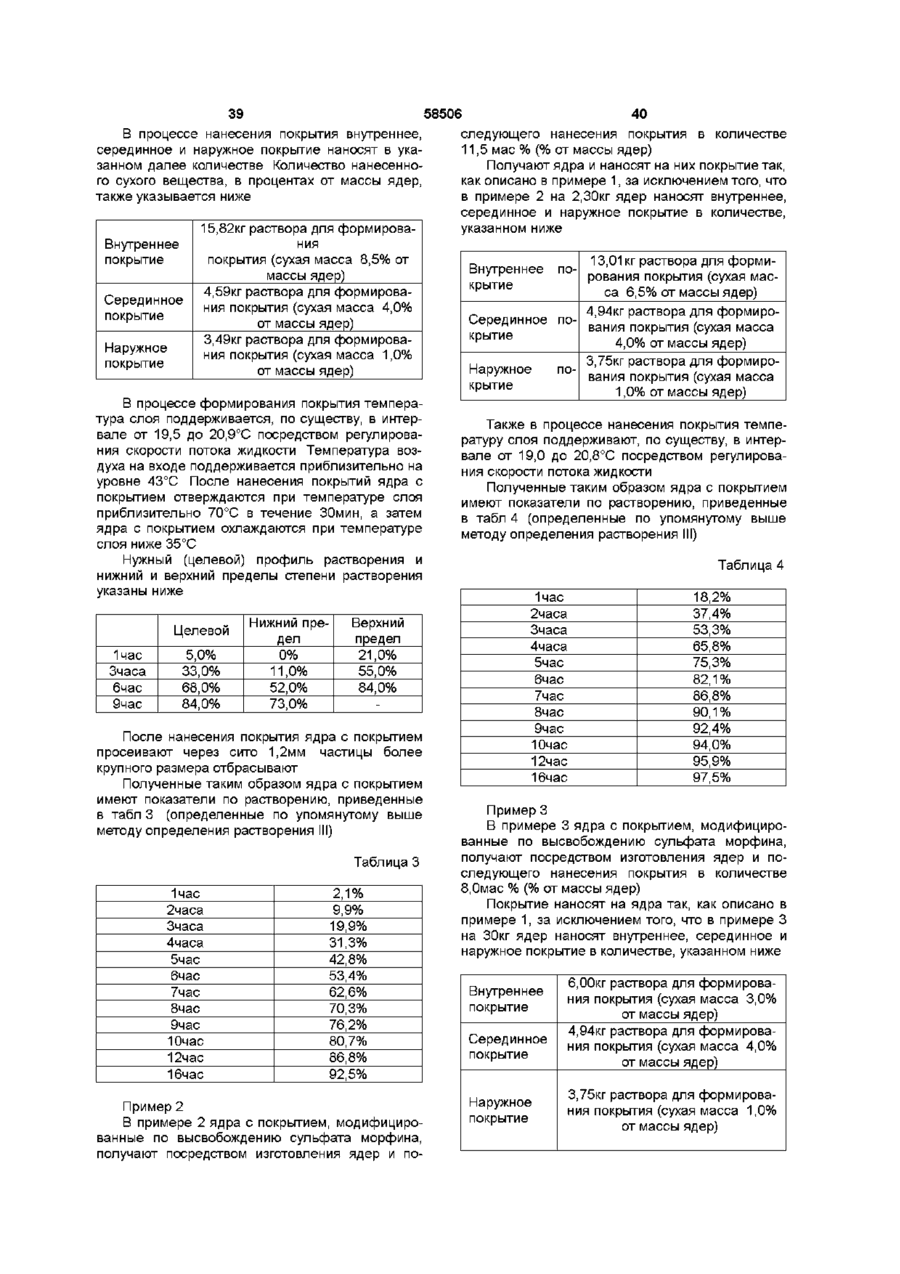
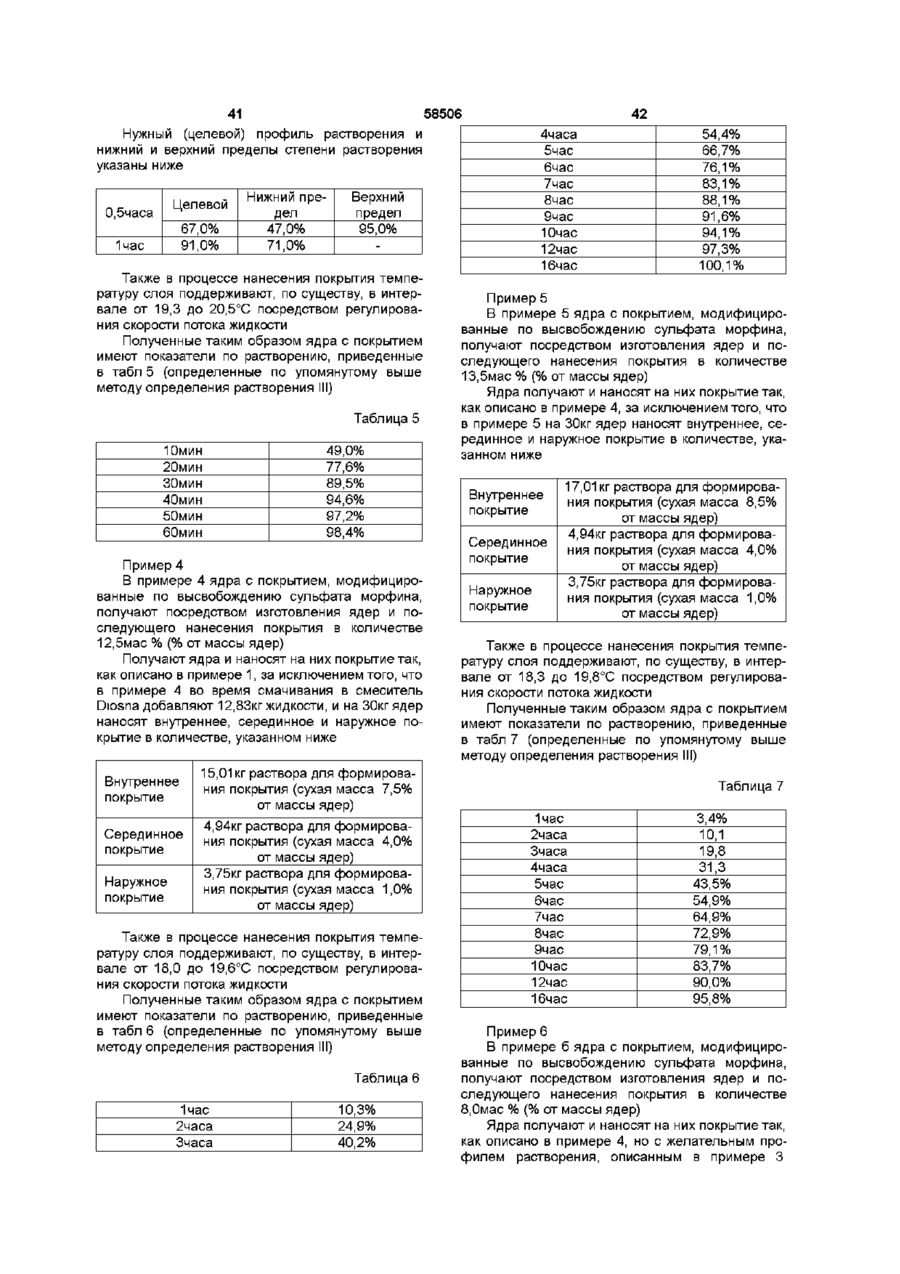
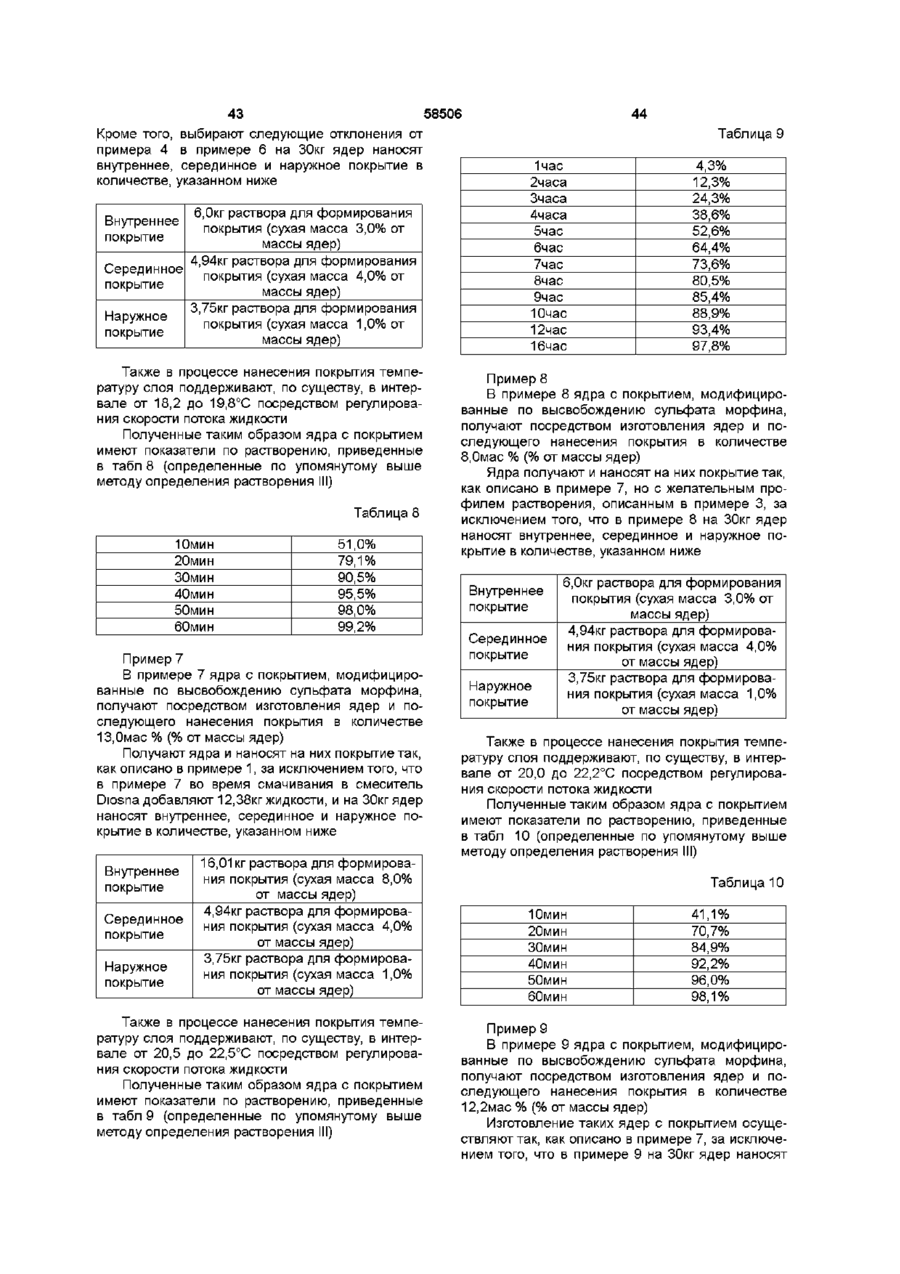
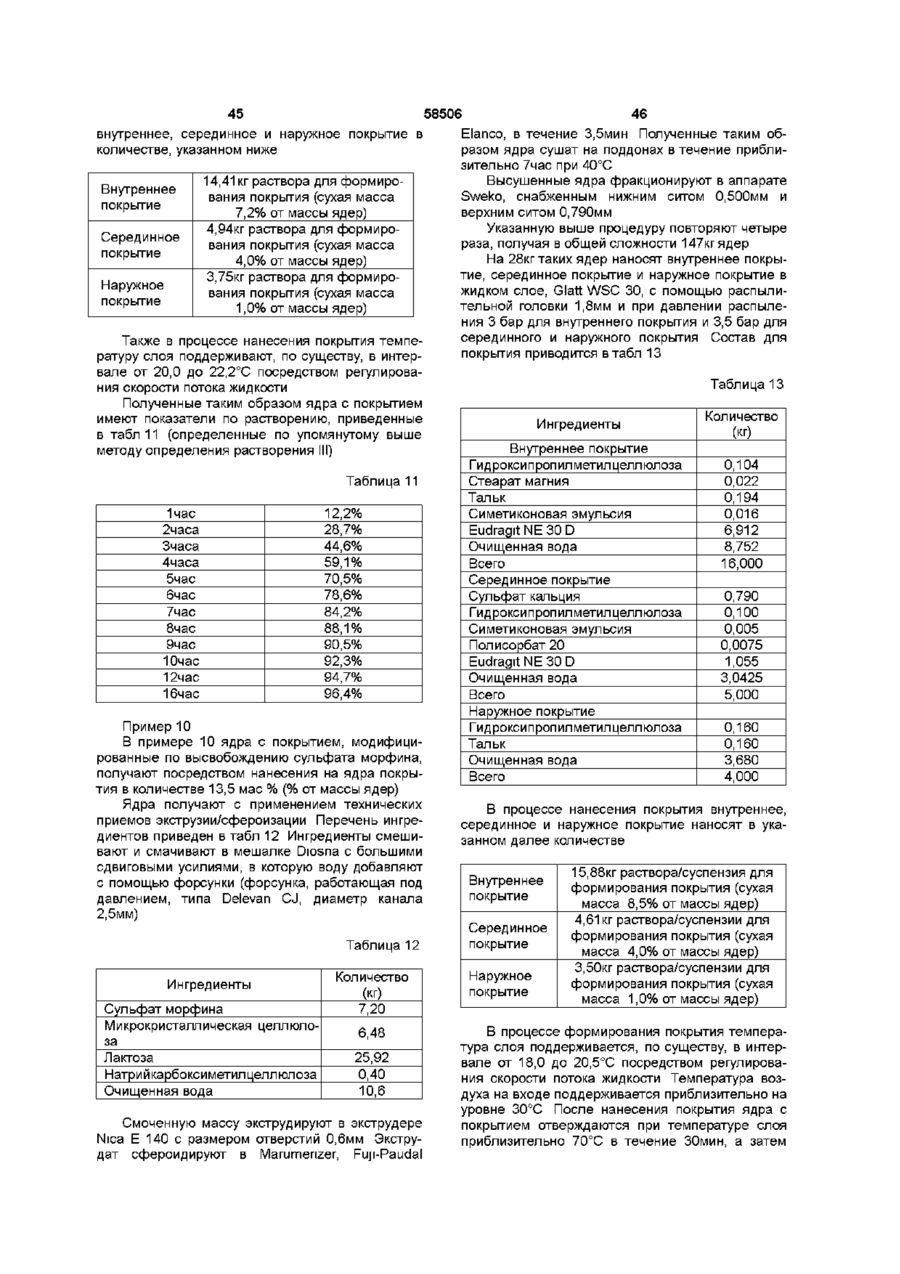
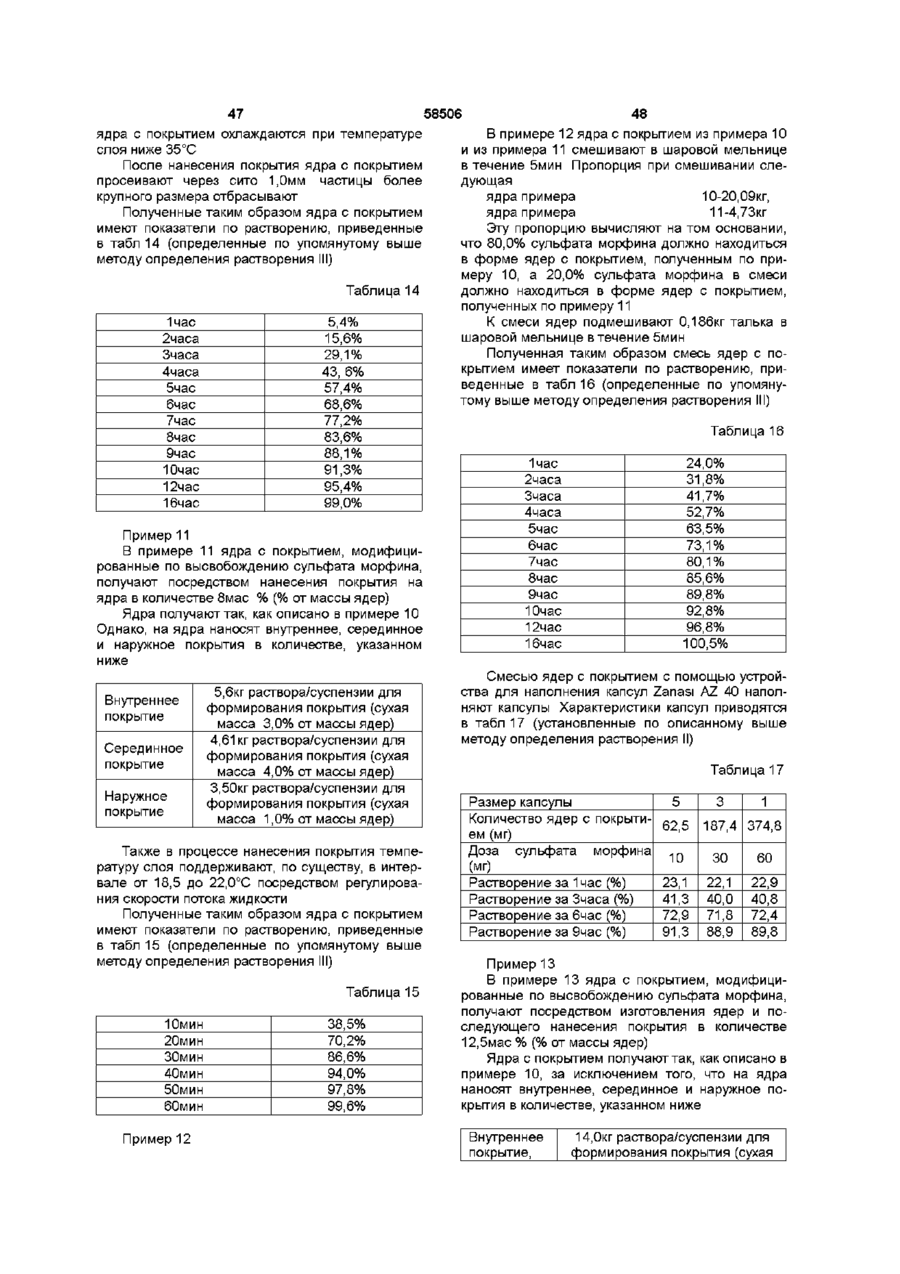
1. Пероральная фармацевтическая композиции в виде множественной дозированной формы с модифицированным высвобождением для введения анальгетически эффективного количества опиоида для получения как относительно быстрого наступления анальгетического действия, так и поддержания анальгетически активной концентрации в плазме в течение по крайней мере 12 часов, причем единица дозы композиции содержит по меньшей мере две следующие фракции множественной дозированной формы: первую фракцию множественной дозированной формы с покрытием и относительно быстрым высвобождением для относительно быстрого высвобождения опиоида in vivo для получения терапевтически активной концентрации в плазме в течение относительно короткого промежутка времени, и вторую фракцию множественной дозированной формы с покрытием для отсроченного высвобождения опиоида in vivo для поддержания анальгетически активной концентрации в плазме в течение периода по меньшей мере в 12 часов, причем первая и вторая фракции составлены таким образом в отношении высвобождения из них и в отношении соотношения между первой и второй фракцией в единице дозы, чтобы получить
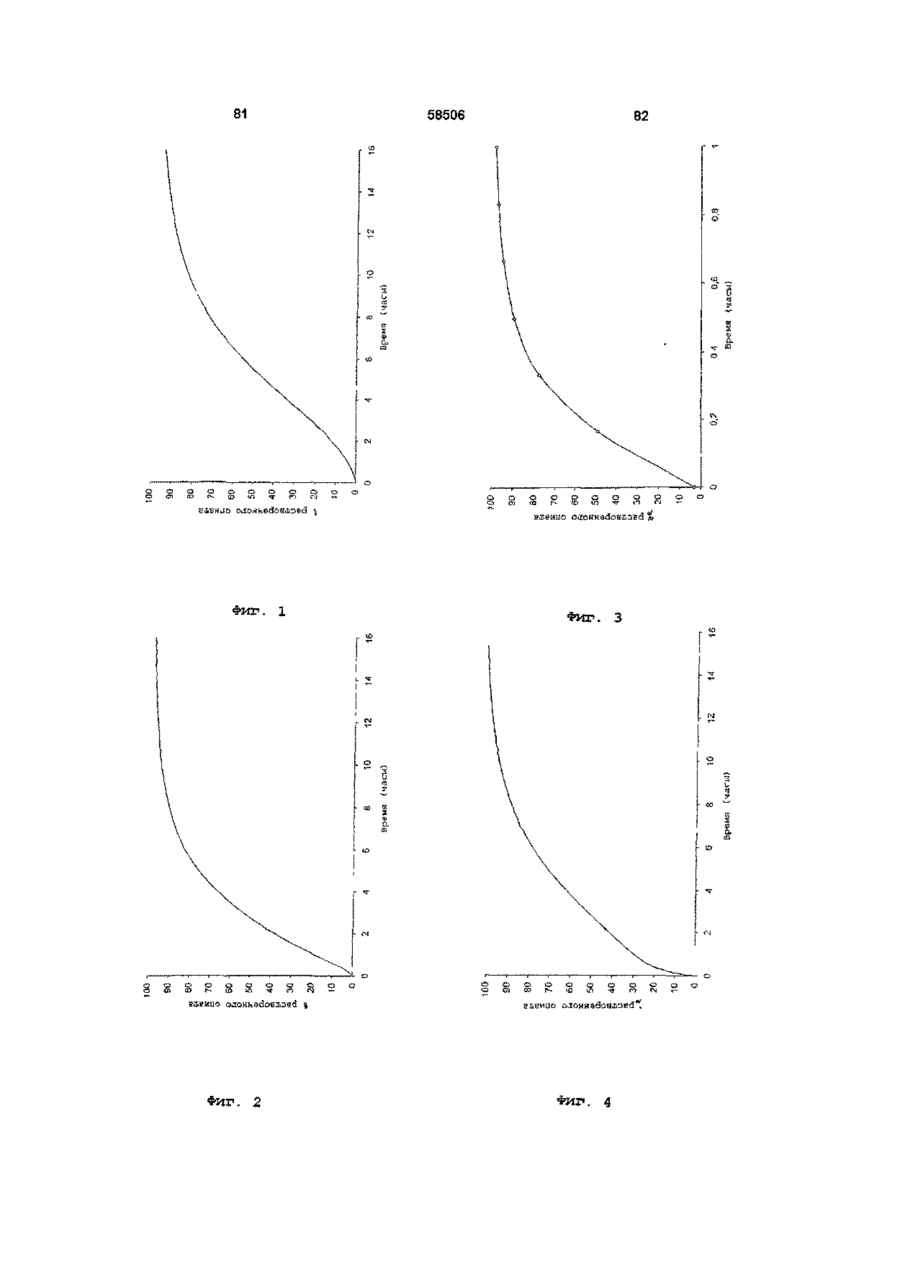
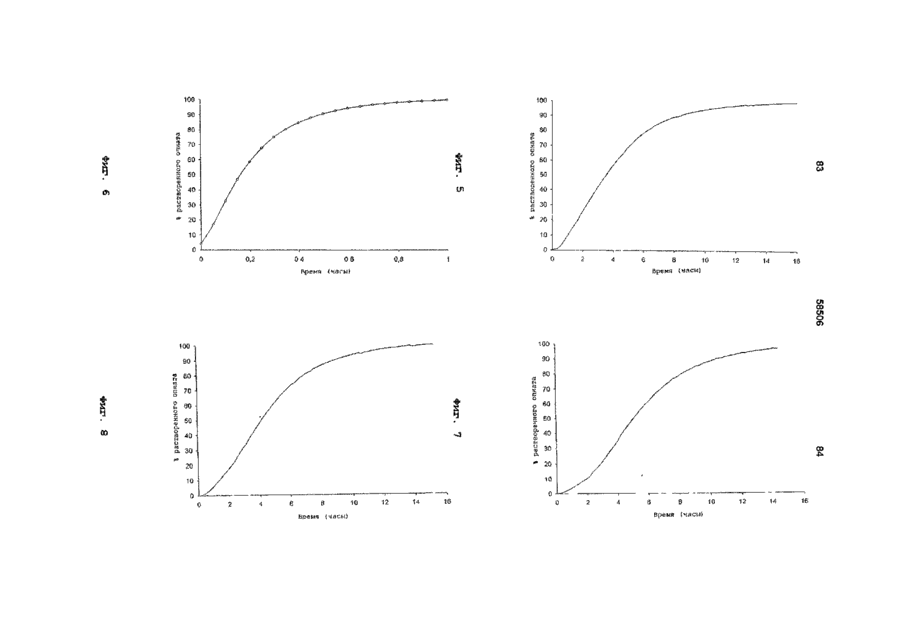
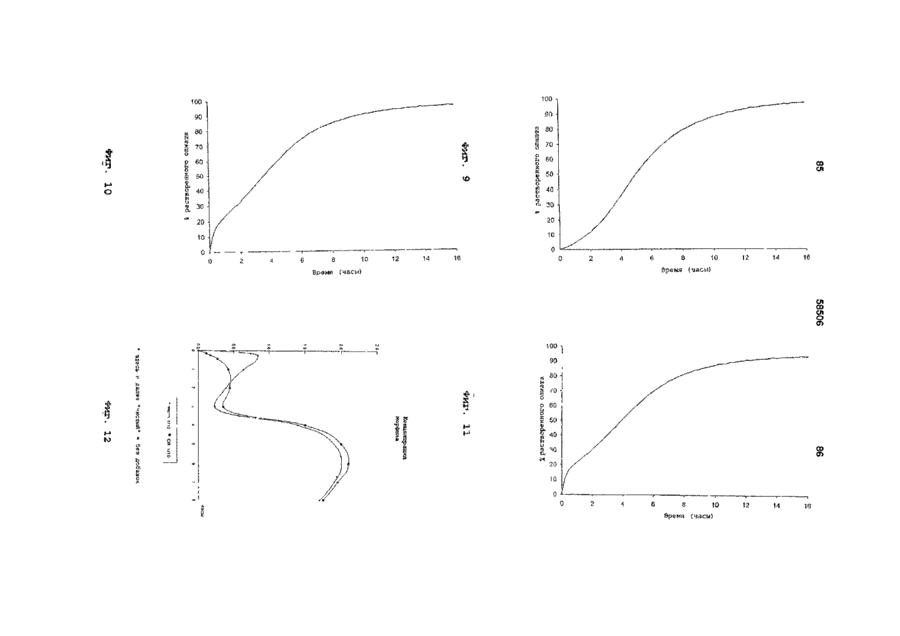
I) относительно быстрое in vitro высвобождение опиоида из первой фракции множественной дозированной формы, с относительно быстрым высвобождением как определено методом растворения с использованием лопастной мешалки согласно Фармакопее США (ФСША), при скорости вращения 100 об/мин, температуре 37°C и 0,1 н хлористоводородной кислоты в качестве растворяющей среды
II) отсроченное in vitro высвобождение опиоида из второй фракции множественной дозированной формы с отсроченным высвобождением, относительно высвобождения in vitro опиоида из первой фракции, при определении указанным методом растворения, причем быстрое высвобождение и отсроченное высвобождение in vitro адаптированы таким образом, что первая фракция, по существу, высвобождается, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению опиоида, содержащегося в первой фракции, высвобождается 10% опиоида, содержащегося во второй фракции, как определено указанным методом растворения.
2. Композиция по п. 1, отличающаяся тем, что характеристики растворения in vitro первой фракции множественной дозированной формы с относительно быстрым высвобождением обеспечивают в течение 0,5 часа высвобождение, по меньшей мере, 30% опиоида при определении указанным в п. 1 методом растворения.
3. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro первой фракции множественной дозированной формы с относительно быстрым высвобождением обеспечивают в течение 1 часа высвобождение, по меньшей мере, 50% опиоида при определении указанным в п. 1 методом растворения.
4. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 1 часа высвобождение 0 %-30 % опиоида, при определении указанным в п. 1 методом растворения.
5. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 3 часов высвобождение, по меньшей мере, 10%-70% опиоида, при определении указанным в п. 1 методом растворения.
6. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 6 часов высвобождение 35%-95% опиоида, при определении указанным в п. 1 методом растворения.
7. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 9 часов высвобождение 50%-100% опиоида, при определении указанным в п. 1 методом растворения.
8. Композиция по п. 1, отличающаяся тем, что характеристики растворения in vitro первой и второй фракций адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению первой фракции, и из второй фракции высвобождается 5%, при определении указанным в п.1 методом растворения.
9. Композиция по п. 1, отличающаяся тем, что характеристики растворения in vitro первой и второй фракций адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 70% высвобождению первой фракции, из второй фракции высвобождается 10%, при определении указанным в п. 1 методом растворения.
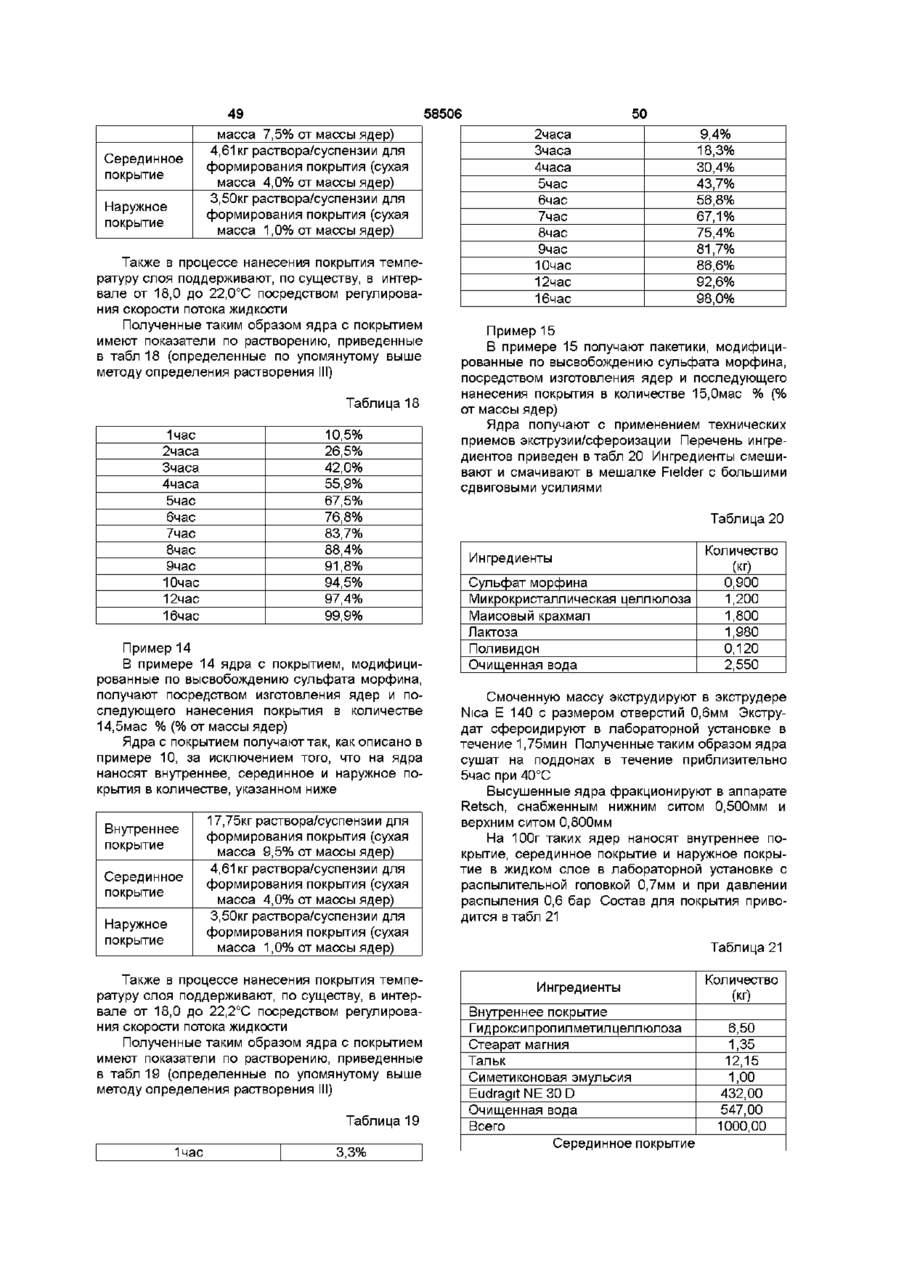
10. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 1 часа высвобождение 5%-50% опиоида из первой и второй фракций, как определено методом растворения V, с использованием аппаратуры для растворения согласно ФСША и ЕФ, скорости вращения 100 об/мин, температуре 37°С и 0,1 н хлористоводородной кислоты в качестве растворяющей среды.
11. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 3 часов высвобождение 20%-80% опиоида, как определено методом растворения V, указанным в п. 10.
12. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 6 часов высвобождение 40%-98% опиоида, как определено методом растворения V, указанным в п. 10.
13. Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 9 часов высвобождение 50%-100% опиоида, при определении методом растворения V, указанным в п. 10.
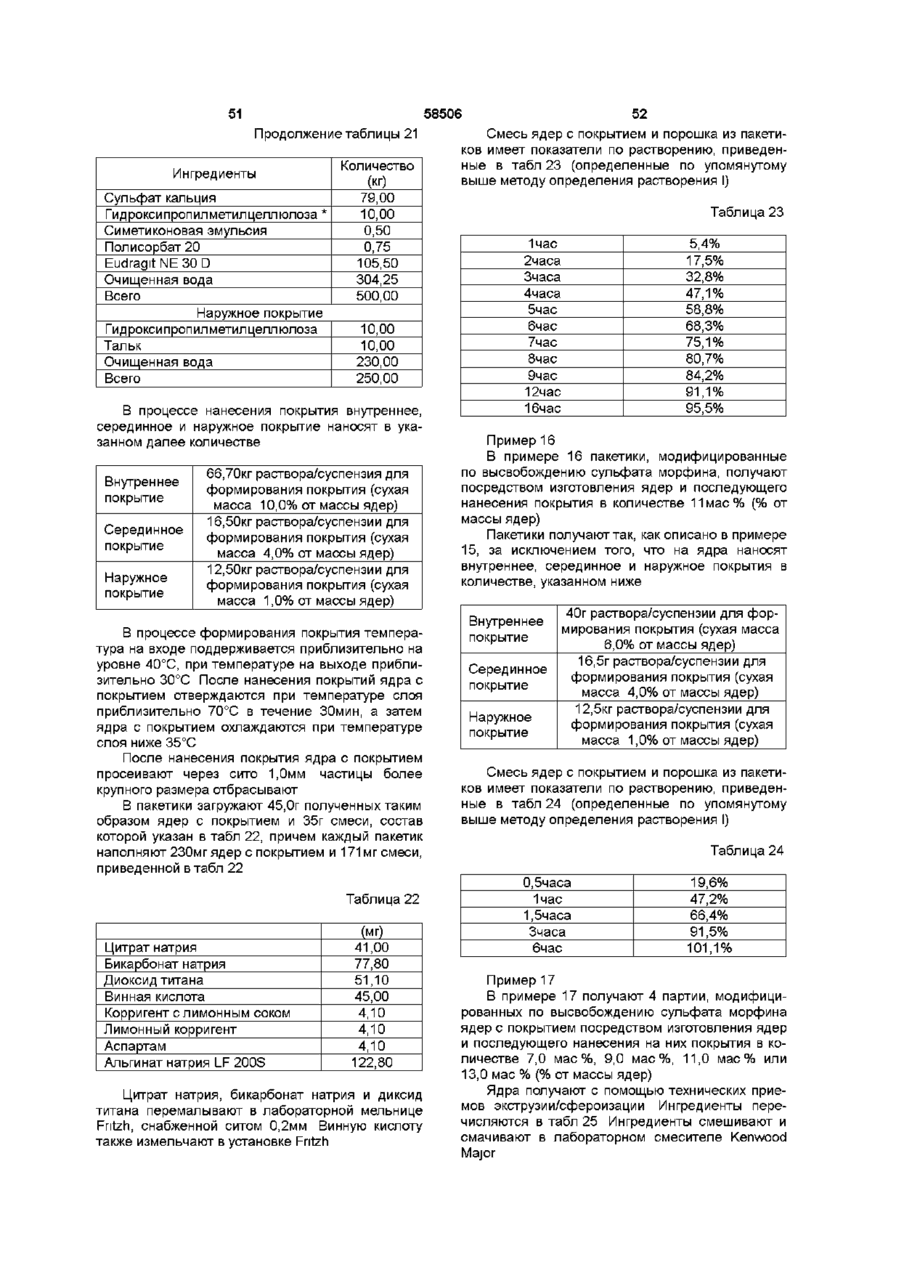
14.Композиция по любому из предшествующих пунктов, отличающаяся тем, что соотношение между первой и второй фракцией множественной дозированной формы находится в интервале 1:20-1:2, например в интервале 1:10-1:3, предпочтительно - в интервале 1:8-1:3, более предпочтительно - в интервале 1:7-1:3,5, еще более предпочтительно в интервале 1:3,5-1:4,5, и наиболее предпочтительно - в соотношении 1:4, при расчете по массе фракций.
15. Композиция по любому из предшествующих пунктов, отличающаяся тем, что множественная дозированная форма представляет гранулы с покрытием, по существу, однородные в поперечном сечении.
16. Композиция по любому из предшествующих пунктов, отличающаяся тем, что отдельные единицы первой фракции дозированной формы, по существу, имеют тот же размер и массу, что и отдельные единицы второй фракции.
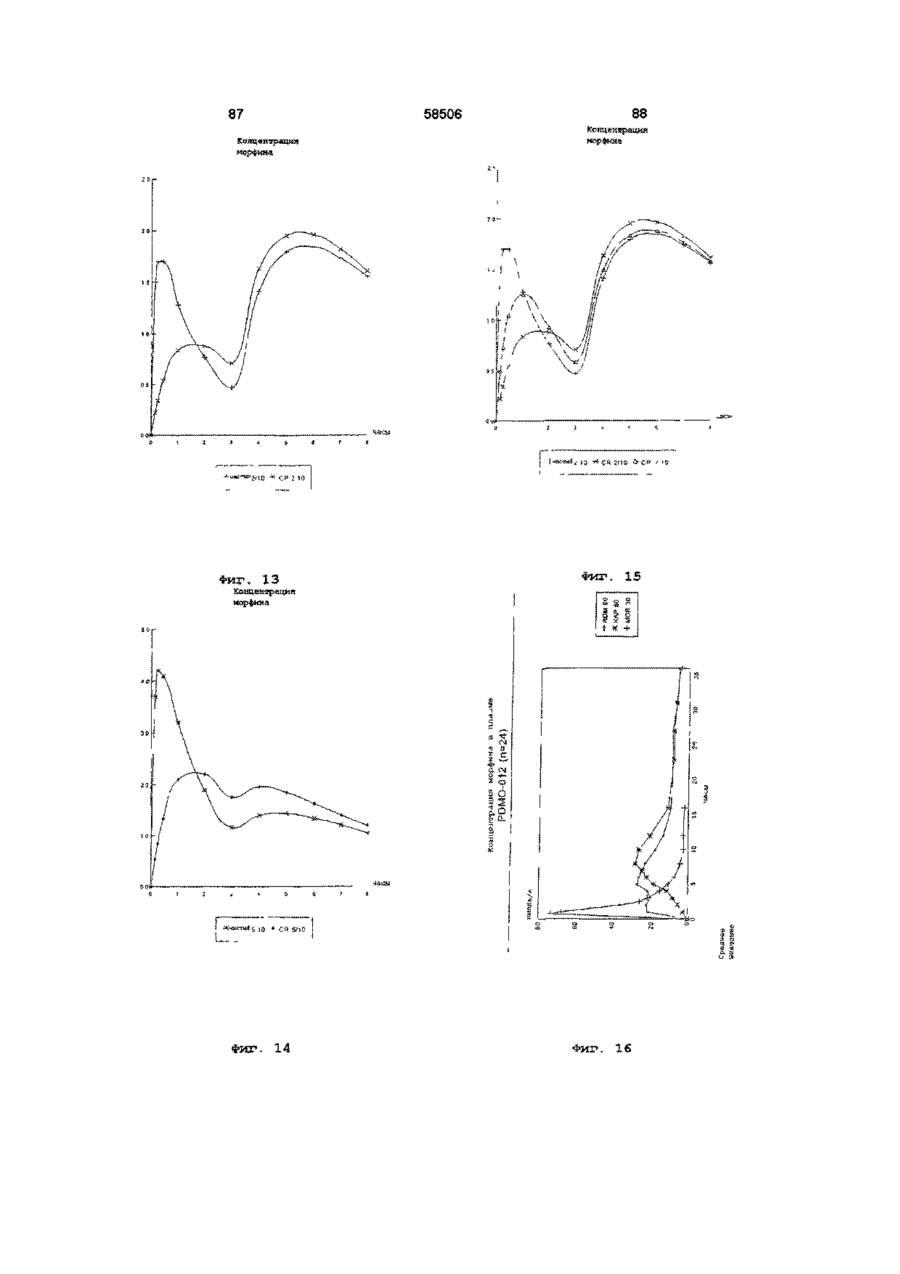
17. Композиция по любому из предшествующих пунктов, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, по существу, такая же, как пиковая концентрация в плазме, полученная, в результате, из второй фракции.
18. Композиция по любому из пп. 1-16, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, выше пиковой концентрации в плазме, полученной, в результате, из второй фракции.
19. Композиция по любому из пп. 1-16, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, ниже пиковой концентрации в плазме, полученной, в результате, из второй фракции.
20. Композиция по любому из предшествующих пунктов, отличающаяся тем, что первая фракция обеспечивает, в результате, терапевтически активную концентрацию опиоида в плазме до тех пор, пока отсроченное высвобождение опиоида из второй фракции множественной дозированной формы с отсроченным высвобождением способствует поддержанию терапевтически активной концентрации опиоида в плазме.
21. Композиция по любому из предшествующих пунктов, отличающаяся тем, что покрытие каждой фракции содержит, по существу, одни и те же компоненты, образующие покрытие.
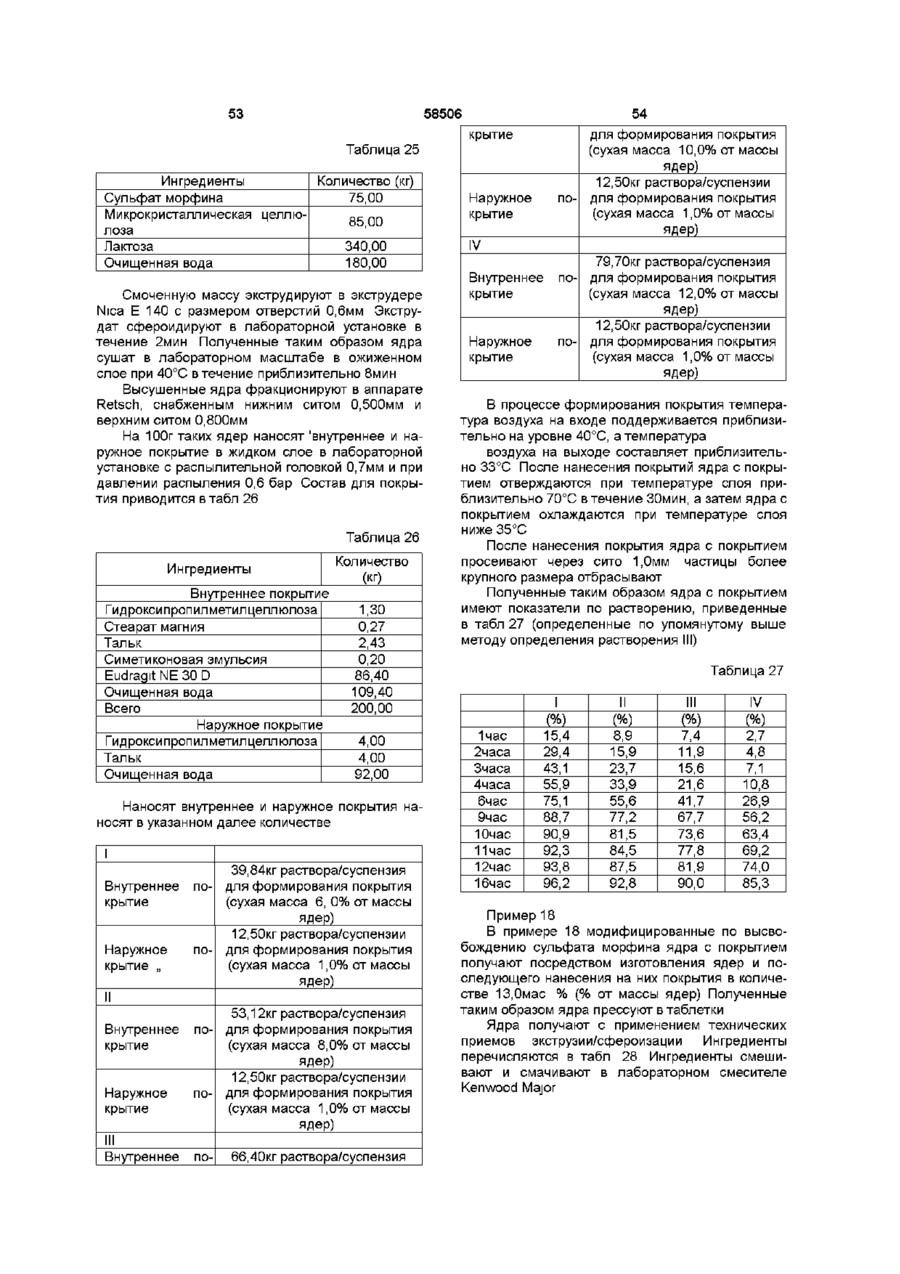
22. Композиция по п. 21, отличающаяся тем, что количество покрытия на первой фракции, в пересчете на сухую массу покрытия, находится в интервале, соответствующем примерно 10%-80%, в пересчете на сухую массу, от количества покрытия на второй фракции.
23. Композиция по любому из предшествующих пунктов, отличающаяся тем, что покрытия модифицирующие высвобождение фракций являются, по существу, нерастворимыми в воде, но через них может диффундировать вода, и, по существу, рН-независимыми.
24. Композиция по любому из предшествующих пунктов, отличающаяся тем, что единица дозы композиции содержит примерно 10 мг опиоида.
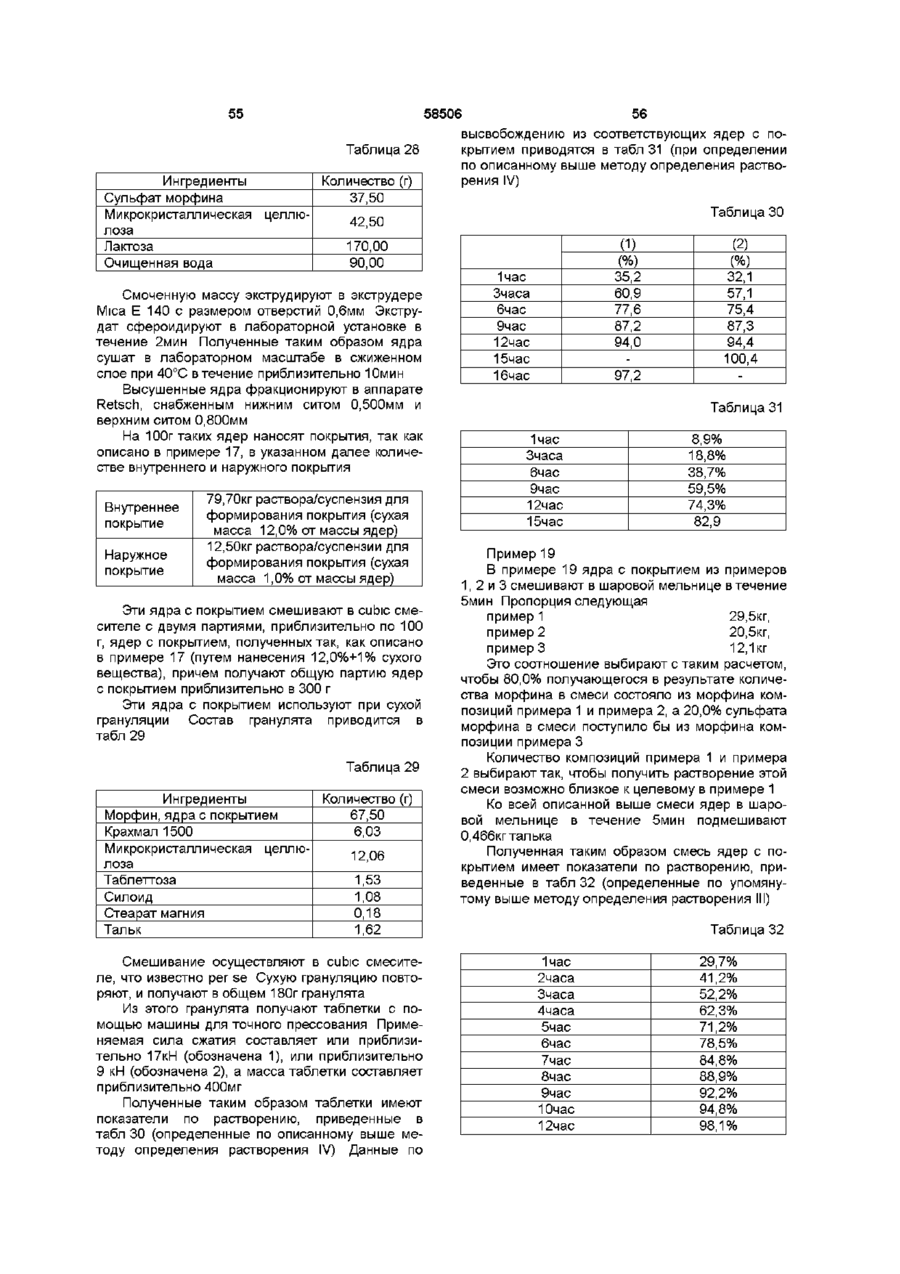
25. Композиция по любому из пп. 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 20 мг опиоида.
26. Композиция по любому из пп. 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 30 мг опиоида.
27. Композиция по любому из пп. 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 50 мг опиоида.
28. Композиция по любому из пп. 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 60 мг опиоида.
29. Композиция по любому из пп. 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 100 мг опиоида.
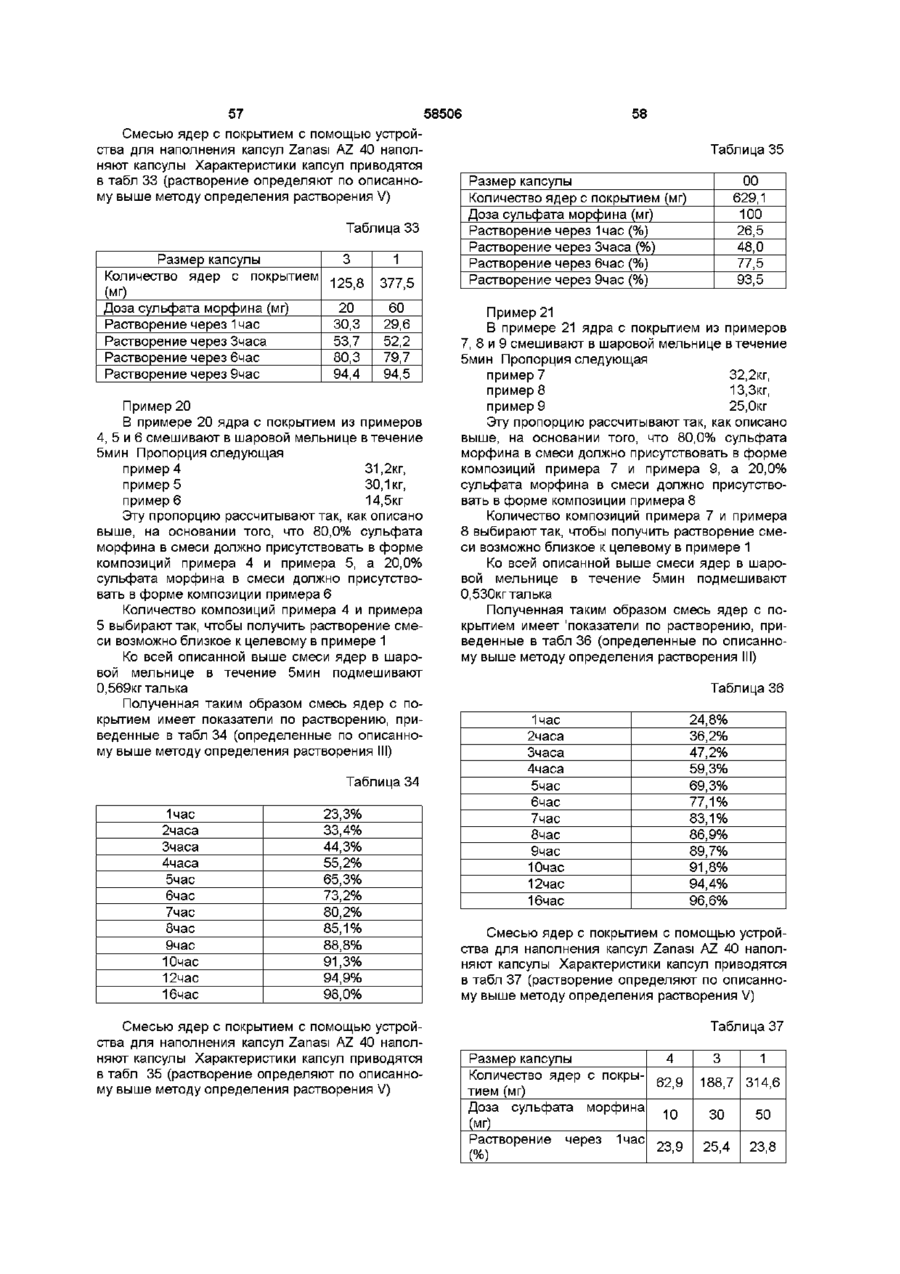
30. Композиция по любому из пп. 1-29, включающая единицу дозы для введения анальгетически эффективного количества опиоида дважды в сутки.
31. Композиция по любому из пп. 1-29, включающая единицу дозы для введения анальгетически эффективного количества опиоида один раз в сутки.
32. Композиция по любому из предшествующих пунктов, отличающаяся тем, что единица дозы композиции имеет форму капсулы.
33. Композиция по любому из предшествующих пунктов, отличающаяся тем, что опиоид представляет собой морфин или его фармацевтически приемлемую соль.
34. Композиция по любому из пп. 1-32, отличающаяся тем, что опиоид представляет собой сульфат морфина.
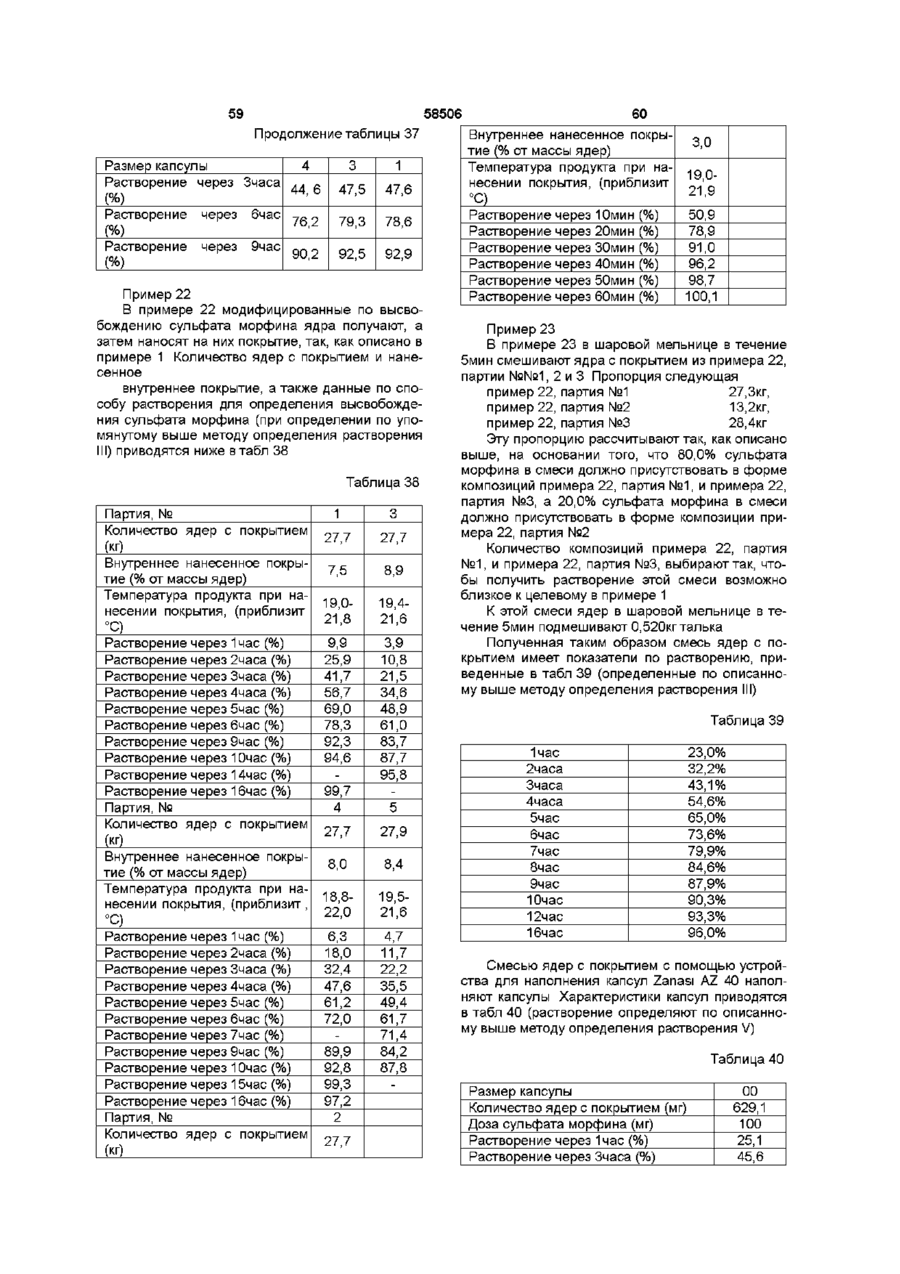
35. Композиция по любому из пп. 1-32, отличающаяся тем, что опиоид представляет собой трамадол или его фармацевтически приемлемую соль.
36. Способ получения единицы дозы пероральной композиции в виде множественной дозированной формы с модифицированным высвобождением по любому из пп. 1-30, включающий введение в единицу дозы, по меньшей мере, двух следующих фракций множественных единиц с покрытием: первой фракции множественной дозированной формы с покрытием и относительно быстрым высвобождением для относительно быстрого высвобождения опиоида in vivo для получения терапевтически активной концентрации в плазме в течение относительно короткого промежутка времени, и второй фракции множественной дозированной формы с покрытием для отсроченного высвобождения опиоида in vivo для поддержания анальгетически активной концентрации в плазме в течение, по меньшей мере, 12 часов, причем композиция первой и второй фракций, в отношении высвобождения из них и в отношении соотношения между первой и второй фракцией в единице дозы, адаптированы таким образом, чтобы получить
I) относительно быстрое in vitro высвобождение опиоида из первой фракции множественной дозированной формы с покрытием, с относительно быстрым высвобождением как определено указанным в п. 1 методом растворения,
II) отсроченное in vitro высвобождение опиоида из второй фракции множественной дозированной формы с покрытием с отсроченным высвобождением, относительно высвобождения in vitro опиоида из первой фракции, как определено методом растворения, указанным в п. 1, причем быстрое высвобождение и отсроченное высвобождение in vitro адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению опиоида, содержащегося в первой фракции, высвобождается 10% опиоида, содержащегося во второй фракции, как определено указанным в п. 1 методом растворения.
Текст
1 Пероральная фармацевтическая композиции в виде множественной дозированной формы с модифицированным высвобождением для введения анальгетически эффективного количества опиоида для получения как относительно быстрого наступления анальгетического действия, так и поддержания анальгетически активной концентрации в плазме в течение по крайней мере 12 часов, причем единица дозы композиции содержит по меньшей мере две следующие фракции множественной дозированной формы первую фракцию множественной дозированной формы с покрытием и относительно быстрым высвобождением для относительно быстрого высвобождения опиоида in vivo для получения терапевтически активной концентрации в плазме в течение относительно короткого промежутка времени, и вторую фракцию множественной дозированной формы с покрытием для отсроченного высвобождения опиоида in vivo для поддержания анальгетически активной концентрации в плазме в течение периода по меньшей мере в 12 часов, причем первая и вторая фракции составлены таким образом в отношении высвобождения из них и в отношении соотношения между первой и второй фракцией в единице дозы, чтобы получить I) относительно быстрое in vitro высвобождение опиоида из первой фракции множественной дозированной формы, с относительно быстрым вы свобождением как определено методом растворения с использованием лопастной мешалки согласно Фармакопее США (ФСША), при скорости вращения ЮОоб/мин, температуре 37°С и 0,1 н хлористоводородной кислоты в качестве растворяющей среды II) отсроченное in vitro высвобождение опиоида из второй фракции множественной дозированной формы с отсроченным высвобождением, относительно высвобождения in vitro опиоида из первой фракции, при определении указанным методом растворения, причем быстрое высвобождение и отсроченное высвобождение in vitro адаптированы таким образом, что первая фракция, по существу, высвобождается, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению опиоида, содержащегося в первой фракции, высвобождается 10% опиоида, содержащегося во второй фракции, как определено указанным методом растворения 2 Композиция по п 1 , отличающаяся тем, что характеристики растворения in vitro первой фракции множественной дозированной формы с относительно быстрым высвобождением обеспечивают в течение 0,5 часа высвобождение, по меньшей мере, 30% опиоида при определении указанным в п 1 методом растворения 3 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro первой фракции множественной дозированной формы с относительно быстрым высвобождением обеспечивают в течение 1 часа высвобождение, по меньшей мере, 50% опиоида при определении указанным в п 1 методом растворения 4 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 1 часа высвобождение 0%-30% опиоида, при определении указанным в п 1 методом растворения 5 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высво О (О о ю 00 ю бождением обеспечивают в течение 3 часов высвобождение, по меньшей мере, 10%-70% опиоида, при определении указанным в п 1 методом растворения 6 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 6 часов высвобождение 35%-95% опиоида, при определении указанным в п 1 методом растворения 7 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения in vitro второй фракции множественной дозированной формы с отсроченным высвобождением обеспечивают в течение 9 часов высвобождение 50%-100% опиоида, при определении указанным в п 1 методом растворения 8 Композиция по п 1 , отличающаяся тем, что характеристики растворения in vitro первой и второй фракций адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению первой фракции, и из второй фракции высвобождается 5%, при определении указанным в п 1 методом растворения 9 Композиция по п 1 , отличающаяся тем, что характеристики растворения in vitro первой и второй фракций адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 70% высвобождению первой фракции, из второй фракции высвобождается 10%, при определении указанным в п 1 методом растворения 10 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 1 часа высвобождение 5%-50% опиоида из первой и второй фракций, как определено методом растворения V, с использованием аппаратуры для растворения согласно ФСША и ЕФ, скорости вращения 100 об/мин, температуре 37°С и 0,1 н хлористоводородной кислоты в качестве растворяющей среды 11 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 3 часов высвобождение 20%-80% опиоида, как определено методом растворения V, указанным в п 10 12 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 6 часов высвобождение 40%-98% опиоида, как определено методом растворения V, указанным в п 10 13 Композиция по любому из предшествующих пунктов, отличающаяся тем, что характеристики растворения композиции in vitro обеспечивают в течение 9 часов высвобождение 50%-100% опиоида, при определении методом растворения V, указанным в п 10 58506 14 Композиция по любому из предшествующих пунктов, отличающаяся тем, что соотношение между первой и второй фракцией множественной дозированной формы находится в интервале 1 201 2, например в интервале 1 10-1 3, предпочтительно - в интервале 1 8-1 3, более предпочтительно - в интервале 1 7-1 3,5, еще более предпочтительно в интервале 1 3,5-1 4,5, и наиболее предпочтительно - в соотношении 1 4, при расчете по массе фракций 15 Композиция по любому из предшествующих пунктов, отличающаяся тем, что множественная дозированная форма представляет гранулы с покрытием, по существу, однородные в поперечном сечении 16 Композиция по любому из предшествующих пунктов, отличающаяся тем, что отдельные единицы первой фракции дозированной формы, по существу, имеют тот же размер и массу, что и отдельные единицы второй фракции 17 Композиция по любому из предшествующих пунктов, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, по существу, такая же, как пиковая концентрация в плазме, полученная, в результате, из второй фракции 18 Композиция по любому из пп 1-16, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, выше пиковой концентрации в плазме, полученной, в результате, из второй фракции 19 Композиция по любому из пп 1-16, отличающаяся тем, что первая фракция обеспечивает, в результате, пиковую концентрацию опиоида в плазме, которая, ниже пиковой концентрации в плазме, полученной, в результате, из второй фракции 20 Композиция по любому из предшествующих пунктов, отличающаяся тем, что первая фракция обеспечивает, в результате, терапевтически активную концентрацию опиоида в плазме до тех пор, пока отсроченное высвобождение опиоида из второй фракции множественной дозированной формы с отсроченным высвобождением способствует поддержанию терапевтически активной концентрации опиоида в плазме 21 Композиция по любому из предшествующих пунктов, отличающаяся тем, что покрытие каждой фракции содержит, по существу, одни и те же компоненты, образующие покрытие 22 Композиция по п 2 1 , отличающаяся тем, что количество покрытия на первой фракции, в пересчете на сухую массу покрытия, находится в интервале, соответствующем примерно 10%-80%, в пересчете на сухую массу, от количества покрытия на второй фракции 23 Композиция по любому из предшествующих пунктов, отличающаяся тем, что покрытия модифицирующие высвобождение фракций являются, по существу, нерастворимыми в воде, но через них может диффундировать вода, и, по существу, рН-независимыми 24 Композиция по любому из предшествующих пунктов, отличающаяся тем, что единица дозы композиции содержит примерно 10мг опиоида 25 Композиция по любому из пп 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 20мг опиоида 26 Композиция по любому из пп 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 30 мг опиоида 27 Композиция по любому из пп 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 50мг опиоида 28 Композиция по любому из пп 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 60мг опиоида 29 Композиция по любому из пп 1-23, отличающаяся тем, что единица дозы композиции содержит примерно 100мг опиоида 30 Композиция по любому из пп 1-29, включающая единицу дозы для введения анальгетически эффективного количества опиоида дважды в сутки 31 Композиция по любому из пп 1-29, включающая единицу дозы для введения анальгетически эффективного количества опиоида один раз в сутки 32 Композиция по любому из предшествующих пунктов, отличающаяся тем, что единица дозы композиции имеет форму капсулы 33 Композиция по любому из предшествующих пунктов, отличающаяся тем, что опиоид представляет собой морфин или его фармацевтически приемлемую соль 34 Композиция по любому из пп 1-32, отличающаяся тем, что опиоид представляет собой сульфат морфина 35 Композиция по любому из пп 1-32, отличающаяся тем, что опиоид представляет собой трамадол или его фармацевтически приемлемую соль 36 Способ получения единицы дозы пероральной композиции в виде множественной дозированной формы с модифицированным высвобождением по Настоящее изобретение относится к пероральной фармацевтической композиции в виде множественной дозированной формы с модифицированным высвобождением для введения анальгетически эффективного количества опиоида как для получения относительно быстрого наступления анальтезирующего действия, так и поддержания анальгетически активной концентрации в плазме в течение относительно продолжительного периода времени Композиция в виде множественной дозированной формы с модифицированным высвобождением содержит по меньшей мере две фракции, при этом на отдельные дозированные формы наносят покрытие для отсроченного высвобождения, созданное для высвобождения активного ингредиента таким, образом, что получают относительно быстрое наступление обезболивающего действия, так и поддержание анальгетически активной концентрации в плазме в течение относительно продолжительного периода времени, причем за счет этого композицию адаптируют для введения один или два раза в сутки 58506 любому из пп 1-30, включающий введение в единицу дозы, по меньшей мере, двух следующих фракций множественных единиц с покрытием первой фракции множественной дозированной формы с покрытием и относительно быстрым высвобождением для относительно быстрого высвобождения опиоида in vivo для получения терапевтически активной концентрации в плазме в течение относительно короткого промежутка времени, и второй фракции множественной дозированной формы с покрытием для отсроченного высвобождения опиоида in vivo для поддержания анальгетически активной концентрации в плазме в течение, по меньшей мере, 12 часов, причем композиция первой и второй фракций, в отношении высвобождения из них и в отношении соотношения между первой и второй фракцией в единице дозы, адаптированы таким образом, чтобы получить I) относительно быстрое in vitro высвобождение опиоида из первой фракции множественной дозированной формы с покрытием, с относительно быстрым высвобождением как определено указанным в п 1 методом растворения, II) отсроченное in vitro высвобождение опиоида из второй фракции множественной дозированной формы с покрытием с отсроченным высвобождением, относительно высвобождения in vitro опиоида из первой фракции, как определено методом растворения, указанным в п 1 , причем быстрое высвобождение и отсроченное высвобождение in vitro адаптированы таким образом, что первая фракция высвобождается, по существу, когда начинается высвобождение из второй фракции, в момент времени, соответствующий по меньшей мере 50% высвобождению опиоида, содержащегося в первой фракции, высвобождается 10% опиоида, содержащегося во второй фракции, как определено указанным в п 1 методом растворения Уровни лекарственного средства, превышающие низший уровень терапевтической концентрации в плазме, можно поддерживать в течение длительного периода времени посредством приема больших доз составленных обычным образом лекарственных форм Однако, увеличение дозировки не является подходящим подходом, так как такие дозы могут создать токсичное и нежелательно высокое содержание лекарственного средства С другой стороны, другой подход состоит в введении лекарственного средства с некоторыми временными интервалами, с образованием, в результате, колеблющегося уровня лекарственного средства, так называемого пикового и провального действия Такой подход, как правило, связан с некоторыми возможными проблемами, такими как большой пик (токсическое действие) и провальное действие (неактивный уровень лекарственного средства), и потеря согласия пациента, что приводит к неэффективности или неудаче лечения лекарственными средствами Однако, если концентрация в плазме при применении обычных таблеток поддерживается постоянно на уровне, превышающем терапевтический уровень, требуется неприемлемо высокая суточная доза, если опиоид не вводится достаточно часто Известны препараты с регулируемым высвобождением, созданные для быстрого выделения части общей дозы лекарственного средства Эта доза нагрузки представляет количество лекарственного средства, которое будет обеспечивать нужную фармакологическую реакцию настолько быстро, насколько это возможно в соответствии с биофармацевтическими свойствами лекарственного средства Такие составы сначала будут давать выброс терапевтического средства, а затем будут высвобождать это средство, по существу, с постоянной скоростью, как описано в WO 95/14460, опубликованной 1 июня 1995 Описанная здесь композиция относится копиоидным составам с отсроченным высвобождением, содержащим множество субстратов, включающих активный ингредиент в матрице для отсроченного высвобождения, или с покрытием для отсроченного высвобождения, содержащих веществозамедлитель Гранулы с отсроченным высвобождением затем покрывают опиоидом в форме с незамедлительным высвобождением, или, в случае композиции в форме желатиновой капсулы, опиоид без добавок включают в желатиновую капсулу посредством введения в капсулу достаточного количества незамедлительно высвобождаемого опиоида в виде порошка или в виде гранул При другом подходе саму желатиновую капсулу покрывают слоем с незамедлительным выделением опиоида Основной недостаток описанной выше композиции состоит в том, что включение опиоида без добавок в желатиновую капсулу без защитного покрытия может легко привести к потере контроля за избыточной дозой, в особенности, если капсула неплотная или пациент разрушает капсулу Кроме того, чтобы снизить избыточное количество опиоида для части с незамедлительным высвобождением, то, что касается фракции с отсроченным высвобождением, нет возможности модифицировать высвобождение, а есть только возможность избежания токсических концентраций в плазме или регулирования пиковых концентраций в плазме Вышеупомянутые препараты с регулируемым высвобождением являются длительно действующими и непрерывно высвобождают лекарственное средство Однако, композиции такого типа могут привести, в результате, к нежелательной пониженной биологической доступности, вероятно, изза того, что активный ингредиент не выделяется в нужное время Прием с композициями в виде множественной дозированной формы по изобретению имеет целью модифицированное высвобождение активного вещества по предварительно установленной схеме для снижения и задержки пиковой концентрации в плазме без воздействия на степень биологической доступности лекарственного средства Может быть уменьшена частота побочного действия, а благодаря отсрочке по времени получения пиковой концентрации в плазме и растяжению 58506 8 времени с терапевтически эффективной концентрацией в плазме можно снизить частоту введения до дозы, принимаемой только два или один раз в сутки Это обстоятельство направлено также на улучшение согласия пациента Другим преимуществом лекарственной формы в виде множественной дозированной формы с модифицированным высвобождением является то, что исключаются высокие местные концентрации активного вещества в желудочно-кишечной системе, причем, благодаря свободному распределению элементов в желудочно-кишечном тракте, независимо от опорожнения Кроме того, пациентам, страдающим от хронических болей, очень часто требуются высокие суточные дозы анальгетиков, например, примерно 100мг морфина Если такую высокую дозу опиоида следует давать один раз в сутки, высвобождение из лекарственной формы должно быть безопасным Композиция также должна быть очень устойчивой при хранении, поскольку незамедлительное высвобождение из-за случайного повреждения, например, покрытия или капсулы лекарственной формы с высокой концентрацией, может привести к нежелательной высокой концентрации в плазме, так называемому дозовому демпингсиндрому, который может вызвать смерть пациента За счет применения лекарственной формы с множественной дозированной формой с покрытием опасность дозового демпинг-синдрома из-за, например, разрыва покрытия снижается, поскольку количество активного ингредиента в каждом элементе с покрытием является ничтожным Однако основным недостатком однократного приема в сутки может быть низкая пиковая концентрация в плазме в конце суток, и, таким образом, потеря ослабления болей Так как лечение от боли представляет баланс ослабления боли, с одной стороны, и опасности побочного действия, с другой стороны, например, из-за аккумуляции лекарственного средства, интервал между приемами, обычно вычисляют таким образом, что концентрация лекарственного средства существенно снижается ко времени приема следующей дозы Соответственно, пациент весьма часто будет страдать от усиления боли, прежде чем концентрация лекарственного средства, являющаяся результатом приема следующей дозы, достигнет терапевтического уровня Кроме того, следует отметить, что при лечении от боли часто требуются относительно повышенные дозы, соответствующие относительно повышенной пиковой концентрации, например, при острой боли Соответственно, может понадобиться относительно повышенная начальная концентрация анальгетика по сравнению с концентрацией, способной поддерживать состояние ослабления боли Так как лечение в случае хронических болей часто включает продолжительное лечение и, как следствие, большие расходы, лекарственные формы для приема один раз в сутки не должны подразумевать дорогостоящий и сложный способ получения, так как повышенная стоимость такого продукта, по сравнению со стоимостью обычно применяемых препаратов, фактически будет ме 58506 10 высвобождения и соотношение между фракциями шать успешному применению лекарственного приспособлены для получения средства I) относительно быстрого поглощения части Однако пока не описана анальгетическая опиоида в результате чего анальгетически активфармацевтическая композиция для перорального ная концентрация в плазме достигается за отноприменения, которую можно получать легким, десительно короткий период времени и образуется шевым и надежным способом, и которая, в то же из одной фракции множественной дозированной время, дает подходящий профиль высвобождения формы, и активного вещества, обеспечивающий, в результате, длительный период действия, так что удаетII) уменьшенной и отсроченной пиковой конся, как быстро смягчить боль после введения, так центрации в плазме, результатом чего является и избежать ее на протяжении примерно 12поддержание анальгетически активной концен24часов трации в плазме на протяжении относительно длительного периода времени, и полученной из Следовательно, существует потребность в годругой фракции множественной дозированной товой лекарственной форме, содержащей опиоид, формы допускающий введение как больших, так и малых суточных доз только один или два раза в сутки С помощью модифицированных по высвобожбезопасным и надежным способом, и которую легдению многоэлементных лекарственных форм ко получить, предпочтительно, с привлечением настоящего изобретения достигаются и поддеробычных способов получения и настолько малым живаются терапевтические уровни, и в то же вречислом производственных стадий, насколько возмя ограничиваются сопутствующие побочные можно Также важно, чтобы опиоидная компози'действия, такие как тошнота, рвота или сонлиция для ежесуточного введения содержала активвость, которые, как полагают, связаны с высоким ный ингредиент в таком варианте, чтобы композисодержанием в крови опиоидных анальгетиков ция имела нужную скорость растворения, так как Также предполагается, что лекарственные формы непредвиденно быстрое растворение опиоида по настоящему изобретению связаны с уменьможет представлять опасность для пациента шенной опасностью привыкания к лекарственным средствам по сравнению с лечением общеприняЦелью настоящего изобретения является петыми средствами Кроме того, модифицированные роральная композиция в виде множественной допо высвобождению многоэлементные лекарствензированной формы с модифицированным высвоные формы настоящего изобретения, предпочтибождением для введения суточной дозы опиоида тельно, высвобождают опиоидный анальгетик со в дозированной форме, которая требует введения скоростью, не зависящей от рН, в результате чего самое большее только два раза в сутки, предпочустраняется рН-зависимый "дозовый демпинг" тительно - один раз в сутки, и которая преодолепосле перорального введения вает недостатки ранее предложенных готовых форм с модифицированным высвобождением в Также, поскольку первая относительно бысттой части, что лекарственная форма обеспечивародействующая фракция композиции по изобреет как по существу быстрое высвобождение из тению содержит опиоид в форме с покрытием, первой фракции, содержащей множественную высвобождение фракции можно модифицировать дозированную форму с модифицированным выдо желательного профиля высвобождения, что свобождением, так и отсроченное и длительное очень важно с точки зрения безопасности лекарвысвобождение из второй фракции множественственного средства Прежде всего, устраняется ной дозированной формы с модифицированным "свободный опиоид" в капсуле или на оболочке, высвобождением опиоида, посредством чего который может появиться из-за разрушения или смягчение боли достигается за короткий промежупросачивания из композиции ток времени после введения и сохраняется после Так как формирование покрытия для каждой введения по меньшей мере в течение 12 часов, фракции можно осуществить, по существу, с попредпочтительно - 24 часов мощью идентичных процедур и материалов, производственную себестоимость можно сохранить Другим аспектом изобретения является спона невысоком уровне соб получения композиции - пероральной фармацевтической модифицированной по высвобождеПодробное описание изобретения нию композиции в виде множественной дозироТаким образом, настоящее изобретение отнованной формы, и, кроме того, способ лечения пасится к пероральной фармацевтической композициентов композицией по изобретению, при котоции в виде множественной дозированной формы с ром интервал между введениями увеличивается модифицированным высвобождением для введепримерно до 12-24часов ния анальгетически эффективного количества опиоида как для получения относительно быстроСоответственно, настоящее изобретение отго наступления а нал ьгети чес ко го действия, так и носится к пероральной модифицированной' по для поддержания анальгетически активной конвысвобождению композиции в виде множественцентрации в плазме в течение относительно длиной дозированной формы, содержащей опиоид в тельного периода времени, причем единица дозы качестве активного вещества, причем композиция композиции содержит по меньшей мере две слевключает единицу дозы, содержащие по меньшей дующие фракции из множественной дозированной мере две различные фракции из множественной формы дозированной формы со свойствами модифицированного высвобождения, причем конструкция первую фракцию множественной дозированкаждой фракции в отношении модифицированного ной формы с покрытием и модифицированным высвобождением для относительно быстрого вы 12 11 58506 свобождения опиоида in vivo для получения терамножественной дозированной формы, по одному певтически активной концентрации в плазме за из вариантов воплощения изобретения, могут в относительно короткий промежуток времени, и пределах 1 часа обеспечить высвобождение, при определении по описанному здесь методу опревторую фракцию множественной дозированделения растворения III, в интервале 0%-30%, ной формы с покрытием и модифицированным например, 0%-20%, предпочтительно - в интервавысвобождением для отсроченного высвобожделе 0%-10%, наиболее предпочтительно - примерния опиоида in vivo для поддержания терапевтино на 5% чески активной концентрации в плазме в течение периода по меньшей мере в 12 часов, Кроме того, характеристики растворения in vitro второй фракции модифицированной по выпричем готовая форма из первой и второй свобождению множественной дозированной форфракций, в отношении модифицированного вымы могут в пределах 3 часов обеспечить высвосвобождения и в отношении соотношения между бождение, при определении по описанному здесь первой и второй фракцией в стандартной дозе, методу определения растворения III, в интервале составляется таким образом, чтобы получить 10%-70%, например, 15%-60%, предпочтительно I) относительно быстрое in vitro высвобождев интервале 20%-50%, предпочтительнее - в инние опиоида из первой фракции модифицировантервале 25%-45%, наиболее предпочтительно ной по высвобождению множественной дозиропримерно на 35% ванной формы, при измерении по методу определения растворения III, описанному ниже в разделе В пределах 6 часов характеристики растворе"Материалы и методы", ния in vitro второй фракции модифицированной по высвобождению множественной дозированной II) отсроченное in vitro высвобождение из втоформы могут обеспечить высвобождение, при рой фракции модифицированной по высвобождеопределении по описанному здесь методу опрению множественной дозированной формы, отноделения растворения III, в интервале 35%-95%, сительно высвобождения in vitro опиоида из пернапример, в интервале 50%-90%, предпочтительвой фракции, при измерении по методу определено - в интервале 60%-80%, предпочтительнее - в ния растворения III, как описано в описании ниже, интервале 65%-75%, наиболее предпочтительно причем быстрое высвобождение и отсроченпримерно на 70% ное высвобождение in vitro согласовываются таким образом, что первая фракция высвобождаетКроме того в пределах 9 часов характеристики ся, по существу, когда начинается высвобождение растворения in vitro второй фракции модифицироиз второй фракции, в момент времени, соответстванной по высвобождению множественной дозивующий высвобождению 50% первой фракции, и рованной формы могут обеспечить высвобождевысвобождается 10% второй фракции, при измение, при определении по описанному здесь меторении по методу определения растворения III, ду определения растворения III, в интервале 501описанному здесь 100%, например, в интервале 60%-98%, предпочтительно - в интервале 70%-95%, предпочтительВ одном из вариантов воплощения изобретенее - в интервале 80%-90%, наиболее предпочтиния композиция Может содержать модифициротельно - примерно на 85% ванную по высвобождению множественную дозированную форму, при этом характеристики расЧтобы гарантировать, что высвобождение творения in vitro первой фракции модифицированвторой фракции имеет нужное отставание по вреной по высвобождению множественной дозиромени относительно высвобождения первой фракванной формы обеспечивают в пределах ции, характеристики растворения in vitro первой и получаса высвобождение, при определении по второй фракций, в одном из вариантов воплощеописанному здесь методу определения растворения изобретения, согласуются таким образом, что ния III, по меньшей мере на 30%, например, по первая фракция высвобождается, по существу, меньшей мере на 40%, предпочтительно - по когда высвобождение из второй фракции начинаменьшей мере на 50%, предпочтительнее - по ется в момент времени, соответствующий высвоменьшей мере на 60%, и еще предпочтительнее бождению по меньшей мере 50% первой фракции по меньшей мере на 70%, наиболее предпочтии вторая фракция высвобождается на 5%, при тельно - по меньшей мере на 90% измерении по описанному здесь методу определения растворения III Кроме того, характеристики Кроме того, композиция может содержать морастворения in vitro первой и второй фракций, в дифицированные по высвобождению многие едитом же или в другом упомянутых выше вариантах ницы, при этом характеристики растворения in воплощения изобретения, согласуются таким обvitro первой фракции модифицированной по выразом, что первая фракция высвобождается, по свобождению множественной дозированной форсуществу, когда высвобождение из второй фракмы обеспечивают в пределах 1 часа высвобождеции начинается в момент времени, соответствуюние, при определении по описанному здесь метощий высвобождению по меньшей мере 70% перду растворения определения III, по меньшей мере, вой фракции, и вторая фракция высвобождается на 50%, например, по меньшей мере, на 60%, на 10%, при измерении по описанному здесь мепредпочтительно - по меньшей мере, на 70%, тоду определения растворения III предпочтительнее - по меньшей мере на 80%, и еще предпочтительнее - по меньшей мере, на Две фракции модифицированной множест90%, наиболее предпочтительно - по меньшей венной дозированной формы можно выбрать, с мере на 95% учетом модифицированного высвобождения из каждой фракции и соотношения между двумя Характеристики растворения in vitro второй фракциями, таким образом, что характеристики фракции модифицированной по высвобождению 58506 14 13 растворения композиции in vitro в пределах 1часа Отдельные элементы первой и второй фракобеспечат высвобождение опиоида в первой и ций отличаются в отношении свойств модифицивторой фракциях в интервале 5%-50%, например, рованного высвобождения, например, вследствие в интервале 5%-45%, предпочтительно - в интерколичества образующего покрытие материала, вале 15%-40%, наиболее предпочтительно - в нанесенного на каждую из множественной дозиинтервале 20%-35%, например, примерно на 27%, рованной формы каждой фракции Однако, отпри определении по описанному здесь методу дельные элементы двух фракций, предпочтительопределения растворения V но, имеют, по существу, одинаковый размер Кроме того, две фракции модифицированной Предпочтительно/ чтобы модифицированная множественной дозированной формы можно вымножественная дозированная форма первой брать, с учетом модифицированного высвобождефракции давала в результате пиковую концентрания из каждой фракции и соотношениямежду цию опиоида в плазме, которая, по существу, тадвумя фракциями, таким образом, что характерикая же, что и пиковая концентрация из второй стики растворения композиции in vitro обеспечат фракции Так как пиковая концентрация в плазме высвобождение в пределах 3 часов, при опредеиз второй фракции подгоняется таким образом, лении по описанному здесь методу определения что пик имеет пролонгированный характер благорастворения V, в интервале 20%-80%, например, даря характеристикам растворения фракции, опив интервале 25%-70%, предпочтительно - в интерсанным здесь, пик этой второй фракции должен, вале 30%-60%, наиболее предпочтительно - в по существу, предпочтительно представлять низинтервале 35%-55%, например, примерно на 50% ший уровень терапевтической концентрации в плазме При таком предпочтительном варианте Кроме того, две фракции модифицированной воплощения изобретения уровень концентрации в множественной дозированной формы можно выплазме таков по величине, что нет избытка опиоибрать, с учетом модифицированного высвобождения из каждой фракции и соотношения между двумя фракциями, таким образом, что характеристики растворения композиции in vitro обеспечат высвобождение в пределах бчасов, при определении по описанному здесь методу определения растворения V, в интервале 40%-98%, например, в интервале 50%-95%, предпочтительно - в интервале 60%-90%, предпочтительнее - в интервале 65%-85%, наиболее предпочтительно - в интервале 70%-83%, например, примерно на 80% Кроме того, две фракции модифицированной множественной дозированной формы можно выбрать, с учетом модифицированного высвобождения из каждой фракции и соотношения между двумя фракциями, таким образом, что характеристики растворения композиции in vitro обеспечат высвобождение в пределах Эчасов, при определении по описанному здесь методу определения растворения V, в интервале 501-100%, например, в интервале 60%-99%, предпочтительно - в интервале 70%-98%, предпочтительнее - в интервале 75%-97%, наиболее предпочтительно - в интервале 80%-95%, например, в интервале 85%-96%, как, например, примерно на 95% В предпочтительном варианте воплощения изобретения композиция удовлетворяет приведенным выше критериям в отношении характеристик растворения композиции во всем упомянутом временном интервале Соотношение между первой и второй фракциями модифицированной по высвобождению множественной дозированной формы в композиции по изобретению может находиться в интервале 1 20-1 2, например, в интервале 1 10-1 3, предпочтительно - в интервале 1 8-1 3, предпочтительнее - в интервале 1 7-1 3,5, еще предпочтительнее - в интервале 1 3,5-1 4,5, и наиболее предпочтительно - в интервале 1 4 В предпочтительном варианте воплощения изобретения множественная дозированная форма имеет покрытие и представляет в поперечном сечении, по существу, однородные гранулы Так как общее количество, опиоида - содержащегося в первой фракции, вообще, относительно мало (например, примерно 20%), по сравнению с общей концентрацией опиоида в композиции, пиковая концентрация опиоида в плазме, образованная первой фракцией, которая выше пиковой концентрации, получающейся от второй фракции, не представляет существенный расход опиоида Однако, за исключением случая, когда пациент страдает от тяжелой острой боли, при которой, как часто, оказывается, требуется более высокая концентрация в плазме, чем концентрация в плазме для поддержания ослабления боли, пик первой фракции не должен превышать пика второй фракции в течение длительного периода времени Даже в тех случаях, когда пик первой фракции, предпочтительно, выше пика второй фракции, неподходящей высокой концентрации в плазме (в пределах токсического уровня), образованной из первой фракции, можно легко избежать благодаря модифицированному освобождению В другом варианте воплощения изобретения, например, в случаях, когда пациент удовлетворительно излечивается при введении лекарственной композиции по изобретению один или два раза в сутки, первая фракция может быть подогнана так, чтобы она давала пик концентрации опиоида в плазме, который ниже пика концентрации, получающейся от второй фракции В этом обычно нет необходимости при острой боли, так как опиоид, остающийся в плазме от предыдущей введенной дозы, может содействовать поддержанию достаточно высокой концентрации в плазме до тех пор, пока высвобождается вторая фракция композиции В других случаях суточную дозу можно вводить, а подходящее время суток, когда пациент испытывает меньшую потребность в анальгетике, например, перед сном Соответственно, важным аспектом изобретения является вариант, при котором первая фракция дает, а результате, терапевтически активную 15 58506 16 концентрацию опиоида в плазме до тех пор, пока ство, что композицию можно изготовить в виде отсроченное высвобождение опиоида из второй ряда лекарственных форм, например, с 10мг, фракции модифицированной высвобождению 30мг, и т д , причем каждый ряд обладает отдельмножественной дозированной формы не внесет ными свойствами, являющимися результатом исвклад в поддержание терапевтически активной полнения модифицированного высвобождения из концентрации опиоида в плазме первой и второй фракций, а также соотношения между этими фракциями Затем из соответствуюПредпочтительно, чтобы покрытие для модищих лекарственных форм в пределах каждого ряфицированного высвобождения каждой фракции да можно выбрать нужную общую дозу содержало, по существу, одни и те же компоненты Отставание по времени высвобождения из Предпочтительной лекарственной формой по второй фракции относительно высвобождения из изобретению является форма капсулы Размер первой фракции можно получить посредством капсулы согласуется с количеством опиоида в формирования покрытия для модифицированного композиции высвобождения первой фракции, составляющего Указанные выше дозировочные количества не примерно от 10% до, примерно, 80%, в пересчете следует рассматривать как ограничение объема на сухую массу, от количества покрытия для моизобретения, так как для специалиста ясно, что дифицированного высвобождения второй фракможно применить любое количество опиоида, огции раниченное только объемом композиции Также предпочтительно, чтобы покрытие для Основной целью настоящего изобретения явмодифицированного высвобождения фракций, по ляется единица дозы для введения анальгетичесуществу, не растворялось в воде, но было бы ски активного эффективного количества опиоида вододиффундирующим и, по существу, рНтолько один раз в сутки Однако, так как некотонезависимым, что даст независимость абсорбции рые пациенты еще могут нуждаться, или предпоот присутствия пищи в желудке читать, введение два раза в сутки, изобретение не должно ограничиваться композицией с однократКоличество опиоида в композиции в виде носуточной единицей дозы до тех пор, пока кажмножественной дозированной формы с модифидая из композиций единиц доз удовлетворяет цированным высвобождением по изобретению упомянутым выше критериям в отношении расможно выбрать таким образом, чтобы оно сооттворения ветствовало примерно 5мг, 10мг, 20мг, 30мг, 50мг, 60мг, 100мг, 200мг или 300мг морфина - дозам, В другом аспекте настоящее изобретение отвообще известным в технике Однако композиция носится к способу получения единицы дозы перопо изобретению, предпочтительно, содержит коральной композиции в виде множественной дозиличество опиоида, которое составляет суточное рованной формы с модифицированным высвобоанальгетически эффективное количество опиоида ждением, описанной выше и в примерах, причем указанный способ включает введение в единицу Вообще, в случае обычных лекарственных дозы по меньшей мере двух следующих фракций форм, таких как таблетки, содержащих опиоид без множественной дозированной формы с покрытидобавок, не всегда можно получить идентичные ем профили высвобождения, когда различные дозы вводят вместе, так как нагрузка активного ингрепервой фракции модифицированной по выдиента может отличаться в зависимости от разсвобождению множественной дозированной формера таблетки Профиль высвобождения в случае мы с покрытием для относительно быстрого вы100мг, принятых в виде одной дозы, может, таким свобождения опиоида in vivo для получения тераобразом, отличаться от 100мг, принятых в виде 5 певтически эффективной концентрации в плазме доз по 20мг каждая Даже в случае коммерчески за относительно короткий промежуток времени, и доступных модифицированных по высвобождению второй фракции модифицированной по высвоболекарственных форм не всегда наблюдается ждению множественной дозированной формы с идентичные профили высвобождения при разных покрытием для отсроченного высвобождения дозировках опиоида in vivo для поддержания анальгетически активной концентрации в плазме на протяжении Теперь имеется возможность вводить с компериода по меньшей мере в 12 часов, позицией по настоящему изобретению различные дозы с идентичными профилями высвобождения причем композиция из первой и второй фракПока композицию в виде множественной дозироций, в отношении модифицированного высвобожванной формы с модифицированным высвобождения из них и в отношении соотношения между дением по настоящему изобретению получают с первой и второй фракцией в стандартной форме, одним и тем же типом многих элементов с покрыподгоняется таким образом, чтобы получить тием первой и второй фракций и в одном и том же I) относительно быстрое высвобождение соотношении, каждую из лекарственных форм опиоида in vitro из первой фракции модифицироможно вводить вместе для получения любой жеванной по высвобождению множественной дозилательной общей дозы без изменения общего рованной формы, при измерении посредством профиля высвобождения из всей дозы Соответметода определения растворения III, как описано ственно, можно получить надежную и предсказуениже в описании, мую концентрацию в плазме в течение всего проII) отсроченное высвобождение in vitro из втомежутка времени между введениями, независимо рой фракции модифицированной по высвобождеот общей дозы нию множественной дозированной формы, относительно высвобождения in vitro опиоида из перСледовательно, другим преимуществом комвой фракции, при измерении посредством метода позиции по изобретению является то обстоятель 17 58506 18 определения растворения III, как описано в описапромедол, проперидин, пропирам, пропоксифен, нии, суфентанил, тилидин, трамадол, их соли, смеси с любым из вышеперечисленных, смешанные |іпричем быстрое и отсроченное высвобождеагонисты/анатагонисты, JJ,- и/или к-агонисты, сочение in vitro согласуются таким образом, что первая тания вышеперечисленных веществ и т п фракция высвобождается, по существу, когда начинается высвобождение из второй фракции в Модифицированная по высвобождению опиомомент времени, соответствующий высвобождеида пероральная лекарственная форма настоящению 50% первой фракции, и вторая фракция выго изобретения, предпочтительно, включает в касвобождается на 10%, при измерении по методу честве терапевтического активного ингредиента определения растворения III, описанному здесь морфин в количестве, соответствующем по массе Термин "композиция в виде множественной примерно 5-800мг морфина сульфата С другой дозированной формы с модифицированным выстороны, лекарственная форма может содержать свобождением", используемый в данном контекэквивалентное молярное количество солей морсте, определяет высвобождение лекарственного фина В других предпочтительных вариантах восредства с такой скоростью, что уровень конценплощения изобретения, где опиоидный анальгетик трации в плазме поддерживается выше терапевиной, чем морфин, лекарственная форма содертического (анальгетически активного) уровня, но жит его соответствующее количество, обеспечиниже токсического уровня, на протяжении максивающее, по существу, равнозначное терапевтичемально возможного периода ское действие Термин "фракция" множественной дозированКак правило, опиаты после перорального ввеной формы в данном контексте относится к части дения легко поглощаются в желудочно-кишечном множественной дозированной формы единицы тракте Многие опиоиды, в том числе, морфин, дозы Фракция будет отличаться, вообще, от друявляются объектом первоочередного метаболизгой фракции множественной дозированной формы ма в печени Удовлетворительное обезболивание единицы дозы Даже хотя определены только две у раковых больных ассоциируется с весьма широфракции, в пределах объема данного изобретения ким сравнительно устойчивым интервалом конв одной единице дозы может иметься более двух центрации морфина в плазме - 16-364нг/мл фракций Соответственно, единица дозы по изо(Goodmann and Gilman's, The Pharmacological бретению содержит, по меньшей мере, две разBasis of Therapeutics, 8th Edition 1990 p 496) Пеличные фракции риод полу выведения морфина составляет примерно 1,5-2час, однако морфин метаболизируется Термин "единица дозы" в данном контексте до активных продуктов, таких как морфин-6относится к одной единице, например, капсуле глюкуронид, у которого более длительный период Единица дозы представляет множество отдельполу выведения Средняя продолжительность ных единиц, которые, в соответствии с общим содействия первой одиночной дозы морфина в 10мг, стоянием техники, могут иметь форму капсулы, введенной перорально, внутримышечно или подтаблетки, конвертика и т п кожно, составляет примерно 4-5часов Примеры Термин "опиоид" используется здесь для ободоз других опиоидных анальгетиков, обеспечизначения группы лекарственных средств, которые вающих приблизительно такое же обезболиваюпо своим свойствам, в разной степени, подобны щее действие, как 10мг морфина, хорошо известопию или морфину Термин охватывает' природны в технике, см , например, Goodmann and ные и синтетические опиоиды, а также активные Gilman's, The Pharmacological Basis of метаболиты, такие как морфин-6-глюкуронид и Therapeutics, 8th Edition 1990 p 497 морфин-3-глюкуронид, и смеси опиоидов, В объем данного определения опиоидов также входят Термин "биологическая доступность" означает фармацевтически приемлемые соли и/или комстепень, до которой лекарственное средство абплексы опиоидов сорбируется из модифицированной композиции в Другими подходящими примерами опиоидов виде множественной дозированной формы являются альфентанил, аллилпродин, альфапроВ данном контексте термин "терапевтически дин, анилеридин, бензил морфин, бензитрамид, активная концентрация в плазме на протяжении бупренорфин, буторфанол, клонитазен, кодеин, периода по меньшей мере в 12 (24) часов" вклюциклазоцин, дезоморфин, декстроморамид, дезочает ситуацию, при которой введенный опиоид цин, диампромид, дигидрокодеин, диметаболизируется до активных продуктов, что гидроморфин, дименоксадол, димефептанол, диприводит к анальтезирующему действию на прометилтиамбутен, диоксафетилбутират, дипипатяжении установленного периода Соответственнон, эптазоцин, этогептазин, этилметилтиамбутен, но, опиоид в плазме в том виде, в каком введен, этилморфин, этонитазенфентанил, героин, гидроможет непосредственно не обнаруживаться в кокондон, гидроморфон, гидроксипетидин, изометаличестве, обычно принимаемом за анальгетически дон, декстропропоксифен, кетобемидон, левалэффективный уровень лорфан, леворфанол, левофенацилморфан, лоСуточную дозу для каждого пациента обычно фентанил, меперидин, мептазинол, метазоцин, вычисляют на основе суммы доз, которые даются метадон, метопон, морфин, мирофин, налбуфин, перорально р п (=по мере необходимости) в тенарцеин, никорморфин, норлеворфанол, нормечение нескольких дней Соответственно, если котадон, налорфин, норморфин, норпипанон, опий, личество конкретного опиоида за 48 часов состаоксикодон, оксиморфон, папаверетум, пентазоцин, вило 120мг, суточная доза составляет 60мг, незафенадоксон, феноморфан, феназодин, фенопевисимо оттого, отражает ли введение определенридин, пиминодин, пиритрамид, профептазин, 20 19 58506 ную картину, например, необходимость вводить Предпочтительно, чтобы профиль высвобожболее высокие дозы в дневное время дения из ядра отдельного элемента, по существу, не являлся ограничивающим в отношении желаВ одном из вариантов воплощения настоящетельного высвобождения из гранулы с покрытием, го изобретения первая фракция множественной например, чтобы само ядро давало примерно дозированной формы содержит количество опио100% высвобождение в пределах 1 часа, предпочида, соответствующее примерно 25%-17% (от 1/4 тительно - в пределах 45 минут, при измерении до 1/6) суточной дозы Для пациентов, на которых при проверке растворения in vitro, описанной в удовлетворительно действует 4-суточные дозы примерах Однако ядра гранул с более медленобычной, без отсроченного высвобождения, комным высвобождением активного вещества тем не позиции, первая фракция в одном примере соменее входят в объем изобретения держит количество опиоида соответствующее 25% суточной дозы Тогда вторая фракция может Пероральная фармацевтическая, композиций содержать остальные 75% суточной дозы в виде множественной дозированной формы с модифицированным высвобождением по изобреОднако предпочтительное количество первой тению, как правило, будет представлять капсулу, фракции может содержать 20% суточной дозы, а содержащую множество элементов, как правило вторая фракция может содержать 80% суточной более 100, пакетик, содержащий множество эледозы ментов, как правило - более 1000, или таблетку, В другом варианте воплощения настоящего изготовленную из множества элементов, как праизобретения первая фракция множественной довило - более, чем из 100, таким образом, что табзированной формы содержит количество опиоида летка, по существу, сразу после проглатывания соответствующее количеству опиоида, необходибудет распадаться в желудке на множество отмому для получения анальгезирующего действия дельных элементов, свободно распространяюпосле первой единичной пероральной дозы обычщихся по желудочно-кишечному тракту ной опиоидной композиции без отсроченного высвобождения В данном контексте термин "однократносуточная" означает, что фармацевтическую композиОтдельные элементы композиций в виде мноцию для получения подходящей терапевтической жественной дозированной формы по изобретению и/или профилактической реакции необходимо будут представлять, обычно гранулы или шарики вводить только один раз в сутки, однако любое размером (средний диаметр) примерно 0,1-2мм введение может включать совместное введение Наиболее предпочтительный размер гранулы 0,5нескольких единиц доз, например, 2-4 единицы 0,8мм Гранулы и шарики содержат сочетание дозы, если требуемое количество активного веактивного вещества опиоида и эксципиентов Кощества нельзя включить в состав только одной гда гранулы или шарики не имеют покрытия, сочеединицы дозы композиции, или если предпочтитание активного вещества и эксципиентов назытельна единица дозы композиции малого размера вается ядром В данном контексте термин "ядра, которые в В соответствии с приведенным выше опредепоперечном сечении являются, по существу, одлением "однократносуточная" термин "двухразонородными" обозначает ядра, в которых активное восуточная" предлагается для обозначения того, вещество не, сосредоточено в наружном слое на что фармацевтическую композицию необходимо массе ядра, иными словами, обычные ядра, котовводить самое большее только два раза в сутки, рые по всему поперечному сечению ядра содерчтобы получить у пациента подходящую терапевжат, по существу, одну и ту же композицию, сотическую и/или профилактическую реакцию держащую мелкиечастицы, содержащие активное В связи с этим существенным преимуществом вещество, в противоположность ядрам типа "мелкомпозиции по изобретению является то, что кого драже", каждое из которых состоит из массы профиль высвобождения из каждой из единиц доз эксципиента с активным веществом, нанесенным является постоянным, независимо от общего кона его поверхность, Из этого определения Судет личества активного ингредиента в единице дозы, понятно, что ядра, которые в поперечном сечении, до тех пор, пока соотношение, по существу, иденпо существу, однородны, будут, естественно, сотичных гранул с "быстрым" и "медленным" высвостоять из смеси активного вещества с эксципиенбождением остается постоянным том (эксципиентами), и эта смесь необязательно Независимо от данных выше определений будет качественно или количественно однородна "однократносуточная" и "двухразовосуточная", по всей площади поперечного сечения ядра, а предпочтительна стандартная форма, созданная может показать, например, градиент концентрации для доставки активного ингредиента после введеопиоида или они (отдельные участки) могут состония только один раз в сутки Однако, из-за индиять, по существу, из одного опиоида В дальнейвидуальных особенностей, некоторым пациентам шем описании и формуле изобретения такие ядра, может потребоваться новая доза, например, через которые в поперечном сечении, по существу, од12 или 18часов, если у пациента, например, анонородны, для краткости часто будут называться мальное поглощение или время прохождения по просто "ядра" кишечнику Если у индивидуума относительно быстрое прохождение по кишечнику, некоторая Предполагается, что ядро, содержащее опиочасть активного ингредиента может выделиться ид в, по существу, однородной форме, обеспечираньше, чем высвободится вся доза, или может вает более воспроизводимое высвобождение аквысвободится в толстой кишке, в которой поглотивного ингредиента, по сравнению, например, с щение меньше частицами, в которых активный ингредиент образует часть покрытия 22 21 58506 Фармацевтическую композицию в виде мноII) отсроченное высвобождение in vitro из втожественной дозированной формы по настоящему рой фракции модифицированной по высвобождеизобретению готовят, предпочтительно, в виде нию множественной дозированной формы, отноединицы дозы, которая после перорального ввесительно высвобождения опиоида in vitro из пердения распадается на множество отдельных элевой фракции, при измерении посредством метода ментов Форма стандартной формы, предпочтиопределения растворения III, упомянутого в опительно, является твердой, как, например, капсула сании, или пакетик, особенно предпочтительна форма причем быстрое и отсроченное высвобождекапсулы ние in vitro согласуются таким образом, что первая фракция высвобождается, по существу, когда наФактическая нагрузка опиоида в фармацевтичинается высвобождение из второй фракции в ческой композиции по изобретению, т е конценмомент времени, соответствующий высвобождетрация опиоида в мае %, вычисленная по отношению 50% первой фракции, и на момент, когда вынию к общей массе гранулы, может зависеть от свобождается 10% опиоида, содержащегося во конкретного опиоида, используемого в композивторой фракции, при измерении по методу опреции Когда нагрузка опиоида в отдельных гранулах деления растворения III, упомянутого в описании двух фракций и соотношение между двумя фракциями для одной единицы дозы, содержащей, В другом варианте изобретение относится к например, 10мг морфина идентичны с нагрузкой и способу получения пероральной фармацевтичесоотношением в другой стандартной форме, соской композиции в виде множественной дозиродержащей, например, 100мг морфина, профиль ванной формы с модифицированным высвобожвысвобождения для этих доз будет идентичным дением, при котором Следовательно, индивидуальную общую дозу а) отдельные элементы, содержащие активможно вводить пациенту посредством комбинироное вещество, покрываются смесью для внутренвания подходящих единиц доз, выбранных, нанего пленочного покрытия, содержащего пленкопример, среди доз с 10, 30 и 100мг опиоида, без образующее вещество, причем на первую фракизменения общего профиля высвобождения всего цию отдельных элементом лекарственной формы количества введенного опиоида наносится покрытие, по количеству, в пересчете на сухую массу покрытия, соответствующее приПредпочтительно, гранулы фармацевтической мерно 10%-90% от массы покрытия, в пересчете композиции по изобретению содержат примерно на сухую массу покрытия, второй фракции от10мас% или больше опиоида от общей массы дельных элементов лекарственной формы, гранулы Упомянутые выше композиции можно полуб) на покрытые таким образом элементы, нечить обычными способами, известными в технике обязательно, наносится наружный пленочный Данное изобретение относится также к способу слой, содержащий пленкообразующее вещество, получения пероральной фармацевтической комв) смесь отдельных элементов первой и втопозиции в виде множественной дозированной рой фракции вводят в состав лекарственной форформы с модифицированным высвобождением мы при желательном соотношении между фракСпособ получения стандартной формы пероральциями ной фармацевтической композиции в виде множеПленкообразующее вещество на стадии б) ственной дозированной формы с модифицироможно выбрать таким образом, что при повышенванным высвобождением включает введение в ных температурах предотвращается слипание состав стандартной формы по меньшей мере двух элементов, затем покрытые элементы нагревают следующих фракций до температуры выше 40°С, предпочтительно - не выше 65-75°С, и посредством этого во внутреннем первой фракции модифицированной по выпленочном слое в однородной смеси с пленкообсвобождению множественной дозированной форразующим веществом формируется непрерывная мы с покрытием для относительно быстрого выфаза В некоторых случаях этот процесс отверсвобождения опиоида in vivo для получения тераждения может происходить также до нанесения певтически активной концентрации в плазме за слоя наружного покрытия относительно короткий промежуток времени, и второй фракции модифицированной по высвобоКак упоминалось выше, гранулы, содержащие ждению множественной дозированной формы а опиоил используемый в фармацевтической компокрытием для отсроченного высвобождения позиции по настоящему изобретению, покрываютопиоида in vivo, для поддержания анальгетически ся покрытием для модифицированного высвобожактивной концентрации в плазме на протяжении дения Покрытие для модифицированного высвопериода по меньшей мере в 12 часов, бождения наносят на гранулы из раствора и/или суспензии, предпочтительно, в водном растворипричем композиция из первой и второй фрактеле, но можно также применять органический ций, в отношении модифицированного высвобожсостав для покрытия дения из них и в отношении соотношения между первой и второй фракцией в стандартной форме, Примерами пленкообразующих веществ, подподгоняется таким образом, чтобы получить ходящих для применения в соответствии с настоящим изобретением, являются вещества, выI) относительно быстрое высвобождение бранные из группы, состоящей из производных опиоида in vitro из первой фракции модифицироцеллюлозы, таких как, например, этилцеллюлоза, ванной по высвобождению множественной дозиацетат целлюлозы, пропионат целлюлозы, бутированной формы, при измерении посредством рат целлюлозы, валерат целлюлозы, ацетатпрометода определения растворения III, как описано пионат, целлюлозы, акриловых полимеров, таких ниже в описании, 23 58506 как, например, полиметилметакрилат, виниловых полимеров, таких как, например, поливинилацетат, поливинилформаль, поливинилбутираль, сополимер винилхлорида и винилацетата, сополимер этилена и винилацетата, сополимер винилхлорида, пропилена и винилацетата, кремнийорганических полимеров, таких как, например, лестничный полимер сексвифенилсилоксана, и коллоидный диоксид кремния, поликарбоната, полистирола, сложного полиэфира, кумароноинденового полимера, полибутадиена и других высокомолекулярных синтетических полимеров В некоторых предпочтительных вариантах воплощения изобретения акриловый полимер состоит из одного или нескольких аммрниометакрилатных сополимеров Аммонийметакрилатные сополимеры хорошо известны в технике, и описаны в NF XVII как полностью полимеризованные сополимеры эфиров акриловой и метакриловой кислоте низким содержанием групп четвертичного аммония В одном из предпочтительных вариантов воплощения изобретения акриловое покрытие представляет лак из акриловой смолы, используемый в форме водной дисперсии, например, лак, коммерчески доступный от Rohm Pharraa, под торговым названием Eudragit® В других предпочтительных вариантах воплощения изобретения акриловое покрытие содержит смесь двух акрилатных лаков, коммерчески доступных Rohm Pharma, под торговым названием Eudragit® RL 30D и Eudragit® RS 30D, соответственно Eudragit® RL 30D и Eudragit® RS 30D являются сополимерами эфиров акриловой и метакриловой кислот с низким содержанием групп четвертичного аммония, причем молярное отношение аммониевых групп к оставшимся нейтральным (мет) акриловым эфирам составляет 1 20 в Eudragit® RL 30D и 1 40 в Eudragit® RS 30D Смеси Eudragit® RL/RS 30D не растворяются в воде и в дигестивных жидкостях Однако, покрытия, образованные из этих же материалов, в водных растворах и дигестивных жидкостях могут набухать и являются проницаемыми Дисперсии Eudragit® RL/RS 30D можно смешивать в любом нужном соотношении для получения, в конечном счете, модифицированной по высвобождению композиции с нужным профилем растворения Наиболее желательные модифицированные по высвобождению композиции можно получить с замедляющим покрытием на основе Eudragit® NE 30D, представляющего нейтральную смолу с молекулярной массой 800000 Количество нанесенного покрытия подбирается таким образом/ чтобы получить заранее обусловленные характеристики растворения фракции композиции Массовый процент покрытия для модифицированного высвобождения отдельной гранулы/ в случае фракции, обеспечивающей длительное действие опиоида, будет составлять в среднем максимум примерно 15мас%/ например, 12мас %/ предпочтительно - самое большее в среднем примерно 10 мае %, предпочтительнее в среднем интервале бмас %-9мас %/ по отношению к массе отдельной гранулы без покрытия Количество нанесенного покрытия зависит от 24 предварительно установленных характеристик растворения ядер определенного состава и нужного профиля высвобождения из фракции В случае фракции, обеспечивающей незамедлительное высвобождение опиоида, масса покрытия может составлять, в среднем, самое большее примерно 8мас %, например, самое большее примерно бмас %, предпочтительно - в среднем самое большее примерно 5мас %, предпочтительно самое большее примерно 4мас %, например, 3,5мас %, предпочтительно - в среднем примерно Змас %, по отношению к массе отдельной гранулы без покрытия Однако масса нанесенного покрытия также должна подбираться таким образом, чтобы не возникало проблем его разрушения Материал для формирования покрытия можно смешивать с различными добавками, такими как пластификаторы, антиадгезивы, например, коллоидный диоксид кремния, инертные наполнители и пигменты, способом, известным perse Липкость диспергируемых в воде пленкообразующих веществ можно преодолеть просто с помощью включения в покрытие антиадгезива Антиадгезив, предпочтительно, является мелкоизмельченным/ по существу, нерастворимым в воде, фармацевтически приемлемым несмачивающимся порошком, обладающим в покрытии антиадгезивными свойствами Примерами антиадгезивов являются стеараты металлов, например, стеарат магния или стеарат кальция, микрокристаллическая целлюлоза или минеральные вещества, такие как кальцит, по существу нерастворимые в воде фосфаты кальция или по существу нерастворимые в воде сульфаты кальция, коллоидный диоксид кремния, диоксид титана, сульфаты бария, гидрированные силикаты алюминия, водные алюминиевокалиевые силикаты и тальк Предпочтительным антиадгезивом является тальк Антиадгезив или смесь антиадгезивов включается в покрытие, предпочтительно, в количестве примерно 0,1-70мас %, вчастности - в количестве примерно 1-60мас%, и предпочтительно - в количестве примерно 8-50мас %, от массы слоя внутренней пленки При выборе талька с малым размером частиц получают большую площадь поверхности, являющееся результатом более сильное антиадгезивное действие дает возможность включать меньшее количество определенного антиадгезива Отдельная множественная дозированная форма с регулируемым высвобождением может также содержать второе покрытие Такое покрытие можно подобрать для стабилизации множественной дозированной формы с регулируемым высвобождением и для предупреждения нежелательных изменений в профиле высвобождения из каждого элемента с покрытием Соответственно, второй лак или покрытие могут внести вклад в стабильность профиля высвобождения единичной дозы Также обнаружено, как ни удивительно, что если во второе покрытие добавляется кальций, например, в форме сульфата кальция, наблюдается повышенная устойчивость при хранении 26 25 58506 Соответственно, множественная дозированлактоза (например, высушенная распылением ная форма также может содержать наружный лактоза, а-лактоза, р-лактоза, таблеттоза®, разпленочный слой личные сорта фарматозы®, микротоза или FastВ одном из вариантов наружный второй слой Floe®), микрокристаллическая целлюлоза (наприсодержит водное пленкообразующее вещество, мер сорта авицела®, такие как авицел® РН101, которое предупреждает слипание элементов при авицел® РН102 или авицел® рН105, Elcema® повышенных температурах и придает элементам Р100, Emcocel®, Vivacel®, Ming Таї® и Solkaтекучесть, причем водное пленкообразующее веFloc®), L-гид роксипропил целлюлоза (с низкой щество является антиадгезивом при температурах степенью замещения) (например, L-HPC-CH31 и выше примерно 40°С, особенно - при температуL-HPC-CH11), декстрины, мальтодекстрины (нарах выше примерно 50°С, например, при темперапример, Lodex® 5 и Lodex® 10) крахмалы или мотуре примерно от 60°С до, примерно, 120°С, и его дифицированные крахмалы (в том числе, картовыбирают среди материалов для диффузионных фельный крахмал, кукурузный крахмал и рисовый покрытий, таких как этилцеллюлоза, или материакрахмал), хлорид натрия, фосфат калия, фосфат лов для энтеросолюбильных покрытий, таких как кальция (например, основной фосфат кальция), анионные эфиры поли(мет)акриловой кислоты, сульфат кальция, карбонат кальция Проверено, фталата гид роксипропил метил целлюлозы, ацечто для фармацевтических композиций по натофталата целлюлозы, поливинилацетатафталастоящему изобретению особенно подходят микрота, сополимеров поливинилацетатфталата с крокристаллическая целлюлоза, Lтоновой кислотой или их смесей, или водораствогид роксипропил целлюлоза, декстрины, мальторимых пленкообразующих материалов, таких как декстрины, крахмалы и модифицированные крахводорастворимые производные целлюлозы, намалы пример, таких как гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, метилцеллюлоза, пропилМожно использовать дезинтегрирующие вецеллюлоза, гид роксиэтил целлюлоза, карбоксищества, такие как производные целлюлозы, в том этил целлюлоза, карбоксиметил гид роксиэтил целчисле, микрокристаллическую целлюлозу, крахлюлоза, гидроксиметилцеллюлоза, карбоксиметималы, включая картофельный крахмал, натрийклэтил целлюлоза, роскармелозу ( т е , сшитую натриевую соль карбоксиметил целлюлозы, например, Ac-Di-Sol®), метилгидроксипропилцеллюлоза или гидроксипроальгиновая кислота или альгинаты, нерастворипил метил целлюлоза мый поливинилпирролидон (например, поливиПримерами пластификаторов для применения дон® CL, поливидон® CL-M, коллидон® CL, полипо настоящему изобретению являются триацетинпласдон® XL, полипласдон® XL-10), натрийкарацетилированный моноглицерид, сурепное масло, боксиметилкрахмал (например, примогель® и эксоливковое" масло, кунжутной масло, ацетилтрибуплотаб®) тилцитрат, ацетилтриэтилцитрат, глицерин, сорДругими подходящими фармацевтически прибит, диэтилоксалат, диэтилмалат, диэтилмалеат, д и этил фу марат, диэтилсукцинат, диэтилмалонат, емлемыми эксципиентами могут являться красидиоктилфталат, дибутилсебаценат, триэтил циттели, корригенты, поверхностно-активные вещестрат, трибутилцитрат, глицеролтрибутират, полива и буферные вещества этиленгликоль, полипропиленгликоль и их смеси В дальнейшем изобретение описывается в Пластификатор обычно вводят в количестве меприведенных ниже примерах нее Юмас % в расчете на содержание сухого веКраткое описание чертежей щества в составе покрытия На фиг 1 приводится график профиля высвобождения модифицированных по высвобождению Кроме активного вещества лекарственного ядер с покрытием, полученных по примеру 1 средства в форме гранул с покрытием фармацевтическая композиция по изобретению может также На фиг 2 приводится график профиля высвосодержать фармацевтически приемлемые эксцибождения модифицированных по высвобождению пиенты ядер с покрытием, полученных по примеру 2 На фигЗ приводится график профиля высвоВ данном контексте термин "фармацевтически приемлемый эксципиент" предназначен для обобождения модифицированных по высвобождению значения любого материала, инертного в том ядер с покрытием, полученных по примеру 3 смысле, что он сам по себе, по существу, не обНа фиг 4 приводится график профиля высволадает каким либо терапевтическим и/или профибождения модифицированных по высвобождению лактическим действием Фармацевтически приемядер с покрытием, полученных по примеру 19 лемый эксципиент можно добавлять к активному На фиг 5 приводится график профиля высвовеществу лекарственного средства с целью созбождения модифицированных по высвобождению дания возможности для получения фармацевтиядер с покрытием, полученных по примеру 22, ческой композиции с приемлемыми техническими партия №1 свойствами Хотя фармацевтически приемлемый На фиг 6 приводится график профиля высвоэксципиент может несколько влиять на высвобожбождения модифицированных по высвобождению дение активного вещества лекарственного средядер с покрытием, полученных по примеру 22, ства, материалы, пригодные для получения мопартия №2 дифицированного высвобождения, в это опредеНа фиг 7 приводится график профиля высволение не включаются бождения модифицированных по высвобождению Могут включаться наполнители, разбавители, ядер с покрытием, полученных по примеру 22, связующие, такие как сахароза, сорбит, маннит, партия №3 28 27 58506 На фиг 8 приводится график профиля высвокам, соответствует композиции с модифицированбождения модифицированных по высвобождению ной по высвобождению множественной дозироядер с покрытием, полученных по примеру 22, ванной формамой с константой скорости абсорбпартия №4 ции 0,8 - быстродействующей фракции, и кривая, построенная по заштрихованным треугольникам, На фиг 9 приводится график профиля высвосоответствует композиции с фракцией с более бождения модифицированных по высвобождению быстрым модифицированным высвобождением из ядер с покрытием, полученных по примеру 22, множественной дозированной формы с констанпартия №5 той скорости абсорбции 2 Модифицированные по На фиг 10 приводится график профиля вывысвобождению многоэлементные вторые фраксвобождения модифицированных по высвобождеции во всех трех композициях имеют константу нию ядер с покрытием, полученных по примеру 23 скорости абсорбции 0,2 Временной лаг для поНа фиг 11 приводится график профиля выглощения этой второй фракции составляет тричасвобождения модифицированных по высвобождеса, подобно композициям, показанным на фиг 12, нию ядер с покрытием, полученных по примеру 24 13и 14 На фиг 12 приводятся графики концентрации морфина (сульфата морфина) в плазме, в произНа фиг 16 приводятся графики концентрации вольных единицах концентрации, после введения морфина в плазме после введения трех различидентичного общего количества морфина Вторые ных композиций с морфином Подробности см в фракции обеих композиций, с медленным, по суиспытании 1 ществу, высвобождением, идентичны КомпозиНа фиг 17 приводятся профили растворения ция, которой соответствуют не заштрихованные in vivo и in vitro, соответственно, для композиции квадраты, содержит 10% чистого сульфата морРерго-Оозе®-морфин, ср испытание 1 фина (не модифицированная) Другая композиция, Фиг 18 показывает корреляцию растворения которой соответствуют заштрихованные квадраты, Рерго-Оозе®-морфина in vitro и in vivo, cp испысодержит такое же количество морфина в форме тание 1 фракции модифицированной по высвобождению На фиг 19 приводится график Леви для Reproмножественной дозированной формы по изобреОозе®-морфина, ср испытание 1 тению Графики строятся на основе допущения На фиг 20 показаны предполагаемые уровни односекционной открытой модели, при этом конморфина в плазме, подробности см в испытании станта скорости удаления (Ке) морфина составля1 ет 0,5, константа скорости абсорбции (Ка) чистого На фиг 21 приводятся графики концентрации морфина равна 10, константа скорости абсорбции морфина в плазме после введения однократной в случае медленнодействующей модифицировандозы в виде капсулы с модифицированной по, ной по высвобождению множественной дозировысвобождению множественной дозированной ванной формы второй фракции равна 0,2, и равна формой, полученной по примеру 12, под названи0,8 в случае быстродействующей модифицироем Рерго-Оозе®-морфин (RDM) и MST Contmus® ванной по высвобождению множественной дози(MST), принятых без еды (без пищи) и с едой (с рованной формы первой фракции Эта модель пищей) Другие детали выясняются из испытания предназначается для пояснения действий первой 2 фракции содержащей модифицированную по выНа фиг 22 приводятся графики, соответстсвобождению множественную дозированную вующие графикам, приведенным на фиг 21, за форму, по сравнению с композицией с не модиисключением того, что приводится концентрация в фицированным высвобождением плазме морфин-6-глюкуронида На фиг 13 приводятся графики, подобные На фиг 23 приводятся графики, соответстграфикам на фиг 12, но в данном случае соотновующие графикам, приведенным на фиг 21, за шение между первой и второй фракцией каждой исключением того, что приводится концентрация в композиции составляет 2/10 Композиции, содерплазме морфин-3-глюкуронида жащей 20% морфина без добавок, соответствуют На фиг 24 приводятся графики концентрации крестики, а композиции, содержащей такое же морфина в плазме после введения двух различколичество первой модифицированной по высвоных композиций с морфином, ср испытание 3 бождению многоэлементной фракции, соответстНа фиг 25 приводятся графики средней инвуют звездочки Вторые фракции каждой композитенсивности боли, подробнее см испытание 3 ции идентичны На фиг 26 приводится эффективная оценка На фиг 14 приводится график, подобный грапредпочтительной обработки, ср испытание 3 фику на фиг 12, но в данном случае соотношение Материалы и методы между первой и второй фракцией 5/10, и композиНиже приводится перечень материалов, исции, содержащей морфин без добавок, соответстпользуемых в композициях, исследованных в ходе вуют звездочки, а композиции, содержащей перразработки настоящего изобретения В тех случавую модифицированную по высвобождению мноях, когда ссылка дается на официальную фармагоэлементную фракцию, соответствуют заштрихокопею, эта ссылка дается на последнее издание ванные ромбы указанной фармакопеи На фиг 15 приводятся графики для трех комИспользуются следующие аббревиатуры позиций, при этом соотношение между двумя ЕФ - европейская фармакопея, фракциями составляет 2/10 Кривая, построенная БФ - Британская фармакопея, по крестикам, соответствует композиции с морфиФСША - фармакопея США, ном без добавок, кривая, построенная по звездоч 29 58506 NF - национальный фармакологический справочник Эксципиенты Качество Сульфат морфина БФ Натрийальгинат LF 200S ЕФ Аспартам NF Maydis Amylum ЕФ Натрия цитрат ЕФ Натрия гидрокарбонат ЕФ Диоксид титана ЕФ Винная кислота ЕФ Коррикент с лимонным соком Лимонный корригент Поливидон К 30 ЕФ Микрокристаллическая целлюлоза ЕФ Карбоксиметил целлюлоза Natncum ЕФ Лактозы моногидрат ЕФ Вода очищенная ЕФ Метилгидроксипропилцеллюлоза (Pharma Coat 606) ЕФ Метил гид роксипропил целлюлоза (Methocel E 5 PreЕФ mium) Магния стеарат ЕФ Тальк ЕФ Симетиконовая эмульсия ФСША EudragitNE30D Кальция сульфат Полисорбат 20 Силоид 244 Таблеттоза Предв желатинированный крахмал NF УФ ЕФ ЕФ NF 30 Изготовитель Macfarlan Protan Biopolymer Holland Sweetner Company Cerestar Kirsch Solvay Bayer Vmal Givaudan Diibendorf Givaudan Dubendorf ISP и BASF FMC Henkel Hollandse Melksvirkerfabnk и DMV Shin-etsu Dow Akcros Chemicals Whittaker, Clark and Daniels Dow Corning Поставляется Rohm Pharma Gmbh, Дармштадт, Германия Giulmi Chemie Hefti Grace Meggle Colorcon Метод 1 определения растворения опиоида (сульфата морфина) (единицы морфина) Аппаратура Фильтр из стекловолокна Растворяющая среда Скорость вращения Мешалка Время отбора проб Длина волны детекции Измерительный прибор Температура растворяющей среды аппаратура для растворения по ФСША и ЕФ + автоматическая система растворения PERKIN ELMER+программа PEDS PC Whatman CF/D 900,0мл 0,1 N HCI ЮОоб/мин Лопастная Как указано в таблицах Я=284нм УФ-спектрофотометр, кювета 1см 37,0°С±0,5°С Приготовление реагентов Растворяющая среда 0,1 N HCI 83мл конц HCI (37%) разбавляют очищенной водой до 10,00л Исходный стандартный раствор S (готовят 2 раствора) 100мг (=q, мг) сульфата морфина R растворяют в 50,00мл 0,1 N HCI Контрольные растворы из 2 стандартов 3,00мл S разбавляют 0,1 N HCI до 200,00мл (б) Образец - "пустышка" 0,1 N HCI (в) Измерения Различие в поглощении между растворами б и в измеряют при максимуме примерно 284нм (k-i) Европейская фармакопея, V619 Вычисления Вычисляют реакцию (по 3 показателям) для каждого из измерений ki N,1 q-2 Расхождение между вышать 2% и R2 не должно пре Определение Е ] * Исходные растворы 1 и 2 смешивают в соотношении 1 1 Разбавляют 4,00мл этого раствора 0,1 N HCI до 200,00мл Стандартный раствор и образец - "пустышку" (0,1 N HCI) нагревают до 37°С Когда 2 раствора нагреваются до 37°С, в измерительную кювету закачивают образец - "пустышку" (0,1 N HCI) Закачивание проводят до тех пор, пока не удалят из кюветы все пузырьки воздуха 32 31 58506 Проводят поправку на фон, и в измеритель(компенсацию осуществляют ную кювету закачивают стандартный раствор путем вычисления) Измеряют поглощение стандарта, и вычисляДлина волны деКак в методе I текции ют Е 1% 1см Измерительный Как в методе I -1% abc x5Ox2OOx1O прибор •1см q x4 Температура расКак в методе I творяющей среды abcst = поглощение использованного стандарта, Приготовление реагентов q x = средняя масса (мг) сульфата морфина R в Растворяющая среда 0,1 N HCL Как описано 2 стандартных растворах в методе I Вычисленное значение ВВОДЯТ В проИсходный стандартный раствор (S) (готовят 2 раствора) как описано в методе I грамму PEDS-PC Составление программы проводят в соответРастворы для разбавления стандарта 10мг 1 ствии с руководством PERKIN ELMER пустую капсулу 5 размера растворяют в 900,0мл 0,1 N HCL Процедура Каждый из 7, нужного числа, сосудов наполняют растворяющей средой - 0,1 N HCI 30мг 1 пустую капсулу 3 размера растворяют в (900,00мл) и нагревают до 37,0°С±0,5°С Раство900,0мл 0,1 N HCL ряющую среду из 7 сосудов закачивают в измери60мг 1 пустую капсулу 1 размера растворяют в тельные кюветы УФ-спектрофотометра, и прово900,0мл 0,1 N HCL дят процедуру поправки на фон В 25-мл стаканы Эти растворы используют для разбавления помещают 6 единиц (доз) сульфата морфина и стандарта и в качестве образца - "пустышки" (в) единицу плацебо Дозу плацебо используют во Стандартный раствор время серии опытов как образец - "пустышку" 10мг Разбавляют 5,00мл S 0,1 N HCL до 50,00мл, 10,00мл разбавляют 0,1 N HCL до Процедура приготовления и переноса единиц 100,00мл (б) 1 Тщательно перемешивают содержимое стаканов 30мг Разбавляют 3,00мл S 0,1 N HCL до 200,00мл (б) 2 Отмеряют измерительной склянкой 10,0мл водопроводной воды Воду выливают в стакан и 60мг Разбавляют 3,00мл S 0,1 N HCL до перемешивают до тех пор, пока смесь не будет 100,00мл (б) выглядеть однородной Смесь готова к употребИспытываемые растворы Образцы измеряют лению через 1 минуту неразбавленными (а) 3 Смесь перемешивают непосредственно пеИзмерения Различие в поглощении между ред тем, как перенести ее в сосуд по ФОНА Перастворами б и в (k-i) и между растворами а й в реносят в отдельные сосуды 7 приготовленных (кг) измеряют при максимуме примерно 284нм доз Каждый стакан ополаскивают растворяющей Европейская фармакопея, V 6 19 средой из сосуда с тем, чтобы перенести в сосуд Вычисления Как описано в методе I всю смесь Приемы вычисления 4 Сразу после переноса всех доз в сосуды GSR = - ( R 1 + R 2 ) начинают опыт по растворению st x Метод 11 определения растворения опиоида (сульфата морфина) (капсулы с 10мг, 30мг и 60мг морфина) Аппаратура Фильтр из стекловолокна Растворяющая среда Скорость вращения Мешалка Время отбора проб Отбор проб аппаратура для растворения по ФСША и ЕФ + автом, пробоотборник (прибор для взятия проб на растворение ISKO/Sotax) или автоматическая система растворения PERKIN ELMER Как в методе I Как в методе I Как в методе I Как в методе I Как описано в методе I Автоматический, приблизительно по 9,00мл (v), без замены удаленной жидкости Высвободившееся количество сульфата морфина (у), в мг, вычисляют с помощью приведенных ниже формул 58506 33 ID мг 34 Определение Е ] С ^ Как описано в методе I (мі- выявлявшегосд сульфата морфина), 3 часа GSR* 100x50x50x100 УЗ = 2Э + 300 900 100x50x50x100 у3х ЭОО-v Й5Ях100х50x50x100 ЗО мг> G5,Kxl 00x50x2 00 GSfixl00x50x200 Метод определения растворения III в случае модифицированных по высвобождению множественных дозированных форм с опиоидом (сульфатом морфина) (ыг ЯЫД&ЛИШ1&Г0СЯ сульфата Уз = z% + SSfixl00x50x200 Процедура Каждый из нужного числа, например, 7, сосудов наполняют растворяющей средой - 0,1 N HCL (900,00мл) и нагревают до 37,0°С±0,5°С Растворяющую среду из 7 сосудов закачивают в измерительные кюветы УФспектрофотометра, и проводят процедуру поправки на фон В каждый из 6 сосудов вносят по капсуле В 7-ой сосуд добавляют соответствующую пустую капсулу, и используют в серии опытов в качестве образца-"пустышки" 10мг, 1 пустая капсула размера 5 30мг, 1 пустая капсула размера 3 60мг, 1 пустая капсула размера 1 Аппаратура Фильтр из стекловолокна Растворяющая среда Скорость вращения Мешалка Э00 Э00 сульфата морфина) , Уі = (900-v) хЗ уз = зз Время отбора проб GSSxl00x50x100 900 9 час GSRxlOOxS0x100 900 ЭОО-v 900-2XV n = чистота стандарта сульфата морфина, в процентах; v = количество образца, в ыл. Результате Б процентах: S = (у я 100!Лк; х = установленное содержание (10, 30 или 60}. Процедура Растворяющую среду 0,1 N HCL (900,00мл) вносят в каждый из нужного числа сосудов, например, в 6 сосудов, которые нагревают до 37,0°С±0,5°С В каждый сосуд переносят по одной капсуле Настройка автоматического пробоотборника в соответствии с инструкцией к прибору Метод определения растворения с применением только автоматического оборудования Аппаратура аппаратура для растворения по ФСША и ЕФ + автоматическая система растворения PERKIN ELMER (PEDS) + программа PEDS PC Контрольный раствор из 2 стандартов - как в методе I Измерения Как описано в методе I Вычисления Как описано в методе I Как в методе I Как в методе I Как в методе I Как в методе I Как в методе I Система растворения по ФСША/ЕФ + автоматический пробоотборник, медленнодействующая модифицированная по высвобождению множественная дозированная форма 1, 3, 6, 9час , быстродействующая модифицированная по высвобождению множественная дозированная форма 1/2, 1час, смесь из медленно и быстро действующей модифицированной по высвобождению множественной дозированной формы 1, 3, 6, 9час , Как описано в методе II Автоматическая система растворения PERKIN Отбор проб ELMER, как описано в методе II Длина волны детекции Как в методе I Измерительный прибор Как в методе I Температура раствоКак в методе I ряющей среды Приготовление реагентов Как описано в методе I Исходный стандартный раствор (S) (готовят 2 раствора) как описано в методе I Стандартный раствор Разбавляют 3,00мл S 0,1 N HCL до 100,00мл Испытываемые растворы Образцы измеряют неразбавленными (а) Образец - "пустышка" 0,1 N HCL (в) 35 Измерения Как описано в методе I Вычисления Как описано в методе I Приемы вычисления 58506 GSR = — (R-j + R2) Высвободившееся количество сульфата морфина (у), в мг, вычисляют с помощью приведенных ниже формул Медленнодействующая модифицированная по высвобождению множественная дозированная форма GSFxlGOxSOxlQQ 3 часа морфича). вшегмвлівгося GSMx100x50x100 900 Уз~ 900 ЭОО-v 900-2KV Бистродеиствукжая і моди^ици^рванная іі пе; іі высвобождению множественна^ дозырОБачна^ форма 1/2 часа xnxS00xv>:3 (мг> вш&твиегося сульфата морфина), GSRxlOOx50xlOQ Zl SSHxT00x50x100 Время отбора проб Как в методе I Как в методе I Как в методе I Как в методе I Как следует из таблиц Температура растворяющей Как в методе среды Приготовление реагентов Растворяющая среда 0,1 N HCL Как описано в методе I Исходный стандартный раствор (S) (готовят 2 раствора) как описано в методе I Контрольный раствор иэ 2 стандартов Как описано в методе I Измерения Как описано в методе I Вычисления Как описано в методе I Определение Е] с ^ Как описано в методе I GSSxlOOxSOxlOO z 36 Фильтр из стекловолокна Растворяющая среда Скорость вращения Мешалка УЗ = 900 п - чистота стандарта сульфата морфина, в гроцентахv = количество образца, в мл Процедура Растворяющую среду 0,1 N HCL (900,00мл) вносят в каждый из 6 сосудов, и нагревают до 37,0°С±0,5°С В каждый сосул переносят количество модифицированной по высвобождению множественной дозированной формы (=р, мг) соответствующее 60мг сульфата морфина Настройка автоматического пробоотборника в соответствии с инструкцией к прибору Метод определения растворения с применением только автоматического оборудования Аппаратура аппаратура, для растворения по ФСША и ЕФ + система растворения PERKIN ELMER (PEDS) + программа PEDS PC Контрольный раствор из 2 стандартов - как описано в методе I Процедура Каждый из 6 сосудов наполняют растворяющей средой - 0,1 N HCL (900мл) и нагревают до 37,0°С ± 0,5°С В каждый из 6 сосудов вносят количество модифицированной по высвобождению множественной дозированной формы (=р, мг), соответствующее 60мг сульфата морфина В 7-ой сосуд добавляют стандартный раствор с концентрацией, соответствующей 0,07мг/мл (60мг/900мл) Программу PEDS составляют в соответствии с руководством PERKIN ELMER Метод IV определения растворениярпиоида, (сульфата морфина) (таблетки с 40мг морфина и модифицированная по высвобождению множественная дозированная форма для таблеток) Аппаратура Как в методе I Процедура Каждый из нужного числа сосудов наполняют растворяющей средой 0,1 N HCL (900мл ), и нагревают до 37,0°С±0,5°С Таблетки В каждый сосуд переносят по одной таблетке Модифицированная по высвобождению множественная дозированная форма В каждый сосуд переносят количество элементов, соответствующее 40мг сульфата морфина Метод V определения растворения опиоида (сульфата морфина) (капсулы с 10мг, 20мг, 30мг, 50 мг, 60мг и 100мг морфина) аппаратура для растворения по ФСША и Аппаратура ЕФ +автом пробоотборник (ISKO/Sotax) Фильтр из стекловоWhatman GF/F локна Растворяющая среда Как в методе I Скорость вращения Как в методе I Мешалка Как в методе I Время отбора проб Как следует из таблиц Как описано в методе Отбор проб Температура раствоКак в методе ряющей среды Приготовление реагентов Растворяющая среда 0,1 N HCL как описано в методе I Процедура Как описано в методе II Исходный стандартный раствор (S) (готовят 2 раствора) как описано в методе I Калибровочная кривая Каждый из двух стандартных исходных растворов (раствор S) разбавляют растворяющей средой для получения стандартных растворов, перекрывающих три уровня концентрации Уровень, каКонцентрация либровочная кривая приблизит 18% указанного со1 держания приблизит 60% указанного со2 держания приблизит 105% указанного со3 держания 37 58506 38 Измерения В примере 1 ядра с покрытием, модифицированные по высвобождению сульфата морфина, Измерения стандартных и испытываемых располучают посредством изготовления ядер и потворов осуществляют с помощью ВЭЖХ следующего нанесения покрытия в количестве Колонка Superspher RP 18 100, 250 4,6мм 13,5мас % (% от массы ядер) Детектор Детектор УФ-поглощения, Я,=287нм Ядра получают с применением технических Подвижная фаза Растворяют в 500мл воды приемов экструзии/сфероизации Перечень ингредля ВЭЖХ 11,54г л аури л сульфата натрия, 15,60 диентов приведен в табл 1 Ингредиенты смешиNaH2PO4 2H2O, добавляют 500мл аце-тонитрила и вают и смачивают в мешалке Diosna с большими 5,00мл триэтиламина, и все тщательно перемесдвиговыми усилиями, в которую воду добавляют шивают Затем с помощью фосфорной кислоты с помощью форсунки (форсунка, работающая под (конц) доводят рН до 3,6±0,05 (приблизит Змл) давлением, типа Delevan CJ, диаметр канала Фильтруют под вакуумом через фильтр Whatman 4,0мм) GF/A Скорость потока 1,0мл/мин Таблица 1 Петля 20мкл для капсул с 50, 60 и 100мг, 100мкл для капсул с 10, 20 и 30мг Ингредиенты Количество (кг) Время хроматографии для испытываемого и стандартного раствора приблизит 1,75%НОрфин [минут] (^приблизит Юминут) Сульфат морфина 8,10 Примечание Микрокристаллическая целлюлоза 7,26 Образец испытываемого раствора для опреЛактоза 29,16 деления методом ВЭЖХ в случае образцов Натрийкарбоксиметил целлюлоза 0,45 (^испытываемый раствор) и растворов для калибОчищенная вода 12,6 ровочной кривой перед анализом фильтруют через фильтры Whatman GF/A Испытываемые расСмоченную массу экструдируют в экструдере творы не разбавляют Nica E 140 с размером отверстий 0,6мм ЭкструВычисления Перед впрыскиванием образцов дат сфероидируют в Marumenzer, Fuji-Paudal, в анализируют шесть растворов, описанных в разтечение 4мин Полученные таким образом ядра деле "Калибровочная кривая", и получают линейсушат на поддонах в течение приблизительно ную регрессию ответа от концентрации Для вы13час при40°С числения используют наклонный участок (наклонВысушенные ядра фракционируют в аппарате калибровка) и отрезок, отсекаемый на координатSweko, снабженным нижним ситом 0,500мм и ной ОСИ (ОТреЗОКкалибровка) верхним ситом 0,790мм Доверительный интервал отсекаемого отрезка На 27,9кг таких ядер наносят внутреннее пов 95% должен включать начало координат крытие, серединное покрытие и наружное покрыКоличество (уі, уз, Уб, Уэ) растворенного сультие в жидком слое, Glatt WSC 30, с помощью расфата морфина вычисляют в процентах от устапылительной головки 1,8мм и при давлении расновленного содержания в каждой из капсул с попыления 3 бар для внутреннего покрытия и 3,5 мощью приведенных ниже выражений бар для серединного и наружного покрытия Со1 час став для покрытия приводится в табл 2 (^ г -оарй@оу„агиорсо«г хпхЭООхЮО 10 0 XX Ингредиенты 3 часа 900 6 час «ах100хх 900 90G-V Э час Ета goo х 10 0 х х 900-v 500-2KV Аг= площадь морфинового пика на хроматограмме испытываемого раствора п = чистота стандарта сульфата морфина, в процентах, v = количество образца, в мл х = установленное содержание в капсуле Пример 1 Внутреннее покрытие Гид роксипроп ил метил целлюлоза Стеарат магния Тальк Симетиконовая эмульсия EudragitNE30D Очищенная вода Всего Серединное покрытие Сульфат кальция Гид роксипроп ил метил целлюлоза Симетиконовая эмульсия Полисорбат 20 EudragitNE30D Очищенная вода Всего Наружное покрытие Гид роксипроп ил метил целлюлоза Тальк Очищенная вода Всего Таблица 2 Количество (кг) 0,163 0,034 0,304 0,025 10,800 13,674 25,000 1,817 0,230 0,012 0,017 2,428 6,941 11,500 0,360 0,360 8,280 9,000 58506 40 39 В процессе нанесения покрытия внутреннее, следующего нанесения покрытия в количестве серединное и наружное покрытие наносят в ука11,5 мае % (% от массы ядер) занном далее количестве Количество нанесенноПолучают ядра и наносят на них покрытие так, го сухого вещества, в процентах от массы ядер, как описано в примере 1, за исключением того, что также указывается ниже в примере 2 на 2,30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже 15,82кг раствора для формирования Внутреннее покрытия (сухая масса 8,5% от покрытие 13,01 кг раствора для формиВнутреннее помассы ядер) рования покрытия (сухая маскрытие 4,59кг раствора для формироваса 6,5% от массы ядер) Серединное ния покрытия (сухая масса 4,0% 4,94кг раствора для формиропокрытие Серединное поот массы ядер) вания покрытия (сухая масса крытие 3,49кг раствора для формирова4,0% от массы ядер) Наружное ния покрытия (сухая масса 1,0% 3,75кг раствора для формиропокрытие Наружное от массы ядер) по- вания покрытия (сухая масса крытие 1,0% от массы ядер) В процессе формирования покрытия температура слоя поддерживается, по существу, в интерТакже в процессе нанесения покрытия темпевале от 19,5 до 20,9°С посредством регулироваратуру слоя поддерживают, по существу, в интерния скорости потока жидкости Температура возвале от 19,0 до 20,8°С посредством регулировадуха на входе поддерживается приблизительно на ния скорости потока жидкости уровне 43°С После нанесения покрытий ядра с Полученные таким образом ядра с покрытием покрытием отверждаются при температуре слоя имеют показатели по растворению, приведенные приблизительно 70°С в течение ЗОмин, а затем в табл 4 (определенные по упомянутому выше ядра с покрытием охлаждаются при температуре методу определения растворения III) слоя ниже 35°С Нужный (целевой) профиль растворения и Таблица 4 нижний и верхний пределы степени растворения указаны ниже 1час 18,2% 2часа 37,4% Нижний преВерхний Зчаса 53,3% Целевой дел предел 4часа 65,8% 1час 5,0% 0% 21,0% 5час 75,3% Зчаса 33,0% 11,0% 55,0% бчас 82,1% бчас 68,0% 52,0% 84,0% 7час 86,8% 9час 84,0% 73,0% 8час 90,1% 9час 92,4% После нанесения покрытия ядра с покрытием Ючас 94,0% просеивают через сито 1,2мм частицы более 12час 95,9% крупного размера отбрасывают 16час 97,5% Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 3 (определенные по упомянутому выше методу определения растворения III) Таблица 3 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 2,1% 9,9% 19,9% 31,3% 42,8% 53,4% 62,6% 70,3% 76,2% 80,7% 86,8% 92,5% Пример 2 В примере 2 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и по Пример 3 В примере 3 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 8,0мас % (% от массы ядер) Покрытие наносят на ядра так, как описано в примере 1, за исключением того, что в примере 3 на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 6,00кг раствора для формирования покрытия (сухая масса 3,0% от массы ядер) 4,94кг раствора для формирования покрытия (сухая масса 4,0% от массы ядер) 3,75кг раствора для формирования покрытия (сухая масса 1,0% от массы ядер) 42 41 58506 Нужный (целевой) профиль растворения и нижний и верхний пределы степени растворения указаны ниже Целевой 0,5часа 67,0% 91,0% 1час Нижний предел 47,0% 71,0% Верхний предел 95,0% Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 19,3 до 20,5°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 5 (определенные по упомянутому выше методу определения растворения III) Таблица 5 Юмин 20мин ЗОмин 40мин 50мин бОмин 49,0% 77,6% 89,5% 94,6% 97,2% 98,4% Пример 4 В примере 4 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 12,5мас % (% от массы ядер) Получают ядра и наносят на них покрытие так, как описано в примере 1, за исключением того, что в примере 4 во время смачивания в смеситель Diosna добавляют 12,83кг жидкости, и на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 15,01 кг раствора для формирования покрытия (сухая масса 7,5% от массы ядер) 4,94кг раствора для формирования покрытия (сухая масса 4,0% от массы ядер) 3,75кг раствора для формирования покрытия (сухая масса 1,0% от массы ядер) Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 18,0 до 19,6°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 6 (определенные по упомянутому выше методу определения растворения III) Таблица 6 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 10,3% 24,9% 40,2% 54,4% 66,7% 76,1% 83,1% 88,1% 91,6% 94,1% 97,3% 100,1% Пример 5 В примере 5 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 13,5мас % (% от массы ядер) Ядра получают и наносят на них покрытие так, как описано в примере 4, за исключением того, что в примере 5 на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 17,01 кг раствора для формирования покрытия (сухая масса 8,5% от массы ядер) 4,94кг раствора для формирования покрытия (сухая масса 4,0% от массы ядер) 3,75кг раствора для формирования покрытия (сухая масса 1,0% от массы ядер) Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 18,3 до 19,8°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 7 (определенные по упомянутому выше методу определения растворения III) Таблица 7 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 3,4% 10,1 19,8 31,3 43,5% 54,9% 64,9% 72,9% 79,1% 83,7% 90,0% 95,8% Пример 6 В примере б ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 8,0мас % (% от массы ядер) Ядра получают и наносят на них покрытие так, как описано в примере 4, но с желательным профилем растворения, описанным в примере 3 44 43 58506 Кроме того, выбирают следующие отклонения от примера 4 в примере 6 на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Таблица 9 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 6,0кг раствора для формирования покрытия (сухая масса 3,0% от массы ядер) 4,94кг раствора для формирования Серединное покрытия (сухая масса 4,0% от покрытие массы ядер) 3,75кг раствора для формирования Наружное покрытия (сухая масса 1,0% от покрытие массы ядер) Внутреннее покрытие Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 18,2 до 19,8°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 8 (определенные по упомянутому выше методу определения растворения III) Таблица 8 Юмин 20мин ЗОмин 40мин 50мин бОмин 51,0% 79,1% 90,5% 95,5% 98,0% 99,2% Пример 7 В примере 7 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 13,0мас % (% от массы ядер) Получают ядра и наносят на них покрытие так, как описано в примере 1, за исключением того, что в примере 7 во время смачивания в смеситель Diosna добавляют 12,38кг жидкости, и на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 16,01 кг раствора для формирования покрытия (сухая масса 8,0% от массы ядер) 4,94кг раствора для формирования покрытия (сухая масса 4,0% от массы ядер) 3,75кг раствора для формирования покрытия (сухая масса 1,0% от массы ядер) Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 20,5 до 22,5°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 9 (определенные по упомянутому выше методу определения растворения III) 4,3% 12,3% 24,3% 38,6% 52,6% 64,4% 73,6% 80,5% 85,4% 88,9% 93,4% 97,8% Пример 8 В примере 8 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 8,0мас % (% от массы ядер) Ядра получают и наносят на них покрытие так, как описано в примере 7, но с желательным профилем растворения, описанным в примере 3, за исключением того, что в примере 8 на 30кг ядер наносят внутреннее, серединное и наружное покрытие в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 6,0кг раствора для формирования покрытия (сухая масса 3,0% от массы ядер) 4,94кг раствора для формирования покрытия (сухая масса 4,0% от массы ядер) 3,75кг раствора для формирования покрытия (сухая масса 1,0% от массы ядер) Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 20,0 до 22,2°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 10 (определенные по упомянутому выше методу определения растворения III) Таблица 10 Юмин 20мин ЗОмин 40мин 50мин бОмин 41,1% 70,7% 84,9% 92,2% 96,0% 98,1% Пример 9 В примере 9 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 12,2мас % (% от массы ядер) Изготовление таких ядер с покрытием осуществляют так, как описано в примере 7, за исключением того, что в примере 9 на 30кг ядер наносят 46 45 58506 внутреннее, серединное и наружное покрытие в Elanco, в течение 3,5мин Полученные таким образом ядра сушат на поддонах в течение прибликоличестве, указанном ниже зительно 7час при 40°С Высушенные ядра фракционируют в аппарате 14,41 кг раствора для формироВнутреннее Sweko, снабженным нижним ситом 0,500мм и вания покрытия (сухая масса покрытие верхним ситом 0,790мм 7,2% от массы ядер) Указанную выше процедуру повторяют четыре 4,94кг раствора для формироСерединное раза, получая в общей сложности 147кг ядер вания покрытия (сухая масса покрытие На 28кг таких ядер наносят внутреннее покры4,0% от массы ядер) тие, серединное покрытие и наружное покрытие в 3,75кг раствора для формироНаружное жидком слое, Glatt WSC 30, с помощью распыливания покрытия (сухая масса покрытие тельной головки 1,8мм и при давлении распыле1,0% от массы ядер) ния 3 бар для внутреннего покрытия и 3,5 бар для серединного и наружного покрытия Состав для Также в процессе нанесения покрытия темпепокрытия приводится в табл 13 ратуру слоя поддерживают, по существу, в интервале от 20,0 до 22,2°С посредством регулироваТаблица 13 ния скорости потока жидкости Полученные таким образом ядра с покрытием Количество имеют показатели по растворению, приведенные Ингредиенты (кг) в табл11 (определенные по упомянутому выше Внутреннее покрытие методу определения растворения III) Гид роксипроп ил метил целлюлоза 0,104 Таблица 11 Стеарат магния 0,022 Тальк 0,194 1час 12,2% Симетиконовая эмульсия 0,016 2часа 28,7% EudragitNE30D 6,912 Зчаса 44,6% Очищенная вода 8,752 4часа 59,1% Всего 16,000 5час 70,5% Серединное покрытие бчас 78,6% Сульфат кальция 0,790 7час 84,2% Гид роксипроп ил метил целлюлоза 0,100 8час 88,1% Симетиконовая эмульсия 0,005 9час 90,5% Полисорбат 20 0,0075 Ючас 92,3% EudragitNE30D 1,055 12час 94,7% Очищенная вода 3,0425 16час 96,4% Всего 5,000 Наружное покрытие Пример 10 Гид роксипроп ил метил целлюлоза 0,160 В примере 10 ядра с покрытием, модифициТальк 0,160 рованные по высвобождению сульфата морфина, Очищенная вода 3,680 получают посредством нанесения на ядра покрыВсего 4,000 тия в количестве 13,5 мае % (% от массы ядер) Ядра получают с применением технических В процессе нанесения покрытия внутреннее, приемов экструзии/сфероизации Перечень ингресерединное и наружное покрытие наносят в укадиентов приведен в табл 12 Ингредиенты смешизанном далее количестве вают и смачивают в мешалке Diosna с большими сдвиговыми усилиями, в которую воду добавляют 15,88кг раствора/суспензия для с помощью форсунки (форсунка, работающая под Внутреннее формирования покрытия (сухая давлением, типа Delevan CJ, диаметр канала покрытие масса 8,5% от массы ядер) 2,5мм) 4,61кг раствора/суспензии для Серединное формирования покрытия (сухая покрытие Таблица 12 масса 4,0% от массы ядер) 3,50кг раствора/суспензии для Наружное Количество формирования покрытия (сухая Ингредиенты покрытие (кг) масса 1,0% от массы ядер) Сульфат морфина 7,20 Микрокристаллическая целлюлоВ процессе формирования покрытия темпера6,48 за тура слоя поддерживается, по существу, в интерЛактоза 25,92 вале от 18,0 до 20,5°С посредством регулироваНатрийкарбоксиметил целлюлоза 0,40 ния скорости потока жидкости Температура возОчищенная вода 10,6 духа на входе поддерживается приблизительно на уровне 30°С После нанесения покрытия ядра с Смоченную массу экструдируют в экструдере покрытием отверждаются при температуре слоя Nica E 140 с размером отверстий 0,6мм Экструприблизительно 70°С в течение ЗОмин, а затем дат сфероидируют в Marumenzer, Fuji-Paudal 48 47 58506 ядра с покрытием охлаждаются при температуре В примере 12 ядра с покрытием из примера 10 слоя ниже 35°С и из примера 11 смешивают в шаровой мельнице в течение 5мин Пропорция при смешивании слеПосле нанесения покрытия ядра с покрытием дующая просеивают через сито 1,0мм частицы более крупного размера отбрасывают ядра примера 10-20,09кг, Полученные таким образом ядра с покрытием ядра примера 11-4,73кг имеют показатели по растворению, приведенные Эту пропорцию вычисляют на том основании, в табл 14 (определенные по упомянутому выше что 80,0% сульфата морфина должно находиться методу определения растворения III) в форме ядер с покрытием, полученным по примеру 10, а 20,0% сульфата морфина в смеси должно находиться в форме ядер с покрытием, Таблица 14 полученных по примеру 11 К смеси ядер подмешивают 0,186кг талька в 1час 5,4% шаровой мельнице в течение 5мин 2часа 15,6% Полученная таким образом смесь ядер с поЗчаса 29,1% крытием имеет показатели по растворению, при4часа 43, 6% веденные в табл 16 (определенные по упомяну5час 57,4% тому выше методу определения растворения III) бчас 68,6% 7час 77,2% Таблица 16 8час 83,6% 9час 88,1% 1час 24,0% Ючас 91,3% 2часа 31,8% 12час 95,4% Зчаса 41,7% 16час 99,0% 4часа 52,7% 5час 63,5% Пример 11 бчас 73,1% В примере 11 ядра с покрытием, модифици7час 80,1% рованные по высвобождению сульфата морфина, 8час 85,6% получают посредством нанесения покрытия на 9час 89,8% ядра в количестве 8мас % (% от массы ядер) Ючас 92,8% Ядра получают так, как описано в примере 10 12час 96,8% Однако, на ядра наносят внутреннее, серединное 16час 100,5% и наружное покрытия в количестве, указанном ниже Смесью ядер с покрытием с помощью устройства для наполнения капсул Zanasi AZ 40 напол5,6кг раствора/суспензии для Внутреннее няют капсулы Характеристики капсул приводятся формирования покрытия (сухая покрытие в табл 17 (установленные по описанному выше масса 3,0% от массы ядер) методу определения растворения II) 4,61кг раствора/суспензии для Серединное формирования покрытия (сухая покрытие Таблица 17 масса 4,0% от массы ядер) 3,50кг раствора/суспензии для Наружное Размер капсулы 5 3 1 формирования покрытия (сухая покрытие масса 1,0% от массы ядер) Количество ядер с покрыти62,5 187,4 374,8 ем (мг) Доза сульфата морфина Также в процессе нанесения покрытия темпе10 30 60 (мг) ратуру слоя поддерживают, по существу, в интервале от 18,5 до 22,0°С посредством регулироваРастворение за 1час (%) 23,1 22,1 22,9 ния скорости потока жидкости Растворение за Зчаса (%) 41,3 40,0 40,8 Полученные таким образом ядра с покрытием Растворение за бчас (%) 72,9 71,8 72,4 имеют показатели по растворению, приведенные Растворение за 9час (%) 91,3 88,9 89,8 в табл 15 (определенные по упомянутому выше методу определения растворения III) Пример 13 В примере 13 ядра с покрытием, модифициТаблица 15 рованные по высвобождению сульфата морфина, получают посредством изготовления ядер и поЮмин 38,5% следующего нанесения покрытия в количестве 20мин 70,2% 12,5мас % (% от массы ядер) ЗОмин 86,6% Ядра с покрытием получают так, как описано в 40мин 94,0% примере 10, за исключением того, что на ядра наносят внутреннее, серединное и наружное по50мин 97,8% крытия в количестве, указанном ниже бОмин 99,6% Пример 12 Внутреннее покрытие, 14,0кг раствора/суспензии для формирования покрытия (сухая 49 Серединное покрытие Наружное покрытие Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 18,0 до 22,0°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 18 (определенные по упомянутому выше методу определения растворения III) Таблица 18 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 10,5% 26,5% 42,0% 55,9% 67,5% 76,8% 83,7% 88,4% 91,8% 94,5% 97,4% 99,9% Пример 14 В примере 14 ядра с покрытием, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 14,5мас % (% от массы ядер) Ядра с покрытием получают так, как описано в примере 10, за исключением того, что на ядра наносят внутреннее, серединное и наружное покрытия в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 17,75кг раствора/суспензии для формирования покрытия (сухая масса 9,5% от массы ядер) 4,61кг раствора/суспензии для формирования покрытия (сухая масса 4,0% от массы ядер) 3,50кг раствора/суспензии для формирования покрытия (сухая масса 1,0% от массы ядер) Также в процессе нанесения покрытия температуру слоя поддерживают, по существу, в интервале от 18,0 до 22,2°С посредством регулирования скорости потока жидкости Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 19 (определенные по упомянутому выше методу определения растворения III) Таблица 19 1час 50 58506 масса 7,5% от массы ядер) 4,61кг раствора/суспензии для формирования покрытия (сухая масса 4,0% от массы ядер) 3,50кг раствора/суспензии для формирования покрытия (сухая масса 1,0% от массы ядер) 3,3% 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 16час 9,4% 18,3% 30,4% 43,7% 56,8% 67,1% 75,4% 81,7% 86,6% 92,6% 98,0% Пример 15 В примере 15 получают пакетики, модифицированные по высвобождению сульфата морфина, посредством изготовления ядер и последующего нанесения покрытия в количестве 15,0мас % (% от массы ядер) Ядра получают с применением технических приемов экструзии/сфероизации Перечень ингредиентов приведен в табл 20 Ингредиенты смешивают и смачивают в мешалке Fielder с большими сдвиговыми усилиями Таблица 20 Ингредиенты Сульфат морфина Микрокристаллическая целлюлоза Маисовый крахмал Лактоза Поливидон Очищенная вода Количество (кг) 0,900 1,200 1,800 1,980 0,120 2,550 Смоченную массу экструдируют в экструдере Nica E 140 с размером отверстий 0,6мм Экструдат сфероидируют в лабораторной установке в течение 1,75мин Полученные таким образом ядра сушат на поддонах в течение приблизительно 5час при 40°С Высушенные ядра фракционируют в аппарате Retsch, снабженным нижним ситом 0,500мм и верхним ситом 0,800мм На ЮОг таких ядер наносят внутреннее покрытие, серединное покрытие и наружное покрытие в жидком слое в лабораторной установке с распылительной головкой 0,7мм и при давлении распыления 0,6 бар Состав для покрытия приводится втабл 21 Таблица 21 Ингредиенты Количество (кг) Внутреннее покрытие Гид роксипроп ил метил целлюлоза Стеарат магния Тальк Симетиконовая эмульсия EudragitNE30D Очищенная вода Всего Серединное покрытие 6,50 1,35 12,15 1,00 432,00 547,00 1000,00 58506 51 Продолжение таблицы 21 Ингредиенты Сульфат кальция Гидроксипропилметилцеллюлоза * Симетиконовая эмульсия Полисорбат 20 EudragitNE30D Очищенная вода Всего Наружное покрытие Гидроксипропилметилцеллюлоза Тальк Очищенная вода Всего Количество (кг) 79,00 10,00 0,50 0,75 105,50 304,25 500,00 10,00 10,00 230,00 250,00 В процессе нанесения покрытия внутреннее, серединное и наружное покрытие наносят в указанном далее количестве Внутреннее покрытие Серединное покрытие Наружное покрытие 66,70кг раствора/суспензия для формирования покрытия (сухая масса 10,0% от массы ядер) 16,50кг раствора/суспензии для формирования покрытия (сухая масса 4,0% от массы ядер) 12,50кг раствора/суспензии для формирования покрытия (сухая масса 1,0% от массы ядер) В процессе формирования покрытия температура на входе поддерживается приблизительно на уровне 40°С, при температуре на выходе приблизительно 30°С После нанесения покрытий ядра с покрытием отверждаются при температуре слоя приблизительно 70°С в течение ЗОмин, а затем ядра с покрытием охлаждаются при температуре слоя ниже 35°С После нанесения покрытия ядра с покрытием просеивают через сито 1,0мм частицы более крупного размера отбрасывают В пакетики загружают 45,Ог полученных таким образом ядер с покрытием и 35г смеси, состав которой указан в табл 22, причем каждый пакетик наполняют 230мг ядер с покрытием и 171мг смеси, приведенной в табл 22 Таблица 22 Цитрат натрия Бикарбонат натрия Диоксид титана Винная кислота Корригент с лимонным соком Лимонный корригент Аспартам Альгинат натрия LF 200S (мг) 41,00 77,80 51,10 45,00 4,10 4,10 4,10 122,80 Цитрат натрия, бикарбонат натрия и диксид титана перемалывают в лабораторной мельнице Fntzh, снабженной ситом 0,2мм Винную кислоту также измельчают в установке Fntzh 52 Смесь ядер с покрытием и порошка из пакетиков имеет показатели по растворению, приведенные в табл 23 (определенные по упомянутому выше методу определения растворения I) Таблица 23 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час 12час 16час 5,4% 17,5% 32,8% 47,1% 58,8% 68,3% 75,1% 80,7% 84,2% 91,1% 95,5% Пример 16 В примере 16 пакетики, модифицированные по высвобождению сульфата морфина, получают посредством изготовления ядер и последующего нанесения покрытия в количестве 11мас% (% от массы ядер) Пакетики получают так, как описано в примере 15, за исключением того, что на ядра наносят внутреннее, серединное и наружное покрытия в количестве, указанном ниже Внутреннее покрытие Серединное покрытие Наружное покрытие 40г раствора/суспензии для формирования покрытия (сухая масса 6,0% от массы ядер) 16,5г раствора/суспензии для формирования покрытия (сухая масса 4,0% от массы ядер) 12,5кг раствора/суспензии для формирования покрытия (сухая масса 1,0% от массы ядер) Смесь ядер с покрытием и порошка из пакетиков имеет показатели по растворению, приведенные в табл 24 (определенные по упомянутому выше методу определения растворения I) Таблица 24 0,5часа 1час 1,5часа Зчаса бчас 19,6% 47,2% 66,4% 91,5% 101,1% Пример 17 В примере 17 получают 4 партии, модифицированных по высвобождению сульфата морфина ядер с покрытием посредством изготовления ядер и последующего нанесения на них покрытия в количестве 7,0 мае %, 9,0 мае %, 11,0 мае % или 13,0 мае % (% от массы ядер) Ядра получают с помощью технических приемов экструзии/сфероизации Ингредиенты перечисляются в табл 25 Ингредиенты смешивают и смачивают в лабораторном смесителе Kenwood Major 53 Таблица 25 Ингредиенты Количество (кг) Сульфат морфина 75,00 Микрокристаллическая целлю85,00 лоза Лактоза 340,00 Очищенная вода 180,00 Смоченную массу экструдируют в экструдере Nica E 140 с размером отверстий 0,6мм Экструдат сфероидируют в лабораторной установке в течение 2мин Полученные таким образом ядра сушат в лабораторном масштабе в ожиженном слое при 40°С в течение приблизительно 8мин Высушенные ядра фракционируют в аппарате Retsch, снабженным нижним ситом 0,500мм и верхним ситом 0,800мм На ЮОг таких ядер наносят 'внутреннее и наружное покрытие в жидком слое в лабораторной установке с распылительной головкой 0,7мм и при давлении распыления 0,6 бар Состав для покрытия приводится втабл 26 Таблица 26 Ингредиенты Внутреннее покрытие Гид роксипроп ил метил целлюлоза Стеарат магния Тальк Симетиконовая эмульсия EudragitNE30D Очищенная вода Всего Наружное покрытие Гид роксипроп ил метил целлюлоза Тальк Очищенная вода Количество (кг) 1,30 0,27 2,43 0,20 86,40 109,40 200,00 4,00 4,00 92,00 Наносят внутреннее и наружное покрытия наносят в указанном далее количестве I Внутреннее крытие Наружное крытие „ 39,84кг раствора/суспензия по- для формирования покрытия (сухая масса 6, 0% от массы ядер) 12,50кг раствора/суспензии по- для формирования покрытия (сухая масса 1,0% от массы ядер) II Внутреннее крытие Наружное крытие III Внутреннее 53,12кг раствора/суспензия по- для формирования покрытия (сухая масса 8,0% от массы ядер) 12,50кг раствора/суспензии по- для формирования покрытия (сухая масса 1,0% от массы ядер) по 54 58506 66,40кг раствора/суспензия крытие Наружное крытие для формирования покрытия (сухая масса 10,0% от массы ядер) 12,50кг раствора/суспензии по- для формирования покрытия (сухая масса 1,0% от массы ядер) IV Внутреннее крытие Наружное крытие 79,70кг раствора/суспензия по- для формирования покрытия (сухая масса 12,0% от массы ядер) 12,50кг раствора/суспензии по- для формирования покрытия (сухая масса 1,0% от массы ядер) В процессе формирования покрытия температура воздуха на входе поддерживается приблизительно на уровне 40°С, а температура воздуха на выходе составляет приблизительно 33°С После нанесения покрытий ядра с покрытием отверждаются при температуре слоя приблизительно 70°С в течение ЗОмин, а затем ядра с покрытием охлаждаются при температуре слоя ниже 35°С После нанесения покрытия ядра с покрытием просеивают через сито 1,0мм частицы более крупного размера отбрасывают Полученные таким образом ядра с покрытием имеют показатели по растворению, приведенные в табл 27 (определенные по упомянутому выше методу определения растворения III) Таблица 27 1час 2часа Зчаса 4часа бчас 9час Ючас 11 час 12час 16час I (%) 15,4 29,4 43,1 55,9 75,1 88,7 90,9 92,3 93,8 96,2 II (%) 8,9 15,9 23,7 33,9 55,6 77,2 81,5 84,5 87,5 92,8 III (%) 7,4 11,9 15,6 21,6 41,7 67,7 73,6 77,8 81,9 90,0 IV (%) 2,7 4,8 7,1 10,8 26,9 56,2 63,4 69,2 74,0 85,3 Пример 18 В примере 18 модифицированные по высвобождению сульфата морфина ядра с покрытием получают посредством изготовления ядер и последующего нанесения на них покрытия в количестве 13,0мас % (% от массы ядер) Полученные таким образом ядра прессуют в таблетки Ядра получают с применением технических приемов экструзии/сфероизации Ингредиенты перечисляются в табл 28 Ингредиенты смешивают и смачивают в лабораторном смесителе Kenwood Major 55 58506 Таблица 28 Ингредиенты Сульфат морфина Микрокристаллическая лоза Лактоза Очищенная вода Количество (г) 37,50 целлю Наружное покрытие Таблица 30 42,50 170,00 90,00 Смоченную массу экструдируют в экструдере Mica E 140 с размером отверстий 0,6мм Экструдат сфероидируют в лабораторной установке в течение 2мин Полученные таким образом ядра сушат в лабораторном масштабе в сжиженном слое при 40°С в течение приблизительно Юмин Высушенные ядра фракционируют в аппарате Retsch, снабженным нижним ситом 0,500мм и верхним ситом 0,800мм На ЮОг таких ядер наносят покрытия, так как описано в примере 17, в указанном далее количестве внутреннего и наружного покрытия Внутреннее покрытие 56 высвобождению из соответствующих ядер с покрытием приводятся в табл 31 (при определении по описанному выше методу определения растворения IV) 79,70кг раствора/суспензия для формирования покрытия (сухая масса 12,0% от массы ядер) 12,50кг раствора/суспензии для формирования покрытия (сухая масса 1,0% от массы ядер) Эти ядра с покрытием смешивают в cubic смесителе с двумя партиями, приблизительно по 100 г, ядер с покрытием, полученных так, как описано в примере 17 (путем нанесения 12,0%+1% сухого вещества), причем получают общую партию ядер с покрытием приблизительно в 300 г Эти ядра с покрытием используют при сухой грануляции Состав гранулята приводится в табл 29 Таблица 29 Ингредиенты Количество (г) Морфин, ядра с покрытием 67,50 Крахмал 1500 6,03 Микрокристаллическая целлю12,06 лоза Таблеттоза 1,53 Силоид 1,08 Стеарат магния 0,18 Тальк 1,62 Смешивание осуществляют в cubic смесителе, что известно per se Сухую грануляцию повторяют, и получают в общем 180г гранулята Из этого гранулята получают таблетки с помощью машины для точного прессования Применяемая сила сжатия составляет или приблизительно 17кН (обозначена 1), или приблизительно 9 кН (обозначена 2), а масса таблетки составляет приблизительно 400мг Полученные таким образом таблетки имеют показатели по растворению, приведенные в табл 30 (определенные по описанному выше методу определения растворения IV) Данные по О) (%) 35,2 60,9 77,6 87,2 94,0 97,2 1час Зчаса бчас 9час 12час 15час 16час (2) (%) 32,1 57,1 75,4 87,3 94,4 100,4 Таблица 31 1час Зчасэ бчас 9час 12час 15час 8,9% 18,8% 38,7% 59,5% 74,3% 82,9 Пример 19 В примере 19 ядра с покрытием из примеров 1, 2 и 3 смешивают в шаровой мельнице в течение 5мин Пропорция следующая пример 1 29,5кг, пример 2 20,5кг, пример 3 12,1кг Это соотношение выбирают с таким расчетом, чтобы 80,0% получающегося в результате количества морфина в смеси состояло из морфина композиций примера 1 и примера 2, а 20,0% сульфата морфина в смеси поступило бы из морфина композиции примера 3 Количество композиций примера 1 и примера 2 выбирают так, чтобы получить растворение этой смеси возможно близкое к целевому в примере 1 Ко всей описанной выше смеси ядер в шаровой мельнице в течение 5мин подмешивают 0,466кг талька Полученная таким образом смесь ядер с покрытием имеет показатели по растворению, приведенные в табл 32 (определенные по упомянутому выше методу определения растворения III) Таблица 32 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час 29,7% 41,2% 52,2% 62,3% 71,2% 78,5% 84,8% 88,9% 92,2% 94,8% 98,1% 58 57 58506 Смесью ядер с покрытием с помощью устройства для наполнения капсул Zanasi AZ 40 наполТаблица 35 няют капсулы Характеристики капсул приводятся в табл 33 (растворение определяют по описанноРазмер капсулы 00 му выше методу определения растворения V) Количество ядер с покрытием (мг) 629,1 Доза сульфата морфина (мг) 100 Таблица 33 Растворение через 1час (%) 26,5 Растворение через Зчаса (%) 48,0 Размер капсулы 3 1 Растворение через бчас (%) 77,5 Количество ядер с покрытием Растворение через 9час (%) 93,5 125,8 377,5 (мг) Доза сульфата морфина (мг) 20 60 Пример 21 Растворение через 1час 30,3 29,6 В примере 21 ядра с покрытием из примеров Растворение через Зчаса 53,7 52,2 7, 8 и 9 смешивают в шаровой мельнице в течение Растворение через бчас 80,3 79,7 5мин Пропорция следующая Растворение через 9час 94,4 94,5 пример 7 32,2кг, пример 8 13,3кг, Пример 20 пример 9 25,0кг В примере 20 ядра с покрытием из примеров Эту пропорцию рассчитывают так, как описано 4, 5 и 6 смешивают в шаровой мельнице в течение выше, на основании того, что 80,0% сульфата 5мин Пропорция следующая морфина в смеси должно присутствовать в форме композиций примера 7 и примера 9, а 20,0% пример 4 31,2кг, сульфата морфина в смеси должно присутствопример 5 30,1кг, вать в форме композиции примера 8 пример 6 14,5кг Эту пропорцию рассчитывают так, как описано Количество композиций примера 7 и примера выше, на основании того, что 80,0% сульфата 8 выбирают так, чтобы получить растворение смеморфина в смеси должно присутствовать в форме си возможно близкое к целевому в примере 1 композиций примера 4 и примера 5, а 20,0% Ко всей описанной выше смеси ядер в шаросульфата морфина в смеси должно присутствовой мельнице в течение 5мин подмешивают вать в форме композиции примера 6 0,530кг талька Количество композиций примера 4 и примера Полученная таким образом смесь ядер с по5 выбирают так, чтобы получить растворение смекрытием имеет 'показатели по растворению, приси возможно близкое к целевому в примере 1 веденные в табл 36 (определенные по описанному выше методу определения растворения III) Ко всей описанной выше смеси ядер в шаровой мельнице в течение 5мин подмешивают 0,569кг талька Таблица 36 Полученная таким образом смесь ядер с покрытием имеет показатели по растворению, при1час 24,8% веденные в табл 34 (определенные по описанно2часа 36,2% му выше методу определения растворения III) Зчаса 47,2% 4часа 59,3% Таблица 34 5час 69,3% бчас 77,1% 1час 23,3% 7час 83,1% 2часа 33,4% 8час 86,9% Зчаса 44,3% 9час 89,7% 4часа 55,2% Ючас 91,8% 5час 65,3% 12час 94,4% бчас 73,2% 16час 96,6% 7час 80,2% 8час 85,1% Смесью ядер с покрытием с помощью устрой9час 88,8% ства для наполнения капсул Zanasi AZ 40 наполЮчас 91,3% няют капсулы Характеристики капсул приводятся 12час 94,9% в табл 37 (растворение определяют по описанному выше методу определения растворения V) 16час 98,0% Смесью ядер с покрытием с помощью устройства для наполнения капсул Zanasi AZ 40 наполняют капсулы Характеристики капсул приводятся в табл 35 (растворение определяют по описанному выше методу определения растворения V) Таблица 37 Размер капсулы 4 Количество ядер с покры62,9 тием (мг) Доза сульфата морфина 10 (мг) Растворение через 1 час 23,9 (%) 3 1 188,7 314,6 30 50 25,4 23,8 59 58506 Продолжение таблицы 37 Размер капсулы Растворение через Зчаса Растворение через бчас Растворение через 9час 4 3 1 44, 6 47 5 47 6 76 2 79 3 78,6 90 2 92 5 92 9 Пример 22 В примере 22 модифицированные по высвобождению сульфата морфина ядра получают, а затем наносят на них покрытие, так, как описано в примере 1 Количество ядер с покрытием и нанесенное внутреннее покрытие, а также данные по способу растворения для определения высвобождения сульфата морфина (при определении по упомянутому выше методу определения растворения III) приводятся ниже втабл 38 Таблица 38 Партия, № Количество ядер с покрытием (кг) Внутреннее нанесенное покрытие (% от массы ядер) Температура продукта при нанесении покрытия, (приблизит °С) Растворение через 1час (%) Растворение через 2часа (%) Растворение через Зчаса (%) Растворение через 4часа (%) Растворение через 5час (%) Растворение через бчас (%) Растворение через 9час (%) Растворение через Ючас (%) Растворение через 14час (%) Растворение через 16час (%) Партия, № Количество ядер с покрытием (кг) Внутреннее нанесенное покрытие (% от массы ядер) Температура продукта при нанесении покрытия, (приблизит, °С) Растворение через 1час (%) Растворение через 2часа (%) Растворение через Зчаса (%) Растворение через 4часа (%) Растворение через 5час (%) Растворение через бчас (%) Растворение через 7час (%) Растворение через 9час (%) Растворение через Ючас (%) Растворение через 15час (%) Растворение через 16час (%) Партия, № Количество ядер с покрытием (кг) 1 3 27,7 27,7 7,5 8,9 19,021,8 19,421,6 9,9 25,9 41,7 56,7 69,0 78,3 92,3 94,6 99,7 4 3,9 10,8 21,5 34,6 48,9 61,0 83,7 87,7 95,8 5 27,7 27,9 8,0 8,4 18,822,0 19,521,6 6,3 18,0 32,4 47,6 61,2 72,0 89,9 92,8 99,3 97,2 2 4,7 11,7 22,2 35,5 49,4 61,7 71,4 84,2 87,8 27,7 60 Внутреннее нанесенное покры3,0 тие (% от массы ядер) Температура продукта при на19,0несении покрытия, (приблизит 21,9 °С) Растворение через Юмин (%) 50,9 Растворение через 20мин (%) 78,9 Растворение через ЗОмин (%) 91,0 Растворение через 40мин (%) 96,2 Растворение через 50мин (%) 98,7 Растворение через бОмин (%) 100,1 Пример 23 В примере 23 в шаровой мельнице в течение 5мин смешивают ядра с покрытием из примера 22, партии №№1, 2 и 3 Пропорция следующая пример 22, партия №1 27,3кг, пример 22, партия №2 13,2кг, пример 22, партия №3 28,4кг Эту пропорцию рассчитывают так, как описано выше, на основании того, что 80,0% сульфата морфина в смеси должно присутствовать в форме композиций примера 22, партия №1, и примера 22, партия №3, а 20,0% сульфата морфина в смеси должно присутствовать в форме композиции примера 22, партия №2 Количество композиций примера 22, партия №1, и примера 22, партия №3, выбирают так, чтобы получить растворение этой смеси возможно близкое к целевому в примере 1 К этой смеси ядер в шаровой мельнице в течение 5мин подмешивают 0,520кг талька Полученная таким образом смесь ядер с покрытием имеет показатели по растворению, приведенные в табл 39 (определенные по описанному выше методу определения растворения III) Таблица 39 1час 2часа Зчаса 4часа 5час бчас 7час 8час 9час Ючас 12час Ючас 23,0% 32,2% 43,1% 54,6% 65,0% 73,6% 79,9% 84,6% 87,9% 90,3% 93,3% 96,0% Смесью ядер с покрытием с помощью устройства для наполнения капсул Zanasi AZ 40 наполняют капсулы Характеристики капсул приводятся в табл 40 (растворение определяют по описанному выше методу определения растворения V) Таблица 40 Размер капсулы Количество ядер с покрытием (мг) Доза сульфата морфина (мг) Растворение через 1час (%) Растворение через Зчаса (%) 00 629,1 100 25,1 45,6
ДивитисяДодаткова інформація
Назва патенту англійськоюOral pharmaceutical modified release multiple-units composition and process for its preparation
Назва патенту російськоюПероральная фармацевтическая композиция в виде многокомпонентной лекарственной формы с замедленным высвобождением и способ ее получения
МПК / Мітки
МПК: A61K 31/485, A61K 9/54, A61P 25/04
Мітки: дозованої, модифікованим, форми, пероральна, фармацевтична, вигляді, вивільненням, композиція, множинної, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/47-58506-peroralna-farmacevtichna-kompoziciya-u-viglyadi-mnozhinno-dozovano-formi-z-modifikovanim-vivilnennyam-i-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Пероральна фармацевтична композиція у вигляді множинної дозованої форми з модифікованим вивільненням і спосіб її одержання</a>
Попередній патент: 2-аміно-4-біциклоаміно-1,3,5-триазини, гербіцидний засіб або засіб для регулювання росту рослин та спосіб боротьби з шкідливими рослинами або регулювання росту рослин
Наступний патент: Спосіб діагностики стану серцево-судинної системи
Випадковий патент: Спосіб профілактики вторинних рубцево-спайкових процесів при аномаліях розвитку спинного мозку та його оболонок та spina biffida