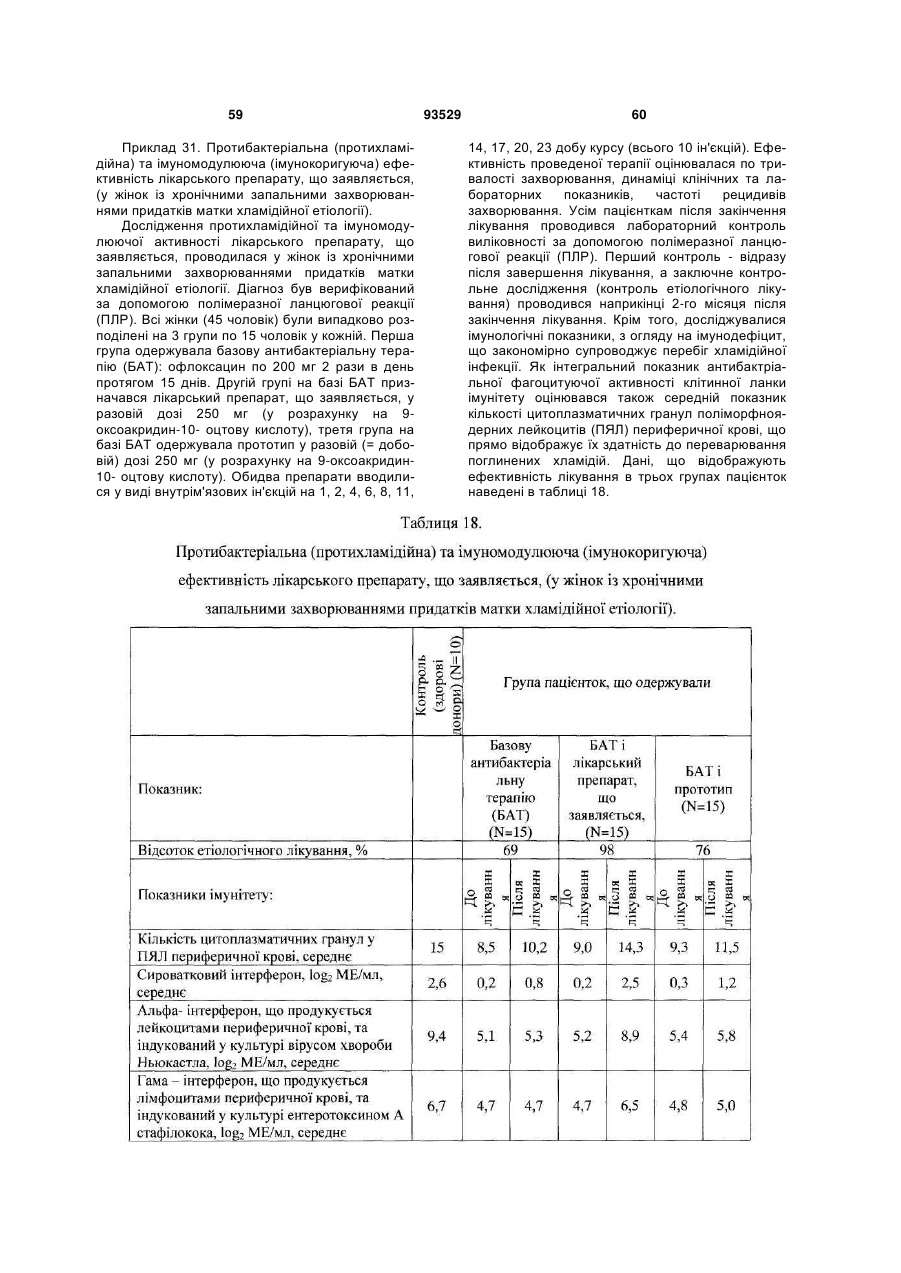
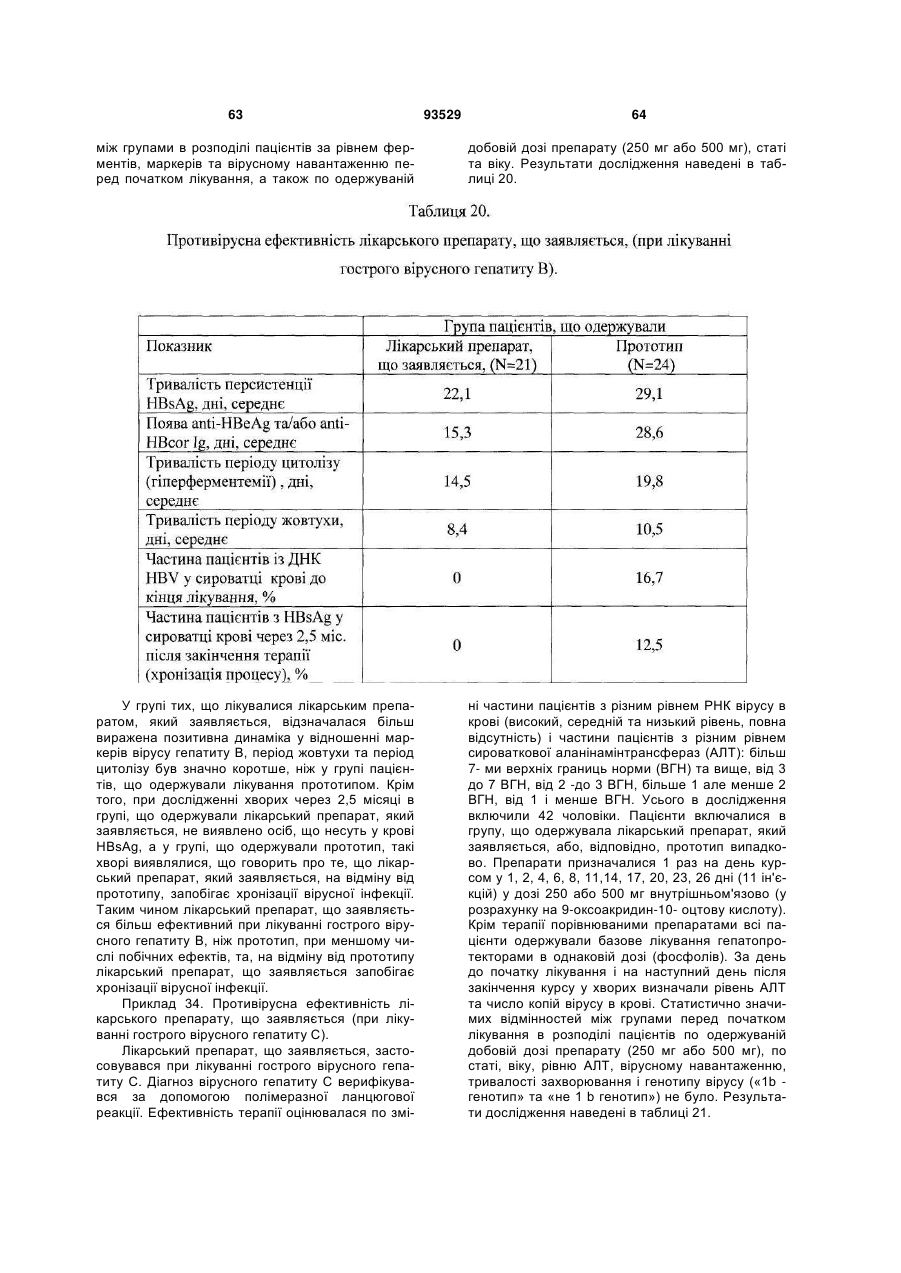
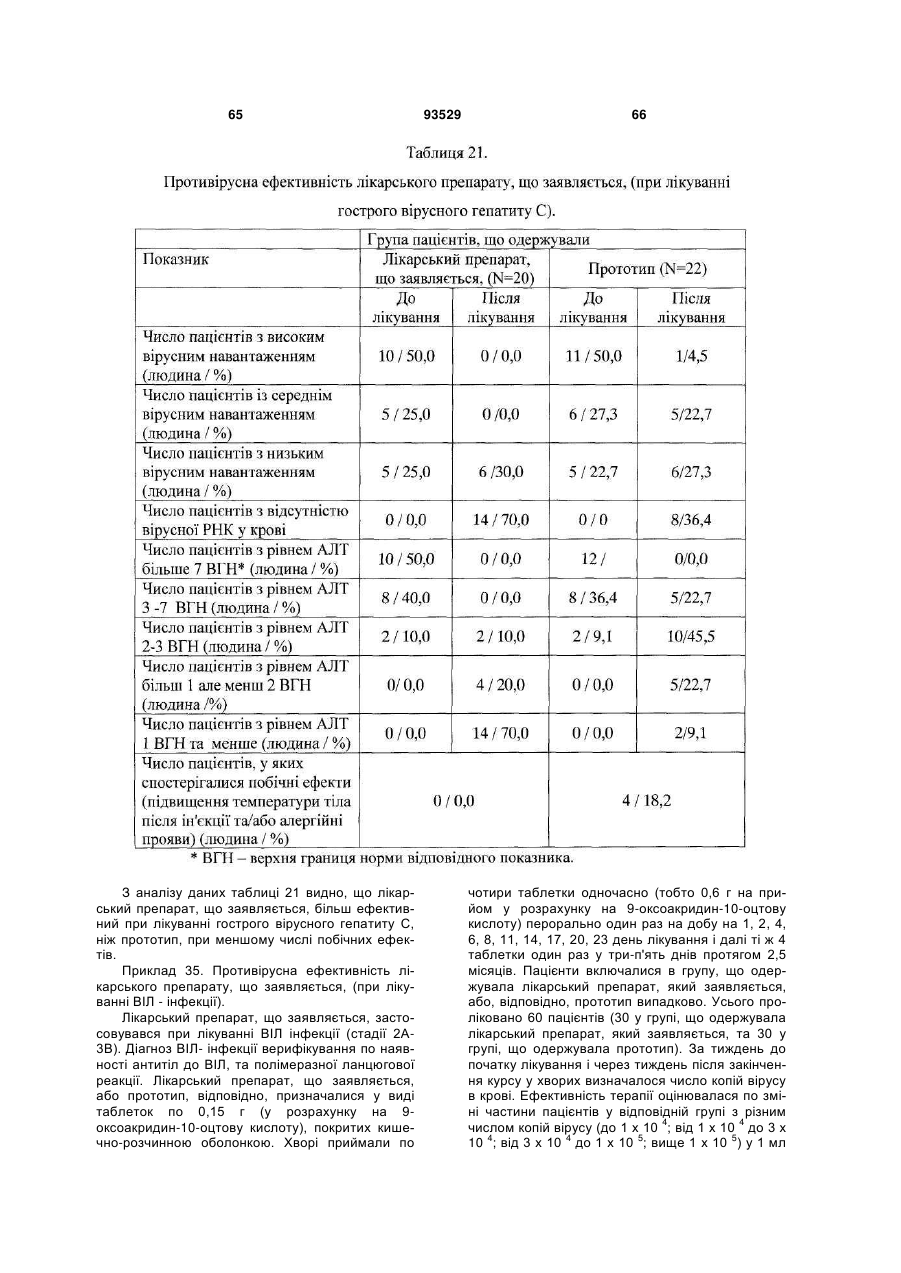
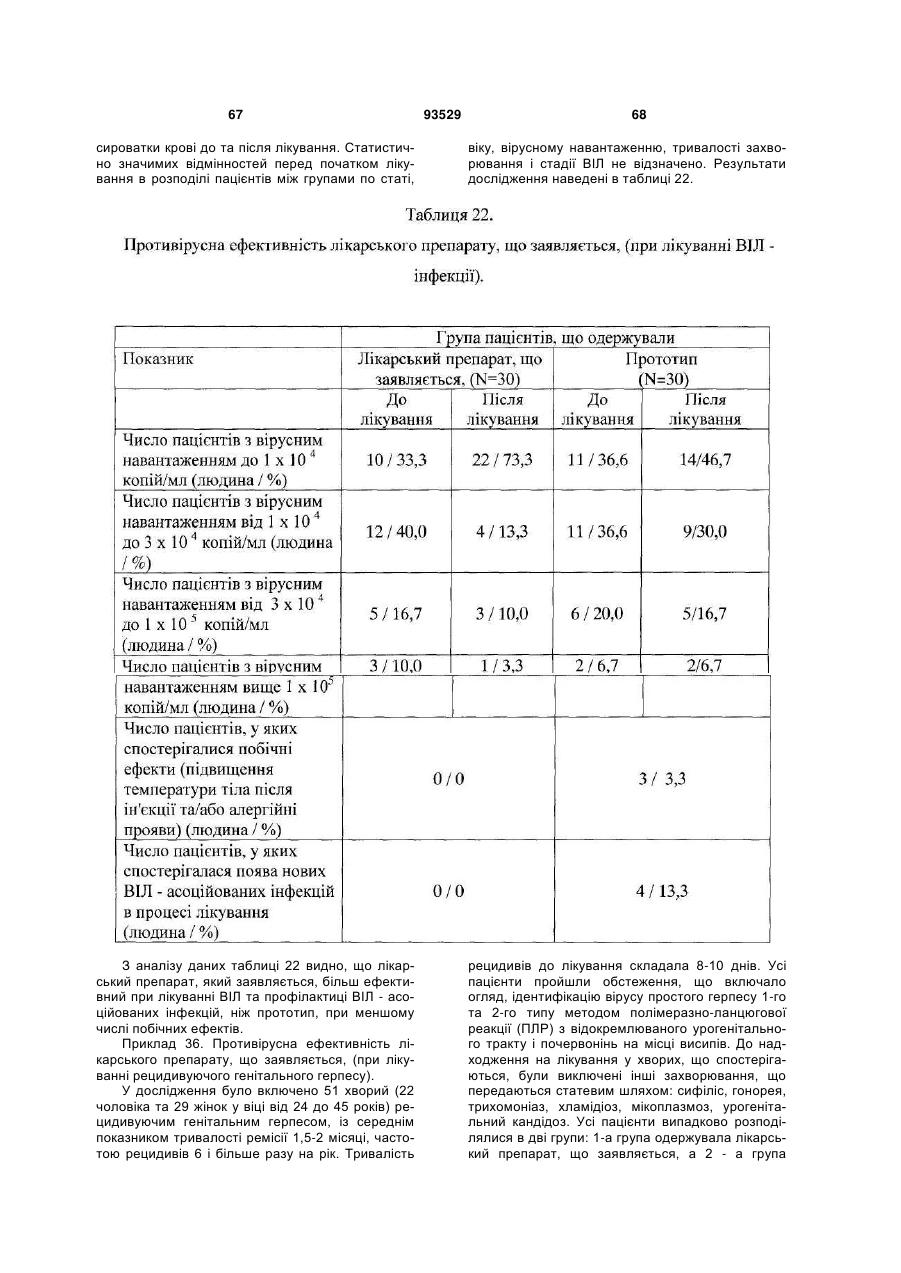
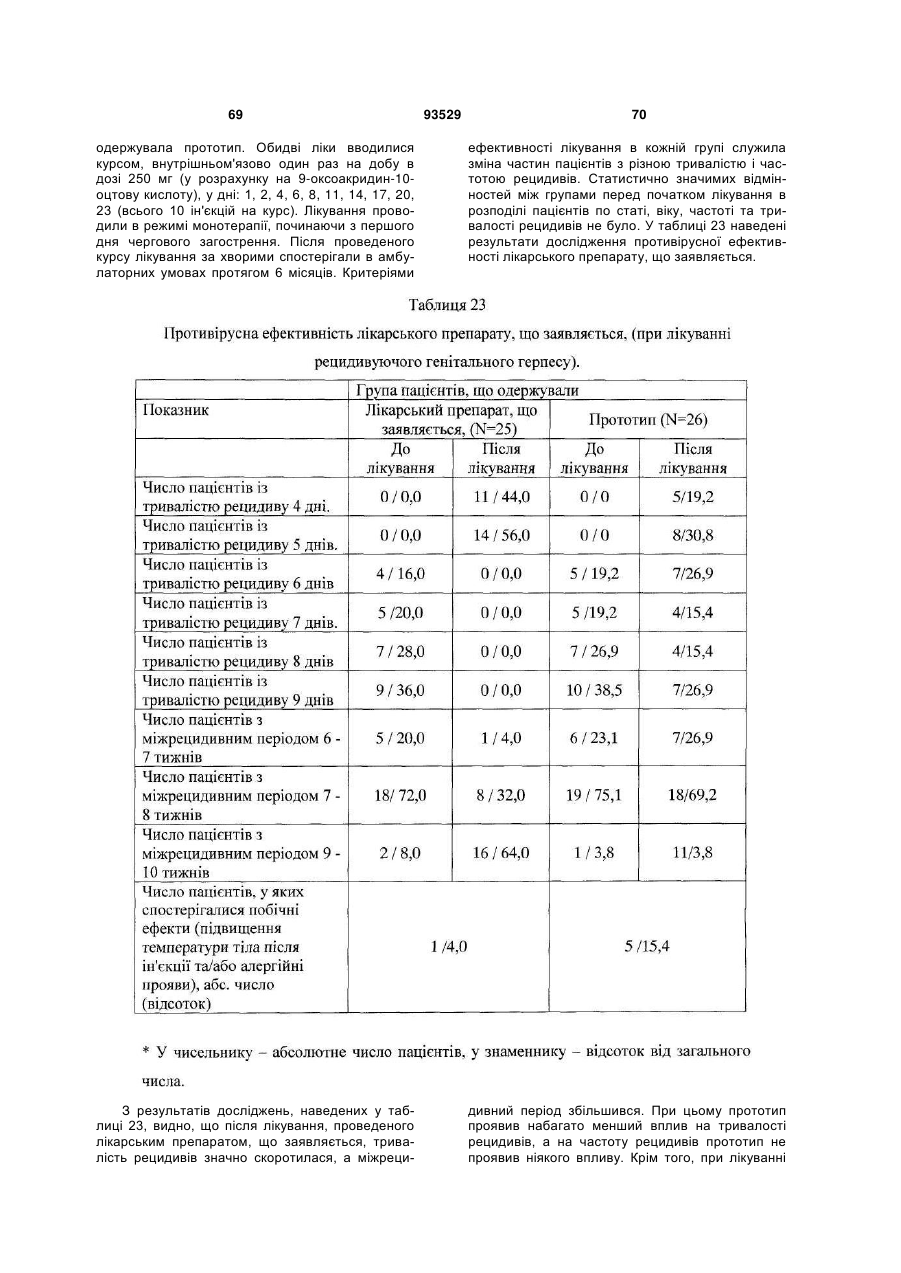
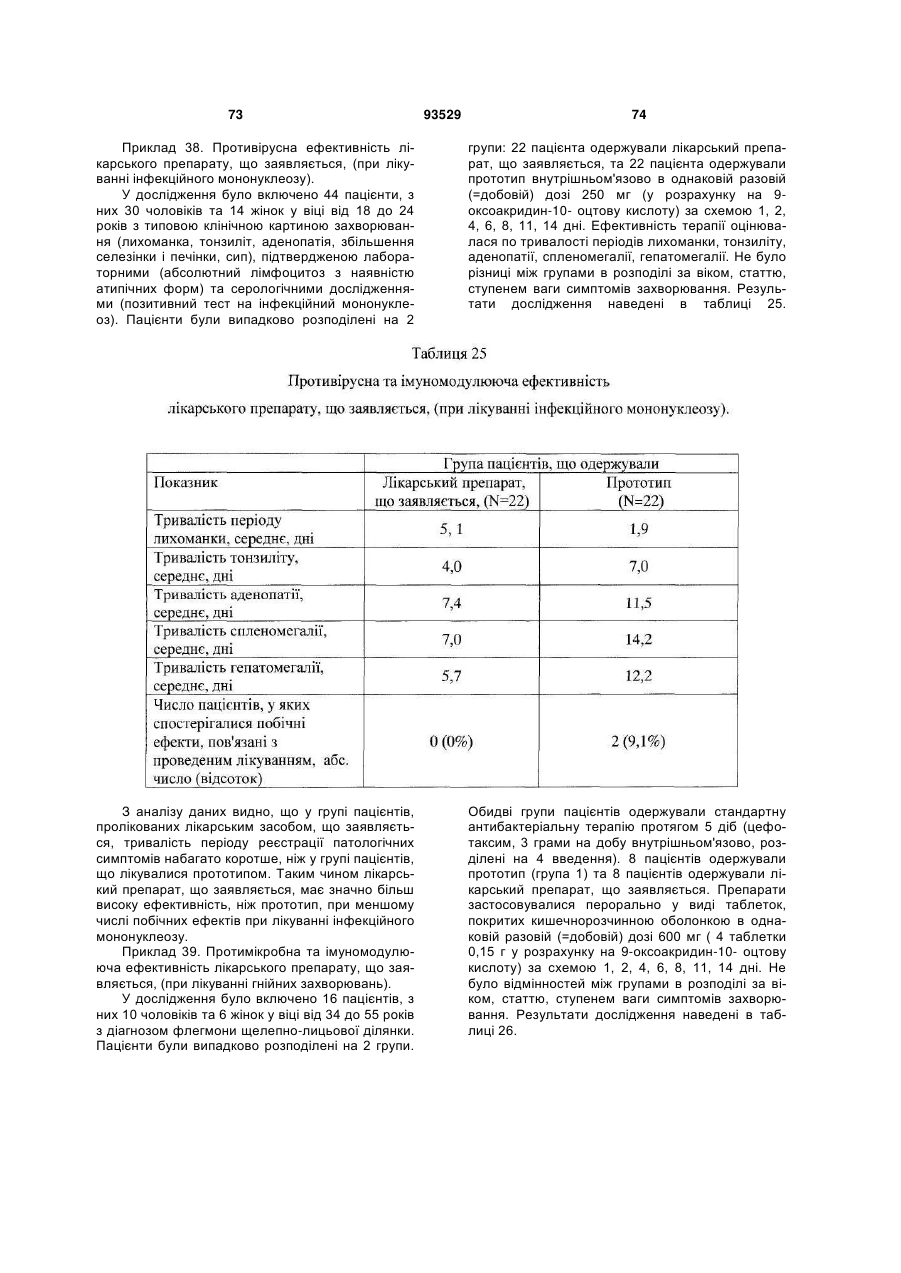
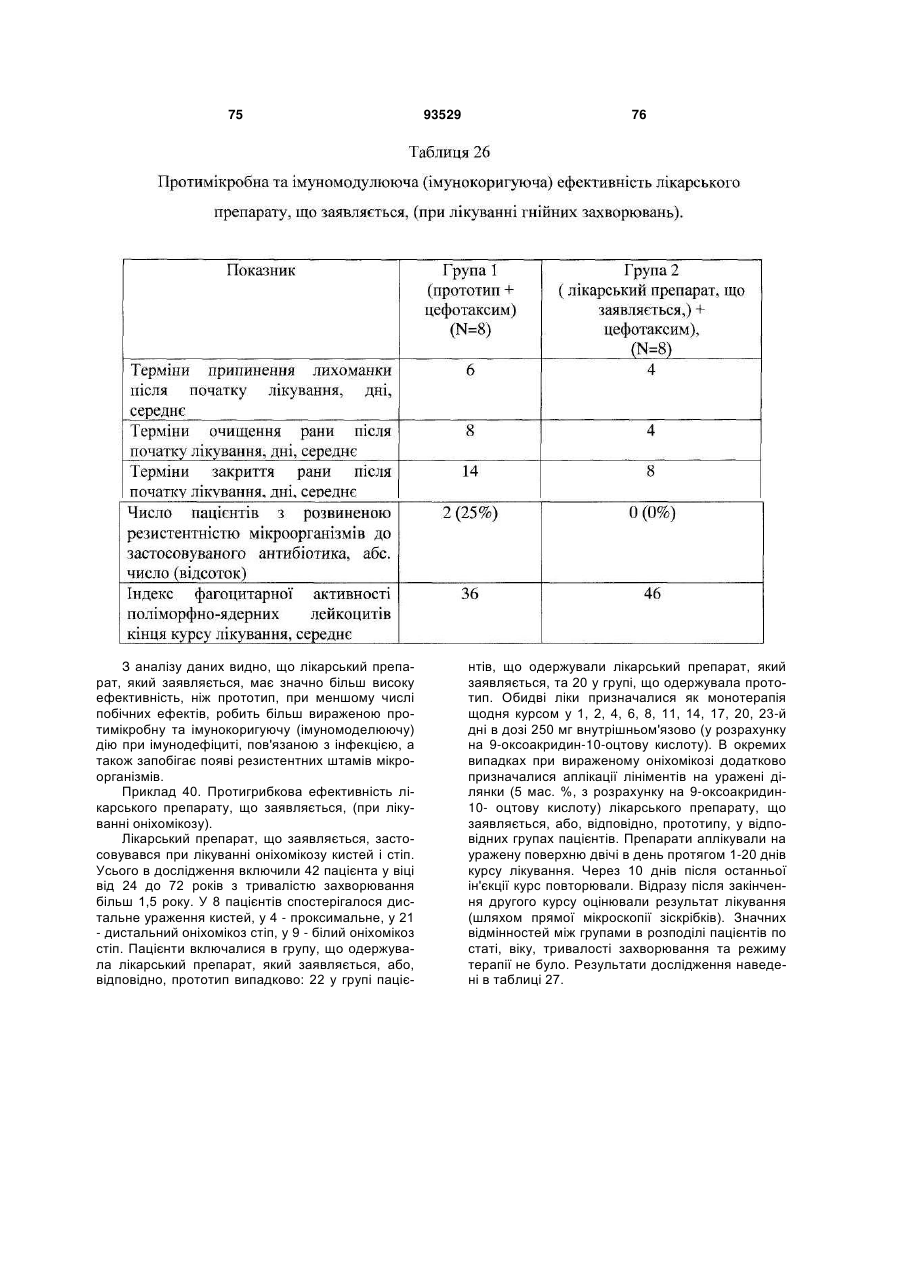
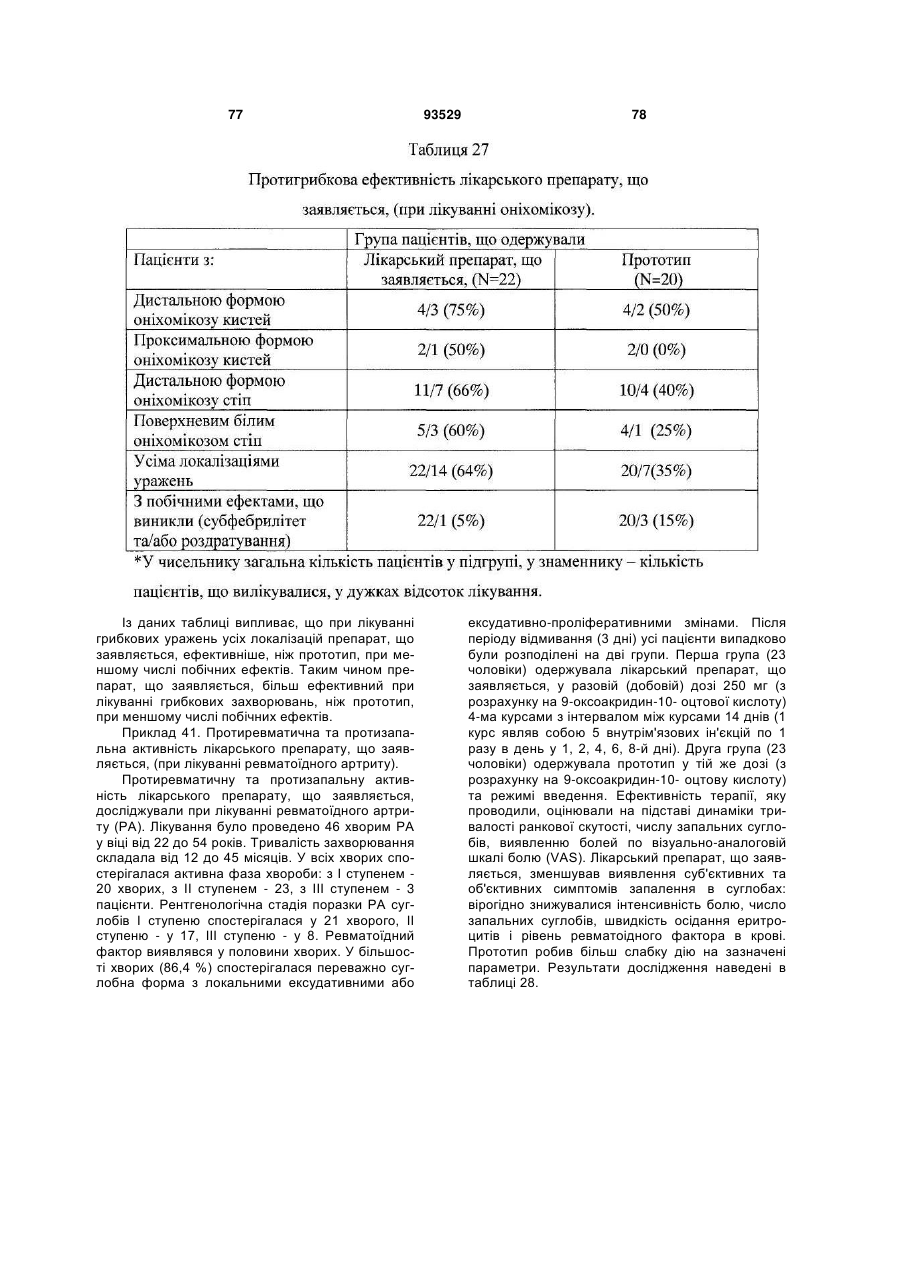
Солі і суміші 9-оксоакридин-10-оцтової кислоти з 1-алкіламіно-1-дезоксиполіолами
Формула / Реферат
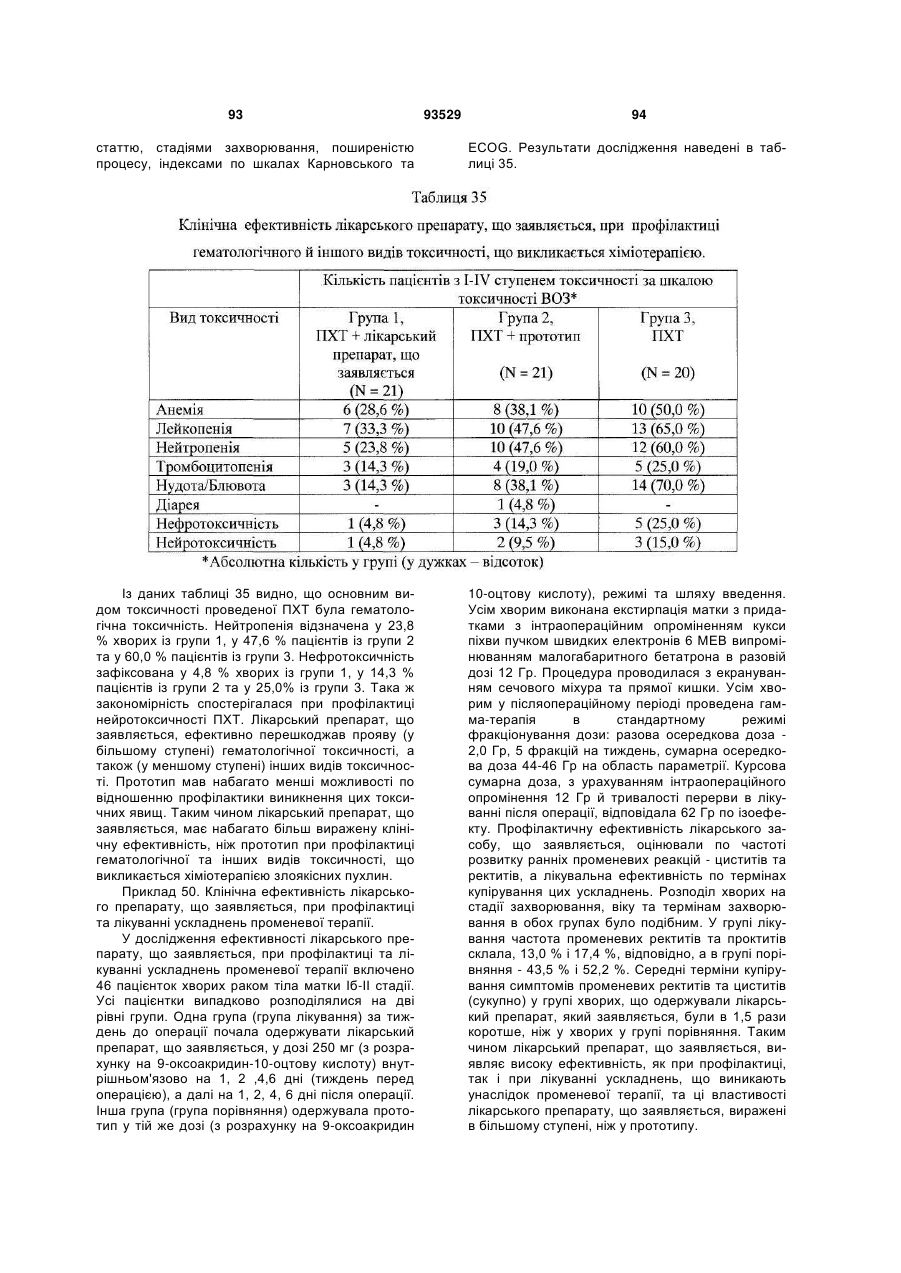
1. Солі 1-алкіламіно-1-дезоксиполіолів з 9-оксоакридин-10-оцтовою кислотою, що мають загальну формулу (І):
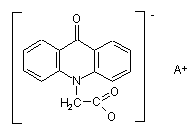 , (І)
, (І)
де А+ являє собою (II)
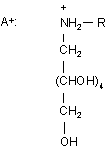 , (ІI)
, (ІI)
де R вибраний із групи, що складається з: етил; пропіл; бутил.
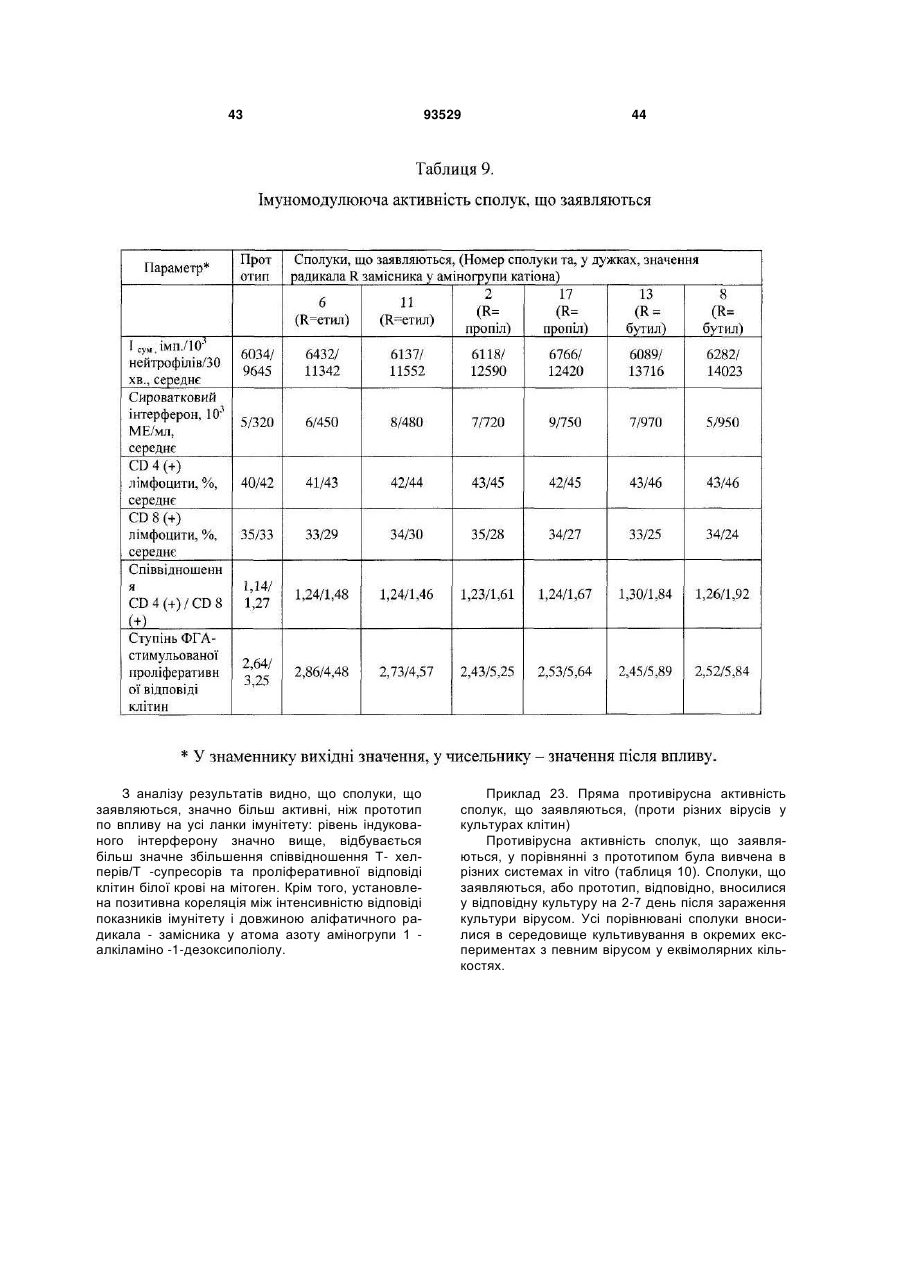
2. Солі за п. 1, що мають дію, вибрану із групи, що включає: імуномодулюючу, імунокоригуючу, протипаразитарну, протисклеротичну, противірусну, протибактеріальну, у тому числі протихламідійну, протигрибкову, протизапальну, протипухлинну, радіопротективну, стреспротективну дію.
3. Сіль за п. 1, вибрана з групи:
N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-глюцитол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-глюцитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-галактитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-галактитол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-галактитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-манітол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-манітол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-D-манітол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-глюцитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-глюцитол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-глюцитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-галактитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-галактитол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-галактитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-манітол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-манітол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат;
N-(1-дезокси-L-манітол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат.
4. Лікарський препарат, що містить діючу речовину та фармацевтично прийнятний носій або розчинник, який відрізняється тим, що як діючу речовину він містить в ефективній дозі одну або декілька солей формули (І) за п. 1 та/або суміш зазначеної солі формули (І) або 9-оксоакридин-10-оцтової кислоти формули:
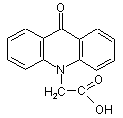 (ІII)
(ІII)
з одним або декількома 1-алкіламіно-1-дезоксиполіолами загальної формули (II)
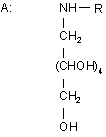 , (ІI)
, (ІI)
де
R вибраний із групи, що складається із: етил; пропіл; бутил.
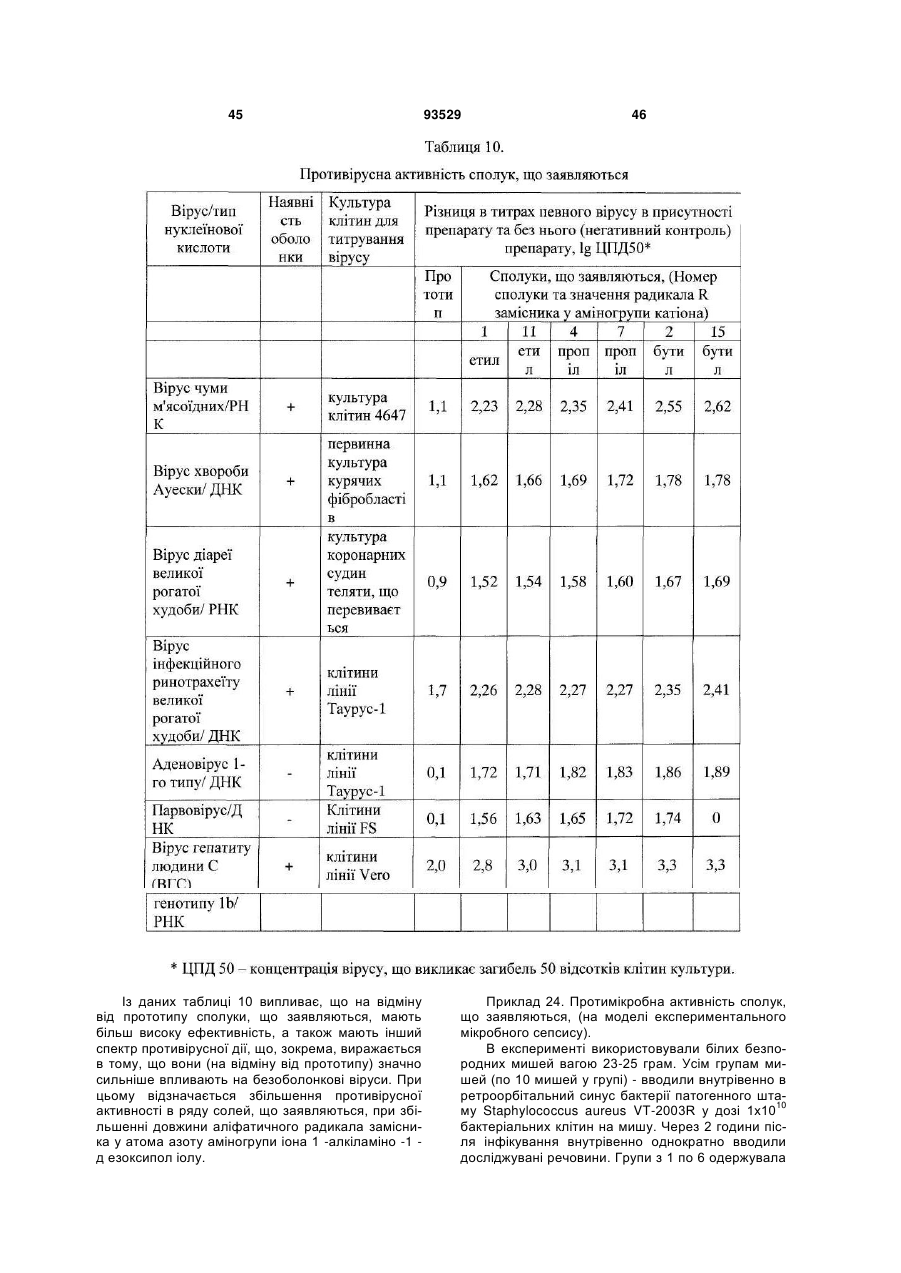
5. Лікарський препарат за п. 4, що має дію, вибрану з групи, що включає імуномодулюючу, імунокоригуюючу, протипаразитарну, протисклеротичну, противірусну, протибактеріальну, у тому числі протихламідійну, протигрибкову, протизапальну, протипухлинну, радіопротективну, стреспротективну дію.
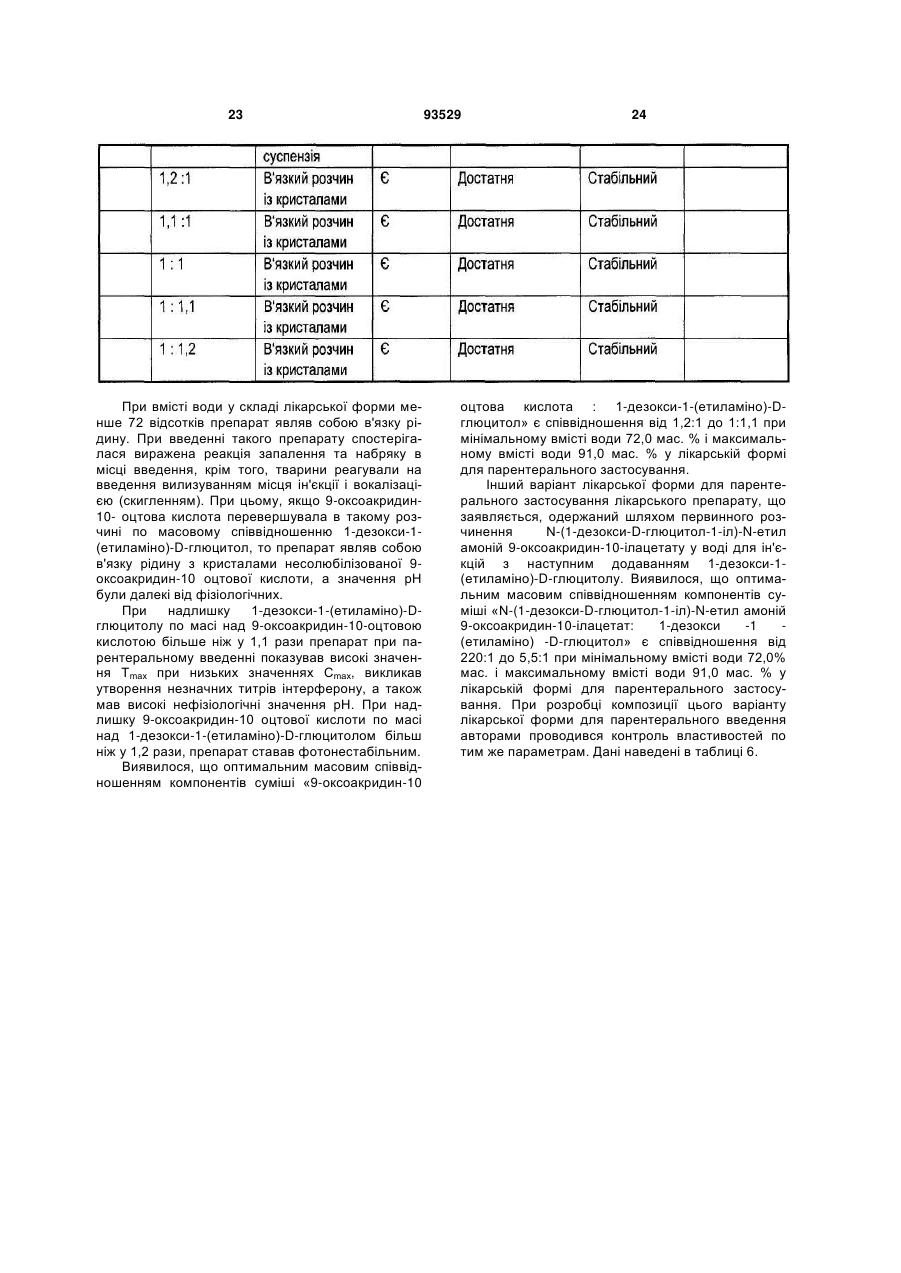
6. Лікарський препарат за п. 4, який відрізняється тим, що він одержаний шляхом змішування 9-оксоакридин-10-оцтової кислоти формули (III) з одним або декількома 1-алкіламіно-1-дезоксиполіолами загальної формули (II), при цьому співвідношення в суміші 9-оксоакридин-10-оцтової кислоти до 1-алкіламіно 1-дезоксиполіолу складає від 1,2:1 до 1:1,1.
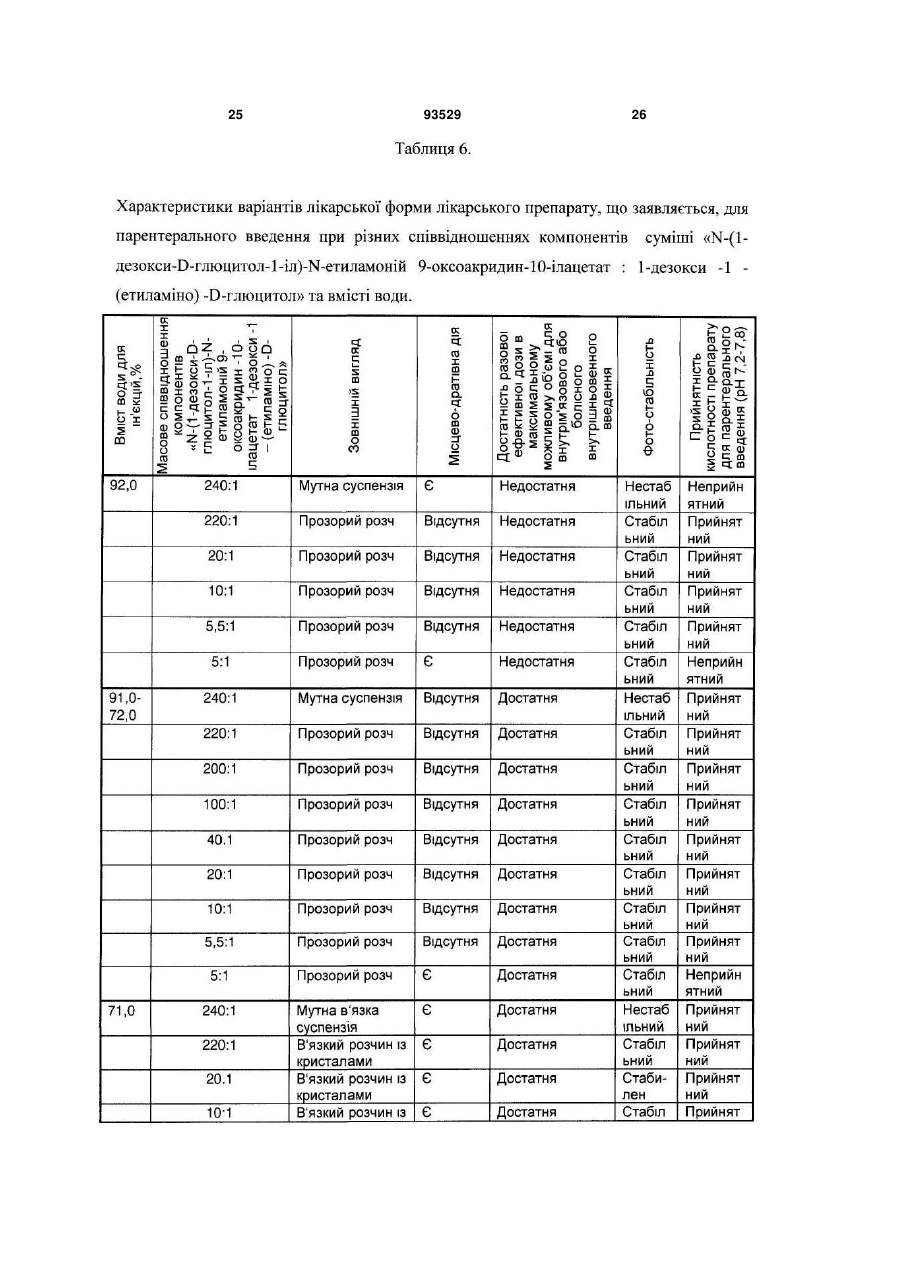
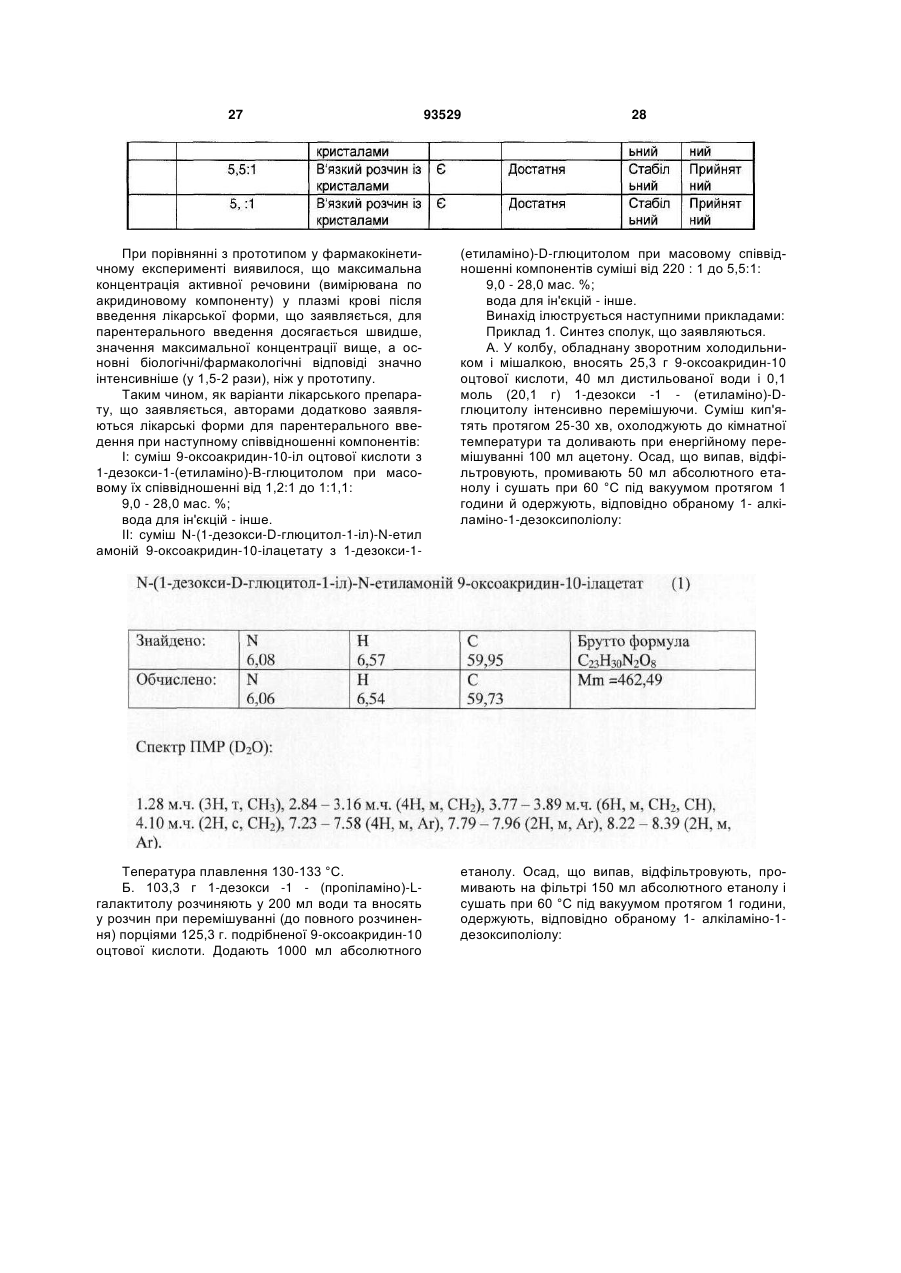
7. Лікарський препарат за п. 4, який відрізняється тим, що він одержаний шляхом змішування солі формули (І) з одним або декількома 1-алкіламіно-1-дезоксиполіолами загальної формули (II), при цьому співвідношення у суміші солі формули (І) до 1-алкіламіно-1-дезоксиполіолу складає від 220:1 до 5,5:1.
8. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для парентерального застосування.
9. Лікарський препарат за п. 8, який відрізняється тим, що він містить сіль формули (І) або суміш 9-оксоакридин-10-оцтової кислоти формули (III) або солі формули (І) з одним або декількома 1-алкіламіно-1-дезоксиполіолами загальної формули (II), у кількості 9,0-28,0 мас. %; вода для ін'єкцій - решта.
10. Лікарський препарат за п. 8, який відрізняється тим, що він містить суміш 9-оксоакридин-10-оцтової кислоти з 1-дезоксі-1-(етиламіно)-D-глюцитолом при масовому співвідношенні від 1,2:1 до 1:1,1, у кількості 9,0-28,0 мас. %; вода для ін'єкцій - решта.
11. Лікарський препарат за п. 8, який відрізняється тим, що містить суміш N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетату з 1-дезокси-1-(етиламіно)-D-глюцитолом при масовому співвідношенні, відповідно, від 220:1 до 5,5:1, у кількості 9,0-28,0 мас. %; вода для ін'єкцій - решта.
12. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для перорального застосування.
13. Лікарський препарат за будь-яким з пп. 4-7, який відрізняється тим, що він являє собою одиничну дозовану форму, що забезпечує введення зазначеного лікарського препарату в дозі 0,5 до 20 мг/кг маси тіла, більш переважно від 3 до 10 мг/кг маси тіла, з розрахунку на 9-оксоакридин-10-оцтову кислоту або її залишок.
14. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для місцевого застосування.
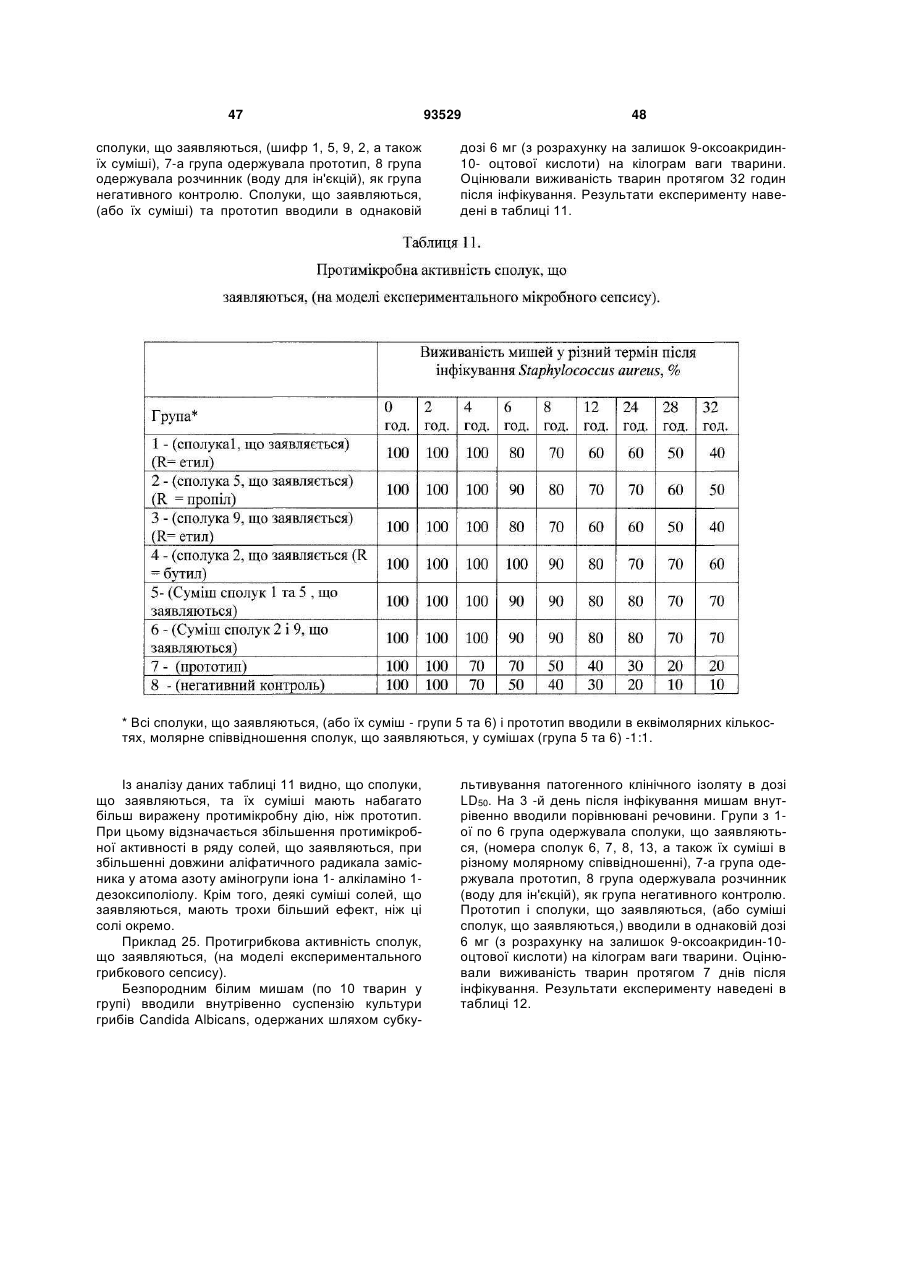
15. Застосування солі формули (І) за п. 1 та/або суміші 9-оксоакридин-10-оцтової кислоти формули (III) або солі формули (І) з одним або декількома 1-алкіламіно-1-дезоксиполіолами загальної формули (II), як визначено в п. 4, або їх фармацевтично прийнятних похідних або попередників для лікування і профілактики захворювань та/або патологічних станів людини.
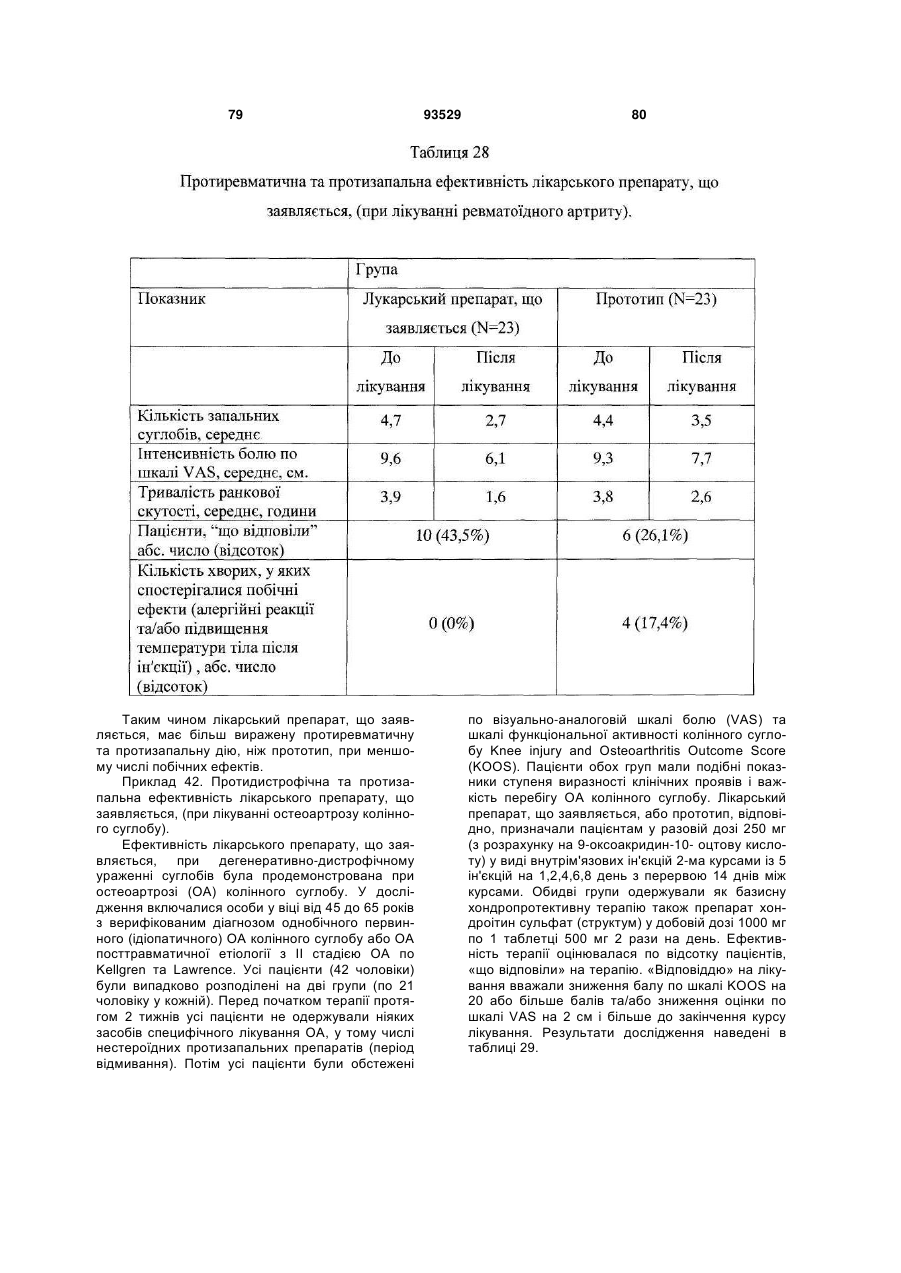
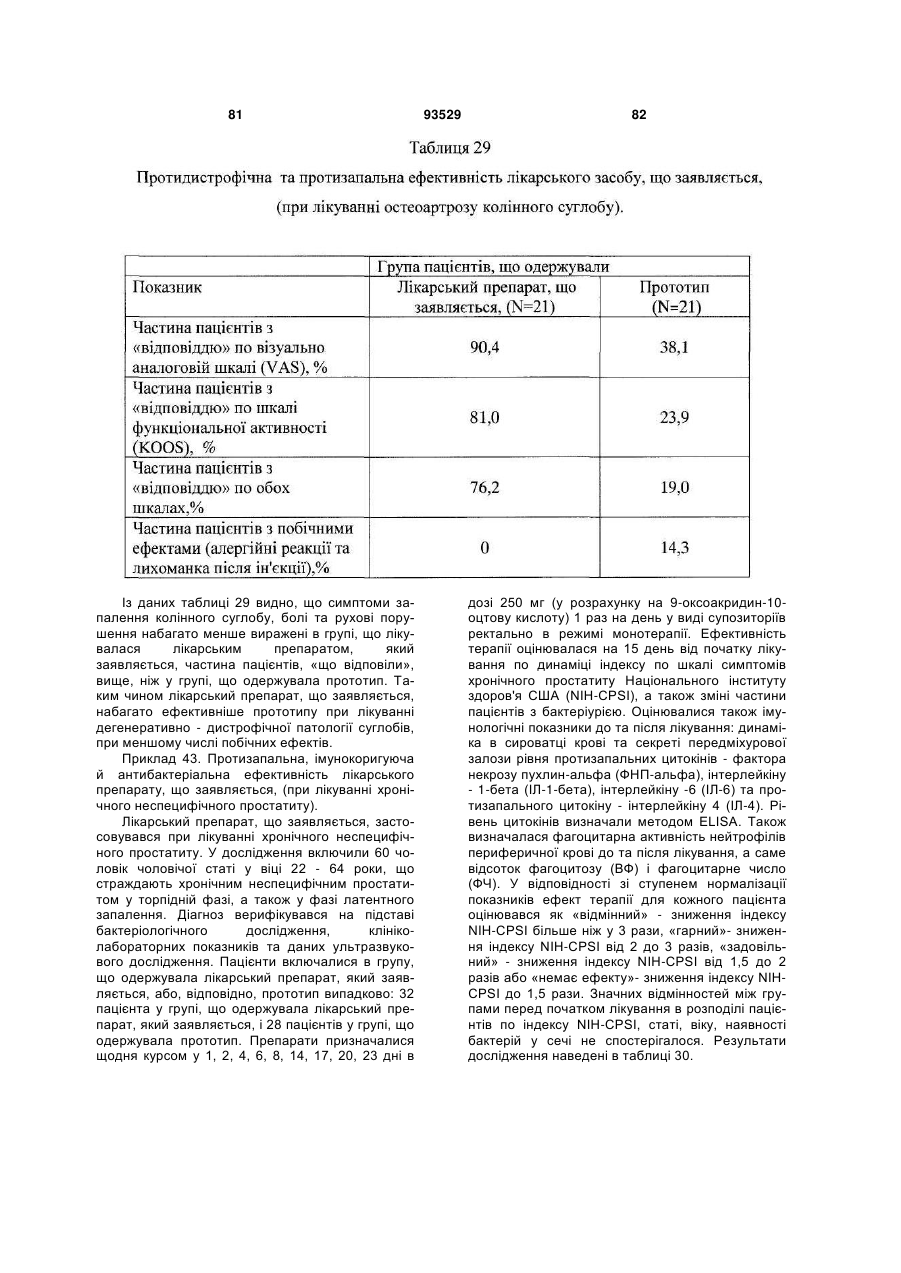
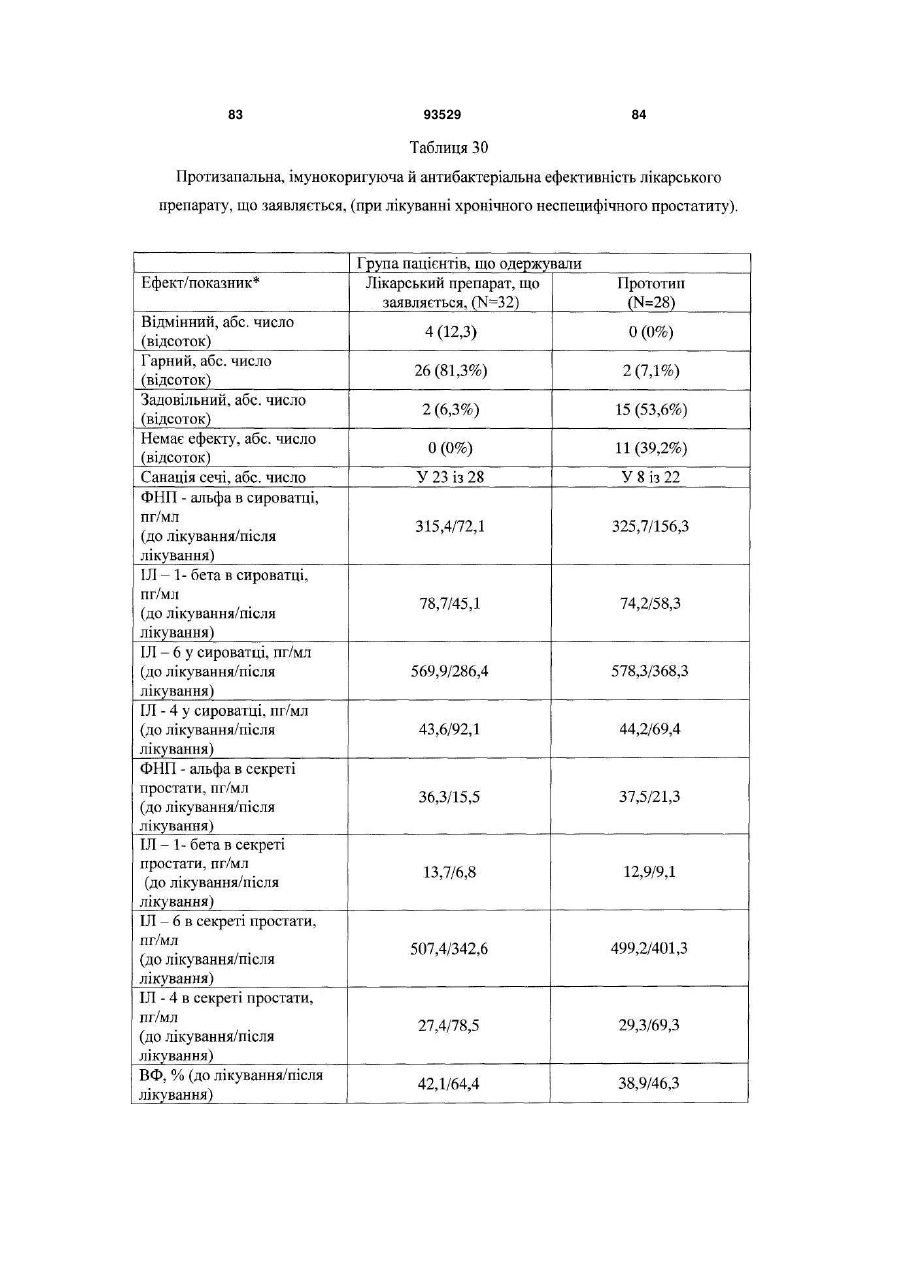
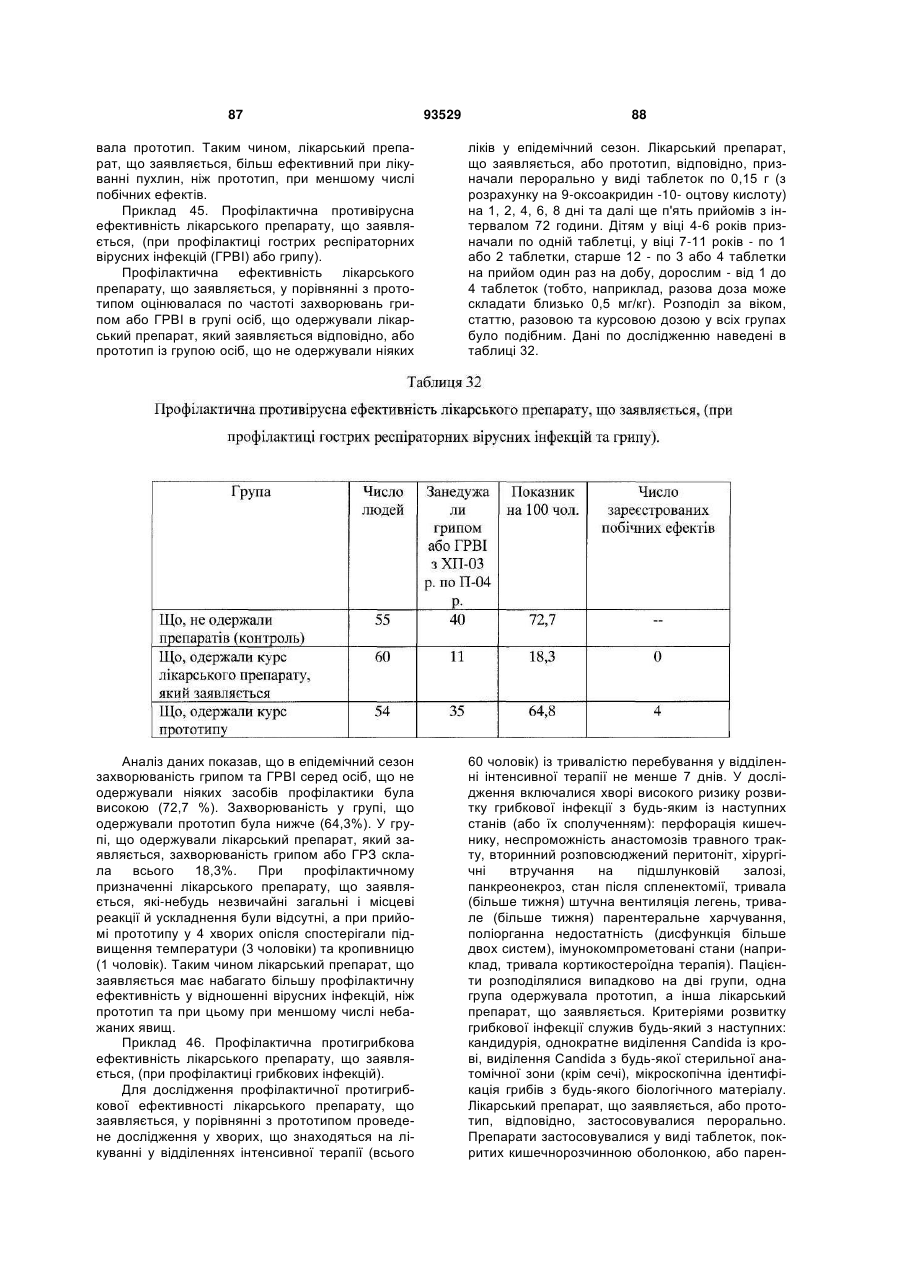
16. Застосування за п. 15, для запобігання або лікування захворювань та/або патологічних станів, які супроводжуються або пов'язані зі зміною імунного статусу, наприклад, вибраних з наступних, але не обмежуваних ними: ВІЛ-інфекції, нейроінфекції, у тому числі серозних менінгітів та енцефалітів; вірусних гепатитів А або В та/або С, та/або D; герпесу та/або цитомегаловірусної інфекції; інфекційного мононуклеозу; імунодефіцитів, у тому числі вторинних імунодефіцитів, пов'язаних із травмами, вірусними та/або бактеріальними, та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарних інвазій; бактеріальної (у тому числі хламідійної) інфекції; ревматичних та системних захворювань сполучної тканини, у тому числі ревматоїдного артриту; дегенеративно-дистрофічних захворювань суглобів, у тому числі вторинного і первинного остеоартрозу; онкологічних захворювань; патологічних станів, що викликаються цитостатичною терапією та/або опроміненням.
17. Спосіб профілактики або лікування захворювань та/або патологічних станів, пов'язаних зі змінами імунного статусу, що включає використання сполуки за будь-яким з пп. 1-3 та/або лікарського препарату за будь-яким з пп. 4-14.
18. Спосіб профілактики або лікування за п. 17, який відрізняється тим, що стани вибрані з групи, що включає, але не обмежується ними, ревматичні та системні захворювання сполучної тканини, у тому числі ревматоїдний артрит, дегенеративно-дистрофічні захворювання суглобів, у тому числі вторинний і первинний остеоартроз; вірусні захворювання, у тому числі, але не обмежуючись ними, нейроінфекції, у тому числі серозні менінгіти й енцефаліти; ВІЛ-інфекція, вірусний гепатит А або В та/або С, та/або D; герпес та/або цитомегаловірусна інфекція; інфекційний мононуклеоз; імунодефіцити, у тому числі вторинні імунодефіцити, пов'язані з травмами, вірусними та/або бактеріальними, та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарні інвазії; грибкові захворювання, у тому числі, але не обмежуючись ними, оніхомікоз та кандидоз; бактеріальну (у тому числі хламідійну) інфекцію; простатит; ревматичні і системні захворювання сполучної тканини, у тому числі ревматоїдний артрит; дегенеративно-дистрофічні захворювання суглобів, у тому числі вторинний та первинний остеоартроз; онкологічні захворювання, патологічні стани, що викликаються цитостатичною терапією та/або опроміненням.
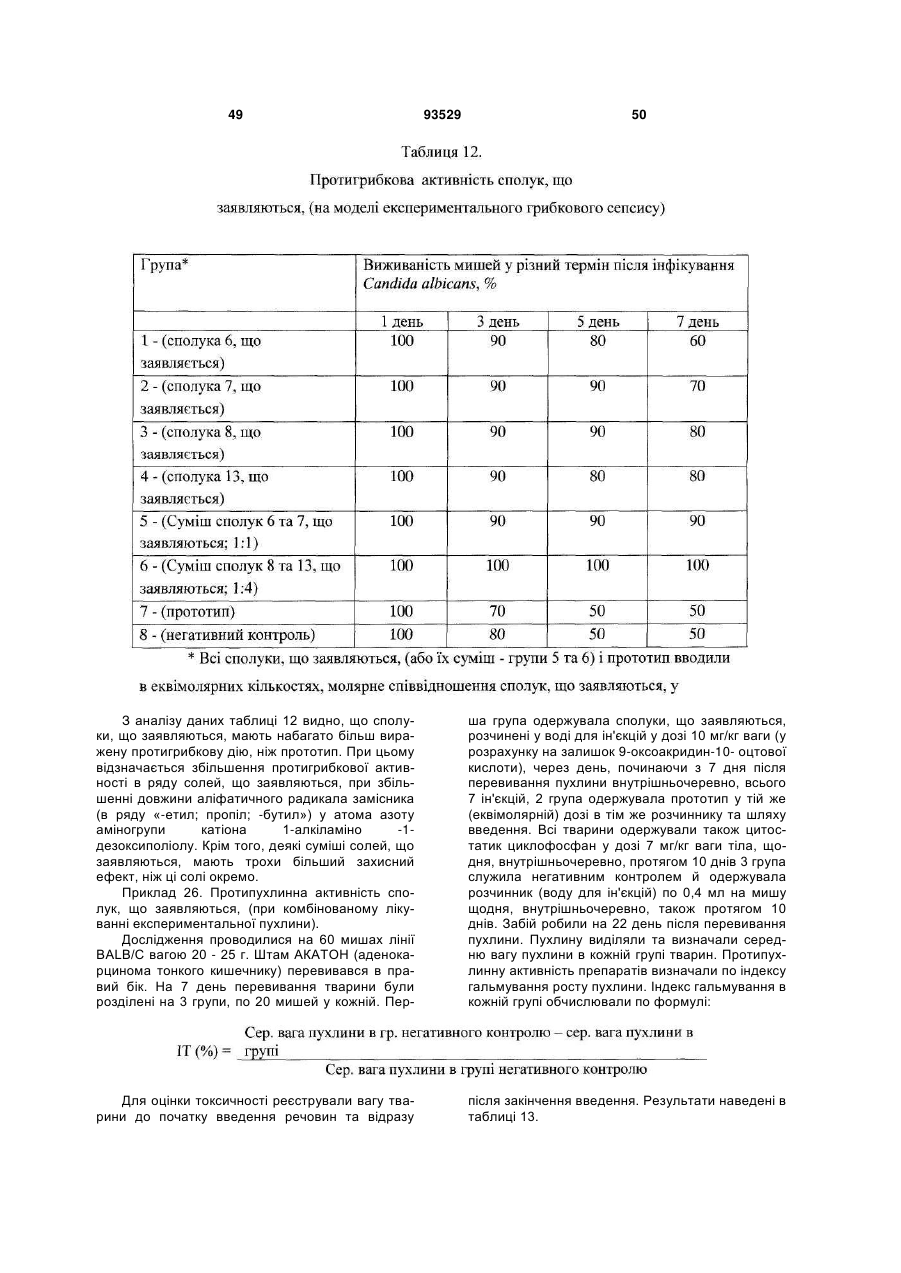
19. Спосіб за будь-яким з пп. 17 або 18, у якому зазначену сполуку за будь-яким з пп. 1-3 та/або лікарський препарат за будь-яким з пп. 4-14 застосовують для профілактики або лікування захворювань та/або патологічних станів людини.
20. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять раз на добу.
21. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 20, який відрізняється тим, що лікарський препарат вводять у дозі від 3 до 10 мг/кг ваги тіла, з розрахунку на 9-оксоакридин-10-оцтову кислоту або її залишок.
22. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять курсом.
23. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять парентерально від 5 до 12 разів курсом за схемою на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29 день курсу.
24. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 22, який відрізняється тим, що курс повторюють.
25. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 24, який відрізняється тим, що курс повторюють з інтервалом 10-14 днів.
26. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 24, який відрізняється тим, що курс повторюють не менше 2 разів.
27. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат застосовують як у режимі монотерапії, так і в складі комплексної та/або комбінованої терапії.
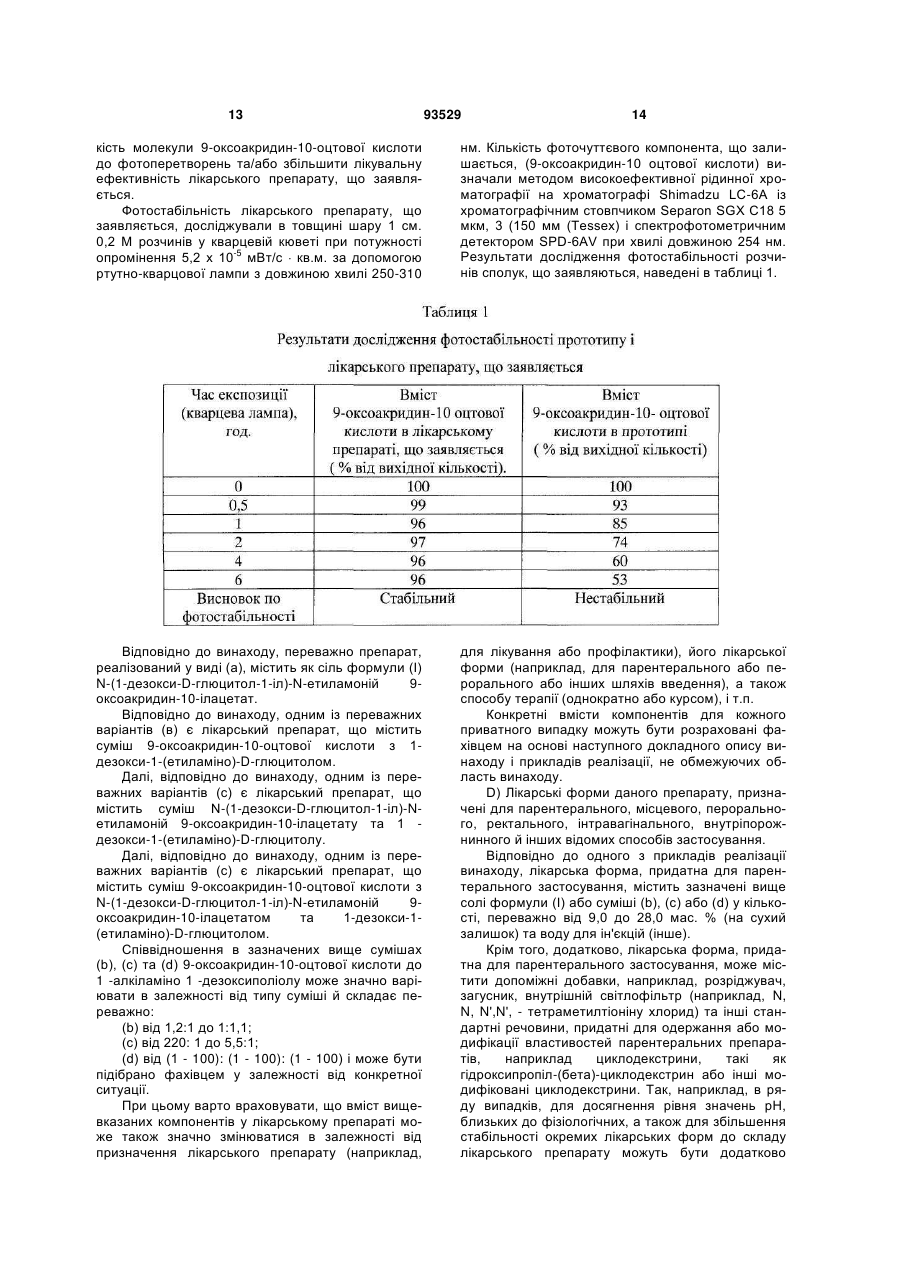
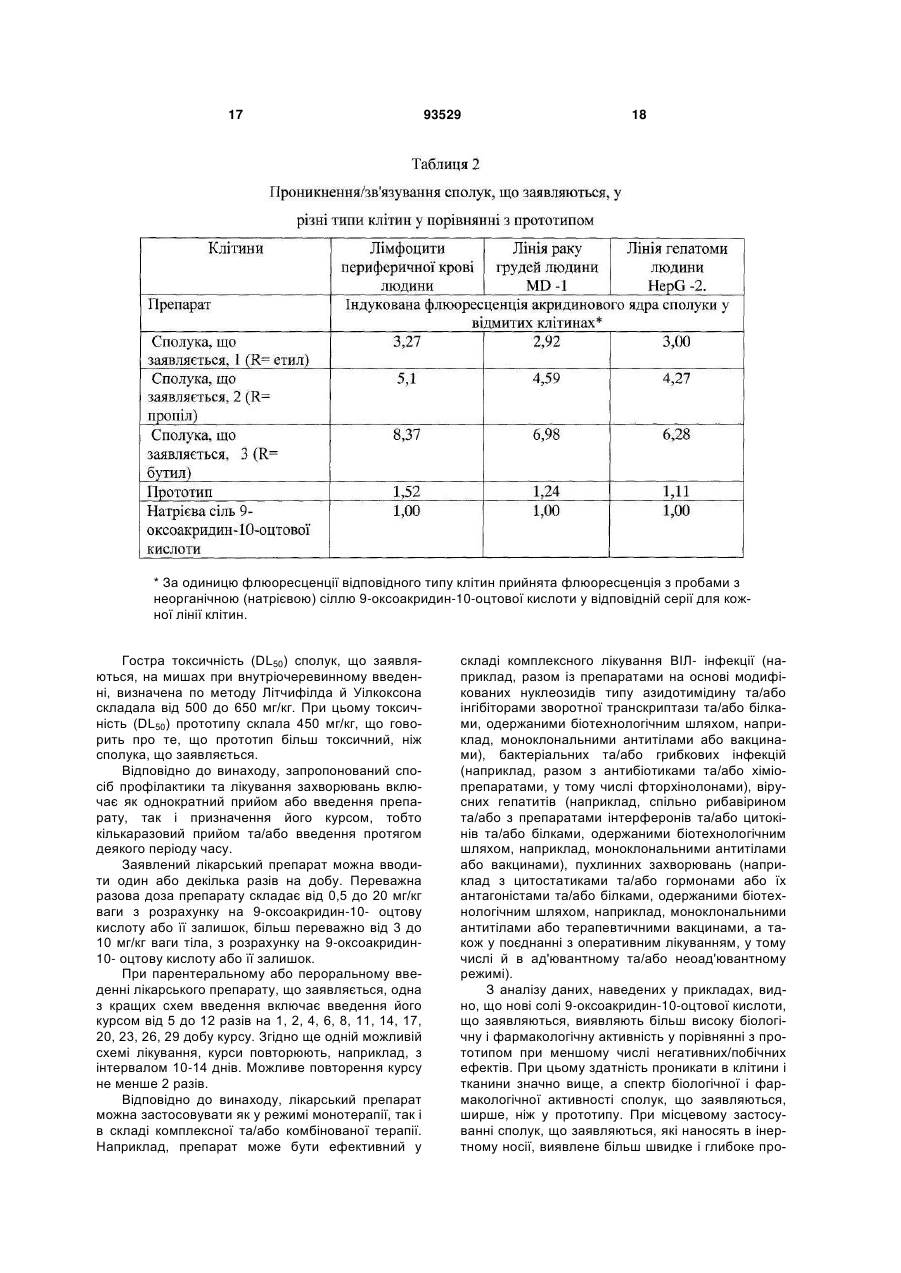
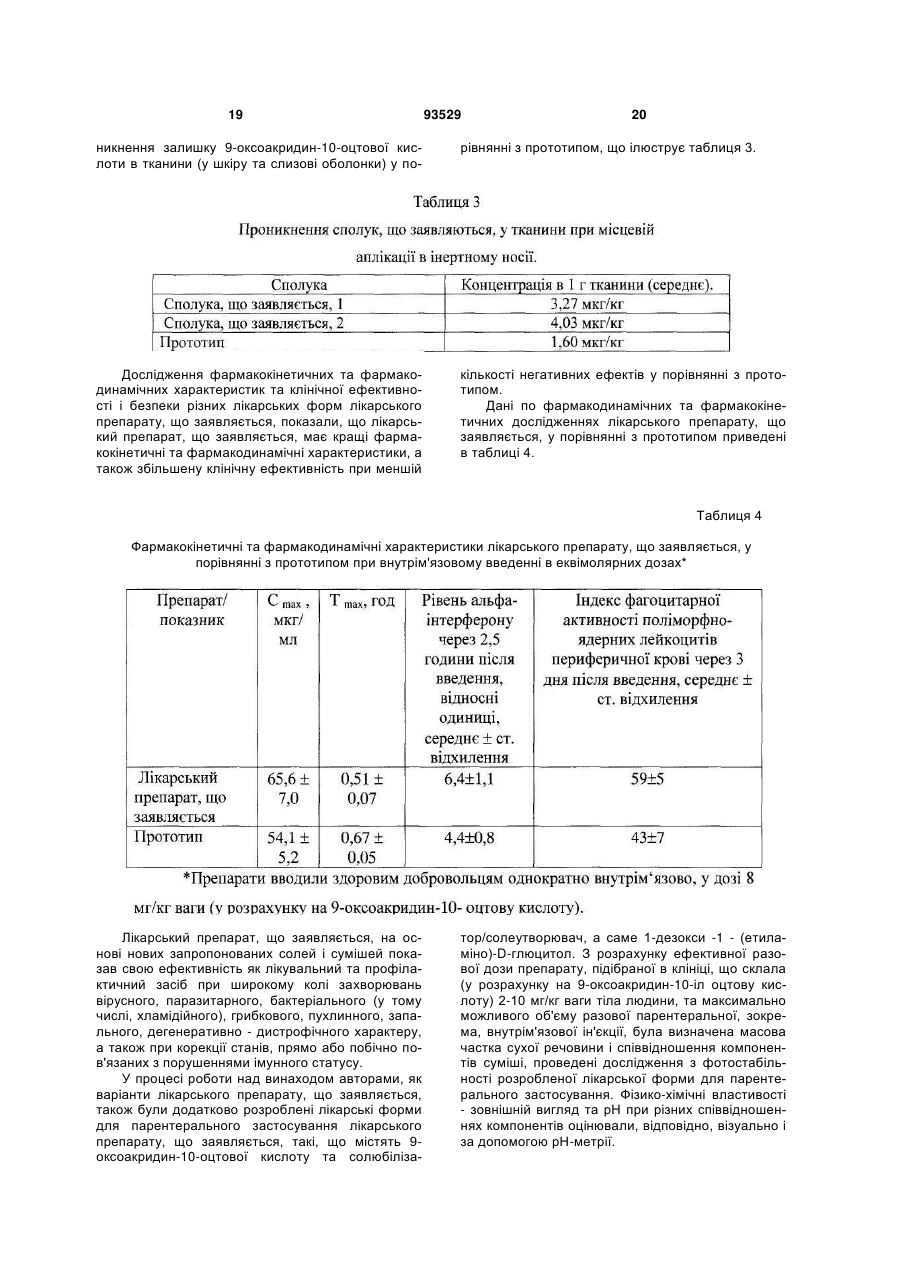
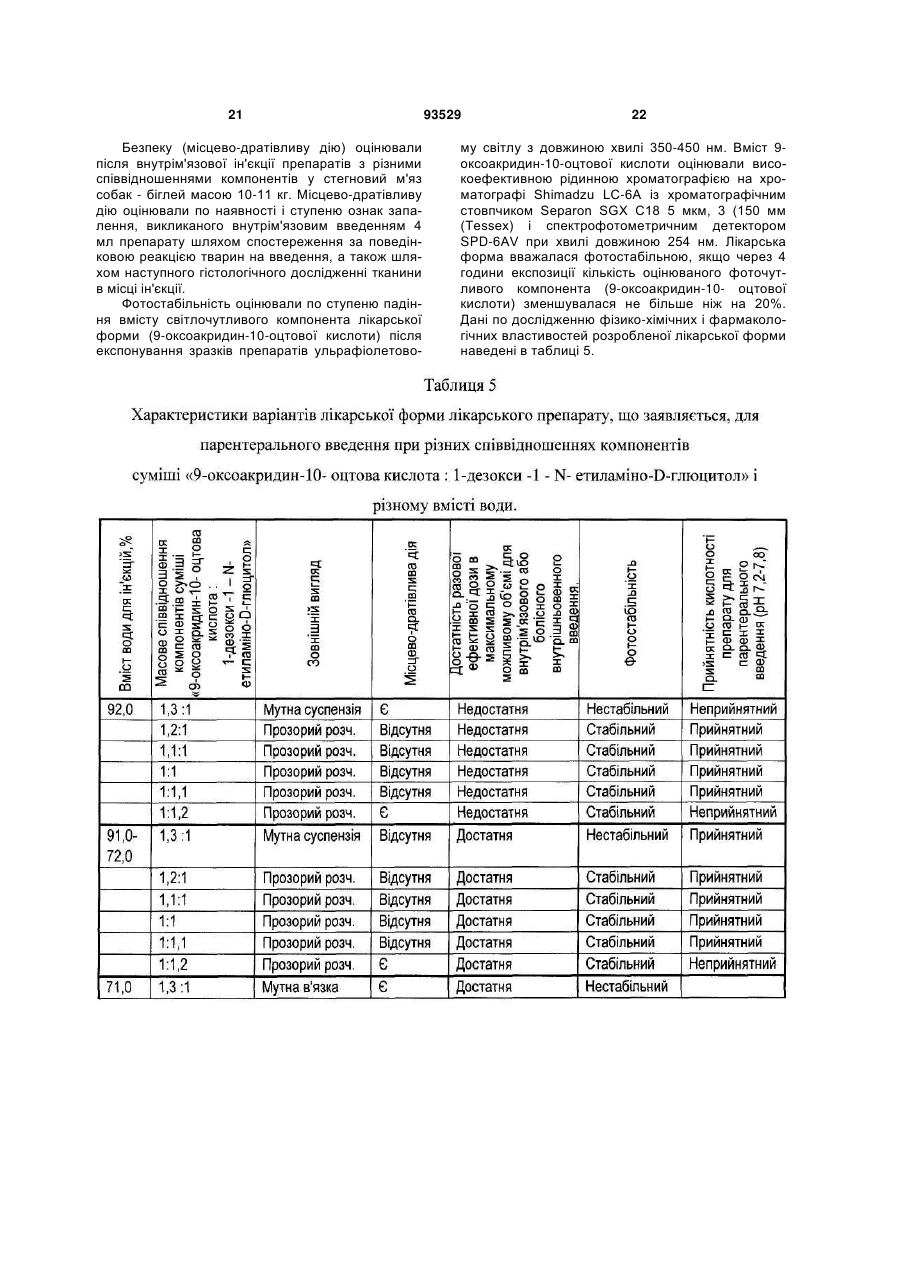
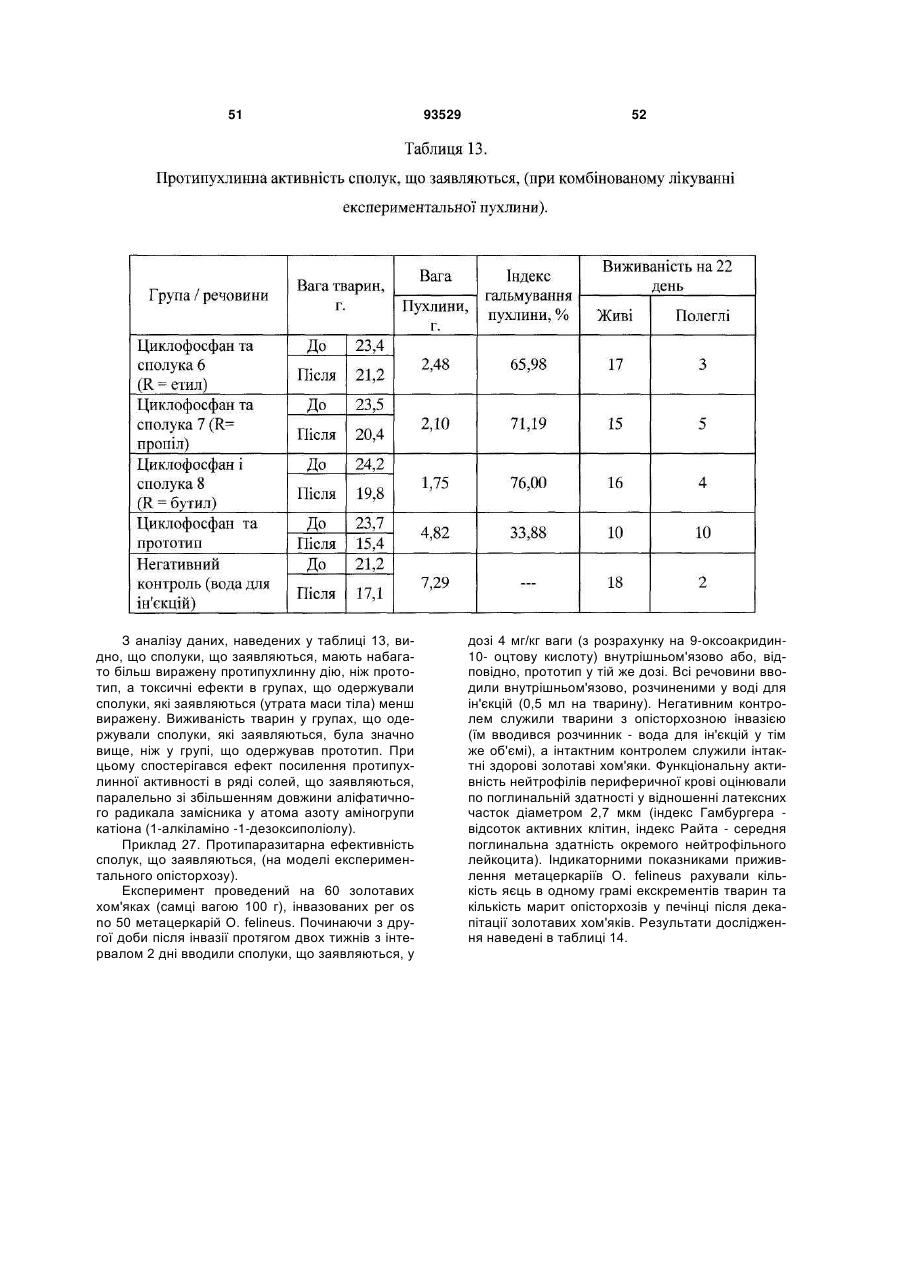
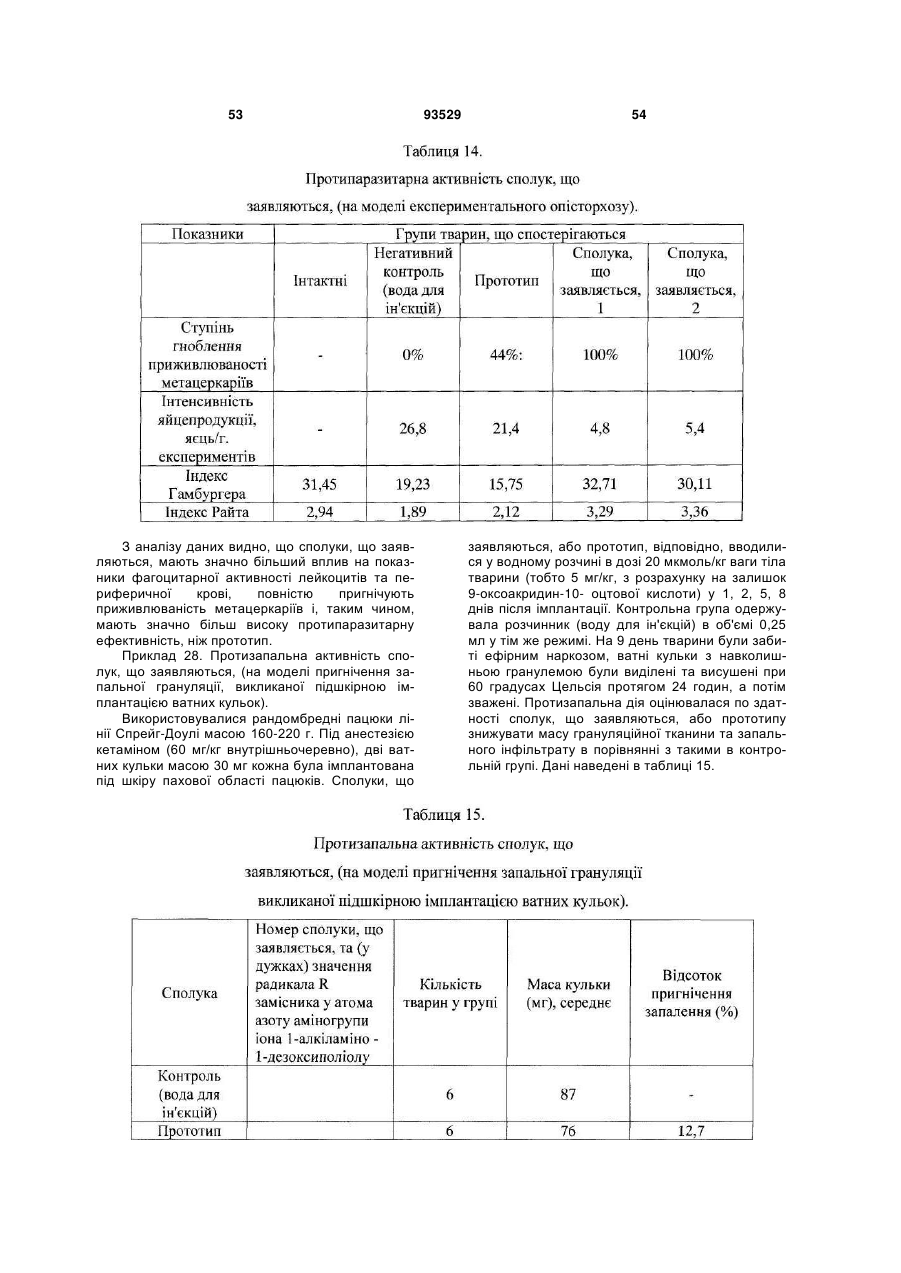
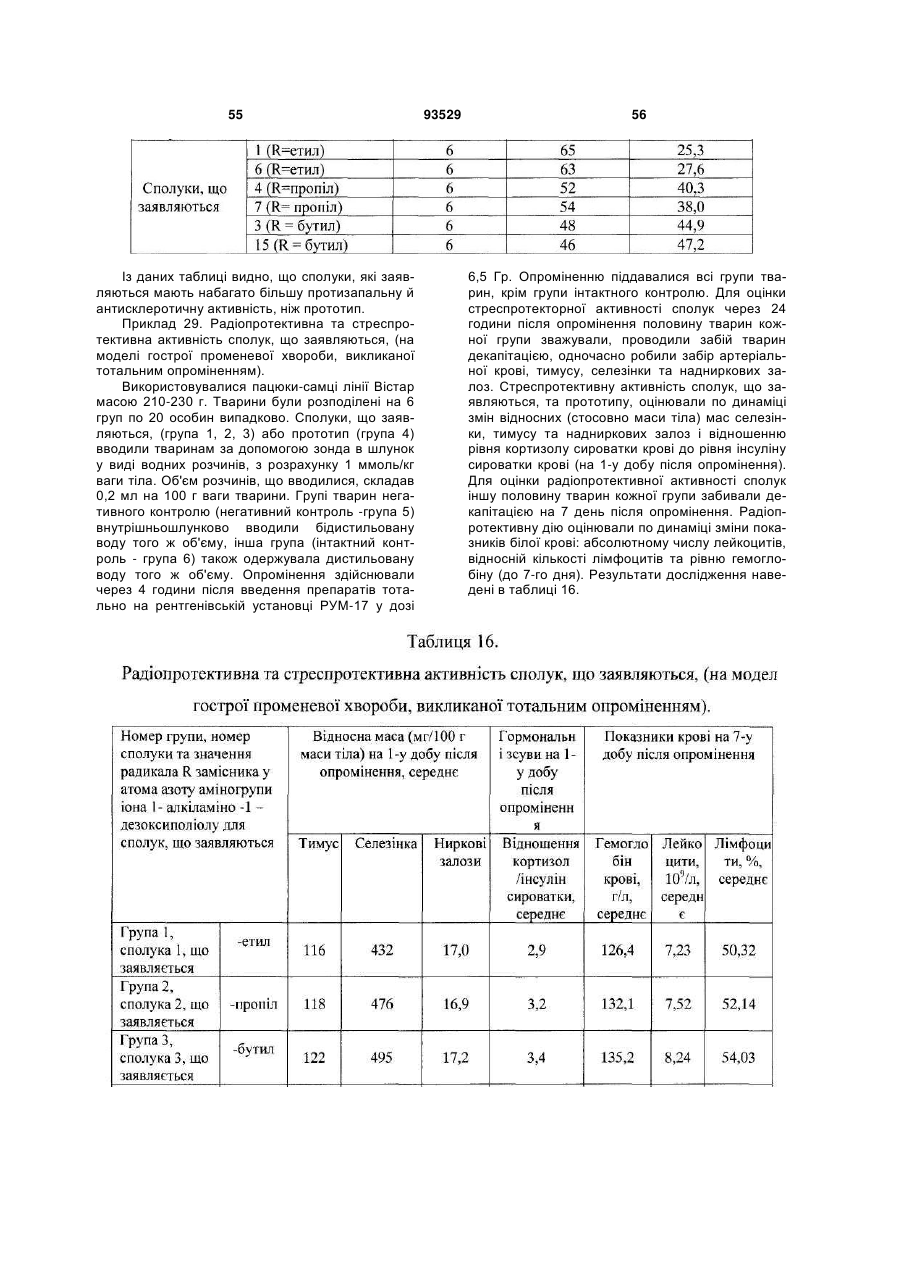
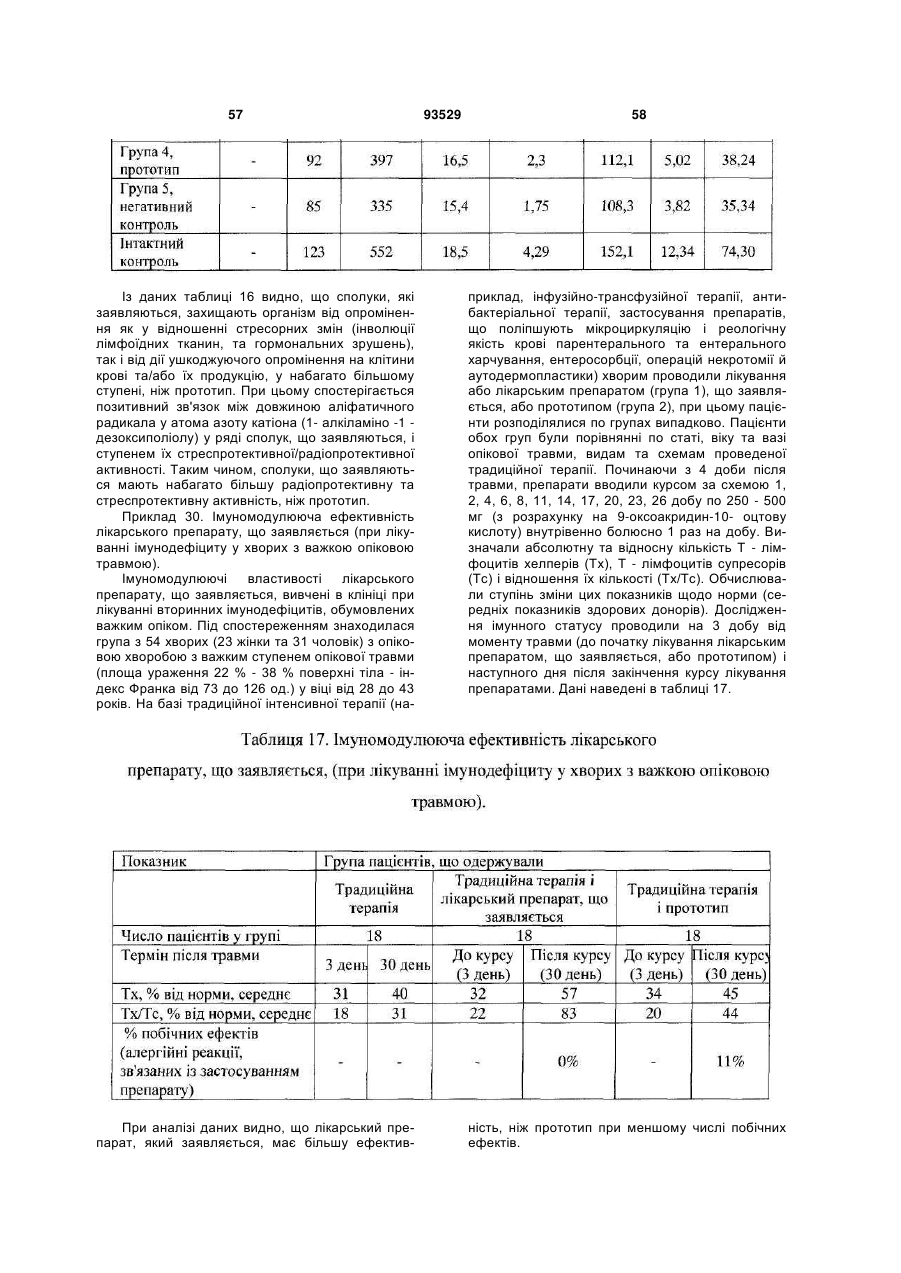
Текст
1. Солі 1-алкіламіно-1-дезоксиполіолів з 9оксоакридин-10-оцтовою кислотою, що мають загальну формулу (І): C2 2 (19) 1 3 93529 ну він містить в ефективній дозі одну або декілька солей формули (І) за п. 1 та/або суміш зазначеної солі формули (І) або 9-оксоакридин-10-оцтової кислоти формули: O N H2C C (ІII) O OH з одним або декількома 1-алкіламіно-1дезоксиполіолами загальної формули (II) A: NH R CH2 (CHOH)4 (ІI) CH2 OH , де R вибраний із групи, що складається із: етил; пропіл; бутил. 5. Лікарський препарат за п. 4, що має дію, вибрану з групи, що включає імуномодулюючу, імунокоригуюючу, протипаразитарну, протисклеротичну, противірусну, протибактеріальну, у тому числі протихламідійну, протигрибкову, протизапальну, протипухлинну, радіопротективну, стреспротективну дію. 6. Лікарський препарат за п. 4, який відрізняється тим, що він одержаний шляхом змішування 9оксоакридин-10-оцтової кислоти формули (III) з одним або декількома 1-алкіламіно-1дезоксиполіолами загальної формули (II), при цьому співвідношення в суміші 9-оксоакридин-10оцтової кислоти до 1-алкіламіно 1-дезоксиполіолу складає від 1,2:1 до 1:1,1. 7. Лікарський препарат за п. 4, який відрізняється тим, що він одержаний шляхом змішування солі формули (І) з одним або декількома 1-алкіламіно1-дезоксиполіолами загальної формули (II), при цьому співвідношення у суміші солі формули (І) до 1-алкіламіно-1-дезоксиполіолу складає від 220:1 до 5,5:1. 8. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для парентерального застосування. 9. Лікарський препарат за п. 8, який відрізняється тим, що він містить сіль формули (І) або суміш 9оксоакридин-10-оцтової кислоти формули (III) або солі формули (І) з одним або декількома 1алкіламіно-1-дезоксиполіолами загальної формули (II), у кількості 9,0-28,0 мас. %; вода для ін'єкцій решта. 10. Лікарський препарат за п. 8, який відрізняється тим, що він містить суміш 9-оксоакридин-10оцтової кислоти з 1-дезоксі-1-(етиламіно)-Dглюцитолом при масовому співвідношенні від 1,2:1 4 до 1:1,1, у кількості 9,0-28,0 мас. %; вода для ін'єкцій - решта. 11. Лікарський препарат за п. 8, який відрізняється тим, що містить суміш N-(1-дезокси-Dглюцитол-1-іл)-N-етиламоній 9-оксоакридин-10ілацетату з 1-дезокси-1-(етиламіно)-D-глюцитолом при масовому співвідношенні, відповідно, від 220:1 до 5,5:1, у кількості 9,0-28,0 мас. %; вода для ін'єкцій - решта. 12. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для перорального застосування. 13. Лікарський препарат за будь-яким з пп. 4-7, який відрізняється тим, що він являє собою одиничну дозовану форму, що забезпечує введення зазначеного лікарського препарату в дозі 0,5 до 20 мг/кг маси тіла, більш переважно від 3 до 10 мг/кг маси тіла, з розрахунку на 9-оксоакридин-10оцтову кислоту або її залишок. 14. Лікарський препарат за будь-яким з пп. 4-7 у формі, придатній для місцевого застосування. 15. Застосування солі формули (І) за п. 1 та/або суміші 9-оксоакридин-10-оцтової кислоти формули (III) або солі формули (І) з одним або декількома 1алкіламіно-1-дезоксиполіолами загальної формули (II), як визначено в п. 4, або їх фармацевтично прийнятних похідних або попередників для лікування і профілактики захворювань та/або патологічних станів людини. 16. Застосування за п. 15, для запобігання або лікування захворювань та/або патологічних станів, які супроводжуються або пов'язані зі зміною імунного статусу, наприклад, вибраних з наступних, але не обмежуваних ними: ВІЛ-інфекції, нейроінфекції, у тому числі серозних менінгітів та енцефалітів; вірусних гепатитів А або В та/або С, та/або D; герпесу та/або цитомегаловірусної інфекції; інфекційного мононуклеозу; імунодефіцитів, у тому числі вторинних імунодефіцитів, пов'язаних із травмами, вірусними та/або бактеріальними, та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарних інвазій; бактеріальної (у тому числі хламідійної) інфекції; ревматичних та системних захворювань сполучної тканини, у тому числі ревматоїдного артриту; дегенеративно-дистрофічних захворювань суглобів, у тому числі вторинного і первинного остеоартрозу; онкологічних захворювань; патологічних станів, що викликаються цитостатичною терапією та/або опроміненням. 17. Спосіб профілактики або лікування захворювань та/або патологічних станів, пов'язаних зі змінами імунного статусу, що включає використання сполуки за будь-яким з пп. 1-3 та/або лікарського препарату за будь-яким з пп. 4-14. 18. Спосіб профілактики або лікування за п. 17, який відрізняється тим, що стани вибрані з групи, що включає, але не обмежується ними, ревматичні та системні захворювання сполучної тканини, у тому числі ревматоїдний артрит, дегенеративнодистрофічні захворювання суглобів, у тому числі вторинний і первинний остеоартроз; вірусні захворювання, у тому числі, але не обмежуючись ними, нейроінфекції, у тому числі серозні менінгіти й енцефаліти; ВІЛ-інфекція, вірусний гепатит А або В та/або С, та/або D; герпес та/або цитомегаловіру 5 93529 6 сна інфекція; інфекційний мононуклеоз; імунодефіцити, у тому числі вторинні імунодефіцити, пов'язані з травмами, вірусними та/або бактеріальними, та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарні інвазії; грибкові захворювання, у тому числі, але не обмежуючись ними, оніхомікоз та кандидоз; бактеріальну (у тому числі хламідійну) інфекцію; простатит; ревматичні і системні захворювання сполучної тканини, у тому числі ревматоїдний артрит; дегенеративно-дистрофічні захворювання суглобів, у тому числі вторинний та первинний остеоартроз; онкологічні захворювання, патологічні стани, що викликаються цитостатичною терапією та/або опроміненням. 19. Спосіб за будь-яким з пп. 17 або 18, у якому зазначену сполуку за будь-яким з пп. 1-3 та/або лікарський препарат за будь-яким з пп. 4-14 застосовують для профілактики або лікування захворювань та/або патологічних станів людини. 20. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять раз на добу. 21. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 20, який відрізняється тим, що лікарський препарат вводять у дозі від 3 до 10 мг/кг ваги тіла, з розра хунку на 9-оксоакридин-10-оцтову кислоту або її залишок. 22. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять курсом. 23. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат вводять парентерально від 5 до 12 разів курсом за схемою на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29 день курсу. 24. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 22, який відрізняється тим, що курс повторюють. 25. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 24, який відрізняється тим, що курс повторюють з інтервалом 10-14 днів. 26. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 24, який відрізняється тим, що курс повторюють не менше 2 разів. 27. Спосіб профілактики або лікування захворювань та/або патологічних станів людини за п. 19, який відрізняється тим, що лікарський препарат застосовують як у режимі монотерапії, так і в складі комплексної та/або комбінованої терапії. Винахід відноситься до медицини та ветеринарії, а саме до лікарських препаратів, що містять N - акридоноцтову кислоту, тобто (9-оксоакридин10(9H)-іл)оцтову кислоту або, що теж саме 2-(9оксоакридин-10-іл)оцтову кислоту, міжнародна непатентована назва (МНН) криданімод, CAS 38609-97-1: диметиламіно-н-пропіл)-1,2:5,6-ди-О-ізопропіліден, D - глюкофуранозою (препарат «Анандін», Патент РФ№ 2197248). У випадку використання деяких органічних сполук (таких, які є слабкими органічними основами) як солюбілізатори 9-оксоакридин-10- оцтової кислоти у водних розчинах утворюється або індивідуальна речовина - сіль, або комплекс без утворення індивідуальної хімічної сполуки. В останньому випадку часто при видаленні розчинника з розчину сухий залишок являє собою механічну суміш двох індивідуальних речовин: 9оксоакридин-10-оцтової кислоти та солюбілізатора, без чіткої температури плавлення та не може бути чітко охарактеризований як індивідуальна хімічна сполука. При розчиненні такої суміші у воді 9-оксоакридин-10-оцтова кислота й органічна основа дисоціюють не повністю. Між дисоційованими і недисоційованими молекулами встановлюється динамічна рівновага. Крім того, у водному середовищі відбувається утворення комплексів між молекулами вихідних речовин, на що вказує зміна ПМР - спектрів їх суміші в розчині D2O, які відрізняються від суми індивідуальних ПМР - спектрів вихідних компонентів. Основною проблемою створення промислово придатних розчинів солей та комплексів 9оксоакридин-10-оцтової кислоти і лікарських препаратів на її основі є їх фізико-хімічна нестабільність, що обумовлено наступним: 1) Високою світлочутливістю акридинового скелету 9-оксоакридин-10- оцтової кислоти, що характерно для всіх сполук на основі акридину. далі - 9-оксоакридин-10-оцтову кислоту та/або її солі. Відомі противірусні та імуномодулюючі препарати, що містять різні солі 9-оксоакридин-10оцтової кислоти: натрієва сіль (препарат «Неовір», Регістр лікарських засобів Росії, Енциклопедія ліків, РЛЗ -11 випуск, Гол. ред. Г.Л. Вишковський, М.: РЛЗ-2004р., 1503с), суміші 9-оксоакридин-10оцтової кислоти із солеутворювачами/солюбілізаторами, наприклад з метиламіноспиртом (препарат Циклоферон, що містить як солеутворювачі/солюбілізатори 1-дезокси-і(метиламіно)-D-глюцитол (меглюмін), Регістр лікарських засобів Росії, Енциклопедія лік, РЛЗ -11 випуск, Гол. ред. Г.Л. Вишковський, М: РЛЗ-2004, 1503с.) або з N, Nдиметиламіноізопропілглюкозою, а саме 3-О-(N,N 7 При поглинанні світла ультрафіолетової та видимої частини спектра у водних розчинах відбувається фотоперетворення акридинового кільця з інактивацією іона 9-оксоакридин-10- оцтової кислоти. 2) Низькою розчинністю самої (неіонованої форми) 9-оксоакридин-10- оцтової кислоти, що призводить до необхідності створення більш високого (нефізіологічного) рівня рН (8,0 та більш). При цьому, при високому рівні рН відбувається прискорене декарбоксилювання 9-оксоакридин-10оцтової кислоти з утворенням 9-метил-10акридону. Подоланню цих проблем покликано введення до складу лікарської форми крім солеутворювача та/або солюбілізатора стабілізуючих добавок і буферних систем, що знижують кислотність середовища. Крім того, зниження рН розчину приводить значення кислотності до цифр, більш близьких до фізіологічних значень рН. У патенті РФ № 2031650 для цих цілей запропоновано уводити до складу лікарської форми ТРІС - основу (трометамін) та динатрієву сіль ЕДТА (трилон Б). Також пропонується введення до складу лікарської форми натрієвої солі 9-оксоакридин-10- оцтової кислоти буферної системи на основі лимонної кислоти та її натрієвої солі (препарат «Неовір», Регістр лікарських засобів Росії, Енциклопедія ліків, РЛЗ -11 випуск, Гол. ред. Г.Л. Вишковський,- М.: РЛЗ-2004, 1503 с). У патенті РФ №2020941 до складу лікарської форми натрієвої солі 9-оксоакридин-10- оцтової кислоти крім цитратного буфера вводять N, N, N',N', - тетраметилтіоніну хлорид у співвідношенні «похідне акридину : N, N, N',N', - тетраметилтіоніну хлорид» 1:0,001-0,01). При цьому N, N, N',N', -тетраметилтіоніну хлорид служить внутрішнім світлофільтром, що захищає молекулу активної речовини від впливу світла. Протягом ряду років запропонована значна кількість лікарських засобів, що містять солі та комплекси, утворені 9-оксоакридин-10-оцтовою кислотою і різними солеутворювачами або солюбілізаторами, наприклад, складними аміноцукрами (Патент РФ № 2036198) та їх монозаміщеними ефірами (Патент РФ № 2197248). Відомий також ряд лікарських засобів на основі солей 9оксоакридин-10-оцтової кислоти з 1-дезокси-Nметиламіногексаспиртами (Патент РФ № 2135474). У патенті РФ 2182004 для зниження процесів фотодеструкції, збільшення термостабільності і підвищення біологічної активності запропоновано додатково вводити в препарат до водного розчину солі, утвореної 9-оксоакридин-10оцтовою кислотою та N-метил-D-глюкаміном, тобто розчину 1-дезокси-1-N-[метил-(2-акри-9-он-10іл-ацетат)]-амоній-Д-глюцитолу додаткову кількість самого другого солеутворюючого компонента (тобто N-метил -D-глюкаміну) як стабілізатора. При цьому в препараті 1-дезокси-1-N-[метил-(2акри-9-он-10-іл-ацетат)]-амоній-д-глюцитолу міститься від 8,5 мас. % до 25,0 мас. %, Nметилглюкаміну від 0,05 мас. % до 1,0 мас. %, вода для ін'єкцій до 100%. Таким чином, у водному розчині цього препарату солеутворювачі (9оксоакридин-10- оцтова кислота, з однієї сторони 93529 8 та N-метил - D-глюкамін, з іншої) знаходяться не в еквімолярному співвідношенні, й солюбілізатор/солеутворювач N-метил-D-глюкамін присутній у надлишку. Необхідно окремо підкреслити, що високі солюбілізуючі властивості аміноцукрів (у тому числі аміноспиртів) та їх ефірів у першу чергу обумовлені високим вмістом гідроксильних груп у складі їх молекул. Використання у складі лікарського препарату низькомолекулярних органічних або неорганічних солеутворювачів приводить до значного збільшення осмолярності водного розчину солі або комплексу, обумовленої власною осмотичною активністю солеутворювача. Це призводить до місцевої хворобливості при парентеральному введенні препарату, особливо, при підшкірному або внутрім'язовому. При використанні як солюбілізатори 9-оксоакридин-10- оцтової кислоти та/або стабілізатори водних розчинів її солей органічних сполук з більш високою молекулярною масою (більш 150 Да), наприклад, лінійних або циклічних аміноцукрів та їх ефірів осмолярність розчину знижується, але також збільшується в'язкість розчину. Збільшення в'язкості розчину приводить до труднощів при ультрафільтрації та/або розливі препарату в ампули в процесі виробництва і використанні в медичній практиці, а також до нестабільності такого розчину при його зберіганні, особливо на холоді. В останньому випадку частина 9оксоакридин-10- оцтової кислоти переходить у протоновану форму й випадає у виді нерозчинного осаду, що перешкоджає подальшому використанню препарату в клініці. Крім того, введення до складу лікарського препарату з метою солюбілізації 9-оксоакридин10-оцтової кислоти у водному середовищі органічних соле-/комплексоутворювачів та/або стабілізаторів з більш високою молекулярною масою в масових кількостях, порівнянних з масовою кількістю самої 9-оксоакридин-10- оцтової кислоти, приводить до значного зменшення швидкості усмоктування 9-оксоакридин-10-оцтової кислоти з місця ін'єкції при внутрім'язовому та/або підшкірному введенні препарату та/або уповільненого розпаду комплексу, що утвориться, «солюбілізатор - 9оксоакридин-10- оцтова кислота» при внутрішньовенному введенні або пероральному введенні. В'язкий органічний солюбілізатор відіграє роль «депо» після внутрім'язової та/або підшкірної ін'єкції. Швидкість усмоктування активної речовини в кров з місця ін'єкції після внутрім'язового та/або підшкірного введення або швидкість розпаду комплексу й звільнення іона 9-оксоакридин-10- оцтової кислоти при внутрішньовенному введенні або пероральному застосуванні відіграє ключову роль у здійсненні фармакологічного ефекту 9оксоакридин-10- оцтової кислоти і її солей. Це пов'язано з тим, що, будучи в першу чергу індуктором інтерферонів та інших цитокінів (чим обумовлені основні імуномодулюючі й противірусні властивості сполук на її основі), 9-оксоакридин-10оцтова кислота діє за принципом «все або нічого». Тобто для здійснення біологічних ефектів, у тому числі індукції викиду інтерферонів та інших цитокі 9 нів необхідне досягнення в короткий час визначеного мінімального (граничного) рівня вмісту іонованої форми 9-оксоакридин-10- оцтової кислоти в середовищі, що оточує клітину-мішень. 9-оксоакридин-10- оцтова кислота виводиться нирками в незміненому виді зі значною швидкістю (період її напівелімінації з кровотоку при внутрішньовенному введенні, наприклад, у виді її натрієвої солі, не перевищує 30 хв). Різниця у швидкості усмоктування 9-оксоакридин-10- оцтової кислоти з місця введення при внутрім'язовій або підшкірній ін'єкції (або його вивільнення з комплексу «солюбілізатор - 9-оксоакридин-10- оцтова кислота» при внутрішньовенній ін'єкції або пероральному введенні), з одного боку, і швидкості елімінації її іонованої форми з крові, з іншого боку, має критичне значення в досягненні ефективної концентрації активної речовини в крові і тканинах. Таким чином, швидкість досягнення максимальної концентрації активної речовини (Тmах) при введенні того або іншого препарату 9-оксоакридин-10-оцтової кислоти багато в чому визначає повноту прояву біологічних/фармакологічних властивостей сполук на її основі. Солі 1-дезокси-і-N-метиламіногексаспиртів з N - акридоноцтовою (тобто, 9-оксоакридин-10- оцтовою) кислотою і лікарський засіб на їх основі, описаний в патенті РФ № 2135474, як найбільш близький до заявленого винаходу, обраний авторами заявленого винаходу як прототип. Обраний прототип має ряд недоліків. З погляду на біологічні та фармакологічні властивості прототип має недостатню здатність проникати в клітини, що є важливим, оскільки основні біологічні ефекти сполук 9-оксоакридин-10- оцтової кислоти пов'язані з її здатністю взаємодіяти з внутрішніми субстратами клітини, у тому числі з ДНК. З погляду на фізико-хімічні властивості у водних розчинах прототипу в процесі промислового виготовлення та/або тривалого збереження відбувається утворення продукту декарбоксилювання (9-метил-10-акридону) і фотодеструкція акридинового скелета 9-оксоакридин-10- оцтової кислоти. З погляду на фармакокінетичні та фармакологічні властивості у клініці прототип характеризується зниженою швидкістю усмоктування основної діючої речовини 9-оксоакридин-10-оцтової кислоти в системний кровотік з місця внутрім'язової або підшкірної ін'єкції препарату, зниженою швидкістю вивільнення 9-оксоакридин-10-оцтової кислоти зі зв'язку із солеутворювачем та неадекватним розподілом активної речовини між кров'ю і тканинами при внутрішньовенному введенні або пероральному прийомі, зниженим проникненням активної речовини в тканині при місцевому нанесенні. Прототип характеризується зниженою здатністю викликати викид інтерферонів і цитокінів у людини та тварин і, має низьку клінічну ефективність при недосить широкому спектрі захворювань, які можливо ефективно лікувати в клініці за допомогою прототипу. Задачею даного винаходу є одержання нового, клінічно більш ефективного, стабільного при виробництві й зберіганні, такого, що має кращі 93529 10 фармакокінетичні та фармакодинамічні характеристиками, малотоксичного лікарського препарату на основі 9-оксоакридин-10-оцтової кислоти, призначеного для профілактики та лікування імунопатологічних, паразитарних, дистрофічних (дегенеративних), вірусних, бактеріальних, грибкових, пухлинних захворювань та патологічних станів людини і тварин. Поставлена задача реалізується новими солями та сумішами на основі 9-оксоакридин-10оцтової кислоти при використанні як соле/комплексоутворювач або як другий компонент суміші 1-алкіламіно-1-дезоксиполіолів загальної формули (II): де R = етил; пропіл або бутил; а також лікарським препаратом, що містить вищевказані суміші та солі (у тому числі в різних сполученнях) як діючу речовину, що має наступні дії: імунокоригуючі, імуномодулюючі, противірусні, протибактеріальні (у тому числі протихламідійні), протизапальні, протипаразитарні, протигрибкові, протипухлинні, радіопротективні, стреспротективні, і призначеним для лікування, профілактики або корекції наступних груп захворювань та/або станів: імунодефіцитів, вірусних інфекцій, грибкових інфекцій, бактеріальних інфекцій (у тому числі викликаних хламідіями), паразитарних інвазій, запальних процесів, пухлинних захворювань, дегенеративно-запальних захворювань суглобів (артрозів), токсичних явищ, викликаних хіміотерапевтичним та/або променевим впливом, а також лікарськими формами даного препарату, призначеними для парентерального, місцевого, перорального й іншого способів застосування. У процесі роботи над винаходом з'ясувалося, що при збільшенні гідрофобності солеутворювача із зазначеної групи 1-алкіламіно-1- дезоксиполіолів за рахунок збільшення довжини аліфатичного вуглеводневого ланцюга замісника у атома азоту аміногрупи в ряду "етил - пропіл - бутил", з одного боку, закономірно знижується здатність відповідного 1-алкіламіно-1- дезоксиполіолу солюбілізувать 9-оксоакридин-10-оцтову кислоту формули (III): у водному розчині, а з іншого боку, зненацька спостерігається значне поліпшення фармакодина 11 мічних властивостей лікарського препарату та посилення його фармакологічної ефективності при зниженні побічних ефектів, як при парентеральному введенні, так і при місцевому (у тому числі ректальному й інтравагінальному) і пероральному застосуванні. В дослідженнях у порівнянні з прототипом виявилося, що сполуки і лікарський препарат, що заявляються, набагато активніше/ефективніше прототипу, як в експериментальних системах, так і в клініці. Крім того, зненацька виявилося, що солі, що заявляються, і суміші не тільки мають меншу токсичність у порівнянні з прототипом при відповідному молярному співвідношенні 9-оксоакридин10 оцтової кислоти та відповідного соле/комплексоутворювача (соле/комплексоутворювачів), але і мають інший спектр біологічних властивостей, нехарактерний як для вихідних компонентів, узятих окремо, так і для прототипу. Крім того, зненацька виявилася залежність між довжиною аліфатичного радикала замісника в ряду «етил-пропіл-бутил» у атома азоту аміногрупи 1-алкіламіно-1- дезоксиполіолу та різними видами і ступенем біологічної/ фармакологічної активності. Спроби подальшого збільшення аліфатичного «хвоста» алкіламіногрупи (5 атомів вуглецю і вище) 1-алкіламіно-1- дезоксиполіолів приводить до різкого падіння розчинності солі/комплексу у водному середовищі. При цьому знижується його стабільність та/або виникає неможливість одержання лікарської форми для парентерального введення з прийнятним об'ємом разової дози препарату, а також збільшується токсичність солі/суміші. Таким чином, відповідно до винаходу, запропоновані: А) Солі 1-алкіламіно-1-дезоксиполіолів з 9оксоакридин-10-оцтовою кислотою, що мають загальну формулу (І): де де R обраний із групи, що складається із: етил; пропіл; бутил. B) Солі формули (І), що мають імуномодулюючу, імунокоригуючу, протипаразитарну, протискле 93529 12 ротичну, противірусну, протибактеріальну, у тому числі протихламідійну, протигрибкову, протизапальну, протипухлинну, радіопротективну та стреспротективну дію. C) Лікарський препарат, що має імуномодулюючу, імунокоригуючу, протипаразитарну, протисклеротичну, противірусну, протибактеріальну, протигрибкову, протизапальну, протипухлинну, радіопротективну, стреспротективну дію й таку, що містить нові солі формули (І), що заявляються, (а також їх сполуки), а також суміші зазначеної солі формули (І) та/або 9-оксоакридин-10-оцтової кислоти формули (III): з одним або декількома 1-алкіламіно-1дезоксиполіолами загальної формули (II) де: R обраний із групи, що складається із: етил; пропіл, бутил; (а також їх сполуки) як діюча речовина. Зазначений лікарський препарат може бути реалізований у декількох варіантах, відповідно до приведеної далі формули винаходу, тобто препарат може містити, наприклад: (а) сіль 9-оксоакридин-10-оцтової кислоти, що є сполукою формули (І); (в) суміш 9-оксоакридин-10-оцтової кислоти формули (III) з 1-алкіламіно-і-дезоксиполіолами загальної формули (II); (c) суміш солі формули (І) з 1-алкіламіно-1дезоксиполіолами загальної формули (ІІ); (d) суміш солі формули (І) з 9-оксоакридин-10оцтовою кислотою формули (III) та 1-алкіламіно-1дезоксиполіолами загальної формули (II). При створенні лікарського препарату та його лікарських форм на основі сумішей 1-алкіламіно-1дезоксиполіолів формули II і 9-оксоакридин-10оцтової кислоти компоненти даної суміші брали в співвідношенні, близькому до еквімолярного, але в окремих випадках один з компонентів брали в істотному надлишку. Крім того, авторами даного винаходу було показано, що використання суміші солюбілізаторів/солеутворювачів формули II у різних їх співвідношеннях при створенні лікарського препарату, що заявляється, або використання сумішей солей, що заявляються, здатно додатково збільшити стій 13 93529 14 кість молекули 9-оксоакридин-10-оцтової кислоти до фотоперетворень та/або збільшити лікувальну ефективність лікарського препарату, що заявляється. Фотостабільність лікарського препарату, що заявляється, досліджували в товщині шару 1 см. 0,2 М розчинів у кварцевій кюветі при потужності опромінення 5,2 х 10-5 мВт/с кв.м. за допомогою ртутно-кварцової лампи з довжиною хвилі 250-310 нм. Кількість фоточуттєвого компонента, що залишається, (9-оксоакридин-10 оцтової кислоти) визначали методом високоефективної рідинної хроматографії на хроматографі Shimadzu LC-6A із хроматографічним стовпчиком Separon SGX С18 5 мкм, 3 (150 мм (Tessex) і спектрофотометричним детектором SPD-6AV при хвилі довжиною 254 нм. Результати дослідження фотостабільності розчинів сполук, що заявляються, наведені в таблиці 1. Відповідно до винаходу, переважно препарат, реалізований у виді (а), містить як сіль формули (І) N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9оксоакридин-10-ілацетат. Відповідно до винаходу, одним із переважних варіантів (в) є лікарський препарат, що містить суміш 9-оксоакридин-10-оцтової кислоти з 1дезокси-1-(етиламіно)-D-глюцитолом. Далі, відповідно до винаходу, одним із переважних варіантів (с) є лікарський препарат, що містить суміш N-(1-дезокси-D-глюцитол-1-іл)-Nетиламоній 9-оксоакридин-10-ілацетату та 1 дезокси-1-(етиламіно)-D-глюцитолу. Далі, відповідно до винаходу, одним із переважних варіантів (с) є лікарський препарат, що містить суміш 9-оксоакридин-10-оцтової кислоти з N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9оксоакридин-10-ілацетатом та 1-дезокси-1(етиламіно)-D-глюцитолом. Співвідношення в зазначених вище сумішах (b), (с) та (d) 9-оксоакридин-10-оцтової кислоти до 1 -алкіламіно 1 -дезоксиполіолу може значно варіювати в залежності від типу суміші й складає переважно: (b) від 1,2:1 до 1:1,1; (c) від 220: 1 до 5,5:1; (d) від (1 - 100): (1 - 100): (1 - 100) і може бути підібрано фахівцем у залежності від конкретної ситуації. При цьому варто враховувати, що вміст вищевказаних компонентів у лікарському препараті може також значно змінюватися в залежності від призначення лікарського препарату (наприклад, для лікування або профілактики), його лікарської форми (наприклад, для парентерального або перорального або інших шляхів введення), а також способу терапії (однократно або курсом), і т.п. Конкретні вмісти компонентів для кожного приватного випадку можуть бути розраховані фахівцем на основі наступного докладного опису винаходу і прикладів реалізації, не обмежуючих область винаходу. D) Лікарські форми даного препарату, призначені для парентерального, місцевого, перорального, ректального, інтравагінального, внутріпорожнинного й інших відомих способів застосування. Відповідно до одного з прикладів реалізації винаходу, лікарська форма, придатна для парентерального застосування, містить зазначені вище солі формули (І) або суміші (b), (с) або (d) у кількості, переважно від 9,0 до 28,0 мас. % (на сухий залишок) та воду для ін'єкцій (інше). Крім того, додатково, лікарська форма, придатна для парентерального застосування, може містити допоміжні добавки, наприклад, розріджувач, загусник, внутрішній світлофільтр (наприклад, N, N, N',N', - тетраметилтіоніну хлорид) та інші стандартні речовини, придатні для одержання або модифікації властивостей парентеральних препаратів, наприклад циклодекстрини, такі як гідроксипропіл-(бета)-циклодекстрин або інші модифіковані циклодекстрини. Так, наприклад, в ряду випадків, для досягнення рівня значень рН, близьких до фізіологічних, а також для збільшення стабільності окремих лікарських форм до складу лікарського препарату можуть бути додатково 15 введені неорганічні та/або органічні основи, широко застосовувані для цієї мети у фармацевтиці, наприклад, гідроксиди лужних металів та/або третинні, вторинні й четвертинні аміни (такі як, диетаноламін; 1,2-етилендіамін: триоксиметиламінометан (трометамін); діетиламін; гідрабамін; етаноламін; триетаноламін, глюкамін; 2-(4-імідазоліл)етиламін; холін; аргінін та їх просторові ізомери і т.п.). При цьому кількість основи, що додатково вводиться, залежить від ступеня її лужних властивостей і складає від 0,01% до 5% від сухого залишку лікарського препарату. Далі, відповідно до іншого приклада реалізації винаходу, лікарська форма, придатна для місцевого (топічного) застосування, може являти собою емульсію, суспензію, гель, крем, лінімент і т.п. Лікарська форма для місцевого застосування може містити зазначені вище солі формули (І) або суміші (b), (с) або (d) у кількості, переважно від 5,0 до 90,0 мас. % та кремову, мазеву або гелеву основу. Далі, згідно ще одному прикладу реалізації винаходу, лікарська форма, придатна для перорального застосування, може являти собою таблетки (у тому числі покриті кишечнорозчинною оболонкою), а також драже, капсули, гранули, суспензії та розчини і т.п. Лікарська форма для перорального застосування містить зазначені вище солі формули (І) або суміші (b), (с) або (d) у кількості, переважно від 20,0 до 99,9 мас. % . Одинична дозована форма для перорального прийому може містити дозу від 0,5 до 30 мг/кг ваги тіла, переважно, від 2 до 10 мг/кг (тобто, наприклад, для людини масою 60-80 кг від 120-160 мг до 600 - 800 мг), з розрахунку на 9-оксоакридин-10оцтову кислоту або її залишок. Далі, відповідно до винаходу, лікарська форма, придатна для ректального та/або інтравагінального застосування, може являти собою супозиторії, лінімент, крем, гель, емульсію, суспензію і т.п. Переважно, лікарська форма, придатна для ректального та/або інтравагінального введення, містить зазначені вище солі формули (І) або суміші (b), (c) або (d) у кількості, переважно, від 5,0 до 90,0 мас. %. Одинична дозована форма, придатна для ректального та/або інтравагінального введення (супозиторій), може містити дозу від 2 до 10 мг/кг ваги тіла (тобто, наприклад, для людини масою 60-80 кг від 120-160 мг до 600 - 800 мг), з розрахунку на 9-оксоакридин-10- оцтову кислоту або її залишок. E) Відповідно до винаходу, далі запропоноване застосування солі формули (І) та/або суміші 9оксоакридин-10-оцтової кислоти або солі формули (І) з одним або декількома 1-алкіламіно-1дезоксиполіолами загальної формули (II), або їх фармацевтично прийнятних похідних або попередників, або тих, що містять їх фармацевтичні препарати, для лікування та профілактики захворювань й патологічних станів людини і тварин. Зокрема, запропоноване застосування зазначених вище солей, сумішей і препаратів на їх основі для запобігання або лікування захворювань та/або станів, пов'язаних або таких, що супрово 93529 16 джуються зміною імунного статусу, наприклад, що включають (але не обмежуються ними): ВІЛ - інфекцію, нейроінфекцію, у тому числі серозні менінгіти й енцефаліти; вірусні гепатити А або В та/або С та/або D; герпес та/або цитомегаловірусну інфекцію; інфекційний мононуклеоз; імунодефіцит, у тому числі вторинний імунодефіцит, пов'язаний із травмою, вірусними та/або бактеріальними та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарну інвазію; бактеріальну, у тому числі хламідійну інфекцію; ревматичні і системні захворювання сполучної тканини, у тому числі ревматоїдний артрит; дегенеративно-дистрофічні захворювання суглобів, у тому числі вторинний і первинний остеоартроз; простатит; онкологічні захворювання, патологічні стани, що викликаються хіміотерапією та/або опроміненням. Зазначені вище солі, суміші і лікарські препарати на їхній основі можна застосовувати для лікування і профілактики захворювань та/або патологічних станів людини і тварин. F) Далі, відповідно до винаходу, запропоновані способи лікування і профілактики широкого кола захворювань і патологічних станів інфекційної і неінфекційної природи з використанням лікарського препарату, що заявляється, зокрема, лікування і профілактики станів, пов'язаних зі змінами імунного статусу, лікування і профілактики ревматичних і системних захворювань сполучної тканини, у тому числі, але не обмежуючись ними, ревматоїдного артриту; дегенеративно-дистрофічних захворювань суглобів, у тому числі вторинного і первинного остеоартроза; вірусних захворювань, у тому числі, але не обмежуючись ними, ВІЛ -інфекції, вірусних гепатитів А або В та/або С та/або D; герпесу та/або цитомегаловірусної інфекції; інфекційного мононуклеозу; імунодефіцитів, у тому числі вторинних імунодефіцитів, пов'язаних із травмою, вірусними та/або бактеріальними та/або грибковими інфекціями та/або паразитарними інвазіями; паразитарних інвазій; грибкових захворювань, у тому числі, але не обмежуючись ними, оніхомікозу, кандидозу; бактеріальної, у тому числі хламідійної інфекції; простатиту; пухлинних захворювань, а також для профілактики і корекції токсичних явищ, що закономірно виникають унаслідок проведення цитостатичної та/або променевої терапії. При проведенні експериментальних робіт та клінічних досліджень показано, що сполуки, що заявляються, і лікарський препарат, що заявляється, мають виражений імуномодулюючий, імунокоригуючий, протипаразитарний, протисклеротичний, противірусний, протибактеріальний, протигрибковий, протизапальний, протипухлинний, радіопротективний та стреспротективний ефект, при цьому мають низьку токсичність, мале число побічних ефектів, стабільність. Біологічну/фармакологічну активність та токсичність нових сполук, що заявляються, у тому числі їх здатність проникати/ зв'язуватися зі структурами клітини вивчали на різних моделях in vitro та in vivo у порівнянні з прототипом. Показано, що сполуки, що заявляються, у більшій мірі, ніж прототип, проникають/зв'язуються зі структурами клітини, що ілюструється таблицею 2. 17 93529 18 * За одиницю флюоресценції відповідного типу клітин прийнята флюоресценція з пробами з неорганічною (натрієвою) сіллю 9-оксоакридин-10-оцтової кислоти у відповідній серії для кожної лінії клітин. Гостра токсичність (DL50) сполук, що заявляються, на мишах при внутріочеревинному введенні, визначена по методу Літчифілда й Уілкоксона складала від 500 до 650 мг/кг. При цьому токсичність (DL50) прототипу склала 450 мг/кг, що говорить про те, що прототип більш токсичний, ніж сполука, що заявляється. Відповідно до винаходу, запропонований спосіб профілактики та лікування захворювань включає як однократний прийом або введення препарату, так і призначення його курсом, тобто кількаразовий прийом та/або введення протягом деякого періоду часу. Заявлений лікарський препарат можна вводити один або декілька разів на добу. Переважна разова доза препарату складає від 0,5 до 20 мг/кг ваги з розрахунку на 9-оксоакридин-10- оцтову кислоту або її залишок, більш переважно від 3 до 10 мг/кг ваги тіла, з розрахунку на 9-оксоакридин10- оцтову кислоту або її залишок. При парентеральному або пероральному введенні лікарського препарату, що заявляється, одна з кращих схем введення включає введення його курсом від 5 до 12 разів на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29 добу курсу. Згідно ще одній можливій схемі лікування, курси повторюють, наприклад, з інтервалом 10-14 днів. Можливе повторення курсу не менше 2 разів. Відповідно до винаходу, лікарський препарат можна застосовувати як у режимі монотерапії, так і в складі комплексної та/або комбінованої терапії. Наприклад, препарат може бути ефективний у складі комплексного лікування ВІЛ- інфекції (наприклад, разом із препаратами на основі модифікованих нуклеозидів типу азидотимідину та/або інгібіторами зворотної транскриптази та/або білками, одержаними біотехнологічним шляхом, наприклад, моноклональними антитілами або вакцинами), бактеріальних та/або грибкових інфекцій (наприклад, разом з антибіотиками та/або хіміопрепаратами, у тому числі фторхінолонами), вірусних гепатитів (наприклад, спільно рибавірином та/або з препаратами інтерферонів та/або цитокінів та/або білками, одержаними біотехнологічним шляхом, наприклад, моноклональними антитілами або вакцинами), пухлинних захворювань (наприклад з цитостатиками та/або гормонами або їх антагоністами та/або білками, одержаними біотехнологічним шляхом, наприклад, моноклональними антитілами або терапевтичними вакцинами, а також у поєднанні з оперативним лікуванням, у тому числі й в ад'ювантному та/або неоад'ювантному режимі). З аналізу даних, наведених у прикладах, видно, що нові солі 9-оксоакридин-10-оцтової кислоти, що заявляються, виявляють більш високу біологічну і фармакологічну активність у порівнянні з прототипом при меншому числі негативних/побічних ефектів. При цьому здатність проникати в клітини і тканини значно вище, а спектр біологічної і фармакологічної активності сполук, що заявляються, ширше, ніж у прототипу. При місцевому застосуванні сполук, що заявляються, які наносять в інертному носії, виявлене більш швидке і глибоке про 19 93529 20 никнення залишку 9-оксоакридин-10-оцтової кислоти в тканини (у шкіру та слизові оболонки) у по рівнянні з прототипом, що ілюструє таблиця 3. Дослідження фармакокінетичних та фармакодинамічних характеристик та клінічної ефективності і безпеки різних лікарських форм лікарського препарату, що заявляється, показали, що лікарський препарат, що заявляється, має кращі фармакокінетичні та фармакодинамічні характеристики, а також збільшену клінічну ефективність при меншій кількості негативних ефектів у порівнянні з прототипом. Дані по фармакодинамічних та фармакокінетичних дослідженнях лікарського препарату, що заявляється, у порівнянні з прототипом приведені в таблиці 4. Таблиця 4 Фармакокінетичні та фармакодинамічні характеристики лікарського препарату, що заявляється, у порівнянні з прототипом при внутрім'язовому введенні в еквімолярних дозах* Лікарський препарат, що заявляється, на основі нових запропонованих солей і сумішей показав свою ефективність як лікувальний та профілактичний засіб при широкому колі захворювань вірусного, паразитарного, бактеріального (у тому числі, хламідійного), грибкового, пухлинного, запального, дегенеративно - дистрофічного характеру, а також при корекції станів, прямо або побічно пов'язаних з порушеннями імунного статусу. У процесі роботи над винаходом авторами, як варіанти лікарського препарату, що заявляється, також були додатково розроблені лікарські форми для парентерального застосування лікарського препарату, що заявляється, такі, що містять 9оксоакридин-10-оцтової кислоту та солюбіліза тор/солеутворювач, а саме 1-дезокси -1 - (етиламіно)-D-глюцитол. З розрахунку ефективної разової дози препарату, підібраної в клініці, що склала (у розрахунку на 9-оксоакридин-10-іл оцтову кислоту) 2-10 мг/кг ваги тіла людини, та максимально можливого об'єму разової парентеральної, зокрема, внутрім'язової ін'єкції, була визначена масова частка сухої речовини і співвідношення компонентів суміші, проведені дослідження з фотостабільності розробленої лікарської форми для парентерального застосування. Фізико-хімічні властивості - зовнішній вигляд та рН при різних співвідношеннях компонентів оцінювали, відповідно, візуально і за допомогою рН-метрії. 21 Безпеку (місцево-дратівливу дію) оцінювали після внутрім'язової ін'єкції препаратів з різними співвідношеннями компонентів у стегновий м'яз собак - біглей масою 10-11 кг. Місцево-дратівливу дію оцінювали по наявності і ступеню ознак запалення, викликаного внутрім'язовим введенням 4 мл препарату шляхом спостереження за поведінковою реакцією тварин на введення, а також шляхом наступного гістологічного дослідженні тканини в місці ін'єкції. Фотостабільність оцінювали по ступеню падіння вмісту світлочутливого компонента лікарської форми (9-оксоакридин-10-оцтової кислоти) після експонування зразків препаратів ульрафіолетово 93529 22 му світлу з довжиною хвилі 350-450 нм. Вміст 9оксоакридин-10-оцтової кислоти оцінювали високоефективною рідинною хроматографією на хроматографі Shimadzu LC-6A із хроматографічним стовпчиком Separon SGX С18 5 мкм, 3 (150 мм (Tessex) і спектрофотометричним детектором SPD-6AV при хвилі довжиною 254 нм. Лікарська форма вважалася фотостабільною, якщо через 4 години експозиції кількість оцінюваного фоточутливого компонента (9-оксоакридин-10- оцтової кислоти) зменшувалася не більше ніж на 20%. Дані по дослідженню фізико-хімічних і фармакологічних властивостей розробленої лікарської форми наведені в таблиці 5. 23 При вмісті води у складі лікарської форми менше 72 відсотків препарат являв собою в'язку рідину. При введенні такого препарату спостерігалася виражена реакція запалення та набряку в місці введення, крім того, тварини реагували на введення вилизуванням місця ін'єкції і вокалізацією (скигленням). При цьому, якщо 9-оксоакридин10- оцтова кислота перевершувала в такому розчині по масовому співвідношенню 1-дезокси-1(етиламіно)-D-глюцитол, то препарат являв собою в'язку рідину з кристалами несолюбілізованої 9оксоакридин-10 оцтової кислоти, а значення рН були далекі від фізіологічних. При надлишку 1-дезокси-1-(етиламіно)-Dглюцитолу по масі над 9-оксоакридин-10-оцтовою кислотою більше ніж у 1,1 рази препарат при парентеральному введенні показував високі значення Тmах при низьких значеннях Сmах, викликав утворення незначних титрів інтерферону, а також мав високі нефізіологічні значення рН. При надлишку 9-оксоакридин-10 оцтової кислоти по масі над 1-дезокси-1-(етиламіно)-D-глюцитолом більш ніж у 1,2 рази, препарат ставав фотонестабільним. Виявилося, що оптимальним масовим співвідношенням компонентів суміші «9-оксоакридин-10 93529 24 оцтова кислота : 1-дезокси-1-(етиламіно)-Dглюцитол» є співвідношення від 1,2:1 до 1:1,1 при мінімальному вмісті води 72,0 мас. % і максимальному вмісті води 91,0 мас. % у лікарській формі для парентерального застосування. Інший варіант лікарської форми для парентерального застосування лікарського препарату, що заявляється, одержаний шляхом первинного розчинення N-(1-дезокси-D-глюцитол-1-іл)-N-етил амоній 9-оксоакридин-10-ілацетату у воді для ін'єкцій з наступним додаванням 1-дезокси-1(етиламіно)-D-глюцитолу. Виявилося, що оптимальним масовим співвідношенням компонентів суміші «N-(1-дезокси-D-глюцитол-1-іл)-N-етил амоній 9-оксоакридин-10-ілацетат: 1-дезокси -1 (етиламіно) -D-глюцитол» є співвідношення від 220:1 до 5,5:1 при мінімальному вмісті води 72,0% мас. і максимальному вмісті води 91,0 мас. % у лікарській формі для парентерального застосування. При розробці композиції цього варіанту лікарської форми для парентерального введення авторами проводився контроль властивостей по тим же параметрам. Дані наведені в таблиці 6. 25 93529 26 27 93529 28 При порівнянні з прототипом у фармакокінетичному експерименті виявилося, що максимальна концентрація активної речовини (вимірювана по акридиновому компоненту) у плазмі крові після введення лікарської форми, що заявляється, для парентерального введення досягається швидше, значення максимальної концентрації вище, а основні біологічні/фармакологічні відповіді значно інтенсивніше (у 1,5-2 рази), ніж у прототипу. Таким чином, як варіанти лікарського препарату, що заявляється, авторами додатково заявляються лікарські форми для парентерального введення при наступному співвідношенні компонентів: І: суміш 9-оксоакридин-10-іл оцтової кислоти з 1-дезокси-1-(етиламіно)-В-глюцитолом при масовому їх співвідношенні від 1,2:1 до 1:1,1: 9,0 - 28,0 мас. %; вода для ін'єкцій - інше. II: суміш N-(1-дезокси-D-глюцитол-1-іл)-N-етил амоній 9-оксоакридин-10-ілацетату з 1-дезокси-1 (етиламіно)-D-глюцитолом при масовому співвідношенні компонентів суміші від 220 : 1 до 5,5:1: 9,0 - 28,0 мас. %; вода для ін'єкцій - інше. Винахід ілюструється наступними прикладами: Приклад 1. Синтез сполук, що заявляються. А. У колбу, обладнану зворотним холодильником і мішалкою, вносять 25,3 г 9-оксоакридин-10 оцтової кислоти, 40 мл дистильованої води і 0,1 моль (20,1 г) 1-дезокси -1 - (етиламіно)-Dглюцитолу інтенсивно перемішуючи. Суміш кип'ятять протягом 25-30 хв, охолоджують до кімнатної температури та доливають при енергійному перемішуванні 100 мл ацетону. Осад, що випав, відфільтровують, промивають 50 мл абсолютного етанолу і сушать при 60 °С під вакуумом протягом 1 години й одержують, відповідно обраному 1- алкіламіно-1-дезоксиполіолу: Тепература плавлення 130-133 °С. Б. 103,3 г 1-дезокси -1 - (пропіламіно)-Lгалактитолу розчиняють у 200 мл води та вносять у розчин при перемішуванні (до повного розчинення) порціями 125,3 г. подрібненої 9-оксоакридин-10 оцтової кислоти. Додають 1000 мл абсолютного етанолу. Осад, що випав, відфільтровують, промивають на фільтрі 150 мл абсолютного етанолу і сушать при 60 °С під вакуумом протягом 1 години, одержують, відповідно обраному 1- алкіламіно-1дезоксиполіолу: 29 93529 30 Температура плавлення 127-130 °С. В. У колбу, обладнану зворотним холодильником вносять 100 г 9-оксоакридин-10-оцтової кислоти та 150 мл води, потім, при інтенсивному перемішуванні додають 93,6 г, 1-дезокси -1 (бутиламіно)-D-манітолу. Одержану суміш кип'ятять протягом 20 хв до повного розчинення компонентів. Розчин охолоджують до 20 - 22 °С і змішу ють з 400 мл ацетону. Колбу з осадом, що випав, витримують при температурі талого льоду (0 - 1 С°) протягом 4 годин. Потім осад відфільтровують, промивають на фільтрі 40 мл охолодженого ацетону та висушують у вакуумі при 60 °С і одержують, відповідно обраному 1- алкіламіно-1дезоксиполіолу: Температура плавлення 126-129 °С. Аналогічним чином одержують солі 9оксоакридин-10 оцтової кислоти та D- і Lізомерних варіантів відповідних обраних 1алкіламіно-1-дезоксиполіолів: N-(1-дезокси-D-глюцитол-1-іл)-N-пропіламоній 9-оксоакридин-10-ілацетат (4); N-(1-дезокси-D-глюцитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат (5); N-(1-дезокси-D-галактитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат (6); N-(1-дезокси-D-галактитол-1-іл)-Nпропіламоній 9-оксоакридин-10-ілацетат (7); N-(1-дезокси-D-галактитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат (8); N-(1-дезокси-D-манітол-1-іл)-N-етиламоній 9оксоакридин-10-ілацетат (9); N-(1-дезокси-D-манітол-1-іл)-N-пропіламоній 9оксоакридин-10-ілацетат (10); N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9оксоакридин-10-ілацетат (11); N-(1-дeзoкcи-D-глюцитoл-1-iл)-N-пpoпiлaмoнiй 9-oкcoaкpидин-10-iлaцeтaт (12); N-(1-дезокси-D-глюцитол-1-іл)-N-бутиламоній 9-оксоакридин- 10-ілацетат (13); N-(1-дезокси-D-галактитол-1-іл)-N-етиламоній 9-оксоакридин-10-ілацетат (14); N-(1-дезокси-D-галактитол-1-іл)-N-бутиламоній 9-оксоакридин-10-ілацетат (15); N-(1-дезокси-D-манітол-1-іл)-N-етиламоній 9оксоакридин-10-ілацетат (16); N-(1-дезокси-D-манітол-1-іл)-N-пропіламоній 9оксоакридин-10-ілацетат (17); N-(1-дезокси-D-манітол-1-іл)-N-бутиламоній 9оксоакридин-10-ілацетат (18); Вихід одержаних сполук складає 96-99 %. Одержані в сухому виді солі являють собою світложовті кристалічні порошки, гігроскопічні, добре розчинні у воді та полярних розчинниках, мало розчинні або нерозчинні в хлороформі й інших неполярних розчинниках. Хроматографічна чистота одержаних сполук складає 97-99%. Приклад 2. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти і 1-алкіламіно 1 -дезоксиполіолу. 31 У 300 мл води для ін'єкцій вносять 100,0 г дрібнокристалічної 9-оксоакридин-10-оцтової кислоти та при інтенсивному перемішуванні вносять 82,6 г солюбілізатору - 1-дезокси -1 - (етиламіно) -Dглюцитолу. Суміш перемішують протягом 2 годин при кімнатній температурі до повного розчинення компонентів. Потім доводять об'єм розчину до 1100 - 1200 мл водою для ін'єкцій. Потім у розчин вводять ще 1-дезокси -1 -(етиламіно) -D-глюцитол невеликими порціями, контролюючи кислотність розчину до рН розчину до 7,4-7,8, а об'єм розчину доводять до 1400 мл водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл. Одержаний розчин містить 12,5 мас. % 9-оксоакридин-10оцтової кислоти, 10,5 мас. % 1-дезокси-і(етиламіно) -D-глюцитолу й 77 мас. % води для ін'єкцій. Приклад 3. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та 1-алкіламіно 1-дезоксиполіолу. У 80 літрів води для ін'єкцій поміщають 12,5 кг дрібнокристалічної 9-оксоакридин-10-оцтової кислоти та при інтенсивному перемішуванні вносять порціями 110,3 кг солюбілізатора - 1-дезокси -1 (пропіламіно)-D-глюцитолу. Суміш перемішують протягом 2 годин при кімнатній температурі до повного розчинення компонентів. Потім доводять об'єм розчину до 90 л водою для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,8 шляхом додаткового введення триоксиметиламінометану (трометаміну) невеликими порціями, а об'єм розчину доводять до 100 л водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 12,5 мас. % 9оксоакридин-10- оцтової кислоти, 11,03 мас. % 1дезокси -1 - (пропіламіно)-D-глюцитолу, 0,05 - 0, 1% триоксиметиламінометану (трометаміну) та інше - вода для ін'єкцій. Приклад 4. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину сіль, утворену 9-оксоакридин10- оцтовою кислотою та 1-алкіламіно 1дезоксиполіолом. 90 г N-(1-дезокси-L-галактитол-1-іл)-Nпропіламоній 9-оксоакридин-10-ілацетату розчиняють у 800 мл води для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,6 шляхом додаткового введення -діетаноламіну невеликими порціями, а об'єм розчину доводять до 1000 мл водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 9,0 мас. % 9 N-(1-дезокси-L-галактитол-1-іл)-Nпропіламоній 9-оксоакридин-10-ілацетату, 0,02 - 0, 5% -діетаноламіну й інше - вода для ін'єкцій. Приклад 5. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та 1-алкіламіно 1-дезоксиполіолу. У 70 літрів води для ін'єкцій поміщають 12,5 кг дрібнокристалічної 9-оксоакридин-10- оцтової кислоти та при інтенсивному перемішуванні вносять 93529 32 порціями 23,4 кг солюбілізатора - 1-дезокси -1(бутиламіно)-D-глюцитолу. Суміш перемішують протягом 2 годин при кімнатній температурі до повного розчинення компонентів. Об'єм розчину доводять до 100 л водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 12,5 мас. % 9-оксоакридин10- оцтової кислоти, 23,4 мас. % 1-дезокси -1 (бутиламіно)-D-глюцитолу, й інше - вода для ін'єкцій. Приклад 6. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та двох різних 1-алкіламіно -1дезоксиполіолів. У 70 літрів води для ін'єкцій поміщають 4,85 кг дрібнокристалічної 9-оксоакридин-10- оцтової кислоти і при інтенсивному перемішуванні вносять порціями 4,16 кг суміші солюбілізаторів -1-дезокси -1 - (етиламіно)-D-глюцитолу та 1-дезокси -1-( пропіламіно)-D-глюцитолу з молярним співвідношенням компонентів суміші солюбілізаторів 1:1. Усі компоненти перемішують протягом 2 годин при кімнатній температурі до повного розчинення. Потім доводять об'єм розчину до 90 л водою для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,6 шляхом додаткового введення гідроксиду натрію невеликими порціями, а об'єм розчину доводять до 100 л водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 4,85 мас. % 9-оксоакридин-10оцтової кислоти, 2,00 мас. % 1-дезокси -1 (етиламіно)-D-глюцитолу, 2,14 мас. % 1-дезокси -1 - (пропіламіно)-D-глюцитолу, (тобто масове співвідношення компонентів суміші складає, відповідно, 2,42:1:1,06; масовий вміст суміші в препараті 9,0 %); 0,005 - 0,02% натрію гідроксиду й інше вода для ін'єкцій. Приклад 7. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та двох різних 1-алкіламіно-1дезоксиполіолів. У 700 мл води для ін'єкцій поміщають 125 г дрібнокристалічної 9-оксоакридин-10- оцтової кислоти і при інтенсивному перемішуванні вносять порціями 106 г суміші солюбілізаторів -1-дезокси 1-(пропіламіно)-D-глюцитолу та 1-дезокси -1 (етиламіно)-D-глюцитолу з молярним співвідношенням компонентів суміші солюбілізаторів 1:2. Усі компоненти перемішують і кип'ятять зі зворотним холодильником 20 хв, охолоджують до кімнатної температури і доводять об'єм розчину до 900 мл водою для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,6 шляхом введення діетиламіну невеликими порціями, а об'єм розчину доводять до 1000 мл водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 12,5 мас. % 9-оксоакридин-10оцтової кислоти, 3,7 мас. % 1-дезокси -1 (пропіламіно)-D-глюцитолу, 6,9 мас. % 1-дезокси 1-(етиламіно)-D-глюцитолу, (тобто масове співвід 33 ношення компонентів суміші складає, відповідно, 3,37:1:1,86; масовий вміст суміші в препараті 23,1 %); 0,02 - 0,06 % діетиламіну й інше - вода для ін'єкцій. Приклад 8. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш солі (утвореної 9оксоакридин-10оцтовою кислотою та 1алкіламіно -1-дезокси-поліолу) з 1-алкіламіно -1дезоксиполіолом. У 70 мл води для ін'єкцій поміщають 22,8 г N(1-дезокси-L-галактитол-1-іл)-N-етиламоній 9оксоакридин-10- ілацетату, розчиняють при інтенсивному перемішуванні. Потім доводять об'єм розчину до 90 мл водою для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,6 шляхом додаткового введення невеликими порціями 1-дезокси-1(етиламіно)-L-галактитолу, а об'єм розчину доводять до 100 мл водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 22,8 мас. % N-(1-дезокси-Dгалактитол-1-іл)-N-етиламоній 9-оксоакридин-10ілацетату, від 0,4 до 0,11 мас. % 1-дезокси-і(етиламіно) -L-галактитолу, (тобто масове співвідношення компонентів суміші складає, відповідно, від 57:1 до 207 : 1; масовий вміст суміші в препараті від 22,9 до 23,2 %), й інше - вода для ін'єкцій. Приклад 9. Приготування лікарського препарату для парентерального застосування, що містить як діючу речовину суміш N-(1-дезокси-D-глюцитол1-іл)-N-етиламоній 9-оксоакридин-10- ілацетату з 1-дезокси-1- (етиламіно)-D-глюцитолом. У 700 мл води для ін'єкцій поміщають 228,0 г N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9оксоакридин-10- ілацетату, розчиняють при інтенсивному перемішуванні. Потім доводять об'єм розчину до 900 мл водою для ін'єкцій. Вимірюють рН і доводять рН розчину до 7,4-7,6 шляхом додаткового введення невеликими порціями 1-дезокси -1(етиламіно)-D-глюцитолу, а об'єм розчину доводять до 1000 мл водою для ін'єкцій. Розчин фільтрують через стерилізуючий фільтр, розливають у стерильні ємності об'ємом 2 мл або 5 мл. Одержаний розчин містить 22,8 мас. % N-(1-дезокси-Dглюцитол-1-іл)-N-етиламоній 9-оксоакридин-10ілацетату, від 0,4 до 0,11 мас. % 1-дезокси -1(етиламіно)-D-глюцитолу, (тобто масове співвідношення компонентів суміші складає, відповідно, від 57:1 до 207 : 1; масовий вміст суміші в препараті від 22,9 до 23,2 %), й інше - вода для ін'єкцій. Приклад 10. Приготування лікарського препарату для місцевого застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та 1-алкіламіно -1-дезоксиполіолу. Змішують 8,8 г 1-дезокси -1-(пропіламіно)-Lманітолу та 10,00 г 9-оксоакридин-10- оцтової кислоти, розтирають суміш у ступці або гомогенізаторі, додають 50 мл води, 130 г медичного вазеліну, 0,2 г Твіну 20, додають консервант натрію бензоат 0,04 г та емульгують компоненти у високошвидкісному міксері до одержання однорідного крему. Одержаний крем, що містить 5 мас. % 9оксоакридин-10- оцтової кислоти і 4,4 мас. % 1 93529 34 дезокси -1- (пропіламіно)-L-манітолу розфасовують у банки або туби. Приклад 11. Приготування лікарського препарату для місцевого застосування, що містить як діючу речовину сіль, утворену 9-оксоакридин-10оцтовою кислотою та 1-алкіламіно -1дезоксиполіолом. 9,1 г N(і-дезокси-D-глюцитол-і-іл)-Nетиламоній 9-оксоакридин-10-ілацетату ретельно змішують з 89,9 г 1,2 - пропіленгліколю та вносять до 0,15 % консерванту метилпарабену. Одержаний рідкий лінімент, що містить 9,1 г (9,1 мас. %) N-(1-дезокси-D-глюцитол-1-іл)-N-етиламоній 9оксоакридин-10- ілацетату, (що відповідає 5 мас. % залишку 9-оксоакридин-10- оцтової кислоти), розфасовують по флаконах 5-10 мл, стерилізують автоклавуванням при тиску 1 атм. і 120 °С 20 хвилин, стерильно закупорюють гумовими пробкам і, потім, алюмінієвими ковпачками. Приклад 12. Приготування лікарського препарату для перорального введення, що містить як діючу речовину суміш солі (утвореної 9оксоакридин-10оцтовою кислотою та 1алкіламіно-1-дезоксиполіолом) з 1-алкіламіно 1дезоксиполіолом. 278 г N-(1-дезокси-D-глюцитол-1-іл)-Nетиламоній 9-оксоакридин-10-ілацетату та 32,6 г 1дезокси -1 - (етиламіно)-D-глюцитолу змішують і гранулюють у грануляторі, додаючи розчин метилцелюлози. Після просівання гранулят опудрюють стеаратом магнію і таблетують одержану масу, одержуючи 970 ядер таблеток. Поверхню одержаних ядер таблеток покривають за допомогою емульсії, що містить 13 мас. % сополімеру метакрилату та етакрилату й 7 мас. % 1,2- пропіленгліколю. Маса покриття складає 0,015 - 0,020 г на кожне ядро. У результаті одержують таблетки, кожна з яких містить 0,28 г N-(1-дезокси-L-глюцитол-1-іл)N-етиламоній 9-оксоакридин-10-ілацетату, 0,03 г 1дезокси -1- (етиламіно)-D-глюцитолу (тобто, масове співвідношення компонентів суміші, відповідно, 933:1) і 0,004 г метилцелюлози та стеарату магнію (сумарно) й 0,015-0,020 г кишечнорозчинного покриття. Приклад 13. Приготування лікарського препарату для перорального застосування, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та 1-алкіламіно -1-дезоксиполіолу. 150 г 9-оксоакридин-10- оцтової кислоти та 160 г 1-дезокси -1 -(етиламіно)-D-глюцитолу (масове співвідношення компонентів 1:1,07) змішують і гранулюють у грануляторі, додаючи розчин метилцелюлози. Після просівання гранулят опудрюють стеаратом магнію і таблетують одержану масу, одержуючи 970 ядер таблеток. Поверхню одержаних ядер таблеток покривають за допомогою емульсії, що містить 13 мас. % сополімеру метакрилату та етакрилату і 7 мас. % 1,2 пропіленгліколю. Маса покриття складає 0,015 - 0,020 г на кожне ядро. У результаті одержують таблетки, кожна з яких містить суміш 0,15 г 9-оксоакридин-10- оцтової кислоти з 0,16 г 1-дезокси -1 (етиламіно)-Dглюцитолу (тобто сумарно суміші більше 99,9% по масі в лікарському препараті, масове співвідношення компонентів суміші, відповідно, 1:1,07) й 0, 35 004 г метилцелюлози та стеарату магнію (сумарно) і 0,015 - 0,020 г кишечнорозчинного покриття. Приклад 14. Приготування лікарського засобу для перорального застосування, що містить як діючу речовину суміш солі (утвореної 9оксоакридин-10- оцтовою кислотою та 1- алкіламіно-1-дезокси-поліолом) та 1-алкіламіно-1дезоксиполіолу. 278 г N-(1-дезокси-D-глюцитол-1-іл)-Nетиламоній 9-оксоакридин-10-ілацетату та 32,6 г 1дезокси -1 -(етиламіно)-D-глюцитолу змішують і гранулюють у грануляторі, додаючи розчин метилцелюлози (співвідношення компонентів суміші, відповідно, 8,52:1). Після просівання гранулят опудрюють стеаратом магнію і таблетують одержану масу, одержуючи 970 ядер таблеток. Поверхню одержаних ядер таблеток покривають за допомогою емульсії, що містить 13 мас. % сополімеру метакрилату та етакрилату і 7 мас. % 1,2- пропіленгліколю. Маса покриття складає 0,015 - 0,020 г на кожне ядро. У результаті одержують таблетки, кожна з яких містить 0,28 г N-(1-дезокси-Lглюцитол-1-іл)-N-етиламоній 9-оксоакридин-10ілацетату, 0,03 г 1-дезокси -1 -(етиламіно)-Dглюцитолу (сумарно компонентів суміші в лікарському препараті близько 99,9% по масі) та 0, 004 г метилцелюлози і стеарату магнію (сумарно) й 0,015 - 0,020 г кишечнорозчинного покриття. Приклад 15. Приготування лікарського препарату для перорального застосування, що містить як діючу речовину суміш різних солей, (утворених 9-оксоакридин-10-оцтовою кислотою та 1алкіламіно-1-дезоксиполіолами) з 1-алкіламіно-1дезоксиполіолом. 143,4 г N-(1-дезокси-L-манітол-1-іл)-Nпропіламоній 9-оксоакридин-10- ілацетату, 147,7 N-(1-дезокси-D-галактитол-1-іл)-N-бутиламоній 9оксоакридин-10 -ілацетату, 32,6 г 1-дезокси -1 (етиламіно)-D-глюцитолу змішують (тобто масове співвідношення компонентів суміші, відповідно, 4,38:4,5:1) та гранулюють у грануляторі, додаючи розчин метилцелюлози. Після просівання гранулят опудрюють стеаратом магнію і таблетують одержану масу, одержуючи 970 ядер таблеток. Поверхню одержаних ядер таблеток покривають за допомогою емульсії, що містить 13 мас. % сополімеру метакрилату та етакрилату і 7 мас. % 1,2- пропіленгліколю. Маса покриття складає 0,015-0,020 г на кожне ядро. У результаті одержують таблетки, кожна з яких містить 0,14 г N-(1дезокси-L-манітол-1-іл)-N-пропіламоній 9оксоакридин-10-ілацетату, 0,15 N-(1-дезокси-Dгалактитол-1-іл)-N-бутиламоній 9-оксоакридин-10ілацетату, 0,03 г 1-дезокси -1 -(етиламіно) -Dглюцитолу (сумарно компонентів суміші в лікарському препараті близько 99,9% по масі) та 0, 004 г метилцелюлози і стеарату магнію (сукупно) й 0,015-0,020 г кишечнорозчинного покриття. Приклад 16. Приготування лікарського препарату для перорального застосування, що містить як діючу речовину суміш солі (утвореної 9оксоакридин-10-оцтовою кислотою та 1алкіламіно-1-дезоксиполіолом) з 9-оксоакридин10- оцтовою кислотою та з 1-алкіламіно-1дезоксиполіолом. 93529 36 198 г N-(1-дезокси-L-манітол-1-іл)-Nпропіламоній 9-оксоакридин-10- ілацетату, 1 г 9оксоакридин-10- оцтової кислоти, 1 г 1-дезокси -1 (етиламіно)-D-глюцитолу змішують (тобто масове співвідношення компонентів суміші, відповідно, 198 : 1:1) і гранулюють у грануляторі, додаючи розчин метилцелюлози. Після просівання гранулят опудрюють кальцію стеаратом, додають 800 г лактози, перемішують та суміш капсулюють по 0,5 г у кожну капсулу. У результаті одержують капсули, кожна з яких містить 0,1 г діючої речовини (сумарно компонентів суміші в лікарському препараті близько 20% по масі) близько 0,4 г лактози і 0, 004 г метилцелюлози і стеарату кальцію (сукупно). Приклад 17. Одержання лікарського препарату у виді супозиторіїв для ректального або інтравагінального введення, що містить як діючу речовину суміш 9-оксоакридин-10- оцтової кислоти та 1алкіламіно -1-дезоксиполіолу. 25 г дрібнокристалічної 9-оксоакридин-10- оцтової кислоти змішують з 21 г 1-дезокси -1 (етиламіно)-D-глюцитолу й одержану суміш вводять у розплавлену при 40 градусах основу для супозиторіїв Вітепсол (Witepsol) H15 масою 104 г. Одержану композицію в гарячому виді гомогенізують і, потім, формують та прохолоджують, одержуючи супозиторії торпедоподібної форми, масою 1,5 г. Вихід 96 - 98 %. Одержують супозиторії масою 1,5 г для ректального або інтравагінального введення наступного складу: 9-оксоакридин-10оцтової кислоти - 0,25 г; -дезокси -1 -(етиламіно)D-глюцитолу - 21 г (співвідношення компонентів суміші, відповідно 1:1,19, сумарно суміші в лікарському препараті 30,6 %); основи для супозиторіїв Вітепсол (Witepsol) Н15 - інше. Дослідження активності/ефективності сполук, що заявляються, та лікарського препарату, що заявляється Приклад 18. Проникнення/зв'язування сполук, що заявляються, з різними типами клітин. Для вивчення швидкості проникнення/зв'язування сполук, що заявляються, у клітини людини, використовували лімфоцити периферичної крові людини (ЛПК), клітини, лінія раку грудей людини MD -1 , клітини гепатоми людини HepG -2. Перед внесенням солей, що заявляються, прототипу та (для порівняння) натрієвої солі 9оксоакридин-10-оцтової кислоти, відповідно MD -1 клітини (104 клітин/лунку) культивували в 96 лунковому планшеті протягом 48-годин в DMEM повному середовищі. HepG -2 клітини (5 х 10 4 клітин/лунку) культивували протягом 96-ти годин у DMEM повному середовищу. ЛПК (5 х 105 клітин/лунку) культивували протягом 72-х годин у повному середовищі DMEM. В культуральну рідину вносили розчин сполук у повному середовищі DMEM для одержання кінцевої концентрації відповідної сполуки 1 М. Через 15 хвилин інкубації клітини відмивали дворазово фізіологічним розчином вимірювали флюоресценцію солей, що проникли/зв'язалися, на планшетному флюоресцентному рідері Lambda Fluoro 320 Е зі збудливою хвилею 254 нм та хвилею детекції 510 нм (визначення іона 9-оксоакридин-10- оцтової кислоти). Результати експерименту були наведені в таблиці 37 2. З даних таблиці видно, що кількість заявлених солей, що проникли та/або зв'язалися з клітиною, у 5 -7 разів вище, ніж прототипу або солі 9оксоакридин-10- оцтової кислоти з лужним металом. При цьому кількість препарату усередині клітини майже експоненційно росте зі збільшенням довжини аліфатичного радикала-замісника у атома азоту амінної групи 1-алкіламіно -1дезоксиполіолу. Таким чином, сполуки, що заявляються, проникають у клітини значно швидше та/або надійніше зв'язуються зі структурами клітини, ніж прототип. Приклад 19. Проникнення сполук, що заявляються, у тканини при місцевій аплікації в інертному носії. Місцева аплікація сполук, що заявляються, показала, що діюча речовина проникає в тканини швидше й глибше, ніж для прототипу. Швидкість та глибина проникнення сполук, що заявляються, у тканини при місцевому нанесенні досліджувалася на пацюках масою 250-280 г. У тварин виголювалися 2 ділянки шкіри, розміром 1x2 см. по обидва боки від середини спини. На одну ділянку наносився лікарський засіб, що заявляється, у розчині інертного носія - 1,2 - пропіленгліколю, а на іншу (симетричну) ділянку тієї ж тварини наносився прототип у тім носії. Концентрація нанесеного прототипу і лікарського засобу, що заявляється, нанесених на одну тварину була однаковою (від 1 до 10 % у різних серіях експериментів). Ділянки шкіри з нанесеними препаратами прикривали шматочками поліетиленової плівки для запобігання висихання та вилизування нанесених лік твариною. Через 2 або 4 години після нанесення препаратів тварин забивали ефірним наркозом, залишки нанесених препаратів відразу ретельно видалялися 96 % спиртом. Із середини ділянок, на які були нанесені речовини, вирізували шматочок шкіри площею 1 см. кв. Екстрагували акридиновий компонент (9-оксоакридин-10- оцтову кислоту) шляхом гомогенізації вирізаної тканини в хлороформі з наступним центрифугуванням. Вимірювали вміст 9-оксоакридин-10- оцтової кислоти в надосаді методом високоефективної рідинної хроматографії. Результати дослідження були наведені в таблиці 3. При аналізі результатів, наведених у таблиці 3, 93529 38 видно, що сполуки, що заявляються, проникають у шкіру в 2-3 рази більшій кількості, ніж прототип. Приклад 20. Інтерфероніндукуюча активність сполук, що заявляються, (у культурі мононуклеарів периферичної крові людини, збагаченої дендритними клітинами). Інтерфероніндукуючу активність сполук, що заявляються, у порівнянні з прототипом вивчали в культурі мононуклеарів периферичної крові людини, збагаченої фракцією дендритних клітин, відповідальних за продукцію інтерферонів типу І. Мононуклеари периферичної крові людини від 20 різних здорових донорів (n = 20) виділяли з цільної донорської крові (з додаванням ЕДТА) шляхом центрифугування в градієнті щільності в системі «фікол : верографін». Клітини двічі відмивали розчином Хенкса. Відмиті мононуклеари периферичної крові людини ресуспедували у повному середовищі РПМІ 1640 з додаванням HEPES-буферу, натрію пірувату, L- глютаміну, та інактивованої телячої сироватки. Одержані клітини збагачували дендритними клітинами шляхом імуномагнітної сепарації. Для цього клітини інкубували з моноклональними антитілами, що специфічно зв'язуються з дендритними клітинами (антитіла зв'язуються зі специфічним для дендритних клітин лецитином), а потім збирали клітини на колонку Miltenyi MS (використовували BDCA-4 Cell Isolation Kit (Miltenyi Biothec)). Після процедури збагачення частка інтерферонпродукуючих (дендритних) клітин зростала приблизно в 20 разів. Розведені у тому ж середовищі (РПМІ 1640, але без сироватки) клітини в концентрації 1,5 х 106 в 1 мл, засівали в 24-лункові плоскодонні планшети по 1 мл у лунку і культивували в термостаті при температурі 37 °С протягом 24 годин або зі сполуками, що заявляються, або з прототипом, або без таких (контроль=спонтанна продукція цитокінів). Після цього клітини центрифугували, надосадову рідину відділяли та визначали в ній за допомогою імуноферментного аналізу (ELISA) рівень інтерферонів, зокрема, гамма-інтерферону, альфа-інтерферону, омега-інтерферону. Усі сполука (або прототип) додавалися в середовище культивування до концентрації 30 мікромоль/мл. Результати дослідження наведені в таблиці 7. 39 Із даних таблиці видно, що сполуки, які заявляються, виявляють набагато більшу інтерфероніндукуючу активність, ніж прототип, а при збільшенні довжини аліфатичного ланцюга радикала замісника в атома азоту аміногрупи іона (1алкіламіно -1-дезоксиполіолу) в ряду (етил, пропіл, бутил) інтерферон індукуюча активність збільшується. Крім того, прототип не проявив ніякого впливу на рівень продукції омега-інтерферону. Також зненацька виявилося, що L та D ізомери тієї самої речовини мають різну активність у відношенні індукції інтерферонів. Так, наприклад, сполука 12, (L - ізомер) значно збільшувала рівень продукції гамма-інтерферону, ніж її D -ізомерний аналог (сполука 4). У відношенні інтерферонуомега залежність в окремих випадках була зворотною. Сполука 1 (D - ізомер) індукувала більшу кількість інтерферон-омега, ніж її L - ізомерний варіант (сполука 11). Таким чином сполуки, що заявляються, мають набагато більш виражену інтерфероніндукуючу активність, ніж прототип, а спектр індукованих ними інтерферонів має інший профіль, ніж спектр інтерферонів, індукованих прототипом. Приклад 21. Цитокініндукуюча активність сполук, що заявляються (у культурі мононуклеарів периферичної крові людини). Цитокініндукуючу активність сполук, що заявляються, у порівнянні з прототипом вивчали в культурі мононуклеарів периферичної крові людини. Експерименти проводилися на мононуклеарах 93529 40 крові від 20 різних здорових донорів (n = 20). Мононуклеари периферичної крові людини виділяли з цільної донорської крові (з додаванням ЕДТА) шляхом центрифугування в градієнті щільності Histopaque 1077. Клітини двічі відмивали розчином Хенкса. Відмиті мононуклеари периферичної крові людини, розведені в середовищі 199 у концентрації 1,5 х106 у 1 мл, засівали в 24-лункові плоскодонні планшети по 1 мл у лунку та культивували в термостаті при температурі 37°С протягом 24 годин або зі сполуками, що заявляються, або з прототипом, або без таких (контроль= спонтанна продукція цитокінів). Після інкубації надосадову рідину збирали і визначали в ній за допомогою імуноферментного аналізу (ELISA) рівень цитокінів, зокрема, інтерлейкіну - 2, (ІЛ-2), інтерлейкіну - 4 (ІЛ - 4), інтерлейкіну - 10 (ІЛ - 10). В окремій серії експериментів вивчалася здатність сполук, що заявляються, (у порівнянні з прототипом) перешкоджати індукції протизапального цитокіну фактора некрозу пухлин - альфа (ФНП -альфа) у відповідь на синтетичний олігодезоксинуклеотид CpG-ODN (імітуючий контакт клітин з бактеріями). CpG-ODN вносився в середовище культивування до концентрації 19 мкг/мл одночасно з досліджуваними сполуками. ФНП - альфа визначали в культуральній рідині також методом ELISA. Через 24 години інкубації всі сполуки, що заявляються, (або прототип, відповідно) додавалися в середовище культивування до концентрації 30 мкмоль/мл. Результати дослідження наведені в таблиці 8. 41 Із даних таблиці видно, що сполуки, що заявляються, виявляють набагато більшу цитокініндукуючу активність у відношенні окремих протизапальних інтерлейкінів, а при збільшенні довжини аліфатичного ланцюга радикала замісника у атома азоту аміногрупи іона 1-алкіламіно -1дезоксиполіолу в ряду «-етил; -пропіл; -бутилу» цитокініндукуюча активність збільшується. Прототип, на відміну від сполук, що заявляються, проявив слабкий гальмуючий вплив на CpG-ODNіндукований рівень фактора некрозу пухлини альфа. Також зненацька виявилося, що L та D ізомери тієї самої речовини мають різну активність у відношенні індукції визначених цитокінів. Так, наприклад, сполука 11, (L - ізомер) збільшувала рівень продукції інтерлейкіну - 10 тільки на 2112 пг/мл від спонтанної продукції, у той час як її D ізомерний варіант (сполука 1) збільшувала рівень продукції цього ж цитокіну на 2927 пг/мл. У відношенні інтерлейкіну - 2 ситуація була зворотною. Сполука 11 (L - ізомер) індукувала набагато більшу кількість інтерлейкіну - 2, ніж її D - ізомер (сполука 1). Таким чином сполуки, що заявляються, мають набагато більш виражену цитокініндукуючу активність у відношенні протизапальних цитокінів та більшу здатність пригнічувати синтез протизапальних цитокінів, ніж прототип, а спектр індукованих ними цитокінів має інший профіль, ніж спектр цитокінів, індукованих прототипом. Приклад 22. Імуномодулююча активність сполук, що заявляються 93529 42 Імуномодулюючу активність сполук, що заявляються, досліджували в порівнянні з прототипом при однократному внутрішньовенному введенні 0,2 М водних розчинів пацюкам лінії Вістар з розрахунку 8,0х10-4 М/кг маси тіла. Оцінювалися вихідні параметри імунної системи, а також після впливу сполук: фагоцитарну активність нейтрофілів периферичної крові, киснезалежний метаболізм нейтрофілів периферичної крові (на 3 день), рівень сироваткового інтерферону (через 4 години), кількість CD 4 (+) та CD 8 (+) лімфоцитів (на 3 день). Киснезалежний метаболізм нейтрофілів оцінювали за допомогою люмінол-залежної хемілюмінесценції (ХЛ). Виміри інтенсивності ХЛ проводилися на біохемілюмінометрі. Киснезалежний метаболізм нейтрофілів крові оцінювали по Ісум. сумарній кількості імпульсів, що випускаються 1 х 103 нейтрофілами протягом усього часу реєстрації (30 хв) ХЛ -відповіді. Рівень сироваткового інтерферону визначали біологічним методом (індекс захисту клітин у культурі від ушкодження вірусом Сендай) у порівнянні зі стандартним препаратом інтерферону, приводячи потім значення активності до міжнародних одиниць (МО). Відносний вміст CD 4(+) та CD 8(+) лімфоцитів визначали за допомогою моноклональних антитіл на проточному цитофлюориметрі. Також визначали зміну проліферативної відповіді культури клітин цільної крові на стандартний мітоген (фітогемааглютинін) по ступеню (кратності) зміни введення в ДНК клітин [Н3]тимідину при інкубації протягом 1 години при 37 °С. Результати дослідження наведені в таблиці 9. 43 З аналізу результатів видно, що сполуки, що заявляються, значно більш активні, ніж прототип по впливу на усі ланки імунітету: рівень індукованого інтерферону значно вище, відбувається більш значне збільшення співвідношення Т- хелперів/Т -супресорів та проліферативної відповіді клітин білої крові на мітоген. Крім того, установлена позитивна кореляція між інтенсивністю відповіді показників імунітету і довжиною аліфатичного радикала - замісника у атома азоту аміногрупи 1 алкіламіно -1-дезоксиполіолу. 93529 44 Приклад 23. Пряма противірусна активність сполук, що заявляються, (проти різних вірусів у культурах клітин) Противірусна активність сполук, що заявляються, у порівнянні з прототипом була вивчена в різних системах in vitro (таблиця 10). Сполуки, що заявляються, або прототип, відповідно, вносилися у відповідну культуру на 2-7 день після зараження культури вірусом. Усі порівнювані сполуки вносилися в середовище культивування в окремих експериментах з певним вірусом у еквімолярних кількостях. 45 Із даних таблиці 10 випливає, що на відміну від прототипу сполуки, що заявляються, мають більш високу ефективність, а також мають інший спектр противірусної дії, що, зокрема, виражається в тому, що вони (на відміну від прототипу) значно сильніше впливають на безоболонкові віруси. При цьому відзначається збільшення противірусної активності в ряду солей, що заявляються, при збільшенні довжини аліфатичного радикала замісника у атома азоту аміногрупи іона 1 -алкіламіно -1 д езоксипол іолу. 93529 46 Приклад 24. Протимікробна активність сполук, що заявляються, (на моделі експериментального мікробного сепсису). В експерименті використовували білих безпородних мишей вагою 23-25 грам. Усім групам мишей (по 10 мишей у групі) - вводили внутрівенно в ретроорбітальний синус бактерії патогенного штаму Staphylococcus aureus VT-2003R у дозі 1x1010 бактеріальних клітин на мишу. Через 2 години після інфікування внутрівенно однократно вводили досліджувані речовини. Групи з 1 по 6 одержувала 47 сполуки, що заявляються, (шифр 1, 5, 9, 2, а також їх суміші), 7-а група одержувала прототип, 8 група одержувала розчинник (воду для ін'єкцій), як група негативного контролю. Сполуки, що заявляються, (або їх суміші) та прототип вводили в однаковій 93529 48 дозі 6 мг (з розрахунку на залишок 9-оксоакридин10- оцтової кислоти) на кілограм ваги тварини. Оцінювали виживаність тварин протягом 32 годин після інфікування. Результати експерименту наведені в таблиці 11. * Всі сполуки, що заявляються, (або їх суміш - групи 5 та 6) і прототип вводили в еквімолярних кількостях, молярне співвідношення сполук, що заявляються, у сумішах (група 5 та 6) -1:1. Із аналізу даних таблиці 11 видно, що сполуки, що заявляються, та їх суміші мають набагато більш виражену протимікробну дію, ніж прототип. При цьому відзначається збільшення протимікробної активності в ряду солей, що заявляються, при збільшенні довжини аліфатичного радикала замісника у атома азоту аміногрупи іона 1- алкіламіно 1дезоксиполіолу. Крім того, деякі суміші солей, що заявляються, мають трохи більший ефект, ніж ці солі окремо. Приклад 25. Протигрибкова активність сполук, що заявляються, (на моделі експериментального грибкового сепсису). Безпородним білим мишам (по 10 тварин у групі) вводили внутрівенно суспензію культури грибів Candida Albicans, одержаних шляхом субку льтивування патогенного клінічного ізоляту в дозі LD50. На 3 -й день після інфікування мишам внутрівенно вводили порівнювані речовини. Групи з 1ої по 6 група одержувала сполуки, що заявляються, (номера сполук 6, 7, 8, 13, а також їх суміші в різному молярному співвідношенні), 7-а група одержувала прототип, 8 група одержувала розчинник (воду для ін'єкцій), як група негативного контролю. Прототип і сполуки, що заявляються, (або суміші сполук, що заявляються,) вводили в однаковій дозі 6 мг (з розрахунку на залишок 9-оксоакридин-10оцтової кислоти) на кілограм ваги тварини. Оцінювали виживаність тварин протягом 7 днів після інфікування. Результати експерименту наведені в таблиці 12. 49 93529 50 З аналізу даних таблиці 12 видно, що сполуки, що заявляються, мають набагато більш виражену протигрибкову дію, ніж прототип. При цьому відзначається збільшення протигрибкової активності в ряду солей, що заявляються, при збільшенні довжини аліфатичного радикала замісника (в ряду «-етил; пропіл; -бутил») у атома азоту аміногрупи катіона 1-алкіламіно -1дезоксиполіолу. Крім того, деякі суміші солей, що заявляються, мають трохи більший захисний ефект, ніж ці солі окремо. Приклад 26. Протипухлинна активність сполук, що заявляються, (при комбінованому лікуванні експериментальної пухлини). Дослідження проводилися на 60 мишах лінії BALB/C вагою 20 - 25 г. Штам АКАТОН (аденокарцинома тонкого кишечнику) перевивався в правий бік. На 7 день перевивання тварини були розділені на 3 групи, по 20 мишей у кожній. Пер ша група одержувала сполуки, що заявляються, розчинені у воді для ін'єкцій у дозі 10 мг/кг ваги (у розрахунку на залишок 9-оксоакридин-10- оцтової кислоти), через день, починаючи з 7 дня після перевивання пухлини внутрішньочеревно, всього 7 ін'єкцій, 2 група одержувала прототип у тій же (еквімолярній) дозі в тім же розчиннику та шляху введення. Всі тварини одержували також цитостатик циклофосфан у дозі 7 мг/кг ваги тіла, щодня, внутрішньочеревно, протягом 10 днів 3 група служила негативним контролем й одержувала розчинник (воду для ін'єкцій) по 0,4 мл на мишу щодня, внутрішньочеревно, також протягом 10 днів. Забій робили на 22 день після перевивання пухлини. Пухлину виділяли та визначали середню вагу пухлини в кожній групі тварин. Протипухлинну активність препаратів визначали по індексу гальмування росту пухлини. Індекс гальмування в кожній групі обчислювали по формулі: Для оцінки токсичності реєстрували вагу тварини до початку введення речовин та відразу після закінчення введення. Результати наведені в таблиці 13. 51 З аналізу даних, наведених у таблиці 13, видно, що сполуки, що заявляються, мають набагато більш виражену протипухлинну дію, ніж прототип, а токсичні ефекти в групах, що одержували сполуки, які заявляються (утрата маси тіла) менш виражену. Виживаність тварин у групах, що одержували сполуки, які заявляються, була значно вище, ніж у групі, що одержував прототип. При цьому спостерігався ефект посилення протипухлинної активності в ряді солей, що заявляються, паралельно зі збільшенням довжини аліфатичного радикала замісника у атома азоту аміногрупи катіона (1-алкіламіно -1-дезоксиполіолу). Приклад 27. Протипаразитарна ефективність сполук, що заявляються, (на моделі експериментального опісторхозу). Експеримент проведений на 60 золотавих хом'яках (самці вагою 100 г), інвазованих per os no 50 метацеркарій О. felineus. Починаючи з другої доби після інвазії протягом двох тижнів з інтервалом 2 дні вводили сполуки, що заявляються, у 93529 52 дозі 4 мг/кг ваги (з розрахунку на 9-оксоакридин10- оцтову кислоту) внутрішньом'язово або, відповідно, прототип у тій же дозі. Всі речовини вводили внутрішньом'язово, розчиненими у воді для ін'єкцій (0,5 мл на тварину). Негативним контролем служили тварини з опісторхозною інвазією (їм вводився розчинник - вода для ін'єкцій у тім же об'ємі), а інтактним контролем служили інтактні здорові золотаві хом'яки. Функціональну активність нейтрофілів периферичної крові оцінювали по поглинальній здатності у відношенні латексних часток діаметром 2,7 мкм (індекс Гамбургера відсоток активних клітин, індекс Райта - середня поглинальна здатність окремого нейтрофільного лейкоцита). Індикаторними показниками приживлення метацеркаріїв О. felineus рахували кількість яєць в одному грамі екскрементів тварин та кількість марит опісторхозів у печінці після декапітації золотавих хом'яків. Результати дослідження наведені в таблиці 14. 53 З аналізу даних видно, що сполуки, що заявляються, мають значно більший вплив на показники фагоцитарної активності лейкоцитів та периферичної крові, повністю пригнічують приживлюваність метацеркаріїв і, таким чином, мають значно більш високу протипаразитарну ефективність, ніж прототип. Приклад 28. Протизапальна активність сполук, що заявляються, (на моделі пригнічення запальної грануляції, викликаної підшкірною імплантацієюватних кульок). Використовувалися рандомбредні пацюки лінії Спрейг-Доулі масою 160-220 г. Під анестезією кетаміном (60 мг/кг внутрішньочеревно), дві ватних кульки масою 30 мг кожна була імплантована під шкіру пахової області пацюків. Сполуки, що 93529 54 заявляються, або прототип, відповідно, вводилися у водному розчині в дозі 20 мкмоль/кг ваги тіла тварини (тобто 5 мг/кг, з розрахунку на залишок 9-оксоакридин-10- оцтової кислоти) у 1, 2, 5, 8 днів після імплантації. Контрольна група одержувала розчинник (воду для ін'єкцій) в об'ємі 0,25 мл у тім же режимі. На 9 день тварини були забиті ефірним наркозом, ватні кульки з навколишньою гранулемою були виділені та висушені при 60 градусах Цельсія протягом 24 годин, а потім зважені. Протизапальна дія оцінювалася по здатності сполук, що заявляються, або прототипу знижувати масу грануляційної тканини та запального інфільтрату в порівнянні з такими в контрольній групі. Дані наведені в таблиці 15. 55 Із даних таблиці видно, що сполуки, які заявляються мають набагато більшу протизапальну й антисклеротичну активність, ніж прототип. Приклад 29. Радіопротективна та стреспротективна активність сполук, що заявляються, (на моделі гострої променевої хвороби, викликаної тотальним опроміненням). Використовувалися пацюки-самці лінії Вістар масою 210-230 г. Тварини були розподілені на 6 груп по 20 особин випадково. Сполуки, що заявляються, (група 1, 2, 3) або прототип (група 4) вводили тваринам за допомогою зонда в шлунок у виді водних розчинів, з розрахунку 1 ммоль/кг ваги тіла. Об'єм розчинів, що вводилися, складав 0,2 мл на 100 г ваги тварини. Групі тварин негативного контролю (негативний контроль -група 5) внутрішньошлунково вводили бідистильовану воду того ж об'єму, інша група (інтактний контроль - група 6) також одержувала дистильовану воду того ж об'єму. Опромінення здійснювали через 4 години після введення препаратів тотально на рентгенівській установці РУМ-17 у дозі 93529 56 6,5 Гр. Опроміненню піддавалися всі групи тварин, крім групи інтактного контролю. Для оцінки стреспротекторної активності сполук через 24 години після опромінення половину тварин кожної групи зважували, проводили забій тварин декапітацією, одночасно робили забір артеріальної крові, тимусу, селезінки та надниркових залоз. Стреспротективну активність сполук, що заявляються, та прототипу, оцінювали по динаміці змін відносних (стосовно маси тіла) мас селезінки, тимусу та надниркових залоз і відношенню рівня кортизолу сироватки крові до рівня інсуліну сироватки крові (на 1-у добу після опромінення). Для оцінки радіопротективної активності сполук іншу половину тварин кожної групи забивали декапітацією на 7 день після опромінення. Радіопротективну дію оцінювали по динаміці зміни показників білої крові: абсолютному числу лейкоцитів, відносній кількості лімфоцитів та рівню гемоглобіну (до 7-го дня). Результати дослідження наведені в таблиці 16. 57 93529 58 Із даних таблиці 16 видно, що сполуки, які заявляються, захищають організм від опромінення як у відношенні стресорних змін (інволюції лімфоїдних тканин, та гормональних зрушень), так і від дії ушкоджуючого опромінення на клітини крові та/або їх продукцію, у набагато більшому ступені, ніж прототип. При цьому спостерігається позитивний зв'язок між довжиною аліфатичного радикала у атома азоту катіона (1- алкіламіно -1 дезоксиполіолу) у ряді сполук, що заявляються, і ступенем їх стреспротективної/радіопротективної активності. Таким чином, сполуки, що заявляються мають набагато більшу радіопротективну та стреспротективну активність, ніж прототип. Приклад 30. Імуномодулююча ефективність лікарського препарату, що заявляється (при лікуванні імунодефіциту у хворих з важкою опіковою травмою). Імуномодулюючі властивості лікарського препарату, що заявляється, вивчені в клініці при лікуванні вторинних імунодефіцитів, обумовлених важким опіком. Під спостереженням знаходилася група з 54 хворих (23 жінки та 31 чоловік) з опіковою хворобою з важким ступенем опікової травми (площа ураження 22 % - 38 % поверхні тіла - індекс Франка від 73 до 126 од.) у віці від 28 до 43 років. На базі традиційної інтенсивної терапії (на приклад, інфузійно-трансфузійної терапії, антибактеріальної терапії, застосування препаратів, що поліпшують мікроциркуляцію і реологічну якість крові парентерального та ентерального харчування, ентеросорбції, операцій некротомії й аутодермопластики) хворим проводили лікування або лікарським препаратом (група 1), що заявляється, або прототипом (група 2), при цьому пацієнти розподілялися по групах випадково. Пацієнти обох груп були порівнянні по статі, віку та вазі опікової травми, видам та схемам проведеної традиційної терапії. Починаючи з 4 доби після травми, препарати вводили курсом за схемою 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26 добу по 250 - 500 мг (з розрахунку на 9-оксоакридин-10- оцтову кислоту) внутрівенно болюсно 1 раз на добу. Визначали абсолютну та відносну кількість Т - лімфоцитів хелперів (Тх), Т - лімфоцитів супресорів (Тс) і відношення їх кількості (Тх/Тс). Обчислювали ступінь зміни цих показників щодо норми (середніх показників здорових донорів). Дослідження імунного статусу проводили на 3 добу від моменту травми (до початку лікування лікарським препаратом, що заявляється, або прототипом) і наступного дня після закінчення курсу лікування препаратами. Дані наведені в таблиці 17. При аналізі даних видно, що лікарський препарат, який заявляється, має більшу ефектив ність, ніж прототип при меншому числі побічних ефектів. 59 Приклад 31. Протибактеріальна (протихламідійна) та імуномодулююча (імунокоригуюча) ефективність лікарського препарату, що заявляється, (у жінок із хронічними запальними захворюваннями придатків матки хламідійної етіології). Дослідження протихламідійної та імуномодулюючої активності лікарського препарату, що заявляється, проводилася у жінок із хронічними запальними захворюваннями придатків матки хламідійної етіології. Діагноз був верифікований за допомогою полімеразної ланцюгової реакції (ПЛР). Всі жінки (45 чоловік) були випадково розподілені на 3 групи по 15 чоловік у кожній. Перша група одержувала базову антибактеріальну терапію (БАТ): офлоксацин по 200 мг 2 рази в день протягом 15 днів. Другій групі на базі БАТ призначався лікарський препарат, що заявляється, у разовій дозі 250 мг (у розрахунку на 9оксоакридин-10- оцтову кислоту), третя група на базі БАТ одержувала прототип у разовій (= добовій) дозі 250 мг (у розрахунку на 9-оксоакридин10- оцтову кислоту). Обидва препарати вводилися у виді внутрім'язових ін'єкцій на 1, 2, 4, 6, 8, 11, 93529 60 14, 17, 20, 23 добу курсу (всього 10 ін'єкцій). Ефективність проведеної терапії оцінювалася по тривалості захворювання, динаміці клінічних та лабораторних показників, частоті рецидивів захворювання. Усім пацієнткам після закінчення лікування проводився лабораторний контроль виліковності за допомогою полімеразної ланцюгової реакції (ПЛР). Перший контроль - відразу після завершення лікування, а заключне контрольне дослідження (контроль етіологічного лікування) проводився наприкінці 2-го місяця після закінчення лікування. Крім того, досліджувалися імунологічні показники, з огляду на імунодефіцит, що закономірно супроводжує перебіг хламідійної інфекції. Як інтегральний показник антибактріальної фагоцитуючої активності клітинної ланки імунітету оцінювався також середній показник кількості цитоплазматичних гранул поліморфноядерних лейкоцитів (ПЯЛ) периферичної крові, що прямо відображує їх здатність до переварювання поглинених хламідій. Дані, що відображують ефективність лікування в трьох групах пацієнток наведені в таблиці 18.
ДивитисяДодаткова інформація
Назва патенту англійськоюSalts of 9-oxoacridine-10-acetic acid with 1-alkylamno-1-desoxy-polyols
Автори англійськоюSurkov Kirill Gennadievich
Назва патенту російськоюСоли и смеси 9-оксоакридин-10-уксусной кислоты c 1-алкиламино-1-дезоксиполиолами
Автори російськоюСурков Кирилл Геннадиевич
МПК / Мітки
МПК: A61P 31/12, A61P 37/02, C07H 5/00, A61K 31/435, C07D 219/00, A61P 33/00
Мітки: 1-алкіламіно-1-дезоксиполіолами, 9-оксоакридин-10-оцтової, кислоти, суміші, солі
Код посилання
<a href="https://ua.patents.su/48-93529-soli-i-sumishi-9-oksoakridin-10-octovo-kisloti-z-1-alkilamino-1-dezoksipoliolami.html" target="_blank" rel="follow" title="База патентів України">Солі і суміші 9-оксоакридин-10-оцтової кислоти з 1-алкіламіно-1-дезоксиполіолами</a>
Попередній патент: Фармацевтична композиція, що містить кристалічну модифікацію гідрохлориду донепезилу, та спосіб отримання з неї комприматів
Наступний патент: Композиція з пролонгованим вивільненням активної речовини, спосіб її одержання та застосування
Випадковий патент: Захисний оптичний компонент з ефектом пропускання, виготовлення такого компонента і захищений документ, забезпечений таким компонентом