Штам васіllus suвтіlіs – активний антагоніст збудників склероми людини
Номер патенту: 25671
Опубліковано: 30.10.1998
Автори: Лисецька Марина Володимирівна, Бойко Надія Володимирівна
Формула / Реферат
Штам Bacillus subtilis №092 - активний антагоніст збудників склероми людини.
Текст
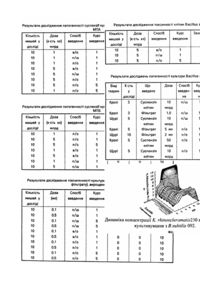
Винахід відноситься до галузі мікробіології, зокрема до розробки біопрепаратів медичного призначення і може бути використаний для профілактики і терапії склероми у людей. Відомі способи використання деяких культур живих мікробів-антагоністів - Serratia marcescens, Pseudomonas spp. в якості терапевтичного протисклеромного засобу (Губина К.М. Некоторые микробы-антагонисты бактерий капсульной группы / Львовск. мед. институт. 7 - ая научн. конф. по склероме. - Львов, 1951. - С.35 - 36; Михайловский С.В., Музыка М.М., Бариляк Р.А., Губина К.М. Лечение склеромы дыхательных путей антибиотиками и микробами-антагонистами // Вестник оториноларингологии. -1953. - №1. - С.7 11), проте вони не знай-шли впровадження в широку медичну практику. Найбільш суттєвим їх недоліком є, насамперед, належність вказаних бактерій до групи умовно-патогенних мікроорганізмів. Є дані про ефективне застосування бактисубтилу, біоспорину, гінеспорину, споробактерину, флонівіну, ентерогерміну тощо в якості засобів лікування дисбактеріозів, гострих кишкових інфекцій, алергій та інших патологічних процесів у людей і тварин, викликаних патогенними та умовно-патогенними бактеріями (Смирнов В.В., Резник С.Р., Сорокулова И.Б., Вьюницкая В.А. Дискуссионные вопросы создания и применения бактериальных препаратов для коррекции микрофлоры теплокровных // Микробиол. журн. 1992. - 54. - №6. - С.82 - 94; Смирнов В.В., Резник С.Р., Вьюницкая В.А., Сорокулова И.В., Самгородская Н.В., Тофан А.В. Современные представления о механизмах лечебнопрофилактического действия пробиотиков из бактерий рода Bacillus // Микробиол. журн. - 1993. 55. - №4. - С.92 - 112). Переваги застосування пробіотиків є їх абсолютна нешкідливість для організму теплокровних та широкий спектр їх антибактеріальної дії. Однак ні один із відомих препаратів не характеризується антагоністичною активністю стосовно Klebsiella rhinoscleromatis - збудника склероми людей. Найбільш близьким до запропонованого є штам B.subtilis ВКПМ №B-5225 (Авторское свидетельство СССР №1779692 от 08.08.92 - прототип). Даний штам B.subtilis ВКПМ №B-5225 характеризується високою антагоністичною активністю стосовно збудників гострих клебсієльозів та призначений для використання в медицині та ветеринарії для профілактики і лікування дисбактеріозів та гострих кишкових захворювань, викликаних Klebsiella pneumoniae. Відоме успішне застосування даного штаму в випадку генералізованого гострого септичного клєбсієльозу у лабораторних тварин. Однак, вказаний штам характеризується незначною інгібуючою активністю стосовно K.rhinoscleromatis лише в дослідах in vitro, a використання його для профілактики і терапії експериментальної склероми, викликаної K.rhinoscleromatis (локальний хронічний процес) не дає ефекту. Завдання винаходу полягає у розширенні спектру антимікробної дії культур B.subtilis, а саме, у встановленні протисклеромної ефективності штаму B.subtilis №092. Поставлене завдання досягається таким чином, що згідно винаходу в якості активного антагоністу збудників склероми людини використовують штам B.subtilis №092. Скринінг культур бацил здійснювали серед 200 штамів спорових аеробних бактерій музею мікробних культур Ужгородського державного університету та Інституту мікробіології і вірусології Національної академії наук України, ізольованих із грунту та шлунково-кишкового тракту (ШКТ) молодняку сільськогосподарських тварин. Антисклеромну ефективність щодо клінічних культур K.rhinoscleromatis (50 штамів) - збудників склероми людини визначали методом відстроченого антагонізму (Егоров Н.С. Основы учения об антибиотиках. - М.: Высш. шк., 1986. - 448с.) на сусло-агарі (СА), щільному Гаузе №2 (Методические рекомендации по выделению и идентификации бактерий рода Bacillus из организма человека и животных. - К., 1983. - 50с.), в умовах сумісного культивування (експерименти in vitro), а також на білих безпородних мишах, відтворюючи локальну легеневу та гостросептичну моделі склероми (експерименти in vivo). Відібраний штам B.subtilis №092 ізольовано із ШКТ здорового теляти 10-денного віку. Оптимальними умовами культивування зазначеного штаму є вирощування його на середовищі Гаузе №2 та СА. Штам B.subtilis №092 має такі видові ознаки: це грампозитивні аеробні палички, що продукують каталазу. Добре ростуть на м'ясопептонному агарі (МПА), СА, середовищі Громико (МПА : СА; 1 : 1), картопляному агарі. На МПА утворюють складчасті колонії в'язкої консистенції тілесного кольору, краї колоній неправильної форми. На картопляному агарі колонії світло-тілесного кольору, блискучі, в'язкої консистенції, краї рівні. На середовищі Громико колонії тілесного кольору, складчасті з опуклим центром,краї розсічені, консистенція в'язка. У мазках 18-годинної культури спостерігаються паличковидні клітини, 1,9 ´ 0,5мкм, розташовані поодиноко, попарно, рідко ланцюжками. Клітини рухомі. При спороутворенні клітина не роздувається. Спори еліпсовидні, 0,9 ´ 0,5мкм, у клітині розташовані центрально. Культура ферментує глюкозу, арабінозу, ксилозу, мальтозу, галактозу, лактозу, манніт, сахарозу з утворенням кислоти; не розкладає дульцит, рамнозу; дає позитивну реакцію Фогес Проскауера, гідролізує крохмаль, желатину, не гідролізує сечовину; утилізує цитрат; не використовує пропіонат. Культура не росте в анаеробних умовах, не утворює включення полі-bоксимасляної кислоти на середовищі МПА з клюкозою; не володіє лецитиназною активністю, індол, сірководень не утворює, не потребує вітамінів та амінокислот - додаткових факторів росту. Штам росте при температурі від +10°C до 45°C. Температурний оптимум - 37°C. Росте при наявності у середовищі 5% натрію хлористого та не росте при 10% вмісті NaCl у середовищі. Штам не патогенний для теплокровних. Зберігання культури здійснюється під мінеральною олією на СА, (pH 7,0) при температурі 20 - 22°C, термін зберігання 1 рік. Зберігання культури можливе в ліофільновисушеному стані після 48 - 72 год інкубації на СА з додаванням до бактеріальної суспензії 0,85г NaCl, 1г желатину, 4г сахарози і дистильованої води до 100мл (захисне середовище). Режим сублімації - від -20°C до +30°C на протязі 32 годин. При температурі 20°C термін зберігання 5 років. Штам B.subtilis №1119 (авторський номер) депоновано в колекції промислово цінних культур (Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів) та присвоєно йому колекційний номер 092. Нижче наведені експериментальні дані (див. табл.1 - 10, фіг.), що доводять істотні переваги застосування відібраного штаму B.subtilis 092 (авторський номер 1119) в якості протисклеромного засобу. Приклад 1. Протисклеромна ефективність B.subtilis №092 в експериментах in vitro. Антагоністичну активність досліджуваних культур бацил стосовно клінічних штамів клебсієл склероми визначали методом відстроченого антагонізму на щільних середовищах СА і Гаузе №2. З числа усіх досліджуваних культур спорових аеробних бактерій відібрано 11 штамів B.subtilis, що характеризувались виразною протисклеромною ефективністю: 919, 922, 931, 934, 935, 961, 1106, 1110, 092 - ізольовані із ШКТ здорових телят, а також культури: 575, Kp601 - виділені з грунту. Більшу антибактеріальну активність досліджуваних штамів бацил стосовно клінічних культур K.rhinoscleromatis спостерігали при вирощуванні їх на СА, де зона затримки росту тест культур сягала 32,1мм (табл.1). Максимальна протисклеромна ефективність, виявлена методом відстроченого антагонізму, була властива штамам B.subtilis: 934, 1106, 1110, 092, що викликали затримку росту тест-культур 28,9мм і більше при вирощуванні на СА та 22,6 - 29,9 на Гаузе №2. Штам B.subtilis ВКПМ №B-5225 (прототип) характеризувався дещо меншою антагоністичною активністю в експериментах in vitro: зони затримки росту тест-культур у цьому випадку не перевищували 25,8 - 27,1мм. Приклад 2. Визначення мінімальної пригнічуючої концентрації (МПК) B.subtilis 092 по відношенню до K.rhinoscleromatis 230 при сумісному культивуванні. Для визначення мінімальної пригнічуючої концентрації в умовах сумісного культивування одномоментно вносили культури B.subtilis №092 та K.rhinoscleromatis 230 в конічні колби з 50мл рідкого Гаузе №2 в співвідношеннях 1 : 1; 1 : 2; 1 : 4; 1 : 10; 1 : 20; 1 : 40; 1 : 60; 1 : 80; 1 : 100; 1 : 120; 1 : 140; 1 : 160; 1 : 180; 1 : 200. Титр B.subtilis №092 та K.rhinoscleromatis 230 - кількість колонієутворюючих одиниць (КУО) - визначали в динаміці: через 1 годину після початку експерименту та через 1, 2, 3, 4, 6, 8, 10, 12 добу, висіваючи мікроб-антагоніст і тесткультуру на селективне середовище для бацил (Методические рекомендации по выделению и идентификации бактерий рода Bacillus из организма человека и животных. - К., 1983. - 50с.) і K-2 для клебсієл (Калина Г.П. Срезы узко направленного действия для обнаружения и количественного учета клебсиелл // ЖМЭИ. - №6. -1980. - С.28 - 32). Паралельно визначали концентрації K.rhinoscleromatis 230 без антагоністу (контроль). МПК прототипу встановлювали в аналогічних умовах. При сумісному культивуванні B.subtilis №092 і K.rhinoscleromatis 230 показано, що виразне пригнічення росту клебсієл спостерігали вже через 48 - 72год після внесення культур. Простежено, що на 8 - 10 добу експерименту вміст клебсієл практично відсутній при співвідношеннях мікробаанатагоністу та тест-культури 1 : 100. Відмічено наявність зворотної залежності між швидкістю зниження концентрації клебсієл та зростанням титрів бацил у середовищі. При зменшенні концентрації мікробу-антагоністу (1 : 120 - 1 : 200) спостерігали бактеріостатичну ефективність спорової культури. Очевидно, за МПК B.subtilis №092 стосовно клебсієл склероми можна вважати титр 1млн. мікробних клітин (табл.2, рис.). При сумісному культивуванні прототипу B.subtilis ВКПМ №B-5225 та K.rhinoscleromatis 230 в відповідних співвідношеннях не спостерігали суттєвого зниження титру клебсієл склероми (різниця КУО K.rhinoscleromatis 230 в досліді та контролі статистично не достовірна). Наявність формування стійкості K.rhinoscleromatis 230 до B.subtilis №092 встановлювали на протязі 12 пасажів тест-культури та мікробу-антагоністу. Для цього в конічні колби з 50мл рідкого Гаузе №2 засівали 2 ´ 10 клітин добової культури B.subtilis №092 і через 48 годин культивування (t = 37°C) вносили 108 клітин добової культури K.rhinoscleromatis 230. Після повторної добової інкубації (t = 37°C) проводили висів 0,1мл культуральної рідини на середовище K-2 для підрахунку колонієутворюючих одиниць клебсієл склероми. Життєздатні субкультури K.rhinoscleromatis 230 знову підсівали до B.subtilis №092 за вищевказаною схемою. Показано, що, починаючи з 2 - го пасажу, кількість життєздатних клітин клебсієл склероми в досліді (в перерахунку на 1мл середовища) прогресивно зменшувалась порівняно з контролем (табл.3). Після 7 - 8 пасажів популяція клебсієл була практично нежиттєздатною. Приклад 3. Ефективність B.subtilis №092 в експериментах in vivo. Найбільш переконливим тестом для визначення антисклеромної ефективності відібраних штамів бацил вважали підтвердження вказаних властивостей в дослідах на лабораторних тваринах. Гостросептичну модель склеромної інфекції відтворювали шляхом парентерального введення білим безпородним мишам 500млн мікробних клітих K.rhinoscleromatis 230 (DL100). Легеневу форму експериментальної склероми одержували за допомогою інтраназальної інокуляції лабораторних тварин (під легким ефірним наркозом) інфектом титром 100млн мікробних клітин на мишу. Профілактичну (за 24 години до введення інфекту) та лікувальну (через 24 години після введення інфекту) активність штамів B.subtilis визначали шляхом парентерального (1млрд мікробних клітин на мишу) та інтраназального (100млн мікробних клітин на мишу) застосування мікробу-антагоністу. Прототип застосовували в аналогічних умовах та дозах. Контрольні тварини одержували лише K.rhinoscleromatis 230. Результати експерименту визначали за показниками збереження лабораторних тварин до 12 дня включно. Із 11 використаних для виконання дослідів на лабораторних тваринах штамів B.subtilis 5 культур характеризувались значною протективною дією: 934, 1106, 1110, 092, Kp601. Проте, найбільш високу профілактичну ефективність як на легеневій та гостросептичній моделі склероми виявив штам B.subtilis №092 (табл.4). Відсоток збереження лабораторних тварин при цьому складав 86,7 93,3% проти 53% при використанні прототипу. Відсоток збереження контрольних тварин не перевищував 6,7%. Зведення B.subtilis №092 лабораторним тваринам у вказаних дозах і зазначеними способами не призводило до появи у них будь-яких ознак патологічного процесу. Терапевтичне застосування B.subtilis №092 в якості протисклеромного засобу забезпечувало збереження 66,6 - 79,9% від загального числа взятих у дослід лабораторних тварин (табл.5). Лікування експериментальної склероми за допомогою штамів B.subtilis 934, 1106, 092, Kp601 та прототипу не дало позитивних результатів (відсоток збереження тварин у цьому випадку був на рівні контролю). Приклад 4. Дослідження впливу B.subtilis №092 на організм теплокровних. Проведено дослідження патогенності: 1) суспензії штаму B.subtilis №092, вирощеного на МПА та на м'ясопептонному бульйоні (МПБ) при температурі 37°C на протязі 24 годин. Після росту культури на МПБ клітини відокремлювали центрифугуванням. Після росту на МПА клітини змивали фізіологічним розчином (табл.6, 7); 2) центрифугату та фільтрату культуральної рідини штаму B.subtilis №092, вирощеного на протязі 10 діб на м'ясо-пептонному бульйоні при температурі 37°C (табл.8); 3) суспензії клітин, вирощених при температурі 37°C на МПА та прогрітих протягом 30хв при 80°C (табл.9). Перевірку патогенності здійснювали на білих мишах вагою 18 - 20г та щурах вагою 180 - 200г, кролях вагою 2,0 - 2,2кг (табл.10). Тваринам вводили суспензію та фільтрати перорально (п/о) та у ін'єкціях підшкірно (п/ш) та внутрішньоочеревинно (в/о). Спостереження за тваринами здійснювали щоденно на протязі 15 днів після ін'єкцій. У період спостереження усі тварини були активними, добре поїдали харчові раціони, фізіологічні відправлення у них не порушувались, поведінкові реакції були звичайними, змін з боку шкірного покриву не відмічали. Після закінчення спостережень органи тварин підлягали патоморфологічному дослідженню. Результати макроскопічного аналізу. Серце - звичайної форми, у піддослідних тварин таке ж саме, як і у контрольних. Легені - за об'ємом, будовою долей у піддослідних і контрольних тварин одинакові, поверхні гладкі, долі легко відділяються одна від одної, спайок не відмічено. Шлунок, петлі тонкого та товстого кишківника зовні звичайні, ознак запальних реакцій не відмічено. При розтині просвіту видно не змінений (такий як і у контрольних тварин) малюнок слизових. Печінка - темно-червоного кольору, середнього кровенаповнення, не збільшена. Долі відділені одна від одної, поверхні гладкі. Нирки - за розмірами та формою не відрізняються у контрольних та дослідних тварин, поверхні гладкі, на розрізі видно чіткий малюнок коркової та мозкової речовини. Селезінка - не збільшена, звичайної консистенції. На розрізі пульпа помірного кровенаповнення, темно-червоного кольору. Таким чином, введення суспензії 24-годинної культури B.subtilis №092 внутрішньоочеревинно (парентерально) та перорально у дозах 1 - 5млрд мікр кл на мишу не викликало у тварин будь-яких ознак захворювання. Вивчення будови внутрішніх органів тварин не виявило у них будь-яких патологічних змін, реєстрованих макроскопічно. Введення мишам фільтратів культуральної рідини штаму B.subtilis №092 не виявило у тварин наявності будь-якого патологічного процесу, реєстрованого клінічне чи при макроскопічному вивченні внутрішніх органів тварин. Результати мікроскопічного вивчення. Для мікроскопічного вивчення брали шматочки органів не пізніше, ніж через 15 хвилин після смерті. Шматочки органів фіксували, заливали в парафін, фарбували гематоксилін-еозином по Ерліху, азуреозином по Максимову. Препарати печінки, фарбували також для виявлення глікогену. Серце - у міокарді не відмічено ні дистрофічних, ні некротичних змін м'язових волокон, як тотальних, так і зональних. Також відсутні патологічні зміни сполучної тканини, розташованої між м'язовими волокнами. М'язові волокна нічим не відрізняються від таких у контрольних тварин. Легені - легенева тканина та капілярна сітка звичайна, уражень не відмічено. Альвеоли чисті, не розширені, вільні від ексудату. Набухання або злущування епітелію альвеол не відмічено. Альвеолярні перетинки в нормі, не злущуються, не розрихлені. Шлунок та кишківник - слизова шлунку не потовщена, достатньо повнокровна. Змін кількості складок не спостерігається. Поверхня слизової чиста. Мілких крововиливів та ерозій нема. Дегенеративних змін нема ні в покривних клітинах слизової, ні у клітинах залоз. Гіперплазія залоз також відсутня. Ін'єкція судин слизової оболонки кров'ю в межах норми. Атрофічних явищ, що проявляються у зменшенні товщини слизової, у зменшенні кількості та в укороченні залоз, а також у розростанні сполучної тканини не спостерігається. Будова стінок тонкого кишківника звичайна, така ж, як і будова стінки кишківника контрольних тварин. Ворсинки звичайної форми та величини. Покривний епітелій з чіткими межами. Клітинна цитоплазма світла: розміщення ядер центральне. Цілісність епітелію тонкого кишківника не порушена. При дослідженні мікроскопічної будови товстого кишківника спостерігається чітко виражена складчатість стінки. Покривний епітелій наповнений бокаловидними клітинами. Просвіти крипт чисті. В епітеліальних клітинах протоплазма однорідна, ядра овальної форми добре контуруються. Фолікули та судини підслизового шару добре видно, їх гістоархітектоніка не порушена. М'язовий шар клітин товстого кишківника піддослідних та контрольних тварин одинаковий. При мікроскопічному дослідженні печінки виявлено чітко означений дольковий рисунок без будь-яких порушень. Строма сполучної тканини та судинна сітка рівномірно розподілені, без будь-яких ознак патології. Трабекулярна будова доль звичайна, змін не відмічено. Печінкові клітини піддослідних та контрольних тварин однакових розмірів, їх краї чіткі. більшість клітин одноядерна. Мікроскопічне дослідження нирок. Корковий шар, пірамідки мозкової речовини, клубочки у піддослідних тварин такі ж самі, як і у контрольних. Порожнини капсул Шумлянського щілевидної форми, їх епітеліальна вистилка не змінена. Будьяких ознак патологічних змін епітелію канальців не відмічено: клітини звичайної величини, їх межі чіткі. Просвіти канальців вільні. Сполучна тканина коркового та мозкового шару звичайна, однакова як у піддослідних, так і у контрольних тварин. Мікроскопія селезінки. Видна червона та біла пульпа, співвідношення яких звичайне. Патологічних змін зі сторони елементів пульпи чи фолікулів не відмічається. Гіперплазія клітинних елементів не спостерігається. Сполучнотканинні перетинки звичайної товщини. Кровенаповнення судин помірне. Мозок. Мозкові оболонки тонкі, не інфільтровані, судини трошки розширені. Неврони без видимих змін, відмічається невиражений гліоз. Епендима шлуночків без змін. Таким чином, у порівнянні з прототипом, штам Bacillus subtilis №092 володіє селективною високоефективною дією по відношенню до збудників склероми людини. Запропонований штам Bacillus subtilis №092 може бути використаний в ендемічних зонах хронічного захворювання для виготовлення на його основі протисклеромного засобу на фармацевтичних підприємствах. Перелік основних термінів B.subtilis Bacillus subtilis K.rhinoscleromatis ШКТ МПА МПБ МПК СА КУО п/о п/ш в/о DL100 пробіотики склерома Klebsiella rhinoscleromatis шлунково-кишковий тракт м'ясопентонний агар м'ясопептонний бульйон мінімальна пригнічуюча концентрація сусло-агар колонієутворюючі одиниці перорально (через рот) підшкірно парентерально, внутрішньоочеревинно летальна доза 100 біопрепарати на основі живих мікроорганізмів хронічне, ендемічне для України (в т.ч. для Закарпаття) і Білорусії захворювання верхніх дихальних шляхів людини
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 1/20, C12R 1/125, A61P 31/04, A61P 11/00, A61K 35/74
Мітки: активний, штам, васіllus, suвтіlіs, збудникiв, людини, антагоніст, склероми
Код посилання
<a href="https://ua.patents.su/5-25671-shtam-vasillus-suvtilis-aktivnijj-antagonist-zbudnikiv-skleromi-lyudini.html" target="_blank" rel="follow" title="База патентів України">Штам васіllus suвтіlіs – активний антагоніст збудників склероми людини</a>
Попередній патент: Спосіб одержання ліпофільного екстракту обніжжя бджолиного
Наступний патент: Спосіб моделювання пародонтиту
Випадковий патент: Пристрій пожежогасіння