Спосіб одержання заміщених 4-аміно-5-карбоксамідо-1,2,3-триазолів
Номер патенту: 38426
Опубліковано: 12.01.2009
Автори: Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Гладков Євгеній Станіславович, Сірко Світлана Миколаївна
Формула / Реферат
Спосіб одержання заміщених 4-аміно-5-карбоксамідо-1,2,3-триазолів загальної формули
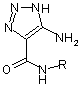 ,
,
де R=Н, С6Н5, С6Н4-СН3-4, С6Н4-СН3-2, С6Н4-Сl-4, C6H4-F-4, С6Н4-ОСН3-4,
що включає конденсацію похідного нітрилу з азідом в етанолі при кипінні, який відрізняється тим, що як похідний нітрил використовують R-(N-заміщені)ціаноацетаміди, як азід - бензилазід, реакцію конденсації проводять у присутності каталізатора - етилату натрію, після чого продукт, що утворився, дебензилюють у присутності аміду натрію.
Текст
Спосіб одержання заміщених 4-аміно-5карбоксамідо-1,2,3-триазолів загальної формули 2 3 38426 Br Br Br H3 C 4 COOC2H5 NaOCH 3, NH 3 H3 C CH 3OH H3 C CN [H]Pd/C 10 % N CH3OH C2 H5OH NH2 CH3 На першій стадії до розчину етил-2бромпропіоната у метанолі додають метилат натрію. Розчин охолоджують до 0°С і насичують газоподібним аміаком упродовж 12 хвилин. Реакційну суміш містять в баню з льодом, видержують 4,5 години, а потім відганяють розчинник при 30°С на роторному випарнику. Продукт перекристалізовують із діетилового ефіру, висаджують петролейним ефіром. Одержують 2-бромпропіоамід з температурою плавлення 123-125°С, вихід складає 52%. Час реакції на першій стадії - приблизно 7-8 годин. Амід, що одержано на першій стадії, змішують з п'ятиоксидом фосфору і піском, інтенсивно перемішують 5 хвилин, а потім нагрівають до високої температури і продукт відганяють у приймач, що охолоджується льодом, під вакуумом. Одержаний 2-бромпропіонітрил збирають при 46°С (15 мм. рт. ст.) з кількісним виходом. На третій стадії до півторакратного надлишку азіду натрію у воді додають розчин 2бромпропіонітрилу у етанолі упродовж 5 хвилин. Суміш нагрівають при кипінні 35 хвилин, додають воду. 2-Азідопропіонітрил, що одержують, переганяють з водяним паром. Маслянистий шар продукту екстрагують ефіром, промивають водою, сушать над Na2SO4. Після відгонки ефіру одержують 2-азідопропіонітрил, «чистий для аналізу» з виходом 74%. Час реакції на третій стадії складає приблизно 17-18 годин. На четвертій стадії розчин 2азідопропіонітрилу у метанолі обезкиснюють азотом і гідрують під невеликим тиском у присутності каталізатора 10% Pd/C упродовж 1 години. Розчин фільтрують на цеоліті і випаровують. Масло, що II утворилося, розчиняють у хлороформі, охолоджують до -10°С і одержують 4-аміно-5-метил-1,2,3тріазол з виходом 18% після перекристалізації із хлороформу, температура плавлення 104-105°С. Загальний час одержання 4-аміно-5-метил1,2,3-тріазолу складає приблизно 31-35 годин. Недоліком відомого синтезу є тривалий, багатостадійний процес, пов'язаний з виділенням проміжних продуктів на кожній технологічній стадії і їх очищенням. Крім того, вакуумна перегонка, перегонка з водяним паром, екстракції органічними розчинниками ускладнюють спосіб, а використання горючих і легкозаймистих розчинників (діетиловий ефір, низкокиплячий петролейний ефір), лакриматорів обмежують використання цього способу навіть у лабораторних умовах. Використання каталізатора, який вітчизняною промисловістю не випускається, дорого коштує і містить 10 % паладію на вуглі і дуже низький вихід кінцевого продукту також являються недоліками відомого способу одержання. Крім того, спосіб не дозволяє розширювати асортимент амінотріазолів з різними замісниками за карбоксамідним угрупуванням, що звужує можливість мати сполуки з корисними властивостями для біології та медицини. Відомий спосіб одержання 4-аміно-5карбоксамідо-1,2,3-тріазолу - сполуки формули III [L. Bennett, H. Baker, J. Org. Chem., 22, 707 (1957)]. H N N N CONH2 Спосіб складається із 4-х стадій і здійснюється за схемою: C2H 5ONa N NH 2 H 2N N (CONH2 )2 HO N H N O N NH N H O III NH 2 NH2 C2 H5OOCCH2CN NaN3 CN H N N N3 H3 C P2 O5 CONH2 N NaNO2 OH NaHSO3 NH4 OH [P] HO N N N OH H N NH2 CONH2 . HSO III NaNO2 3 HCl 5 38426 На першій стадії до розчину етилату натрію, що одержують розчиненням металічного натрію в абсолютному етанолі, додають еквімолярні кількості сечовини і етилціаноацетату. С уміш нагрівають 3 години на киплячій водяній бані. Осад, що утворюється, фільтрують, промивають абсолютним етанолом, розчиняють у воді. Додають льодяну оцтову кислоту до нейтральної реакції на лакмус. Одержують 6-аміно-2,4-дигідрооксипіримідин. На другій стадії до 6-аміно-2,4дигідрооксипіримідину додають розчин нітриту натрію у воді при інтенсивному перемішуванні. Утворюється проміжний продукт - 6-аміно-2,4дигідрокси-6-нітрозопіримідин, до якого повільно при перемішуванні додають гідросульфіт натрію при слабкому нагріванні до повного знебарвлення розчину. Після цього реакційну суміш нагрівають ще 15 хвилин і охолоджують. Жовтий осад 5,6діаміно-2,4-дигідроксипіримідина бісульфіту відфільтровують, промивають водою. Вихід складає 58%. Час реакції на другій стадії складає приблизно 5-7 годин. На третій стадії бісульфітну сполуку 5,6діаміно-2,4-дигідроксипіримідину розчиняють у невеликій кількості 10% водного розчину NaOH. Додають етанол до повного осадження натрієвої солі 5,6-діаміно-2,4-дигідроксипіримідину, відфільтровують продукт, промивають спиртом і розчиняють у воді. Водний розчин нагрівають до кипіння, нейтралізують НСl, одержують жовто-оранжевий 5,6-діаміно-2,4-дигідроксипіримідин. Вільна основа піримідину легко окислюється у повітрі з утворенням смолистих продуктів, що не розчиняються у кислотах або у луга х. 5,6-діаміно-2,4-дигідроксипіримідин підкислюють НСl, додають другу порцію нітриту натрію у воді. Суміш залишають на 12 годин при кімнатній температурі, після чого випарюють повністю у вакуумі. Одержують 1,4-дигідро[1,2,3]триазоло[4,5я]піримідин-5,7-діон (8-аза-ксантин) з виходом 47%. Час реакції на третій стадії складає приблизно 17-18 годин. На четвертій стадії 8-азаксантин суспендують у концентрованому розчині аміаку і містять у автоклав. Температуру у автоклаві при обертанні його упродовж 1 години підвищують до 195-200°С, потім видержують 4 години при 175-185°С і автоклав швидко охолоджують до кімнатної температури. Рідина, що утворилась, при стоянні швидко темнішає, потім її виділяють у вигляді срібної солі і промивають водою. Потім суспендують у воді, розкладають сірководнем, сіль Ag2S відфільтровують, фільтрат випарюють у вакуумі повністю до утворення безкольорового залишку. Після перекристалізації із води одержують 4-аміно-5-карбоксамідо1,2,3-тріазол. Час реакції на четвертій стадії складає приблизно 10-12 годин. Загальний час синтезу 4-аміно-5карбоксамідо-1,2,3-тріазолу складає приблизно 37-40 годин, а загальний вихід з ура хуванням всіх технологічних стадії - приблизно 17-20 %. Недоліками відомого способу одержання сполуки формули III є використання для синтезу авто 6 клава, що працює під тиском, сірководню (з різким, подразнюючим слизові оболонки і дихальні органи запахом) для виділення кінцевого продукту, використання вакууму для видалення розчинників і сушіння речовин. Слід також відзначити, що авторам не вдалося одержати велику кількість структурних аналогів за аміно- і карбоксамідною групами, одержано лише два продукти ацілювання за цими групами, що свідчить про вибірковість відомого способу і неможливість одержати широкий набір сполук указаної структури. Тривалість технологічного процесу одержання сполуки формули III (37-40 годин) також слід віднести до недоліків способу. Указані недоліки позбавляють можливості широкого використання відомого способу. Найбільш близьким за технічною суттю до способу, що заявляється, є перший із наведених аналогів, який і вибрано в якості прототипу. В основу корисної моделі поставлено задачу розробки простого і доступного способу одержання заміщених 4-аміно-5-карбоксамідо-1,2,3тріазолів, що дозволяє скоротити час реакції, підвищити вихід і якість кінцевих продуктів. Рішення поставленої задачі забезпечується тим, що у способі одержання заміщених 4-аміно-5карбоксамідо-1,2,3-тріазолів, що включає конденсацію похідного нітрилу з азідом в етанолі при кипінні, згідно корисної моделі, в якості похідного нітрилу використовують R-(Nзаміщені)ціаноацетаміди, в якості азіду - бензилазід, реакцію конденсації проводять у присутності каталізатора - етилату натрію, після чого продукт, що утворився, дебензилюють в присутності аміду натрію. Вибір компонентів реакції конденсації R-(Nзаміщених)ціаноацетамідів і бензилазіду дозволяє здійснювати синтез у дві стадії, підвищити якість і вихід кінцевих продуктів, розширити їх асортимент. Крім того, в залежності від замісника R спосіб, що заявляється, дозволяє широко модифікувати хімічну стр уктур у кінцевого продукту і одержувати великий набір заміщених амінотріазолів - напівпродуктів для потенційних фізіологічно активних речовин. Використання каталізатора - етилату натрію прискорює утворення 4-аміно-3-бензил-5-Rкарбоксамідо-1,2,3-тріазолів, зменшуючи тим самим тривалість реакції конденсації. Реакцію дебензилювання проводять без використання органічного розчинника в умовах низкотемпературної взаємодії 4-аміно-3-бензил-5-Rкарбоксамідо-1,2,3-тріазолів з амідом натрію. Газоподібний аміак, вступаючи до реакції з натрієм, утворює амід натрію, і конденсуючись у реакторі, він перетворюється у рідкий аміак, який і служить розчинником у процесі дебензилювання. У таблиці 1 представлено порівняльні характеристики способу, що заявляється, і способупрототипу. У таблиці 2 наведено температури плавлення, виходи основних продуктів реакції і їх 1Н Я МР дані, а також наведено аналогічні параметри сполуки, одержаної за способом-прототипом. 7 38426 8 Спосіб, що заявляється, складається із двох стадій і реалізується за схемою: Ph R CH2CN HN O N N PhCH2N3 N C2 H5ONa, C2H5 OH O NH2 NaNH2 NH3 N R H N NH N O NH2 N R H де R=Н, С6Н5, С6Н4-СН3-4, С6Н4-СН3-2, С 6Н4Сl-4, C 6H4-F-4, C 6H4-OCH3-4. На першій стадії еквімолярну суміш бензилазіду і R-(N-заміщеного)ціаноацетаміду в абсолютному етанолі, що вміщує етилат натрію, нагрівають упродовж 5-6 годин. Після охолодження суміш виливають у воду. Осад що випав, відфільтровують і сушать. На другій стадії відповідний 4-аміно-3-бензил5-R-карбоксамідо-1,2,3-тріазол охолоджують на бані ізопропанол-рідкий азот і при безперервному перемішуванні пропускають газоподібний аміак упродовж 20-30 хвилин. У колбу при постійному охолодженні додають порціями металічний натрій і перемішують ще 1 годину. Для зникнення синього забарвлення, що утворюється, у розчин додають амонію хлорид і реакційну масу залишають при перемішуванні для видалення надлишку аміаку, що не вступив до реакції. Потім приливають 50мл метанолу для видалення натрію, що не вступив до реакції і виливають у холодну воду. Реакційну масу о холоджують 3 години, осадок фільтрують, сушать. Одержують відповідні заміщені 4-аміно-5карбоксамідо-1,2,3-тріазоли. Загальна тривалість синтезу складає приблизно 13-15 годин. Приклад. Спосіб одержання 4-аміно-5-(N-4метилфенілкарбокс-амідо)-1,2,3-тріазолу (табл. 2, поз. 3). На першій стадії еквімолярну суміш 13,3г (0,1 моль) бензилазіду і 17,4г (0,1 моль) N-4метилфенілціаноацетаміду в 250мл абсолютного етанолу у присутності етилату натрію кип'ятять упродовж 5 годин, після чого виливають у 1л холодної води. Осад, що випав, відфільтровують, одержують 4-аміно-3-бензил-5-(4метилфеніл)карбоксамідо-1,2,3-тріазол. Вихід складає 27,3г (89%). На другій стадії 15,35г (0,05 моль) 4-аміно-3бензил-5-фенілкарбоксамідо-1,2,3-тріазолу при I охолодженні на бані ізопропиловий спирт - рідкий азот піддають дебензилюванню, пропускаючи газоподібний аміак при інтенсивному перемішуванні суміші впродовж 20 хвилин. При цьому порціями (1,5г) додають металічний натрій. Реакційну масу перемішують ще 1 годину, потім додають амонію хлорид до зникнення синього фарбування. Після повного випару аміаку у реакційну масу приливають 50мл метилового спирту для повного розчинення натрію, що не прореагував, а потім 1 л холодної води. Осад, що випав при охолодженні, відфільтровують, фільтрат підкислюють хлороводневою кислотою до рН 7. Випадає осад, що фільтрують і сушать. Вихідні данні: температура плавлення 176177°С; Вихід складає 8,03г (74%). Спектральні дані 1Н ЯМР (ДМСО-d6), d (м.ч.): 2.24 (s, 3H, СН3), 5,97 (bs, 2Н, NH2), 7,07 (d, 2Н), 7,65 (d, 2Н), 9,86 (s, 1Н, NH), 13,5 (bs, 1H, NH) Решта прикладів сполук, що одержано, зведено у таблиці 2. Як видно із тексту матеріалів, що заявляються, запропоноване технічне рішення має наступні переваги: - спосіб, що заявляється, складається з двох технологічних стадій (спосіб-прототип - із 4 стадій); - тривалість синтезу складає 13-15 годин (у способі-прототипі 31-35 годин); - спосіб, що заявляється, дозволяє одержувати кінцеві продукти з високими виходами 70-92% (за способом-прототипом вихід складає 18%); - спосіб, що заявляється, дозволяє одержувати кінцеві продукти чистими, що не потребують додаткових перекристалізацій. Можливість модифікації хімічної структури заміщених 4-аміно-5-карбоксамідо-1,2,3-тріазолів за способом, що заявляється, дозволяє вважати, що спосіб знайде широке застосування у хімічній практиці. Таблиця 1 Кількість стадій Тривалість процесу, годин Вихід основного продукту, % Умови проведення Спосіб, що заявляється 2 13-15 70-92 Спосіб-прототип 4 31-35 18 Вакуумні перегонки, перегонки з водяним паром, Абсолютний етанол, гаекстракції органічними розчинниками, перекрисзоподібний аміак талізації, використання паладієвого каталізатора 9 38426 10 Таблиця 2 N NH N NH 2 № п/п O Т.пл., °С Вихід, % 1 Н ЯМР спектри, (ДМСО-d6), δ (м.ч.) N R H R 1 H 235-237 80 2 C6H5 127 81 3 С6Н4-СН3-4 176-177 74 4 С6Н4-СН3-2 158-159 70 5 С6Н4-Сl-4 141-142 92 6 C6H4-F-4 124-125 76 7 С6Н4-ОСН3-4 137-139 78 Комп’ютерна в ерстка А. Крижанівський 4,85 (bs, 2H, NH2), 6,21 (s, 1H, NH), 6,47(s, 1H, NH), 13,1 (bs, 1H, NH) 5,02 (bs, 2H, NH 2), 7,24 (m, 2H), 7,64 (m, 3H), 9,27 (s, 1H, NH), 12,0 (bs, 1H, NH) 2,24 (s, 3H, CH3), 5,97 (bs, 2H, NH2), 7,07 (d, 2H), 7,65 (d, 2H), 9,86 (s, 1H, NH), 13,5 (bs, 1H, NH) 2,23 (s, 3H, CH3), 6,17 (bs, 2H, NH2), 7,16 (m, 4H, Ar), 9,29 (s, 1H, NH), 14,3 (bs, 1H, NH) 4.,85 (bs, 2H, NH 2), 7,25 (d, 2H), 7,58 (d, 2H), 10,05 (s, 1H, NH), 13,0 (bs, 1H, NH) 4,98 (bs, 2H, NH2), 6,92 (d, 2H), 7,68 (d, 2H), 11,20 (s, 1H, NH), 13,3 (bs, 1H, NH) 3,73 (s, 3H, ОСН3), 5,31 (bs, 2H, NH2), 6,73 (d, 2H), 7,53 (d, 2H), 10,15 (s, 1H, NH), 13,0 (bs, 1H, NH) Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of substituted 4-amino-5-carboxamido-1,2,3-triazoles
Автори англійськоюHladkov Yevhenii Stanislavovych, Sirko Svitlana Mykolaivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения замещенных 4-амино-5-карбоксамидо-1,2,3-триазолов
Автори російськоюГладков Евгений Станиславович, Сирко Светлана Николаевна, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 249/00
Мітки: одержання, заміщених, 4-аміно-5-карбоксамідо-1,2,3-триазолів, спосіб
Код посилання
<a href="https://ua.patents.su/5-38426-sposib-oderzhannya-zamishhenikh-4-amino-5-karboksamido-123-triazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених 4-аміно-5-карбоксамідо-1,2,3-триазолів</a>
Попередній патент: Буферний каскад
Наступний патент: Сигналізатор рівня
Випадковий патент: Спосіб закритого формування антирефлюксного ізоперистальтичного субмукозного терміно-термінального тонкокишкового анастомозу









