Похідні 3-аміно-4-карбоксамідо-1н-піразолу та спосіб їх одержання
Номер патенту: 82262
Опубліковано: 25.03.2008
Автори: Десенко Сергій Михайлович, Комихов Сергій Олександрович, Петрова Марина Генадіївна, Афанасіаді Людмила Михайлівна
Формула / Реферат
1. Похідні 3-аміно-4-карбоксамідо-1H-піразолу загальної формули І:
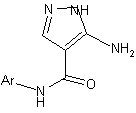 , І
, І
де
![]() ,
,
з підвищеною розчинністю в органічних розчинниках і розбавленій соляній кислоті.
2. Спосіб одержання сполук загальної формули І
 , І
, І
де
![]() ,
,
який відрізняється тим, що проводять конденсацію відповідного заміщеного ціаноацетаніліду з морфоліном або вторинним аміном, ортомурашиним ефіром у середовищі органічного розчинника у рівномолярному співвідношенні компонентів при кипінні реакційної маси в одну стадію до утворення відповідного карбоксаміду 3-заміщених 2-ціанакрилових кислот та взаємодію останнього з гідразингідратом у водному середовищі до утворення кінцевого продукту, що виділяють фільтрацією.
3. Спосіб за п. 2, який відрізняється тим, що як вторинний амін використовують діетиламін, ізопропіламін, дибутиламін.
4. Спосіб за п. 2, який відрізняється тим, що як розчинник використовують ацетонітрил, ізопропіловий або бутиловий спирти.
Текст
1. Похідні 3-аміно-4-карбоксамідо-1H-піразолу загальної формули І: 2 3 гетероциклічних сполук -потенціальних фізіологічно активних речовин, що відіграють важливу роль у життєдіяльності людини. Серед заміщених 3-аміно-1H-піразолів відома сполука формули II Сполуку і спосіб її одержання описано у [Десенко С.М., Орлов В.Д. Азагетероциклы на основе ароматических непредельных кетонов. Харьков: Фолио, 1998, с.117-118]. Сполука II розчиняється в органічних розчинниках, а саме, у бензолі, толуолі, диметилформаміді, мало розчиняється у гексані, гептані, етанолі, хлороформі, не розчиняється у воді, ефірі. Нестійка до кисню повітря, при стоянні в таких умовах темніє. У кислих середовищах у присутності органічних кислот легко циклізується в імідазопіразоли. Тому при проведенні реакції з моно- і бінуклеофілами в аналогічних умовах може утворюватися суміш діамінопіразолу і продукту циклізації з непостійним співвідношенням цих двох речовин у суміші. Сполука II має структурно декілька реакційних центрів, приблизно однакових за реакційною здатністю - вільні аміногрупи, наявність іміногрупи у гетероциклі. Це визначає поліфункцюнальність структури цієї молекули. Так, часто при синтезі складних гетероциклічних сполук може відбуватися декілька конденсаційних конкуруючих процесів з участю сполуки ІІ. Як наслідок, утворюється суміш гетероциклів, які важко або, взагалі, не можна розділити хімічним шляхом. Звідси, дуже низькі виходи цільових продуктів, необхідність їх трудомісткої процедури розділення і очистки багаторазовими кристалізаціями. Кватернізація атомів азоту аміно- і іміногруп в агресивних середовищах виключає можливість використання їх у синтезах при дії кислих реагентів. Як і сполуки, що мають вільні аміногрупи, сполука ІІ на повітрі піддається частковому окисленню, змінює своє забарвлення, не може тривалий час зберігатися в таких умовах. В молекулі сполуки ІІ положення 4 зайнято аміногрупою, що обмежує можливість варіювання замісників у піразольному циклі в широких межах. Це є суттєвим недоліком структури сполуки ІІ. Один з представників цього класу сполук, а саме 3,4-діаміно-5-метил-1H-піразол (сполука II) використовується як бінуклеофільний реагент для синтезу азотовмісних гетероциклічних сполук, наприклад, похідних піразоло-[1,5-а]піримідинів, з метою пошуку нових фізіологічно активних речовин, що використовуються як медичні препарати. 82262 4 Спосіб одержання сполуки II складається із чотирьох стадій і реалізується за схемою: На першій стадії діацетонітрил отримують в результаті взаємодії ацетонітрилу з металічним натрієм. При переводі металічного натрію у диспергований стан у відомому способі одержання сполуки II використовуються сухий сірчаний ефір та толуол. Реакція взаємодії натрію з ацетонітрилом екзотермічна та проходить з виділенням великої кількості тепла. Автори вказують, що необхідно ефективне охолодження та тепловідвід, інакше можливий викид реакційної маси і навіть займання легкозаймистого ефіру при контакті з нагрівальними приладами. Діацетонітрил, що утворився, екстрагують ефіром, розчин висушують над MgSO4, і відганяють ефір із реакційної маси. Продукт кристалізують із легкозаймистого розчинника бензолу. Час реакції приблизно 28-30 годин. На другій стадії проміжний діацетонітрил взаємодіє з гідразингідратом у водному середовищі в присутності соляної кислоти. Час реакції приблизно 3-4 години. Нітрозування 3-аміно-5-метилігіразолу в соляній кислоті проводять при сильному охолодженні (0°С) нітритом натрію; нітрозопродукт, що утворився відновлюють цинковим пилом. Час реакції приблизно 5-7 годин. На наступній стадії виділяють 3,4-діаміно-5метилпіразол із реакційної суміші екстракцією бензолом. Після упарювання розчинника у вакуумі продукт кристалізують із суміші бензол-гептан (1:1). Час реакції приблизно 10-12 годин. Загальна тривалість синтезу складає приблизно 46-53 годин. До недоліків відомого методу слід віднести використання легкозаймистих, вогненебезпечних (ефір, толуол, бензол, гептан) розчинників для синтезу і екстракції, вибухонебезпечних речовин (металічний натрій, реагуючи з водою, вибухає з виділенням великої кількості тепла і займанням). Використання сильних окислювачів на стадії нітрозування і соляної кислоти в великих кількостях збільшує шкідливі технологічні стоки і викиди в навколишнє середовище шкідливих хімічних речовин (оксиди азоту). Очистка проміжних продуктів шляхом екстракцій, перекристалізацій і відгонка розчинників в вакуумі збільшує час проведення реакції, що також слід віднести до недоліків відомого методу. В зв'язку з викладеним технічне рішення має обмежене використання. Найбільш близьким за хімічною будовою і прийнятним в якості прототипу до сполук, що заявляються, є сполука ІІІ, що описана у [O. Moukachafig, M.L. Taha, A. Moumo, Nucleosides Nucleotides, 22, 967 (2003)]. 5 82262 6 1964, №5, с.550]; похідні піразолу використовуються для лікування захворювань, що викликані вірусом імунодефіциту людини (ВІЛ) [Заявка РФ №2003112610/04; СО7D231/18 від 04.10.2001р.]. Спосіб одержання 3-аміно-4-карбоксамідо-1Hпіразолу включає 3 реакційні стадії і реалізується за схемою: Наявність гетероциклічного кільця та вільної аміногрупи передбачає надання структурі III тих же властивостей і особливостей, що і у аналога II, але сполука ІII, на відміну від структури II, мало розчинна в органічних розчинниках і слабій соляній кислоті, що імітує концентрацію НС1 у шлунковому соку. Так, в 1000мл етанолу розчиняється всього лише 4.1г речовини III, у хлороформі і ефірі - практично не розчиняється, в 0,52% розчині НС1 - 0,7г, не розчиняється - у воді. Недоліком структури сполуки - прототипу є хімічна нестійкість в агресивних середовищах. Так, в присутності водовід'ємних агентів в агресивному середовищі сполука III відомої структури перетворюється в відповідний нітрил, що не дозволяє говорити про постійність властивостей, що проявляє структура - прототип в таких умовах. Крім того, в указаних умовах може проходити солеутворення за вільною аміногрупою. Конкуруюча дія цих двох процесів також порушує сталість хімічного складу. Наявність амідної групи –CONH2 не дає можливості видозмінювати хімічну структуру прототипу, варіювати структури нових хімічних речовин на основі відомої структури прототипу. Це також можна віднести до суттєвого недоліку сполуки III. Труднощі синтезу сполуки III, його дорожнеча, малодоступність сировини (зокрема, оцтовий ангідрид, малонодінітрил), неваріабільність структури прототипу обмежують його використання як фармакофорного фрагмента при одержанні речовин для медичної і фармакологічної хімії. Як і аналог II, сполука - прототип використовується у синтезі складних конденсованих гетероциклічних сполук лікарських препаратів, зокрема, вона є напівпродуктом у синтезі лікарського препарата алопуринолу, для лікування ревматизму, подагри і таке інше [Международная Фармакопея, Всемирная Организация Здравоохранения, Женева, 1983, т.2, с.30-32)]. При фармакологічних дослідженнях піразольних сполук, аналогічних сполуці III, виявилося, що вони мають властивість знімати і запобігати електрошоковим явищам. Амінозаміщені піразоли мають протиракову, протисудомну, анальгетичну дію, діють на центральну нервову систему [Garattini S., Palma V., Cancer Chemoth. Rev., 1961, v.13, р.9; Кудрин Л.Н., Полевой Л.Г., Фармакол. и токсикология, На першій стадії утворюється етоксиметиленмалононітрил кип'ятінням малононітрилу з триетоксиметаном в оцтовому ангідриді впродовж 4 годин. Продукт перекристалізовують із етанолу. Час реакції 6-7 годин. Конденсацією етоксиметиленмалононітрилу з гідразингідратом в етиловому спирті (кип'ятіння протягом 6 годин) на другій стадії реакції одержують 3-аміно-4-карбонітрил-1H-піразол. Продукт двічі кристалізують із етанолу і сушать в вакуумі протягом 8 годин. Час реакції 14-20 годин. Окисненням нітрилу водною сірчаною кислотою при охолодженні до 5°С на третій стадії отримують сірчанокислу сіль 3-аміно-4карбоксамідо-1H-піразол. Для промивання речовини автори використовують ацетон, який видаляють сушкою в вакуумі при 80°С. Сірчанокисла сіль 3-аміно-4-карбоксамідо-1Hпіразолу є проміжним продуктом у подальшому синтезі лікарського препарату - алопуринолу. Загальний час реакції складає 28-37 годин. До недоліків відомого методу слід віднести використання оцтового ангідриду, що має сльозогінний характер, подразнює слизову оболонку очей і порожнину рота. Шкідливі стоки виробництва, що утворилися на першій стадії, містять оптову кислоту, яка не регенерується. Отриманий в якості проміжного продукту етоксиметиленмалононітрил викликає алергічні реакції і дерматити, численні висипи на шкірі рук, що заважає роботі в хімічній лабораторії. Суттєвим недоліком є багатостадійність синтезу, що приводить до додаткових витрат реактивів і робочого часу. Проміжні продукти, отримані на кожній стадії, потребують обов'язкової очистки - перекристалізації із легкозаймистих розчинників (етанола, ацетона) та сушіння речовин в вакуумі (для повного осушення), що також викликає додаткові витрати робочого часу. Задача винаходу складається з пошуку нових сполук в ряду похідних 3-амінопіразолів, що мають більш високу розчинність в органічних розчинниках, стійких до дії агресивних середовищ, а також у розробці більш простого і доступного способу одержання сполук, що заявляються (підвищення виходу продуктів, поліпшення їх якості, скорочення тривалості процесу, зменшення шкідливих стоків виробництва). 7 Поставлена задача досягається розробкою нових похідних 3-аміно-4-карбоксамідо-1Hпіразолу які мають підвищену розчинність в органічних розчинниках, і способом одержання сполук загальної формули І, де Аr має вказані вище ароматичні радикали, що включає синтез відповідного похідного 2-ціанакрилової кислоти і його конденсацію з гідразингідратом у розчиннику впродовж часу, необхідного для утворення кінцевого продукту, згідно з винаходом, синтез відповідного похідного 2-ціанакрилової кислоти здійснюють взаємодією відповідного заміщеного ціанацетаніліду з морфоліном або вторинними амінами, ортомурашиним ефіром у середовищі органічного розчинника в рівномолярному співвідношенні компонентів при кип'ятінні реакційної маси в одну стадію до утворення відповідного арилкарбоксаміду 3-заміщених 2ціанакрилових кислот, а їх конденсацію з гідразингідратом проводять у водному середовищі до утворення кінцевого продукту, що виділяють фільтрацією. В якості вторинного аміну використовують діетиламін, ізопропіламін, дибутиламін. В якості органічного розчинника доцільно використовувати ацетонітрил, ізопропіловий або бутиловий спирти. Видозміна структури сполук, що заявляються, привела до усунення недоліків, притаманних прототипу, і появі нових властивостей, а подовження ланцюга спряження у молекулах сполук І може сприяти і появленню нових властивостей у сполук цієї структури. Так, введення пептидного фрагмента в 4-положення 3амінопіразолу надає їм подібність до білкових структур, що може відбитися на появі нових фізіологічних властивостей у речовин. Наявність ариламідного угрупування, що є полярною функціональною групою, приводить до підвищення розчинності в органічних розчинниках, що для даної структури є несподіваним. Сполука І, що має в 4-положенні молекули піразолу фенільний радикал Аr=С6Н5, при 20°С має більш високу розчинність в органічних розчинниках (див. таб.1), що приблизно в 2-17 разів перевищує розчинність прототипу. Карбоксамідне угрупування у сполуках, що заявляються, інертно до дії агресивних і водовід'ємних реагентів, що забезпечує стійкість при роботі в таких умовах. Можливість модифікації хімічної структури сполук І шляхом варіювання арильного радикалу, зв'язаного безпосередньо з амідною групою (CONHAr фрагмент) дозволяє одержувати більш широкий асортимент нових барвників і перспективних фізіологічно активних речовин в ряду похідних піразолу. В способі одержання сполук І, що заявляється, для повного проходження реакції утворення цих 82262 8 сполук в необхідному напрямку компоненти реакції беруть приблизно у рівномолярному співвідношенні ціаноацетанілід -0,3М, ортомурашиний ефір - 0,34М, морфолін або вторинний амін - 0,38М. Ортомурашиний ефір, морфолін або вторинний амін беруть в дуже незначному надлишку лише для покращення розчинності ціанацетаніліду. В противному випадку може утворитися густа суспензійна маса, що розчиняється тільки при тривалому кип'ятінні, що збільшує час проходження реакції. Якщо використовувати компоненти у зменшеному співвідношенні, ніж потрібно за рівнянням реакції, в реакційній масі спостерігається наявність непрореагованого ціанацетаніліду, бо реакція не проходить повністю. При використанні вказаних реагентів у великому надлишку реакція проходить повністю, але продукти реакції, що утворилися, розчиняються у надлишку морфоліну (або вторинного аміну) і ортомурашиного ефіру і виділення цих продуктів затруднено. Для відгону надлишку цих розчинників треба використовувати вакуумну перегонку, що ускладнює процес одержання і в апаратурному оформленні, і за часом. Морфолін (або вторинний амін) використовується у синтезі як розчинник основного характеру і як реагент реакції. їх підбір зумовлений відмінними фізичними властивостями - високою розчинною здатністю, високою температурою кипіння, високою основністю; вони являються не агресивними середовищами для проведення реакції, на відміну від оцтового ангідриду, який використовується у прототипі. Вони сприяють протіканню реакції у необхідному напрямку одержанню відповідних заміщених 3-аміно-4карбоксамідо-1H-піразолів, запобігаючи побічним реакціям. Синтез проходить в умовах основного каталізу (в прототипі - кислотний каталіз). Виявилося, що сполучення цих розчинників з іншими компонентами реакції в умовах основного каталізу дає змогу виділяти із реакційної маси продукти, що заявляються, з хорошими виходами, високим ступенем чистоти без перекристалізації. Розроблені умови синтезу арилкарбоксамідів 3-заміщених 2-ціанакрилових кислот дозволяють зменшити тривалість процесу одержання кінцевих продуктів до двох стадій (у прототипі - 3 технологічні стадії) за рахунок того, що кінцеві продукти утворюються відразу після обробки вказаних арилкарбоксамідів 3-заміщених 2ціанакрилових кислот гідразингідратом у водному середовищі. За способом прототипом конденсацією похідного 2-ціанакрилової кислоти етоксиметиленмалононітрилу з гідразингідратом утворюється 3-аміно-4-карбонітрил-1H-піразол, який окислюють Н2SO4. Спосіб реалізується за схемою: 9 На першій стадії синтезують відповідні арилкарбоксаміди 3-заміщених 2-ціанакрилових кислот конденсацією ціанацетанілідів з морфоліном або вторинними амінами, ортомурашиним ефіром і ацетонітрилом або спиртами при кип'ятінні реакційної маси. Одержаний відповідний арилкарбоксамід вводять у реакцію з гідразингідратом у водному середовищі до утворення відповідного кінцевого продукту, який виділяють фільтрацією. За способом, що заявляється, основні (сполуки І) і проміжні продукти вже в процесі синтезу одержують достатньо чистими і не потребують подальшої перекристалізації. Цим виключаються додаткові витрати органічних розчинників для очистки кінцевих продуктів, здешевлюється їх вартість. Загальна тривалість технологічного процесу за способом, що заявляється, складає 8-12годин (за способом - прототипом - 28-37 годин). Сумарний вихід концевих продуктів у заявляємому способі складає 75 - 94% (у прототипі -40%). У таблиці 1 дано порівняльні дані з розчинності сполуки, що заявляється, (Аr=С6Н5) і прототипу. У таблиці 2 наведено порівняльні характеристики способу одержання заміщених 3аміно-4-карбоксамідо-1H-піразолів, що заявляється, і способу -прототипу. У таблиці 3 представлено характеристики сполук І і їх спектральні дані за способом, що заявляється, і прототипом. Нижче наведено приклади конкретного виконання синтезів заміщених 3-аміно-4арилкарбоксамідо-1Н-піразолів. Приклад 1. Одержання 3-аміно-4фенілкарбоксамідо-1H-піразолу (табл.3, поз. 1). У круглодонну колбу, яка обладнана зворотним холодильником і мішалкою, завантажують 49,5г (0,3моль) ціаноацетаніліда, приливають 63мл (0,3моль) ортомурашиного ефіру, 34мл (0,39моль) морфоліну, 15мл ацетонітрілу. Суміш нагрівають при перемішуванні до повного розчинення суспензії і утворення феніламіду 3-(N-морфоліно)-2-ціанакрилової кислоти (60-90 хвилин), продукт відфільтровують, сушать. У круглодонну колбу, яка обладнана зворотним холодильником, завантажують 51,5г (0,2моль) феніламіду 3-(N-морфоліно)-2ціанакрилової кислоти і 14мл (0,28моль) 96-% гідразингидрату в 100мл гарячої води. Суміш кип'ятять на водяній бані протягом 20 хвилин. Осад, що випав, фільтрують. Зовнішній вигляд - білі кристали. Вихідні дані: 38г (94%), Т.пл.175-176°С. Елементний аналіз - знайдено %: N 27,71,С10Н10N4О. Обчислено %: N 27,72. Структуру 3-аміно-4-фенілкарбоксамідо-1Hпіразолу підтверджено також спектральними даними. Спектри ядерного магнітного резонансу (ЯМР 1 Н) виміряно на спектрометрі VARIAN Mercury VX200 (200МГц) в розчинах 82262 10 дейтеродиметилсульфоксиду (ДМСО-d6), внутрішній стандарт тетраметилсилан; δ(м.ч.): 6,4 (2Н, у. с, NH2), 6,8-7,7 (5Н, м, Аr), 7,95 (1Н, с, СНпіразол), 9,46 (1Н, у. с, NH), 11,84 (1H, у. с, NH). Приклад 2. Одержання 3-аміно-4фенілкарбоксамідо-1H-піразолу (табл.3, поз. 1). Синтез здійснюють аналогічно прикладу 1, замість морфоліну на першій стадії реакції використовують діетиламін у тому ж мольному співвідношенні, що і морфолін - 28,4г (0,39М). Зовнішній вигляд - білі кристали. Вихідні дані: 33,8г (84%), Т.пл.174-176°С. Елементний аналіз: знайдено % N 27,84,С10Н10N4О. Обчислено %: N 27,72. Спектр ЯМР(1Н), δ(м.ч.): 6,4 (2Н, у.с, NH2), 6,87,7 (5Н, м, Аr),7,95 (1Н, с, СН-піразол), 9,46 (1Н, у. с, NH), 11,84 (1Н, у. с, NH). Приклад 3. Одержання 3-аміно-4фенілкарбоксамідо-1Н-піразолу (табл.3, поз. 1). Синтез здійснюють аналогічно прикладу 1, замість адетонітрилу використовують ізопропіловий спирт у тій самій кількості, що і ацетонітрил (15мл). Зовнішній вигляд - білі кристали. Вихідні дані: 36г (89%), Т.пл.173-175°С. Елементний аналіз : знайдено % N 27,65,С10Н10N4О. Обчислено %: N 27,72. Спектр ЯМР(1Н), δ(м.ч.): 6,4 (2Н, у. с, NH2 ), 6,87,7 (5Н, м, Аr),7,95 (1Н, с, СН-піразол), 9,46 (1Н, у. с, NH), 11,84 (1H, у. с, NH). Приклад 4. Одержання 3-аміно-4фенілкарбоксамідо-1H-піразолу (табл.3, поз. 1). Синтез здійснюють аналогічно прикладу 1, замість ацетонітрилу використовують бутиловий спирт у тій самій кількості, що і ацетонітрил (15мл). Зовнішній вигляд - білі кристали. Вихідні дані: 38г (94%), Т.пл.176°С. Елементний аналіз : знайдено % N 27,89,С10Н10N4О. Обчислено %: N 27,72. Спектр ЯМР(1Н), δ(м.ч.): 6,40 (2Н, у. с, NH2), 6,8-7,7 (5Н, м, Аr),7,95 (1Н, с, СН-піразол), 9,46 (1Н, у. с, NH), 11,84 (1Н, у. с, NH). Приклад 5. Одержання 3-аміно-4-(3метилфеніл)-карбоксамідо-1H-піразолу (табл.3, поз.2). Синтез проводять аналогічно прикладу 1, з тією лише різницею, що замість ціаноацетаніліду використовують 3-метилціаноацетанілід в кількості 53,8г (0,3М). Зовнішній вигляд: білі кристали. Вихідні дані: 38,3г (88,7%), Т.пл.168-169°С. Елементний аналіз : знайдено % N 25,78; С11Н12N4О. Обчислено %: N 25,92. Спектр ЯМР 1H, δ(м.ч.): 6,20 (2Н, у. с, NH2), 6,84-7,98 (4Н, м, СН-аром.), 9,3 (1Н, с, СНпіразол), 8,01 (1Н, у. с, NH), 11,84 (1Н, у. с, NH), 2,26 (3Н, с., СН3). Приклад 6. Одержання 3-аміно-4-(4метилфеніл)-карбоксамідо-1H-піразолу (табл. 3, поз 3). 11 Синтез проводять аналогічно прикладу 1, для реакції беруть 53,8г (0,3М) 4метилціаноацетаніліду. Зовнішній вигляд: білий порошок з рожевим відтінком. Вихідні дані: 36г (84%), Т. пл. 215-216°С Елементний аналіз - знайдено %: N 25,84; 25,78. С11Н12N4О Обчислено %: N 25,92. Спектр ЯМР 1Н, δ(м.ч.): 5,89 (2Н, у. с., NH2), 7,09-7,50 (4Н, м, СН-аром), 7,94 (1Н, с, СНпіразол), 9,31 (1H, с, NH), 11,85 (1Н, у. с, NH), 2,23 (3Н, с., СН3). Приклад 7. Одержання 3-аміно-4-(4етоксифеніл)-карбоксамідо-1H-піразолу (табл. 3, поз.4). Синтез проводять аналогічно прикладу 1. Для реакції беруть 63,1г (0,3М) 4етоксиціаноацетаніліду. Зовнішній вигляд: білі кристали. Вихідні дані: 36,9г (75%), Т. пл. 198-200°С Елементний аналіз - знайдено %: N 20,31; С12Н14N4О4 Обчислено %: N 20,14. Спектр ЯМР 1Н, δ(м.ч.): 6,2 (2Н, у. с, NH2), 6,82-7,54 (4Н, м, СН-аром), 8,0 (1Н, у. с, NH), 9,25 (1Н, с, СН-піразол), 11,84 (1Н, у. с, NH), 1,29 (3Н, т, СН3), 3,94-3,97 (2Н, кв, СН2). Приклад 8. Одержання 3-аміно-4-(4фторфеніл)-карбоксамідо-1H-піразолу (табл. 3, поз. 5). Синтез проводять аналогічно прикладу 1. Для реакції беруть 55г (0,3М) 4-фторціаноацетаніліду. Зовнішній вигляд: білі кристали. Вихідні дані: 40г (90,9%) Т.пл.209-210°С Елементний аналіз - знайдено %: N 25,56. С10Н9N4ОF. Обчислено %: N 25,45. Спектр ЯМР 1H, δ(м.ч.): 5,84 (2Н, у.с, NH2), 7,11-7,66 (4Н, м, СН-аром), 7,95 (1Н, с, СНпіразол), 9,46 (1H, у.с, NH). Приклад 9. Одержання 3-аміно-4-(2,4диметилфеніл)-карбоксамідо-1H-піразолу (табл. 3, поз. 6). Синтез проводять аналогічно прикладу 1. Для реакції беруть 66,5г (0,3М) 2,4диметилціаноацетаніліду. Зовнішній вигляд: жовтий кристалічний порошок. Вихідні дані: 35г (76%), Т. пл. 118-120°С Елементний аналіз - знайдено %: N 24,41. С12Н14N4О Обчислено %: N 24,35. Спектр ЯМР 1Н δ(м.д.): 5,87 (2Н, у. с, NH2), 6.97-7.13 (3Н, м, СН-аром.), 7,92 (1Н, у. с, NH), 9,01 (1Н, с, СН-піразол), 11,87 (1Н, у. с, NH), 2,15 (3Н, с, СН3), 2,24 (3Н, с, СН3). Приклад 10. Одержання 3-аміно-4-(2-метил-5хлорфенил)-карбоксамідо-1H-піразолу (табл. 3, поз. 7). Синтез проводять аналогічно прикладу 1. Для реакції беруть 64,5г (0,3М) 2-метил-5-хлорціаноацетаніліду. Зовнішній вигляд: жовтий кристалічний порошок. 82262 12 Вихідні дані: 36г (71,8%) Т.пл.203-204°С Елементний аналіз - знайдено %: N 22,44. С11Н11N4СІ. Обчислено %: N 22,35. Спектр ЯМР 1Н δ(м.ч.): 6,03 (2Н, у. с, NH2), 7,14-7,48 (3Н, м, СН-аром.), 7,86 (1Н, у. с, NH), 9,07 (1Н, с, СН-піразол), 11,87 (1Н, у. с, NH), 2,24 (3Н, с, СН3). Приклад 11. Одержання 3-аміно-4-(4хлорфеніл)-карбоксамідо-1Н-піразолу (табл. 3, поз. 8). Синтез проводять аналогічно прикладу 1, Для реакції беруть 60,2г (0,3М) 4-хлорціаноацетаніліду. Зовнішній вигляд: білий порошок. Вихідні дані: 38г (80,33%) Т. пл. 185-187°С Елементний аналіз - знайдено %: N 23,79; С10H9N4ОСІ Обчислено %: N 23,68. Спектр ЯМР 1Н δ(м.ч.): 6,12 (2Н, у. с, NH2), 7,30-7,67 (4Н, м, СН-аром), 7,72 (1Н, с, NH), 9,52 (1Н, с, СН-піразол), 11,88 (1Н, у. с., NH). Як видно з тексту описаних матеріалів заявки і даних таблиць 1-3, технічне рішення, що пропонується, у порівнянні з прототипом має наступні переваги: - структура, що заявляється, більш рухлива і забезпечує одержання більш широкого асортименту похідних піразолу з покращеними властивостями; - дозволяє широко варіювати у молекулі 3амінопіразолу арильні радикали; - структура, що заявляється, дозволяє значно підвищити розчинність сполук І в органічних розчинниках і в розбавленій соляній кислоті, процентний вміст якої імітує її процентний вміст у шлунковому соку. Спосіб одержання сполук І, що заявляються, дозволяє: - зменшити кількість технологічних стадій до двох (спосіб - прототип - три); - використовувати у синтезі доступні, неагресивні розчинники вітчизняного виробництва; - підвищити вихід кінцевих продуктів до 7594% у порівнянні з способом-прототипом - 40%; - скоротити тривалість процесу одержання заміщених 3-аміно-4-карбоксамідо-1Н-піразолів до 8-12 годин (у прототипі -28-30 годин); - виключити очистку проміжних продуктів; - підвищити якість кінцевих продуктів за рахунок використання морфоліну або вторинних амінів, що сприяє протіканню реакції у необхідному напрямку без побічних реакцій і продуктів; - зменшити шкідливі технологічні стоки виробництва шляхом їх утилізації за допомогою водних розчинів. Всі ці переваги нових сполук І та способу їх одержання розширюють можливості використання їх в указаних областях застосування. Спосіб одержання сполук І, що заявляються, простий у технологічному виконанні (пройшов апробацію в лабораторних умовах) і може бути легко відтворений в умовах промислового виробництва. 13 82262 14 Таблиця 1 Порівняльні дані з розчинності сполуки, що заявляється, і прототипу Розчинник Сполука, що заявляється (Аr=С6Н5) Прототип спирт Розчинність у 1000мл, г при 20°С хлороформ ефір 0,52% неї вода 6,7 3,4 1,3 1,3 0,9 4,1 0,2 0,1 0,7 Не розчиняється Таблиця 2 Порівняльні характеристики способу одержання заміщених 3-аміно-4-карбоксамідо-1H-піразолів, що заявляються, і прототипу Кількість стадій реакції Спосіб, що заявляється Прототип Тривалість проц., година Сумарний вихід основи. продукта, % Очищення проміжних продуктів Застосування легкозаймистих, вогненебезпечних, вибухових речовин 2 15-18 75-94 Не потребується Не застосовується Потребується перекристалізація, сушка у вакуумі оцтовий ангідрид, етанол, Н2SО4, ацетон, етоксиметиленмал ононітріл-викликає дерматити, алергічні реакції 3 28-30 40 (сумарний вихід, перерахований нами)
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 3-amino-4-carboxamido-1н-pyrazole and the process for preparation thereof
Автори англійськоюKomikhov Serhii Oleksandrovych, Petrova Maryna Hennadiivna, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюПроизводные 3-амино-4-карбоксамидо-1н-пиразола и способ их получения
Автори російськоюКомихов Сергей Александрович, Петрова Марина Геннадиевна, Десенко Сергей Михайлович, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 231/10, C07D 231/16, C07D 231/18
Мітки: похідні, 3-аміно-4-карбоксамідо-1н-піразолу, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/7-82262-pokhidni-3-amino-4-karboksamido-1n-pirazolu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-аміно-4-карбоксамідо-1н-піразолу та спосіб їх одержання</a>
Попередній патент: Похідні піролу з антибактеріальною дією
Наступний патент: Спосіб визначення горизонтальних градієнтів рефракції атмосфери
Випадковий патент: Клапанний вузол контейнера для напою, контейнер для напою і спосіб заповнення і випорожнення контейнера











