Спосіб визначення токсичності водного середовища
Номер патенту: 3918
Опубліковано: 27.12.1994
Формула / Реферат
Способ определения токсичности водной среды, предусматривающий приготовление исследуемой и контрольной проб, введение в каждую из них в качестве тест-объекта водного растения, выдерживание тест-объекта, регистрацию функционального показателя, коррелирующего с состоянием водной среды, сравнение показателей, полученных в опыте и контроле, и суждение по результатам сравнения об отсутствии токсичности водной среды или о степени ее токсичности, отличающийся тем, что в качестве водного растения используют валлиснерию Nallisneria splralls), а в качестве функционального показателя регистрируют скорость движения цитоплазмы, которую определяют по перемещению в клетке яркоокрашенных органелл - хлоропластов, увлекаемых движущейся прозрачной протоплазмой, при этом при отклонении показателя на 20% от контроля в сторону стимуляции или угнетения функции делают вывод об отсутствии токсичности водной среды при отклонении показателя в пределах от 51 до 80% в сторону угнетения функции и в пределах от 121 до 150% в сторону ее стимуляции делают вывод о слабой степени токсичности, при отклонении показателя в пределах от 21 до 50% в сторону угнетения функции и в пределах от 151 до 180% в сторону ее стимуляции делают вывод о средней степени токсичности, при отклонении показателя в пределах от 11 до 20% в сторону угнетания функции и в пределах от 181 до 250% в сторону ее стимуляции делают вывод о высокой степени токсичности, а при отклонении показателя в пределах от 0 до 10% в сторону угнетения или в пределах от 251 % и выше в сторону стимуляции делают вывод о летальной токсичности.
Текст
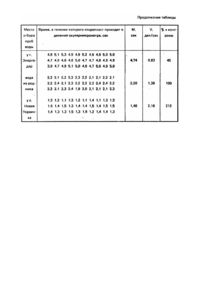
Изобретение относится к биологическому мониторингу пресных вод, а именно - к биологическому способу экспресс-оценки загрязнения природных вод и други х водных сред, который может быть использован в области водной токсикологии, санитарной, гидробиологии, в медико-биодогических исследованиях. Известен способ определения токсичности загрязненных вод и химических веществ по плазмолизу в клетках нитчатых водорослей, который определяют при помощи электрофотоколориметра [1]. О степени токсичности судят по изменению величины плазмолиза в клетках водорослей под влиянием токсиканта по сравнению с контрольными водорослями, не подвергавшимися токсическому воздействию. Недостатками известного способа является следующее: способ позволяет оценить токсичность только веществ, влияющи х на оводненность протоплазмы; установить же токсичность ряда загрязнителей, не относящихся к сильным плазмолитикам, например KCN, NaF, ряда органических растворителей и поверхностно-активных соединений, который оказывают сильное воздействие на дыхание клетки, разобщают окислительное фосфорилирование, разрушают биологические мембраны и. в целом, внутриклеточную стр уктур у, этим способом невозможно, т.е. диапазон определяемых токсикантов ограничен; способ имеет относительно низкую чувствительность - 1-10 мг/л, в то время как ПДК многих токсических химических элементов, в частности тяжелых металлов, составляет 0,01-0,001 мг/л; временные затраты на тестирование, включающие отбор проб исследуемой воды, адаптацию растений на чистых растворах и экспозицию в токсической среде, а также просмотр на приборе, составляют 4-4,5 часа. Прототипом изобретения является способ определения загрязненности донных отложений, который осуществляется путем регистрации начала движения цитоплазмы (протоплазмы) в клетках элодеи, проэкспонированной на водной вытяжке из тестируемого образца донных отложений по отношению к таковому у контрольных растений. Сущность этого метода состоит BJO M, что в природных условиях обитания злодеи в водной среде ее цитоплазма находится в постоянном движении, которое приостанавливается в случае механического повреждения тканей. При этом при постоянной температуре в воде, в которой отсутствуе т загрязнение, движение цитоплазмы восстанавливается за более короткий срок, чем в воде, где имеет место загрязнение, а при высокой степени загрязнения движение цитоплазмы может и вовсе не восстановиться. О степени загрязнения тестируемых водных вытяжек из донных отложений судят по величине отношения регистрируемого показателя у растений, подвергшихся воздействию загрязнений, по отношению к таковому у контрольных растений, не подвергшихся воздействию загрязнений, который авторы предложили назвать коэффициентом регенерации (Кр). При этом при значении Кр меньшем или равном 1 исследуемые донные отложения относят к чистым, при значении его большем 1, но меньшем или равном 3 - донные отложения относят к слабо загрязненным, при значении Кр большем 3, но меньшем 5 - к умеренно загрязненным, а при Кр равном или большем 5 - к сильно загрязненным. Недостатками известного способа является следующее: регистрация наличия загрязнения только по угнетению тест-функции, что сужает круг тестируемых загрязнений и делает способ не совсем точным, так как при всякой высокой стимуляции движения цитоплазмы (например, под воздействием солей меди или стронция) коэффициент регенерации движения будет меньше 1 и по предлагаемой авторами градации уровня загрязнений попадает в разряд от 0 до 1, т.е. а чисты х вод; использование элодеи как тест-организма менее эффективно, так как у нее скорость движения цитоплазмы в 2-3 раза ниже, чем у валлиснерии, а клетки в 5-6 раз мельче, округлые и цитоплазма перемещается вдоль стенок не по прямой, а по дугообразному пути, что усложняет определение скорости ее движения и существенно снижает точность определений; у элодеи для проведения биотестирования пригодно лишь небольшое число верхушечных листьев, которые по отношению к общей биомассе этих растений составляют десятые доли процента, что влечет за собой необходимость наличия неоправданно большого количества общей биомассы растений, из которой в работу идет лишь незначительная ее доля. Это делает проблематичным использование элодеи в полевых условиях при проведении экспресс-оценки вод на больших акваториях, требующи х массовых определений; исходя из того, что донные отложения являются аккумуляторами токсических веществ и содержат их в 1001000 раз больше,чем окружающая их вода, то получение экстрактов при рекомендуемом в альтернативном способе соотношении грунт-вода как 1:8 свидетельствует о том, что чувствительность стартовых механизмов движения протоплазмы на порядок ниже, чем при достижении стабильности ее движения; приготовление срезов из тонких листьев элодеи более сложно, чем препарата из листьев валлиснерии, у которой просто отсекают полсантиметра листовой пластинки. В основу предлагаемого изобретения поставлена задача создания способа определения токсичности водной среды, в котором определение токсичности проводят при помощи биологической тест-функции водного растения - скорости движения протоплазмы, путем наблюдения за ее изменением в клетках тест-организма под влиянием токси-кантов, что позволяет повысить чувствитель-ность способа, расширить диапазон исследуемых токсикантов и сократить время проведения тестирования. Поставленная задача решается тем, что в способе определения токсичности водной среды, включающем воздействие тестируемой водной средой на водные растения с последующей оценкой по функциональному показателю водного растения, согласно изобретению, вводится в качестве водного растения валлиснерия (Vallisneria spiralis), а в качестве функционального показателя - скорость движения цитоплазмы, определяемая по перемещению в клетке ярко окрашенных органелл - хлоропластов, увлекаемых движущейся прозрачной бесцветной протоплазмой, при этом при отклонении показателя на 20% от контроля в сторону стимуляции или угнетения функции делают вывод об отсутствии токсичности водной среды, при отклонении показателя в пределах от 51 до 80% в сторону угнетения функции и в пределах от 121 до 150% в сторону ее стимуляции делают вывод о слабой степени токсичности, при отклонении показателя в пределах от 21 до 50 % в сторону угнетения функции и в пределах от 151 до 180% в сторону стимуляции делают вывод о средней степени токсичности, при отклонении показателя в пределах от 11 до 20% в сторону угнетения функции и в пределах от 181 до 250% в сторону ее стимуляции делают вывод о высокой степени токсичности, а при отклонении показателя в пределах от 0 до 10% в сторону угнетения или в пределах от 251 % и выше в сторону стимуляции делают вывод о летальной токсичности. Известно, что природные воды представляют собой сложные по физико-химическому составу системы, содержащие как различные тонкодисперсные взвешенные вещества, так и растворенные вещества минеральной и органической природы. Присутствие в воде этих примесей в тех или иных концентрациях, в том или ином качественном составе может либо усилить токсический эффект загрязняющих водоем веществ, либо снизить его. Так, например, всем известны токсические свойства меди. Однако наибольшую токсичность медь проявляет, если она находится в водоеме в ионной форме. Если в водоеме много растворенных органических ве ществ, токсичность меди снижается, так как она образует с органическим веществом природных вод (например гуминовыми и фульвокислотами) мало или вовсе нетоксичные соединения. Проявление степени токсичности многих веществ зависит также от рН, окислительно-восстановительных и ряда других свойств воды. Таким образом, предлагаемый способ позволяет выявить истинную токсичность воды данного водоема или его отдельного участка по наличию в ней загрязняющих примесей в их наиболее токсичной форме, что обычно не совпадает с валовым содержанием токсиканта, определяемым химическими методами, т.е. этот способ позволяет дать интегральную характеристику степени неблагополучного состояния той или иной категории природных пресных вод, оперативно выявить локальные источники загрязнения с целью немедленного принятия мер по их устранению. При проведении исследований в полевых условиях используют культур у валлиснерии, выращенную в стеклянных емкостях среднего объема (5-10 л), удобных для транспортировки либо на борту исследовательского судна, либо в автомашине, оборудованной под полевую лабораторию. Преимущества предлагаемого способа заключаются в следующем: 1. Повышается чувствительность способа в среднем в 10 раз. 2. Расширяется диапазон определяемых токсикантов. 3. Предлагаемый способ позволяет определить истинную токсичность воды данного водоема или его отдельного участка по наличию в ней загрязняющих примесей в их наиболее токсичной форме, что обычно не совпадает с валовым содержанием токсиканта, определяемым химическими методами, т.е. способ позволяет дать интегральную характеристику степени загрязнения природных пресных вод и оперативно выявить локальные источники загрязнения. 4. Сокращаются временные затраты на определение токсичности более, чем в 2 раза по сравнению с прототипом (в прототипе 4-4,5 часа, в предлагаемом способе 1,5-2 часа). 5. Способ прост в применении как в полевых усло виях, так и для лабораторных исследований. Выбор тест-объекта обусловлен следующим: валлиснерия типичный гидрофит, для которого вода является естественной средой обитания; цитологическими особенностями метаболизма, а именно - в клетках валлиснерии происходит ротационное движение протоплазмы, т.е. вращательное движение по периметру клетки, о скорости которого можно судить по изменению положения в клетке отдельных хорошо видимых клеточных структур (например, хлоропластов). Ротационное движение в отличие от колебательного, циркуляционного, фонтанирующего (у харовы х водорослей, корневых волосков водокраса и др.) можно легко зафиксировать под микроскопом при помощи окулярмикрометра и секундомера и выразить в стандартных единицах измерения скоростей; особенностью анатомического строения листьев - в средней их части клетки крупные, в оптической проекции сильновытянутые в виде длинных прямоугольников, вследствие чего вдоль линейных участков длинных боковых стенок клетки протоплазма движется с той или иной постоянной скоростью; ротационное движение протоплазмы свойственно и для другого водного растения - элодеи, однако у нее клетки очень мелкие, округлые, неудобные для проведения измерений скорости внутриклеточного движения; для тестирования у валлиснерии пригодны все зрелые листья, кроме очень молодых и старых, в то время как у эродеи хорошо видимое ротационное движение протоплазмы можно обнаружить лишь в молодых листьях, расположенных на верхушках побегов; простота получения культуры этого неприхотливого водного растения, хорошо адаптированного к широкому диапазону возможных изменений рН, Eh, rН среды. Способ осуществляется следующим образом. С помощью батометра отбирают пробы воды и наливают ее в соответственно маркированные химические стаканы. В каждый химический стакан с испытуемой водой помещают по 1-2 листа валлиснерии, отделенных от материнского растения, и экспонируют их в течение 1-1,5 часов при температуре 24-25 градусов по Цельсию. Контролем служат растения, экспонируемые в чистой аквариумной воде, в которой выращивали исходную культур у валлиснерии. По истечении экспозиции лист валлиснерии вынимают из стакана и из него готовят препарат для просмотра под микроскопом. Препарат готовят следующим образом. Из медиальной части листа высекают три кусочка листовой пластинки и помещают их на предметное стекло в каплю воды, в которой экспонировались листья, накрывают покровным стеклом и просматривают на световом микроскопе (объектив 40, окуляр 7). Наблюдения проводят в прозенхимных клетках листа вблизи центрального сосудисто-волокнистого пучка. Эти клетки наиболее удобны для проведения наблюдения, так как они в оптической проекции имеют сильно вытянутые боковые стороны и короткие основания. Для этих клеток характерно ротационное движение протоплазмы, о скорости которого можно судить по изменению положения в клетке отдельных мелких хорошо видимых клеточных стр уктур, перемещающи хся вместе с прозрачной протоплазмой. Такими структурами могут быть средних размеров зрелые ярко окрашенные хлоропласты. Вдоль длинной оси клетки хлоропласты, увлекаемые движущейся протоплазмой, перемещаются с определенной постоянной скоростью, которую можно измерить при помощи окулярмикрометра, фиксируя время прохождения хлоропластом одного или нескольких его делений секундомером. Скорость I движения протоплазмы рассчитывают по формуле: V = , где t V - скорость движения протоплазмы, кол-во делений/сек; I - количество делений окулярмикрометра; t - время, сек. Повторность опытов трехкратная. Из отдельных поверхностей готовят по препарату и в каждом из них проводят по 20-30 измерений. Полученный материал обрабатывают статистически при помощи формул, общепринятых в практике вариационной статистики. О степени токсичности испытуемых образцов вод судят по отклонению величин скоростей движения протоплазмы у растений в опытных вариантах по сравнению с контролем. Воздействие может быть либо стимулирующим, либо угнетающим движение протоплазмы. Это связано с тем, что скорость движения протоплазмы является, с одной стороны, функцией интенсивности энергетических процессов, с другой - вязкости протоплазмы. Под воздействием токсических веществ может произойти как сильная стимуляция окислительновосстановительных процессов, вызывающая быстрое вращение протоплазмы и приводящая со временем к истощению организма, а, в конечном итоге, и к его гибели, так и их угнетение, сопровождающееся снижением скорости движения. Под влиянием загрязняющих природные воды веществ может измениться вязкость протоплазмы в клетках тест-организма. Переход состояния протоплазмы из золя в гель и обратно существенно отражается на ее подвижности. С разжижением протоплазмы связано увеличение скорости ее движения. Повышение вязкости вследствие коагуляции белков протоплазмы снижает скорость ее движения вплоть до полной остановки. Чем выше абсолютная величина отклонения от контроля, тем более глубокие нарушения происходят в метаболизме клетки. Пример 1. На научно-исследовательском судне "Академик В.И. Вернадский" отбирали пробы воды в различных точках каскада днепровских водохранилищ: у г. Днепродзержинска (Днепродзержинское водохранилище), у г. Энергодара (Каховское в-ще), у села Новая Украинка (Каневское в-ще), в роднике вблизи г. Новой Каховки. Отобранные пробы воды исследовали на токсичность предлагаемым способом (сущность метода описана выше). Полученные результаты исследований сведены в таблице. Оказалось, что изменение скорости движения протоплазмы в клетках валлиснерии под влиянием испытуемых вод колеблется в достаточно широком диапазоне. У г. Днепродзержингка скорость движения протоплазмы составила 73% от контроля, что соответствует слабой степени токсичности; у г. Энергодара - 45%, что соответствует средней степени токсичности. У с. Новая Украинка в Каневском водохранилище скорость движения протоплазмы превысила контроль и составила 212%, что соответствуе т высокой степени токсичности. Родниковая вода, как и следовало ожидать, была на уровне контроля, т.е. соответствовала абсолютно чистой воде. Предлагаемый нами способ можно использовать не только для оценки токсичности природных вод, но и в модельных водных системах: для оценки токсичности растворов, содержащих испытуемые токсические вещества; для оценки токсичности сточных вод ряда производств; для контроля вод на входе и выходе того или иного участка технологического процесса, в ходе которого образуются загрязняющие компоненты, Пример 2. Для исследования или контроля токсичности сточных вод проводят предварительную калибровку эталонных токсикантное 100 т.е. тех загрязнителей, наличие которых в стоках известно. Для этого в лабораторных условиях по методике, аналогичной в примере 1, проведены исследования токсичности воды, содержащей соли тяжелых металлов. Диапазон концентраций испытуемых растворов солей составил от 1 до 1000 ПДК действующего начала. Результаты проведенных испытаний представлены графически на фигура х 1 (А, Б, В, Г). Построение калибровочных графиков позволяет проследить динамику токсического воздействия в градиенте испытуемых токсикантов. На фигурах А и Б четко видно стимулирующее воздействие (на 20-30%) солей марганца и меди в концентрациях, в 2-3 раза превышающих ПДК действующего химического элемента, Дальнейшее увеличение концентрации этих элементов приводит к стойкому уменьшению скорости движения протоплазмы с резким снижением и полной остановкой движения под влиянием концентраций, в 100-1000 раз превышающих ПДК эти х элементов. Однако не все тяжелые металлы в малых концентрациях стимулируют движение протоплазмы. Например, цинк и никель (фиг. В, Г) при возрастании концентрации от 1 до 10 ПДК вызывают стойкое снижение скорости движения протоплазмы до полной ее остановки под влиянием критических концентраций. Таким образом, в приведенных примерах четко регистрируется токсичность исследуемых растворов. Из приведенных калибровочных графиков видно, что чувствительность этого способа по тяжелым металлам составляет несколько ПДК, т.е. 0,05-0,15 мг/л, в то время как при регистрации плазмолиза (прототип) она составляет 1-10 мг/л.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of toxicity of water medium
Автори англійськоюSirenko Lidiia Yakimivna
Назва патенту російськоюСпособ определения токсичности водной среды
Автори російськоюСиренко Лидия Якимовна
МПК / Мітки
МПК: G01N 33/18
Мітки: середовища, визначення, спосіб, токсичності, водного
Код посилання
<a href="https://ua.patents.su/5-3918-sposib-viznachennya-toksichnosti-vodnogo-seredovishha.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення токсичності водного середовища</a>
Попередній патент: Спосіб виплавки сталі у подовому сталеплавильному агрегаті
Наступний патент: Установка пожежегасіння
Випадковий патент: Біометричний сенсор та спосіб його виготовлення (варіанти)