Спосіб виготовлення комбінованого препарату інсуліну людини
Номер патенту: 46668
Опубліковано: 15.05.2002
Автори: Сологуб Павло Павлович, Пояркова Світлана Олексіївна, Лесик Ігор Павлович, Лазарєв Олексій Павлович, Рибачук Валентина Миколаївна, Прудієв Дмитро Павлович, Мельник Валерій Миколайович, Луців Володимир Романович, Стадник Віктор Іванович, Соляник Людмила Павлівна, Власенко Микола Миколайович
Формула / Реферат
Даний винахід відноситься до похідних дигідроімідазо[5,1-а]-![]() -карболіну загальної формули (І), в якій, зокрема: R1, R2, R3, R4, R6 і R7 однакові або різні, незалежно один від одного, означають атом водню, атом галогену, алкіл, гідроксил, алкоксил, тригалогеналкіл, алкіламіногрупу, діалкіламіногрупу, арил, арилалкіл, карбоксил, алкілкарбонілоксигрупу, ацил, арилоксигрупу або арилалкоксил; R5 означає атом водню, алкіл або арилалкіл; та їх ізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою. Застосування як лікарського засобу особливо як снодійного.
-карболіну загальної формули (І), в якій, зокрема: R1, R2, R3, R4, R6 і R7 однакові або різні, незалежно один від одного, означають атом водню, атом галогену, алкіл, гідроксил, алкоксил, тригалогеналкіл, алкіламіногрупу, діалкіламіногрупу, арил, арилалкіл, карбоксил, алкілкарбонілоксигрупу, ацил, арилоксигрупу або арилалкоксил; R5 означає атом водню, алкіл або арилалкіл; та їх ізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою. Застосування як лікарського засобу особливо як снодійного.
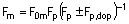 (І)
(І)
Текст
Спосіб виготовлення комбінованого препарату інсуліну людини, який включає одержання ефіру інсуліну людини транспептидацією свинячого інсуліну надлишком ди-трет-бутилового ефіру треоніну у водно-органічному середовищі в присутності трипсину, хроматографічне очищення отриманого ефіру, зняття захисних груп, кристалізацію інсуліну людини, приготування частки короткої дії комбінованого препарату шляхом розчинення певної кількості кристалів інсуліну в розбавленій кислоті та змішування з розчинами консерванту, ізотонічного агента і речовинами з буферною ємкістю, приготу C2 2 46668 1 3 46668 4 парату інсуліну, який включає одержання ефіру молярного надлишку ді-трет-бутилового ефіру інсуліну людини транспептидацією свинячого інсутреоніну від більш ніж 100 до 500 та за вагового ліну надлишком ді-трет-бутилового ефіру треоніну співвідношення трипсину і свинячого інсуліну від 1 у водно-органічному середовищі в присутності до 300 - 1000, потім розбавляють реакційну суміш трипсину, яка проводиться за молярного надлишку водою у 2 - 3 рази, проводять очищення рідинною ді-трет-бутилового ефіру по відношенню до свиняхроматографією високого тиску ефіру інсуліну лючого інсуліну більше ніж 5 і за вагового співвіднодини та інсуліну людини, одержаного після прямої шення трипсину і свинячого інсуліну від 1 до 1 кристалізації, при приготуванні обох часток комбі200, інгібування реакції створенням кислого серенованого препарату розчинення кристалів інсуліну довища з pH 3, очищення отриманого ефіру аніонв розбавленій кислоті проводять поетапно, причім ною та/або катіонною хроматографією, зняття заспочатку одержують дрібнодисперсну суспензію хисних груп відомим способом трифтороцтовою кристалів інсуліну у воді, потім до неї додають рокислотою, кристалізацію інсуліну людини, приготузбавлену кислоту, і при приготуванні частки провання частки короткої дії комбінованого препарату лонгованої дії комбінованого препарату суміш, шляхом розчинення певної кількості кристалів інотриману після змішування з забуференими розсуліну в розбавленій кислоті та змішування з розчинами m-крезолу, фенолу і гліцерину, витримучинами консерванту, ізотонічного агента і речовиють за температури 18 - 21°С протягом 20 - 22 нами з буферною ємністю, приготування частки годин. пролонгованої дії комбінованого препарату шляСупутніми спорідненими домішками до свиняхом розчинення кристалів інсуліну, які залишиличого інсуліну являються свинячий проінсулін та ся, також в розбавленій кислоті з наступним додапродукти модифікації і деградації свинячого інсуванням кислих розчинів іонів цинку і ліну. протамінсульфату, змішуванням з забуференими Водно-органічне середовище являє собою ворозчинами m-крезолу, фенолу і гліцерину, витриду з сумішшю апротонних (наприклад, діметілацемуванням суміші до утворення кристалів та поєдтамід) та протонних (наприклад, 1,2 етандіол, 1,4 нання отриманих часток комбінованого препарату бутандіол, 1,5 пентадіол) розчинників. інсуліну [Galenics of Insulin Preparations. J. Brange Трипсин у представленому технічному рішенні et.al., стр. 27, 31, 43, 66]. Цей спосіб дозволяє збіможе бути свинячим або бичачим. льшити вихід ефіру інсуліну людини, який харакВ реакції транспептидації може використовутеризує вихід інсуліну у процесі виробництва готоватися ді-трет-бутиловий ефір треоніну або його вих лікарських форм, до 60% (а за певних умов і сіль. навіть до 90%), суттєво знизити кількість шкідлиРозбавлення реакційної суміші водою в 2 - 3 вих домішок, які важко усуваються (до 7%), та зарази дозволяє безпосередньо наносити розбавлебезпечити стабільність фізичного стану готової ну суміш на колонку системи рідинної хроматоглікарської форми. рафії високого тиску або, як вона ще називається, Але недоліками цього способу все ще залисистеми високоефективної рідинної хроматографії шаються досить високі імунологічні властивості (ВЕРХ), що спрощує спосіб та усуває необхідність препарату та значні втрати інсуліну у процесі вивиконання ряду технологічних операцій, які описаробництва. ні в прототипі, тобто: осадження реакційної суміші, Завданням винаходу є створення ефективновідокремлення осаду центрифугуванням, розчиго, економічного способу виготовлення комбінованення осаду. Необхідність виконання таких операного препарату інсуліну з низькими імунологічними цій також усувається і після зняття захисних груп властивостями, який гарантує збільшення виходу завдяки прямій кристалізації. інсуліну в процесі виробництва. Окрім того, використання системи ВЕРХ доПоставлене завдання вирішується тим, що у зволяє ефективно відокремити ефір інсуліну люспособі виготовлення комбінованого препарату дини від свинячого інсуліну, який не прореагував, інсуліну людини, який включає одержання ефіру та домішок-супутників реакції транспептидації. інсуліну людини транспептидацією свинячого інсуЗаключне очищення кінцевого продукту перліну надлишком ді-трет-бутилового ефіру треоніну шої стадії - інсуліну людини, який одержується у водно-органічному середовищі в присутності після зняття захисних груп відомим способом тритрипсину, хроматографічне очищення отриманого фтороцтовою кислотою та прямої кристалізації ефіру, зняття захисних груп, кристалізацію інсуліну інсуліну людини, також проводиться на колонці людини, приготування частки короткої дії комбіносистеми високоефективної рідинної хроматографії ваного препарату шляхом розчинення певної кільі дозволяє досягти ще кращих результатів. кості кристалів інсуліну в розбавленій кислоті та Умови реакції транспептидації (ферментзмішування з розчинами консерванту, ізотонічного субстратне співвідношення та молярний надлишок агента і речовинами з буферною ємністю, приготуді-трет-бутилового ефіру треоніну), які відрізняють вання частки пролонгованої дії комбінованого прерішення, що заявляється, дозволяють збільшити парату шляхом розчинення кристалів інсуліну, які ступінь конверсії свинячого інсуліну або вихід ефізалишилися, також в розбавленій кислоті з настуру інсуліну людини до 98% та зменшити кількість пним додаванням кислих розчинів іонів цинку і домішок, котрі важко усуваються, до 1,5%. На ще протамінсульфату, змішуванням з забуференими більший ступіть усунення домішок спрямоване і розчинами m-крезолу, фенолу і гліцерину і витридодаткове очищення кристалів інсуліну людини муванням суміші до утворення кристалів, поєддо 0,9%. нання отриманих часток комбінованого препарату Для приготування лікарської форми інсуліну інсуліну, реакцію транспептидації проводять за пролонгованої дії кристали інсуліну спочатку су 5 46668 6 спендують у воді і добре перемішують до одерякості рухомої фази використали 0,05M ацетатний жання дрібнодисперсної суспензії, а потім додають буфер, який містив пропанолу-2 від 10 до 20% за до неї 1M HCl. Приготування дрібнодисперсної pH 2,5. Фракцію інсуліну людини відкристалізували суспензії на першому етапі, тобто коли кожна за pH 5,8, суспензію кристалів профільтрували, окрема дрібна частка інсуліну виявляється вже з промили водою та ліофільно висушили. Вихід інусіх боків оточеною водою, створює умови для їх суліну людини склав 5,05г. Методом імунофермешвидкого розчинення у розбавленій кислоті на нтного аналізу було встановлено, що залишок другому етапі. Таким чином, час контакту кристасвинячого проінсуліну у отриманому інсуліні людилів інсуліну з кислотою зменшується, що призвони становив менше 1мкг/г. Щодо інших споріднедить до зменшення утворення А21-дезаміду інсуних домішок, то за допомогою аналітичної системи ліну, а отже до підвищення чистоти препарату. ВЕРХ був встановлений їх вміст - 0,85%. Потім додають кислі розчини іонів цинку та протаПриготування кристалічної частки пролонговамінсульфату, змішують з забуференими розчинаної дії комбінованого препарату інсуліну, яка склами, які обов'язково містять і m-крезол, і фенол, а дає 85% від загальної кількості інсуліну. також гліцерин. Одержаний розчин витримують за Кристали інсуліну людини у кількості 2,295г температури 18 - 21°С протягом 20 - 22 годин. Тапомістили в 170мл води, а потім добре перемішакий режим вирощування кристалів дозволяє одерли до одержання дрібнодисперсної суспензії, дожати кристалічну суспензію зі звуженим діапазодали 1М НСl в такій кількості, щоб pH розчину був ном довжини кристалів тетрагональної форми не нижче 3,1. 0,189г протамінсульфату розчинили порівняно з прототипом (від 1 до 25мкм і від 1 до у 31мл води, додаючи 1M HCl до такого ж pH. 60мкм, відповідно), що забезпечує більш рівномір0,135г цинку хлориду додали у розчин протамінсуне вивільнення інсуліну в організмі людини, тобто льфату. Потім змішали всі приготовані кислі роззабезпечує одержання препарату більш високої чини. Далі приготували буферний розчин з 3,125г якості. натрію фосфорнокислого однозаміщеного двоводКомбіновані препарати за даним способом ного в 1,235л води, додали ще 23,8г гліцерину, можуть бути виготовлені з різними пропорціями 2,23г m-крезолу і 0,895г фенолу та перемішували розчинної та кристалічної часток інсуліну, наприпротягом 30 хвилин і pH суміші довели до 7,8. Далі клад, 15/85, 25/75, 50/50. Такі препарати зберігабуферний розчин піддали стерилізуючій фільтрації ють свої хімічні та фізичні властивості, незалежно і профільтрували туди суміш кислих розчинів провід співвідношення розчинної та кристалічної частамінсульфату, цинку хлориду та інсуліну. Отриток, і забезпечують спрощення процедури введенману суміш витримали, перемішуючи, за темпераня препарату та збільшують точність дозування. тури 20°C протягом 21 години для одержання Вирішення поставленого завдання ілюструєтькристалічної суспензії. ся прикладами конкретного виконання. Приготування розчинної частки короткої дії Приклад 1 комбінованого препарату, яка складає 15%. 6г сирого свинячого інсуліну суспендували в Кристали інсуліну людини у кількості 0,405г 24мл води, додали 3,0мл оцтової кислоти, 180мл помістили в 52,5мл води, а потім добре переміша0,7М ді-трет-бутилового ефіру треоніну в суміші ли до одержання дрібнодисперсної суспензії, додіметілацетаміду та 1,4 бутандіолу, 19мг трипсину дали 1M HCl в такій кількості, щоб pH розчину був в 12мл 0,05M кальцію ацетату, реакційну суміш не нижче 3,1. Далі приготували буферний розчин з перемішували протягом 16 годин за температури 0,55г натрію фосфорнокислого однозаміщеного 23°С. Реакцію інгібували розбавленням водою у двоводного в 210мл води, додали ще 4,2г гліцеридва рази по відношенню до об'єму реакційної суну, 0,39г m-крезолу і 0,157г фенолу та перемішуміші і pH суміші довели до 2,5 10% НСl. Розбавлевали протягом 30 хвилин і pH суміші довели до ну реакційну суміш відфільтрували через фільтр з 7,4. Розчин інсуліну змішали з буферним розчином розміром пор 0,2мкм для нанесення на колонку і провели стерилізуючу фільтрацію в ємність з системи ВЕРХ. В якості нерухомої фази викорискристалічною суспензією, перемішали протягом тали сорбент DIASOGEL ODS (С 18) з розміром години і розлили в асептичних умовах у флакони часток 15мкм і розміром пор 120Ǻ. Для рухомої та картриджі. Дослідження комбінованого препафази використали 0,05M гліцин-НСl буфер, який рату інсуліну за допомогою аналітичної системи містив 0,015M амонію сульфату і пропанолу-2 з ВЕРХ показали, що препарат має загальну активконцентрацією від 20 до 35% за pH 2,5. Фракцію ність 39,9МО/мл, вміст високомолекулярних споефірної похідної осадили в присутності іонів цинку лук 0,3%, споріднених супутніх домішок 0,9%, А21за pH від 6,8 до 7,0, відцентрифуговали, одержадезаміду інсуліну 0,4%, активність супернатанту ний осад промили водою та висушили у вакуумній складає 6,5МО/мл.. Кристали, досліджені за допосушильній шафі. 5,0г одержаного ефіру інсуліну могою мікроскопа з 400-кратним збільшенням, людини розчиняли в 60мл трифтороцтової кисловиявили тетрагональну форму і довжину від 3 до ти, витримали суміш протягом 40 хвилин за тем21мкм. ператури 25°С, трифтороцтову кислоту відігнали Приклад 2 на роторному випарнику за температури не вище Умови одержання комбінованого препарату інніж 30°С, одержаний залишок сирого інсуліну люсуліну, як в прикладі 1, за винятком того, що співдини розчинили у воді і провели пряму цитратну відношення розчинної частки до кристалічної кристалізацію за pH 5,8. складало 25/75. Дослідження комбінованого преКристалічну суспензію профільтрували, криспарату згідно з прикладом 2 показали, що активтали промили водою, розчинили в 0,25M оцтовій ність препарату, вміст високомолекулярних спокислоті та нанесли на колонку системи ВЕРХ. В лук, споріднених супутніх домішок, А21-дезаміду 7 46668 8 інсуліну і розміри кристалів були на рівні, описанту складає 5,9МО/мл. Довжина кристалів складаному в першому прикладі, але в межах помилки ла 2 - 24мкм. визначення. При цьому активність супернатанту Приклад 8 складала 10,3МО/мл. Умови одержання комбінованого препарату інПриклад 3 суліну людини, як в прикладі 1, за винятком того, Умови одержання комбінованого препарату інщо розчин, одержаний після змішування з забусуліну, як в прикладі 1, за винятком того, що співференими розчинами m-крезолу, фенолу і гліцевідношення розчинної частки до кристалічної рину, витримували за температури 14°С. Досліскладало 50/50. Дослідження комбінованого предження комбінованого препарату згідно з парату з згідно прикладом 3 показали, що активприкладом 8 показали, що активність препарату, ність препарату, вміст високомолекулярних сповміст високомолекулярних сполук, споріднених лук, споріднених супутніх домішок, А21-дезаміду супутніх домішок, А21-дезаміду інсуліну, активінсуліну і розміри кристалів були на рівні, описаність супернатанту були на рівні, описаному в ному в першому прикладі, але в межах помилки першому прикладі, але в межах помилки визнавизначення. При цьому активність супернатанту чення. Однак при цьому 95% кристалів мали довскладала 21МО/мл. жину від 1 до 55мкм. Приклад 4 Приклад 9 Умови одержання комбінованого препарату інУмови одержання комбінованого препарату інсуліну, як в прикладі 1, за винятком того, що на суліну людини, як в прикладі 1, за винятком того, першій стадії процесу додали 30мг трипсину в що розчин, одержаний після змішування з забу12мл 0,05M кальцію ацетату, а реакцію проводили ференими розчинами m-крезолу, фенолу і гліцепротягом 10 годин за температури 23°С. Вихід рину витримували за температури 25°С. Досліінсуліну склав 3,76г. Дослідження комбінованого дження комбінованого препарату згідно з препарату з згідно прикладом 4 показали, що акприкладом 9 показали, що активність препарату, тивність препарату складає 39,2МО/мл, вміст вивміст високомолекулярних сполук, споріднених сокомолекулярних сполук 0,7%, споріднених супусупутніх домішок, А21-дезаміду інсуліну були на тніх домішок 4,1%, А21-дезаміду інсуліну 2,0%, а рівні, описаному в першому прикладі, але в межах активність супернатанту 6,4МО/мл. Довжина криспомилки визначення. Довжина кристалів дорівнюталів складала 2 - 23мкм. вала від 1 до 50мкм і активність супернатанту стаПриклад 5 новила 8,3МО/мл, що свідчило про неповний проУмови одержання комбінованого препарату інцес кристалізації. суліну, як в прикладі 1, за винятком того, що на Приклад 10 першій стадії процесу додали 4,8мг трипсину в Умови одержання комбінованого препарату ін12мл 0,05M кальцію ацетату, а реакцію проводили суліну людини, як в прикладі 1, за винятком того, протягом 10 годин за температури 23°С. Вихід що розчин, одержаний після змішування з забуінсуліну склав 3,395г. Дослідження комбінованого ференими розчинами m-крезолу, фенолу і гліцепрепарату з згідно прикладом 5 показали, що акрину витримували протягом 17 годин. Дослідження тивність препарату складає 38,5МО/мл, вміст викомбінованого препарату згідно з прикладом 10 сокомолекулярних сполук 0,8%, споріднених супупоказали, що активність препарату, вміст високотніх домішок 1,8%, А21-дезаміду інсуліну 0,8%, молекулярних сполук, споріднених супутніх доміактивність супернатанту складає 6,8МО/мл. Довшок, А21-дезаміду інсуліну, активність супернатажина кристалів складала 2 - 25мкм. нту були на рівні, описаному в першому прикладі, Приклад 6 але в межах помилки визначення. Кількість крисУмови одержання комбінованого препарату інталів з довжиною від 1 до 25мкм складала тільки суліну людини, як в прикладі 1, за винятком того, 55%. що на першій стадії процесу додали 180мл 0,51M Приклад 11 ді-трет-бутилового ефіру треоніну в суміші діметіУмови одержання комбінованого препарату інлацетаміду та 1,4 бутандіолу. Вихід інсуліну склав суліну людини, як в прикладі 1, за винятком того, 3,1г. Дослідження комбінованого препарату згідно що розчин, одержаний після змішування з забуз прикладом 6 показали, що препарат має активференими розчинами m-крезолу, фенолу і гліценість 39,3МО/мл, вміст високомолекулярних спорину витримували протягом 25 годин. Дослідження лук 0,8%, споріднених супутніх домішок 1,6%, А21комбінованого препарату згідно з прикладом 11 дезаміду інсуліну 0,8%, а активність супернатанту показали, що активність препарату, вміст високоскладає 7,0МО/мл. Довжина кристалів складала 1 молекулярних сполук, споріднених супутніх домі- 25мкм. шок, А21-дезаміду інсуліну, активність супернатаПриклад 7 нту були на рівні, описаному в першому прикладі, Умови одержання комбінованого препарату інале в межах помилки визначення. Кількість криссуліну людини, як в прикладі 1, за винятком того, талів з довжиною від 1 до 25мкм складала 95%. що на першій стадії процесу додали 180мл 1,29M Такий же результат одержують і коли розчин виді-трет-бутилового ефіру треоніну в суміші діметітримують 22 години, тобто тут просто процес оделацетаміду та 1,4 бутандіолу. Вихід інсуліну склав ржання готової лікарської форми необґрунтоване 3,44г. Дослідження комбінованого препарату згідзатягується. но з прикладом 7 показали, що препарат має актиОтже, аналіз прикладів конкретного виконання вність 39,3МО/мл, вміст високомолекулярних спо(приклади 1 - 3) свідчить, що способом, який заявлук 0,75%, споріднених супутніх домішок 1,3%, ляється, можуть бути одержані комбіновані препаА21-дезаміду інсуліну 1,1%, активність супернатарати інсуліну людини з різним співвідношенням 9 46668 10 кристалічної та розчинної часток. Використання тик комбінованого препарату. Недодержання реданого способу дозволяє збільшити вихід інсуліну жиму вирощування кристалів, який заявляється людини, зменшитикількість домішок, тобто поліп(приклади 8 - 11), не дозволяє одержати більш шити чистоту препарату. У той же час аналіз прикоднорідні кристали за довжиною, а отже не забезладів 4 - 7 показує, що недодержання діапазонів печує більш рівномірне вивільнення інсуліну в орвеличин, які заявляються, призводить до зменганізмі людини, тобто одержання препарату більш шення виходу інсуліну та погіршення характерисвисокої якості. Комп’ютерна верстка М. Клюкін Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing combined dosage form of human insulin
Автори англійськоюLazariev Oleksii Pavlovych, Lutsiv Volodymyr Romanovych, Rybachuk Valentyna Mykolaivna, Lesyk Ihor Pavlovych
Назва патенту російськоюСпособ получения комбинированного препарата инсулина человека
Автори російськоюЛазарев Алексей Павлович, Луцив Владимир Романович, Рыбачук Валентина Николаевна, Лесик Игорь Павлович
МПК / Мітки
МПК: A61K 38/28, C07K 14/62
Мітки: інсуліну, людини, спосіб, комбінованого, виготовлення, препарату
Код посилання
<a href="https://ua.patents.su/5-46668-sposib-vigotovlennya-kombinovanogo-preparatu-insulinu-lyudini.html" target="_blank" rel="follow" title="База патентів України">Спосіб виготовлення комбінованого препарату інсуліну людини</a>
Попередній патент: Спосіб приготування готової лікарської форми інсуліну короткої дії
Наступний патент: Спосіб переробки шкіряних відходів у шкіряний порошок
Випадковий патент: Модифікатори адгезії і когезії для асфальту









