Спосіб одержання оксикодону
Номер патенту: 86094
Опубліковано: 25.03.2009
Автори: Снупарек Владіслав, Прокса Бохуміл, Ратковска Любіца
Формула / Реферат
1. Спосіб одержання оксикодону формули І, який відрізняється тим, що тебаїн формули II або його аналог формули III, де R являє собою С2-С5алкіл, алкіларил, переважно бензил, метоксибензил або аліл,
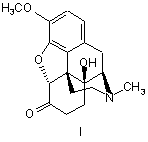 ,
,
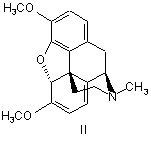 ,
,
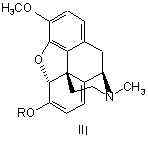 ,
,
перемішують з пероксидом водню або пероксокислотами у присутності щавлевої кислоти та іншої органічної кислоти, з одержаного кристалічного осаду оксалату 14-гідроксикодеїнону шляхом додавання основи виділяють 14-гідроксикодеїнон формули IV
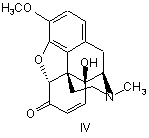 ,
,
який гідрують воднем у присутності каталізатора, з одержанням оксикодону формули (І).
2. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що інша органічна кислота є мурашиною кислотою або оцтовою кислотою.
3. Спосіб одержання оксикодону за п. 1 або 2, який відрізняється тим, що концентрація мурашиної кислоти становить 80-90 %, переважно 88 %.
4. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що концентрація пероксиду водню становить 25-33 %.
5. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що пероксокислота є пероксооцтовою кислотою, пероксобензойною кислотою або м-хлорпероксобензойною кислотою.
6. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що молярне співвідношення тебаїн або його аналог : щавлева кислота : інша органічна кислота : пероксид водню або пероксокислота становить 0,8-2:1:2,0-3,0:2,0-3,0, переважно 1,5-2,0:1:2,3-2,7:2,3-2,7.
7. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що температуру під час реакції тебаїну або його аналогів з пероксидом водню або пероксокислотами підтримують 0-35 °С, переважно 15-25°С.
8. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що кристалічний осад оксалату 14-гідроксикодеїнону розділяють, за допомогою фільтрації, центрифугування або декантації, тверді речовини розчиняють у воді, 14-гідроксикодеїнон вивільняють шляхом додавання основи, або реакційну суміш, що містить оксалат 14-гідроксикодеїнону, підлуговують шляхом додавання основи і осаджений 14-гідроксикодеїнон виділяють шляхом фільтрації, декантації або центрифугування.
9. Спосіб одержання оксикодону згідно з будь-яким з пунктів 1 та 5, який відрізняється тим, що значення показника рН у підлуженій реакційній суміші, що містить оксалат 14-гідроксикодеїнону, становить 9-10, переважно 9,2-9,6.
10. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що 14-гідроксикодеїнон, розчинений у водному розчині органічної кислоти, гідрують воднем у присутності каталізатора.
11. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що оксикодон використовують для одержання гідрохлориду оксикодону.
12. Фармацевтична композиція, що містить оксикодон або його гідрохлорид, одержаний згідно з пунктом 1, і принаймні один фармацевтично прийнятний ексципієнт.
Текст
1. Спосіб одержання оксикодону формули І, який відрізняється тим, що тебаїн формули II або його аналог формули III, де R являє собою С2С5алкіл, алкіларил, переважно бензил, метоксибензил або аліл, C2 2 (19) 1 3 86094 4 11. Спосіб одержання оксикодону за п. 1, який відрізняється тим, що оксикодон використовують для одержання гідрохлориду оксикодону. 12. Фармацевтична композиція, що містить оксикодон або його гідрохлорид, одержаний згідно з пунктом 1, і принаймні один фармацевтично прийнятний ексципієнт. Даний винахід стосується фармацевтичного виробництва, а саме одержання Оксикодону (І), який представляє собою сильний анальгетичний засіб, який використовують в терапевтичній практиці в формі його гідрохлориду або використовують як проміжний продукт під час виробництва антагоністів морфину таких як Налоксон або Налтрексон. лоти (Krassnig R., Hederer Ch., Schmidhammer H.: Arch. Pharm. 329, 325 (1996)). Співставні результати досягаються, коли тебаїн (II) взаємодіє з пероксокислотами, наприклад, мхлорпербензойною кислотою в суміші оцтової кислоти і трифтороцтової кислоти (Hauser F.M., Chen T-K., Carroll F. I. J. Med.Chem. 17, 1117 (1974)); але Ijima і інші прийшли до висновку, що в результаті цієї реакції не забеспечуються відтворювані виходи (приблизно 25 %) і утворюється велика кількість небажаних продуктів (lijima I., Rice К.С, Brossi, Α.: Helv. Chim. Acta 60, 2135 (1977)). В модифікованій процедурі, замість тебаїну (II) може використовуватися кодеїн (V), Схема 2, який спочатку окислюють з одержанням кодеїнону (VI), який за допомогою реакції з будь-яким ацилюючим або алкілувальним агентами, забеспечує енолетер/естер VII (ЕР 889045, US 5,869,669, US 4,639,520), по суті аналог тебаїну, який потім поступово перетворюють на 14р-гідроксикодеїнон (IV) за допомогою будь-якого з вищезгаданих способів. Оксикодон (І) одержують двома основними способами: а) Перетворенням тебаїну (II), природного алкалоїду, виділеного з рослини Papaver somniferum L, або його аналогів (III), де R представляє собою алкокси- або аміноалкільний залишок. Під час цієї процедури (Схема 1), тебаїн (II) взаємодіє в кислому середовищі з пероксидом водню, пероксокислотами або іншими оксидуючими агентами з утворенням 14b-гідроксикодеїнону (IV), який гідрують з одержанням Оксикодону (І). Тебаїн, розчинений в гарячій концентрованій оцтовій кислоті перетворюється на 14bгідроксикодеїнон за допомогою реакції з 30% пероксидом водню (Freund Μ., Speyer Ε.: J.Prakt. Chem. 94, 135 (1916); Lutz R.E., Small L. J. Org.Chem. 4, 220-233 (1939); DE 286431) приблизно з 30% виходом. Приблизно такий самий вихід одержують також окисленням тебаїну (II) за допомогою хромової кислоти (DE 286431; DE 411530) або ацетату марганцю (Viebock F.: Chem. Ber. 67, 197 (1934)). Значно більший вихід (приблизно 75%) спостерігається, коли тебаїн (II) взаємодіє з пероксидом водню в оцтовій кислоті при температурі, що не перевищує 40 °С (Feldmann I.Ch., Liutenberg A.I.: Zh. Prikl. Khim. 18, 715 (1945)), або в суміші сірчаної кислоти та 88% мурашиної кис До цієї групи можна також віднести спосіб Sankyo (GB 1.260.699), в якому вихідною сполукою для здійснення способу є кодеїнон (VI), який взаємодією з піролідином в апротонних розчинниках, забезпечує кодеїнонпіролідиніленамін (VIII), Схема 3. Наступною реакцією з пероксидом водню, хромовою кислотою, органічними пероксикислотами (пероксиоцтовою, пероксибензойною) або перманганатом, в середовищі водної оцтової кислоти, фосфорної кислоти і т.д., одержують 14гідроксикодеїнон (IV). b) Окисленням кодеїнону (VI) за допомогою дії пероксикислот, комбінації органічних кислот та пероксиду водню або неорганічних оксидуючих агентів (наприклад, Со3+ солей), з максимальним виходом 57 % 14р-гідроксикодеїнону, який гідрували до Оксикодону (І) (Coop Α., Rice K.C.: Tetrahedron 55, 11429 (1999)). 5 C-7-C-8 подвійний зв'язок 14bгідроксикодеїнону гідрували в присутності каталізатора відповідно до СН 75110 (США 1.468.805) на Pt черні, колоїдному Pd або в присутності PdCI2 (США 1.485.673) в розведеній оцтовій кислоті. У Ijima також як і у Lutz R.E. та Small L. (J. Org. Chem. 4, 220 (1939)) як каталізатор цієї реакції використовують Pd/BaSO4 (J. Med. Chem. 21, 398 (1978)); відомо також використання 10 % Pd/C в концентрованій оцтовій кислоті (Krassnig R., Hederer Ch., Schmidhammer H.: Arch.Pharm. 329, 325 (1996)), з виходом приблизно 70 %. У Feldmann та Liutenberg (Zh. Prikl. Khim. 18, 715 (1945)) гідрохлорид 14b-гідроксикодеїнону гідрували на нікелі Ренея (Raney-Ni) в гарячому етанолі з 74 % виходом гідрохлориду Оксикодону. Всі згадані способи одержання Оксикодону (І) мають наступні недоліки: реакція пероксиду/пероксикислот з тебаїном або його аналогами не надає однозначно відтворюваних результатів, утворюється суміш побічних продуктів, що погано відділяються і виходи є низькими. Ці недоліки усуваються за допомогою способу згідно з винаходом. Стислий опис винаходу Представлений винахід забезпечує спосіб одержання Оксикодону формули І за допомогою реакції тебаїну (II) або його аналогів формули III, де R представляє собою С2 -С5 алкіл, алкіларил, переважно бензил, метоксибензил або аліл, з пероксидом водню або пероксокислотами такими як пероксооцтова кислота, пероксобензойна кислота або м-хлорпероксобензойна кислота, в присутності щавелевої кислоти та іншої органічної кислоти, наприклад, мурашиної кислоти або оцтової кислоти, з утворенням кристалічного осаду оксалату 14-гідроксикодеїнону, з якого шляхом додавання основи виділяли осад, 14гідроксикодеїнон формули IV, який гідрували воднем у присутності каталізатора, одержуючи Оксикодон (І). За допомогою реакції тебаїну або його аналогів формули III з пероксидом водню або пероксокислотами у присутності щавелевої кислоти та іншої органічної кислоти одержують 14гідроксикодеїнон, який з щавелевою кислотою, утворює слабкорозчинний кристалічний осад оксалату 14-гідроксикодеїнону. Таким чином рівновага реакції перетворення тебаїну зміщується і пригнічуються наступні небажані побічні реакції, такі як окислення тебаїну до транс- 10 86094 6 гідрокситебаї ну або приєднання води до 14гідроксикодеїнону, з одержанням (8S)гідроксиоксикодону, т.д. Коли мурашину кислоту використовують як іншу органічну кислоту, її концентрація є переважно 80 - 90 %, більш переважно 88 %. Концентрація пероксиду водню є переважно 25 - 33 %. Молярне співвідношення тебаїн або його аналог: щавелева кислота : інша органічна кислота : пероксид водню або пероксокислота переважно складає 0,8 - 2 : 1 : 2,0 - 3,0 : 2,0 - 3,0, більш переважно 1,5 - 2,0 : 1 : 2,3 - 2,7 : 2,3 - 2,7. Температура під час реакції тебаїну або його аналогів з пероксидом водню або пероксокислотами переважно складає 0-35°С, більш переважно 15-25°С. В попередніх способах, окислення тебаїну/аналогів тебаїну проводили пероксидом водню/пероксокислотами в присутності органічної або неорганічної кислоти (важливою є протонізація азоту в молекулі тебаїну, для того щоб уникнути утворення N-оксиду або досягти необхідної розчинності субстрату). В способі, описаному у Krassnig R. і інші, Arch. Pharm. 329, 325 (1996) використовують суміш тебаїну, сірчаної кислоти, мурашиної кислоти і пероксиду водню; система є гомогенною протягом всієї реакції. Після завершення реакції суміш виливали на лід і підлуговували шляхом додавання гідроксиду амонію. Продукт, 14-гідроксикодеїнон, екстрагували дихлорметаном. Перевага способу відповідно до представленого винаходу полягає в тому, що окислення тебаїну/його аналогів пероксидом водню або пероксокислотами у присутності кислоти та іншої органічної кислоти (мурашиної, оцтової), приводить до осадження продукту, (14гідроксикодеїнону), приводячи до гетерогенної системи, що зміщує рівновагу реакції окислення і усуває наступні реакції продукту, (14гідроксикодеїнону), з оксидуючим агентом, таким чином приводить до більш високого ступеня перетворення та одержання більш чистого продукту. Після завершення реакції реакційну суміш (суспензію) охолоджували, підлуговували (вивільнюючи 14-гідроксикодеїнон у формі основи з його солей) і осаджений продукт, (14-гідроксикодеїнон), відфільтровували, промивали та сушили. Цей спосіб передбачає більш високий вихід більш чистого продукту ніж попередні способи. В відомих способах (наприклад, Arch. Pharm. 329, 325 (1996)) в результаті реакції тебаїну з пероксидом водню у присутності сірчаної кислоти і мурашиної кислоти, вихід 14-гідроксикодеїнону складав 74,3% і 78,5%, відповідно і чистота продукту складала 88,3% і 90,1% (25 °С), відповідно. В способі відповідно до даного патенту, використовували молярне співвідношення реагентів тебаїн:щавелева кислота:мурашина кислота:пероксид водню = 16:8,6:22:21, вихід продукту складав 91,3% і чистота продукту складала 93,3 % (25°С). Реакційну суміш, утворену суспензією оксалату 14-гідроксикодеїнону в реакційному середовищі, після перетворення введеного тебаїну, можна об 7 86094 робити шляхом розділення суспензії за допомогою центрифугування, декантації або фільтрації, розчиняючи оксалат 14-гідроксикодеїнону в гарячій воді і осаджуючи 14-гідроксикодеїнон, корегуючи показник рН додаванням основи, 14гідроксикодеїнон, який відокремили, промивали та сушили. Інший спосіб відокремлення 14гідроксикодеїнону представляє процедуру, в якій реакційну суміш, в якій диспергували оксалат 14гідроксикодеїнону, підлуговували шляхом додавання основи, корегуючи показник рН до 9-10, переважно 9,2-9,6, 14-гідроксикодеїнон розділяли шляхом центрифугування або фільтрації, або необов'язково екстрагували з лужного середовищаорганічним розчинником. 14-Пдроксикодеїнон одержаний за допомогою цього способу гідрували за допомогою відомого способу у присутності каталізатора вибраного з групи рідкоземельних металів таких як Pt або Pd, 8 або Ni у водному розчині органічної кислоти, наприклад, оцтової кислоти. Одержаний Оксикодон осаджували з реакційного середовища, корегуючи показник рН шляхом додавання лугу; одержаний осад розділяли за допомогою фільтрації або центрифугування і продукт сушили. Оксикодон розчиняли в розведеній хлорводневій кислоті при температурі 70 - 90 °С і гідрохлорид Оксикодону починав кристалізуватися під час повільного охолодження. Процес виходу продукту, гідрохлориду Оксикодону в формі кристалів, характеризували за допомогою RTG дифракційного аналізу, результати якого представлені в Таблиці 1. Оксикодон або гідрохлорид Оксикодону, одержаний згідно з винаходом, може бути використаний як активний компонент в фармацевтичній композиції, що додатково містить принаймні один фармацевтично придатний ексціпієнт. Таблиця 1 Характеристичні піки в RTG дифракційній картинці гідрохлориду Оксикодону 2Θ° 8,30 10,04 10,70 11,34 12,06 12,86 13,94 14,52 16,20 17,16 RI [%] 85 37 79 39 96 34 56 34 100 44 □2Θ° 17,68 18,24 19,10 20,26 21,54 23,48 23,98 25,14 26,00 27,10 RI [%] 78 73 79 82 41 44 53 58 35 34 Представлений спосіб корисний тим, що дозволяє одержувати продукт з низьким вмістом домішок в виходах, що перевищують дані описані в попередньому рівні техніки. Наступні приклади описують спосіб згідно з винаходом більш детально; однак, не обмежують в будь-якому відношенні його об'єм. Приклади Приклад 1 а) 18,66 кг щавелевої кислоти розчиняли у воді, додавали 84,8 кг тебаїну і після цього розчиняли, додавали 19,50 кг 88% мурашиної кислоти і 42,4 кг 30% пероксиду водню. Реакційну суміш перемішували при 25° С поки не відбувалося повне перетворення тебаїну (визначали за допомогою капілярного електрофорезу; капіляр 50 см x 0,05 мм, електроліт 100 мМ TRIS/фосфат, рН 2,7, 5 мМ диметокси-Р-циклодекстрин, температура 25°С, 30 кВ; час міграції тебаїну 5,6 хв.). Реакційну суміш охолоджували до 5° С, додавали 10% водний розчин КОН при перемішуванні, при рН 9,2. Осаджені кристали 14-гідроксикодеїнону відділяли центрифугуванням, промивали водою і сушили. Одержували приблизно 76 кг 14-гідроксикодеїнону (89 %). b) 72,50 кг 14-Пдроксикодеїнону розчиняли у 10% водному розчині оцтової кислоти, додавали 5% Pd/C каталізатор і суміш гідрували в умовах □2Θ□ 27,64 28,10 28,92 29,32 29,98 31,14 33,28 33,72 34,26 35,06 RI [%] 29 44 33 26 44 21 29 26 25 36 □2Θ□ 35,66 36,84 38,18 38,98 40,36 42,96 44,10 44,88 45,84 47,56 RI [%] 21 18 20 18 18 18 27 19 16 17 надлишкового тиску електролітичного водню при 104 -106 кПа, при температурах 30 - 35 °С. Реакційну суміш розводили за допомогою 200 л води, фільтрували, фільтрат охолоджували до 5 °С і основу Оксико-дону осаджували, коригуючи показник рН додаванням етанольного розчину аміаку до досягнення значення 9,2. Суспензію центрифугували, Оксикодон промивали водою і сушили при 70 - 80 °С. Одержували принаймні 67 кг (92 %, чистота 98,5 %) Оксикодону. c) Водний розчин НСІ (87,0 кг води і 13,00 кг концентрованої НСІ) перемішували з 48 кг основи Оксикодону при 80 °С, додавали активоване вугілля і діатомову землю і після перемішування протягом 15 хвилин суспензію фільтрували, фільтрат поступово охолоджували до кінцевої температури 1-3°С. Осаджені кристали відділяли центрифугуванням, промивали етанолом і гідрохлорид Оксикодону сушили при температурі приблизно 7080°С. Одержували 51,2 кг (91%) гідрохлориду Оксикодону, температура кипіння 219 °С, [α]D20-145°, вміст води 6,0 %, чистота 99,4 % (колонка RP С8, 150 x 3,9 мм, 5 мкм, з передколонкою RP С8, 20 x 3,9 мм, 5 мкм, мобільна фаза 0,005 мол/л гексансульфонат натрію - метанол - фосфорна кислота триетиламін (о/о) (900:100:5:2), показник рН =2,5 коригували NaOH; швидкість потоку 1,5 мл/хв; те 9 86094 мпература 50 °С; УФ, λ=206 нм), вміст 100,03 % (титрування). Приклад 2 Тебаїн (1 кг) розчиняли у водному розчині щавелевої кислоти (0,21 кг у 1 л води). Додавали 0,23 кг 88 % мурашиної кислоти та 0,81 кг пероксооцтової кислоти (39 %). Реакційну суміш перемішували при 25 °С до повної витрати тебаїну (оцінювали за допомогою капілярного зонального електрофорезу (КЗЕ)). Реакційну суміш охолоджували до 5 °С, додавали 10% водний розчин гідроксиду натрію при перемішуванні до досягнення значення показника рН 9,2. Осаджені кристали 14гідроксикодеїнону відділяли центрифугуванням, промивали водою і сушили. Одержували приблизно 0,92 кг 14-гідроксикодеїнону (91,8 %). Наступна методика одержання гідрохлориду Оксикодону є подібною до наведеної в Прикладі 1b) і 1с). Приклад 3 6-Бензилокси-4,5а-епокси-3-метокси-17метилморфін-6,8(14)-дієн (52,5 г) розчиняли в розчині, одержаному розчиненням 9,8 г щавелевої кислоти у 35 мл води, додавали 10 мл оцтової кислоти і 21,2 мл 30% пероксиду водню. Реакційну суміш перемішували при 20 °С до повного перетворення бензилового аналогу тебаїну, реакційну суміш охолоджували до 2 °С, додавали 8% водний розчин NaOH при перемішуванні до досягнення значення показника рН 9,2. Осаджені кристали 14гідроксикодеїнону відфільтровували, промивали Комп’ютерна верстка Д. Шеверун 10 водою і сушили. Одержували приблизно 37 г 14гідроксикодеїнону (82 %). Наступна методика одержання гідрохлориду Оксикодону є подібною до наведеної в Прикладі 1b) і 1с). Приклад 4 4,5α-Епокси-6-етокси-3-метокси-17метилморфін-6,8(14)-дієн (22,1 г) розчиняли в розчині (10 г щавелевої кислоти в 35 мл води); додавали мурашину кислоту (9,8 мл, 88%) та пероксид водню (21,2 мл). Суміш перемішували при 30 °С протягом 30 годин, охолоджували до 10 °С, осаджений оксалат 14-гідроксикодеїнону відфільтровували та промивали. Вологий оксалат 14гідроксикодеїнону розчиняли в 80 мл води при 65 °С і додавали 10% гідроксид калію до досягнення значення показника рН 9,3, суспензію 14гідроксикодеїнону охолоджували до 15 °С, тверді речовини відфільтровували, промивали і сушили. Одержували приблизно 17,6 г 14гідроксикодеїнону (вихід 83%, чистота 93,2 %). Промислова придатність Виробництво Оксикодону формули І та його гідрохлориду описаних в цьому документі пропонує значну перевагу по відношенню до економічного попиту та боротьби з забрудненням оточующого середовища, порівняно з відомими способами. Гідрохлорид Оксикодону використовують для виробництва фармацевтичних препаратів, які мають анальгетичні дії. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the preparation of oxycodone
Автори англійськоюSnuparek Vladislav, Ratkovska Lubica, Proksa Bohumil
Назва патенту російськоюСпособ получения оксикодона
Автори російськоюСнупарек Владислав, Ратковска Любица, Прокса Бохумил
МПК / Мітки
МПК: C07D 489/00
Мітки: спосіб, одержання, оксикодону
Код посилання
<a href="https://ua.patents.su/5-86094-sposib-oderzhannya-oksikodonu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання оксикодону</a>
Попередній патент: Спосіб виготовлення колісних заготовок з ободом, диском і маточиною
Наступний патент: Електрична заземлювальна гайка
Випадковий патент: Персоніфікований протиугінний пристрій для блокування важелів педалей зчеплення, гальма та важеля або педалі керування подачею палива транспортного засобу /варіанти/.









