Конденсована похідна бензазепіну, проміжна сполука для її одержання та фармацевтична композиція
Номер патенту: 64690
Опубліковано: 15.03.2004
Автори: Яцу Такеюкі, Косіо Хіроюкі, Мацухіса Акіра, Сакамото Кен-ітіро, Ямазакі Ацукі, Танака Акіхіро, Танігуті Нобуакі
Формула / Реферат
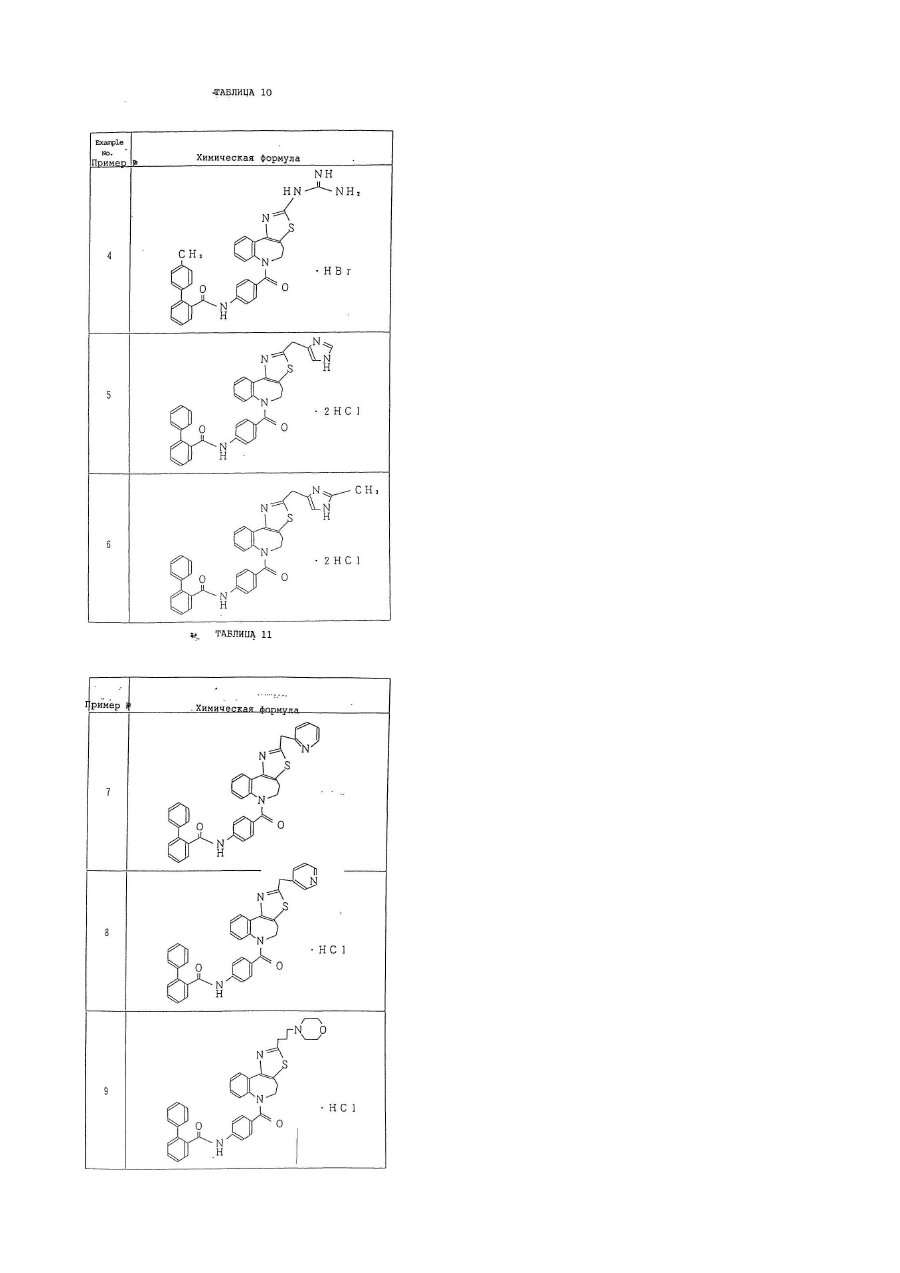
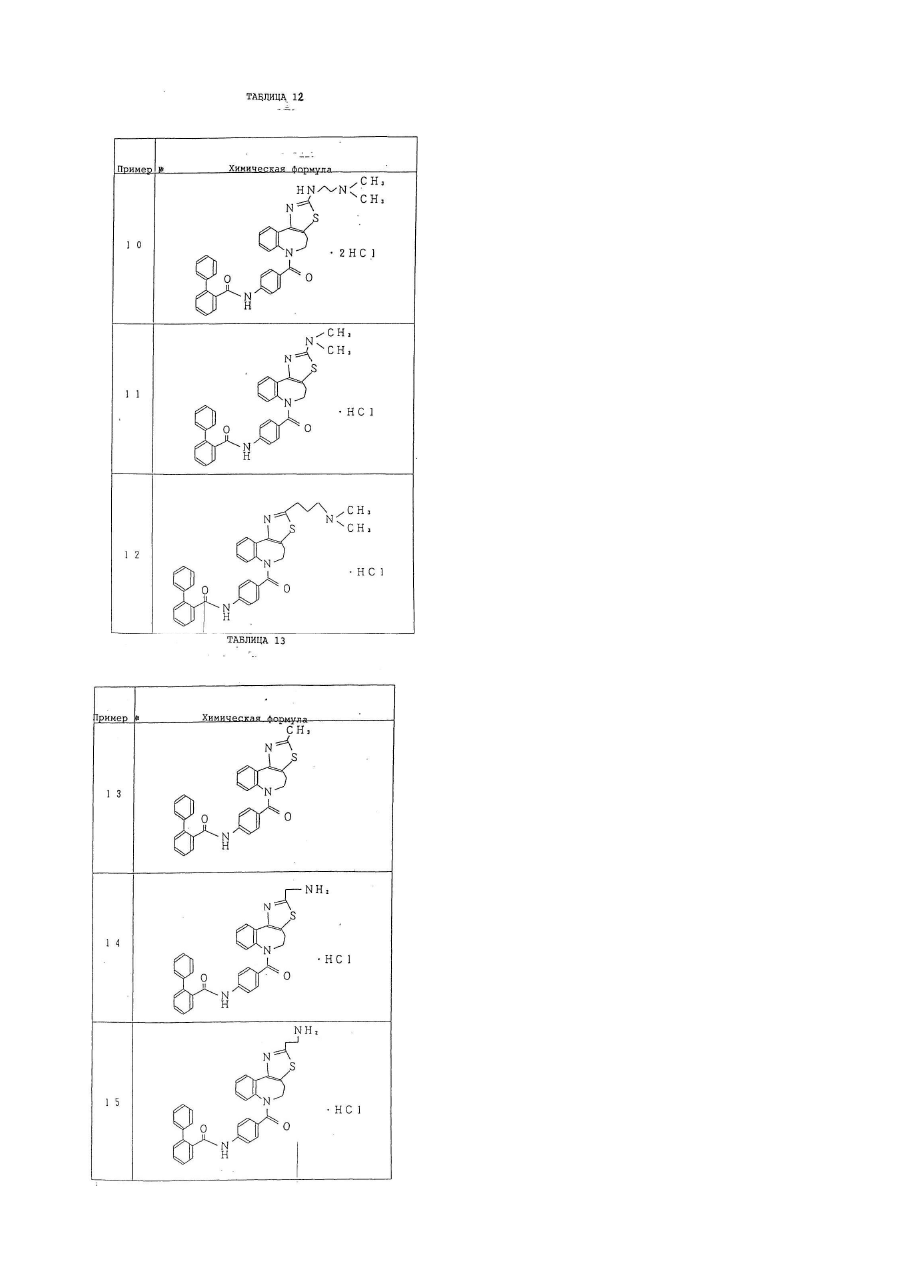
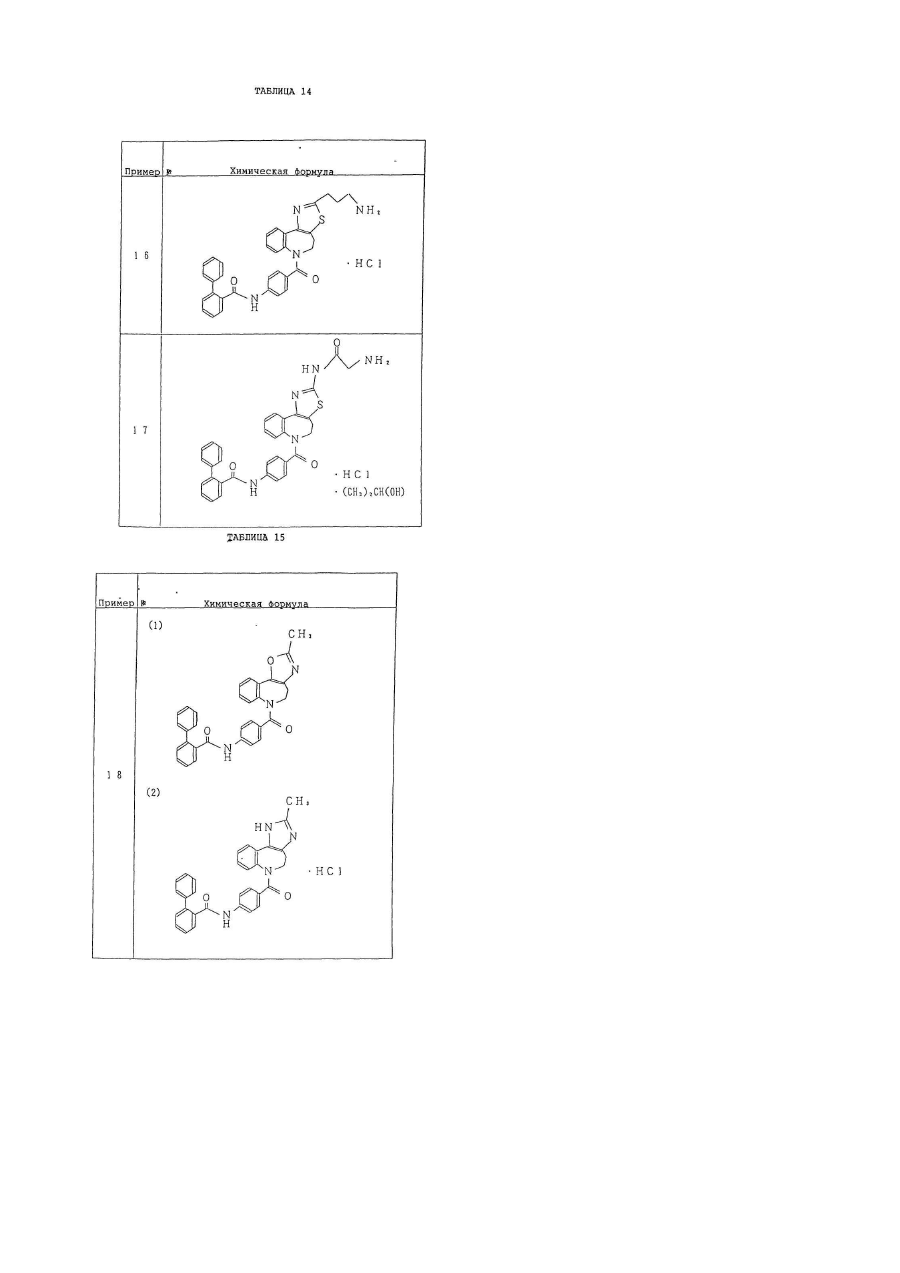
1. Производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом или его соль, представленное следующей общей формулой (I):
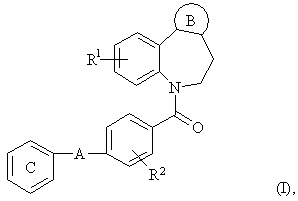
где
R1 и R2 представляют собой атом водорода;
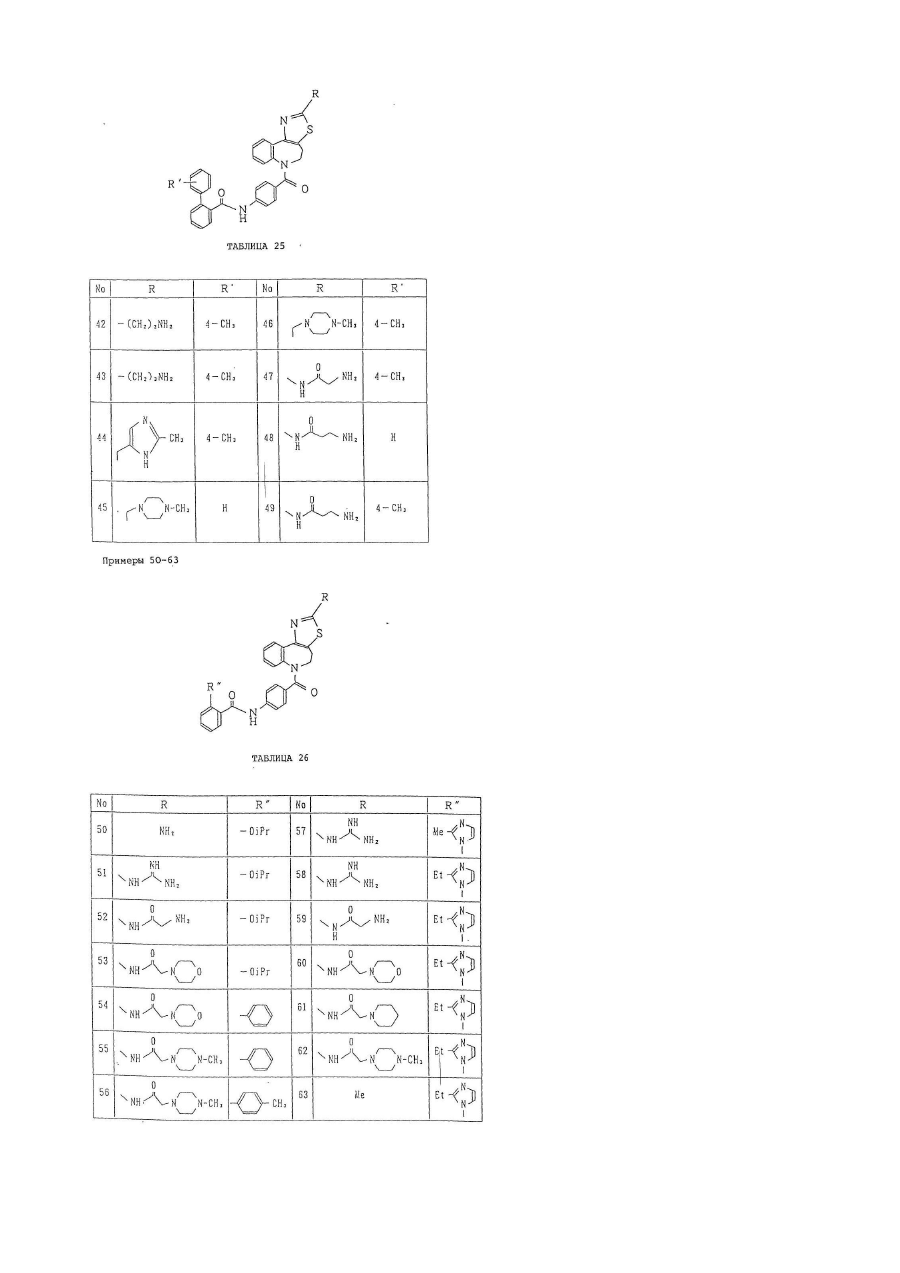
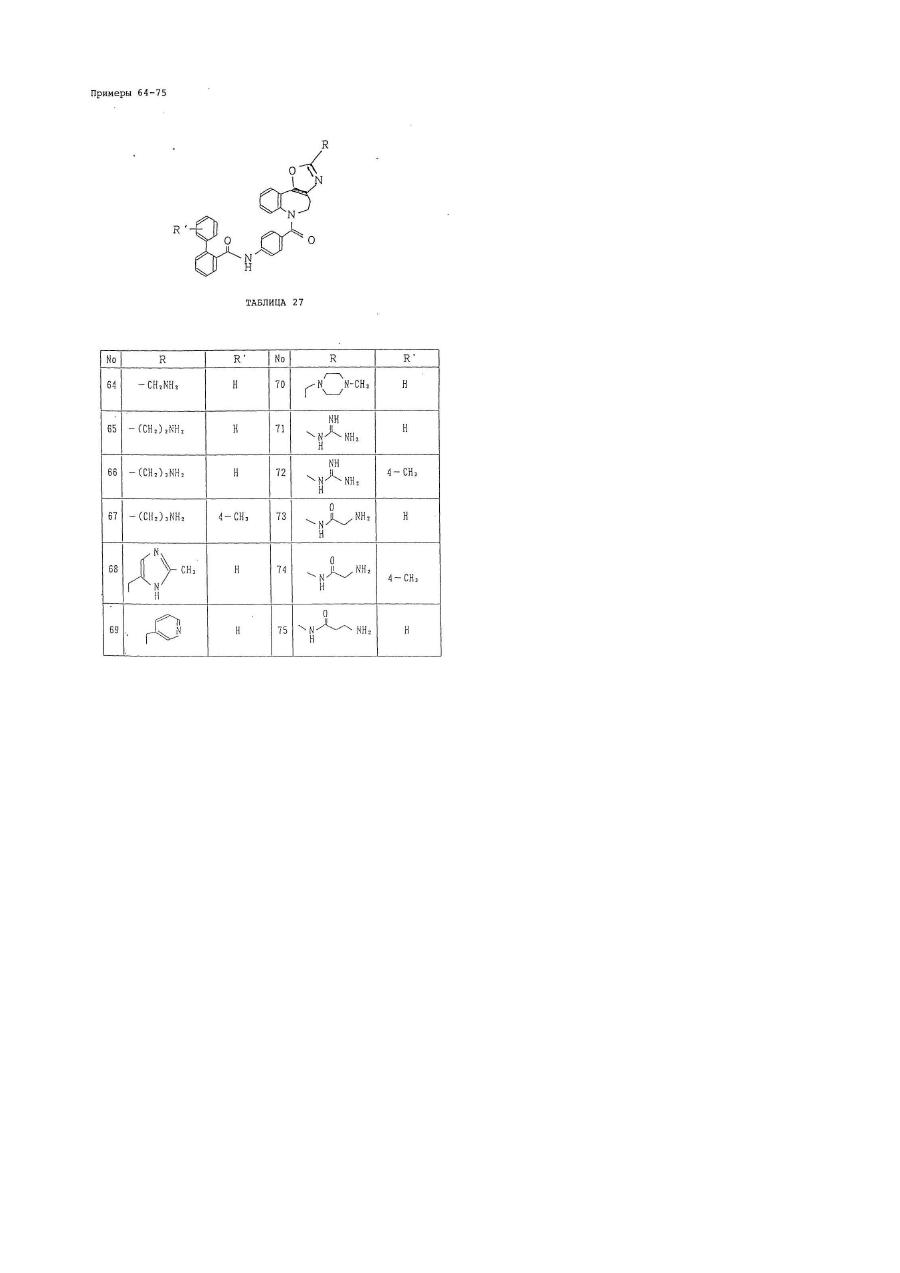
кольцо В представляет собой азотсодержащее ароматическое 5-членное кольцо, содержащее, по крайней мере, 1 атом азота или атом серы, и указанное кольцо В представлено формулой:
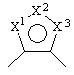 ,
,
где один из X1 и X3 представляет собой группу формулы =N–, а другой представляет собой группу формулы –NR5–, –О– или –S–;
X2 представляет собой группу формулы =СR6–;
R5 представляет собой атом водорода или низшую алкильную группу;
R6 имеет следующие значения:
а) атом водорода,
b) низший алкил, незамещенный или замещенный следующими группами:
аминогруппой; морфолиногруппой; 1-пиперазинильной группой, которая необязательно может быть замещена низшей алкильной группой по атому азота кольца; или фенильной, имидазолильной или пиридильной группой, которая, необязательно, может быть замещена низшей алкильной группой;
с) циклоалкильная группа, содержащая 3 - 8 атомов углерода;
d) аминогруппа; аминогруппа, моно- или дизамещенная низшей алкильной группой или низшей алканоильной группой (эти группы дополнительно могут быть замещены аминогруппой; моно- или динизшей алкиламиногруппой; пиперидиногруппой; морфолиногруппой; или 1-пиперазинильной группой, которая, необязательно, может быть замещена низшей алкильной группой);
е) гуанидиногруппа; или
f) гидроксильная группа, низшая алкоксильная группа или низшая алкилтиогруппа;
кольцо С является бензольным кольцом, которое, необязательно, может иметь от 1 до 5 заместителей, соответственно, выбранных из:
а) низшей алкильной группы;
b) незамещенной низшей алкоксигруппы;
с) атома галогена;
d) фенильной группы, которая, необязательно, может быть замещена низшей алкильной группой; и
е) имидазолильной группы, которая, необязательно, может быть замещена низшей алкильной группой;
–А– представляет собой простую связь; группу, представленную формулой
–NНСО-(СR3R4)n–, где n = 0 или 1, R3, R4 могут быть одинаковыми или отличающимися друг от друга, и каждый представляет собой атом водорода, низшую алкильную группу (при условии, что R3 и R4 могут вместе образовывать низшую алкиленовую группу, содержащую 2-7 атомов углерода).
2. Производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным циклом или его соль по п.1, где указанное кольцо В обозначает кольцо, представленное формулой:
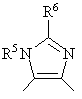 ,
, 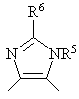 ,
, 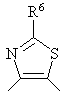 и
и 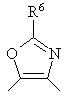 ,
,
где R5 и R6 имеют значения, указанные в п.1.
3. Производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом или его соль по п. 2, где
R6 представляет собой:
а) атом водорода,
b) низшую алкильную группу, незамещенную или замещенную следующими группами:
аминогруппой; морфолиногруппой; 1-пиперазинильной группой, которая, необязательно, может быть замещена низшей алкильной группой по атому азота кольца; или фенильной, имидазолильной или пиридильной группой, которая, необязательно, может быть замещена низшей алкильной группой;
с) циклоалкильную группу, содержащую 3 – 8 атомов углерода;
d) аминогруппу; аминогруппу, моно- или дизамещенную низшей алкильной или низшей алканоильной группой (эти группы могут быть еще замещены аминогруппой или моно- или динизшей алкиламиногруппой), или
е) гуанидиногруппу, и
кольцо С обозначает бензольное кольцо, которое, необязательно, может иметь заместитель в o-(орто)положении, который выбран из низшей алкильной группы; незамещенной низшей алкоксигруппы; атома галогена; фенильной группы, которая, необязательно, может быть замещена низшей алкильной группой; и имидазолильной группы, которая, необязательно, может быть замещена низшей алкильной группой.
4. Производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом или его соль по п. 3, где указанное кольцо С является бензольным кольцом, незамещенным или замещенным низшей алкилзамещенной фенильной группой.
5. Производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом или его соль по п. 4, где R6 представляет собой:
а) атом водорода,
b) низшую алкильную группу, незамещенную или замещенную следующими группами:
аминогруппой; морфолиногруппой; фенильной группой; имидазолильной группой, которая, необязательно, может быть замещена низшей алкильной группой; или пиридильной группой,
с) циклопропильную группу,
d) аминогруппу; диметиламинозамещенную низшую алкиламиногруппу, амино низшую алканоиламиногруппу или
e) гуанидиногруппу.
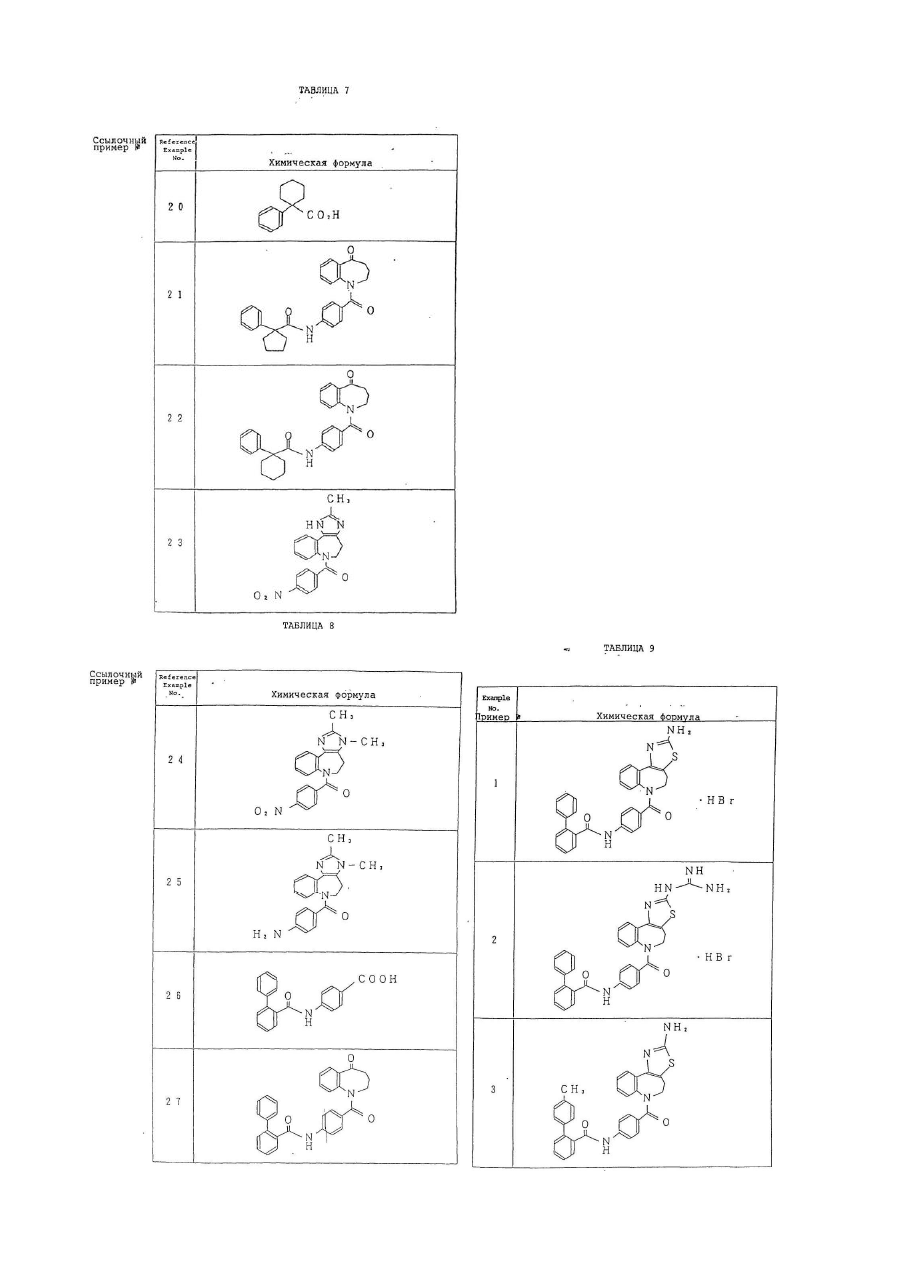
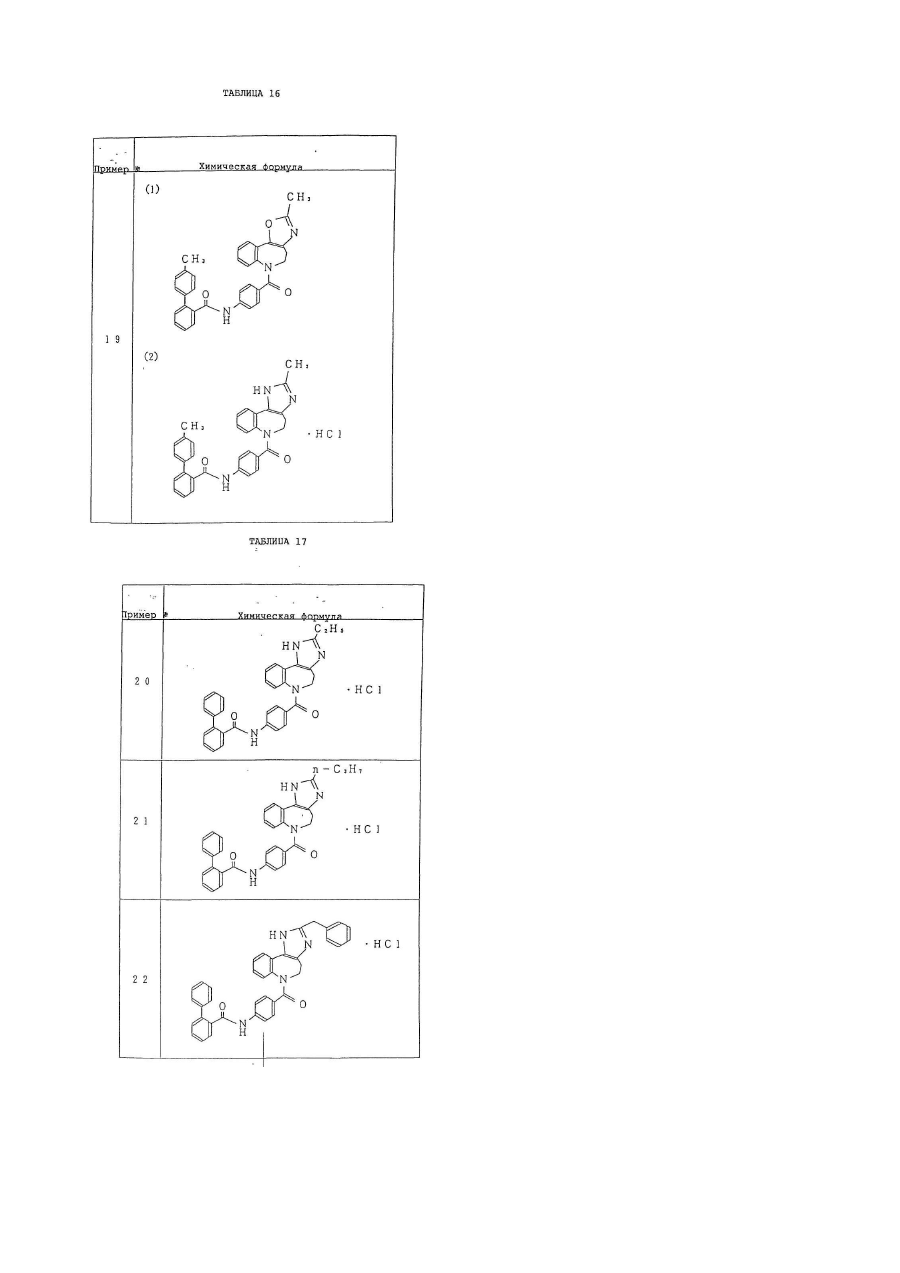
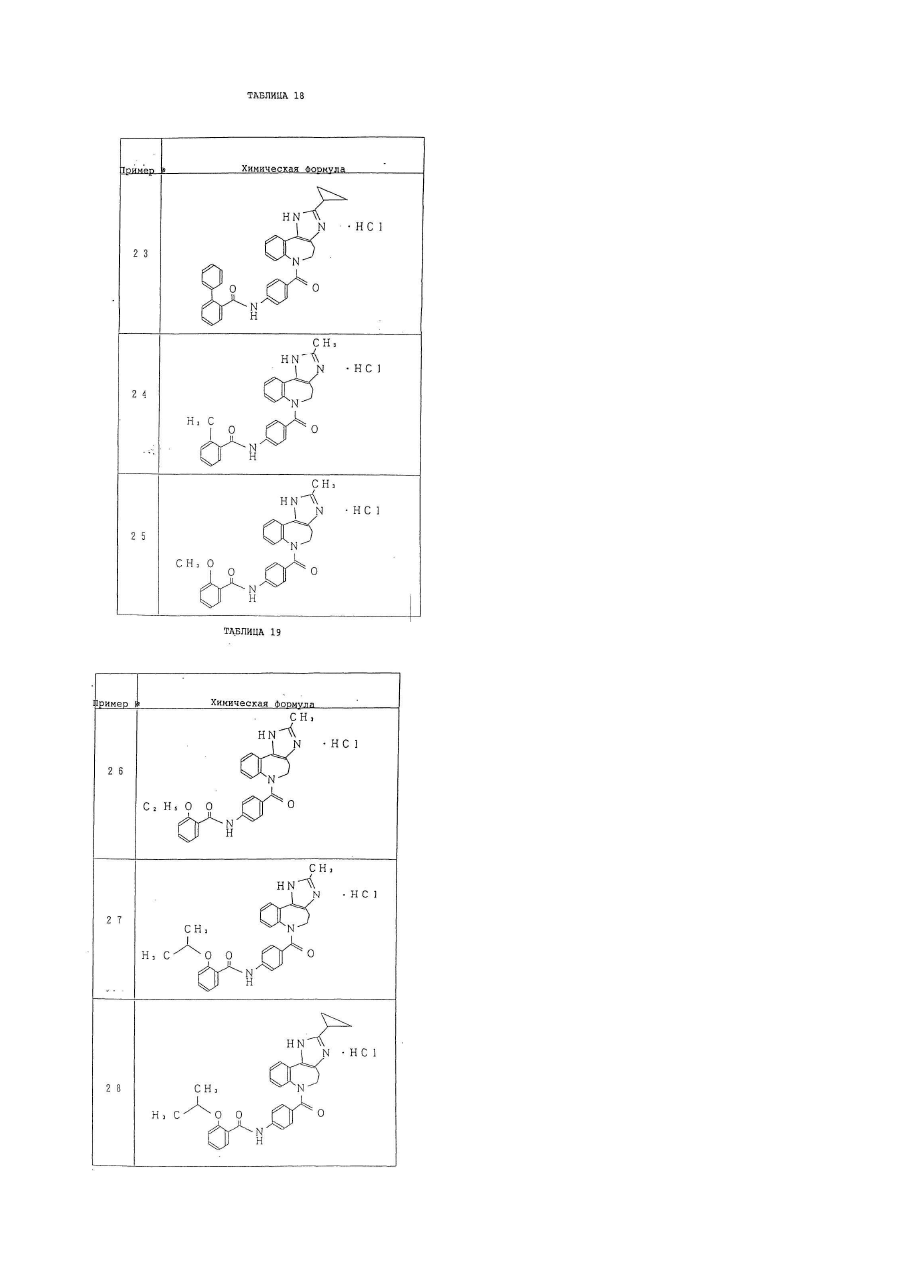
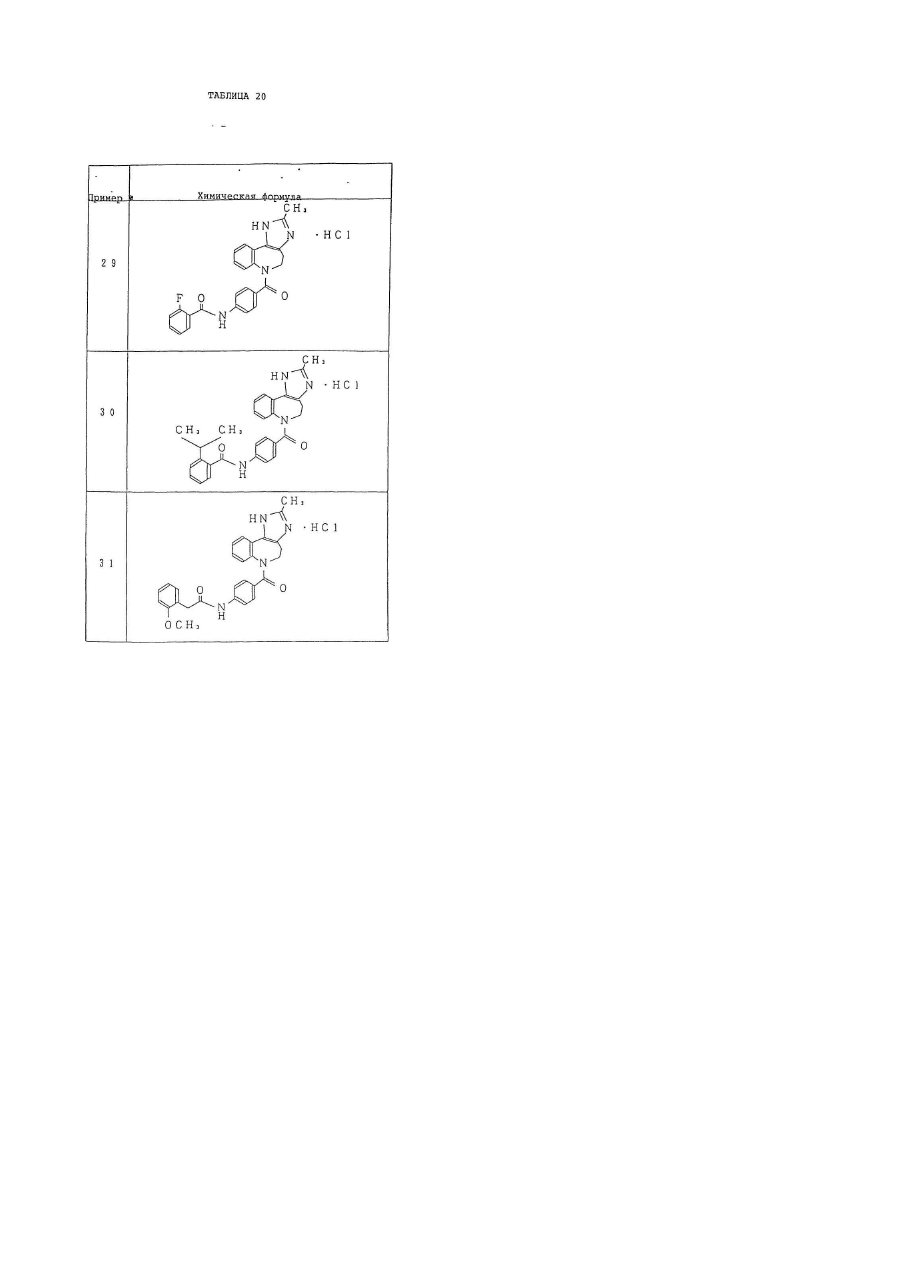
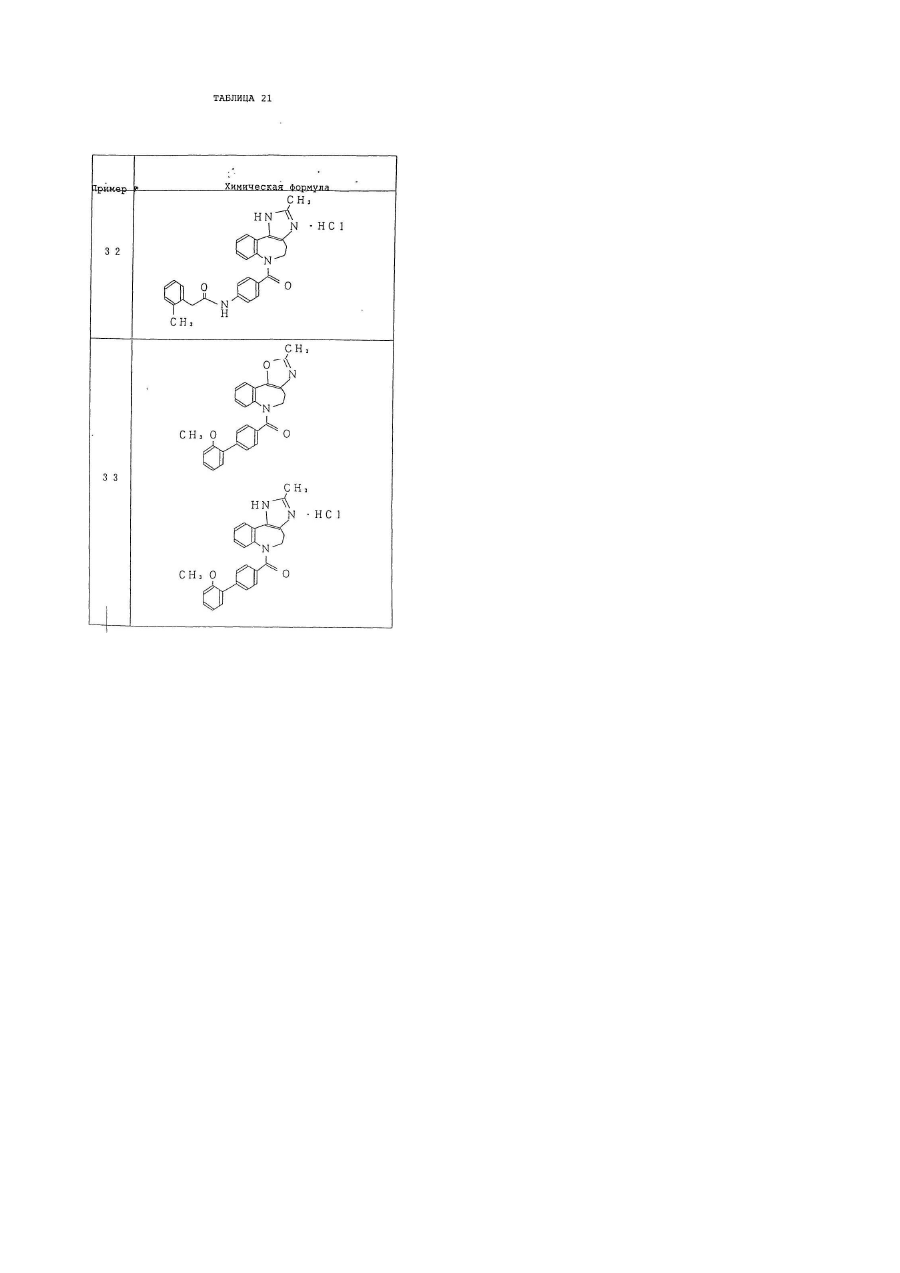
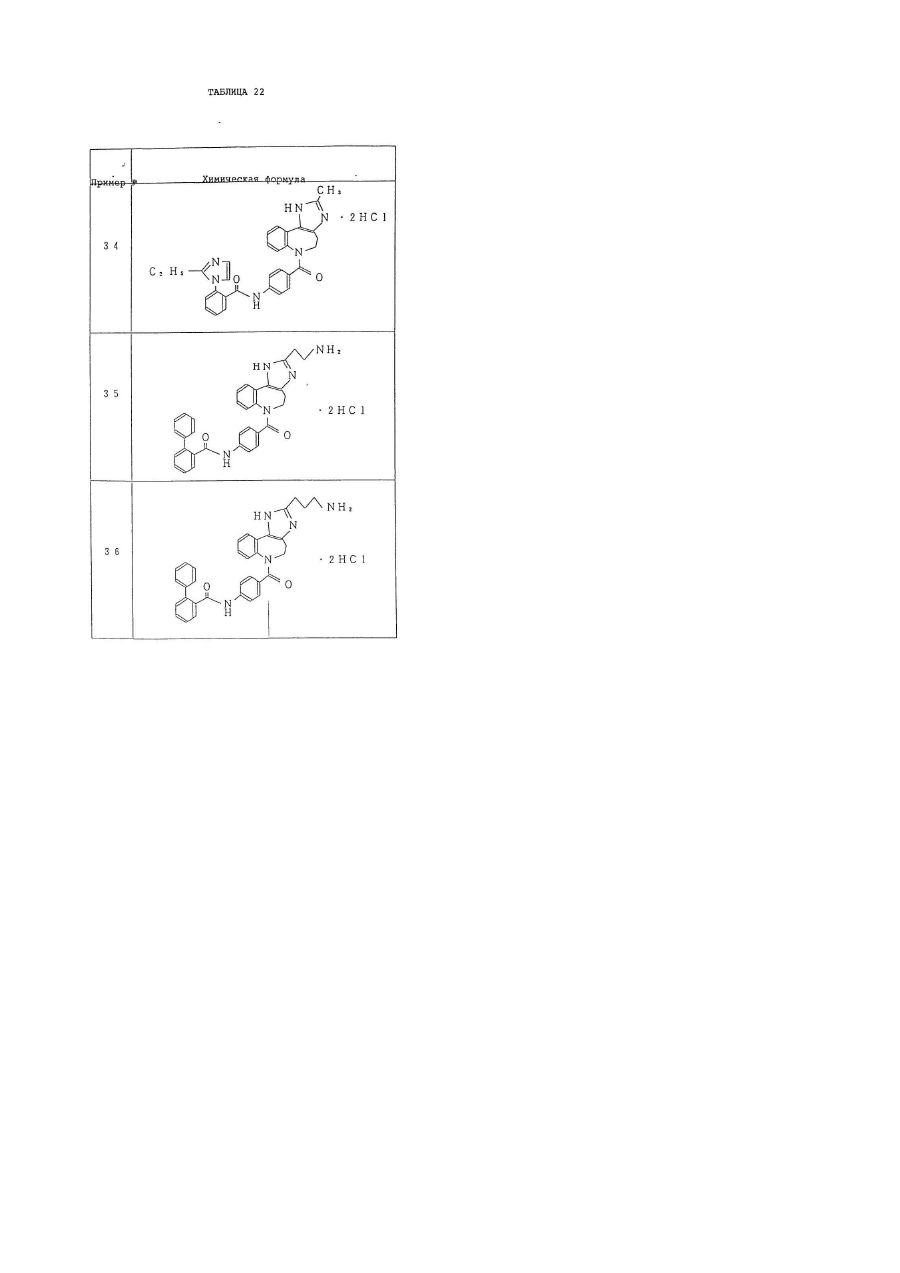
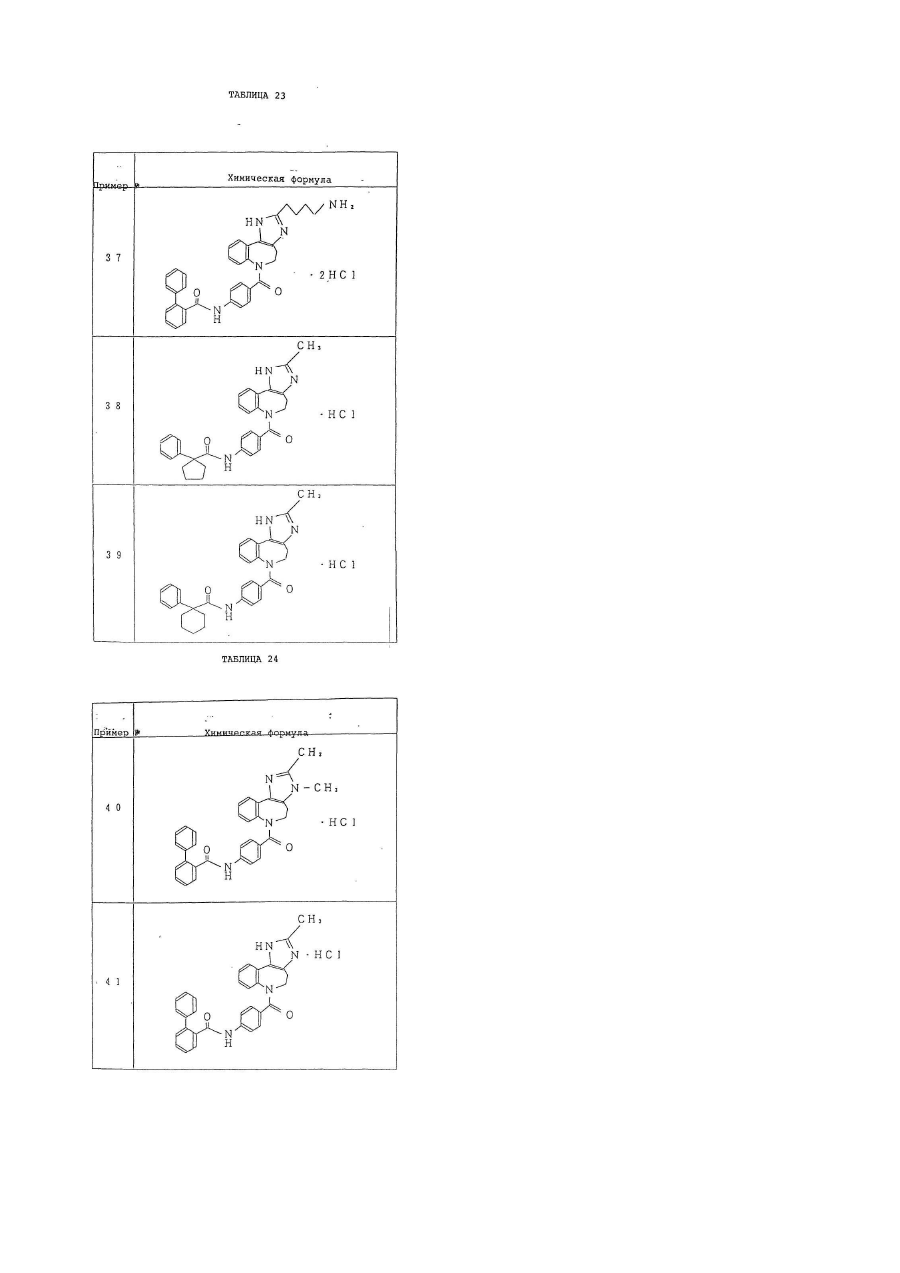
6. Производное бензазепина по п.1, представляющее собой
4'-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид или его соль.
7. Производное бензазепина по п.1, представляющее собой
4'-[(2-этил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид или его соль.
8. Производное бензазепина по п.1, представляющее собой
4'-[(2-циклопропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид или его соль.
9. Производное бензазепина по п.1, представляющее собой
4'-[(2-пропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид или его соль.
10. Фармацевтическая композиция, обладающая антагонистической активностью в отношении аргининвазопрессина, содержащая эффективное количество производного бензазепина с конденсированным азотсодержащим 5-членным кольцом или его соль по п. 1 в качестве активного компонента.
11. Антагонист аргининвазопрессина, который содержит эффективное количество производного бензазепина с конденсированным азотсодержащим 5-членным циклом или его соль по п. 1 в качестве активного компонента.
12. (4-Бифенил-2-илкарбоксамид)бензойная кислота в качестве промежуточного соединения для получения соединения общей формулы (I), по п. 1, где кольцо С обозначает бензольное кольцо, замещенное в положении 2 фенилом, и –А– обозначает группу формулы –NНСО–(СR3R4)n–, где n = 0.
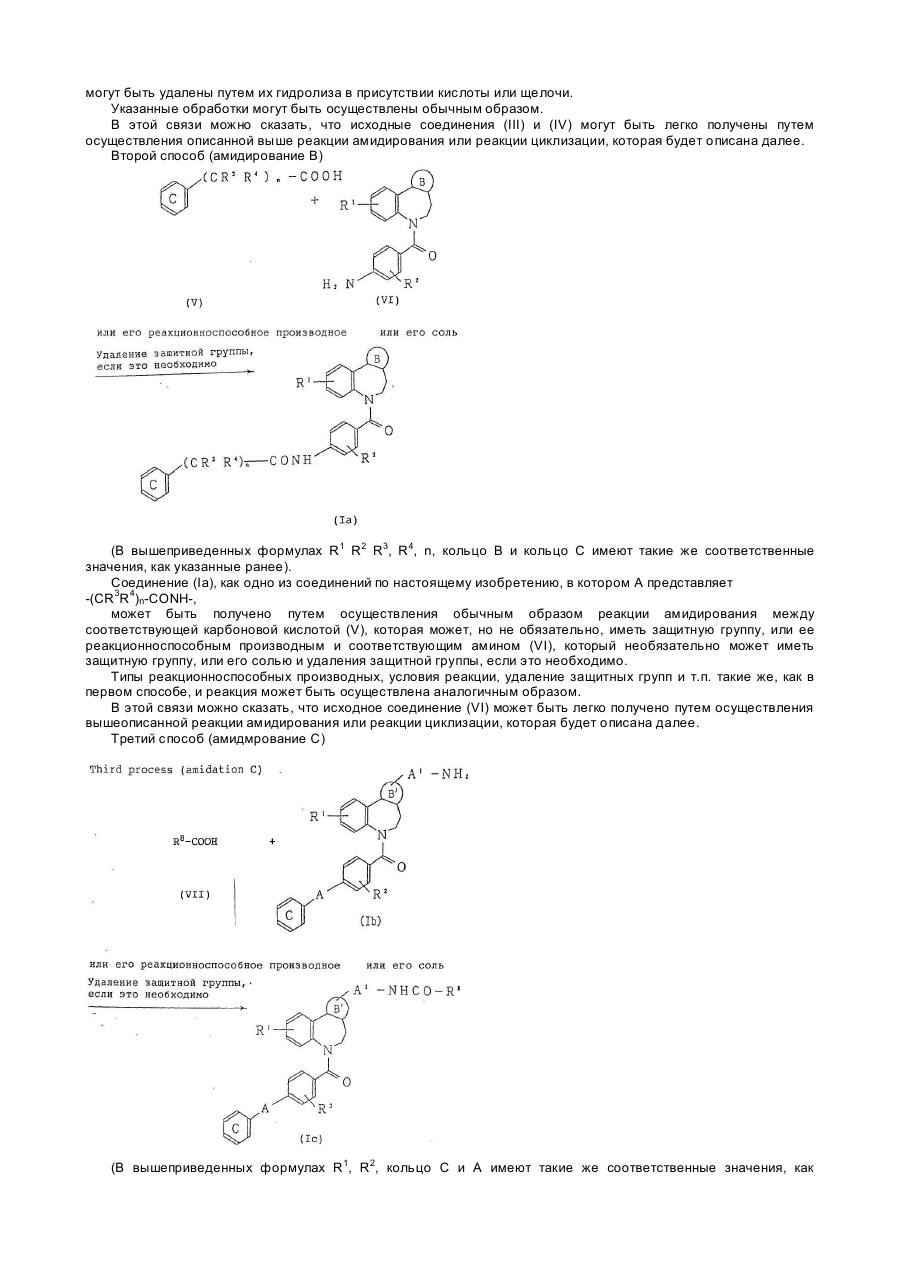
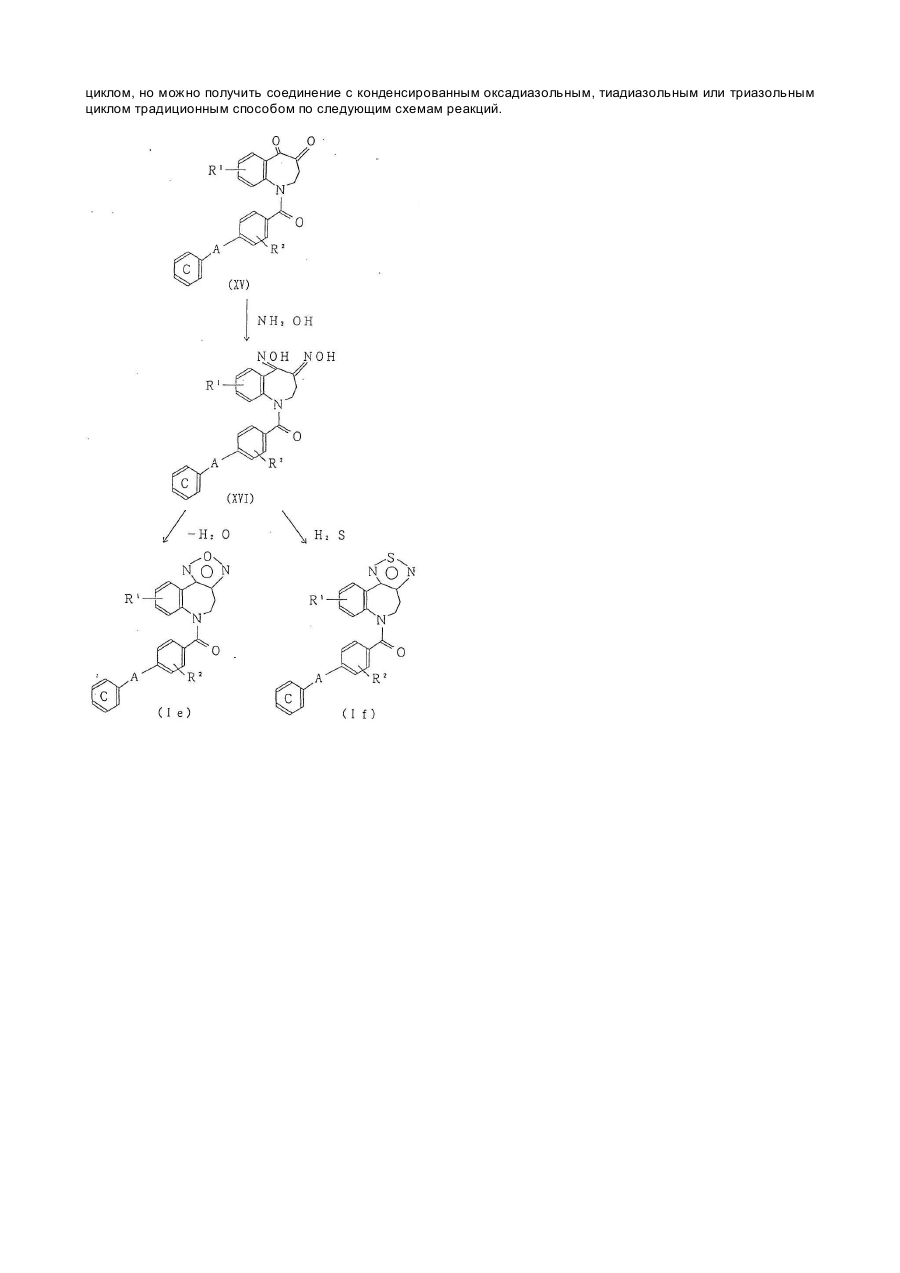
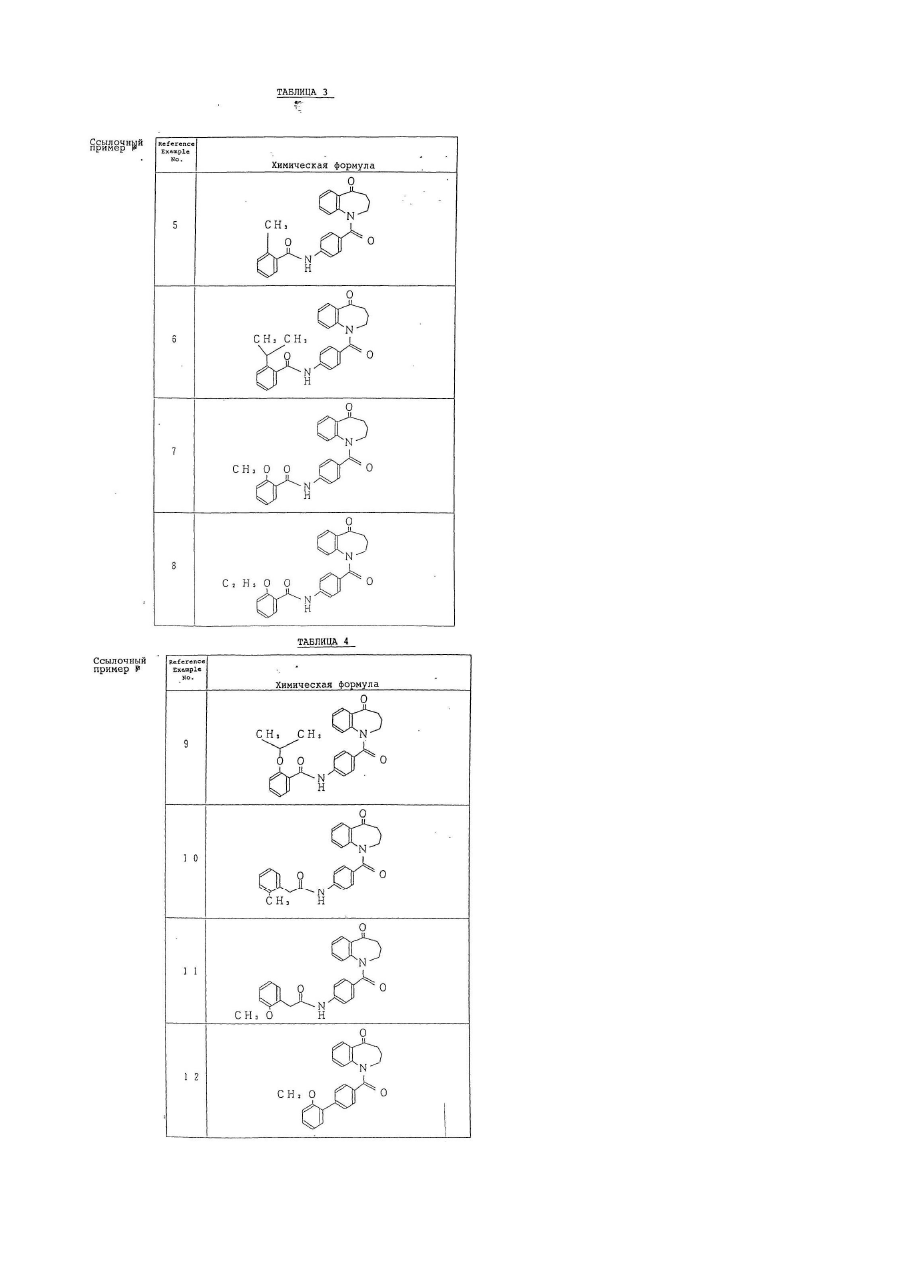
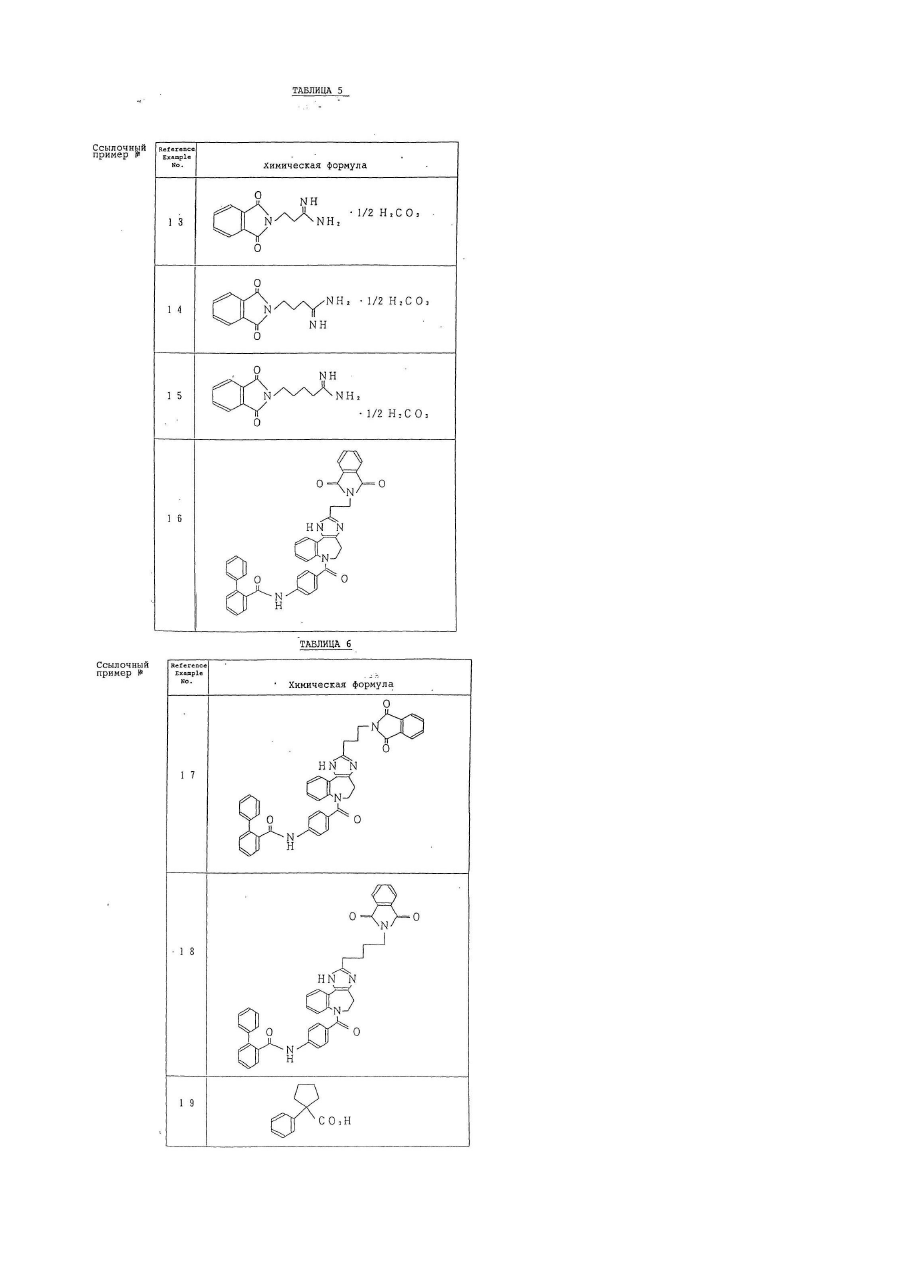
Текст
Настоящее изобретение относится к новым производным бензазепина с конденсированным ароматическим гетероциклическим кольцом, которые используются как антагонисты аргининвазопрессина, к их солям, к фармацевтическим препаратам, которые содержат эти соединения в качестве активного компонента, и к промежуточным соединениям, пригодным для синтеза этих соединений. Аргининвазопрессин (АВП) является пептидом, состоящим из 9 остатков аминокислот, который синтезируется и выделяется в гипоталамо-нейрогипофизеальной системе. В качестве антагонистов аргининвазопрессина синтезированы соединения пептидного и непептидного типа. Например, соединение, описанное в JP-A-2-32098, известно как соединение пептидного типа (использованное здесь сокращение "JP-A" означает "опубликованная нерассмотренная заявка на патент Японии"). С другой стороны, производные 2,3,4,5тетрагидро-1Н-бензазепина, представленные следующей общей формулой, описаны в ЕР-А-0514667 и JP-A-5132466 как антагонисты вазопрессина непептидного типа. (В отношении символов формулы выше смотри вышеуказанные патентные публикации). Кроме того, в международной патентной публикации №91/05549 описано соединение, представленное следующей общей формулой, и производные 2,3,4,5-тетрагидро-1Н-бензодиазепина и производные 2,3,4,5тетрагидро-1Н-1-бензазепина, описанные в JP-A-4-154765, являются известными. (В отношении символов формулы выше смотри вышеуказанные патентные публикации). Хотя и были, как описано выше, проведены различные исследования, создание новых антагонистов аргининвазопрессина, имеющих более превосходные характеристики в настоящее время все еще остается важной клинической задачей. С другой стороны, почти не известны соединения, имеющие скелетную структуру бензазепина с конденсированным азотсодержащим ароматическим 5-членным циклом, которая является основной структурой соединения по настоящему изобретению, и были лишь сообщения о способах синтеза нескольких соединений, имеющих такую циклическую структуру в J. Chem, Soc., Petkin Trans. 1 (1978), №8, 862-70 и Org. Prep. Proced. Int., 25 (5) , 602-6 (1993), но их структура явно отличается от структуры соединения по настоящему изобретению. Кроме того, не известно применение этих соединений в качестве фармацевтических препаратов. Авторы настоящего изобретения провели обширные исследования соединений, проявляющих антагонизм по отношению к аргининвазопрессину, и создали настоящее изобретение, основываясь на обнаружении того, что новое производное бензазепина с конденсированным ароматическим гетероциклическим кольцом, представленное приведенной ниже общей формулой (I), проявляет неожиданно значительный антагонизм по отношению к аргининвазопрессину. Таким образом, настоящее изобретение относится к производному бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом, представленному следующей формулой (I), и к его соли. (Символы в формуле имеют следующие значения: кольцо В: азотсодержащее ароматическое 5-членное кольцо, имеющее, по крайней мере, 1 атом азота и, необязательно, один атом кислорода или серы, которое может, необязательно, иметь заместитель(и), R1, R2: могут быть одинаковыми или отличающимися друг от друга и каждый представляет атом водорода, атом галогена, низшую алкильную группу, аминогруппу, которая может быть, необязательно, замещена низшей(ими) алкильной(ыми) группой (ами), низшую алкоксигруппу, А: одинарная связь; группа, представленная формулой -NHCO-(CR3R4)n-, n: 0 или целое число от 1 до 3, R3, R4: могут быть одинаковыми или отличающимися друг от друга и каждый представляет атом водорода, низшую алкильную группу (при условии, что R3 и R4 могут вместе образовывать низшую алкиленовую группу, имеющую от 2 до 7 углеродных атомов), и кольцо С: бензольное кольцо, которое может, необязательно, иметь заместитель(и)). Далее, особенно предпочтительным соединением является производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом (I) или его соль, где і) кольцо В является кольцом, представленным формулой: (символы в формуле имеют следующие значения: X1, X3: один из них обозначает группу, представленную формулой =N-, а другой обозначает группу, представленную формулой -NR5-, -О-, -S- или =N-, Х2: группа, представленная формулой =CR6-, -О-, -S- или =N-, R5: атом водорода, низшая алкильная группа, и R6: а) атом водорода, b) низшая алкильная, низшая алкенильная или низшая алкинильная группа, незамещенная или замещенная следующими группами: аминогруппой; моно- или ди-(низший алкил)аминогруппой; (низший алканоил)аминогруппой, замещенной аминогруппой или моно- или ди-(низший алкил)аминогруппой; защищенной аминогруппой; 1-пирролидинильной группой; пиперидиногруппой; морфолиногруппой; 1-пиперазинильной, 1-имидазолидинильной, 1гомопиперазинильной или 1-пиразолидинильной группой, которая может быть не обязательно замещена низшей алкильной группой по атому азота кольца; гуанидиногруппой; амидиногруппой; гидроксильной группой; низшей алкоксильной группой; цианогруппой; карбамоильной группой; карбоксильной группой; низшей алкоксикарбонильной группой; низшей алканоилоксигруппой; или фенильной, имидазолильной, пиридильной, пиразинильной, пиримидинильной, пиридазинильной, пиразолильной, пирролильной, тетразолильной, триазолильной, тиазолильной или оксазолильной группой, которые могут быть необязательно замещены низшей алкильной группой, атомом галогена, низшей алкоксильной группой, аминогруппой, моно- или ди- низшей алкиламиногруппой, гидроксильной группой или карбоксильной группой, c) циклоалкильная группу, имеющая от 3 до 8 углеродных атомов, d) аминогруппа; аминогруппа, моно- или дизамещенная низшей алкильной, низшей алкенильной, низшей алкинильной или низшей алканоильной группой (эти группы могут быть дополнительно замещены аминогруппой; моно- или ди- низшая алкиламиногруппа; 1-пирролидинильная группа; пиперидиногруппа; морфолиногруппа; или 1-пиперазинильная, 1-имидазолидинильная или 1-гомопиперазинильная группа, которая может быть необязательно замещена низшей алкильной группой по атому азота кольца; 1-пирролидинильная группа; пиперидиногруппа; морфолиногруппа; или 1-пиперазинильная, 1-имидазолидинильная или 1гомопиперазинильная группа, которая может быть необязательно замещена низшей алкильной группой, е) гуанидиногруппа, амидиногруппа, или f) гидроксильная группа, низшая алкоксильная группа, меркаптогруппа, низшая алкилтиогруппа), и ii) кольцо С является бензольным кольцом, которое может необязательно иметь от 1 до 5 заместителей, соответственно выбранных из a) низшей алкильной, низшей алкенильной или низшей алкинильной группы, которая может быть необязательно замещена атомом галогена или гидроксильной группой, b) низшей алкоксигруппы, которая может быть необязательно замещена атомом галогена, цианогруппой, гидроксильной группой, карбоксильной группой, низшей алкоксикарбонильной группой, низшей алканоильной группой, низшей алканоилоксигруппой, карбамоильной группой, низшей алкиламинокарбонильной группой или фталимидогруппой; гидроксильной группы; меркаптогруппы; или низшей алкилтиогруппы, c) атома галогена; цианогруппы, d) карбоксильной группы; низшей алкоксикарбонильной группы; низшей алканоильной группы; низшей алканоилоксигруппы; карбамоильной группы; низшей алкиламинокарбонильной группы, аминогруппы; моно- или ди-(низший алкил)аминогруппы; (низший алканоил)аминогруппы; 1пирролидинильной группы; пиперидиногруппы; морфолиногруппы; или 1-пиперазинильной, 1имидазолидинильной или 1-гомопиперазинильной группы, которая необязательно может быть замещена низшей алкильной группой по атому азота кольца, f) циклоалкильной группы, g) фенильной группы, которая необязательно может быть замещена низшей алкильной группой, низшей алкенильной группой, низшей алкинильной группой, атомом галогена, низшей алкоксигруппой, аминогруппой, моно- или ди-(низший алкил)аминогруппой, гидроксильной группой или карбоксильной группой, и h) имидазолильной, триазолильной, тетразолильной, пирролильной, пиридильной, пиразинильной или пиримидинильной группы, которая необязательно может быть замещена низшей алкильной, циклоалкильной или фенильной группой. Настоящее изобретение касается также фармацевтической композиции, в частности, антагониста аргининвазопрессина, которая содержит в качестве активного ингредиента вышеуказанное производное бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом. Кроме того, настоящее изобретение касается также (бифенил-2-илкарбоксамид)бензойной кислоты, которая применяется в качестве промежуточного соединения для синтеза вышеуказанного производного бензазепина с конденсированным азотсодержащим ароматическим 5-членным кольцом. Химическая структура соединения по настоящему изобретению характеризуется тем, что его основная структура представляет собой конденсированное с азотсодержащим ароматическим 5-членным кольцом бензазепиновое кольцо, к которому присоединены замещенная или незамещенная бифенилкарбонильная группа, замещенная или незамещенная бензоиламинобензоильная группа или замещенная или незамещенная фенилалканоиламинобензоильная группа. Соединение по настоящему изобретению, имеющее такую основную структуру, проявляет значительный антагонизм по отношению к аргининвазопрессину, является превосходным при пероральном поглощении и показывает довольно длительное действие, обусловленное его стойкостью к метаболизму в живом организме. Ниже дается подробное описание соединения по настоящему изобретению. Что касается азотсодержащего ароматического 5-членного кольцевого радикала "азотсодержащего ароматического 5-членного кольца, имеющего, по крайней мере, 1 атом азота и, необязательно, один атом кислорода или серы, и который может необязательно иметь заместитель(и)", в качестве примера кольца В соединения по настоящему изобретению, представленного формулой (I), могут быть пиррольное кольцо, пиразольное кольцо, имидазольное кольцо, триазольное кольцо, изоксазольное кольцо, оксазольное кольцо, изотиазольное кольцо, тиазольное кольцо, оксадиазольное кольцо, тиадиазольное кольцо и т.п. Каждое из этих колец может необязательно иметь заместитель или заместители, которые будут описаны далее, и конденсировано с бензазепиновым кольцом через посредство двух его соседних атомов, образующих кольцо. В частности, в качестве азотсодержащего ароматического 5-членного кольцевого радикала кольца В предпочтительным является азотсодержащий ароматический 5-членный цикл, представленный формулами более предпочтителен азотсодержащий ароматический 5-членный цикл, представленный формулами и наиболее предпочтителен азотсодержащий ароматический 5-членный цикл, представленный формулами В этих кольцах атом водорода, образующего кольцо углерода или атом азота, могут быть необязательно замещены как описано далее. Заместитель, находящийся в азотсодержащем ароматическом 5-членном кольце кольца В или в бензольном кольце кольца С, может быть выбран из тех, которые традиционно используются в данной области техники в качестве заместителей ароматических гетероциклических колец или бензольного кольца. Азотсодержащее ароматическое 5-членное кольцо кольца В необязательно может иметь 1-2 заместителя, а бензольное кольцо кольца С может необязательно иметь от 1 до 5 (предпочтительно от 1 до 3) заместителей. Предпочтительно, заместитель в бензольном кольце кольца С может находиться в о (орто)-положение. Примеры этих заместителей включают замещенную или незамещенную алкильную, алкенильную или алкинильную группу, замещенную или незамещенную циклоалкильную или циклоалкенильную группу, замещенную или незамещенную арильную группу и замещенную или незамещенную насыщенную или ненасыщенную гетероциклическую группу, а также атом галогена, гидроксильную группу, алкоксильную группу, замещенную алкоксильную группу, алкенилоксигруппу, алкинилоксигруппу, циклоалкилоксигруппу, циклоалкенилоксигруппу, арилоксигруппу, аралкилоксигруппу, аралкенилокси или аралкинилоксигруппу, меркаптогруппу, алкилтиогруппу, алкенилтиогруппу, алкинилтиогруппу, циклоалкилтиогруппу, циклоалкенилтиогруппу, арилтиогруппу, аралкилтиогруппу, аралкенилтиогруппу или аралкинилтиогруппу, алкоксикарбонильную группу, алкенилоксикарбонильную группу, алкинилоксикарбонильную группу, циклоалкилоксикарбонильную группу, циклоалкенилоксикарбонильную группу, арилоксикарбонильную группу, аралкилоксикарбонильную группу, аралкенилоксикарбонильную группу или аралкинилоксикарбонильную группу, алкиламинокарбонильную группу, алифатическую или ароматическую ацильную или ацилоксигруппу, карбамоильную группу, карбоксильную группу, сульфо новую группу, оксогруппу, тиоксогруппу, цианогруппу, нитрогруппу, аминогруппу, моно- или дизамещенную аминогруппу, гуанидиногруппу, амидиногруппу и замещенную или незамещенную иминогруппу. Кроме этих групп, в качестве заместителя бензольного кольца может быть использована двухвалентная группа, замещенная или незамещенная, которая может содержать гетероатомы (например, 1-3 атома азота, кислорода и/или серы), и которая образует конденсированное кольцо с бензольным кольцом путем присоединения к смежным атомам углерода бензольного кольца, такая, как низная алкиленовая группа, низшая алкениленовая группа, низшая алкиниленовая группа или низшая алкилендиоксигруппа. Примеры заместителей "замещенной алкильной группы", "замещенной алкенильной группы" и "замещенной алкинильной группы" в качестве вышеуказанных заместителей азотсодержащего ароматического 5-членного цикла или бензольного кольца включают циклоалкильную группу, циклоалкенильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную насыщенную или ненасыщенную гетероциклическую группу, атом галогена, гидроксильную группу, алкоксильную группу, алкенилоксигруппу, алкинилоксигруппу, циклоалкилоксигруппу, циклоалкенилоксигруппу, арилокси-, аралкилокси-, аралкенилоксиили аралкинилоксигруппу, группу меркапто, алкилтио, алкенилтио, алкинилтио, циклоалкилтио, циклоалкенилтио, арилтио, аралкилтио, аралкенилтио или аралкинилтио, алкоксикарбонильную, алкенилоксикарбонильную, алкинилоксикарбонильную, циклоалкилоксикарбонильную, циклоалкенилоксикарбонильную, арилоксикарбонильную, аралкилоксикарбонильную, аралкенилоксикарбонильную или аралкинилоксикарбонильную группу, алкиламинокарбонильную группу, алифатическую или ароматическую ацильную или ацилоксигруппу, карбоксильную группу, сульфон, оксогруппу, тиоксогруппу, карбамоильную группу, цианогруппу, нитрогруппу, аминогруппу, моно- или дизамещенную аминогруппу, защищенную аминогруппу, гуанидиногруппу, амидиногруппу и замещенную или незамещенную иминогруппу. Примеры заместителей вышеуказанной "замещенной алкоксигруппы" включают атом галогена, циано-, гидроксильную, карбоксильную, низшую алкоксикарбонильную, низшую алканоильную, низшую алканоилокси-, карбамоильную, низшую алкиламинокарбонильную, фталимидо- и т.п. группы. Примеры заместителей "замещенной циклоалкильной или циклоалкенильной группы" включают низшую алкильную, низшую алкенильную, низшую алкинильную, низшую алкокси-, низшую алканоильную, низшую алканоилокси-, низшую алкоксикарбонильную, амино-, моно- или ди- низшую алкиламино-, гидроксильную, карбоксильную, карбамоильную группы и т.п. Примеры заместителей "замещенной арильной группы" включают низшую алкильную, низшую алкенильную, низшую алкинильную группы, атом галогена, низшую алкоксильную группу, аминогруппу, моно- или ди- низшую алкиламиногруппу, гидроксильную группу, карбоксильную группу и т.п. "Замещенная насыщенная или ненасыщенная гетероциклическая группа" может быть предпочтительно азотсодержащим гетероциклом, более предпочтительно азотсодержащим ароматическим 5- или 6-членным циклом (наиболее предпочтительно имидазолильной, пиридильной, пиразинильной, пиримидинильной, пиридазинильной, пиразолильной, пирролильной, тетразолильной, триазолильной, тиазолильной или оксазолильной группой) и азотсодержащим насыщенным 4-7-членным циклом (наиболее предпочтительно пирролидинильной, пиперидильной, морфолинильной, пиперазинильной, имидазолидинильной, гомопиперазинильной или пиразолидинильной группой). Примеры их заместителей включают низшую алкильную, циклоалкильную, фенильную группы, атом галогена, низшую алкоксильную группу, аминогруппу, моно- или ди- низшую алкиламиногруппу, гидроксильную группу, карбоксильную группу и т.п. Примеры заместителей "моно- или дизамещенной аминогруппы" включают низшую алкильную, низшую алкенильную, низшую алкинильную, низшую алканоильную группы и т.п., причем эти группы необязательно могут быть еще замещены следующими группами: аминогруппой; моно- или ди- низшей алкиламиногруппой; 1-пирролидинильной группой; пиперидиногруппой; морфолиногруппой и 1-пиперазинильной, 1-имидазолидинильной или 1-гомопиперазинильной группой, которая необязательно может быть замещена низшей алкильной группой у атома азота в цикле. Примеры заместителей "замещенной иминогруппы" включают алкильную, арильную, аралкильную группы и т.п. Из вышеуказанных заместителей в азотсодержащем ароматическом 5-членном цикле кольца В или бензольном ядре кольца С заместителями, располагаемыми у углеродных атомов кольца В, могут быть предпочтительно: а) низшая алкильная, низшая алкенильная или низшая алкинильная группа, незамещенная или замещенная следюущими группами: аминогруппой; моно- или ди- низшей алкиламиногруппой; низшей алканоиламиногруппой, замещенной на аминогруппу или моно- или ди- низшую алкиламиногруппу; защищенной аминогруппой; 1-пирролидинильной группой; пиперидино; морфолино; 1-пиперазинильной, 1-имидазолидинильной, 1-гомопиперазинильной или 1пиразолидинильной группой, которая может, но не обязательно, быть замещена на низшую алкильнуто группу у атома азота в цикле; гуанидиногруппой; амидиногруппой; гидроксильной группой; низше алкоксильной группой; цианогруппой; карбамоильной группой; карбоксильной группой; низшей алкоксикарбонильной группой; низшей алканоилоксигруппой; или фенильной, дазолильной, пиридильной, пиразинильной, пиримидинильной, пиридазинильной, пиразолильной, пирролильной, тетраразолильной, триазолильной, тиазолильной или оксазолильной группой, которая может, но не обязательно, быть мещена на низшую алкильную группу, атом галогена, низшую алкоксильную группу, аминогруппу, моно- или ди- низшую алкиламиногруппу, гидрокслиьную группу или карбоксильную группу, c) циклоалкильная группа, имеющая от 3 до 8 углеродных атомов, d) аминогруппа; аминогруппа, моно- или дизамещенная низшей алкильной, низшей алкенильной, низшей алкинильной или низшей алканоильной группой (указанные группы могут дополни тельно быть замещены аминогруппой; моно- или ди- низшей алкиламиногруппой; 1-пирролидинильной группой; пиперидиногруппой; морфолиногруппой; или 1-пиперазинильной, 1-имидазолидинильной или 1-гомопиперазинильноп группой, которая может, но не обязательно, быть замещена на низшую алкильную группу у атома азота в цикле); 1пирролидинильная группа; пиперидиногруппа; морфолиногруппа или 1-пиперазинильная, 1-имидазолидинильная или 1-гомопиперазинильная группа, которая может, но не обязательно, быть замещена на низшую алкильную группу у атома азота в цикле, d) гуанидиногруппу, амидиногруппа, или e) гидроксильная, низшая алкоксильная, меркапто-, низшая алкилтиогруппы, более предпочтительно: а) низшая алкильная группа, незамещенная или замещенная следующими группами: аминогруппой; моно- или ди- низшей алкиламиногруппой; низшей алканоиламиногруппой, замещенной на аминогруппу или моно- или ди- низшую алкиламиногруппу; 1-пирролидинильной группой; пиперидиногруппой; морфолиногруппой; 1-пиперазинильной группой/ которая необязательно может быть замещена низшей алкильной группой у атома азота в цикле; гуанидиногруппой; амидиногруппой или фенильной, имидазолильной, пиридильной, пиразинильной, пиримидинильной, пиридазинильной, пиразолильной, пирролильной, тетразолильной или триазолильной группой, которая необязательно может быть замещена низшей алкильной группой, b) циклоалкильная группа, имеющая от 3 до 8 атомов углерода, c) аминогруппа; аминогруппа, моно- или дизамещенная низшей алкильной или низшей алканоильной группой (эти группы могут быть еще замещены аминогруппой или моно- или ди- низшей алкиламиногруппой), или d) гуанидиногруппа, амидиногрупп, наиболее предпочтительно: a) низшая алкильная группа, незамещенная или замещенная следующими группами: аминогруппой; моно- или ди- низшей алкиламиногруппой; морфолиногруппой; имидазолильной группой, которая необязательно может быть замещена на фенильную или низшую алкильную группу; или пиридильной группой, b) циклопропильная группа, c) аминогруппа; диметиламино-замещенная низшая алкиламиногруппа или амино(низший)алканоиламиногруппа или d) гуанидиногруппа. Особо предпочтительной в качестве заместителя у атома азота в кольце В является низшая алкильная группа. Заместителями, располагаемыми в бензольном ядре кольца С, могут быть предпочтительно: a) низшая алкильная, низшая алкенильная или низшая алкинильная группа, которая может, но не обязательно, быть замещена атомом галогена или гидроксильной группой, b) низшая алкоксигруппа, которая может, но не обязательно, быть замещена атомом галогена, циано-, гидроксильной, карбоксильной, низшей алкоксикарбонильной, низшей алканоильной, низшей алканоилокси-, карбамоильной, низшей алкиламинокарбонильной или фталимидогруппой: гидроксильная группа; меркаптогруппа или низшая алкилтиогруппа, c) атом галогена; цианогруппа, d) карбоксильная группа; низшая алкоксикарбонильная группа; низшая алканоильная группа; низшая алканоилоксигруппа; карбамоильная группа; низшая алкиламинокарбонильная группа; e) аминогруппа; моно- или ди- низшая алкиламиногруппа; низшая алканоиламиногруппа; 1пирролидинильная группа; пиперидиногруппа; морфолиногруппа или 1-пиперазинильная, 1-имидазолидинильная или 1-гомопиперазинильная группа, которая может, но не обязательно, быть замещена низшей алкильной группой у атома азота в цикле, f) циклоалкильная группа, g) фенильная группа, которая необязательно может быть замещена низшей алкильной группой, низшей алкенильной группой, низшей алкинильной группой, атомом галогена, низшей алкоксигруппой, аминогруппой, моно- или ди- низшей алкиламиногруппой, гидроксильной группой или карбоксильной группой, или h) имидазолильная, триазолильная, тетразолильная, пирролильная, пиридильная, пиразинильная или пиримидинильная группа, которая необязательно может быть замещена низшей алкильной, циклоалкильной или фенильной группой, более предпочтительно: низшая алкильная группа; низшая алкоксигруппа; гидроксильная группа; атом галогена; циклоалкильная группа; фенильная группа, которая необязательно может быть замещена низшей алкильной группой, низшей алкенильной группой, низшей алкинильной группой, атомом галогена, низшей алкоксигруппой, аминогруппой, моно- или ди- низшей алкиламиногруппой, гидроксильной группой или карбоксильной группой; или имидазолильная, триазолильная, тетразолильная или пирролильная группа, которая необязательно может быть замещена низшей алкильной группой, и наиболее предпочтительно незамещенная фенильная группа или фенильная группа, замещенная низшей алкильной группой. Если не указано иное, термин "низшая", используемый в определении общей формулы настоящего изобретения, означает неразветвленную или разветвленную углеродную цепь, имеющую от 1 до б атомов углерода. Примеры "алкильной группы" включают алкильные группы с неразветвленной или разветвленной цепью, предпочтительно низшую алкильную группу. Иллюстративные примеры "низшей алкильной группы" включают алкильные группы, имеющие каждая от 1 до 6 углеродных атомов, такие, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2метилпропил и т.п., из которых предпочтительными являются метильная и этильная группы. Примеры "алкенильной группы" включают алкенильные группы с неразветвленной или разветвленной углеродной цепью, предпочтительно низшую алкенильную группу. Иллюстративные примеры "низшей алкенильной группы" включают алкенильные группы, имеющие каждая от 2 до 6 углеродных атомов, такие, как винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бу-тенил, 2-метил-1-пропенил, 2-метилаллил, 1 метил-1-пропенил, 1-метилаллил, 1,1-диметилвинил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 3-метил-1бутенил, 3-метил-2-бутенил, 3-метил-3-бутенил, 2-метил-1-бутенил, 2-метил-2-бутенил, 2-метил-3-бутенил, 1метил-1-бутенил, 1-метил-2-бутенил, 1-метил-3-бутенил, 1,1-диметилаллил, 1,2-диметил-1-пропенил, 1,2диметил-2-пропенил, 1-этил-1-пропеинил, 1-этил-2-пропеинл, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5гексенил, 1,1,диметил-1-бутенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 3,3-диметил-1-бутенил, 1метил-1-пентенил, 1-метил-2-пентенил, 1-метил-3-пентенил, 1-метил-4-пентенил, 4-метил-1-пентенил, 4-метил-2пентенил, 4-метил-3-пентенил и т.п. Примеры "алкинильной группы" включают алкинильные группы с неразветвленной или разветвленной цепью, предпочтительно низшую алкинильную группу. Иллюстративные примеры "низшей алкинильной группы" включают алкинильные группы с неразветвленной или разветвленной цепью, имеющие каждая от 2 до 6 углеродных атомов, такие, как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 3-метил-1-бутинил, 2-метил-3-бутинил, 1-метил-2бутинил, 1-метил-3-бутинил, 1,1-диметил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил и т.п. "Циклоалкильной группой" или "циклоалкенильной группой" являются предпочтительно циклоалкильная или циклоалкенильная группы, имеющие от 3 до 8 углеродных атомов, такие, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и т.п., из которых предпочтительными являются соответственно циклогексильная и циклогексенильная группы. "Арильной группой" предпочтитлеьно является арильная группа, имеющая от 6 до 14 углеродных атомов, такая, как фенил, дифенил, нафтил, антрил, фенантрил и т.п., из которых предпочтительными являются фенильная и нафтильная группы, а особенно предпочтительной - фенильная группа. Примеры "алкоксигруппы" включают алкоксигруппы с неразветвленной или разветвленной цепью, предпочтительно низшую алкоксигруппу. "Низшей алкоксигруппой" предпочтительно является низшая алкоксигруппа, имеющая в качестве ее алкильной части вышеуказанную низшую алкильную группу, и примеры "низшей алкоксигруппы" включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси (амилокси), изопентилокси, трет-пентилокси, неопентилокси, 2-метилбутокси, 1,2диметилпропокси, 1-этилпропокси, гексилокси и т.п., из которых предпочтительными являются метокси- и изопропоксигруппы, особенно метоксигруппа. Примеры "алканоильной группы" включают алканоильные группы с неразветвленной или разветвленной цепью, предпочтительно, низшую алканоильную группу. Иллюстративные примеры "низшей алканоильной группы" включают низшие ацильные группы, имеющие каждая от 1 до 6 атомов углерода, произведенные от насыщенных алифатических карбоновых кислот, такие, как формил, ацетил, пропионил, бутилил, изобутилил, валерил, изовалерил, пивалоил, гексаноил и т.п. "Алканоилоксигруппа" предпочтительно является группой, содержащей в качестве ее алканоильной части ранее упомянутую низшую алканоильную группу, такой, как ацетокси, пропионилокси и т.п. "Алканоиламиногруппа" предпочтительно является группой, содержащей в качестве ее алканоильной части ранее упомянутую низшую алканоильную группу, такой, как ацетамид, пропиониламино и т.п. Примеры "атома галогена" включают фтор, хлор, бром и йод. Термин "моно- или ди- низшая алкиламиногруппа" означает аминогруппу, моно- или дизамещенную упомянутой выше низшей алкильной группой, и ее иллюстративные примеры включают моно- низшие алкиламиногруппы, такие, как метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор/бутиламино, трет-бутиламино, пентил(амил)амино, изопентиламино, неопентиламино, третпентиламино, гексиламино и т.п., и симметрические или асимметрические ди- инзшие алкиламиногруппы, такие, как диметиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино, диизобутиламино, этилметиламино, метилпропиламино и т.п. "Аралкильной группой", "аралкенильной группой" или "аралкинильной группой" предпочтительно является аралкильная, аралкенильная или аралкинильная группа, состоящая из ранее указанной арильной части (в частности, фенильной или нафтильной группы) и низшей алкильной, низшей алкенильной или низшей алкинильной части. "Алкенилоксигруппой", "алкинилоксигруппой", "циклоалкилоксигруппой", "циклоалкенилоксигруппой", "арилоксигруппой", "аралкилоксигруппой", "аралкенилоксигруппой" или "аралкинилоксигруппой" и "алкилтиогруппой", "алкенилтиогруппой", "алкинилтиогруппой", "циклоалкилтиогруппой", "циклоалкенилтиогруппой", "арилтиогруппой", "аралкилтиогруппой", "аралкенилтиогруппой" или "аралкинилтиогруппой" предпочтительно являются группы, имеющие в качестве соответствующей углеводородной части углеродную цепь низшего углеводорода, и если в качестве примера взять "алкенилоксигруппу", то ею предпочтительно является низшая алкенилоксигруппа, имеющая в качестве ее алкенильной части указанную ранее низшую алкенильную группу. "Алкоксикарбонильной группой" предпочтительно является низшая алкоксикарбонильная группа, имеющая в качестве ее алкильной части указанную выше низшую алкильную группу и образующаяся в результате этерификации спирта с неразветвленной или разветвленной цепью, имеющей от 1 до 6 атомов углерода, карбонильной группой, такая, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил, трет-пентилоксикарбонил, гексилоксикарбонил или т.п. Аналогичным образом, "алкенилоксикарбонильной группой", "алкинилоксикарбонильной группой", "циклоалкилоксикарбонильной группой", "циклоалкенилоксикарбонильной группой", "арилоксикарбонильной группой", "аралкилоксикарбонильной группой", "аралкенилоксикарбонильной группой", "аралкинилоксикарбонильной группой" или "алкиламинокарбонильной группой" предпочтительно является группа, такая, например, как (если в качестве примера взять "алкенилоксикарбонильную группу") низшая алкенилоксикарбонильная группа, имеющая в качестве ее алкенильной части указанную ранее низшую алкенильную группу. "Алифатической ацильной группой" предпочтительно является низшая ацильная группа, произведенная от насыщенной или ненасыщенной низшей жирной кислоты, причем может быть предпочтительной указанная выше низшая алканоильная группа. Иллюстративные примеры "ароматической ацильной группы" включают бензоил, толуоил, салицил, нафтоил, фталоил и т.п. "Ацилоксигруппой" является группа, которая в качестве ее ацильной части содержит указанную выше низшую алканоильную или ароматическую ацильную группу, и ее предпочтительные примеры включают ацетокси, бензоилокси и т.п. Иллюстративные примеры "защищенной аминогруппы" включают аминогруппы, каждая из которых защищена алифатической или ароматической ацильной группой, карбамоильной группой, карб-амидной группой, фталоильной группой или т.п. "Низшая алкиленовая группа" представляет собой неразветвленную или разветвленную двухвалентную углеродную цепь, имеющую от 1 до 7 углеродных атомов, и ее иллюстративные примеры включают метилен, этилен, пропилен, тетраметилен, 2-метилтриметилен, 1-этилэтилен, пентаметилен, 1,2-диэтилэтилен, гексаметилен и т.п. "Низшей алкениленовой группой" является неразветвленная или разветвленная двухвалентная углеродная цепь, имеющая 2-7 атомов углерода, и ее иллюстративные примеры включают винилен, пропенилен, 2пропенилен, 1-метилвинилен, 2-метилвинилен, бутенилен, 2-бутенилен, 3-бутенилен, 1-метилпропенилен, 1метил-2-пропенилен, 2-пентенилен, 1-метил-1-бутенилен, 2-гексенилен и т.п. "Низшей алкиниленовой группой" является неразветвленная или разветвленная двухвалентная углеродная цепь, имеющая 2-7 углеродных атомов, и ее иллюстративные примеры включают этинилен, 2-пропинилен, 2бутинилен, 3-бутинилен, 1-метил-2-пропинилен, 2-пентинилен, 2-гексинилен и т.п. "Диметиламино-замещенной низшей алкиламиногруппой" является аминогруппа, монозамещенная вышеуказанной низшек алкильной группой, которая также замещена диметиламиногруппой(ами). "Амино(низший)алканоиламиногруппой" является аминогруппа, монозамещенная указанной выше низшей алканоильной группой, которая также замещена аминогруппой(ами). Соль соединения по настоящему изобретению представляет собой соль присоединения кислоты, образованную с неорганической или органической кислотой, или соль с неорганическим или органическим основанием, причем предпочтительной является фармацевтически приемлемая соль. Иллюстративные примеры таких солей включают соль присоединения кислоты, образованную с неорганической кислотой, такой, как хлористоводородная, бромистоводородная, иодистоводородная, серная, азотная, фосфорная кислоты или т.п., органической кислотой, такой, как муравьиная, уксусная, пропионовая, щавелевая, малоновая, янтарная, фумаровая, малеиновая, молочная, яблочная, винная, лимонная, метансульфо-, этансульфокислота или т.п., или кислотной аминокислотой, такой, как аспарагиновая кислота, глутаминовая кислота или т.п.; и соль с неорганическим основанием, таким, как натрий, калий, магний, кальций, алюминий или т.п., органическим основанием, таким, как метиламин, этиламин, этаноламин или т.п., или основной аминокислотой, такой, как лизин, орнитин, или т.п. Полезны также соли четвертичного аммония. Иллюстративные примеры солей четвертичного аммония включают низший алкилгалогенид, низший алкилтрифурат, низший алкилтозилат, бензилгалогенид и т.п., предпочтительно метилиодид, бензилхлорид и т.п. Соединение общей формулы (I) может образовывать оптические изомеры, вследствие наличия асимметрического углеродного атома, или геометрические изомеры, вследствие наличия двойной связи или циклогексанового ядра. Смеси и отдельные формы различных изомеров, включая такие геометрические и оптические изомеры, также входят в объем настоящего изобретения. В объем настоящего изобретения включены также гидраты, сольваты, таутомеры и т.п. соединения общей формулы (I). Некоторые из соединений по настоящему изобретению проявляют полиморфизм, и все типы полиморфизма предлагаемого соединения также включены в объем настоящего изобретения. Способы получения Соединение по настоящему изобретению и его соли могут быть получены различными способами синтеза, основанными на использовании характеристик их основного углеродного скелета или типа заместителей. В этом случае может быть эффективным с точки зрения технологии получения замещать аминогруппу, карбонильную группу, гидроксильную группу и меркаптогруппу промежуточного соединения или соединения по настоящему изобретению подходящими защитными группами, а именно, функциональными группами, которые могут быть легко преобразованы в аминогруппу, карбонильную группу, гидроксильную группу и меркаптогруппу. В соответствии с условиями реакции могут, но не обязательно, быть использованы защитные группы, описанные, например, Greere and Wuts в "Protective Groups in Organic Synthesis, 2nd ed.". Кроме этих групп гидроксиметиленовая группа (СН-ОН) также является функциональной группой, которая может быть легко преобразована в карбонильную группу, и такая функциональная группа также может быть использована в качестве защитной для карбонильной группы. Ниже описаны типичные примеры способов получения соединения по настоящему изобретению. Первый способ (амидирование А) (В вышеприведенных формулах R1, R2, а, кольцо В и кольцо С имеют такие же соответственные значения, как описанные выше). Соединение (I) по настоящему изобретению может быть получено осуществлением обычным образом амидирования замещенной бензойной кислоты, представленной формулой (III), которая может необязательно быть защищена, или ее реакционноспособного производного и производного бензазепина с конденсированным 5-членным азотсодержащим ароматическим гетероциклическим кольцом, представленного формулой (IV), которое необязательно может быть защищено, или его соли, и, если это необходимо, удалением защитной группы. Примеры реакционноспособного производного соединения (III) включают его обычные сложные эфиры, такие, как метиловый эфир, этиловый эфир, изобутиловый эфир, трет-бутиловый эфир и т.п.; его хлорангидриды, такие, как хлорангидрид, бромангидрид и т.п.; его азиды кислоты; его активные сложные эфиры, полученные взаимодействием его с фенольным производным, таким, как п-нитрофенол, или Nгидроксиламиновым производным, таким, как 1-гидроксисукцинимид, 1-гидроксибензотриазол или т.п.; его симметрические ангидриды кислоты; и его смешанные ангидриды кислоты, включающие смешанные ангидриды органической кислоты, полученные взаимодействием его с алкиловыми эфирами галогенкарбоновой кислоты, такими, как галогениды алкилкарбоновой кислоты или пивалоилгалогениды, и смешанные ангидриды фосфорной кислоты, полученные взаимодействием его с дифенилфосфорилхлоридом или N-метилморфолином. Кроме того, при обеспечении соединению (III) возможности реагировать как свободная кислота, в качестве активного сложного эфира без выделения или т.п., желательно использовать конденсирующий агент, такой, как дициклогексилкарбодиимид, карбонилдиимидазол, дифенилфосфориламид, диэтилфосфорилцианид, 1-этил-3(3-диметиламинопропил)карбодиимидгидрохлорид или т.п. Реакция может быть осуществлена обычно в инертном органическом растворителе, выбранном, например, из галогенированных углеводородов, таких как дихлорметан, дихлорэтан, хлороформ и т.п., ароматических углеводородов, таких, как бензол, толуол, ксилол и т.п., простых эфиров, таких, как диэтиловый эфир, тетрагидрофуран и т.п., сложных эфиров, таких, как этилацетат и т.п., N,N-диметилформамида и диметилсульфоксида в зависимости от используемого реакционноспособного производного, конденсирующего агента и т.п., и при температуре охлаждения или при температуре в пределах от температуры охлаждения до комнатной температуры или от комнатной температуры до температуры нагревания в зависимости от используемого реакционноспособного производного. Для обеспечения мягкого протекания реакции иногда может быть удобным использовать соединение (III) в избыточном количестве или осуществлять реакцию в присутствии основания, такого, как N-метилморфолин, триметиламин, триэтиламин, N,N-диметиланилин, пиридин, 4-(N,N-диметиламино)пиридин, пиколин, лутидин или т.п. Пиридин может быть использован также в качестве растворителя. Реакция может быть осуществлена предпочтительно в отсутствии меркаптогруппы и реакционноспособных амино-, карбокси-, гидрокси- и т.п. групп, но целевой продукт может быть получен путем осуществления реакции после введения защитных групп и удаления защитных групп после завершения реакции. Способ удаления защитных групп изменяют в зависимости от типа использованной защитной группы. Например, когда защитной группой для аминогруппы является замещенная или незамещенная бензилоксикарбонильная группа или т.п., то можно осуществить каталитическое восстановление и, в некоторых случаях, кислотную обработку смесью бромистоводородной и уксусной кислот, смесью бромистоводородной и трифторуксусной кислот, фтористоводородной кислотой и т.п. В случае других защитных групп уретанового типа, таких, как трет-бутоксикарбонильная группа и т.п., удобно использовать кислотную обработку смесью бромистоводородной и уксусной кислот, трифторуксусной кислотой, хлористоводородной кислотой, смесью хлористоводородной и уксусной кислот, смесью хлористоводородной кислоты и диоксана и т.п. Когда защитной группой для аминогруппы является группа, которая образует фталимидогруппу с атомом азота аминогруппы, то первичная аминогруппа может быть образована удалением фталоильной группы путем ее обработки гидразинами, такими, как гидразин, метилгидразин, этилгидразин и т.п., аммиаком или ервичными аминами, такими, как метиламин, этиламин, пропил-амин и т.п. Защитные группы для карбоксильной группы могут быть легко удалены путем омыления, когда защитной группой являются метильная и этильная группы, путем каталитического восстановления или омыления, когда защитной группой являются бензильная группа и различные замещенные бензильные группы, путем указанной выше кислотной обработки, когда защитной группой является трет-бутильная группа, и путем контактирования с водой, когда защитной группой является триметилсилильная группа. При использовании защитных групп для меркаптогруппы и гидроксильной группы они могут быть удалены в большинстве случаев обработкой смесью натрия и жидкого аммиака или обработкой фтористоводородной кислотой, некоторые типы защитных групп (например, О-бензильная, O-ензилоксикарбонильная и S-паранитробензильная) могут быть удалены каталитическим восстановлением и защитные группы ацильного типа могут быть удалены путем их гидролиза в присутствии кислоты или щелочи. Указанные обработки могут быть осуществлены обычным образом. В этой связи можно сказать, что исходные соединения (III) и (IV) могут быть легко получены путем осуществления описанной выше реакции амидирования или реакции циклизации, которая будет описана далее. Второй способ (амидирование В) (В вышеприведенных формулах R1 R2 R3, R4, n, кольцо В и кольцо С имеют такие же соответственные значения, как указанные ранее). Соединение (Iа), как одно из соединений по настоящему изобретению, в котором А представляет -(CR3R4)n-CONH-, может быть получено путем осуществления обычным образом реакции амидирования между соответствующей карбоновой кислотой (V), которая может, но не обязательно, иметь защитную группу, или ее реакционноспособным производным и соответствующим амином (VI), который необязательно может иметь защитную группу, или его солью и удаления защитной группы, если это необходимо. Типы реакционноспособных производных, условия реакции, удаление защитных групп и т.п. такие же, как в первом способе, и реакция может быть осуществлена аналогичным образом. В этой связи можно сказать, что исходное соединение (VI) может быть легко получено путем осуществления вышеописанной реакции амидирования или реакции циклизации, которая будет описана далее. Третий способ (амидмрование С) (В вышеприведенных формулах R1, R2, кольцо С и А имеют такие же соответственные значения, как указанные ранее, а кольцо В' - такое же, как кольцо В, за исключением того, что один атом водорода или заместитель удален, R8 - представляет низшую алкильную группу, которая необязательно может быть замещена амино- или моно-- или ди- низшей алкиламиногруппой, необязательно могущей иметь защитную группу, и А1 представляет одинарную связь или низшую алкиленовую группу). Соединение (1с), как одно из соединений по настоящему изобретению, у которого в 5-членный цикл введена замещенная или незамещенная низшая алканоиламиногруппа, может быть получено осуществлением обычным образом реакции амидирования между соответствующей карбоновой кислотой (VII), которая может, но не обязательно, иметь защитную группу, или ее реакционноспособным производным и соответствующим амином (Ib), который может, но не обязательно, иметь защитную группу, или его солью и удалением защитной группы, если это необходимо. Типы реакционноспособных производных, условия реакции, удаление защитных групп и т.п. такие же, как в первом способе, и реакция может быть осуществлена аналогичным образом. Кроме того, можно получить так же, как в первом способе, соединение, у которого в 5-членный цикл введена замещенная или незамещенная аминокарбонильная группа, или другое соединение, у которого в кольцо С введена группа -NHCO- или -CONH-. Четвертый способ (циклизация) (В вышеприведенных формулах R1, R2, кольцо С, А, X1 и X3 имеют такие же соответственные значения, как указанные ранее, и одни из Y1, и Y2, и Y3, и Y4 образуют в сочетании оксогруппу (=О), а другие представляют атом галогена R9 - атом водорода или заместитель, и Z- группа, представленная =NH, =О или =S). Соединение, как одно из соединений по настоящему изобретению, в котором конденсирован имидазольный, оксазольный или тиазольный цикл, может быть получено взаимодействием соответствующего галогенкетона (VIII), который может необязательно иметь защитную группу, с соответствующими амидинами, гуанидинами, амидами, мочевинами, тиоамидами или тиомочевинами, представленными формулой (IX), и удалением защитной группы, если это необходимо. В этой реакции соответствующие тиоамид и тиомочевина, амидин и гуанидин или амид карбоновой кислоты и производное мочевины могут иногда образовывать соль с кислотой. Для ускорения реакции ее можно осуществлять в присутствии неорганического основания, такого, как гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия или т.п., или соли слабой кислоты с сильным основанием, или органического основания, такого, как пиридин, диизопропилэтиламин, 1,5диазабицикло[4.3.0]нон-5-ен или т.п. Реакция предпочтительно может быть осуществлена в инертном растворителе, который включает спиртовые растворители, такие, как метиловый, этиловый, изопропиловый спирты и т.п., простые эфиры, такие, как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., ацетонитрил, диметилформамид и диметилсульфоксид, и при температуре в пределах от комнатной температуры до температуры обратного стока используемого растворителя. При необходимости реакция может быть осуществлена под давлением. При использовании в реакции амидинов или гуанидинов, в этом случае иногда могут быть образованы оксазолы. При осуществлении реакции в атмосфере газообразного аммиака в присутствии карбоната аммония, ацетата аммония, формамида или т.п., в качестве основного продукта могут быть получены имидазолы. Используемое в этой реакции исходное соединение (VIII) может быть получено, как показано в следующей схеме реакции, осуществлением так же, как в первом способе, реакции амидирования между пара-замещенной бензойной кислотой (X), которая может, но не обязательно, иметь защитную группу, или ее реакционноспособным производным и производным (XI) бензазепина, которое может, но не обязательно, иметь защитную группу, или его солью и взаимодействием полученного продукта с галогенирующим агентом с удалением на любой стадии защитной группы, если это необходимо. В связи с этим соединение, у которого символ А в пара-замещенной бензойной кислоте (X) представляет - (CR3R4)-CONH-, может быть получено осуществлением так же, как в первом способе, реакции амидирования между соответствующей карбоновой кислотой (XIII) или ее реакционноспособным производным и соответствующей пара-аминобензойной кислотой (XIV). (В приведенных выше формулах R1, R2, R3, R4, кольцо С и символ А имеют такие же соответственные значения, как указанные выше, и одни из Y5 , и Y6 , и Y7 , и Y8 образуют в сочетании оксогруппу, а другие представляют оба атомы водорода Типы реакционноспособных производных, условия реакции, способы удаления защитных групп и т.п. на первой стадии реакции амидирования - такие же, как в первом способе. Что касается галогенирующего агента, используемого на стадии галогенирования, то можно использовать любое вещество, традиционно применяемое для галогенирования насыщенных циклических кетонов, но предпочтительно металлический реагент, такой, как галогенид меди(ІІ) (напр., бромид меди(II), хлорид меди(II) или т.п.), или пербромид пиридина, a-пирролидона, четвертичного аммония, диоксана или т.п., такой, как диоксандибромид, фенилтриметиламмонийтрибромид, пербромид пиридинийгидробромида, пирролидонгидротрибромид или т.п., а также сам галоген, такой, как хлор, бром или т.п., или галогенводородная кислота, такая, как хлористоводородная, бромистоводородная или т.п. При использовании металлического реагента или пербромида реакцию соединения (XII) с этим галогенирующим агентом обычно осуществляют в инертном растворителе, выбранном, например, из галогенированных углеводородов, таких, как дихлорметан, хлороформ, тетрахлорид углерода и т.п., простых эфиров, таких, как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., спиртов, таких, как метиловый, этиловый и т.п., ароматических углеводородов, таких, как бензол, толуол, ксилол и т.п., уксусной кислоты, этилацетата, воды или их смеси, и при комнатной температуре или с нагревом в присутствии, если это необходимо, небольшого количества катализатора, такого, как галогенводород или т.п. Целевое соединение может быть также получено взаимодействием соединения (XII) с самим галогеном в качестве галогенируюцего агента в инертном растворителе, таком, как галогенированный углеводород (напр., дихлорметан, хлороформ, тетрахлорид углерода и т.п.) и этиленгликоль, уксусная кислота и т.п., или взаимодействием соединения (XII) с галогенводородной кислотой в качестве галогенируюцего агента в ее кислом растворе или в основном растворе, таком, как водный раствор гидроксида натрия. В этом случае реакция может быть осуществлена при температуре в пределах предпочтительно от -30°С до температуры обратного стока используемого растворителя. Выше описан способ синтеза соединения с конденсированным имидазольным, оксазольным или тиазольным циклом, но можно получить соединение с конденсированным оксадиазольным, тиадиазольным или триазольным циклом традиционным способом по следующим схемам реакций. (В приведенных выше формулах R1, R2, кольцо С и символ А имеют такие же соответственные значения, как указанные выше, и Y9 представляет атом галогена). То есть соединение (Iе) с конденсированным 1,2,5-оксадиазольным циклом и соединение (If) с конденсированным 1,2,5-тиадиазольным циклом могут быть получены взаимодействием производного бензазепиндиона с гидроксиламингидрохлоридом в присутствии основания, такого, как ацетат натрия или т.п., для получения диоксима (XVI) и дегидратированием полученного соединения нагревом в присутствии дегидратирующего агента или обработкой этого соединения сероводородом. Каждая стадия может быть проведена традиционным образом. С другой стороны, соединение (Ig) с конденсированным 1,2,3-оксадиазольным циклом может быть получено путем обработки соединения (VIlla) аммиаком и обработки полученного соединения (XVIII) диазотирующим агентом, таким, как нитрит натрия. То есть соединение (Ig) находится в равновесном состоянии с диазосоединением (XIX). Кроме того, соединение (Ih) с конденсированным 1,2,3-оксадиазольным циклом и соединение (ІІ) с конденсированным 1,2,3-триазольным циклом могут быть получены взаимодействием диазосоединения (XIX) или соединения (Ig) с аммонийгидросульфидом или с аммиаком и аммонийацетатом. Каждая из этих стадий реакции может быть проведена традиционным образом. Исходное соединение (XV) может быть легко получено так же, как в вышеописанном способе амидирования для получения соединения (XII) из соединения (XI), а другое исходное соединение (VIII-а) может быть легко получено способом, описанным ранее. Когда вместо соединения (VIII-а) в качестве исходного соединения используют галокетон, имеющий иные положения для оксогруппы и атома галогена, то могут быть получены соединения, в которых 1,2,3оксадиазольный и 1,2,3-тиадиазольный циклы конденсированы в иных положениях. Пятый способ (взаимное превращение заместителей в ароматическом углеродном кольце) (В приведенных выше формулах R1, R2, кольцо В и символ А имеют такие же соответственные значения, как указанные ранее, и кольцо С‘ одинаково с кольцом С, за исключением того, что один атом водорода или заместитель удален, R10 и R11 могут быть одинаковыми или отличающимися друг от друга и представляют каждый атом водорода, низшую алкильную группу, защитную группу или амидиногруппу при условии, что R10 и R11 могут быть объединены с соседним атомом азота для образования гетероцикла, который может, но не обязательно, быть замещен). Соединение по настоящему изобретению, в котором его ароматическое углеродное кольцо имеет заместитель, может быть получено путем выбора соответствующего исходного соединения и повторения вышеописанного способа, но, когда заместитель в ароматическом углеродном кольце содержит характерную функциональную группу, оно может быть пoлyчeнo путем взаимного превращения, такого, как введение или замещение заместителя в ароматическом углеродном кольце. Например, соединение (Ik), которое содержит по крайней мере один заместитель типа амина в кольце С, может быть получено взаимодействием фторсоединения (Ij), имеющего -СО- или -CºN в соседних положениях, когда А представляет одинарную связь или -CONH-, с аммиаком, соответствующим амином, соответствующим циклическим имином или гуанидином. В этом способе может быть применен традиционный метод N-алкилирования. То есть, хотя реакция протекает в отсутствии растворителя, ее можно осуществлять в инертном органическом растворителе, выбранном, например, из диметилформамида, диметилсульфоксида, ароматических углеводородов, таких, как бензол, толуол, ксилол и т.п., галогенированных углеводородов, таких, как дихлорметан, дихлорэтан, хлороформ и т.п., и спиртов, таких, как метиловый, этиловый, изопропиловый и т.п. Для обеспечения плавности протекания реакции иногда может быть целесообразным осуществлять реакцию в присутствии неорганического основания, такого, как гидрид натрия, карбонат калия, карбонат натрия или т.п. Эту реакцию обычно осуществляют при комнатной температуре, при нагреве или при температуре обратного стока. Этот способ превращения с образованием аминного типа заместителя в ароматическом углеродном кольце может быть также применен к случаю осуществления превращения в такой аминного типа заместитель, как R2. Шестой способ (взаимное превращение заместителей в гетероцикле) (В вышеприведенных формулах R1, R2, кольцо В', А, кольцо С, R10 и R11 имеют такие же соответственные значения, как указанные выше, и А2 представляет одинарную связь или низшую алкиленовую группу и Y11 представляет атом галогена, остаток органической сульфокислоты или, когда А - одинарная связь, алкокси- или алкилтиогруппу). Взаимное превращение заместителей в 5-членном гетероци-кле может быть осуществлено легче, чем в случае ароматического кольца. Например, соединение (Im), содержащее по крайней мере один аминного типа заместитель в гетероцикле, может быть получено взаимодействием соответствоующего галогенида или сульфоната либо, когда А - одинарная связь, простого эфира или тиоэфира (II) с амином (XX). Примеры остатка органической сульфокислоти включают остатки алкансульфокислот, такие, как метансульфонилоксигруппа, этансульфонилоксигруппа и т.п., и остатки ароматических сульфокислот, такие, как бензолсульфонилоксигруппа, толуолсульфонилоксигруппа (в частности, пара-) и т.п. Реакция может быть осуществлена почти так же, как в пятом способе. В данном случае взаимное превращение в заместитель типа амина в гетероцикле может быть использовано как способ, при котором N-замещенное соединение получают взаимодействием иминосоединения, сконденсированного с азотсодержащим гетероциклом, с соответствующим галогенидом или сульфонатом, таким, как низший алкилгалогенид или низший алкилсульфонат. Другие способы Хотя выше описаны лишь амидирование, циклизация и введение заместителя типа амина, но соединение по настоящему изобретению может быть синтезировано различными традиционными способами, потому что предлагаемое соединение содержит различные характеристические фукнциональные группы. Например, соединение, имеющее карбоксильную группу, может быть получено гидролизом соответствующего его сложного эфира; сложный эфир может быть получен этерификацией соответствующей карбоновой кислоты; спирт, фенол, меркаптан и тиофенол могут быть получены гидролизом простого эфира и тиоэфира; и простой эфир и тиоэфир могут быть получены взаимодействием соответствующего спирта, фенола, меркаптана и тиофенола с соответствующими галогенидами, такими, как алкилгалогениды. Полученные описанными выше способами продукты реакции выделяют и очищают в форме свободных соединений, их солей, гидратов или различных сольватов. Соли могут быть получены путем осуществления обычных реакций солеобрзования. Выделение и очистку осуществляют путем выполнения обычных химических операций, таких, как экстрагирование, концентрирование, перегонка, кристаллизация, фильтрование, перекристаллизация и различные типы хроматографии. Как было описано выше, существуют отдельно или в виде смеси изомеры соединения по настоящему изобретению, такие, как рацематы, оптически aктивные вещества, диастереоизомеры и т.п. Рацемическое соединение может быть преобразовано в стереохимически чистый изомер путем использования надлежащего исходного соединения или традиционными методами разделения рацемической смеси (например, методом, при котором рацемическое соединение преобразуют в диастереоизомерную соль обычной оптически активной кислотой (винной или т.п.) и затем подвергают оптическому разделению). Смесь диастереоизомеров может быть также разделена традиционным способом, таким, как дробная кристаллизация, хроматография и т.п. ПРОМЫШЛЕННАЯ ПРИГОДНОСТЬ Соединения по настоящему изобретению и их соли проявляют сильный антагонизм к аргининвазопрессиновому V1- и/или V2-рецептору. То есть соединения по настоящему изобретению включают соединение, которое проявляет сильный антагонизм и к V1-, и к V2-рецепторам, соединение, которое избирательно проявляет сильный антагонизм к V1-рецептору, и соединение, которое избирательно проявляет сильный антагонизм к V2-рецептору. Особо предпочтительным является соединение, проявляющее сильный антагонизм и к V1-, и к V2 рецепторам. Соединения по настоящему изобретению проявляют высокую всасываемость при пероральном введении и надлежащее длительное действие благодаря их стойкости к метаболизму в живом организме. Как следствие (на основе этих функций), соединения по настоящему изобретению оказывают такие действия, как диуретическое, усиление мочевыделения, угнетение секреции фактоpa VIII, расширение кровеносных сосудов, ускорение сердечной деятельности, угнетение сокращения мезангиальных клеток, угнетение разрастания мезангиальных клеток, угнетение глюконеогенеза в печени, угнетение агрегации тромбоцитов, угнетение секреции альдостерона, угнетение продуцирования эндотелина, регулирование кровяного давления, регулирование секреции ренина, регулирование памяти, терморегуляция, регулирование продуцирования простагландинов и т.п., и полезны как характеристические диуретики, усилители мочевыделения, сосудорасширяющие средства, гипотензивные средства, средства, используемые для лечения сердечной и почечной недостаточности и ингибиторы свертывания крови и эффективны в предупреждении и лечении сердечной недостаточности, гипонатремии (понижение содержания натрия в крови), сндрома анормальной секреции вазопрессина (SIADH), гипертензии, болезней почек (нефроз, нефрит, диабетическая нефропатия, хроническая или острая почечная недостаточность), водянки, отёка мозга, асцита, цирроза печени, гипокалемии (понижение содержания калия в крови), нарушения водного обмена, диабета, различных ишемических заболеваний, болезни сосудов головного мозга, циклотимического расстройства, язвы желудка, тошноты, рвоты, обморока, расстройство функции почек и т.п. и в ослаблении последствий инфаркта мозга, внутримозгового кровоизлияния и т.п. Полезность соединений по настоящему изобретению была подтверждена следующими испытаниями. (1) Испытание на связывание с V1-рецепторами По методу Nakamura et al. (J. Biol. Chem., 258, 9283 (1983)) приготавливали образец мембран печени крысы, и [3Н]-Арг-вазопрессин (2нМ, удельная активность = 75,8Сі (куб. дюймов)/ммоль), 70мкг образца мембран и каждое инпытуемое лекарственное вещество (10-8-10-4М) инкубировали при 30°С в течение 30 минут в 250мкл 100мМ Трис-HCl буфера (рК 8,0), содержавшего 5мМ хлорида магния, 1мМ этилендиаминотетрауксусной кислоты (EDTA) и 0,1%-ный бычий сывороточный альбумин (БСА). После этого отсасывали инкубационный раствор, использовав устройство для сбора клеток, выращенных в культуре, и удаляли свободный лиганд и избыточный буфер пропусканием реакционной смеси через стеклянный фильтр (CF/B), в результате чего на фильтре улавливали связанный с рецептором меченый лиганд. Вынув фильтр, тщательно его сушили, после чего содержимое смешивали с жидкой сцинтилляционной смесью, и измеряли посредством жидкостного сцинтилляционного счетчика количество связанного с мембраной [3Н]-вазопрессина для вычисления коэффициента ингибирования по следующей формуле. Коэффициент ингибирова ния (%) = 100 С1 - В1 ´ 100 С0 - В1 где С1 - количество [3Н]-вазопрессина, связанного с мембраной при наличии известного количества каждого испытуемого лекарственного вещества, и [3 Н]-вазопрессина, C0 - количество [3Н]-вазопрессина, связанного с мембраной без добавления испытуемого лекарственного вещества, В1 - количество [3Н]-вазопрессина, связанного с мембраной при наличии избыточного вазопрессина (10-6М). Определив IС50-коннцентрация испытуемого лекарственного вещества, которая при описанном выше вычислении дает коэффициент ингибирования, равный 50%, использовали ее в следующей формуле для вычисления аффинитета связывания нерадиоактивного лиганда, а именно константы диссоциации (Кі). IC50 Ki = 1 + [L] / KD где [L] - концентрация радиоактивного лиганда, KD - константа диссоциации, вычисленная по диаграмме Скатчарда. Отрицательный логарифм вычисленного таким образом значения использовали как значение pKi. Результаты показаны в таблице 1. (2) Испытание на связывание с V2-рецептором Методом Campbell et al. (J. Biol. Chem., 247, 6167 (1972)) готовили образец мембран мозгового вещества почки кролика, и [3Н]-Арг-вазопрессин (2нМ, удельная активность = 75,8куб.дюймов/ммоль), 100мкг образца из мембран и каждое испытуемое лекарственное вещество (10-8-10-4М) подвергали испытанию так же, как при описанном выше испытании на связывание с V1-рецептором, и так же, как там, вычисляли значения pKi. Результаты показаны в таблице 1. Соединения по настоящему изобретению проявляют сильный антагонизм к аргининвазопрессину. Например, соединения примеров 17, 18(2), 20, 21, 23 и 37 проявили сильный антагонизм к обоим V1- и V2-рецепторам, который заметно силен даже в сравнении с соединением ОРС-31260 - антагонистом V2-рецептора и соединением ОРС-21268 - антагонистом V1-рецептора, которые разрабатываются как антагонисты аргининвазопрессина (сравни в таблице 1). ТАБЛИЦА 1 Антагонизм к аргининвазопрессиновым V1- и V2-рецепторам Пример № Активность связывания на аргининвазопрессиновом V1рецепторе (pKi) Активность связывания на аргининвазопрессиновом V2рецепторе (pKi) 1 2 4 6 8 10 12 15 17 18(1) 18(2) 20 21 22 23 24 27 37 38 Сравнительное соединение (1)* Сравнительное ** соединение (2) 8,33 8,82 8,36 7,95 7,74 8,61 8,52 8,91 9,04 8,37 9,05 9,18 8,74 8,11 8,91 7,77 8,21 9,49 8,24 6,71 7,21 8,25 8,69 8,62 8,25 8,59 8,01 8,93 9,11 8,59 8,83 9,04 8,42 8,07 8,98 8,64 7,23 9,30 7,31 8,01 7,85 4,29 * ОРС-31260 (WO 9105549, соединение примера 408, гидрохлорид) ** OCP-21268 (EP 032185, соединение примера 141) (3) V1-антагонизм у находящихся в сознании крыс (пероральное введение) V1-антагонизм проверяли на мужских особях крыс Wister (масса тела 300-320г), каждой из которых была введена (за 2-3 дня до испытания) канюля в левую сонную артерию для измерения кровяного давления и в левую яремную вену для введения аргининвазопрессина (АВП). Кровяное давление измеряли без наркоза посредством датчика давления через канюлю в сонной артерии. Каждое испытуемое соединение суспендировали в 0,5% водном растворе метилцеллюлозы и вводили перорально с дозой 1 или 10мг/кг. Повышение диастолического кровяного давления, вызываемое внутривенным введением 30мЕД/кг АВП перед введением испытуемого соединения, брали за 100%, и измеряли рост давления, вызываемый внутривенным введением 30мЕД/кг АВП, периодически в течение периода от 30 минут после введения испытуемого соединения до 8 часов после введения испытуемого соединения для вычисления коэффициента ингибирования повышения давления испытуемым соединением, т.е. V1-антагонизма испытуемого соединения. Вызванное АВП повышение давления подавляли до 50% или ниже в течение периода от 30 минут после введения образца для испытания до 6 часов после введения испытуемого соединения путем введения 1мг/кг каждого из соединений примеров 18(2), что показывает на пролонгированное действие предлагаемых соединений. С другой стороны, для подавления вызванного АВП повышения давления до 50% или ниже перорально вводили соединение ОРС-21268 при дозе 10мг/кг, в десять раз превышающей дозу указанных соединений по настоящему изобретению, но в течение периода лишь от 30 минут до 1 часа после введения, причем повышение давления, вызываемое АВП, возвращалось до уровня 100% через 4 часа после введения, что показывает на исчезновение V1-антагонизма. Приведенные выше результаты подтвердили, что V1-антагонизм соединений по настоящему изобретению при их пероральном введении находящимся в сознании крысам оказался более сильным и долгодействуюцим по сравнению с соединением ОРС-21268. (4) V2-антагонизм (водный диурез) у находящихся в сознании крыс (пероральное введение) Каждое испытуемое соединение суспендировали в 0.5%-ном водном растворе метилцеллюлозы и вводили перорально с дозой 3мг/кг мужским особям крыс Wister (масса тела 270-300г), лишенных до этого воды и в течение 16-20 часов. Использовав камеру для исследования метаболизма, собирали пробы мочи сразу после введения каждого испытуемого образца и вплоть до 4 часов после введения для измерения количества мочи. В подвергнутой испытанию группе, в которой вводили каждое из соединений примеров 18(2), 20, 21 и 23, количество мочи, собранной за период от момента сразу после введения до 2 часов после введения, было в 4795 раз больше, чем в группе, в которой вводили растворитель, и количество мочи, собранной за период от 2 до 4 часов после введения, было в 8-10 раз больше, чем в группе, в которой вводили растворитель, что показывает на длительный эффект усиления водного диуреза. С другой стороны, в группе, в которой вводили ОРС-31260, количество мочи, собранной за период от момента сразу после введения до 2 часов после введения, было в 11 раз больше, чем в группе, в которой вводили растворитель, а количество мочи, собранной за период от 2 до 4 часов после введения, было почти таким же, как в группе, в которой вводили растворитель, что показывает на исчезновение эффекта усиления водного диуреза. Приведенные выше результаты подтвердили, что усиливающее водный диурез действие соединений по настоящему изобретению при их пероральном введении находящимся в сознании крысам оказалось более сильным и длительным по сравнению с соединением ОРС-31260. Фармацевтическую композицию, содержащую в качестве активного компонента одно или несколько соединений общей формулы (I) и их фармацевтически приемлемые соли, изготавливают в виде различных лекарственных форм, таких, как таблетки, порошки, мелкие гранулы, гранулы, капсулы, пилюли, растворы, инъекционные растворы, суппозитарии, мази, пластыри и т.п., с использованием традиционно применяемых фармацевтических носителей, эксципиентов и других добавок и вводят перорально или парентерально. Клиническая доза соединения по настоящему изобретению для человека может, хотя и не обязательно, быть назначена с учетом симптомов, массы тела, возраста, пола и т.п. каждого, конкретного больного, но обычно она может составлять от 0,1 до 500мг для взрослого человека в сутки в случае перорального введения, причем суточная доза может быть использована одной порцией или раздельными порциями. Поскольку доза меняется в зависимости от различных условий, то достаточные эффекты могут быть получены в некоторых случаях и при меньшей, чем в указанных пределах, дозе. В качестве твердых композиций для перорального введения по настоящему изобретению могут быть использованы таблетки, порошки, гранулы и т.п. В таких твердых композициях один или несколько активных компонентов могут быть смешаны с по крайней мере одним наполнителем, таким, как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, тонкоизмельченная кристаллическая циллюлоза, крахмал, поливинилпирролидон или алюминатметасиликат магния. Обычно композиция может содержать и другие, кроме инертного наполнителя, добавки, которые включают смазывающее вещество, такое, как стеарат магния, разрыхляющее вещество, такое, как фибринкальцийгликолат, стабилизирующее вещество, такое, как лактоза, и солюбилизирующее вещество или адъювант раствора, такой, как глутаминовая или аспаргиновая кислота. При необходимости таблетки или пилюли могут быть покрыты пленкой из растворимого в желудке или в кишечнике вещества, такого, как сахароза, желатин, гидроксипропилцеллюлоза, фталат гидроксипропилметилцеллюлозы или т.п. Жидкие композиции для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, элексиры и т.п., которые содержат традиционно применяемые инертные разбавители, такие, как дистиллированная вода и этанол. Кроме инертных разбавителей такие композиции могут также содержать вспомогательные вещества, такие, как солюбилизирующее вещество или адьювант раствора, увлажняющее вещество, суспендирующее вещество и т.п., а также подслащивающее, вкусовое, ароматизирующее и антисептическое вещества. Инъекционные растворы для парентерального введения включают стерильные водные и неводные растворые суспензии и эмульсии. Примеры разбавителя для использования в водных растворах и суспензиях включают дистиллированную воду для инъекционного применения и физиологический солевой раствор. Примеры неводного разбавителя для применения в растворах и суспензиях включают растительные масла, такие, как пропиленгликоль, полиэтиленгликоль, оливковое масло и т.п., спирты, такие, как этанол и т.п., и Полисорбат 80 (торговое название). Такие композиции могут также содержать такие добавки, как тонизирующее, антисептическое, увлажняющее, эмульгирующее, диспергирующее стабилизирующее (например, лактоза), солюбилизирующее (или адьювант раствора) вещества и т.п. Эти композиции стерилизуют путем бактериального фильтрования через удерживающий бактерии фильтр, бактерицидного смешивания или облучения. В соответствии с другим вариантом можно использовать стерильно изготовленную твердую композицию, растворив ее перед применением в стерильной воде или стерильном инъекционном растворителе. Итак, выше описаны соединения по настоящему изобретению и способы их получения, которые далее будут дополнительно иллюстрированы более подробно со ссылками на следующие ниже примеры. Однако эти примеры не ограничивают настоящее изобретение. Поскольку некоторые из исходных соединений по настоящему изобретению являются новыми соединениями, то даны примеры способов их получения в виде ссылочных примеров. Ссылочный пример 1 В 33мл дихлорметана растворяли 3,32г 2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она и 4,31мл триэтиламина, и к полученному раствору добавляли при перемешивании на ледяной бане 4,59г п-нитробензоилхлорида. Реакционный раствор перемешивали при комнатной температуре еще 60 минут. Затем реакционный раствор смешивали с насыщенным водным раствором бикарбоната натрия и подвергали фазовому разделению. Отделяли слой дихлорметана и промывали его 1н. водным раствором хлористоводородной кислоты и насыщенным водным раствором хлорида натрия (по одному разу каждым раствором). Промытый указанным образом слой осушали над безводным сульфатом магния и затем концентрировали под пониженным давлением. Полученный остаток перекристаллизовывали из метилового спирта, получив в результате 5,68г 1-(4нитробензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она. Физикохимические свойства: 1 Н-ЯМР (d м,д, в CDCl3, внутренний стандарт ТМС): 2,17 (2Н, м) , 2,90 (общ, 3Н), 4,1 (1Н), 6,7 (1Н, м), 7,2-7,55 (общ, 4Н), 7,78-8,15 (общ, 3Н)/ MC (FAB): 311 (М+ + 1). Ссылочный пример 2 В смешанном растворителе, состоящем из 200мл диметилформамида и 100мл метилового спирта, растворяли 19,2г 1-(4-нитробензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она, и к полученному раствору добавляли 3мл никеля Ренея для осуществления гидрирования при нормальном давлении. После завершения абсорбции водорода реакционный раствор фильтровали и концентрировали. Полученный при этом остаток растворяли в дихлорметане и затем промывали насыщенным водным раствором бикарбоната натрия. Полученный дихлорметановый слой осушали над безводным сульфатом магния и затем концентрировали под пониженным давлением. Полученный при этом остаток перекристаллизовывали из метилового спирта, получив в результате 15,5г 1-(4-аминобензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она. Физикохимические свойства: 1 Н-ЯМР (d м,д, в CDCI 3, внутренний стандарт ТМС): 2,15 (2Н, м), 2,90 (2Н, м), 4,05 (2Н), 6,45 (2Н, д), 6,77 (1Н, м), 7,0-7,35 (общ, 4Н), 7,88 (1Н, м). MC (FAB): 281 (M+ + 1). Ссылочный пример 3 К раствору, полученному путем растворения 3,4г о-фенилбензойной кислоты в 34мл дихлорметана, добавляли с перемешиванием при -15°С 2,25мл оксалилхлорида и каталитически эффективное количество N,Nдиметилформамида, и полученную смесь доводили до комнатной температуры в течение 2 часов и перемешивали еще 2 часа. Реакционный раствор концентрировали под пониженным давлением и три раза подвергали азеотропной обработке дихлорметаном. Полученный при этом остаток растворяли в 34мл дихлорметана, и полученный раствор, перемешивая на ледяной бане, добавляли по каплям к 40мл дихлорметанового раствора, содержавшего 4,0г 1-(4-аминобензоил)-2,3, 4,5-тетрагидро-1Н-1-бензазепин-5-она и 3,0мл тризтиламина. Реакционный раствор доводили до комнатной температуры и продолжали перемешивать еще 120 минут. Полученный реакционный раствор смешивали с насыщенным водным раствором бикарбоната натрия и подвергали фазовому разделению. Отделяли дихлорметановый слой и, осушив над сульфатом магния, концентрировали. Полученный при этом остаток перекристаллизовывали из толуола, что дало в результате 5,82г 2-фенил-4'-[(5-оксо-2, 3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида. Физикохимические свойства: 1 Н-ЯМР (d м,д, в CDCI 3, внутренний стандарт ТМС): 2,23 (2Н, м), 2,87 (2Н, м), 4,1 (2Н), 6,75 (1Н, м), 6,8-7,7 (общ, 15Н), 7,85 (1Н, м). MC (FAB): 461 (М+ + 1). Ссылочный пример 4 Используя о-(4-метилфенил)бензойную кислоту и 1-(4-аминобензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5он в качестве исходных материалов, повторяли процедуру ссылочного примера 3, получив в результате 2-(4метилфенил)-4-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил] бензанилид. Физикохимические свойства: 1 Н-ЯМР (d м,д, в CDCI 3, внутренний стандарт ТМС): 2,18 (2Н, м), 2,35 (3Н, с), 2,88 (2Н, м), 4,1 (2Н), 6,72 (1Н, м), 6,85-7,7 (общ, 13Н), 7,85 (2Н). MC (FAB): 475 (М+ + 1). Пример 1 После растворения 500мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 15мл хлороформа и 1,5мл этилацетата, полученный раствор смешивали с 560мг бромида меди(II) и подвергали нагреву с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы, и полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 12мл этилового спирта, и полученный раствор смешивали с 100мг тиомочевины и подвергали 3-часовому нагреву с обратным холодильником. Во время этого нагрева выпадали в осадок бесцветные кристаллы. После охлаждения реакционного раствора на ледяной бане кристаллы отфильтровывали и промывали небольшим объемем этилового спирта, получив в результате 540мг 4'-[(2-амино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидробромата. Физикохимические свойства: Температура плавления >250°С. Данные элементного анализа (C31H24N4O2S·HBr): С( Н( Br( N(%) S(%) %) %) %) Вычислено 62, 4,2 13, 9,38 5,37 : 31 2 37 Найдено: 62, 4,4 13, 9,18 5,21 39 2 51 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,8-3,4 (общ, 3Н), 5,0 (1Н), 6,6-7,8 (общ, 16Н), 8,16 (1Н, м), 10,27 (1Н, с). MC (FAB): 517 (M+ + 1). Пример 2 После растворения 500мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 15мл хлороформа и 1,5мл этилацетата, полученный раствор смешивали с 560мг бромида меди(II) и подвергали нагреву с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия.Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в смешанном растворителе, состоявшем из 10мл 2пропилового спирта и 2мл метилового спирта, и полученный раствор смешивали с 155мг гуанилтиомочевины и подвергали 6-часовому нагреву с обратным холодильником. Во время этого нагрева выпадали в осадок бесцветные кристаллы. После охлаждения реакционного раствора на ледяной бане кристаллы отфильтровывали и промывали небольшим объемом холодного 2-пропилового спирта. Промытые таким образом кристаллы перекристаллизовывали из метилового спирта, получив в результате 452мг 4'-[(2-гуанидино-5,6дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидробромата. Физикохимические свойства; Температура плавления >250°С. 1 Н-ЯМР (d м.д. в ДМСО-dб, внутренний стандарт ТМС): 2,9-3,5 (общ, 3Н), 4,95 (1Н), 6,7-7,8 (общ, 16Н), 8,18 (общ, 5Н), 10,32 (1Н, с). MC (FAB): 559 (М+ + 1). Пример 3 Повторяли реакцию примера 1, за исключением того, что в качестве исходного материала использовали 470мг 2-(4-метилфенил)-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, полученный реакционный раствор концентрировали, и остаток подвергали фазовому разделению, использовав этилацетат и водный раствор бикарбоната натрия. Отделяли этилацетатный слой, осушали его над сульфатом магния и затем концентрировали. Полученный при этом остаток пе-рекристаллизовывали из этилацетата, получив в результате 358мг 4'-[(2-амино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-(4-метилфенил)бензанилида. Физикохимические свойства: Температура плавления 161-163°С. Данные элементного анализа (C32H26N4O2S) C(%) H(%) N(%) S(%) Вычислено: 72,43 4,94 10,56 6,04 Найдено: 72,32 4,85 10,52 5,78 1 Н-ЯМР (S м.д. в ДМСО-d6, внутренний старндарт ТМС): 2,27 (3Н, с), 3,07 (2Н), 5,0 (1Н), 6,72 (1Н, м), 6,8-7,7 (общ, 14Н), 8,18 (1Н, м), 10,29 (1Н, с). MC (FAB): 531 (М+ + 1). Пример 4 Используя 400мг 2-(4-метилфенил)-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в качестве исходного материала, повторяли процедуру примера 2, получив в результате 392мг 4'-[(2-гуанидино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-(4-метилфенил)бензанилидгидробромата. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C33H28N6O2S·HBr): С(%) Н(%) N(%) S(%) Br(%) Вычислено: 60,64 4,47 12,86 4,91 12,23 Найдено: 60,35 4,49 12,72 4,73 12,08 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,27 (3Н, с), 3,30 (общ, 3Н), 6,7-7,8 (общ, 15Н), 7,92 (общ, 4Н), 8,22 (1Н, м), 10,29 (1Н, с). MC (FAB): 573 (М+ + 1). Пример 5 После растворения 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-бензазепин-1-ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 15мл хлороформа и 2мл этил-ацетата, полученный раствор смешивали с 390мг бромида меди(II) и подвергали 3-часовому нагреву с обратным холодильником при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 20мл 2-пропилового спирта, и полученный раствор смешивали с 372мг 4-имидазолилтиоацетамидгидрохлоридом и подвергали 24-часовому нагреву с обратным холодильником. Охладив реакционный раствор до комнатной температуры, отгоняли растворитель и полученный остаток смешивали с хлороформом и насыщенным водным раствором бикарбоната натрия для отделения полученного органического слоя, который затем промывали водой и насыщенным водным раствором хлорида натрия, осушали над безводным сульфатом магния, после чего удаляли из него растворитель путем отгонки под пониженным давлением. Полученный в результате остаток подвергали колоночной хроматографии на силикагеле с элюированием смесью (25:1) хлороформ-метиловый спирт. Полученный элюат в хлороформе смешивали с 5мл смеси 4н хлористоводородная кислота-этилацетат, удаляли путем отгонки растворитель, и полученный при этом остаток перекристаллизовывали из смеси этиловый спирт-диэтиловый эфир, получив в результате 262мг 4'-[(2-(4-имидазолилметил)-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2фенилбензанилида·2НСl. Физикохимические свойства: Температура плавления 192-195°С. Данные элементного анализа (C35H27N5O2S·2HCI·3Н2О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 61,67 4,73 10,27 4,70 10,40 Найдено: 61,82 4,37 10,27 4,79 10,30 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 3,04 (1Н, м), 3,37 (2Н, м) , 4,56 (2Н, с), 5,00 (1Н, м) , 6,78 (1Н, д) , 6,90 (2Н, д), 7,08 (1Н, т) , 7,25-7,69 (общ, 14Н), 8,29 (1Н, д), 10,35 (1Н, с), 14,59 (1Н, с). MC (FAB): 58 2 (М+ + 1). Пример 6 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 262мг 4-(2-метилимидазолил)тиоацетамидгидрохлорида, повторяли процедуру примера 5, получив в результате 263мг 4'-[[2-[4-(2-метилимидазолил)метил]-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил]карбонил]-2фенилбензанилида·2НСI. Физикохимические свойства: Температура плавления 197-200°С. Данные элементного анализа (C36H29N5O2S·2НСI·1,5Н2О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 62,97 4,82 10,20 4,67 10,33 Найдено: 62,75 4,62 10,24 4,73 9,99 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,56 (ЗН, с), 3,05 (1Н, м), 3,36 (2Н, м), 4,48 (2Н, с), 5,00 (1Н, м), 6,79 (1Н, д), 6,90 (2Н, д) , 7,09 (1Н, т) , 7,257,58 (общ, 13Н), 8,33 (1Н, д) , 10,34 (1Н, с), 14,20 (1Н, с). MC (FAB): 596 (М+ + 1). Пример 7 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 370мг 2-пиридилтиоацетамидгидрохлорида, повторяли процедуру примера 5, и полученное свободное основание перекристаллизовывали из смеси хлороформ-диэтиловый эфир, получив в результате 300мг 4'-[[2-(2пиридилметил)-5,6-дигидро-4Н-тиазоло[5,4-d][1]-бензазепин-6-ил]карбонил]-2-фенилбензанилида. Физикохимические свойства; Температура плавления 215-218°С. Данные элементного анализа (C37H28N4O2S): С(%) Н(%) N(%) S(%) Вычислено: 74,98 4,76 9,45 5,41 Найдено: 74,69 4,68 9,32 5,39 1 Н-ЯМР (d м.дю в СDСІ 3, внутренний стардарт ТМС): 3,10 (2Н, м) , 3,49 (1Н, м) , 4,56 (2Н, с), 5,17 (1Н, дд), 6,66 (1Н, д), 6,85 (1Н, д), 6,96-7,10 (5Н, м), 7,22-7,49 (общ, 8Н), 7,46 (1Н, т) , 7,53 (1Н, т), 7,61 (1Н, т), 7,86 (1Н, д) , 8,42 (1Н, д), 8,63 (1Н, д). MC (FAB): 593 (М+ + 1), Пример 8 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 400мг 3-пиридилтиоацетамидгидрохлорида, повторяли процедуру примера 5, получив в результате 100мг 4'-[[2-(3пиридилметил)-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил]карбонил]-2-фенилбензанилидгидрохлорида в виде аморфного твердого вещества. Физикохимические свойства: 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 3,03 (1Н, м), 3,29 (2Н, м), 4,66 (2Н, с), 4,99 (1Н, д), 6,78 (1Н, д), 6,89 (2Н, д), 7,08 (1Н, т), 7,25-7,58 (общ, 12Н), 8,03 (1Н, т), 8,25 (1Н, д), 8,60 (1Н, д), 8,85 (1Н, д), 9,04 (1Н, с), 10,32 (1Н, с). MC (FAB): 593 (М+ + 1), Пример 9 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 337мг 4-морфолинобутантиоамидгидрохлорида, повторяли процедуру примера 5, и полученный остаток перекристаллизовывали из смеси метиловый спирт-диэтиловый эфир, получив в результате 360мг 4'-[[2-(3морфолинопропил)-5,6-дигидро-4Н-тиазоло[5,4-d][1]бенз-азепин-6-ил]карбонил]-2фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления 215-218°С. Данные элементного анализа (C38H36N4O3S·2HCI·1,6Н2О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 62,48 5,68 7,67 4,39 9,71 Найдено: 62,13 5,59 7,45 4,38 9,16 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,27 (2Н, м), 3,06-3,29 (общ, 9Н), 3,45 (2Н, м), 3,85 (1Н, м), 3,85 (3Н, м), 3,95 (2Н, м), 5,00 (1Н, м), 6,79 (1Н, д) , 6,90 (2Н, д), 7,08 (1Н, т), 7,25-7,57 (общ, 12Н), 8,25 (1Н, д), 10,34 (1Н, с). MC (FAB): 629 (М+ + 1). Пример 10 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 300мг диметиламиноэтилтиомочевинагидрохлорида, а также этиловый спирт в качестве растворителя в реакции, повторяли процедуру примера 5, и полученный остаток перекристаллизовывали из смеси этилацетатдиэтиловый эфир, получив в результате 300мг 4'-[(2-диметиламиноэтиламино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилида·2НСI. Физикохимические свойства: Температура плавления 187-190°С. Данные элементного анализа (C35H33N5O2S·2HCI·3Н3О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 58,82 5,78 9,80 4,49 9,92 Найдено: 58,60 5,40 9,73 4,53 9,51 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,85 (6Н, с), 3,02 (2Н, м), 3,19 (1Н, м), 3,37 (2Н, т), 3,76 (2Н, м), 4,97 (1Н, м), 6,74 (1Н, д), 6,93 (2Н, д), 7,04 (1Н, т), 7,24-7,48 (общ, 12Н), 8,24 (1Н, д), 10,35 (1Н, с), 10,59 (1Н, с). MC (FAB): 514 (М+ + 1). Пример 11 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 204мг диметиламинотиоацетамидгидрохлорида, повторяли процедуру примера 5, получив в результате 167мг 4'-[(2диметиламино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида в виде аморфного твердого вещества. Физикохимические свойства: 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 3,04 (1Н, м) , 3,12 (6Н, с), 3,29 (2Н, д), 4,96 (1Н, м), 6,73 (1Н, д), 6,92 (2Н, д), 7,04 (1Н, т), 7,24-7,58 (общ, 12Н), 8,24 (1Н, д), 10,33 (1Н, с). MC (FAB): 545 (М+ + 1). Пример 12 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 285мг диметиламинобутантиоамидгидрохлорида, повторяли процедуру примера 5, получив в результате 212мг 4'-[[2-(3диметиламинопропил)-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазєпин-6-ил]карбонил]-2фенилбензанилидгидрохлорида в виде аморфного твердого вещества. Физикохимические свойства: 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,19 (2Н, м) , 2,79 (6Н, с), 3,10 (3Н, м), 3,18 (2Н, т), 3,27 (2Н, м) , 5,04 (1Н, м), 6,77 (1Н, д) , 6,90 (2Н, д), 7,08 (1Н, т), 7,25-7,58 (общ, 12Н), 8,35 (1Н, д), 10,33 (1Н, с). MC (FAB): 587 (М+ + 1). Пример 13 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 185мг 2-карбоксипропантиоамида, повторяли процедуру примера 5, и полученное свободное основание перекристаллизовывали из смеси метиловый спирт-диэтиловый эфир, получив в результате 186мг 4'-[(2-метил5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилида. Физикохимические свойства: Температура плавления 165-168°С. Данные элементного анализа (C32H25N6O2S·4H2О): С(%) Н(%) N(%) S(%) Вычислено: 73,52 4,97 8,04 6,13 Найдено: 73,35 5,08 7,56 5,88 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,75 (3Н, с), 3,07-3,19 (2Н, м), 3,55 (1Н, м), 5,20 (1Н, м), 6,65 (1Н, д), 6,85 (2Н, д), 6,96-6,99 (3Н, м), 7,01-7,85 (общ, 9Н), 8,38 (1Н, д), 8,39 (1Н, д). MC (FAB): 516 (М+ + 1). Пример 14 (1) После растворения 461мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 14мл хлороформа и 1,4мл этилацетата, полученный раствор смешивали с 560мг бромида меди (II) и подвергали 3-часовому нагреву с обратным холодильником при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 12мл 2-пропилового спирта, и полученный раствор смешивали с 220мг фталимидотиоацетамида и подвергали 6-часовому нагреву с обратным холодильником. Во время этого нагрева выпадали в осадок бесцветные кристаллы. Охладив реакционный раствор на ледяной бане, кристаллы отфильтровывали и промывали небольшим объемом холодного 2-пропилового спирта, получив в результате 410мг 4'-[(2-фталимидометил-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил) карбонил]-2фенилбензанилида. Физикохимические свойства: 1 Н-ЯМР (d м.д. в CDCl3, внутренний стандарт ТМС): 2,8-3,8 (общ, 3Н), 5,21 (2Н, с), 6,64 (1Н, дд), 6,75-8,1 (общ, 19Н), 8,40 (1Н, дд). MC (FAB): 661 (M+ + 1). (2) После суспендирования 390мг 4'-[(2-фталимидометил-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6ил)карбонил]-2-фенилбензанилида в 20мл метилового спирта, полученную суспензию смешивали с 1,2мл смешанного растворителя, состоявшего из 40 массовых частей метиламина и 60 массовых частей метилового спирта, и перемешивали всю ночь при комнатной температуре. Реакционную смесь концентрировали, и полученный остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метиловый спирт = 20:1). Полученное при этом твердое вещество растворяли в 3,5мл метилового спирта, и полученный раствор смешивали с раствором 4н. хлористоводородная кислота-этилацетат и затем с ацетонитрилом для обеспечения образования осадка. Образовавшийся осадок отфильтровывали и промывали небольшим объемом ацетонитрила, получив в результате 200мг 4'-[(2-аминометил-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Чистота после ВЭЖХ: >96%; ODS-80TM (Tosoh). 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,51 (1Н, м), 3,09 (1Н, м), 3,36 (общ, 2Н), 4,47 (2Н, с), 5,02 (1Н), 6,85 (2Н), 7,11 (1Н, т), 7,2-7,7 (общ, 13Н), 7,9 (1Н), 8,45 (1Н, д), 8,81 (2H), 10,35 (1H, с). MC (FAB): 531 (M+ + 1). Пример 15 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 300мг 3-фталимидопропантиоамида, повторяли процедуру примера 14, получив в результате 135мг 4'-[ (2-аминоэтил5,6-дигидро-4Н-тиазоло-[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Чистота после ВЭЖХ: >91%; ODS-80TM (Tosoh). 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 3,05 (1Н, м), 3,40-3,37 (общ, 6Н), 5,01 (1Н, м), 6,77 (1Н, д), 6,91 (2Н, д), 7,09 (1Н, т), 7,25-7,58 (общ, 12Н), 8,14 (1Н, шир,), 8,38 (1Н, д), 10,33 (1Н, с). MC (FAB): 545 (М+ + 1). Пример 16 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида и 376мг 4-фталимидобутантиоамида, повторяли процедуру примера 14 и получили, использовав смесь этиловый спиртэтилацетат в качестве растворителя для перекристаллизации, 193мг 4'-[(3-аминопропил-5,6-дигидро-4Нтиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления 185-188°С. Данные элементного анализа (C34H30N4O2S·HСI·Н2О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 62,50 5,29 8,41 6,39 7,90 Найдено: 62,27 5,09 8,51 5,17 8,15 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,09 (2Н, м), 2,97 (2Н, м), 3,05 (1Н, м), 3,10 (1Н, т), 3,34 (2Н, м), 5,01 (1Н, м), 6,77 (1Н, д), 6,89 (2Н, д), 7,08 (1Н, т), 7,26-7,58 (общ, 12Н), 7,99 (2Н, шир.), 8,33(1Н, д), 10,33 (1Н, с). MC (FAB): 559 (М+ + 1). Пример 17 После растворения 176мг трет-бутоксикарбонилглицина, 205мг 1-гидроксибензтриазола и 0,15мл Nметилморфолина в 3,5мл дихлорметана к полученному раствору добавляли с перемешиванием на ледяной бане 192мг 1-этил-3-(2-диметиламинопропил)карбодиимидгидрохлорид, смесь доводили до комнатной температуры и перемешивали 60 минут. К этому реакционному раствору, опять охлажденному на ледяной бане, добавляли по каплям 4мл дихлорметана, в котором уже было растворено 400мг 4'-[(2-амино-5,6-дигидро-4Н-тиазоло[5,4d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидробромида, описанного в примере 1, и 0,103мл триэтиламина, после чего смесь перемешивали всю ночь при комнатной температуре. Реакционный раствор смешивали с водой, перемешивали 60 минут и затем подвергали фазовому разделению. Отделяли слой дихлорметана, промывали его насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия (один раз каждым раствором) и затем осушали над безводным сульфатом магния. Удалив путем отгонки растворитель, полученный в результате остаток суспендировали в 3 мл метилового спирта. Охлаждая на ледяной бане, суспензию смешивали с 4,4мл смеси 4 н. хлористоводородная кислотадиоксан и перемешивали в течение 3 часов. После этого реакционный раствор концентрировали, и полученный при этом остаток перекристаллизовывали из 2-пропилового спирта, получив в результате 250мг 4'-[(2глициламино-5,6-дигидро-4Н-тиазоло[5,4-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида 2пропилового спирта. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C33H27N6O3S·НСl·С3Н8О): С(%) Н(%) N(%) S(%) Cl(%) Вычислено: 64,51 15,41 10,45 4,78 5,29 Найдено: 64,35 5,19 10,20 4,80 5,10 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,04 (6H, д), 3,80 (1Н, м), 5,05 (1Н), 6,7-7,8 (общ, 16Н), 8,24 (1Н, дд), 10,30 (1Н, с). MC (FAB): 574 (М+ + 1). Пример 18 После растворения 500мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 15мл хлороформа и 1,5мл этилацетата, полученный раствор смешивали с 560г бромида меди(II) и подвергали нагреву с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 10мл ацетонитрила, и полученный раствор смешивали с 750мг карбоната калия и 510мг ацетоамидингидрохлорида и подвергали 90-минутному нагреву с обратным холодильником при интенсивном перемешивании. После охлаждения реакционного раствора до комнатной температуры удаляли путем фильтрования нерастворимые материалы, после чего отгоняли под пониженным давлением растворитель. Полученный остаток растворяли в хлороформе, после чего полученный раствор промывали водой и осушали над безводным сульфатом магния. После отгонки растворителя полученный остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метиловый спирт = 20:1), получив в результате, в порядке элюирования, 4'-[(2-метил-5,6-дигидро-4Н-оксазоло[4,5-d][1]бензазепин-6-ил)карбонил]-2фенилбензанилид и 4'-[(2-метил-1,4,5,6-тетрагидроимидазоло[4,5-d][1]бензазепин-6-ил)карбонил]-2 фенилбензанилид. 4'-[(2-Метил-5,6-дигидро-4Н-оксазоло[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид перекристаллизовывали из этилацетата, получив в результате 40мг кристаллов (пример 18(1)). 4'-[(2-Метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид растворяли в 5мл этилового спирта, полученный раствор смешивали с 0,19мл смеси 4н. хлористоводородная кислотаэтилацетат и охлаждали на ледяной бане, после чего отфильтровывали выпавшие при этом в осадок кристаллы и промывали их небольшим объемом этилового спирта, получив в результате 220мг 4'-[(2-метил-1,4,5,6тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида (пример 18(2)). Физикохимические свойства; 4'-[(2-Метил-5,6-дигидро-4Н-оксазоло[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилид Температура плавления 234-236°С. 1 Н-ЯМР (d м.д. в СDСI 3, внутренний стандарт ТМС): 2,57 (3Н, с), 2,90 (2Н, м), 3,27 (1Н, м), 5,17 (1Н, м), 6,66 (1Н, д), 6,8-7,0 (общ, 6Н), 7,23 (1Н), 7,3-7,6 (общ, 8Н), 7,7-7,9 (общ, 2Н). MC (FAB): 500 (М+ + 1). (СІ): 499 (М+). MC высокого разрешения (FAB): Найдено: 500,200597 Вычислено: 500,197417 Эмпирическая формула C32H25N3O3. 4'-[(2-Метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорид Температура плавления >230°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,70 (3Н, с), 2,99 (1Н, т), 3,17 (2Н, м), 4,99 (1Н, м), 6,87,0 (общ, 3Н), 7,14 (1Н, т), 7,2-7,7 (общ, 12Н), 8,02 (1Н, д), 10,31 (1Н, с), 14,6 (общ, 2Н). MC (FAB): 499 (М+ + 1). (СІ): 498 (М+). MC высокого разрешения (FAB): Найдено: 499,215808 Вычислено: 499,213401 Эмпирическая формула C32H26N4O2. Пример 19 После растворения 800мг 2-(4-метилфенил)-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 24мл хлороформа и 2,4мл этилацетата, полученный раствор смешивали с 560г бромида меди(II) и подвергали нагреву с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 16мл ацетонитрила, и полученный раствор смешивали с 1,17г карбоната калия и 800мг ацетоамидингидрохлорида и подвергали 120-минутному нагреву с обратным холодильником при интенсивном перемешивании. После охлаждения реакционного раствора до комнатной температуры удаляли путем фильтрования нерастворимые материалы, после чего отгоняли под пониженным давлением растворитель. Полученный остаток растворяли в хлороформе, после чего полученный раствор промывали водой и осушали над безводным сульфатом магния. После отгонки растворителя полученный остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метиловый спирт = 30:1), получив в результате, в порядке элюирования, 2-(4-метилфенил)-4'-[(2-метил-5,6-дигидро-4Н-оксазоло[4,5d][1]бензазепин-6-ил)карбонил]бензанилид (пример 19(1)) и 2-(4-метилфенил)-4'-[(2-метил-1,4,5,6тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]бензанилид. 2-(4-Метилфенил)-4'-[(2-метил-1,4,5,6-тетрагидроимидазo[4,5-d][1]бензазепин-6-ил)карбонил]бензанилид растворяли в 10мл этилового спирта, полученный раствор смешивали с 0,37мл смеси 4н хлористоводородная кислота-этилацетат и охлаждали на ледяной бане, после чего отфильтровывали выпавшие при этом в осадок кристаллы и промывали их небольшим объемом этилового спирта, получив в результате 500мг 2-(4метилфенил)-4-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил) карбонил]бензанилидгидрохлорида (пример 19(2)). Физикохимические свойства: 2-(4-Meтилфенил)-4'-[(2-метил-1,4,5,3-тетрагидроимидазо[4,5-d][1]бензазепин-6ил)карбонил]бензанилидгидрохлорид Температура плавления 220-223°С. 1 Н-ЯМР (d м,д, в ДМСО-d6, внутренний стандарт ТМС): 2,25 (3Н, с), 2,67 (3Н, с), 3,02 (1Н, м), 3,16 (2Н, м), 4,99 (1Н, м), 6,8-7,0 (общ, 3Н), 7,15 (общ, 3Н) , 7,2-7,6 (общ, 9Н), 8,04 (1Н, д), 10,33 (1Н, с), 14,6 (общ, 2Н). MC (FAB): 513 (М+ + 1). Пример 20 После растворения 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 15мл хлороформа и 2мл этилацетата, полученный раствор смешивали с 390г бромида меди(II) и подвергали нагреву с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 20мл ацетонитрила, и полученный раствор, смешивали с 1,1г карбоната калия и 371мг этилкарбамидинкарбоната и подвергали 1-часовому нагреву с обратным холодильником при интенсивном перемешивании. После фильтрования реакционного раствора из полученного фильтрата отгоняли растворитель, и полученный остаток смешивали с насыщенным водным раствором бикарбоната натрия и хлороформом для отделения органического слоя, который затем промывали водой и насыщенным водным раствором хлорида натрия и осушали над безводным сульфатом магния. После отгонки растворителя под пониженным давлением полученный остаток подвергали колоночной хроматографии на силикагеле с элюированием смешанным растворителем хлороформ-метиловый спирт (20:1). Полученный элюат смешивали с 5мл смеси 4н хлористоводородная кислота-этилацетат и охлаждали на ледяной бане, после чего отфильтровывали выпавшие в осадок кристаллы и подвергали их перекристаллизации, использовав этиловый спирт в качестве растворителя для перекристаллизации, и в результате получили 248мг 4'-[(2-этил1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C33H28N4O2·HCI·6Н2О): С(%) Н(%) N(%) Cl(%) Вычислено: 68,59 5,62 9,69 6,13 Найдено: 68,28 5,54 9,62 6,48 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,38 (3Н, т), 2,99 (1Н, т), 3,08 (2Н, кв), 3,12 (2Н, м), 4,98 (1Н, м), 6,76 (1Н, д), 6,93 (2Н, д), 7,14 (1Н, т), 7,26-7,58 (общ, 12Н), 8,13 (1Н, д), 10,31 (1Н, с) , 14,70 (1Н, шир.). MC (FAB): 513 (М+ + 1). Пример 21 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, 597мг пропилкарбамидинкарбоната и 1,2г карбоната калия, повторяли процедуру примера 20 получив в результате (с использованием в качестве растворителя для перекристаллизации смеси этилаце-татэтиловый спирт) 243мг 4'[(2-пропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C34H30N4O2·HCI·2H2O): С(%) Н(%) N(%) Cl(%) Вычислено: 68,16 5,89 9,35 5,92 Найдено: 68,86 5,61 9,62 6,00 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,00 (3Н, т), 1,80 (2Н, кв), 2,99 (3Н, м), 3,56 (2Н, м), 4,99 (1Н, м), 6,86 (1Н, д), 6,93 (2Н, д), 7,13 (1Н, т), 7,23-7,58 (общ, 12Н), 8,08 (1Н, д), 10,32 (1Н, с), 14,60 (1Н, шир.). MC (FAB): 527 (М+ + 1). Пример 22 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, 576мг бензилкарбамидинкарбоната и 740мг карбоната калия, повторяли процедуру примера 20, получив в результате (с использованием в качестве растворителя для перекристаллизации смеси этилацетат-этиловый спирт) 225мг 4'-[(2-бензил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2-фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C38H30N4O2·HCI·1,5H2O): С(%) Н(%) N(%) Cl(%) Вычислено: 71,52 5,37 8,78 5,56 Найдено: 71,55 5,22 8,82 5,59 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,97 (1Н, м), 3,09 (2Н, м), 3,41 (2Н, с), 4,96 (1Н, м) , 6,86-7,58 (общ, 22Н), 8,14 (1Н, д), 10,32 (1Н, с), 15,00 (1Н, шир.). MC (FAB): 5 75 (М+ + 1). Пример 23 Используя 400мг 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, 585мг циклопропилкарбамидинкарбоната и 750мг карбоната калия, повторяли процедуру примера 20 получив в результате (с использованием в качестве растворителя для перекристаллизации смеси этилацетат-этиловый спирт) 276мг 4'-[(2-циклопропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2фенилбензанилидгидрохлорида. Физикохимические свойства: Температура плавления >230°С. Данные элементного анализа (C34H28N4O2·HCI·1,5H2O) С(%) Н(%) N(%) Cl(%) Вычислено: 69,44 5,48 9,53 6,03 Найдено: 69,10 5,39 9,42 6,15 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,28-1,37 (общ, 4Н), 1,99 (1Н, м), 2,96 (1Н, м) , 3,09 (1Н, м), 4,96 (1Н, м), 6,83 (1Н, д) , 6,94 (2Н, д), 7,12 (1Н, т), 7,21-7,58 (общ, 12Н), 8,17 (1Н, д), 10,33 (1Н, с), 14,60 (1Н, шир.). MC (FAB): 525 (М+ + 1). Ссылочный пример 5 Используя о-метилбензойную кислоту и 1-(4-аминобензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-он в качестве исходных материалов, повторяли процедуру ссылочного примера 3, и в результате получили 2-метил4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилид. Физикохимические свойства: 1 Н-ЯМР (d м.д. в CDCI 3, внутренний стандарт ТМС): 2,47 (3Н, с), 2,90 (2Н, м), 4,1 (2Н), 6,8 (1Н, м), 7,1-7,7 (общ, 10Н) , 7,82 (2Н). MC (EI): 398 (М+). Ссылочные примеры 6-11 Следующие ниже соединения были получены так же, как описано в ссылочном примере 5. Ссылочный пример 6 2-Изопропил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилид Ссылочный пример 7 2-Метокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилид Ссылочный пример 8 2-Этокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилид Ссылочный пример 9 2-Изопропилокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-і-бензазепин-1-ил)карбонил]бензанилид Ссылочный пример 10 2-Метил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]фенилацетоанилид Ссылочный пример 11 2-Метокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]фенилацетоанилид Ссылочный пример 12 В 17мл дихлорметана растворяли 1,67г 2'-метоксидифен-4-илкарбоновой кислоты, и к полученному раствору добавляли с охлаждением на ледяной бане 0,95мл оксалилхлорида и каталитически эффективное количество диметилформамида, после чего полученную смесь доводили до комнатной температуры. Убедившись в окончании пенообразования, концентрировали реакционный раствор под пониженным давлением и дважды подвергали его азеотропной обработке толуолом. Полученный в результате остаток растворяли в 8,4мл дихлорметана, и полученный раствор добавляли по каплям, с охлаждением на ледяной бане, к раствору, полученному растворением 1,0г 5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепина и 1,53мл триэтиламина в 10мл дихлорметана. Реакционный раствор подогревали до комнатной температуры и перемешивали еще 1 час. Полученный реакционный раствор смешивали с водой и подвергали фазовому разделению для отделения дихлорметанового слоя, который затем промывали 0,5н хлористоводородной кислотой и насыщенным водным раствором бикарбоната натрия и осушали над безводным сульфатом магния. После отгонки растворителя полученный остаток кристаллизовали из толуола, получив в результате 1,65г 1-(2-метоксидифен-4-ил-карбонил)5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепина в виде неочищенных кристаллов. Физикохимические свойства: 1 Н-ЯМР (d м.д. в СDСІ 3, внутренний стандарт ТМС): 2,17 (2Н, м), 2,93 (2Н, м), 3,75 (3Н, с), 6,7-7,7 (общ, 8Н), 7,79 (1Н, д), 7,89 (2Н), 8,2 (1Н, д). MC (EI): 371 (М+). Пример 24 После растворения 2,0г 2-метил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-бензазепин-1-ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 30мл хлороформа и 3мл этилацетата, полученный раствор смешивали с 2,47г бромида меди(II) и подвергали 3-часовому нагреву с обратным холодильником при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный при этом фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 80мл хлороформа, и полученный раствор смешивали с 2,37г ацетамидингидрохлорида и 4,86г карбоната калия и подвергали 20-часовому нагреванию с обратным холодильником в струе аргона. Полученный реакционный раствор смешивали с водой и подвергали фазовому разделению для отделения органического слоя, который затем осушали над безводным сульфатом магния. После удаления растворителя путем перегонки под пониженным давлением полученный остаток кристаллизовали из толуола, получив в результате 1,41г 2-метил-4'-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5d][1]бензазепин-6-ил)карбонил]бензанилида. Часть (1,0г) этого соединения растворяли в 10 мл этилового спирта, смешивали с 0,86мл смеси 4н хлористоводородная кислота-этилацетат и перекристаллизовывали, получив в результате 860мг 2-метил-4'-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6ил)карбонил]бензанилидгидрохлорида. Физикохимические свойства: Температура плавления >230°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,33 (3Н, с), 2,70 (3Н, с), 3,00 (2Н, т), 5,0 (1Н, м), 6,99 (2Н, д), 7,14 (1Н, т), 7,27 (1Н, т), 8,17 (1Н, д), 10,40 (1Н, с), 14,9 (1Н, шир.). MC (FAB): 437 (М+ + 1). Пример 25 Из 2,0г 2-метокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, получили, повторив процедуру примера 24, 890мг неочищенных кристаллов, из 400мг которых получили 360мг 2-метокси-4'[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]бензанилидгидрохлорида. Физикохимические свойства: Температура плавления >210°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,69 (3Н, с), 3,00 (1Н, т), 3,85 (3Н, с), 5,01 (1Н, м), 6,88 (1Н, д) , 7,36 (1Н, т), 7,48 (1Н, т)3 , 8,14 (1Н, д), 10,20 (1Н, с), 14,83 (1Н, шир.). MC (FAB): 453 (М+ + 1). Пример 26 Из 2,0г 2-этокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, получили, повторив процедуру примера 24, 927мг неочищенных кристаллов, из 500мг которых получили 465мг 2-этокси-4'[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]бензанилидгидрохлорида. Физикохимические свойства: Температура плавления >220°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,344 (3Н, т), 2,70 (3Н, с), 3,00 (1Н, т), 4,16 (3Н, кв), 5,02 (1Н, м), 6,88 (1Н, д), 7,03 (3Н, м), 7,13 (1Н, т), 7,35 (1Н, т), 7,46 (1Н, т), 7,54 (1Н, д), 8,18 (1Н, д), 10,19 (1Н, с), 14,86 (1Н, шир.). MC (FAB): 4 67 (М+ + 1). Пример 27 Порцию (410мг) брома, растворенного в 2мл хлороформа, постепенно (в течение примерно 60 минут) добавляли по каплям к 20мл хлороформного раствора, содержавшего 1,0г 2-изопропокси-4'-[(5-оксо-2,3,4,5тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида, при комнатной температуре. Убедившись в исчезновении цвета брома, промывали реакционный раствор насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 40мл хлороформа, и полученный раствор смешивали с 1,10г ацетамидингидрохлорида и 2,25г карбоната калия и подвергали 20-часовому нагреванию с обратным холодильником в струе аргона. Полученный реакционный раствор смешивали с водой и, перемешивая, отфильтровывали выпавшее в осадок твердое вещество, которое затем суспендировали в 20мл этилового спирта, смешивалис 0,58мл смеси 4н хлористоводородная кислота-этилацетат и перекристаллизовывали, получив в результате 600мг 2-изопропокси-4'-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6ил)карбонил]бензанилидгидрохлорида. Физикохимические свойства: Температура плавления >300°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,30 (6Н, д), 2,68 (3Н, с), 3,02 (1Н, т), 4,72 (1Н, кв), 5,0 (1Н, м), 6,89 (1Н, д), 7,37 (1Н, т), 7,65 (1Н, д), 8,10 (1Н, д), 10,18 (1Н, с), 14,7 (1Н, шир.). MC (FAB): 481 (М+ + 1). Пример 28 Порцию (1,32г) брома, растворенного в 6,6мл хлороформа, постепенно (в течение примерно 60 минут) добавляли по каплям к 36мл хлороформного раствора, содержавшего 3,55г 4-[(5-оксо-2,3,4,5-тетрагидро-1Н-1бензазепин-1-ил)карбонил]-2-изопропоксибензанилида, при комнатной температуре. Убедившись в исчезновении цвета брома, промывали реакционный раствор насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 40мл хлороформа, и полученный раствор смешивали с 5,0г циклопропилкарбамидингидрохлорида и 8,02г карбоната калия и подвергали 20-часовому нагреванию с обратным холодильником в струе аргона. Полученный реакционный раствор смешивали с водой для фазового разделения, и отделенный органический слой осушали над безводным сульфатом магния. После удаления растворителя путем отгонки под пониженным давлением полученный остаток кристаллизовали из толуола, получив в результате 2,96г 4'-[(2-циклопропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2изопропоксибензанилида. Часть (1.08г) этого соединения растворяли в 20мл этилового спирта, смешивали с 0,8мл смеси 4н хлористоводородная кислота-этилацетат и перекристаллизовывали, в результате чего получили 916мг 4'-[(2-циклопропил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]-2изопропоксибензанилидгидрохлорида. Физикохимические свойства: Температура плавления >210°С. 1 Н-ЯМР (d м,д, в ДМСО-d6, внутренний стандарт ТМС): примерно 1,36 (общ, 10Н), 2,98 (1Н, т), 3,46 (1Н, шир,), 4,72 (1Н, кв), 5,0 (1Н, м), 6,87 (1Н, д), 7,37 (1Н, т), 7,66 (1Н, д), 8,17 (1Н, д), 10,18 (1Н, с), 14,4 (1Н, шир.). MC (FAB): 507 (М+ + 1). Пример 29 Из 5,0г 2-фтор-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида получили, повторив процедуру примера 24, 4,76г неочищенных кристаллов, из 1,0г которых получили 1,02г 2-фтор-4'-[(2метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]бензанилидгидрохло6-рида. Физикохимические свойства: Температура плавления >270°С. 1 Н-ЯМР (d S м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,70 (3Н, с), 3,01 (1Н, т), 5,02 (1Н, м), 6,87 (1Н, д), 7,02 (2Н, м), 7,14 (1Н, т), 8,18 (1Н, д), 10,55 (1Н, с), 14,8 (1Н, шир.). MC (FAB): 440 (М+ + 1). Пример 30 К 20мл тетрагидрофуранового раствора, содержавшего 1,0г 4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1ил)карбонил]-2-изопропилбензанилида, добавляли с охлаждением на ледяной бане 793мг фенилтриметиламмонийтрибромида, и полученную смесь подогревали до комнатной температуры. Через примерно 60 минут, убедившись в исчезновении цвета брома, осуществляли фильтрование. Отфильтрованный материал промывали тетрагидрофураном, и фильтраты соединяли и концентрировали. Полученный в результате остаток растворяли в хлороформе, промывали водным раствором бикарбоната натрия и затем осушали над безводным сульфатом магния. После отгонки растворителя остаток еще упаривали досуха с использованием вакуумного насоса. Полученное в результате твердое вещество растворяли в 40мл хлороформа, и полученный раствор смешивали с 1,11г ацетамидингидрохлорида и 2,26г карбоната калия и подвергали нагреванию с обратным холодильником в струе аргона. Полученный реакционный раствор смешивали с водой для фазового разделения, и, отделив органический слой, осушали его над безводным сульфатом магния. После удаления растворителя путем отгонки под пониженным давлением полученный остаток кристаллизовали из толуола, получив в результате 640мг 2-изопропокси-4'-[(2-метил-1,4,5,6тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]бензанилида. Часть (563мг) этого соединения растворяли в 5,5мл этилового спирта, смешивали с 0,45мл смеси 4н хлористоводородная кислота-этилацетат и перекристаллизовывали, в результате чего получили 400мг 2-изопропил-4'-[(2-метил-1,4,5,6тетрагидроимидазо[4,5-d][1]-бензазепин-6-ил)карбонил]бензанилидгидрохлорида. Физикохимические свойства: Температура плавления 251-253°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 1,18 (6Н, т), 3,00 (1Н, т), 3,38 (2Н, шир,), 5,0 (ІН, м), 6,89 (1Н, д), 7,16 (1Н, т), 7,55 (2Н, д), 8,11 (1Н, д), 10,47 (1H, с), 14., (1H, шир.). MC (FAB): 465 (M+ + 1). Пример 31 Из 2,0г 2-метокси-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]фенилацетанилида получили, повторив процедуру примера 30, 1,19г неочищенных кристаллов, из 1,19г которых получили 1,25г 2метокси-4'-[(2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6ил)карбонил]фенилацетанилидгидрохлорида. Физикохимические свойства: Температура плавления >200°С. 1 H-HMP (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,68 (3Н, с), 2,98 (1Н, т), 3,60 (2Н, с), 3,73 (3Н, с), 5,0 (1Н, м), 7,12 (1Н, т), 8,10 (1Н, д), 10,26 (1Н, с), 14,7 (2Н, шир.). MC (FAB): 4 67 (М+ + 1). Пример 32 Из 2,0г 2-метил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]фенилацетанилида получили, повторив процедуру примера 30, 1,26г неочищенных кристаллов, из 1,2г которых получили 898мг 2-метил-4'-[(2метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин-6-ил)карбонил]фенилацетанилидгидрохлорида. Физикохимические свойства: Температура плавления 201-203°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,25 (3Н, с), 2,68 (3Н, с), 2,98 (1Н, т), 3,66 (2Н, с), 5,0 (1Н, м), 6,90 (1Н, д), 7,34 (1Н, т), 8,09 (1Н, д), 10,44 (1Н, с), 14,7 (2Н, шир.). MC (FAB): 451 (М+ + 1). Пример 33 Порцию (3мл) хлороформного раствора, содержавшего 300мг брома, постепенно (в течение примерно 60 минут) добавляли по каплям при комнатной температуре к 700мг 1-(2'-метоксидифенил-4-илкарбонил)-5-оксо2,3,4,5-тетрагидро-1Н-1-бензазепина, растворенного в 0,7мл хлороформа. Убедившись в исчезновении цвета брома, промывали реакционный раствор насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха, использовав вакуумный насос. Полученное в результате твердое вещество растворяли в 28мл хлороформа, и полученный раствор смешивали с 714мг ацетамидингидрохлорида и 1,46г карбоната калия и подвергали 20-часовому нагреванию с обратным холодильником в струе аргона. Полученный реакционный раствор смешивали с водой для фазового разделения, и, отделив органический слой, осушали его над безводным сульфатом магния. После отгонки растворителя полученный остаток очищали путем колоночной хроматографии на силикагеле (хлороформ:метиловый спирт = 20:1), получив, в порядке элюирования, 210мг (стекловидное твердое вещество) 6-[(2'-метокси-4-дифенилил)карбонил]-2-метил-5,6-дигидро-4Н-оксазоло[4,5d][1]бензазепина (пример 33(1)) и 390мг (стекловидное твердое вещество) 6-[(2'-метокси-4-дифенилил)карбонил]2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепина. 6-[(2'-Метокси-4-дифенилил)карбонил]-2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепин растворяли в 4,8мл этилового спирта, раствор смешивали с 0,44мл смеси 4н хлористоводородная кислота-этилацетат и охлаждали на ледяной бане для кристаллообразования, после чего образовавшиеся кристаллы отфильтровывали и промывали небольшим объемом этилового спирта, получив в результате 260мг 6-[(2'метокси-4-дифенилил)карбонил]-2-метил-1,4,5,6-тетрагидроимидазо[4,5-d]-[1]бензазепингидрохлорида (пример 33(2)). Физикохимические свойства: 6-[(2'-метокси-4-дифенилил)карбонил]-2-метил-5,6-дигидро-4Н-оксазоло[4,5-d][1]бензазепин 1 Н-ЯМР (d в CDCl3, внутренний стандарт ТМС): 2,57 (3Н, с), 3,73 (3Н, с), 5,22 (1Н, м), 6,78 (1Н, дд), 7,82 (1Н, дд). MC (EI): 410 (M+). 6-[(2'-метокси-4-дифенилил)карбонил]-2-метил-1,4,5,6-тетрагидроимидазо[4,5-d][1]бензазепингидрохлорид Температура плавления >240°С. 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,69 (3Н, с), 3,03 (1Н, т), 3,70 (3Н, с), 5,02 (1Н, м)3 , 6,9-7,4 (общ, 11Н), 8,12 (1Н, д), 14,7 (общ, 2Н). MC (EI): 409 (М+). Пример 34 Часть (1,0г) неочищенных кристаллов 2-фтор-4'-[(2-метил-1,4,5,6-тетрагидроимидазо[5,4-d][1]бензазепин-6ил)карбонил]бензанилида, полученных в примере 39, и 1,1г 2-этилимидазола растворяли в 5мл диметилсульфоксида и перемешивали 24 часа при 120°С. Реакционный раствор добавляли к воде и дважды экстрагировали хлороформом. Хлороформные слои объединяли, промывали насыщенным водным раствором хлорида натрия и затем осушали над безводным сульфатом магния. Удалив путем отгонки растворитель, полученный остаток очищали колоночной хроматографией на силикагеле с использованием растворительной системы хлороформ-метиловый спирт-28%-ный водный аммиак (10:1:0,1), и в результате получили 1,02г стекловидного твердого вещества. Это соединение растворяли в 20мл этилового спирта, смешивали с 1,42мл смеси 4н хлористоводородная кислота-этилацетат и затем концентрировали. Полученный остаток превращали в аморфный порошок, использовав изопропиловый спирт, и затем отфильтровывали, получив в результате 460мг 2-(2-этил-1Н-имидазол-1-ил)-4'-(2-метил-1,4,5,6-тетрагидроимида6-зо[4,5-d][1]бензазепин-6 ил)карбонил]бензанилида·2НСl. Физикохимические свойства: 1 Н-ЯМР (d м.д. в ДМСО-d6, внутренний стандарт ТМС): 2,70 (3Н, с), 3,01 (1Н, т), 5,02 (1Н, м), 7,12 (1Н, т), 8,24 (1Н, д), 10,93 (1Н, с)3 . MC (FAB): 517 (М+ + 1). Ссылочный пример 13 В 35мл сухого хлороформа растворяли 5,46г 3-фталимидопропионитрила, добавляли к раствору 1,76мл этанола, после чего полученную смесь барботировали 30 минут хлористоводородной кислотой с охлаждением на ледяной бане и затем перемешивали в течение 12 часов. Смешивали реакционный раствор с диэтиловым эфиром, и образовавшийся в результате этого осадок отфильтровывали и растворяли в 150мл этанола, после чего полученный раствор смешивали с 3г карбоната аммония и перемешивали при комнатной температуре в течение 24 часов. Отогнав растворитель из реакционного растнора, получили 5,5г (3-фталимидопропионамидин) 1/2 карбоната. Физикохимические свойства: MC (FAB): 218 (М+ + 1). Ссылочный пример 14 Используя 2,963г 4-фталимидобутилонитрила в качестве исходного материала, повторяли процедуру ссылочного примера 13 и в результате получили 3,162г 4-фталимидобутанамидин 1/2 карбоната. Физикохимические свойства: MC (FAB): 232 (М+ + 1). Ссылочный пример 15 Используя 4,472г 5-фталимидовалеронитрила в качестве исходного материала, повторяли процедуру ссылочного примера 13 и в результате получили 4,364г 5-фталимидопентанамидин 1/2 карбоната. Физикохимические свойства: MC (FAB): 245 (М+ + 1). Ссылочный пример 16 После растворения 3,03г 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида в смешанном растворителе, состоявшим из 120мл хлороформа и 15мл этилацетата, полученный раствор смешивали с 2,95г бромида меди (II) и подвергали нагреванию с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха с использованием вакуумного насоса. Порцию (500мг) полученного при этом пенообразного вещества растворяли в 150мл хлороформа, и полученный раствор смешивали с 900мг карбоната калия и 1,3г 3-фталимидопропионамидин 1/2 карбоната, полученного в ссылочном примере 13, и подвергали 16-часовому нагреванию с обратным холодильником. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы. Полученный фильтрат смешивали с насыщенным водным раствором бикарбоната натрия. Полученный органический слой промывали водой и насыщенным раствором хлорида натрия и осушали над безводным сульфатом магния. После отгонки под пониженным давлением растворителя полученый остаток подвергали колоночной хроматографии на силикагеле, в результате чего получали 221мг 4'-[(2-(2-фталимидоэтил)-1,4,5,6-тетрагидроимидазо[4,5d][1]бензазепин-6-ил]карбонил]-2-фенилбензанилида из элюата хлороформметиловый спирт (50:1). Физикохимические свойства: MC (FAB): 658 (М+ + 1). Ссылочный пример 17 После растворения 3,03г 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 120мл хлороформа и 15мл этилацетата, полученный раствор смешивали с 2,95г бромида меди и подвергали нагреванию с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха с использованием вакуумного насоса. Использовав 500мг полученного при этом пенообразного вещества и 1,758г 4-фталимидобутанамидин 1/2 карбоната, полученного в ссылочном примере 14, в качестве исходных материалов, повторяли процедуру, такую же, как в ссылочном примере 16, ив результате получили 389мг 4'-[(2-(3-фталимидопропил)-1,4,5,6-тетрагидроимидазо[4,5d][1]бензазепин-6-ил]карбонил]-2-фенилбензанилида. Физикохимические свойства: MC (FAB): 672 (М+ + 1). Ссылочный пример 18 После растворения 3,03г 2-фенил-4'-[(5-оксо-2,3,4,5-тетрагидро-1Н-1-бензазепин-1-ил)карбонил]бензанилида в смешанном растворителе, состоявшем из 120мл хлороформа и 15мл этилацетата, полученный раствор смешивали с 2,95г бромида меди и подвергали нагреванию с обратным холодильником в течение 3 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы. Полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досухас использованием вакуумного насоса. Использовав 500мг полученного при этом пенообразного вещества и 1,424г 5-фталимидопентанамидин 1/2 карбоната, полученного в ссылочном примере 15, в качестве исходных материалов, повторяли процедуру, такую же, как в ссылочном примере 16, и в результате получили 316мг 4'-[(2-(4-фталимидобутил)-1,4,5,6-тетрагидроимидазо[4,5d][1]бензазепин-6-ил]карбонил]-2-фенилбензанилида. Физикохимические свойства: MC (FAB): 686 (М+ + 1). Ссылочный пример 19 В струе аргона растворяли 10мл тетрагидрофурана 60% гидрид натрия, и полученный раствор смешивали с 2,0г бензилцианида, перемешивали 1 час при комнатной температуре, еще смешивали с 3,69г 1,4-дибромбутана и опять перемешивали 16 часов при комнатной температуре. Реакционную смесь смешивали с водой и этилацетатом, отделяли образовавшийся при этом органический слой, промывали его насыщенным водным раствором хлорида натрия и затем осушали над безводным сульфатом магния. После удаления растворителя путем отгонки под пониженным давлением полученный в результате остаток подвергали колоночной хроматографии на силикагеле, и полученный гексановый элюат смешивали с 45мл серной кислоты и в течение 24 часов нагревали с обратным холодильником. Охладив реакционный раствор до комнатной температуры, смешивали его с ледяной водой и этилацетатом для отделения водного слоя, который затем смешивали с концентрированной хлористоводородной кислотой и этилацетатом, и полученный органический слой отделяли, промывали водой и насыщенным водным раствором хлорида натрия и затем осушали над безводным сульфатом магния. Удалив растворитель путем отгонки под пониженным давлением, получили 978мг 1фенилциклопентанкарбоновой кислоты. Физикохимические свойства: 1 Н-ЯМР (d м. д. в СDСI 3, внутренний стандарт ТМС): 1,84-2,08 (8Н, м), 7,21-7,45 (4Н,м). MC (EI): 190 (М+). Ссылочный пример 20 Использовав 2,0г бензилцианида и 3,9г 1,5-дибромпентана, повторяли процедуру ссылочного примера 19 и в результате получили 980мг 1-фенилциклогексанкарбоновой кислоты. Физикохимические свойства: 1 Н-ЯМР (d м.д. в СDСІ 3, внутренний стандарт ТМС): 1,26-1,87 (10Н, м), 7,22-7,52 (4Н, м). MC (EI): 204 (М+). Ссылочный пример 21 В 20мл дихлорметана смешивали 978мг 1-фенилциклопентанкарбоновой кислоты, полученной в ссылочном примере 19, с 0,7мл оказилхлорида и перемешивали в течение 1 часа на ледяной бане. После отгонки растворителя полученный остаток растворяли в 10мл дихлорметана и добавляли к 20мл дихлорметанового раствора, содержавшего 1,24г 1-(4-аминобензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она и 0,72мл триэтиламина, и смесь перемешивали 3 часа при комнатной температуре. Полученный реакционный раствор смешивали с насыщенным водным раствором карбоната натрия для отделения органического слоя, который затем промывали водой и насыщенным водным раствором хлорида натрия и осушали над безводным сульфатом магния. Удалив растворитель путем отгонки под пониженным давлением, полученный остаток подвергали колоночной хроматографии на силикагеле, и в результате получали 759мг 1-[4-(1-фенилциклопентан1-ил)аминобензоил]-5-оксо-2,3,4,5-1Н-1-бензазепина из элюата хлороформ-метиловый спирт (50:1). Физикохимические свойства: MC (FAB): 453 (М+ + 1). Ссылочный пример 22 Использовав 980мг 1-фенилциклогексанкарбоновой кислоты и 1,2г 1-(4-аминобензоил)-2,3,4,5-тетрагидро1Н-1-бензазепин-5-она в качестве исходных материалов, повторяли процедуру ссылочного примера 21, ив результате получали 1,453г 1-[4-(1-фенилциклогексан-1-ил)аминобензоил]-5-оксо-2,3,4,5-1Н-1-бензазепина. Физикохимические свойства: MC (FAB): 467 (М+ + 1). Ссылочный пример 23 После растворения 2,966г 1-(4-нитробензоил)-2,3,4,5-тетрагидро-1Н-1-бензазепин-5-она в смешанном растворителе, состоявшем из 925мл хлороформа и 9,2мл этилацетата, полученный раствор смешивали с 5,34г бромида меди и подвергали нагреванию с обратным холодильником в течение 2 часов при интенсивном перемешивании. Охладив реакционный раствор до комнатной температуры, отфильтровывали нерастворимые материалы, и полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия. Полученный органический слой осушали над безводным сульфатом магния, концентрировали под пониженным давлением и затем упаривали досуха с использованием вакуумного насоса. Полученное при этом твердое вещество растворяли в 250мл хлороформа, и полученный раствор смешивали с 10,5г карбоната калия и 5,12г ацетамидингидрохлорида и подвергали 20-часовому нагреванию с обратным холодильником. Охладив реакционный раствор до комнатной температуры, удаляли путем фильтрования нерастворимые материалы, и полученный фильтрат промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия и осушали над безводным сульфатом магния. После отгонки под пониженным давлением растворителя полученный остаток подвергали колоночной хроматографии на силикагеле, в результате чего получали 2,077г 6-(4-нитробензоил)-2-метил-1,4,5,6-тетрагидроимидазо[4,5d][1]бензазепина из элюата хлороформ-метиловый спирт (30:1). Физикохимические свойства: MC (FAB): 349 (М+ + 1). Ссылочный пример 24 В струе аргона суспендировали 144мг 60%-ного гидрида натрия в небольшом объеме N,Nдиметилформамида, и к полученной суспензии добавляли затем по каплям (при охлаждении на ледяной бане) раствор, полученный путем растворения 500мг 6-(4-нитробензоил)-2-метил-1,4,5,6-тетрагидроимидазо-[4,5d][1]бензазепина в 20мл N,N-диметилформамида. После 1 часа перемешивания при комнатной температуре реакционный раствор смешивали с 0,11мл метилиодида и перемешивали 24 часа при комнатной температуре. Смешивали реакционный раствор с водой и хлороформом, и полученный органический слой отделяли, промывали насыщенным водным раствором хлорида натрия и затем осушали над безводным сульфатом магния.
ДивитисяДодаткова інформація
Назва патенту англійськоюA condensed benzadepine derivative, an intermediate compound for preparing thereof and a pharmaceutical composition
Назва патенту російськоюКонденсированное производное бензазепина, промежуточное соединение для его получения и фармацевтическая композиция
МПК / Мітки
МПК: C07D 498/04, C07D 513/04, C07D 487/04, A61K 31/55
Мітки: фармацевтична, проміжна, конденсована, композиція, похідна, одержання, бензазепіну, сполука
Код посилання
<a href="https://ua.patents.su/50-64690-kondensovana-pokhidna-benzazepinu-promizhna-spoluka-dlya-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Конденсована похідна бензазепіну, проміжна сполука для її одержання та фармацевтична композиція</a>
Попередній патент: Спосіб отримання трансгенних рослин, що мають модифікований характер розподілення фруктанів
Наступний патент: Пристрій сигналізації про місцезнаходження об”єкта
Випадковий патент: Спосіб створення допоміжного пілот-сигналу, спосіб його прийому і пристрій для його здійснення та спосіб індивідуальної передачі