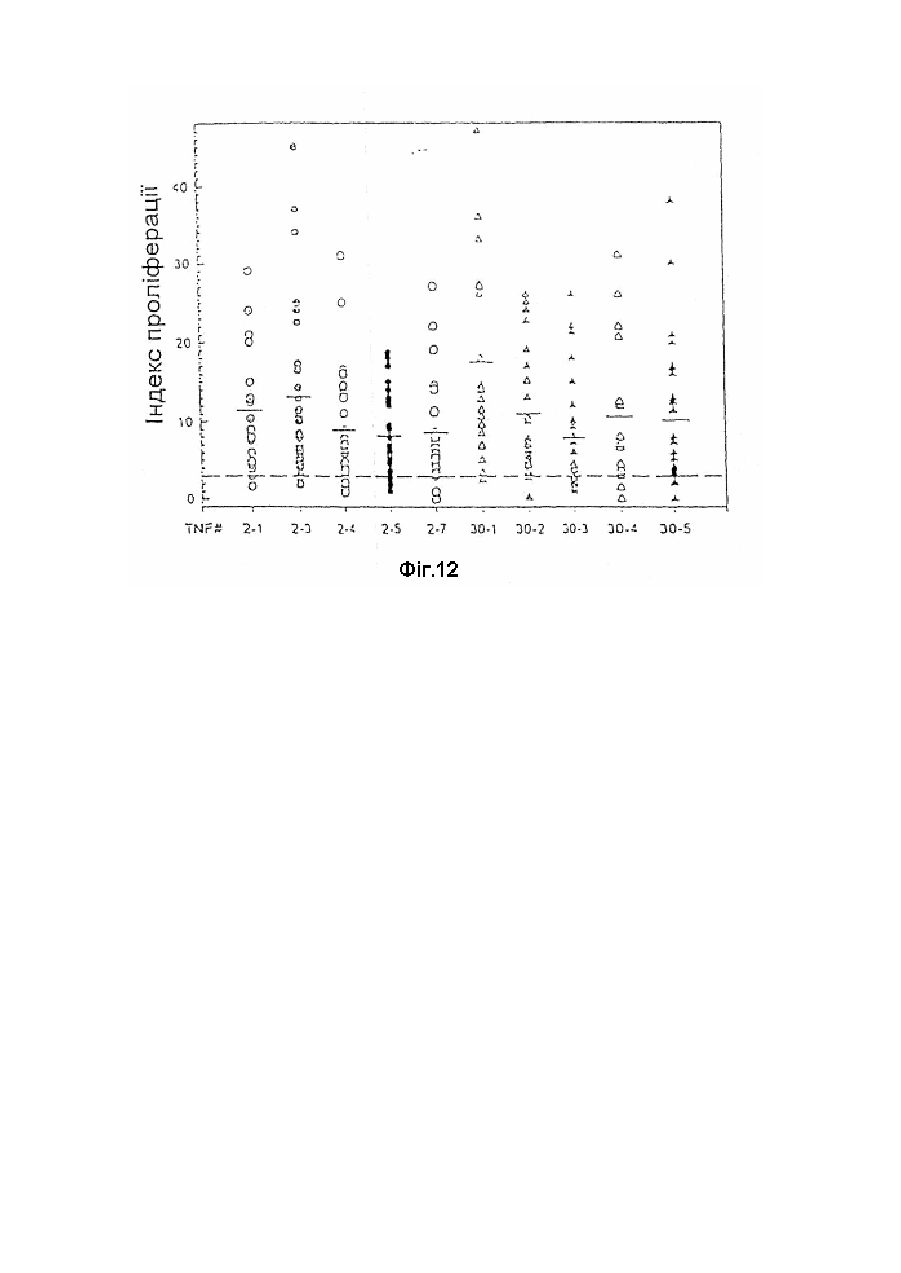
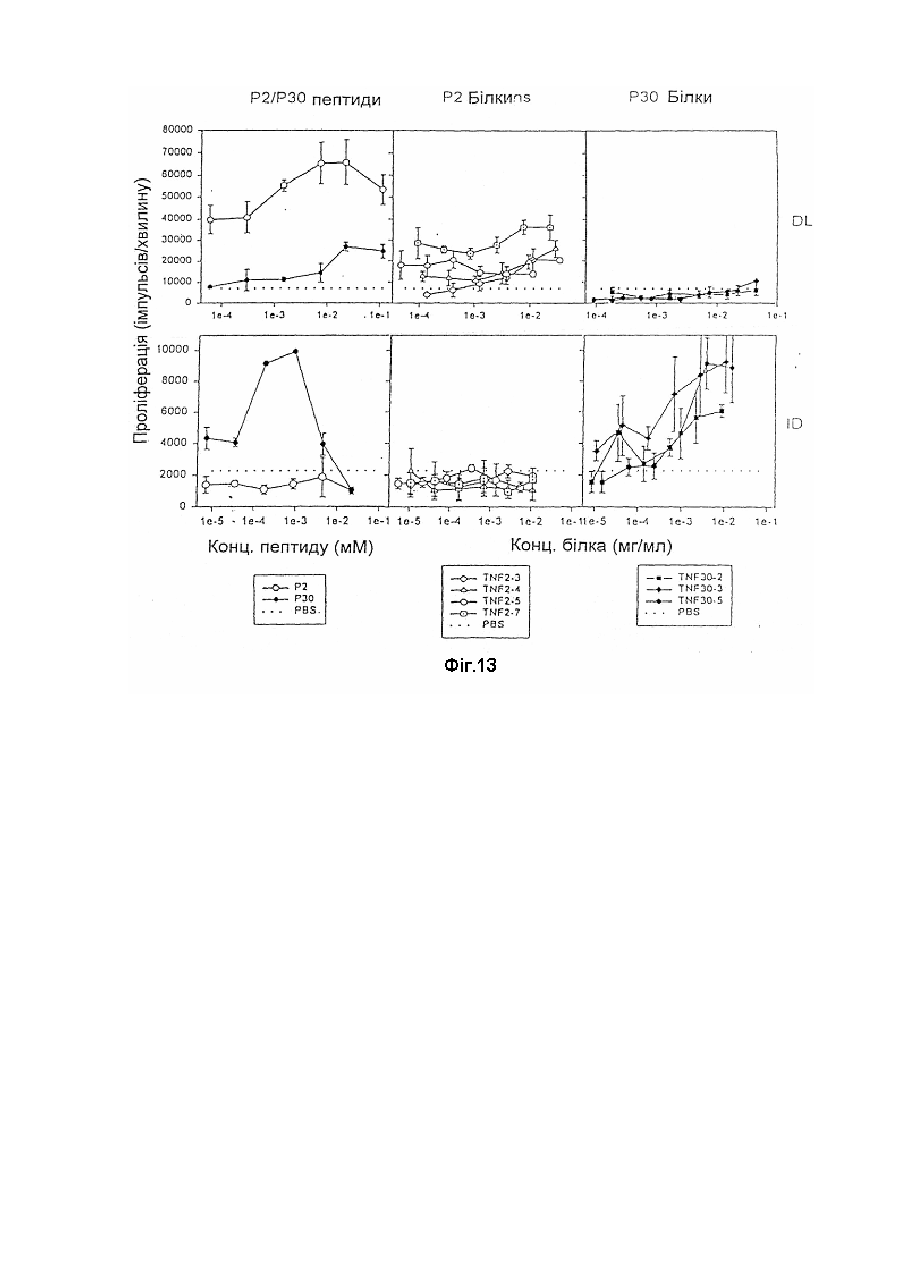
Модифікована молекула tnf-a
Номер патенту: 72440
Опубліковано: 15.03.2005
Автори: Йєнсен Мартін Роланд, Елснер Генрік, Далум Ібен, Моурітсен Сьорен
Формула / Реферат
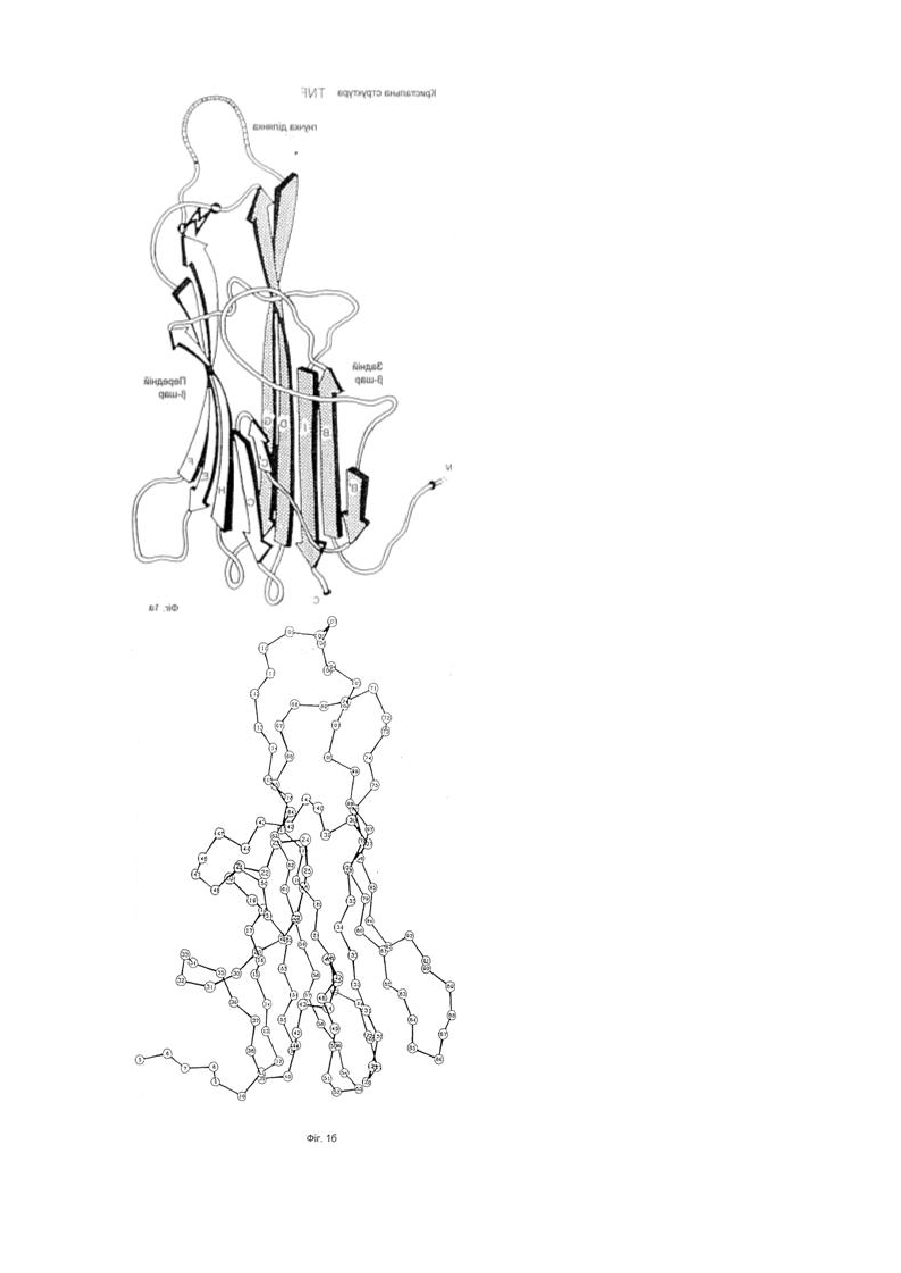
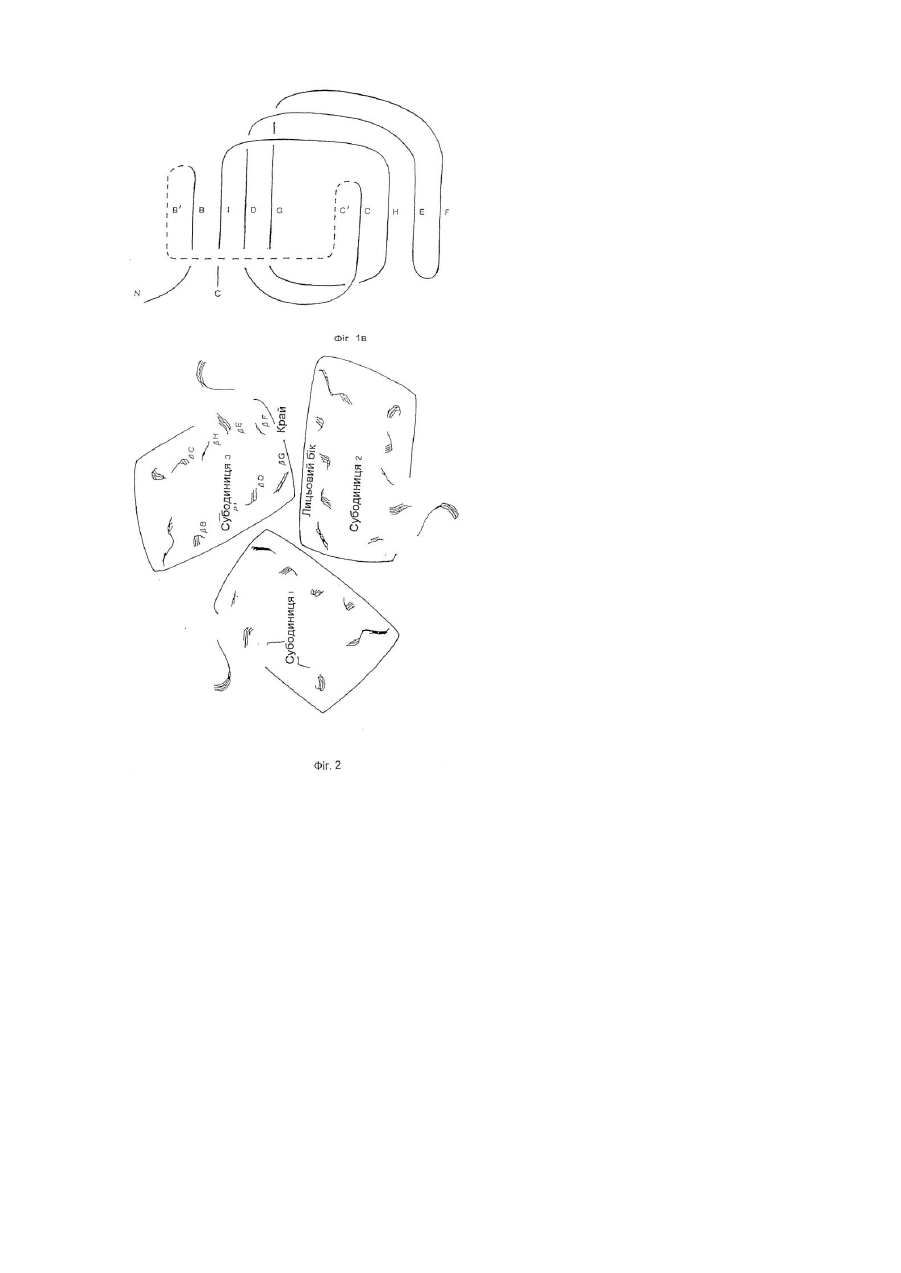
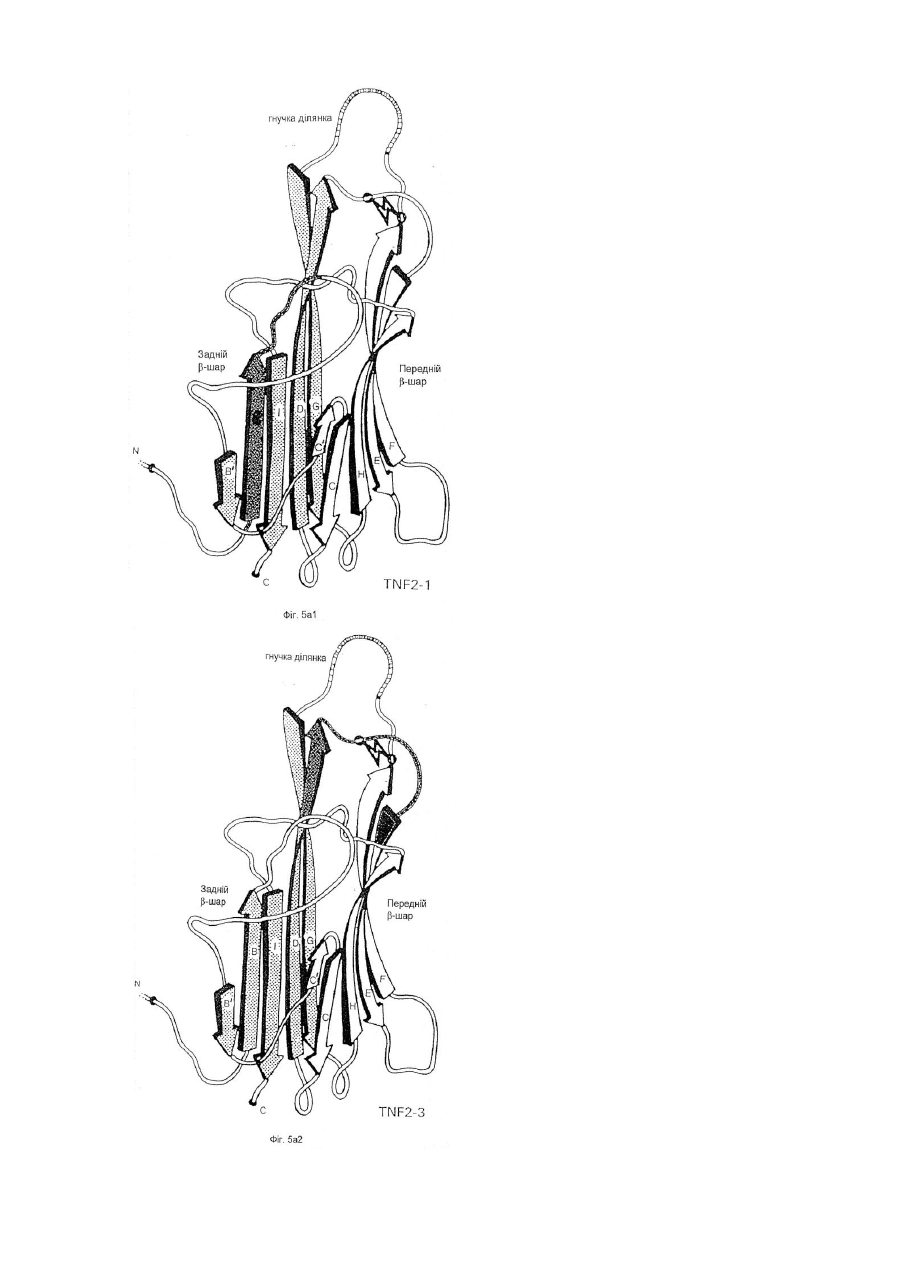
1. Модифікована молекула TNF-α людини, здатна викликати утворення нейтралізуючих антитіл до людського TNF-α дикого типу після введення в клітину-хазяїн людини зазначеної модифікованої молекули TNF-α, яка відрізняється тим, що принаймні один сегмент молекули TNF-α людини заміщений принаймні одним пептидом, що містить імунодомінантний Т-клітинний епітоп або скорочену форму вищезгаданої молекули, яка містить імунодомінантний Т-клітинний епітоп і одну або обидві бокові ділянки молекули TNF-α людини, що містить принаймні один TNF-α В-клітинний епітоп, де заміщення введено у будь-якому з ланцюгів передньої β-складки, у будь-якій зі зв'язуючих петель та/або у будь-якому з В', І або D ланцюгів задньої β-складки, причому заміщення виконано в областях молекули TNF-α зі збереженням структури β-складки В та G ланцюгів, причому при вказаному заміщенні має місце інактивація біологічної активності TNF-α людини при тестуванні в біотесті L929.
2. Модифікована молекула TNF-α людини за п. 1, яка відрізняється тим, що заміщення не включає будь-який повний ланцюг задньої β-складки.
3. Модифікована молекула TNF-α людини за п. 1 або п. 2, яка відрізняється тим, що заміщення включає принаймні сегмент Н ланцюга передньої β-складки і зв’язуючої петлі до І ланцюга задньої β-складки, сегменти Н і І ланцюгів та повної зв’язуючої петлі, сегмент D ланцюга задньої β-складки та принаймні сегмент Е ланцюга передньої β-складки та повної зв’язуючої петлі, повні С′ і С ланцюги передньої β-складки та сегмент D ланцюга задньої β-складки, або принаймні сегмент Е ланцюга передньої β-складки та одної або двох зв’язуючих петель.
4. Модифікована молекула TNF-α людини за пп. 1-3, яка відрізняється тим, що заміщення виконано в областях молекули TNF-α, які включають ланцюги передньої β-складки та/або зв’язуючі петлі так, щоб значною мірою зберегти структуру β-складки будь-якого з ланцюгів задньої β-складки.
5. Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення виконано в областях молекули TNF-α, які включають сегмент D ланцюга задньої β-складки.
6. Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення включає принаймні сегмент Н ланцюга передньої β-складки і зв'язуючої петлі до І ланцюга, краще амінокислоти 132-146.
7. Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення включає сегменти Η і І ланцюгів та повної зв'язуючої петлі, краще амінокислоти 132-152.
8.Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення включає сегмент D ланцюга, принаймні сегмент Е ланцюга і повної зв'язуючої петлі, краще амінокислот 65-79 або 64-84.
9. Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення включає цілі С′ і С ланцюги та сегмент D ланцюга, краще амінокислоти 40-60.
10. Модифікована молекула TNF-α людини за п. 3, яка відрізняється тим, що заміщення включає принаймні сегмент Е ланцюга передньої β-cкладки одного або обох зв'язуючих петель, краще амінокислот 76-90.
11. Модифікована молекула TNF-α людини за будь-яким з попередніх пунктів, яка відрізняється тим, що нейтралізуючі антитіла, утворені проти зазначеної модифікованої молекули TNF-α у придатній клітині-хазяїні, здатні значно інгібувати активність нативного TNF-α в біотесті L929, і/або вищезгадані антитіла значно інгібують зв'язування людського TNF-α дикого типу з 55 кДа рецептором 1 TNF-α (TNF-α - R55) або з 75 кДа рецептором TNF-α (TNF-α - R75).
12. Модифікована молекула TNF-α людини за будь-яким з пп. 1-11, яка відрізняється тим, що інсерційований Т-клітинний епітоп є різнорідним та імуногенним у більшості типів HLA класу ІІ людини.
13. Модифікована молекула TNF-α людини за п. 12, яка відрізняється тим, що епітоп походить з Tetanus toxoid, краще епітоп Р2 та/або Р30.
14. Модифікована молекула TNF-α людини за п. 13, яка відрізняється тим, що має амінокислотну послідовність, показану на SEQ ID NO: 8 .
15. Модифікована молекула TNF-α людини за п. 13, яка відрізняється тим, що має амінокислотну послідовність, показану на SEQ ID NO:10.
16. Модифікована молекула TNF-α людини за п. 13, яка відрізняється тим, що має амінокислотну послідовність, показану на SEQ ID NO: 4 або SEQ ID NO:16.
17. Модифікована молекула TNF-α людини за п. 13, яка відрізняється тим, що має амінокислотну послідовність, показану на SEQ ID NO:20.
18. Модифікована молекула TNF-α людини за п. 13, яка відрізняється тим, що має амінокислотну послідовність, показану на SEQ ID NO:14.
19. Модифікована молекула TNF-α людини за будь-яким з пп. 1-18, яка відрізняється тим, що представлена у формі злитого білка з молекулою ад’юванту.
20. Модифікована молекула TNF-α людини за п. 19, яка відрізняється тим, що молекула ад’юванту являє собою імунологічно активний ад’ювант.
21. Модифікована молекула TNF-α людини за п. 19, яка відрізняється тим, що молекула ад'юванту являє собою GM-CSF, HSP70 або інтерлейкін.
22. Димери, олігомери або мультимери модифікованої молекули TNF-α людини за будь-яким з пп. 1-18.
23. Виділена молекула ДНК, яка відрізняється тим, що кодує модифіковану молекулу TNF-α людини за будь-яким з пп. 1-18.
24. Вектор, що включає виділену молекулу ДНК за п. 23.
25. Вектор експресії, який включає виділену молекулу ДНК за п. 23, що функціонально з'єднана з послідовністю контролю за експресією.
26. Клітина-хазяїн, яка трансформована вектором експресії за п. 25.
27. Клітина-хазяїн за п. 26, яка відрізняється тим, що вона вибрана зі штамів бактерій, дріжджів або інших грибів та ліній клітин комах, ссавців або птахів.
28. Спосіб одержання модифікованої молекули TNF-α людини за будь-яким з пп. 1-18, який включає вирощування клітини-хазяїна за п. 26 або 27 за придатних умов, що дозволяє продукувати модифіковану TNF-α, і виділення одержаної таким чином модифікованої TNF-α.
29. Вакцина проти TNF-α, що містить одну або більше модифікованих молекул TNF-α людини за будь-яким з пп.1-18 і, необов’язково, фармацевтично прийнятний ад'ювант.
30. Вакцина за п. 29, яка відрізняється тим, що фармацевтично прийнятний ад’ювант являє собою фосфат алюмінію, гідроксид алюмінію, фосфат кальцію, дипептид мураміл або iscom.
31. Вакцина за п. 29 або 30, для запобігання або лікування хвороб, спричинених вивільненням TNF-α або його активності, таких як хронічні запальні хвороби.
32. Вакцина за п. 31, яка відрізняється тим, що хронічні запальні хвороби являють собою ревматоїдний артрит і запалення кишок.
33. Вакцина за п. 32, яка відрізняється тим, що запалення кишок являє собою хворобу Крона і виразковий коліт.
34. Вакцина проти TNF-α, що містить виділену ДНК, яка кодує модифіковану молекулу TNF-α людини за будь-яким з пп. 1-18, інсерційовану у придатний вектор експресії.
35. Вакцина за п. 34, яка відрізняється тим, що містить конструкцію, яка включає неінфекційну послідовність ДНК, що не інтегрується, яка кодує модифіковану молекулу TNF-α за будь-яким з пп. 1-18, функціонально з'єднану з послідовністю промотору, яка може контролювати експресію зазначеної послідовності ДНК у людини, в кількості, достатній для того, щоб відбувся перенос вищезгаданої конструкції і відбулася достатня експресія для викликання відповіді нейтралізуючих антитіл проти TNF-α.
36. Вакцина за п. 33 або п. 34, яка відрізняється тим, що містить вірусний вектор експресії.
37. Вакцина за п. 36, яка відрізняється тим, що вірусний вектор експресії являє собою ретровірусний вектор експресії.
38. Вакцина за будь-яким з пп. 29-37, яка відрізняється тим, що призначена для перорального або парентерального введення.
39. Вакцина за п. 38, яка відрізняється тим, що призначена для підшкірного, внутрішньом’язового або внутрішньошкірного введення.
40. Застосування принаймні однієї модифікованої молекули TNF-α за будь-яким з пп. 1-18, необов’язково в комбінації з придатною молекулою ад’юванту або носія, для приготування лікарського засобу для лікування або запобігання хронічних запальних хвороб, раку, кахексії, розсіяного склерозу, діабету, псоріазу, остеопорозу або астми.
Текст
Цей винахід стосується молекул цитокіну людини - фактора некрозу пухлини TNFa (Tumor Necrosis Factor - TNFa), які були модифіковані таким чином, що вони набули здатності викликати нейтралізуючі антитіла до людських TNFa дикого типу після введення модифікованої молекули TNFa людині. Винахід також стосується вакцин TNFa людини, що містять вищезгадані модифіковані молекули TNFa. Інші аспекти винаходу стануть зрозумілими з опису, що наведений нижче. З точки зору фізіології імунна система хребетних функціонує як механізм захисту від інфікування організму об'єктами інфекції, такими як мікроорганізми. Чужорідні білки ефективно видаляються через ретикулоендотеліальну систему циркулюючими антитілами високої специфічності; віруси й бактерії атакуються складним комплексом клітинних і гуморальних механізмів, зокрема, антитілами, цитотоксичними Тлімфоцитами (ЦТЛ), натуральними клітинами-кіллерами (НК), комплементом тощо. Головну роль в цьому процесі відіграють лімфоцити Т-хелпери (Тх), які разом з антигенвмісними клітинами (АВК) регулюють імунний захист через складну мережу цитокінів. Τх-лімфоцити розпізнають білкові антигени, що знаходяться на поверхні АВК. Проте, самі вони не розпізнають природний антиген. Натомість, вони розпізнають складний ліганд, що складається з двох компонентів, білкового антигену (так званого Т-клітинного епітопа), "що прореагував" (фрагментований), і молекули головного комплексу гістосумісності (ГКГ) класу II [О.Werdelin et. al., Imm. Rev.106, 181 (1988)]. Розпізнавання кінець кінцем надає можливість Тх-лімфоциту специфічно допомагати Влімфоцитам утворювати специфічні антитіла до інтактного білкового антигену (Werdelin et. al., згаданий вище). Згадані Т-клітини лише розпізнають певну комбінацію антигену-ГКГ і не розпізнають такий самий або інший антиген, який є продуктом гена іншої алелі ГКГ. Цей феномен має назву обмеження ГКГ. Фрагменти власних білків також знаходяться на АВК, але за звичайних умов такі фрагменти ігноруються або не розпізнаються Тх-лімфоцитами. Це є головною причиною того, що окремі особи, як правило, не містять аутоантитіл в своїй сироватці, що в кінцевому рахунку призвело б до атакування власних білків (що мають назву власні або аутобілки). Проте, у рідких випадках цей процес порушується та імунна система спрямовує свою дію на власні компоненти, що може призвести до аутоімунного захворювання. Присутність деяких власних білків є недоцільною у випадках, де вони в більшій кількості викликають симптоми хвороби. Таким чином відомо, що фактор некрозу пухлини (TNFa) здатний викликати кахексію у пацієнтів з діагнозом "рак" і пацієнтів, що страждають на інші хронічні хвороби [H.N.Lang-stein et. al., Cancer Res. 51, 2302-2306, 1991]. TNFa також відіграє важливу роль в процесі запалення [W.P.Arend et. al., Arthritis Rheum. 33. 305-315, 1990]. і нейтралізація TNFa з використанням моноклональних антитіл, таким чином, виявилася корисною для пацієнтів з хронічними запальними хворобами, такими як ревматоїдний артрит, Elliott et. al., Lancet 1994, 344: 1105-10, і хвороба Крона, van Dullemen et. al.,, Gastroenterology 109(1): 129-135(1995). Таким чином, існує потреба у способі викликання нейтралізуючих антитіл проти таких білків TNFa і цей винахід пропонує вакцину проти TNFa, яка надає цю властивість. ФАКТОР НЕКРОЗУ ПУ ХЛИНИ 1. Загальний опис Фактор некрозу пухлини (TNF) є одним із сімейства регуляторних білків - цитокінів [див. Walsh, G. and Headon, D.F., Protein Biotechnology, 1994, John Willey & Sons Ltd. England, стор.257-267], до яких також належать інтерферони й інтерлейкіни. Зараз відомі дві форми TNF: TNFa і TNFb, відповідно. Хоча обидва білки зв'язуються з однаковими рецепторами й викликають, головним чином, однакові біологічні реакціївідповіді, вони є різними молекулами і мають менш, ніж 30% гомологію. Вихідний білок, що має назву "фактор некрозу пухлини" або TNF, який ще називають TNFa, також має назву кахектин. TNFb має також назву лімфотоксин. TNFa утворюється різними клітинами, головним чином активованими макрофагами, моноцитами, певними Т-лімфоцитами й клітинами НК, окрім клітин печінки й мозку. Найбільш відомим потужним індуктором синтезу TNFa є складна біомолекула, що має назву ліпополісахарид (ЛПС). Вона містить ліпідний та полісахаридний компоненти і також має назву ендотоксин. Сам ліпополісахарид не має будь-якої протипухлинної активності. Сироватка тварин, яким вводили ліпополісахарид, містить фактор, токсичний щодо ракових клітин, і цей фактор, що утворюється специфічними клітинами у відповідь на ліпополісахарид, отримав назву - фактор некрозу пухлини. Різні інші агенти, такі як деякі віруси, гриби й паразити, також стимулюють синтез і вивільнення цих цитокінів. Крім того, TNFa може діяти в аутокринний спосіб, стимулюючи своє власне утворення. Природній TNF людини - це гомотример, що складається з трьох ідентичних поліпептидних субодиниць, щільно з'єднаних навколо потрійної осі симетрії, як буде пояснено нижче. Це розташування нагадує збирання білкових субодиниць багатьох вірусни х білків капсиду. Окремі поліпептидні субодиниці TNFa людини неглікозильовані й складаються з 157 амінокислот. Молекула має молекулярну масу 17300Дт і містить одиничний внутрішньоланцюговий дисульфідний зв'язок. TNFa людини синтезується спочатку як 233амінокислотна молекула-попередник. Протеолітичне розщеплення від -76 до -1 попередньої послідовності, включаючи сигнальну послідовність, вивільнює природний TNFa. TNFa може також існувати у 26000Дт мембрано-зв'язаній формі. Три мономерні субодиниці TNFa збираються нековалентно з утворенням тримеру, як пояснено нижче. TNFa чинить свій біологічний вплив, зв'язуючись зі специфічним рецептором, що присутній на поверхні чутливи х клітин. Було ідентифіковано два різні рецептори TNFa. Один рецептор (TNF-R55) має молекулярну масу 55000Дт, тоді як другий рецептор (TNF-R75) має молекулярну масу приблизно 75000Дт. Ці два різні типи рецепторів виявляють не більш, ніж 25% гомологію послідовності. TNF-R55 присутній на різних клітинах, тоді як поширення рецептора TNF-R75 більш обмежене. Обидва є трансмембранними глікобілками із зовнішньоклітинним зв'язуючим доменом, гідрофобним трансмембранним доменом і внутрішньоклітинним ефекторним доменом. Точні молекулярні механізми, за допомогою яких TNFa чинить свій біологічний вплив, залишаються не визначеними. Зв'язування TNFa з його рецептором викликає низку подій, що опосередковуються G-білками, окрім активації аденілатциклази, фосфорилази А і протеїнкіназ. Точний біологічний вплив, викликаний TNFa, може залежати від типу клітини. Інші фактори, такі як присутність цитокінів, ще сильніше модулюють молекулярний вплив, притаманний впливу TNFa на чутливі клітини. Ген TNFa був клонований і вставлений у різні рекомбінантні експресійні системи, як бактеріальні, так і еукаріотичні. Одержана велика кількість очищеного, біологічно активного TNFa допомогла в клінічній практиці при визначенні багатьох хвороб, головним чином раку. У багатьох таких випадках використання TNFa, одного або разом з інтерферонами, дало, на жаль, дуже невтішні результати. Велику кількість TNFa не можна вводити пацієнтам завдяки його токсичному, якщо не летальному побічному впливу. Як було згадано вище, тривале утворення необґрунтовано підвищеної кількості TNFa також було виявлено при розвитку кахексії, що є виснажливим синдромом, часто пов'язаним із хронічними паразитними або іншими інфекціями і раком. TNFa також пов'язаний з метастазуванням і ростом певних пухлин та викликанням анемій. Крім того, TNFa також безпосередньо пов'язаний з розвитком певних хронічних запальних розладів людини, включаючи ревматоїдний артрит і хворобу Крона, при яких введення моноклональних антитіл до TNFa виявилися корисним. TNFa також пов'язаний з остеопорозом і псоріазом. Крім того, на тваринних моделях було показано, що введення антитіл до TNFa може зменшити або запобігти відторгненню пересаджених або трансплантованих тканин. 2. Структура TNFa 1. Вступ Була розшифрована тривимірна структура фактора некрозу пухлини людини (TNFa) (див. "Tumor Necrosis Factors, Structure, Function and Mechanism of Action"» редактор: Bharat B. Aggarwal і Jan Vilcek, 1992 Marcel Dekker, Ind., New York, Chapter 5 "Crystal Structure of TNFa", Jones, F.Y. Stuart, D.I. and Walker N.P.C.). Біологічна дія TNFa залежить від взаємодії з його рецептором. Ці взаємодії обумовлюються точним розташуванням правильно складеної третинної структури. Таким чином, для того, щоб зрозуміти як молекула TNFa виконує свою біологічну функцію на рівні амінокислотних взаємодій, потрібно не лише знати послідовність амінокислот, але й також тривимірну стр уктуру. II. Тривимірна структура За допомогою аналітичного ультрацентрифугування, розсіювання рентгенівських променів під малим кутом і гель-електрофорезу було виявлено, що біологічно активний TNFa у розчині має тримерну конформацію, і дослідження з використанням поперечних зшивань показало, що це є активна форма білка (Smith and Baglioni, 1987, J.Biol. Chemistry 252, 6951-6954). Дослідження зв'язування з рецептором показало, що тример мав принаймні у 8 разів більшу активність, ніж мономер. Експериментальний доказ показав, що як природній, так і рекомбінантний TNFa існують переважно як тримери за фізіологічних умов. Аналіз спектрів кругового дихроїзму дав підставу віднести TNFa до класу білків з наявністю різноманітних складчастих структур (Davis et. al., Biochemistry 1987, 26, 1322-1326, який повідомив про результати аналізів структури очищеного рекомбінантного TNFa, зроблених за допомогою титрування сульфгідрильних груп, гельфільтрації та кругового ди хроїзму). Були одержані кілька різних кристалічних форм рекомбінантного TNFa людини. Всі одержані кристалічні форми виявляють кристалографічну і/або не кристалографічну потрійну вісь симетрії, що свідчить про присутність TNFa в кристалі як тримеру. Тримери TNFa з'єднані в тісну структур у, яку пронизують 100´10-10м канали, що зазвичай заповнені середовищем, в якому знаходиться молекула. Лише мала частина поверхні молекули бере участь в утворенні міжсубодиничних контактів. Такі контакти могли б у деякій мірі впливати на кілька бокових ланцюгів і, можливо, навіть на короткі частини гнучкого головного ланцюга, що змінювало б їх переважну конформацію в розчині. А. Складання мономера головного ланцюга TNFa Загальна форма одиничної 157-амінокислотної субодиниці тримеру TNFa нагадує клин висотою приблизно 55´10-10м і максимальною шириною 35´10-10м біля основи. Топологія головного ланцюга наведена на Фіг.1а-в; це переважно β-складчаста структура, утворена двома антипаралельними β-складчастими білка вірусного капсиду). Термінологія, прийнята на Фіг.1 для позначення вторинних структурних одиниць, така сама, як встановлена правилами для вірусних структур. Присутні всі стандартні вісім β-ланцюгів (В-І), але зі вставкою між В і С, що додає короткий ланцюг до краю обох β-складок і скорочує наполовину N-кінець стосовно С-кінця так, що кожний β-складчастий шар містить п'ять антипаралельних β-ланцюгів, задня βскладка містить β-ланцюги В', В, І, D і G і передній шар містить β-ланцюги С, С, Η, Ε і F. N-кінець є надзвичайно гнучким. Ця ділянка, так само, як і залишок 10 (див. Фіг.16), є досить незалежною від решти молекули з першими кількома вільними залишками для утворення різних конформацій у розчиннику. Для порівняння, С-кінець занурений в основу задньої β-складки й утворює суцільну частину цієї відносно плоскої вторинної структурної одиниці. Поступовий перехід β-ланцюгів один в одній та вставка між β-ланцюгами В і С утворюють передню поверхню, створену майже цілком з петель: це й є "маскований" бік β-складчастих шарів, які в стр уктурі тримеру знаходяться в розчиннику. Дані кристалографії показали ступінь відносної гнучкості різноманітних частин стр уктури, β-ланцюги утворюють доволі пружну структур у; зокрема, задня β-складка розташована в середині тримеру й, отже, є надзвичайно жорстким. Як можна було б очікувати, саме петлі знаходяться на зовнішній до розчинника поверхні молекули й виявляють високий рівень гнучкості/рухомості. Взагалі, існує загальне зменшення жорсткості, оскільки середина становиться більш вільно упакованою у верхній половині молекули. Б. Загальна топологія тримеру TNFa Три мономерні субодиниці TNFa збираються нековалентно з утворенням компактного конічного тримеру, який має довжину приблизно 55´10-10м і максимальну ширину 50´10-10м. β-ланцюги трьох окремих β складчастих структур розташовані приблизно паралельно (нахил становить приблизно 30°) до потрійної осі тримеру. Взаємодія між субодиницями стосовно потрійної осі відбувається через просте складання один до одного β-складчастих шарів; край β-складчастих шарів, що складається з ланцюгів F і G однієї субодиниці, проходить поперек задньої β-складки (GDIBB') відповідної потрійної субодиниці (див. Фіг.2). С-кінець лежить близько до потрійної осі. Складання один до одного створює надзвичайно щільне з'єднання між субодиницями. Таким чином, серцевина тримеру є повністю недоступною для розчинника. В. Тип амінокислотного розташування Загальне розташування залишків різних типів у тривимірній структурі TNFa не суперечить загальному для білків правилу, а саме, що гідрофобні залишки розташовані в серцевині молекули, тоді як заряджені залишки спрямовані до поверхні. Таким чином, серцевина складчастих шарів TNFa має передбачуване щільне розташування великих аполярних залишків. Енергетика системи не дозволяє TNFa існувати у мономерному стані. Для великої площі поверхні, складеної з комплементарних залишків (наприклад, полярних залишків, розташованих проти полярних залишків), втрата зовнішньої до розчинника площі поверхні надає значну енергетичну перевагу для утворення олігомеру (тобто, тримеру). Спрямування до розчинника великої площі сильно гідрофобних залишків, за звичайних умов розташованих у нижній частині тетрамерної поверхні, також призвело до дестабілізації мономера TNFa. 3. Дослідження структури-функції А. Взаємодії TNFa/антитіло Було виявлено, що антитіла проти TNFa одного виду (наприклад, людини), перехресно не реагують з TNFa інших видів (наприклад, миші), незважаючи на ідентичність послідовності більш, ніж на 80% і здатність TNFa зв'язуватись з рецептором TNFa інших видів. Якщо ступінь варіювання послідовності перенести на тривимірну стр уктур у, то стає очевидним, що більшість послідовність-варіабельних ділянок молекули відповідає поверхневим петлям, з якими взаємодіють антитіла. Ділянки висококонсервативних залишків серед складчастих шарів або на поверхні між субодиницями зовсім не розпізнаються антитілами. Таким чином, епітоп для антитіла проти TNFa буде завжди містити деякі залишки, що змінюватимуться між видами, таким чином запобігаючи зв'язуванню антитіл. Це значить, що властивості взаємодії між TNFa і його рецептором повинні дещо відрізнятися від потрібних для зв'язування антитіла з TNFa. Б. Сайт-спрямований мутагенез Роль різних специфічних залишків і ділянок молекули TNFa стосовно її біологічної (цитотоксичної) активності й зв'язування з рецептором досліджували, замінюючи ті залишки різними амінокислотами або видаляючи частини послідовності, з використанням способів сайт-спрямованого мутагенезу (Jones et. al., op. cit. стор.113-119). Видалення до восьми залишків з N-кінця без будь-якого шкідливого впливу на біологічну активність доводить, що ця ділянка не є вирішальною для загальної стабільності молекули. N-кінцеві залишки чинять непрямий другорядний вплив на біологічну ефективність тримеру TNFa. За звичайних умов неконсервативні заміщення висококонсервативних залишків, які утворюють щільно упаковану серцевину β-складчастих шарів, порушують біологічну активність TNFa [Yamagishi et. al., Protein Engineering, Vol.3, No.8, стор.713-719 (1989)]. Багато таких м утованих білків (мутеїнів) не можуть утворювати стабільну, правильно складену молекулу. Деякі консервативні заміщення все ж можливі в межах гідрофобної частини на нижній частині потрійної осі, проте набагато збільшується коливання в менш щільно упакованій ділянці біля вершини тримеру. Зокрема, Cys 69 і Cys 101, які утворюють дисульфідний зв'язок між двома зв'язуючими петлями в нещільно упакованій молекулі, є відносно нечутливими до змін (див. Фіг.1а). Як правило, для того, щоб зберегти деяку біологічну активність TNFa мутації біля центральної осі, TNFa повинні бути висококонсервативними, щоб зберегти загальну форму TNFa. Залишки на поверхні молекули мають значно більшу свободу для мутування без необоротного руйнівного впливу, що доведено наявністю різноманітних залишків в цій категорії між видами. Таким чином, значні зміни у біологічній активності TNFa завдяки заміщенням в цій зоні вказують на пряму участь таких залишків у функціональній взаємодії тримеру TNFa з його рецептором. Такими амінокислотними залишками є Arg 31, Arg 32 і АІа 33, розташовані у зв'язуючій петлі між В і В' ланцюгом задньої β-складки; Ser 86 і Туr 87, розташовані у зв'язуючій петлі між Ε і F ланцюгами передньої β-складки, й Glu 146, розташований у зв'язуючій петлі між Ηланцюгом передньої β-складки й I-ланцюгом задньої β-складки (див. Фіг.3). Вони знаходяться в двох різних "гарячих" ділянках на передньому й задньому боках мономеру TNFa. Розподіл всіх шкідливих мутацій незалежно від структурної категорії ще більше зміцнює це становище. Наявність цих "гарячих" місць стосовно чутливості біологічної функції до мутацій була розглянута Yamagishi et. al., op.cit, і Goh et. al., Protein Engineering, Vol.4, No.4, crop.380-389 (1991). Дослідження мутування поліпептидів TNFa людини були описані в кількох патентних заявках. Таким чином, Yamagishi et. al., (ЕР 251 037) описує багато сайт-специфічно мутованих молекул TNFa, які є розчинними й мають цитотоксичну й протипухлинну активність, характерну для TNFa людини in vitro і/або in vi vo. Інші мутеїни, що мають активність TNFa, описані у WO 90/07579. Мутеїни, що мають вищу зв'язуючу активність до рецептора p75-TNF людини, ніж до рецептора p55-TNF людини, описані у ЕР-А-619 372. Жодне з цих посилань, які включені сюди шляхом посилання, не описує модифікацію молекули TNFa для знищення біологічної активності TNFa і надання здатності викликати антитіла проти TNFa дикого типу. Проте, вони надають корисні загальні дані стосовно TNFa і його біологічного впливу. Створення та експресія TNFa-аналогів і їх композиція також описані як рецептор-зв'язуючі тести. 4. Висновки Існує багато даних щодо специфічного зв'язку структури та функції для TNFa. Всі факти вказують на важливість тримеру як стабільної природної одиниці. Є очевидним, що дві гарячі ділянки, розташовані на окремих боках мономеру TNFa, знаходяться близько до кожної іншої у межах сусідніх субодиниць у тримері. Таким чином, ділянка функціональної важливості, що складається із залишків 31-35, 84-87 і 143-148, знаходиться на поверхні контакту між двома субодиницями на нижній половині тримеру. Yamagishi et. al., op. cit виявив втрату здатності зв'язуватись з рецептором та цитотоксичності при зміні Asp 143 на Туr, і Tsujimoto et. al., J.Biochem. 101, стор.919-925 (1987) виявив такий самий вплив для Arg 31 і Arg 32 на Asn і Thr. Таким чином, цей сайт може бути напряму пов'язаний з рецептором та цитотоксичністю. Цікаво й те, що ділянка зв'язування TNFa з рецептором знаходиться на поверхні контакту між двома субодиницями. Отже, детальна тривимірна структура TNFa служить для пояснення широкого спектру досліджень зв'язування антитіл, олігомеризації і сайт-специфічного мутагенезу. Якщо структур у розглядають разом з останніми мутантами, підданими сайт-спрямованому мутагенезу, ділянка біологічної важливості стосовно зв'язування з рецептором знаходиться, очевидно, в субодиницях на нижній частині тримеру. Опис рівня техніки У WO 95/05849/ деякі з сучасних винахідників описують спосіб модифікації власних білків так, щоб викликати антитіла проти немодифікованих власних білків, де аналог власного білка створюється засобами молекулярної біології. Більш детально, один або кілька пептидних фрагментів власного білка заміщені одним або кількома пептидними фрагментами, що містять імунодомінантні епітопи чужорідних Т-клітин. Перед створенням винаходу WО 35/05849 використовували кон'югацію пептидів або білків, включаючи власні білки, з білками-носіями, що містили епітоп Т-клітин. WO 92/19746 описує рекомбінантний поліпептид, що містить послідовність LHRH, один або кілька епітопів Т-клітин та сайт очищення, який використовується у вакцинах для імунокастрації тварин. Як переважаючий фактор, в WO 95/05849 зазначено, що імунодомінантний епітоп Т-клітин вставлений так, що фланкуючі ділянки вихідного білка, що містять принаймні 4 амінокислоти, захищаються з кожного боку вставленого епітопу. Іншими словами, епітоп не можна кон'югувати з власним білком як злитий білок. Найкраще, заміщення потрібно робити так, щоб суттєво зберегти третинну структуру ви хідного білка. З іншого боку, не існує ніяких вказівок щодо оптимального внутрішньомолекулярного положення вставленого епітопу для того, щоб створити найбільше утворення антитіл проти немодифікованих власних антитіл. Як можна було б передбачити, це буде залежати від власного білка, але, керуючись загальними вказівками, найбільш придатне (придатні) положення може бути визначено без зайвих досліджень шляхом вибору пептидів, що містять належні імунодомінантні епітопи, заміщуючи пептидні послідовності головним чином однакової довжини у різних частинах власної білкової молекули й визначаючи підвищене утворення антитіл придатними для цього способами. Можливо, дуже важко, використовуючи існуючі засоби моделювання, передбачити, чи заміщення одного або кількох пептидних фрагментів у білку приводить до зміни третинної структури ви хідного білка. Таким чином, в програмах для розробки лікарських засобів пошук потрібних сполук потрібно вважати стандартною процедурою на ранній стадії розробки для визначення, які модифіковані власні білки зберегли третинну структур у ви хідного білка. Це може бути зроблено з використанням кількох експериментальних способів, як було описано в кількох книжках щодо властивостей білків, наприклад, флуоресцентна спектроскопія, круговий дихроїзм в близькій до УФ-спектра області, ІК-спектроскопія з перетворенням в ряд Фур'є та бага товимірні способи ЯМР ["Physical Methods to Characterize Pharmaceutical Biotechnical Proteins", Pharmaceutical Biotechnology Vol.7. Eds. J.N.Herron, W.Jiskoot & D.J.A. Cromelin, Plenum Press, New York (1995)]. В ідеальному варіанті, в процесі скринінгу потрібних сполук два або більше експериментальних способів, згаданих вище, треба змішати для того, щоб оцінити, чи є зміна в третинній структурі. Короткий опис малюнків Фіг.1а ілюструє структур у кристала природного мономеру TNFa. Фіг.є схематичним зображенням складання субодиниці, β-ланцюги наведені як товсті стрілки в напрямку від карбокси до аміно кінця й зв'язуючі петлі наведені як тонкі лінії. Дисульфідний зв'язок показаний як блискавка, а ділянка високої гнучкості поперечно заштрихована. Потрійна вісь тримеру має бути вертикальною для цього положення. Фіг.1б - це слід ланцюга Сa кристальної структури мономеру TNFa. Цей детальний малюнок треба розглядати разом з Фігурою 1а для одержання точного розташування послідовності амінокислот з більш ясним і традиційним уявленням складання субодиниці. Фіг.1в показує структур у TNFa у формі рулону. Вставка між ланцюгами Η і С показана як пунктирні лінії; зв'язок між В і С проходитиме прямо через верх молекули. Фіг.2 показує укладання один до одного β-складчатих шарів тримеру TNF. Вид вниз вздовж потрійної осі показує вузьку плиту тримеру з β-ланцюгами, представленими стрічками, що йдуть у сторінку та з неї. Фіг.3а показує послідовність ДНК, що кодує фактор некрозу пухлини, який має послідовність амінокислоти, наведену на Фіг.3б Послідовність ДНК брали у Gen Bank під реєстраційним номером М10988, SEQ ID NO: 339737. Послідовність була описана Wang et. al., Science 228, 149-154 (1985). Послідовність містить кодони, що кодують -76 - -1 послідовність TNFa людини. Повна послідовність гена, включаючи інтрони, була описана Nedwin et. al., Nucleic Acids, Res. 13 (17) 6361-6373 (1985), Shrrai et. al., Nature 313 (6005), 803-806 (1985) і Dennica et. al., Nature 312 (5996), 724-729 (1984). Фіг.3б показує послідовність амінокислот TNFa людини, включаючи послідовність -76 - -1. Фіг.4а схематично зображує заміщення імунодомінантних епітопів Р2 і Р30 у TNFa дикого типу (ДТ) для утворення аналогів TNFa: ФНП2-1-2-7 і ФНП30-1-30-5. Фіг.4б показує точні розташування заміщень у послідовності ДТ для окремих TNFa аналогів. Фіг.5а і 5б показують структури аналогів, наведених на Фіг.1а, де окремі заміщення Р2 і F30 у ланцюгах βскладок і зв'язуючих петлях, відповідно, позначені чорним. Фіг.6 показує біологічну активність аналогів TNFa у тесті L929 [Meager, А.Leung, Η. & Woolley, J. Tests for Tumor Necrosis Factor and related cytokines., J.Immunol. Meth. 116,1-17 (1989)] порівняно з рекомбінантним TNFa. Фіг.7 показує утворення антитіл до TNFa людини у кролів при вакцинації модифікованими молекулами TNFa у кролів. Фіг.8 показує здатність Р2/Р30 модифікованої молекули TNFa людини викликати нейтралізуючі антитіла, які визначали в тесті з використанням клітин L929. Фіг.9 показує здатність Р2/Р30 модифікованих молекул TNFa людини при введенні кролям викликати нейтралізуючі антитіла, які визначали в тесті з використанням рецепторів. Фіг.10 показує утворення периферійних моноцитів (ПМ) у трьох донорів стосовно пептидів ТТ, Р2 і Р30. Фіг.11 показує поліклональну проліферацію у двох донорів, використовуючи різні Р2 і Р30 модифіковані молекули. Фіг.12 показує індекси проліферації (ІП), підраховані з 34 експериментів для F2 і Р30 модифікованих молекул TNFa. Фіг.13 показує утворення ПМ проти Р2 і Р30 модифікованих білків TNFa у Р2 і Р30 специфічних реагуючих елементах. Фіг.14 показує таке саме утворення ПМ у дво х інши х донорів. Фіг.15 показує вплив бокових амінокислот на розпізнавання Р2 і Р30 Т-клітин. Фіг.16 показує стратегію мутування, використану для приготування модифікованих молекул TNFa. Метою цього винаходу є надання інструкцій щодо того, як певний власний білок в загальному об'ємі винаходу ви щезгаданого WO 95/05849, viz. TNFa людини треба модифікувати для того, щоб зробити його біологічно неактивним, а також для того, щоб індукува ти утворення антитіл до ДТ біологічно активного TNFa. В цьому контексті "біологічно неактивний" стосується активності TNFa ДТ, головним чином, його цитотоксичної активності. З огляду на третинну структуру TNFa, надану вище, слід нагадати, що біологічно активний TNFa є тримером, що складається з трьох субодиниць. Завдяки укладанню одна до одної задньої β-складки представляє заховану зону контакту між субодиницями, які повністю недосяжні для розчинника. Значні заміщення у цій зоні майже необоротно зроблять молекулу TNFa біологічно неактивною. І навпаки, передня βскладка та зв'язуючі ділянки створюють зону досяжної поверхні, яка включає зони, що взаємодіють з рецептором TNFa. Антитіла до ци х зон, таким чином, можливо, будуть здатні перешкоджати зв'язуванню з рецептором і, таким чином, матимуть TNFa- нейтралізуючі властивості. Фахівець у галузі, хто хотів би створити детоксифіковану та ще й імуногенну молекулу TNFa згідно з WO 95/05849, спочатку вставив би імунодомінантний Т-клітинний епітоп у задній β-складці у мономері TNFa. Модифікації цієї зони, таким чином, найбільш вірогідно порушили б біологічну активність TNFa і залишили б передній β-складці, доступний для рецептора, вільним для взаємодії з антитілом. Це також співпадає з сайтспрямованим мутагенезом у щільно упакованій серцевині β-складчастих шарів, описаних вище. Проте, як не дивно, це не так. Як стане очевидним з результатів тестів, наведених нижче, одержаний результат виявився протилежним, оскільки заміщення в В і G ланцюгах задньої β-складки несподівано привели до створення аналогів TNFa, які були не здатні викликати нейтралізуючі антитіла проти TNFa. Таким чином, цей винахід має на меті створення модифікованих молекул TNFa людини, здатних викликати нейтралізуючі антитіла до людського TNFa дикого типу після введення вищезгаданих модифікованих молекул TNFa людині, де принаймні один пептидний фрагмент молекули TNFa був заміщений на принаймні один пептид, що містить імунодомінантний Т-клітинний епітоп, або скорочену форму ви щезгаданої молекули, що містить імунодомінантний епітоп, і одну або обидві бокові ділянки молекули TNFa людини, що містить принаймні один В-клітинний епітоп TNFa, де заміщення приводить до значної зміни в послідовності амінокислот передньої β-складки, у будь-який одній із зв'язуючих петель і/або у будь-якому одному з В', І або D ланцюгів задньої β-складки. Отже, треба уникнути заміщення у В і G ланцюга х задньої β-складки. У цьому контексті "значна зміна" - це зміна, яка більша, ніж просте консервативне заміщення окремих амінокислот, і більша, ніж точкова мутація, яка не змінює вторинної і/або третинної структури TNFa дикого типу. Інакше кажучи, Т-клітинний епітоп, введений у послідовність, повинен бути послідовністю, яка має низьку гомологію з послідовністю TNFa дикого типу. Згідно з цим винаходом також пропонуються модифіковані молекули TNFa людини, здатні викликати нейтралізуючі антитіла до людського TNFa дикого типу після введення вищезгаданих модифікованих молекул TNFa людині, де принаймні один пептидний фрагмент молекули TNFa людини був заміщений на принаймні один пептид, що містить імунодомінантний Т-клітинний епітоп, або скорочену форму вищезгаданої молекули, що містить імунодомінантний епітоп, і одну або обидві бокові ділянки молекули TNFa людини, що містить принаймні один Б-клітинний епітоп TNFa, де вищезгадана модифікована молекула TNFa не має активності TNFa. Термін "не має активності TNFa" в цьому контексті значить, що введення людині такої модифікованої молекули TNFa не призведе до відчутного шкідливого впливу завдяки відомому впливу цитокінів, які стимулюються природним TNFa. Інакше кажучи, модифіковані молекули TNFa винаходу є фармацевтично прийнятними речовинами. Для того, щоб перевірити, чи модифікована молекула TNFa людини згідно з винаходом не має активності TNFa, використовують L929-тест. Крім того, для того, щоб переконатися в імуногенності модифікованих молекул TNFa, одержують антитіла проти модифікованої молекули TNFa в придатному хазяїні, і якщо вони значно інгібують активність TNFa дикого типу в L929-тесті, як описано в цьому винаході, і/або вищезгадані антитіла значно інгібують зв'язування TNFa дикого типу з рецептором 1 TNFa, що має масу 55кДа, (TNFa-R55) або з рецептором TNFa, що має масу 75кДа, (TNFa-R75). До цих придатних хазяїв, наприклад, можуть належати примати, такі як мавпи Rhesus або Cynomuleus, гризуни, такі як щури, миші чи морські свинки, або lagomorph, такий як кріль. Тести, придатні для визначення сили дії модифікованих молекул згідно з винаходом, виконують з використанням антитіла або антисироватки в концентрації, розрахованій для тесту, і повинні відображати фізіологічні умови стосовно реагуючих речовин, або так, щоб можна було б застосувати результати, одержані в тесті, до фізіологічних умов. Інакше кажучи, результати тесту повинні свідчити, що фізіологічна концентрація антитіл проти TNFa in vivo здатна зменшити активність TNFa до принаймні 15%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% або 100%. Фахівець у галузі знатиме, як визначити такі умови. Треба розуміти, що "значне інгібування TNFa дикого типу" може бути таким, що призводить до зменшення або зникнення шкідливого впливу TNFa дикого типу. Таке інгібування може краще бути принаймні 10%, принаймні 15%, принаймні 25%, принаймні 30%, принаймні 35%, принаймні 40%, принаймні 45%, принаймні 50%, принаймні 55%, принаймні 60%, принаймні 65%, принаймні 70%, принаймні 75%, принаймні 80%, принаймні 85%, принаймні 90%, принаймні 95% або навіть 100% . Враховуючи це, модифікованим молекулам TNFa людини згідно з цим винаходом властиве те, що заміщення було зроблене в таких ділянках молекули TNFa, як ланцюги передніх β-складок і/або зв'язуючі петлі так, щоб істотно захистити структур у β-складки від будь-якого з ланцюгів задньої β-складки. Хоча повністю експериментально й не було підтверджено, треба припустити, що ця властивість є звичайною для ланцюгів, що створюють задню β-складку так, що заміщення треба краще робити на ділянках молекули THFa, які не містять будь-якого повного ланцюга задньої β-складки. Враховуючи вищезгадану функціональну важливість залишків 31-35, можна припустити, що треба уникнути заміщень в зв'язуючих петлях між окремими ланцюгами задньої β-складки. Проте можна допустити, щоб заміщення було зроблене в ділянках молекули TNFa, яка лише містить сегмент D ланцюга задньої β-складки. Згідно з кращим втіленням винаходу, заміщення стосується принаймні сегменту Η-ланцюга передньої β-складки і зв'язуючої петлі до І-ланцюга задньої β-складки, краще амінокислоти 132-146. Згідно з іншим втіленням винаходу, заміщення стосується сегментів Н- і І-ланцюгів і цілої зв'язуючої петлі, краще, якщо амінокислот 132-152. Згідно з ще одним кращим втіленням винаходу, заміщення стосується сегменту D-ланцюга задньої β-складки, принаймні сегменту Ε-ланцюга передньої βскладки і цілої зв'язуючої петлі, краще, якщо амінокислот 65-79 або 64-84. Згідно з ще одним втіленням винаходу, заміщення стосується цілих С і С-ланцюгів передньої β-складки сегмента D-ланцюга задньої β-складки, краще, якщо амінокислот 40-60. Згідно з ще одним втіленням винаходу заміщення стосується принаймні сегменту Ε-ланцюга передньої βскладки і однієї або обох зв'язуючих петель, краще, якщо амінокислот 76-90. Вставлений Т-клітинний епітоп повинен бути краще різнорідним та імуногенним у більшості типів HLA класу II людини. Потрібні епітопи може бути одержані з, наприклад, Tetanus toxoid, краще, якщо епітоп Р2 і/або Р30, Panina-Bordrgnon et. al., Eur. J.Immunol. 19:2237-42, 1989. Також можуть бути використані епітопи з diphtheria toxoid. Кращі вищезгадані модифіковані молекули TNFa людини (аналоги TNFa) стосовно розташування заміщення показані у доданому списку послідовностей SEQIDNO:8 і SEQ ID NO: 16. Інші придатні аналоги TNFa наведені як SEQ ID NO: 4, 10, 14 і 16. Винахід також стосується скорочених аналогів TNFa вищезгаданих модифікованих аналогів TNFa згідно з цим винаходом. Таким чином, скорочені аналоги молекул TNFa, що містять різнорідний та імунодомінантний Т-клітинний епітоп і одну або обидві бокові ділянки, що містять принаймні один В-клітинний епітоп TNFa, краще, якщо містять принаймні п'ять амінокислот, також могли б бути можливим активним компонентом вакцини TNFa згідно з винаходом. Т-клітинний епітоп викликав би проліферацію Т-клітин у поєднанні з молекулами головного комплексу гістосумісності (ГКГ) II класу на АВК, тоді як В-клітинний епітоп потенційно розпізнавався б імуноглобуліновими рецепторами на В-клітинах і згодом був би представлений молекулами ГКГ І класу на цих клітинах. Це складає основу створення імунної відповіді на TNFa дикого типу, що несуть В-клітинний епітоп згідно з WO 95/05849 і цим винаходом. В-клітинні епітопи можна було би ідентифікувати у TNFa як теоретично, так і експериментально. Був опублікований алгоритм визначення потенційно лінійних В-клітинних епітопів, і це створило основу для експериментальних досліджень природи цих потенційних епітопів. Антитіла, одержані в чужорідній системі (наприклад, у кроля) у відповідь на ін'єкції скороченої молекули TNFa, що містить Т-клітинні епітопи, можна було б дослідити на здатність in vitro зв'язувати природній TNFa людини, головним чином за рахунок нейтралізації. Моноклональні антитіла, яким властива нейтралізація, можна піддати скринінгу на здатність зв'язувати потенційні В-клітинні епітопи TNFa. Всі ці способи можна використовувати для визначення можливих і найкращих В-клітинних епітопів. Вважається, що вищезгаданий аналог TNFa залишається у формі мономеру, оскільки модифікація ймовірно руйнує властиву йому тенденцію до тримеризації TNFa дикого типу. Проте винахід іще стосується димерів, олігомерів, зокрема тримерів або мультимерів запропонованої модифікованої молекули TNFa, яка не має активності TNFa, а також виділених молекул ДНК, що кодують запропоновані модифіковані молекули TNFa. Виділені молекули ДНК, що кодують кращі аналоги TNFa, мають послідовності, наведені як SEQ ID NO: 7 і 15, і молекули ДНК, що кодують інші придатні аналоги, наведені як SEQ ID NO: 3, 9, 13 і 15. Винахід також пропонує вектори, що містять виділені молекули ДНК, які кодують аналоги, експресійні вектори, що містять вищезгадані молекули ДНК, функціонально з'єднані з придатною послідовністю для контролю за експресією. Іншим аспектом винаходу є хазяїн, трансформований експресійним вектором вищезгаданого аналога. Вищезгаданий хазяїн може бути будь-яким з хазяїв, що зазвичай використовуються для експресії, наприклад, штам бактерій, дріжджі, гриби або комахи, ссавці або клітинні лінії птахів (avian). Винахід також стосується способу створення запропонованих аналогів TNFa, де клітини хазяїна, трансформовані експресійним вектором, що містить аналог, вирощують за належних умов, за яких утворюється і виділяється аналог. За бажанням модифіковані молекули TNFa згідно з винаходом можуть бути експресовані як складений білок або частина з придатною молекулою ад'юванту, краще імунологічно активним ад'ювантом, таким якGMCSF, HSP70 або інтерлейкіном, наприклад, інтерлейкіном 2. Більш детально, модифіковані молекули TNFa утворюються вставкою сегментів належного гена, що кодують пептид, який містить або являє собою імунодомінантні Т-клітинні епітопи, в ген, що кодує природну молекулу TNFa людини. Потім модифікований ген TNFa вставляють у належний еукаріотичний або прокаріотичний експресійний вектор. Експресовані модифіковані молекули TNFa очищають і відновлюють, як описано вище. Хоча, може, було б і краще вставити цілий Т-клітинний епітоп, проте в деяких випадках було б краще вставити пептидну послідовність, що містить як епітоп, так і бокові ділянки білка, з якого одержували епітоп. Згідно з винаходом модифіковані молекули TNFa людини можуть бути використані як вакцини проти TNFa. Принципи розробки рецептур вакцин, основаних на очищених білках, таких як модульовані власні білки, як правило, аналогічні принципам розробки будь-якого іншого білкового лікарського засобу. Потенційні проблеми та інструкції, потрібні для подолання цих проблем, наприклад, збереження третинної структури, розглянуті в кількох посібниках, наприклад, "Therapeutic Peptides and Protein Formulation. Processing and Delivery Systems" Ed. Α.Κ.Banga; Technomic Publishing AG, Basel 1995. Використання ад'юванту, наприклад, гідроксиду алюмінію, фосфату алюмінію (Adju-Phos), фосфату кальцію, аналога дипептиду мурамілу або деяких з більш сучасних розробок ад'ювантів вакцин, таких як мікрочастки, що руйнуються в організмі, і Iscom рецептура для викликання імунної відповіді, знайома науковцям-фармацевтам, що працюють у цій галузі. Приготування вакцин згідно з винаходом, які містять пептидні послідовності як активні складові, добре відоме в галузі, наприклад, в патентах США 4,608,251; 4,601,903; 4,599,231; 4,599,230; 4,596,792 і 4,578,770, усі включені сюди шляхом посилання. Типово такі вакцини готують для ін'єкцій як рідкі розчини або суспензії; тверді форми, придатні для утворення розчинів або суспензій. Препарат може також бути емульсією. Активну імуногенну складову часто змішують з наповнювачами, які є фармацевтично прийнятними й сумісними з активною складовою. До придатних наповнювачів належать, наприклад, вода, сольовий розчин, декстроза, гліцерин, етанол або подібні, та їх комбінації. Крім того, за бажанням вакцина може містити незначну кількість додаткових речовин, таких як агенти для змочування або емульсифікації, агенти-буфери рН або ад'юванти, які підсилюють ефективність вакцини. Вакцини загальноприйнятим чином вводять парентерально, ін'єкцією, наприклад, підшкірно або внутрішньом'язово. До рецептур, придатних для інших шля хів уведення, належать супозиторії і, у деяких випадках, рецептури для орального введення. У випадку супозиторіїв, до традиційних зв'язуючих агентів і носіїв можуть належати, наприклад, поліалкіленгліколі або тригліцериди; такі супозиторії можуть бути утворені з сумішей, що містять активну складову в кількості від 0,5-10%, краще, якщо 1-2%. Оральні рецептури зазвичай містять такі наповнювачі, як, наприклад, манітол, лактозу, крохмаль, стеарат магнію, сахарат натрію, целюлозу, карбонат магнію й подібні. Ці композиції мають форму розчинів, суспензій, таблеток, пілюль, капсул, рецептур тривалого вивільнення або порошків і містять 10-95% активної складової, краще, якщо 2570%. Поліпептиди можуть бути включені у вакцину як нейтральні форми або у формі солей. До фармацевтично прийнятних солей належать кислі солі (утворені вільними аміногрупами пептиду), і ті, що утворені з неорганічними кислотами, такими як, наприклад, соляна чи фосфорна кислота або такими органічними кислотами як оксалоацетат, винна кислота, mandelic й подібні. Солі, утворені вільними карбоксильними групами, можуть також бути з неорганічними основами, такими як, наприклад, натрій, калій, амоній, кальцій або гідроксиди заліза й такі органічні основи, як ізопропіламін, триметиламін, 2-етиламінетанол, гістидин, прокаїн і под. Вакцини вводять залежно від рецептури й у такій кількості, яка була б терапевтично ефективною та імуногенною. Кількість, яку збираються вводити, залежить від пацієнта, наприклад, здатності імунної системи підтримувати імунну відповідь і бажаного ступеня захисту, який, у свою чергу, залежить від кількості TNFa пацієнта. Придатним діапазоном доз є порядок кількох сотень мікрограм активної складової на вакцинацію з кращим діапазоном від приблизно 0,1мкг до 1000мкг, ще краще від приблизно 1мкг до 300мкг і, зокрема, від приблизно 10мкг до 50мкг. Придатні режими для початкового введення й допоміжного також різні залежно від початкового введення, після чого проводять наступні інокуляції або введення. Існує багато способів застосування. Можна використати будь-який із загальновживаних способів для введення вакцини. До них належить оральне застосування на твердій фізіологічно прийнятній основі або у фізіологічно прийнятній дисперсії, парентерально, ін'єкцією або аналогічно. Доза вакцини залежатиме від шляху введення й віку пацієнта, що підлягає вакцинації, і менше - від фізичних характеристик пацієнта. Деякі модифіковані молекули TNFa згідно з цим винаходом є достатньо імуногенними у вакцині, але деякі з інших для викликання імунної відповіді потребують підсилення за рахунок додавання ад'юванту до їх складу. До різноманітних способів досягнення впливу ад'юванту у вакцині належить використання агентів, таких як гідроксид алюмінію або фосфат алюмінію, що зазвичай використовуються як 0,05-0,1% розчин у фосфа тному буфері, домішка синтетичних полімерів цукрів (Carbopol), що використовують як 0,25% розчин, агрегація білка у вакцині нагріванням до температури 70-101°С протягом 30 секунд - 2 хвилин, відповідно. Також може використовува тись агрегація реактивацією оброблених пепсином антитіл (Fab) до альбуміну, змішування з клітинами бактерій, таких як С.Parvum, або ендотоксинами, або ліпополісахаридними компонентами грамнегативних бактерій, створення емульсії у фізіологічно прийнятних масляних носіях, таких як манід моноолеат (АrасеІ А) або емульсії з 20% розчином перфторвуглецю (Fluosol-DA), що використовують як блок-замісник. Згідно з винаходом бромід диметилдіоктадециламонію є цікавим кандидатом на "посаду" ад'юванту, проте QuilA і RIBI також є цікавими кандидатами. Також можливості мають монофосфорилліпід А (МЛА) і дипептид мурамілу (ДМ). До інших придатних ад'ювантів належать гідроксид алюмінію, фосфат алюмінію (Adju-Phos), фосфа т кальцію, аналог дипептиду мурамілу. Серед деяких з недавніх розробок ад'ювантів вакцин можуть бути використані такі, як мікрочастки, що р уйнуються в організмі, і Iscom's . Іншою дуже цікавою (і таким чином кращою) можливістю досягнення впливу ад'юванту є використання способу, описаного у Gosselin GL al., 1992 (який включений сюди цілком шляхом посилання). Коротко кажучи, присутність відповідного антигену, такого як модифікована молекула TNFa цього винаходу, може бути підсилена кон'югуванням такого антигену з антитілом (або антигензв'язуючим фрагментом антитіла) проти рецепторів Feg на моноцитах/макрофагах. Було показано, що особливо кон'югати між антигеном анти-FcgRI підсилюють імуногенність при вакцинації. До інших можливостей належить використання речовин, що модулюють імунну систему, такі як лімфокіни (наприклад, g-ΙΦΗ, ІЛ-2 і ІЛ-12) або синтетичні індуктори g-ΙΦΗ, такі як полі І:С разом з вищезгаданими ад'ювантами. У багатьох випадках необхідно багато раз уводити вакцину, як правило, не більш, ніж 6 вакцинацій, краще не більше чотирьох і найкраще одну або кілька, як правило, принаймні біля трьох. Вакцинації, як правило, проводять в проміжках між двома та дванадцятьма тижнями, краще від трьох до п'яти тижнів. Періодичні повторні введення в інтервалах 1-5 років, як правило, три роки, будуть бажаними для підтримання бажаного рівня захисного імунітету. Однією причиною для змішування поліпептидів винаходу з ад'ювантом є ефективна активація клітинної імунної відповіді. Проте, цей вплив може також бути досягнений у інший спосіб, наприклад, експресією ефективного антигену у вакцині в непатогенному мікроорганізмі. Добре відомим прикладом такого мікроорганізму є Mycobacterium bovis BCG. Вважається за краще, якщо непатогенним організмом є бактерія, наприклад, вибрана з групи, що складається з роду Mycobacterium, Salmonella, Pseuciomonas і Eschericia. Ще краще, якщо непатогенним організмом є Mycobacterium bovis. Включення однієї або кількох копій нуклеотидної послідовності, що кодує молекулу згідно з винаходом у мікобактерії з штаму BCG M.Bo vis, підсилить імуногенний вплив штаму BCG. Очікується, що включення більш ніж однієї копії нуклеотидної послідовності винаходу ще більше підсилить імунну відповідь, і, таким чином, одним з аспектів винаходу є вакцина, де принаймні дві копії, а краще принаймні 5 копій послідовності ДНК, що кодують молекулу, включені в геном мікроорганізму. Копії послідовностей ДНК можуть бути або ідентичними, тобто такими, що кодують однакові молекули, або різновидами такої самої послідовності ДНК, що кодує ідентичний поліпептид або його гомологи, або у іншому втіленні бути різними послідовностями ДНК, що кодують різні поліпептиди, де принаймні один з поліпептидів є поліпептидом згідно з цим винаходом . Жива вакцина винаходу може бути одержана культивацією трансформованої непатогенної клітини згідно з винаходом і перенесенням цих клітин у середовище для одержання вакцини, за бажанням додаючи носій, наповнювач і/або речовину-ад'ювант. Фрагменти нуклеїнової кислоти винаходу можуть бути використані для впливу на експресію антигенів in vi vo, наприклад, фрагменти нуклеїнової кислоти можуть бути використані в так званих ДНК-вакцинах, а також, окрім їх використання як вихідних речовин, для синтезу молекули винаходу й для гібридизаційних зондів (корисних для прямих тестів на гібридизацію або як праймерів у, наприклад, полімеразній ланцюговій реакції (ПЛР) або у інших способах ампліфікації). Останні дослідження довели, що фрагмент ДНК, клонований у вектор, який не реплікується в клітинах еукаріот, може бути введений в тварину (включаючи людину), наприклад, внутрішньом'язовою ін'єкцією або крізьшкірним уведенням (так званий підхід - "генна гармата"). ДНК потрапляє, наприклад, у клітини м'язів і потрібний ген експресується промотором, який функціонує у еукаріот, наприклад, вірусний промотор і продукт гена потім стимулює імунну систему. Ці сучасні способи розглянуті у Ulmer et. al., 1993, який включений сюди шляхом посилання. Ефективність такої "ДНК-вакцини" може бути підсилена введенням гена, що кодує експресійний продукт разом з фрагментом ДНК, що кодує поліпептид, який здатний модулювати імунну відповідь. Наприклад, ген, що кодує попередники лімфокіну або лімфокіни (наприклад, g-ΙΦΗ, ІЛ-2 або ІЛ-12), може бути введений разом з геном, що кодує імуногенний білок, або введенням двох окремих фрагментів ДНК, або введенням обох фрагментів ДНК, включених в однаковий вектор. Вакцини можуть бути використані для запобігання/лікування будь-яких з хвороб, описаних нижче, патофізіологія яких характеризується вивільненням TNFa, зокрема, хронічні запальні хвороби. Як приклад, можна згадати ревматоїдний артрит і запальну хворобу кишок (ЗХК). Остання включає виразковий коліт і хворобу Крона, зокрема, коліт Крона. До інших прикладів належить рак, кахексія, часто споріднена раку, розсіяний склероз, діабет, псоріаз, остеопороз і астма. Рак, який краще лікувати або запобігати йому згідно з винаходом, може бути гістогенно класифікований як злоякісні пухлини ендотелію, включаючи карциноми й аденокарциноми, і як злоякісні неепітеліальні пухлини, включаючи ліпосаркоми, фібросаркоми, хондросаркоми, остеосаркоми, лейміосаркоми, рабдоміосаркоми, гліоми, нейробластоми, медулобластоми, злоякісні меланоми, злоякісні менінгіоми, різноманітні лейкемії, різноманітні міелопроліферативні розлади, різноманітні лімфоми (лімфома Ходжкіна і лімфома, що не належить до лімфоми Ходжкіна), гемоангіосаркома, саркома Капоші, лімфангіосаркома, злоякісна тератома, дисгермінома, семінома і хорікарцинома. Саркоми й аденосаркоми є найбільш поширеними (приблизно 90% загибелі від раку) і, таким чином, представляють інтерес з метою лікування/запобігання згідно з винаходом. Найбільш важливими карциномами й аденокарциномами є ті, що походять з дихальних шляхів (зокрема, з бронхів), молочних залоз, cobrectum і шлунку. Проте карциноми й аденокарциноми передміхурової залози, яєчників, лімфоїдної тканини та кісткового мозку, матки, підшлункової залози, стравоходу, сечового міхура та нирок також викликають значну кількість смертей й представляють інтерес. Краще, якщо вакцини надаватимуться як засіб для запобігання, проте, зважаючи на хронічну природу цих хвороб і властиву для них ремісію та відновлення, вакцини також можуть бути введені пацієнтам, якщо був поставлений діагноз щодо однієї або кількох ви щеперелічених хвороб, і можуть використовуватись для підтримання пацієнта у стані ремісії. Зважаючи на попередні дослідження у мишей, вважається, що модифіковані аналоги TNFa згідно з винаходом можуть також бути введені як частина цілющого лікування вищезгаданих хвороб у гострій стадії або принаймні з метою викликання у пацієнта ремісії і підтримання стабільного стану. На сьогодні ще не визначений ефективний діапазон доз, оскільки вакцини ще не були перевірені на людях, що страждають від будь-якої з хвороб. У будь-якому випадку доза для введення призначається відповідальним лікарем. Згідно з одним втіленням винаходу вакцина складається з суміші двох різних модифікованих молекул TNFa, що містять два різні Т-клітинні епітопи, наприклад, Р2 і Р30, які одержують з tetanus toxoid. Ця суміш за бажанням може містити належну кількість фармацевтично прийнятного ад'юванту. Згідно з ще одним аспектом винаходу вакцини не містять модифікованих молекул TNFa людини, але містить конструкт, що містить неінфекційну та неінтегруючу послідовність ДНК, що кодує ви щезгадані молекули, функціонально з'єднані з промоторною послідовністю, яка може контролювати експресію вищезгаданої послідовності ДНК у людини в кількості, достатній, щоб відбулось поглинання вищезгаданого конструкту, і доста тній, щоб відбулась експресія для утворення нейтралізуючих антитіл проти TNFa. Використання цього типу вакцин, що мають назву ДНК-вакцини, описано у, наприклад, патентах США №5,589,466 і 5,580,859, обидва включені сюди цілком шляхом посилання, зокрема, стосовно способів введення. ДНК-вакцини можуть містити вірусний експресійний вектор, такий як ретровірусний експресійний вектор. Як правило, вакцини згідно з винаходом можуть бути застосовані для орального або парентерального, зокрема, підшкірного, внутрішньом'язового або підшкірного введення. Винахід також стосується використання антитіл, що утворюються внаслідок уведення вакцини згідно з винаходом, краще моноклональних антитіл, зокрема, використання з метою встановлення діагнозу. Винахід також стосується способу тестування тканинних рідин людини на присутність TNFa, який складається з реакції композиції, що містить модифікований TNFa згідно з винаходом, із зразком тканинної рідини людини й визначення, чи вищезгадані антитіла зв'язали TNFa у вищезгаданому зразку. Винахід також стосується способу діагностики TNFa-залежних хвороб, який полягає в застосуванні імунотесту in vitro для виявлення TNFa в тканинних рідинах організму. Вищезгадані способи можуть включати використання твердофазного імуносорбентного аналізу (ТІС А) або подібного, в якому може чи не може використовува тись ампліфікація, наприклад, використовуючи методику з застосуванням авідину/біотину. Властивості вакцин/рекомбінантних білків можуть бути перевірені, використовуючи наступні тести, знайомі фа хівцям у галузі: Електрофорез в поліакриламідному гелі із застосуванням додецилсульфату натрію (ЕПГ-ДСН) та фарбуванням по кумасі або сріблом (дані щодо чистоти та розміру) Ізоелектричне фокусування (ІЕФ) (дані щодо ізоелектричної точки) Тест з використанням ендотоксину (дані щодо чистоти) Тест на білки клітин хазяїна (дані щодо чистоти) Мас-спектроскопія (дані щодо молекулярної маси) Рідинна хроматографія високої розподільної здатності (РХВРЗ) з виявленням за допомогою УФ-світла (дані щодо розподілення маси молекули) Визначення послідовності з N-кінця (дані щодо ідентичності) Круговий ди хроїзм (дані щодо третинної структури) SE - HPLC mall detection (дані щодо третинної структури, визначені за допомогою розсіювання світла) Амінокислотний склад (дані щодо ідентичності) Імуногенність у чужорідних видів (миша, щур або кріль) Реактивність до антитіл у Вестерн-блотах ЯМР спектроскопія Визначення структури кристалу Визначення повної послідовності амінокислот Експериментальна частина з описом кращих втілень 1. Вступ У попередній заявці WO 95/05849 було показано, що Т-клітинний епітоп модифікованих молекул TNFa мишей викликав високі титри антитіл, що перехресно реагують з природним TNFa (дикого типу). Ці антитіла були здатні реагувати з TNFa і його рецептором in vitro та in vivo. Був продемонстрований корисний ефект імунізації проти TNFa на кількох тваринних моделях хвороб, викликаних TNFa, таких як експериментальна кахексія, колагеновий артрит і експериментальний алергічний енцефаломієліт (ЕАЕ). Ці експериментальні результати на тваринах були одержані, незважаючи на той факт, що використані дві модифіковані молекули TNFa мишей (названі MR 103 і MR 106) не були оптимізовані для набуття імуногенності у гаплотипах DBA/1 і SJL ГКГ класу II мишей. Ці лінії мишей використовували для дослідів з колагеновим артритом і ЕАЕ, відповідно. У іншому експерименті було показано, що модифікована іншим чином молекула TNFa мишей (MR 105) викликає сильнішу імунну відповідь, ніж рекомбінантний TNFa, кон'югований з білками Е.соlі з використанням формальдегіду. MR 103, MR 105 і MR 106 - молекули мишей, і зважаючи на попередню заявку WO 95/05840, не можна було зробити будь-яких специфічних висновків ні стосовно імуногенності належним чином заміщеної модифікованої молекули TNFa Т-клітин, ні про потенційну здатність таких молекул викликати аутоантитіла, що нейтралізують TNFa, оскільки вони всі були активні. 2. Створення конструктів TNFa людини У вакцині TNFa для використання у людини модифіковані молекули TNFa людини повинні задовольняти наступним вимогам: а. Вони повинні бути імуногенними для переважної кількості популяції б. Вони повинні бути оптимально здатними викликати антитіла, що нейтралізують TNFa в. Вони не повинні мати будь-якої залишкової біологічної активності TNFa Крім того, у процесі відбору потрібно враховувати інші практичні параметри, такі як рівень рекомбінантної експресії, легкість виділення, розчинність і под. 2.1. Імунологічна різнорідність модифікованих молекули TNFa Під час розробки вакцини TNFa людини метою було створення модифікованих молекул TNFa людини, які в кінцевому рахунку були б імуногенними у переважній частині популяції людини, яка звичайно представляє велику кількість різних типів HLA II класу. Таким чином, використовували різнорідні Т-клітинні епітопи замість ГКГ-специфічних епітопів, використаних у попередніх експериментах на тваринах. З попередньої заявки WO 95/05849 не було відомо, як такі епітопи могли б впливати на здатність таких молекул викликати утворення нейтралізуючих антитіл. Були вибрані два Т-клітинні епітопи Р2 і Р30, одержані з tetanus toxoid (TT), які були описані у науковій літературі. Відомо, що ці епітопи є імунодомінантними у ТТ і здатні зв'язува тись з принаймні 80% молекул HLA II класу в популяції людини. Крім того, при використанні цих ТТ-епітопів очікувалось, що буде можливо тестувати імуногенність TNFaконструктів in vitro на ПМ і лініях Т-клітин, одержаних з донорів з ТТ імунною кров'ю. Послідовність амінокислот епітопу Р2 складає QYIKANSKFIGITEL і відповідає амінокислотами ТТ 830-844, а послідовність епітопу Р30 складає FNNFTVSFWLR VPKVSASHLE і відповідає амінокислотам ТТ 947-967. Вставка Р2 і Р30 у дві різні молекули TNFa людини змінило б на приблизно 10% і 15%, відповідно, природну послідовність TNFa. Якщо обидва епітопи вставляли в одну молекулу TNFa, то приблизно 25% молекули змінювалось, і можна було б подумати, що це була б небажана взаємодія з іншою природною частиною молекули TNFa. Таким чином, було вирішено створити дві молекули TNFa, щоб кожна містила Р2 або Р30. Разом такі дві молекули мали б бути імуногенними у принаймні 80% популяції людини. Крім того, дуже ймовірно, що скорочені молекули, складені частково з Р2 або Р30 епітопів і частково з бокових ділянок TNFa, також вноситимуть свій внесок в імуногенність, що б привело до того, що конструкти були б імуногенними в майже 100% популяції. Хоча було можливо викликати антитіла усіма конструктами TNFa мишей у всіх лініях мишей, перевірених таким чином, порівн. з вищезгаданими MR103, 105 і 106, можна було б апріорі очікувати, що вставка чужорідного Т-клітинного епітопу у певні положення TNFa було б більш корисним, ніж в інші положення стосовно представлення епітопу Т-клітинам з допомогою молекул ГКГ II класу. Таким чином, було вирішено створити низку по-різному модифікованих молекул TNFa людини з Р2 і Р30 епітопом, вставленим в різні положення в молекули, див. Фіг.4. Потім усі молекули перевіряли in vitro у тестах з Т-клітинами із застосуванням ПМ або з Р2/Р30 специфічних ліній Т-клітин, виділених з кількох здорових донорів з ТТ імунною кров'ю. Протилежно до очікуваного було показано, що хоча й були помітні незначні кількісні розбіжності, внутрішньомолекулярне положення епітопів Р2 і Р30 не було суттєвим для здатності реагувати з АВК і потім з ТТ-специфічними Т-клітинами. Таким чином, Р2, вставлений у положення 132-146, 65-79 і 76-90, і Р30, вставлений у положення 40-60 і 132-152 (TNF 2-5, 2-3, 2-7, 30-2, 30-5), були оброблені та представлені Тклітинам. Зважаючи на вищезгадане, ймовірно, що ці молекули в кінцевому рахунку стануть універсально імуногенними в популяції людини. 2.2. Здатність людських модифікованих молекул TNFa викликати утворення нейтралізуючих антитіл Як було згадано вище, неможливо було передбачити в попередніх дослідженнях на мишах, описаних у WO 95/05849, яке положення було б більш придатним для того, щоб викликати утворення нейтралізуючих TNFa антитіл, оскільки три аналоги MR103, MR105 і MR106 були всі здатні викликати утворення антитіл, незалежно від різних зон заміщення. Таким чином, була створена низка різних молекул TNFa людини з Р2 або Р30, вставленими в різних положеннях. Заміщення випадково розподіляли по цілій молекулі. Антитіла, одержані з кроля, при ін'єкції цих молекул піддавали тестуванню в біохімічних та біологічних in vitro теста х на їх здатність перешкоджати біологічній активності TNFa. У неопублікованих дослідженнях авторів цього винаходу було показано, що залежно від внутрішньомолекулярного положення вставленого епітопу спостерігали різну загальну специфічність викликаних аутоантитіл. Протилежно до того, що очікували згідно зі структурними даними молекули TNFa, виявилось, що заміщення, зроблені у передній β-складці Р2 або Р30 повністю позбавляли молекули біологічної активності TNFa, але одночасно зберігали здатність модифікованих молекул викликати утворення нейтралізуючих TNFa антитіл. Молекули, що містять Р2 або Р30, у положеннях, згаданих вище, виявились особливо ефективними при індукції нейтралізуючих антитіл. Будь-які з цих молекул є, таким чином, потенційними кандидатами для використання як вакцини TNFa людини. 2.3. Біологічна активність різних конструктів TNFa Звичайно, що не можна було б використовувати молекулу, якій властива токсичність у TNFa вакцині. Модифіковані молекули TNFa, таким чином, повинні бути нетоксичними, тобто не повинні мати будь-якої остаточної активності TNFa. Всі мутантні білки TNFa були таким чином протестовані in vitro у TNFa-залежних біотестах та тестах на зв'язування з рецептором для того, щоб перевірити, чи не властива їм токсичність. Було чітко показано, що всі модифіковані молекули TNFa людини (ФНП2-3, 2-3, 2-7, 30-2 і 30-5) не мали біологічної активності TNFa. Отже, усі необхідні вимоги до цих молекул як частини універсальної нетоксичної вакцини, здатної викликати нейтралізуючі антитіла до TNFa людини, виконані. ПРИКЛАД 1 Генна інженерія Було вирішено створити 10 різних модифікованих молекул TNFa людини - п'ять, щоб містили Р2, і п'ять епітоп Р30. Епітопи вставляли в різних положеннях всередині молекули. Генні конструкти створювали, використовуючи різні загальновживані ферменти рестрикції і способи мутагенезу, основані на ПЛР. Генні конструкти показані схематично на Фіг.4а і 4б. Послідовності ДНК, що кодують модифіковані молекули TNFa і відповідні послідовності амінокислот, включені як SEQ ID NO: 1 - SEQ ID NO: 20. Конструкти мутантного гена ФНП2-5 людини, протоколи клонування і мутації з наступною експресією, виділенням і очищенням аналога ФНП2-5 описані нижче шляхом наведення прикладів. Створення та одержання ФНП2-5: Генна інженерія мутантного гена ФНП2-5 людини - протоколи клонування та мутагенезу Генна інженерія гена, що кодує мутантний аналог ФНП2-5 людини, була основана на традиційних, основаних на ПЛР, способах мутагенезу, як і всі інші генні конструкти. Природну послідовність ДНК TNFa людини, що кодує розчинну частину цієї молекули, одержували традиційним ПЛР клонуванням, використовуючи синтетичні праймери І і II (таблиця 1 і SEQ ID NO: 21 і 22) з комерційно доступної бібліотеки кДНК людини, КЛОНТЕХ Лабораторіз (CLONTECH Laboratories), Пало Альто, штат Каліфорнія, США (Фіг.16,1). Природний ген вставляли в придбаний від Новаген (Novagen), Медісон, штат Вісконсин 53711, США, експресійний вектор рЕТ28с Е.соlі таким чином, що ген може бути транскрибований в рамку від IPTG-індуцибельного промотору. Генну інженерію TNFa мутантного аналога ФНП2-5 виконували з допомогою способу ПЛР-мутагенезу, застосованого до природної послідовності ДНК. Послідовність нуклеїнової кислоти, що кодує Т-клітинний епітоп, включали в синтетичний 75-мерний олігонуклеотид (праймер "мут2-3", таблиця 1 і SEQ ID NO: 27) між двома 3'- і 5'-ланцюгами гомологічної ДНК TNF, що гібридизуються, таким чином, праймер "мут" здатний гібридизуватися з природною послідовністю гена TNFa людини у певному сайті, вибраному для ФНП2--5, (див. Фіг.16,2а). В олігонуклеотиді "мут" декілька кодонів, що кодують Т-клітинний епітоп, точно підходять кільком TNF-кодонам, пропущеним між двома 3'- і 5'-ланцюгами, що гібридизуються, ДНК, гомологічної TNF. Використовували праймер для мутагенезу для створення продукту, що містив синтетичний 75-мерний олігонуклеотид (праймер "мут2-3", таблиця 1 і SEQ ID NO: 27) між двома 3'- і 5'-ланцюгами гомологічної ДНК TNF, що гібридизуються, таким чином, праймер "мут" здатний гібридизуватися з природною послідовністю гена TNFa людини у певному сайті, вибраному для ΦΗΠ2-5, (див. Фіг.16,2а). В олігонуклеотиді "мут" декілька кодонів, що кодують Т-клітинний епітоп, точно підходять кільком TNF-кодонам, пропущеним між двома 3'- і 5'-ланцюгами, що гібридизуються, ДНК, гомологічної TNF. Використовували праймер для мутагенезу для створення продукту, що містив ДНК, яка кодує Т-клітинний епітоп і послідовність TNFa нижче (або 3') вставленого епітопу, (Фіг.16, 2б). Використовуючи праймери І і III (Таблиця 1, SEQ ID NO: 23) (Фіг.16, 2б) створювали другий продукт ПЛР і з його допомогою - ланцюг ДНК TNFa вище (або 5') вставки епітопу. Два продукти ПЛР нарешті з'єднували у кінцевій ПЛР реакції (Фіг.16,3), використовуючи два віддалених праймери - І і II з двох реакцій. Повну мутантну послідовність ДНК ФНП2-5 потім вводили в експресійний вектор Е.соli, придбаний через комерційну мережу, як для експресії, клонуючи природній ген таким чином, щоб ген міг би бути транскрибований з IPTG-індуцибельного промотору трансформованих клітин. Праймери "мут", використані для створення інших аналогів (ФНП2-1, 2-3, 2-4, 2-7, 30-1, 30-2, 30-3, 30-4 і 30-5), визначені як SEQ ID NO: 23-26 і 28-33, відповідно. Культивування рекомбінантних бактерій, збирання та розчинення включень. Очищення білка аналога ΦΗΠ2-5 Білок ФНП2-5 одержували таким же чином, як і інші рекомбінантні молекули TNFa. 1. Засівали 20мл середовища ТВ, що містило 50мкг/мл карбеніциліну, трансформованим штамом Е.соlі, що несе IPTG-індуцибельний плазмідний вектор, який містить ген TNF, кодуючий рекомбінантний білок; вирощували E.соlі протягом ночі при 37°С при постійному перемішуванні. 2. Розводили цю культуру 1:25 у 250мл середовища ТВ з 50мкг/мл карбеніциліну і вирощували до утворення оптичної густини OD450=1. Викликали експресію рекомбінантного білка додаванням IPTG до кінцевої концентрації 1мМ. Вирощували протягом ночі з енергійним перемішуванням при 37°С. 3. Збирали рекомбінантні клітини з середовища при центрифугуванні 3500хд. Осад промивали один раз у буфері BSB. Використовували 150мл BSB на 50г вологої маси бактерій. 4. Обробляли ультразвуком 4 рази протягом 30 секунд при максимальній амплітуді, доки суспензія бактерій не ставала повністю гомогенною. Обробку ультразвуком проводили з використанням пристрою MSE Soniprep 150p 9,5мм стандартний зонд (Soniprep 05 38 121-1154). 5. Додавали 8мкл PMSF (50глМ) і 80мкл розчину лізозиму (30мг/мл) на грам клітинного осаду. Інкубували 30 хвилин при кімнатній температурі. 6. Додавали 4мг дезоксихолевої кислоти на грам осаду, перемішували та зберігали при 37°С. 7. Коли розчин ставав в'язким, додавали 20мкл ДНК-ази (1мг/мл) на грам осаду й МgСІ2 до кінцевої концентрації 5мМ, перемішували й зберігали при кімнатній температурі 30 хвилин. 8. Обробляли ультразвуком у льоді 5 разів 30 секунд з 30-секундними проміжками за максимальної температури, доки розчин не ставав рідким та нев'язким. 9. Центрифугували при 20000хд протягом однієї години, зберігали супернатант для подальшої перевірки процедури промивання щодо того, чи усі включення випали в осад. 10. Осад ресуспендували у воді MiliQ (1мл Н2О на грам Е.coli), збовтували протягом 1 години. 11. Центрифугували при 20000хд протягом однієї години, зберігали супернатант для перевірки щодо того, чи всі включення випали в осад. 12. Ресуспендовували осад у 1Μ сечовині, розчиняли у 1мл на грам Е.соlі, збовтували протягом 1 години. 13. Центрифугували при 20000хд протягом години, зберігали супернатант для перевірки щодо того, чи всі включення випали в осад. 14. Ресуспендували осад у 1Μ гуаніні, розчиняли у 1мл на 1г Е.соlі, збовтували протягом 1 години. 15. Центрифугували при 20000хд протягом однієї години, зберігали супернатант для перевірки щодо того, чи всі включення випали в осад. 16. Ресуспендували осад у 2,5мл 6Μ гуанідині +20мМ Трис рН8,0, перемішували протягом ночі. 17. Центрифугували при 20000хд протягом однієї години, супернатант, що містив включення рекомбінантного білка, зберігали осад для перевірки чи всі включення розчинились. 18. Розчин білка інтенсивно діалізували проти води MiliQ і потім розчин висушували на холоді. 19. Заморожений сухий матеріал розчиняли в 20мМ Трисі, 6Μ гуанідині, 30% 2-пропані (рН8,0) при концентрації 20мг/мл. Розчин залишали розчинятися протягом ночі при незначному перемішуванні. Присутність мономерів перевіряли на колонці супердекс 200 (ХК 16, Pharmacia, діаметр: 1,6см, висота: 750см). Промивали буфером при 1мл/хв. Зі стандартами порівнювали в тому самому буфері. 20. Очищення білка проводили за допомогою гель-фільтрації на колонці супердекс 200 (ХК20, Pharmacia; висота: 100см, діаметр: 2,6см), яку врівноважували буфером для врівноваження. Промивали у буфері для врівноваження. Застосовували зразок об'єму, що становив приблизно 1% від загального об'єму колонки. 21. Складання рекомбінантного білка проводили за допомогою діалізу. Білок розводили до 0,1мг/мл у буфері для врівноваження і цей розчин переливали у діалізний мішечок та діалізували проти: 20мМ Трис, 4Μ сечовини (рН8,5) з трьома змінами, протягом ночі за кімнатної температури. Діалізний мішечок переносили у буфер Трис (20мМ Трис, 150мМ NaCI (рН8,0)). Таку процедуру проводили тричі - першу проводили за кімнатної температури. Уночі залишали на холоді. Складання оцінювали на колонці Superose 12, врівноважену в буфері Трис (20мМ Трис, 150мМ NaCI (рН8,0)). Проводили порівняння зі стандартами. Зберігання. Рекомбінантні білки зберігали сухими та замороженими. Одержання модифікованих молекул TNFa може бути здійснено, як описано нижче: Вихідний матеріал: 500 літрів ферментованої культури Е.соlі., діафільтрували водою до приблизно 50 літрів. 1) Промивання клітин А) Розтавання замерзлої культури клітин Б) Центрифугування клітин протягом 10 хвилин при 4000хд В) Ресуспендування осаду у 50мМ Трисі, 150мМ NaCI, pH8,0 Повторювання етапів Б) і В) тричі 2) Гомогенізування клітин A) Розтавання замерзлої культури клітин Б) Центрифугування включень протягом 30 хвилин при 16500хд B) Промивання включень тричі 3М гуанідином, 1М NaCI, 5мМ EDTA, 20% цукрозою, 50мМ Трис, рН8,0. Центрифугування включень протягом 30 хвилин при 16500хд 3) Солюбілізація включень Ресуспендували осад у 6Μ гуанідині, 10мМ DTT, 150мМ NaCI, 5%-етанолі, 50мМ Трисі, рН=8,0. Використовували приблизно 1мл буфера/100мг осаду 4) Ультрафільтрація включень А) Видалення твердих домішок 0,45мкм фільтром Б) Видалення високомолекулярних компонентів фільтром 30 KD В) Концентрування включень фільтром 5 KD 5) Заміна буфер у Готували зразок для іонообмінної хроматографії. Замінювали буфер на 6Μ сечовину, 1мМ DTT у 50мМ Трисі, рН 8,0 за допомогою діафільтрацією. 6) ОС - Очи щення сефарозою Завантаження білка на ОС - сефарозну колонку. Промивання колонки чотирма об'ємами Α-буфера, елюювання білка 100% Б-буфера і збирання всіх фракцій TNFa Α-буфер: 6Μ сечовина, 1мМ DTT, 50мМ Трис/СІ, рН8. В-буфер: 6Μ сечовина, 1Μ NaCI, 1мМ UTT, 50мМ Трис/СІ, рН=8. 7) Складання TNFa людини Розведення білка до приблизно 0,1мг TNFa/мл у 6Μ сечовині, 1мМ DTT, 50мМ NaCI, 5% ЕЮН у 20мМ Трис/СІ рН8,8 і видалення сечовини поетапною діафільтрацією наступним буфером. A) 2 Μ Сечовина, 1мМ DTT, 150мМ NaCI у 20мМ Трис/СІ, рН8,8 - протягом ночі при 5°С Б) 1М Сечовина, 1мМ DTT/150мМ NaCI у 20мМ Трис/СІ рН=8,8 - вісім годин при 5°С B) 1мМ DTT, 150мМ NaCl у 20мМ Трис/СІ рН=8,8 - протягом ночі при 5°С Г) 150мМ NaCI у 20мМ Трис/СІ рН=8,8 - протягом ночі при 5°С 8) Зберігання аналога TNFa людини Концентрування білка до 1,0мг/мл і зберігання зразка при -20°С. Середовище ТВ Розчиняли середовище для культивування - Terrific Broth (ТВ) (GIBCO BRL 22711-22) у воді MiliQ згідно з інструкціями виробника. Автоклавували при 121°С протягом 20 хвилин. Карбеніцилін χ 100 маточний розчин (50мг/мл) Двонатрієву сіль карбеніциліну (Sigma C1389) розчиняли у воді MiliQ при концентрації 50мг/мл. Розчин фільтрували через 0,2мкм фільтр (Sterifix 0409 9206) 1PTG x 100 маточний розчин 100мМ Ізопропіл b-D-тіогалактопіранозид (IPTG, USB 17884) 1,19г IPTG розчиняли у 50мл води MiliQ. Розчин фільтрували через 0,2мкм фільтр (Sterifix 0/109 9206) Буфер BSB Буфер для суспендування бактерій 50мМ TRIS (основа Trisma, SigmaT1503) 0,5Μ NaCI (Ridel -de.Haen 31434) 5мМ DTT (DL-дитіотретіол, SIGMA D-0632) pH=8,0 PMSF 50мМ фенілметилсульфонілфторид/SIGMA №P-7626 розчиняли у 2-пропанолі Розчин лізозиму 10мг/мл лізозиму III сорту з білка яйця курки, (КФ 3.2.1.17) SIGMA №L-7001 Дезоксихолева кислота (7-дезоксихолева кислота) SIGMA №D-6750 ДНК-аза 1мг/мл ДНК-аза І, Дезоксирибонуклеаза І, (КФ 3.1.21.1) Boehringer Cat №1284932 Сечовина Сечовина (GibcoBRL 15716-020) Гуанідин Гідрохлорид гуанідину (Sigma G1505) 2-Пропанол Буфер для промивання 20мМ TRIS, (основа Trisma, Sigma T1503) 8Μ сечовина, (GibcoBRL 15716-020) 0,1% β-меркаптоетанол рН=8,0 Буфер для врівноваження 20мМ TRIS, (основа Trisma, Sigma T1503) 8Μ сечовина, (GibcoBRL 15716-020) 0,1% β-меркаптоетанол ПРИКЛАД 2 Експресія, очищення та складання модифікованих молекул TNFa Р2 і Р30 Вважається, що рекомбінантні білки ведуть себе по-різному протягом експресії, очищення і складання. Усі білки експресували у Е.coli і одержували рівень експресії 2-20%. Усі білки ідентифікували за допомогою Вестерн-блотингу, використовуючи комерційно доступні поліклональні антитіла кроля до TNFa людини. Конструкта TNFa експресували один за одним у 250мл культура х партіями 3-4л. Усі модифіковані білки TNFa експресували як включення й більш, ніж 85% чистих й складених білків одержували, як описано вище. Вміст білка визначали стандартним аналізом ВСА. Усі процедури очищення білка повторювали принаймні тричі окремо для кожної молекули і у всі х випадках окремі партії білка перевіряли і визнавали їх однаковими. Білки зберігали у концентраціях 0,2-1,0мг/мл у PBS при –20°C перед використанням. Використовували стандартні аналізи контролю якості, такі як гель електрофорез з ДСН з фарбуванням по Кумассі та сріблом окремих преператів білка. В усі х випадках білки відповідали очікуваним розмірам та мали більш ніж 85% чистоту. Молекули з епітопами, вставленими у положенні 4 (ФНП2-1 і ФНП30-4), експресувались на відносно малому рівні (приблизно 2%). Крім того, ці молекули було дуже важко очистити і особливо важко вони складалися. Обидві молекули, але особливо TNFa, не були дуже розчинними у PBS і намагалися осаджуватись протягом зберігання. ПРИКЛАД З Біологічна активність різних конструктів TNFa Пряму біологічну активність очищених молекул TNFa перевіряли у тесті L929, який є стандартним тестом in vitro для визначення біологічної активності TNFa. Як видно на Фіг.6, жодна з модифікованих молекул TNFa Р2 або Р30 не була здатна вбивати L929 клітини у діапазоні концентрацій, які визначали (до 60мг/мл). Комерційно доступна молекула рекомбінантного TNFa була повністю активною при приблизно 0,6нг/мл. Препарат TNFa був також повністю активний у повному діапазоні концентрацій, які визначали. ПРИКЛАД 4 Здатність модифікованих молекул TNFa викликати нейтралізуючі антитіла Кролів імунізували кожним з десяти конструктів, щоб перевірити, чи можуть вони викликати антитіла, здатні нейтралізувати біологічно активний TNFa людини in vitro. Використовували гр упи по три кролі й кожний кріль отримував 100мг TNFa підшкірно у повному ад'юванті Фройнда і потім 100мг приблизно кожен третій тиждень у неповному ад'юванті Фройнда. Протягом повного періоду 18 тижнів зразки крові збирали через рівні проміжки часу і сироватку перевіряли на активність проти TNFa у загальновживаному, комерційно доступному тесті ТІС А, чисті й немодифіковані молекули TNFa людини використовували як антиген. В усіх кролів утворювались антитіла до TNFa протягом терміну імунізації і максимальний рівень або титри антитіл змінювались з кожною декадою в кожній групі. Середні титри антитіл наведені на Фіг.7. ФНП2-5, ФНП27, ФНП2-3, ФНП2-1 і TNFa дикого типу викликали титр однієї сотні протягом 2-4 тижнів, тоді як ФНП2-4 викликав набагато слабкішу відповідь. Однакову кінетику спостерігали для білків ФНП30, де слабку відповідь також одержували після застосування ФНП30. Здатність сироватки взаємодіяти з TNFa людини і його рецептором перевіряли у L929 тесті та твердофазному тесті на зв'язування з рецептором. У L929 тесті розведення імунної сироватки та неімунної контрольної сироватки додавали до комерційно доступного TNFa людини перед додаванням суміші до L929 клітин. Сироватку усі х трьох кролів у кожній групі перевіряли двічі та рахували середні значення. Оскільки нормальна сироватка намагалася підвищити фонові значення системи визначення кольору, ці значення віднімали від усіх значень і вираховували відносне інгібування у відсотках. Результати тестування всіх кролів на інгібіторну здатність на 14 тиждень показані на Фіг.8. ΦΗΠ2-5, який не містить заміщень у будь-якому сегменті задніх ланцюгів β-складок, є набагато кращим порівняно з іншими конструктами, і ця молекула мала таку саму токсичність, як молекула TNFa ДТ стосовно здатності викликати нейтралізуючі антитіла (дані не наведені). ФНП2-3, який містить малий заміщений сегмент у D β-ланцюзі і ФНП2-7, який не містить жодного заміщеного сегмента ланцюгів задньої β-складки, також були здатні викликати інгібіторні антитіла, і титр нейтралізуючих антитіл до ФНП2-7 значно підвищився протягом наступних трьох тижнів (дані не наведені). ФНП2-4 і ФНП2-1, які містять G та В β-ланцюги, відповідно, задньої β-складки, були нездатними викликати нейтралізуючі антитіла у тесті L929. Результати стосовно білків ФНП30 були більш гетерогенними, хоча ФНП30-3 виявився найкращим на 14 тиждень. ФНП30-1 і ФНП30-4, які містять заміщення у G і В β-ланцюгах задньої β-складки, відповідно, не викликали нейтралізуючих антитіл у L929 тесті. У твердофазному тесті на зв'язування з рецептором рекомбінантний 55кДа рецептор 1 TNFa (TNF-R55) іммобілізували на мікротитрувальні планшети й комерційно доступний біотинильований TNFa людини додавали при належних розведеннях. Специфічне зв'язування рецептора визначали стрептавідином, з'єднаним з пероксидазою хріну, і хромогенним субстратом. При тестуванні сироватки імунізованих кролів сироватку додавали до біотинильованого розчину TNFa людини перед додаванням суміші до вкритого TNFR55 мікротитрувального планшета. Перевіряли сироватку з усі х трьох кролів в кожній групі й вираховували середні значення. Сироватку з неімунізованого кроля використовували як негативний контроль. Значення фону були дуже низькі й тест мав високу чутливість. Результати показані на Фіг.9. Видно, що результати, одержані у L929 тесті, і твердофазний тест на зв'язування з рецептором, відповідно, є майже ідентичним стосовно конструктів TNFa. У твердофазному тесті різниця між ФНП30-2, 30-3 і 30-5 не була значною, як спостерігали у L929 тесті. Твердофазний тест, проте, є більш відтворюваним завдяки його більш біохімічним, ніж клітинним особливостям, і значення нормальної сироватки не віднімали в цьому тесті. Відносну кількість сироватки (у відсотках), при якій відбувається половина максимального інгібування зв'язування TNFa (значення 1С), вираховували для ФНП2-3, ФНП2-5, ФНП2-7, ФНП30-2, ФНП30-3, ФНП30-5 і TNFa ДТ для кожної відповідної антисироватки. Припускаючи, що така сама форма буде і для антисироватки проти ФНП2-1, ФНП2-1, ФНП30-1 і ФНП30-4, виконували екстраполяцію, й значення IC50 також підраховували для цієї сироватки. Результати наведені у Таблиці 2. Таблиця 2 2-1 >100% Значення ІС 50 сироватки антитіл кроля проти TNFa людини у твердофазному тесті 2-3 2-4 2-5 2-7 ДТ 30-1 30-2 30-3 30-4 2,02% >100% 0,53% 1,38% 0,43% >100% 0,32% 0,82% >0,88% 30-5 1,69% Можна побачити, що ФНП2-5 такий самий, як і TNFa (ДТ) миші стосовно здатності викликати нейтралізуючі антитіла у кроля до TNFa миші. ФНП2-1, ФНП2-4, ФНП30-1 і ФНП30-4, які всі містять заміщення у В або G ланцюзі задньої β-складки, є дуже слабкими або навіть загалом нездатними викликати такі антитіла. Це вказує на те, що хоча ланцюги В і G задньої β-складки і не приймають участі у зв'язуванні з рецептором, мутації в цій зоні так чи інакше призводять до порушень в ділянках TNFa людини, що беруть участь у зв'язуванні з рецептором. Здається, що ФНП30-2 і ФНП30-3 також викликають нейтралізуючі антитіла. ПРИКЛАД 5. Здатність модифікованих молекул TNFa стимулювати Т-клітини зі здорових донорів крові, що містять Р2 і Р30 Оскільки очікувалось, що розташування Р2 і Р30 епітопів у модифікованих молекулах TNFa також могло би впливати на взаємодію з антигеном і на присутність вставлених епітопів, і, таким чином, їх імуногенність всі 10 молекул перевіряли у різних Т-клітинних тестах. Використовували тест з поліклональними ПМ і створювали кілька Р2 і Р30-специфічних Т-клітинних ліній, використовуючи загальновживані імунологічні способи для тестування пептидів і рекомбінантних білків TNFa зі вставленими Р2 і Р3 епітопами. Спочатку 28 здорових донорів за власним бажанням перевіряли у загальновживаному тесті з проліферацією ПМ на їх здатність відповідати на ТТ і пептиди Р2 і Р30. На основі цих результатів 19 пацієнтів, здатних створювати відповідь на ТТ, пептиди Р2 і Р30, відбирали для подальших експериментів. Хоча відповідь дуже змінювалась, це чітко підтвердило, що Р2 і Р30 є різнорідними так само, як і імунодомінанті Т клітинні епітопи. Окрім 28 донорів, також відбирали ще 7 донорів. За причин, пояснених нижче, деяких з них відбирали за їх здатність відповідати на Р30 або Р2. Кільком з них, крім того, вводили ТТ для того, щоб вони були здатними давати сильну Т-клітинну відповідь. Деякі з інших гр уп донорів також використовували Р2 або Р30-специфічні Т-клітинні лінії для того, щоб вивча ти присутність антигену Р2 і Р30-модифікованих синтетичних пептидів TNFa, також як і модифікованих молекул. На Фіг.10 наведений ілюстративний приклад поліклональної відповіді ПМ у трьох донорів стосовно ТТ, так само як і пептидів Р2 і Р30. Усі 10 рекомбінантних білків перевіряли тричі у принаймні 6 різних концентраціях, починаючи від приблизно 100мг/мл, і всі ПМ експерименти повторювали 2-3 рази для кожного пацієнта. Внутрішньоклітинне включення 3Н-міченого тимідину використовували для оцінювання Т-клітинної проліферації і результати експерименту підраховували у 96-лунковому планшеті. Підраховували індекси максимальної проліферації (ІП) кожної титрувальної кривої як зв'язок між середньою кількістю імпульсів за хвилину в експериментальних лунках, поділений на середню кількість імпульсів за хвилину, одержаних у лунках без антигену (лише PBS). Дані щодо проліферації Т-клітин одержували тричі, й Con А, також як і Р2 і Р30, використовували як негативний та позитивний контроль, відповідно. На Фіг.11 наведені три приклади експериментів для двох різних донорів крові, використовуючи різні Р2 і Р30 модифіковані молекули TNFa. JH лише дає відповідь на Р2, тоді як SP дає відповідь на обидва Р2 і Р30. Це також відображено у проліферативних відповідях на Р2 і Р30 модифіковані білки TNFa, які майже всі здатні стимулювати ПМ. На Фіг.12 наведені індекси проліферації (ІП), підраховані з 34 експериментів. Хоча дуже важко кількісно порівняти ІП між різними експериментами завдяки різним PBS фонам, здається ясним, що всі конструкти більше або менше, здатні викликати проліферативну відповідь. Серед другої гр упи донорів деякі пацієнти отримували вакцину до ТТ 1-2 місяці перед експериментами. ІП, одержані від цих пацієнтів (НВ, MR/ KG і MW) були найвищими серед спостережених для всіх модифікованих конструктів TNFa і дані було легко одержати. Трьох інших пацієнтів (Dh, ID і LS) піддавали вакцинації більш ніж 5 років тому, і вони всі виявили значення ІП нижче середніх. Це підтверджує, що ІП, які спостерігаються, були антигенспецифічними. Жодних даних стосовно останньої вакцинації ТТ не було відомо для першої групи донорів, але їх статус імунізації був дуже різним. Неможливо вибрати кращий білок TNFa 2 або TNFa 30, лише основуючись на середньому значенні ІП. Це може відбуватися завдяки гетерогенному статусу вакцинації пацієнтів, які приймали участь у ПМ тесті, одержані з пацієнтів з різним статусом відповіді. Було дивно, що Р2 і Р30 у всіх положеннях вставлення у TNFa виявились здатними вступати у взаємодію і презентуватися на Тклітинах. Були виконані деякі подальші експерименти для того, щоб виключити можливість того, що, незважаючи на повторювану афінну хроматографію, гельфільтрацію і діаліз, антигенні препарати могли все ж таки містити значні концентрації неспецифічних мітогенів. Донорів з другої групи, про яких відомо, що вони не утворюють відповіді на Р2 і відповідають на Р30, а також донорів з протилежним зразком відповіді перевіряли у ПМ теста х. На Фіг.13 показано відповідь на Р2/Р30, а також білки TNFa 2 і TNFa 30 для DL і ID. Можна побачити, що одержані специфічні відповіді для Т-клітинних епітопів і відповідно модифікованих молекул ФНПа. Проте не спостерігали жодної значної проліферативної відповіді DL проти білків TNFa 30 (верхній малюнок) і жодної значної проліферативної відповіді ID на білки TNFa 2 (нижній малюнок), що є підтвердженням відсутності неспецифічних мітогенів в очищених препаратах TNFa. Ця можливість була надалі перевірена використанням Р2 і Р30-специфічними лініями Т-клітин, одержаних з другої групи донорів, які культивували протягом принаймні шести тижнів та принаймні тричі піддавали стимуляції відповідними синтетичними Р2 і Р30 пептидами. На Фіг.14 показані результати двох таких експериментів. Можна побачити, що Р2 і Р30-специфічні лінії Т-клітин стимулювали лише їх відповідними білками Р2 і Р30. Крім того, можна знову побачити, що всі TNFa конструкти здатні викликати проліферацію Т-клітин, стверджуючи, що хоча реакція з антигеном може бути кількісно важливою для презентації Р2 і Р30, вона не є значним кількісним обмежуючим фактором для презентації антигену. У літературі є дані, що бічні ділянки епітопів Т-клітин можуть впливати на зв'язування антигенних пептидів з молекулами ГКГ класу II. Оскільки жодне з положень у TNFa, які були вибрані для вставки Р2 або Р30, не заважає презентації антигену, було досліджено, чи могли б різні бічні послідовності вставлених у TN Fa епітопів впливати на Т-клітинну відповідь на Р2 і Р30 епітопи як результат диференційного зв'язування молекулами HLA II класу людини. Таким чином були синтезовані пептиди, наведені в Таблиці 3, які представляють вставлені епітопи, а також бічні амінокислоти TNFa людини. Вони мають назву РР2-5, РР30-3 тощо. Послідовності амінокислот наведені у переліку послідовностей як SEQ ID NO: 34-SEQ ID NO: 42, названі як Pep2-1 - Рер30-5. Таблиця 3 2-1 2-3 2-4 2-5 2-7 Синтетичні пептиди, що представляють Р2 і Р30 і їх бічні ділянки TNFa SRTPSQYIKANSKFIGITELQLQWL 30-1 SRTPSFNNFTVSFWLRVPKVSASHL ERRAN A SQVLFQYIKANSKFIGITEUSRIA 30-2 ALLANFNNFTVSFWLRVPKVSASHL EQVL FK AEAKPQYIKANSKFIGITELGDRLS 30-3 YSQVLFNNFTVSFWLRVPKVSASHL EVSYQT EKGDRQYIKANSKFIGITELSGQVY 30-4 QRETRFNNFTVSFWLRVPKVSASHL EKGDRL ND 30-5 EKGDRFNNFTVSFWLRVPKVSASH LEGIIAL Ці пептиди використовували для стимуляції Р2 і Р30-специфічних ліній Т-клітин. Результати стимуляції Р30-ліній наведені на Фіг.15. Можна побачити, що Р2-специфічні лінії Т-клітин з MR і KG виявляють однакову відповідь на стимуляцію при стимуляції пептидом або відповідним білком TNFa 2. Ясно, що ФНП2-5 є добрим потенційним антигеном, і ці дані підтверджують, що проліферації Т-клітин, що спостерігали, є антигенспецифічними. Як правило, ніякої якісної різниці у стимуляції, коли Р30-специфічні лінії Т-клітин з MR і KG стимулювали пептидами або білками (дані не наведені), не було. Р30-специфічна лінія Т-клітин з НС краще розпізнавалась ФНП30-3 і трохи реагувала з ФНП30-2. ВИСНОВОК Було одержано і описано десять по-різному модифікованих білків TNFa людини. Вони були створені таким чином, що містили два добре відомі різнорідні епітопи Т-клітин - Р2 і Р30 для того, щоб бути потенційно імуногенними у принаймні 85% популяції. Всі білки були експресовані та очищені ФНП2-4 і ФНП30-4 в малій кількості. Мутації в цьому положенні у TNFa також заважають складанню, що призводить до поганої розчинності. Жодної біологічної активності TNFa не було виявлено для модифікованих молекул TNFa. Кролів імунізували всіма десятьма білками, а також природним TNFa. Через 2-3 місяці імунізації стало можливим виявити високі титри перехресно реагуючи х антитіл до людини, немодифіковані TNFa у всіх сироватках. Здатність цих антитіл заважати здійснювати біологічну активність природного TNFa перевіряли в різних тестах in vitro - L929 тесті та твердофазному тесті на зв'язування з рецептором. Обидва тести виявили, головним чином, одне й те саме: ФНП2-1, ФНП2-4, ФНП30-1 і ФНП30-1 не були здатні викликати нейтралізуючі антитіла, де ФНП2-5 був найкращим порівняно з іншими конструктами. ФНП30-2 і ФНП30-3 були однаково ефективними при викликанні нейтралізуючих антитіл і вдвічі кращі за ФНП30-5, який був достатньо ефективним. Дещо дивним було те, що не спостерігалося значної різниці між здатністю молекул стимулювати проліферацію ПМ. Було видно, що це відбувалось не завдяки присутності мітогенів в препаратах антигенів, і, враховуючі ці дані, дійшли до висновку, що положення, вибрані для Р2 і Р30, усі дозволяли присутність відповідних епітопів. Специфічність відповіді, крім того, підтверджували, використовуючи тестування модифікованих білків TNFct, епітопспецифічні лінії Т-клітин, а також синтетичні пептиди, представляючи вставлені епітопи, а також бокові послідовності TNFa. У цих експериментах було чітко показано, що ФНП2-5, ФНП30-2 і ФНП30-3 (серед інших конструктів) були найбільш сильними потенційними імуногенами. Перелік послідовностей (1) ЗАГ АЛЬНІ ДАНІ: (і) ЗАЯВНИК: (A) ІМ'Я: Farmaceutisk Laboratorium Ferring A/S (Б) ВУЛИЦЯ: Indertoften 10 (B) МІСТО: Vanloese (Γ) КРАЇН А: Данія (Д) ПОШТОВИЙ КОД: DK-2720 (іі) НАЗВА ВИНАХОДУ: Модифіковані TNFa - молекули людини, ДНК, що кодують TNFa - молекули, і вакцини, які включають модифіковані TNFa - молекули і ДНК (ііі) КІЛЬКІСТЬ ПОСЛІДОВНОСТЕЙ: 42 (iv) ЕЛЕКТРОННА ФОРМА: (A) ТИП НОСІЯ: Гнучкий диск (Б) КОМП'ЮТЕР: Сумісний з IBM (B) ОПЕРАЦІЙНА СИСТЕМА: PC-DOS/MS-DOS (Г) ПРОГРАМНЕ ЗАБЕЗПЕЧЕННЯ: Patentin Release 1.0, Версія 1,30 (ЕРО) (2) ДАНІ ЩОДО SEQ ID NO: 1: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477п.о. (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: к днк (iii) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) СПОСІБ ВИЗНАЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ:/старт-кодон=1 /функція="Антиген" /продукт= "аналог ФНПa" /доказ= експериментальний /ген-"tnfP2-1" /звичайна назва= "TNF2-1" (xi) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 1: (2) ДАНІ ЩОДО SEQ ID NO: 2: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 2: (2) ДАНІ ЩОДО SEQ ID NO: 3: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійний (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (ν) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) ІНШІ ДАНІ: /старт-кодон=1 /функція= "Антиген" /продукт= "аналог ФНПа" /ген- "tnfF2-3" /звичайна назва="TNF2-3" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO 3: (2) ДАНІ ЩОДО SEQ ID NO: 4: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (XI) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 4: (2) ДАНІ ЩОДО SEQ ID NO: 5: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) ІНШІ ДАНІ: /старт-кодон=1 /функція= "Антиген" /продукт= "аналог ФНПа" /ген= "tnfP2-4" /стандартна назва= "TNF2-4" (xi) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 5: (2) ДАНІ ЩОДО SEQ ID NO: 6: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ SEQ ID NO: 6: (2) ДАНІ ЩОДО SEQ ID NO: 7: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (А) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (Г) ІНШІ ДАНІ: /функція= "Антиген" /продукт= "аналог TNFa" /ген= "tnfP2-5" /стандартна назва ="TNF2-5" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 7: (2) ДАНІ ЩОДО SEQ ID NO: 8: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 8: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 9: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (А) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (В) ІНШІ ДАНІ: /функція= "Антиген" /продукт= "аналог TNFa" /ген= "tnfP2-7" /стандартна назва= "TNF2-7" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 9: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 10: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНІСТЬ: (А) ДОВЖИНА: 157 амінокислот (Б) ТИП: амінокислота (В) ТОПОЛОГІЯ: лінійна (ііі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ SEQ ID NO: 10: (2) ДАНІ ЩОДОSEQ ID NO: 11 (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: 1-10 (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (B) РОЗТАШУВАННЯ: 1...477 (Γ) ІНШІ ДАНІ: /старт-кодон=1 /функція="Антиген" /продукт= "аналог TNFa" /ген= "tnfP30-1" /стандартна назвав= "TNF30-1" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 11: (2) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: 12: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 12: (2) ДАНІ ЩОДО SEQ ID NO: 13: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (ν) АНТИЗМІСТОВНІСТЬ: НЕ МАЄ (νι) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (νιι) ОСОБЛИВОСТІ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) ІНШІ ДАНІ: /старт-кодон=1 /функція="Антиген" /продукт= "аналог TNFa" /ген= "tnfP30-2" /стандартна назва= "TNF30-2" (хі) ОПИС ПОСЛІДОВНОСТІ SEQ ID NO: 13: (2) ДАН! ЩОДО SEQ ID NO: 14: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ SEQ ID NO: 14: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 15: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (В) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) ІНШІ ДАНІ: /старт-кодон=1 /функція= Антиген" /продукт= "аналог TNFa" /ген= "tnfP30-3" /стандартна назва= "TNF30-З" (хі) ОПИС ПОСЛІДОВНОСТІ SEQ ID NO: 15: (2) ДАНІ ЩОДО SEQ ID NO: 16: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 16: (2) ІНФОРМАЦІЯ ДЛЯ SEQ ID NO: 17: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (νi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (B) ІНШІ ДАНІ: /старт-кодон=1 /функція= "Антиген" /продукт= "аналог TNFa" /ген= "tnfP30-4" /стандартна назва= "TNF30-4" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 17: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 18: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (Г) ТИП МОЛЕКУЛИ: білок (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 18: (2) ДАНI ЩОДО SEQ ID NO: 19: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 477 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: подвійна (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (А) ІМ'Я/КЛЮЧ: CDS (Б) РОЗТАШУВАННЯ: 1...477 (Γ) ІНШІ ДАНІ: /старт-кодон=1 /функція= "Антиген" /продукт= "аналог TNFa" /ген= "tnfP30-5" /стандартна назва= "TNF30-5" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 19: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ: SEQ ID NO: 20: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 159 амінокислот (Б) ТИП: амінокислота (B) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: білок (iii) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 20: (2) ДАНІ ЩОДО SEQ ID NO: 21: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 24 пари основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (К/)АНТИЗМІСТОВНІСТЬ: НЕМАЄ (i x) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: misc_feature (Б) РОЗТАШУВАННЯ: 1...24 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція="Праймер для клонування ПЛР ДНК, що кодує TNFa" /продукт="Зв'язування праймеру з геном TNFa" /доказ= експериментальний /стандартна назва= "Праймер І TNFa" /мітка= Праймер І (і) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 21: GAC AAGCOOA TGGTOAGATO ATCT (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 22: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 30 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (iv) ОСОБЛИВІСТЬ: (А) ІМ"Я/КЛЮЧ: miscjeature (Б) РОЗТАШУВАННЯ: 1..30 (В) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує ФНПa" /продукт= "Зв'язування праймеру з геном TNFa" /доказ= експериментальний /стандартна назва= "Праймер II TNFa" /мітка= Праймер 2 (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 22: TCTCTAGAGGGCAATCATCCCAAAGTAGAC (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 23: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 21 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: ДНК (геномна) (iii) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (іх) ОСОБЛИВОСТІ: (A) ІМ'Я/КЛЮЧ: misc_feature (Б) РОЗТАШУВАННЯ: 1...21 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Γ) ІНШІ ДАНІ: /функція= "Праймер для тонування ПЛР ДНК, що кодує TNFa" /продукт= "Зв'язування праймеру з геном TNFa" /доказ= експериментальний /стандартна назва= "Праймер III TNFa" /мітка= Праймер 3 (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 23: CCCAAAGTAG ACCTGCCCAG A (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 24: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 69 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (їх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 7...51 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для тонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут2-1"" /мітка= мут2-1 /примітка= "Праймер "мут2-1"" синтетично синтезований 69-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 24: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 25: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 73 пари основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (А) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 15…59 (В) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут2-3"" /мітка= мут2-3 /примітка= "Праймер "мут2-3"" синтетично синтезований 73-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEO ID NO: 25: (2) ДАНІ ЩОДО SEQ ID NO: 26: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 75 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (їх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 12…56 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут2-4"" /мітка= мут2-4 /примітка= "Праймер "мут2-4" синтетично синтезований 75-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 26: (2) ДАНІ ЩОДО SEQ ID NO: 27: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 75 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 8…52 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут2-5"" /мітка= мут2-5 /примітка= "Праймер "мут2-5"" синтетично синтезований 75-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 27: (2) ДАНІ ЩОДО SEQ ID NO: 28: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (А) ДОВЖИНА: 80 пар основ (Б) ТИП: нуклеїнова кислота (В) ЛАНЦЮГОВІСТЬ: одиничний (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: "Homo sapiens" (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 14...58 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для кпонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут2-7"" /мітка= мут2-7 /примітка= "Праймер "мут2-7"" синтетично синтезований 80-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена ΤΝFα людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 28: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 29: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 96 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ,: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 10...72 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут30-1"" /мітка= мут30-1 /примітка= "Праймер "мут30-1"" синтетично синтезований 96-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 29: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 30: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 100 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: ДНК (геномна) (iii) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВОСТІ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 12..74 (B) метод визначення: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут30-2"" /мітка= мут30-2 /примітка= "Праймер "мут30-2"" синтетично синтезований 100-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 30: (2) ДАНІ ЩОДО SEQ ID NO: 31: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 100 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (ii) ТИП МОЛЕКУЛИ: ДНК (геномна) (iii) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 12...74 (B) МЕТОД ІДЕНТИФІКАЦІЇ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут30-3"" /мітка= мут30-3 /примітка^ "Праймер "мут30-3"" синтетично синтезований 100-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFIa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID NO: 31: (2) ДАНІ ЩОДО SEQ ID NO: 32: (і) ВЛАСТИВОСТІ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 100 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (геномна) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: insertion_seq (Б) РОЗТАШУВАННЯ: 15...77 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут30-4"" /мітка= мут30-4 /примітка= "Праймер "мут30-4"" синтетично синтезований 100-мерний олігонуклеотид, що містить ДНК, що кодує Т-клітинний епітоп Р2 людини між ланцюгами ДНК, гомологічної ланцюгам гена TNFa людини" (хі) ОПИС ПОСЛІДОВНОСТІ: SEQ ID 32: (2) ДАНІ ЩОДО ПОСЛІДОВНОСТІ SEQ ID NO: 33: (і) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 100 пар основ (Б) ТИП: нуклеїнова кислота (B) ЛАНЦЮГОВІСТЬ: одинична (Г) ТОПОЛОГІЯ: лінійна (іі) ТИП МОЛЕКУЛИ: ДНК (генотип) (ііі) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (iv) АНТИЗМІСТОВНІСТЬ: НЕМАЄ (vi) ДЖЕРЕЛО ПОХОДЖЕННЯ: (А) ОРГАНІЗМ: Homo sapiens (іх) ОСОБЛИВІСТЬ: (A) ІМ'Я/КЛЮЧ: lnsertion_seq (Б) РОЗТАШУВАННЯ: 14...76 (B) МЕТОД ВИЗН АЧЕННЯ: експериментальний (Г) ІНШІ ДАНІ: /функція= "Праймер для клонування ПЛР ДНК, що кодує TNFa" /доказ= експериментальний /організм= "Homo sapiens" /стандартна назва= "Праймер "мут30-5""
ДивитисяДодаткова інформація
Назва патенту англійськоюModified tnf a- molecules, dna coding modified a- molecules and vaccines comprising modified tnf a-molecules and dna
Назва патенту російськоюМодифицированные tnf a- молекулы, днк, кодирующая модифицированные tnf a- молекулы и вакцины, которые включают модифицированные tnf a-молекулы и днк
МПК / Мітки
МПК: A61P 29/00, C07K 16/24, A61P 19/02, A61P 11/06, C07K 14/33, G01N 33/53, C12P 21/02, C07K 14/525, C12N 15/09, A61P 1/04, C12N 1/19, C12N 5/10, A61P 3/10, C07K 19/00, C12N 1/21, A61P 19/10, A61K 39/00, A61P 35/00, A61K 38/22, A61P 17/06, C12N 1/15
Мітки: tnf-a, модифікована, молекула
Код посилання
<a href="https://ua.patents.su/50-72440-modifikovana-molekula-tnf-a.html" target="_blank" rel="follow" title="База патентів України">Модифікована молекула tnf-a</a>
Попередній патент: Поворотний затвор
Наступний патент: Спосіб передачі даних, система з використанням такої передачі, передавач і приймач для передачі/прийому цифрових даних
Випадковий патент: Підйомний клапан