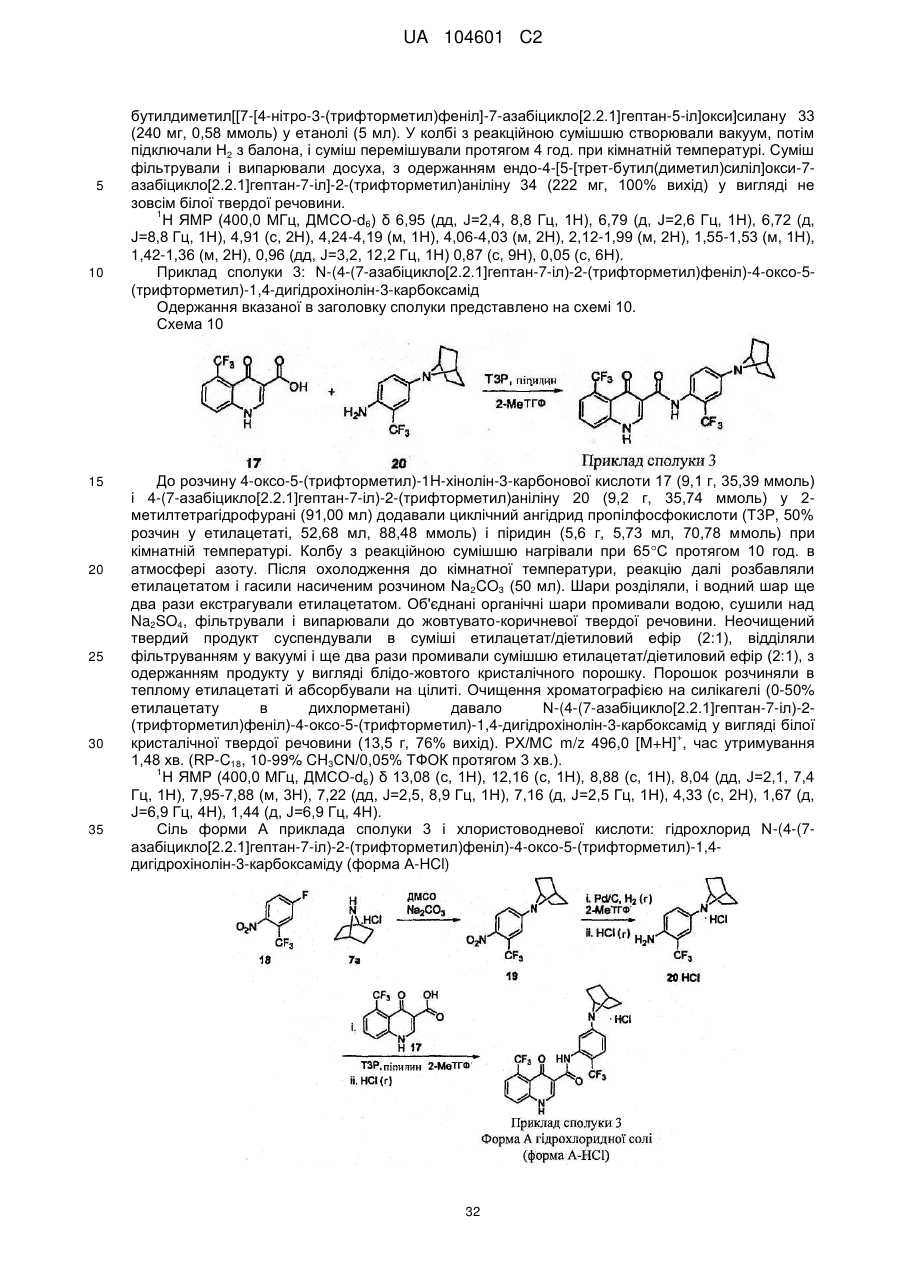
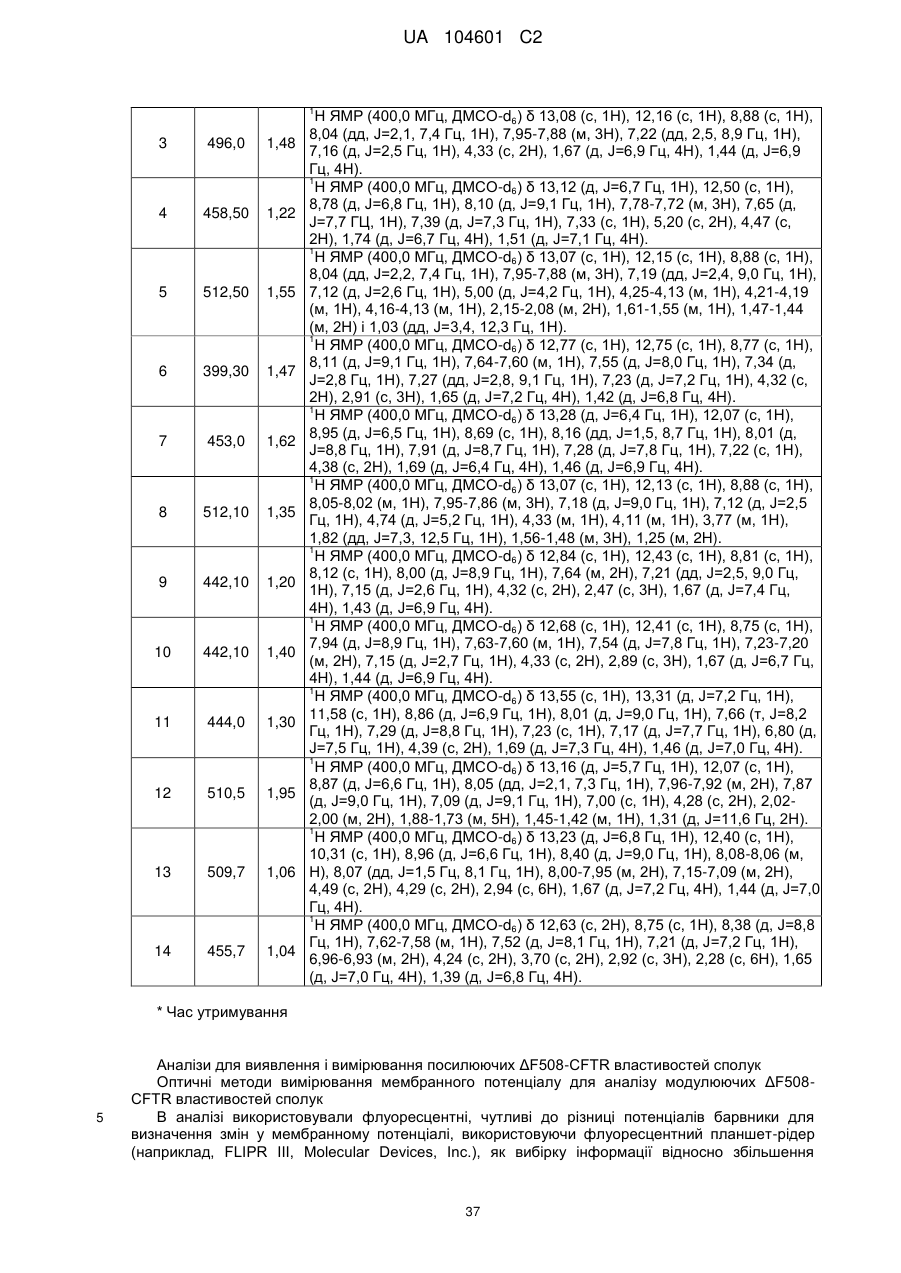
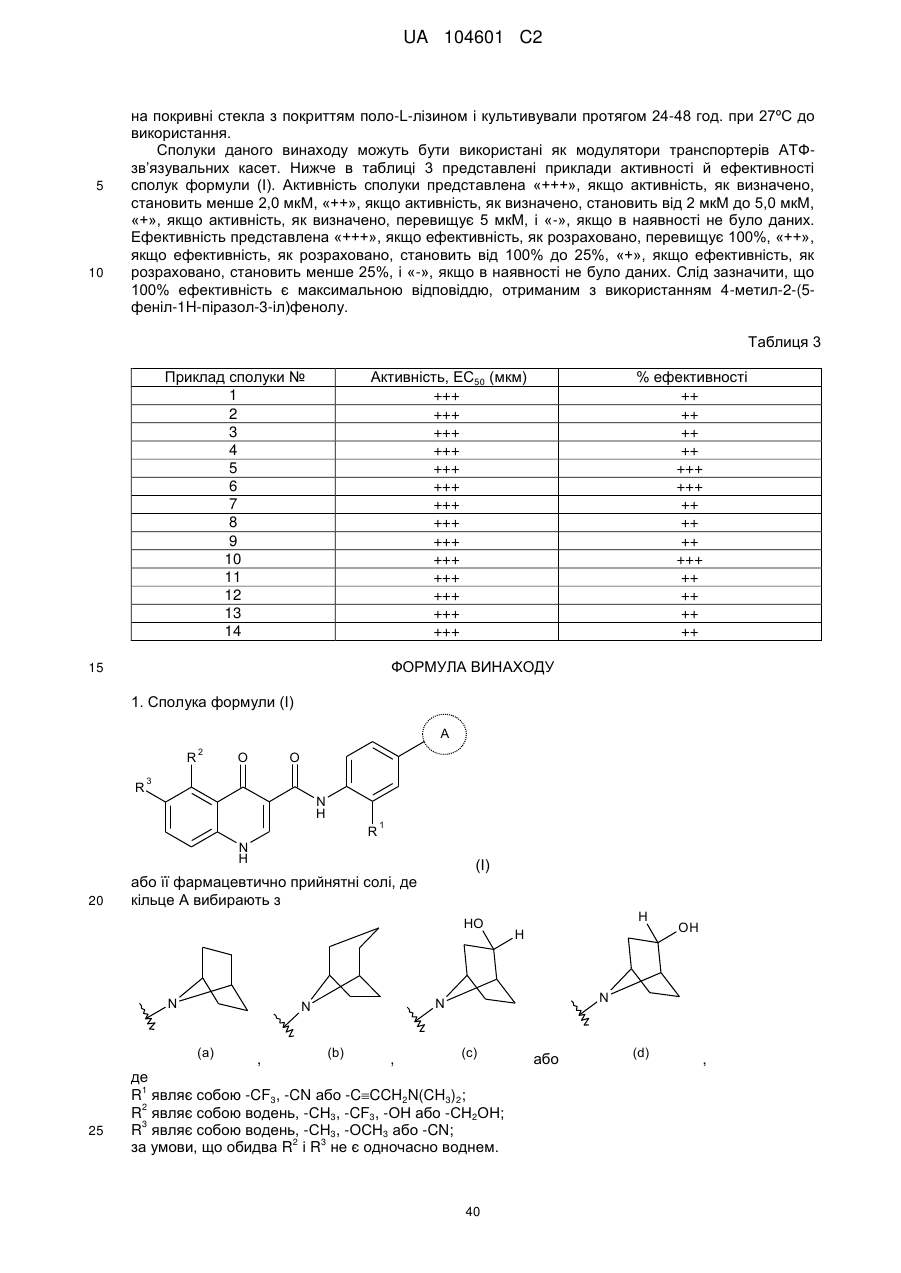
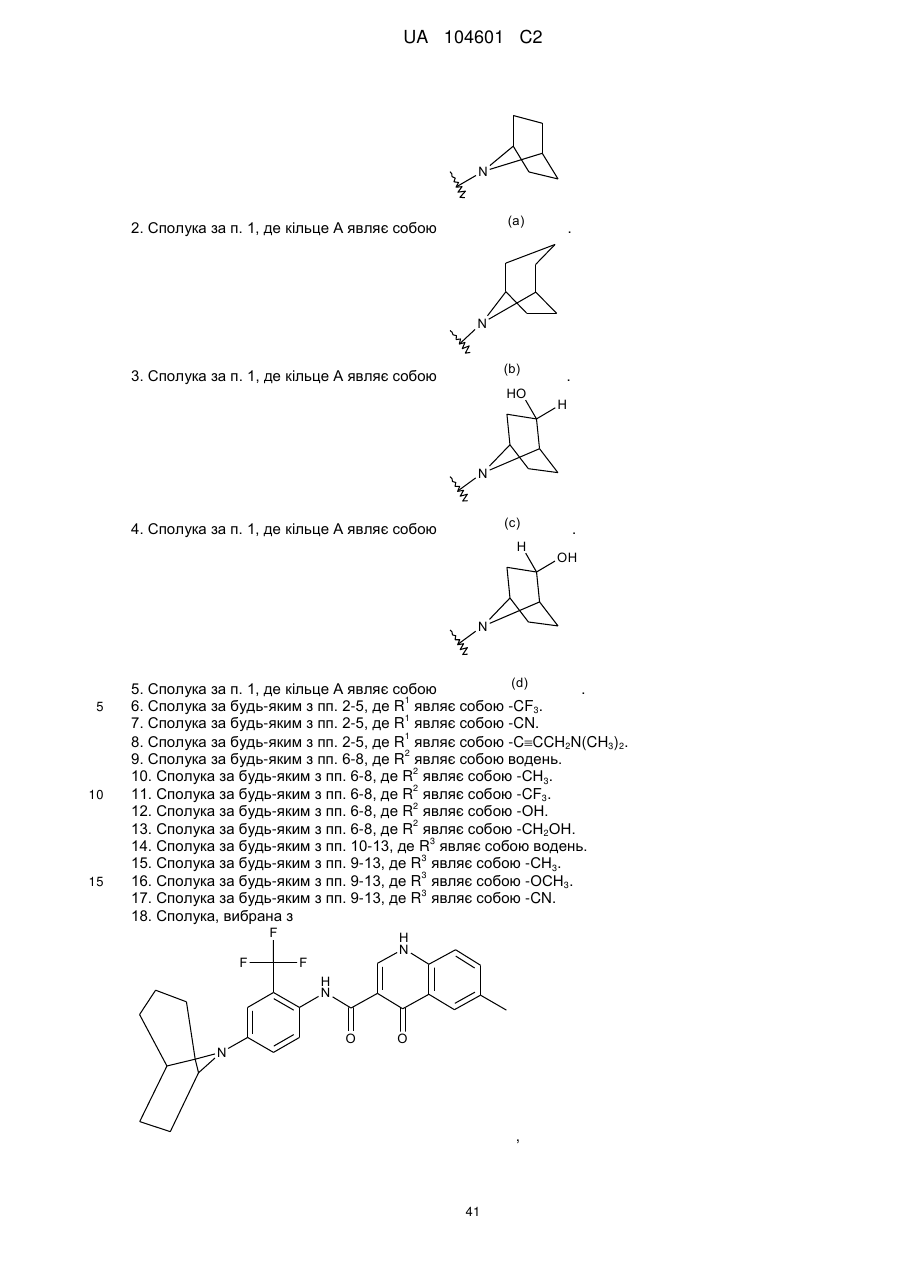
Модулятори регулятора трансмембранної провідності при муковісцидозі
Номер патенту: 104601
Опубліковано: 25.02.2014
Автори: Янг Сяоцин, Ботфілд Мартін, Бінч Хейлі, Гротенхейс Петер Д.Й., Харлі Деніс, Сіліна Аліна, Шет Урві, Нума Мехді Мішель Джамель, Ван Гур Фредрік, Феннінг Лев Т.Д.
Формула / Реферат
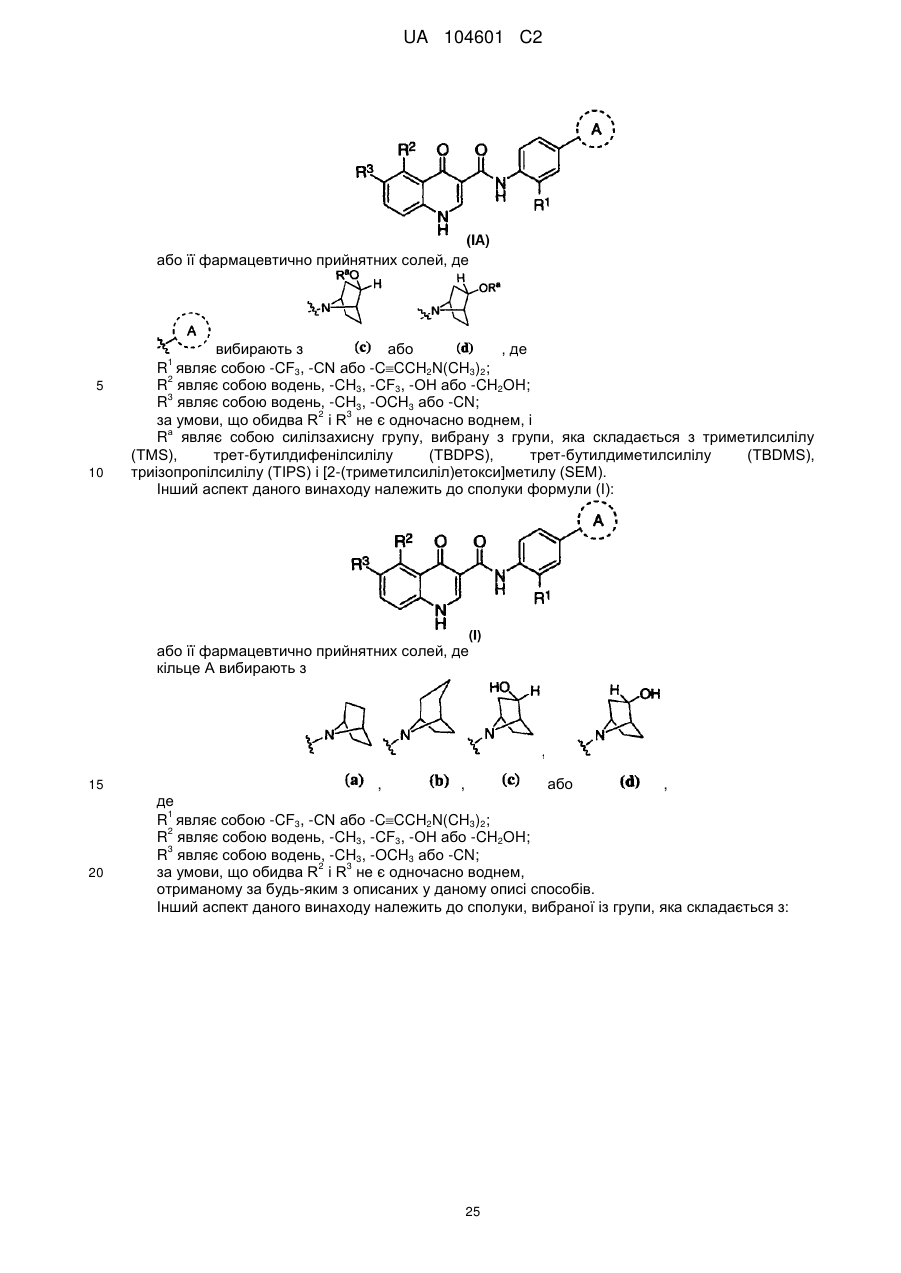
1. Сполука формули (І)
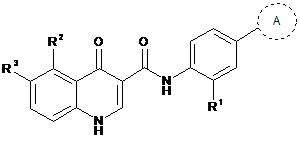 (І)
(І)
або її фармацевтично прийнятні солі, де
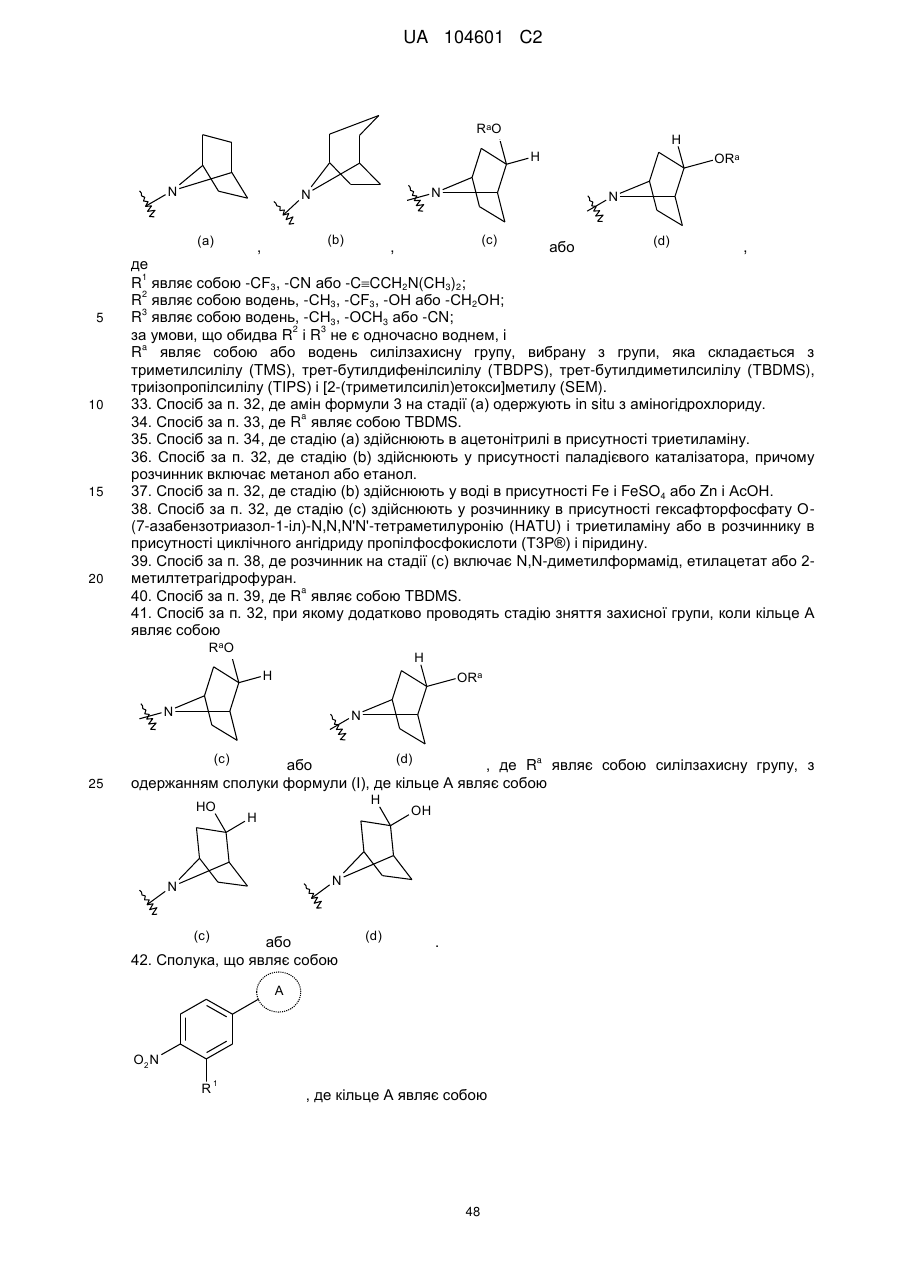
кільце А вибирають з
 ,
,  ,
,  або
або  ,
,
де
R1 являє собою -CF3, -CN або -CºCCH2N(CH3)2;
R2 являє собою водень, -СН3, -CF3, -ОН або -СН2ОН;
R3 являє собою водень, -СН3, -ОСН3 або -CN;
за умови, що обидва R2 і R3 не є одночасно воднем.
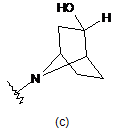
2. Сполука за п. 1, де кільце А являє собою  .
.
3. Сполука за п. 1, де кільце А являє собою  .
.
4. Сполука за п. 1, де кільце А являє собою  .
.
5. Сполука за п. 1, де кільце А являє собою  .
.
6. Сполука за будь-яким з пп. 2-5, де R1 являє собою -CF3.
7. Сполука за будь-яким з пп. 2-5, де R1 являє собою -CN.
8. Сполука за будь-яким з пп. 2-5, де R1 являє собою -CºCCH2N(CH3)2.
9. Сполука за будь-яким з пп. 6-8, де R2 являє собою водень.
10. Сполука за будь-яким з пп. 6-8, де R2 являє собою -СН3.
11. Сполука за будь-яким з пп. 6-8, де R2 являє собою -CF3.
12. Сполука за будь-яким з пп. 6-8, де R2 являє собою -ОН.
13. Сполука за будь-яким з пп. 6-8, де R2 являє собою -СН2ОН.
14. Сполука за будь-яким з пп. 10-13, де R3 являє собою водень.
15. Сполука за будь-яким з пп. 9-13, де R3 являє собою -СН3.
16. Сполука за будь-яким з пп. 9-13, де R3 являє собою -ОСН3.
17. Сполука за будь-яким з пп. 9-13, де R3 являє собою -CN.
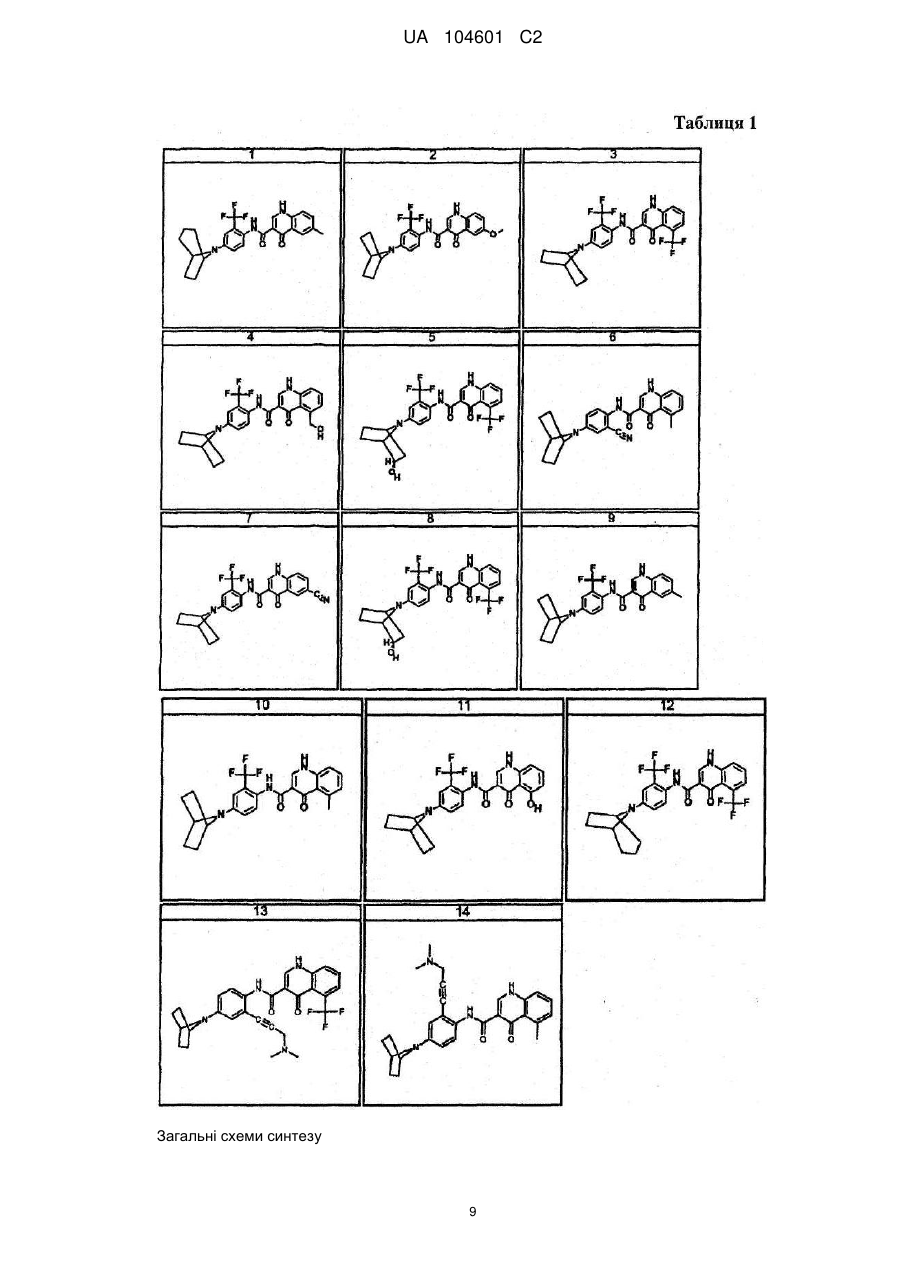
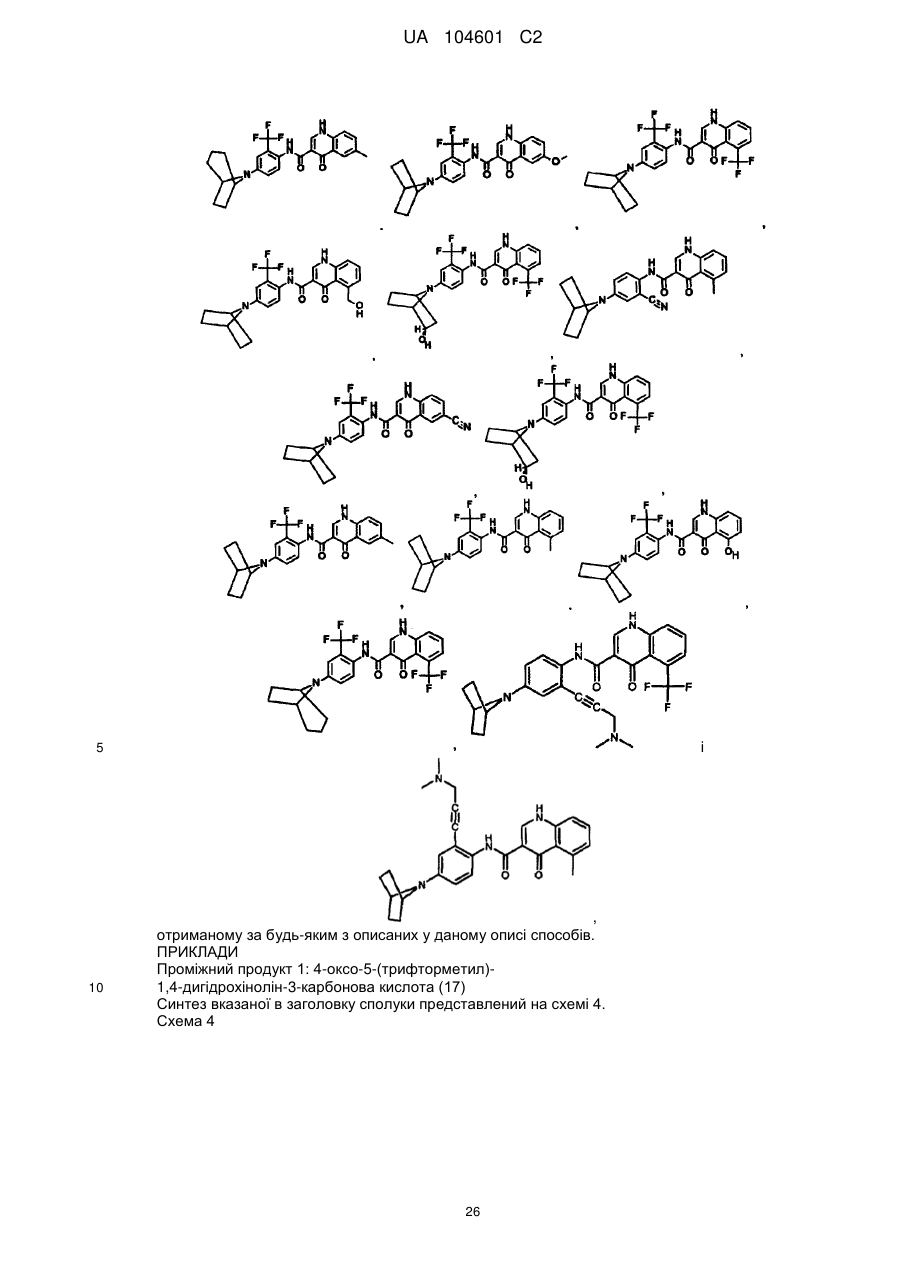
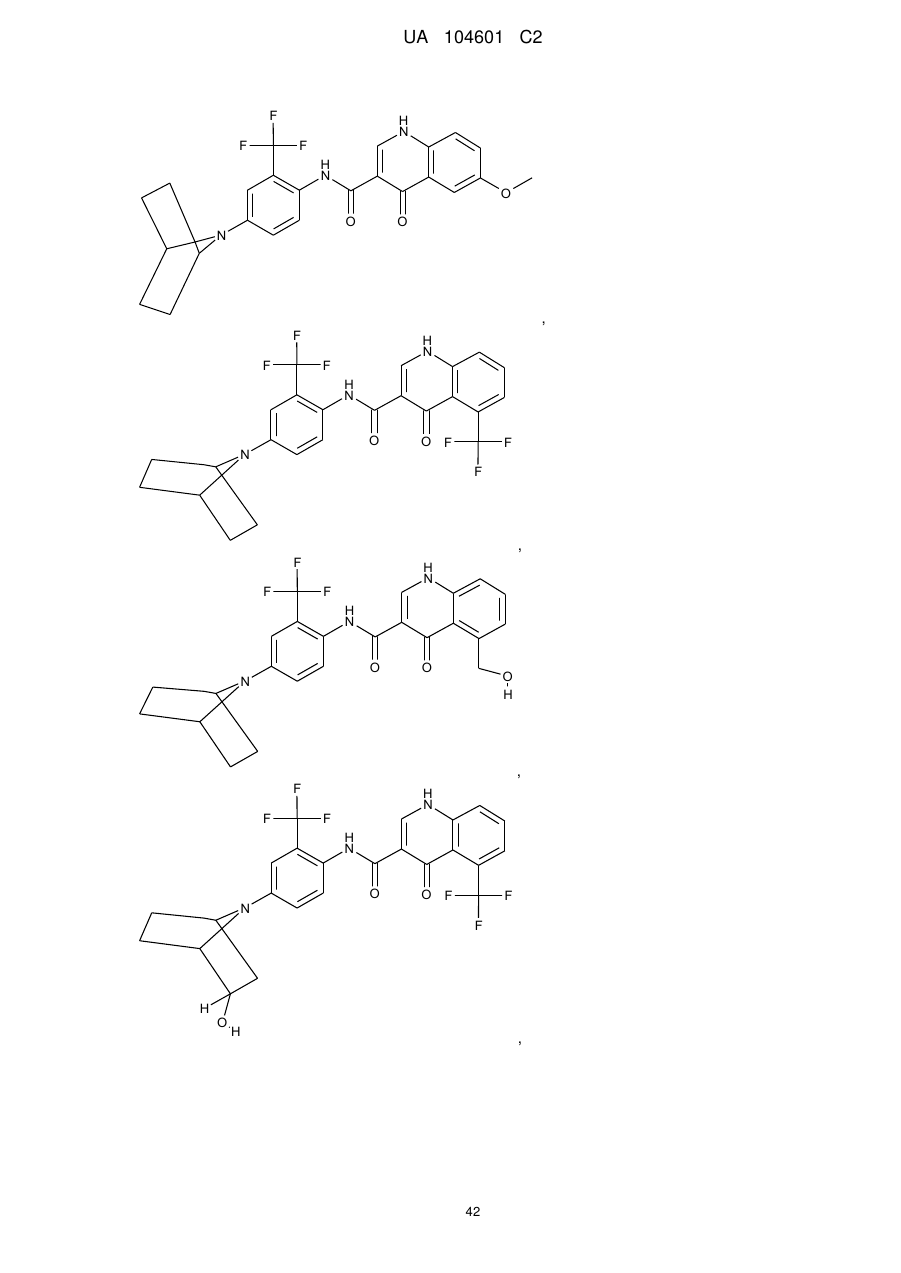
18. Сполука, вибрана з
 ,
,
 ,
,
 ,
,
 ,
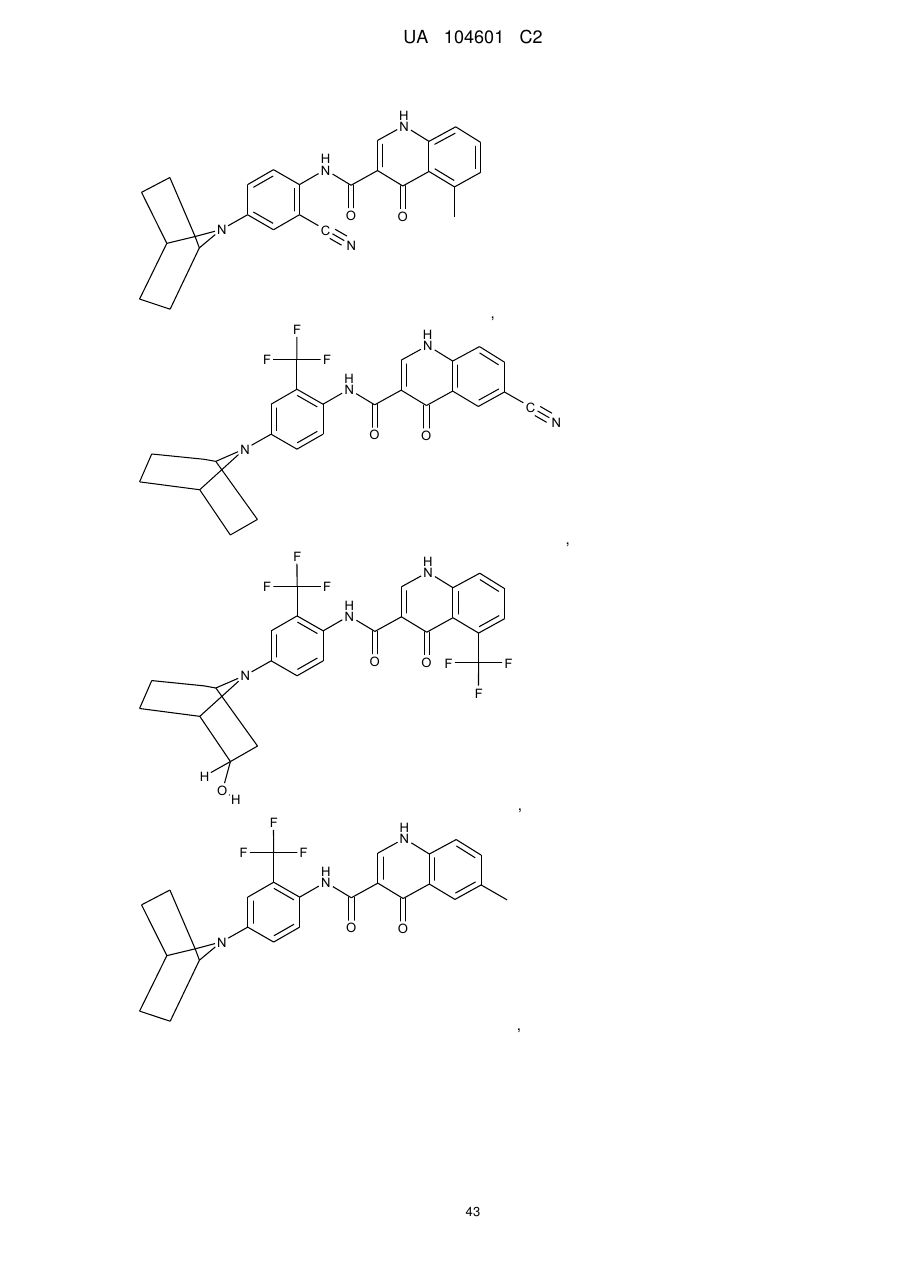
,
 ,
,
 ,
,
 ,
,
 ,
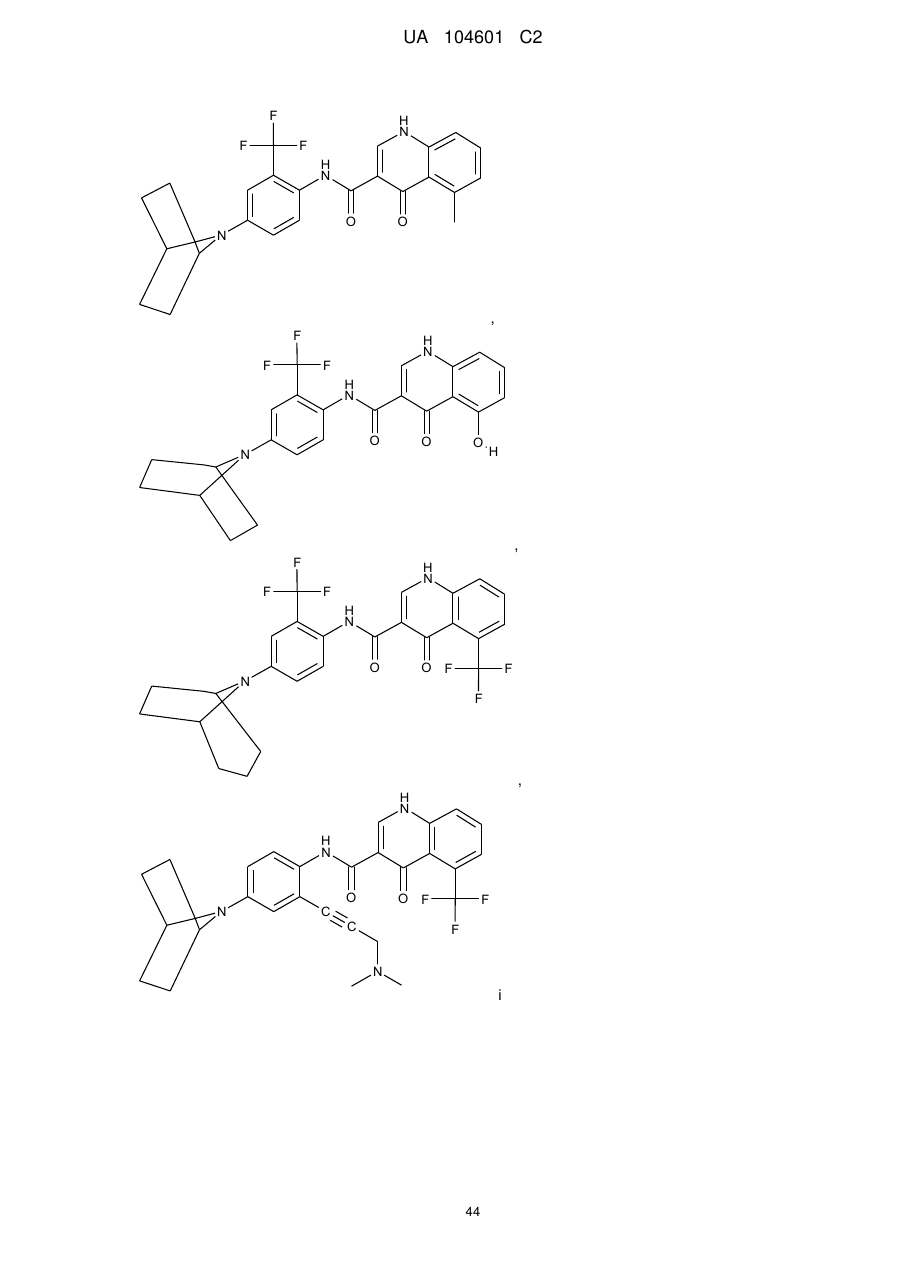
,
 ,
,
 ,
,
 ,
,
 ,
,
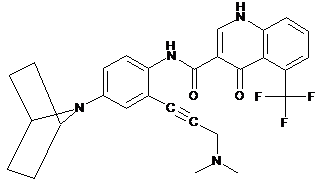 і
і
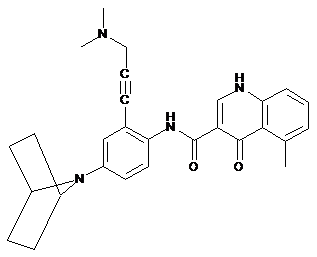 .
.
19. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-18 і фармацевтично прийнятний носій або ад'ювант.
20. Фармацевтична композиція за п. 19, яка додатково містить додатковий засіб, вибраний з муколітичного засобу, бронходилататора, антибіотика, протиінфекційного агента, протизапального засобу, модулятора CFTR, який відрізняється від сполуки формули (І), або поживної речовини.
21. Фармацевтична композиція за п. 20, де зазначеним додатковим засобом є модулятор CFTR, який відрізняється від сполуки формули (І).
22. Спосіб лікування або ослаблення тяжкості захворювання у пацієнта, де зазначене захворювання вибирають з муковісцидозу, астми, викликаного палінням COPD, хронічного бронхіту, риносинуситу, запору, панкреатиту, недостатності підшлункової залози, чоловічої безплідності, викликаної уродженою двосторонньою відсутністю сім'явивідних проток (CBAVD), захворювання легень легкого ступеня, ідіопатичного панкреатиту, алергійного бронхолегеневого аспергільозу (АВРА), захворювання печінки, спадкової емфіземи, спадкового гемохроматозу, дефектів коагуляції-фібринолізису, такого як дефіцит білка С, спадкової хвороби Квінке типу 1, дефектів процесування ліпідів, таких як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомальних хвороб накопичення, таких як хвороба І-клітин/псевдо-Гурлера, мукополісахаридози, хвороба Сандхоф/Тея-Сакса, хвороба Криглер-Наджар типу II, поліендокринопатія/гіперінсулінемія, цукровий діабет, карликовість Ларона, дефіцит мієлопероксидази, первинний гіпопаратиреоз, меланоми, гліканоз CDG типу 1, уроджений гіпертиреоз, остеопсатироз, спадкова гіпофібриногенемія, дефіцит альфа1-антихімотрипсину (ACT), нецукровий діабет (DI), нейрогенний DI, нефрогенний DI, синдром Шарко-Марі-Тута, хвороба Перліцеуса-Мерцбахера, нейродегенеративних захворювань, таких як хвороба Альцгеймера, хвороба Паркінсона, бічний аміотрофічний склероз, прогресуючий над'ядерний параліч, хвороба Піка, декількох поліглутамінових неврологічних розладів, таких як хвороба Хантінгтона, спіномозочкова атаксія типу І, спінальна і бульбарна м'язова атрофія, денторубропалідолюїсова атрофія і міотонічна дистрофія, а також губчатих енцефалопатій, таких як спадкова хвороба Крейтцфельдта-Якоба (через дефект процесування пріонних білків), хвороба Фабрі, синдром Страусслера-Шейнкера, COPD, сухість очей, недостатність підшлункової залози, остеопороз, остеопенія, синдром Горема, порушення каналів для іонів хлору, уроджена міотонія (форми Томсена і Беккера), синдром Бартера типу III, хвороба Дента, стартова хвороба, епілепсія, лізосомальна хвороба накопичення, синдром Ангельмана, первинна циліарна дискінезія (PCD), PCD зі зворотним розташуванням внутрішніх органів (також відома як синдром Картагенера), PCD без зворотного розташування внутрішніх органів і циліарна аплазія, або хвороби Шегрена, при якому вводять зазначеному пацієнту ефективну кількість сполуки за будь-яким з пп. 1-18.
23. Спосіб за п. 22, де зазначеним захворюванням є муковісцидоз.
24. Спосіб лікування або ослаблення тяжкості захворювання, пов'язаного з ослабленням функції CFTR унаслідок мутацій у кодуючому CFTR гені або факторів навколишнього середовища, у пацієнта, при якому вводять зазначеному пацієнту ефективну кількість сполуки за будь-яким з пп. 1-18, де зазначеним захворюванням є муковісцидоз, хронічний бронхіт, рецидивуючий бронхіт, гострий бронхіт, чоловіча безплідність, викликана уродженою двосторонньою відсутністю сім'явивідних проток (CBAVD), жіноча безплідність, викликана уродженою відсутністю матки і піхви (CAUV), ідіопатичний хронічний панкреатит (ІСР), ідіопатичний рецидивуючий панкреатит, ідіопатичний гострий панкреатит, хронічний риносинусит, первинний склерозуючий холангіт, алергійний бронхолегеневий аспергільоз, діабет, сухість очей, запор, алергійний бронхолегеневий аспергільоз (АВРА), кісткові хвороби або астма.
25. Спосіб лікування або ослаблення тяжкості захворювання, пов'язаного з нормальною функцією CFTR, у пацієнта, при якому вводять зазначеному пацієнту ефективну кількість сполуки за будь-яким з пп. 1-18.
26. Спосіб за п. 25, де зазначеним захворюванням є хронічне обструктивне захворювання легень (COPD), хронічний бронхіт, рецидивуючий бронхіт, гострий бронхіт, риносинусит, запор, хронічний панкреатит, рецидивуючий панкреатит і гострий панкреатит, недостатність підшлункової залози, чоловіча безплідність, викликана уродженою двосторонньою відсутністю сім'явивідних проток (CBAVD), захворювання легень легкого ступеня, ідіопатичний панкреатит, захворювання печінки, спадкова емфізема, жовчні конкременти, шлунково-стравохідний рефлюкс, шлунково-кишкові злоякісні новоутворення, запальне захворювання кишечнику, запор, діабет, артрит, остеопороз або остеопенія.
27. Спосіб за п. 25, де зазначеним захворюванням є спадковий гемохроматоз, дефекти коагуляції-фібринолізису, такі як дефіцит білка С, спадкова хвороба Квінке типу 1, дефекти процесування ліпідів, такі як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомальні хвороби накопичення, такі як хвороба І-клітин/псевдо-Гурлера, мукополісахаридози, хвороба Сандхоф/Тея-Сакса, хвороба Криглер-Наджар типу II, поліендокринопатія/гіперінсулінемія, цукровий діабет, карликовість Ларона, дефіцит мієлопероксидази, первинний гіпопаратиреоз, меланома, гліканоз CDG типу 1, уроджений гіпертиреоз, остеопсатироз, спадкова гіпофібриногенемія, дефіцит альфа1-антихімотрипсину (ACT), нецукровий діабет (DI), нейрогенний DI, нефрогенний DI, синдром Шарко-Марі-Тута, хвороба Перліцеуса-Мерцбахера, нейродегенеративні захворювання, такі як хвороба Альцгеймера, хвороба Паркінсона, бічний аміотрофічний склероз, прогресуючий над'ядерний параліч, хвороба Піка, декілька поліглутамінових неврологічних розладів, таких як хвороба Хантінгтона, спіномозочкова атаксія типу І, спінальна і бульбарна м'язова атрофія, денторубропалідолюїсова атрофія і міотонічна дистрофія, а також губчаті енцефалопатії, такі як спадкова хвороба Крейтцфельдта-Якоба (через дефект процесування пріонних білків), хвороба Фабрі, синдром Страусслера-Шейнкера, синдром Горема, порушення каналів для іонів хлору, уроджена міотонія (форми Томсена і Беккера), синдром Бартеру типу III, хвороба Дента, стартова хвороба, епілепсія, лізосомальна хвороба накопичення, синдром Ангельмана, первинна циліарна дискінезія (PCD), PCD зі зворотним розташуванням внутрішніх органів (також відома як синдром Картагенера), PCD без зворотного розташування внутрішніх органів і циліарної аплазії або хвороба Шегрена.
28. Набір для застосування при вимірюванні активності CFTR або його фрагмента в біологічному зразку in vitro або in vivo, що включає
(і) композицію, яка містить сполуку формули (І) за будь-яким з пп. 1-18,
(іі) інструкції відносно
a) приведення композиції в контакт із біологічним зразком і
b) вимірювання активності зазначеного CFTR або його фрагмента.
29. Набір за п. 28, що додатково містить інструкції відносно
a) приведення додаткової сполуки в контакт із біологічним зразком;
b) вимірювання активності зазначеного CFTR або його фрагмента в присутності зазначеної додаткової сполуки і
c) порівняння активності CFTR або його фрагмента в присутності додаткової сполуки з активністю CFTR або його фрагмента в присутності сполуки формули (І) за будь-яким з пп. 1-18.
30. Набір за п. 29, де стадія порівняння активності CFTR або його фрагмента забезпечує показник щільності CFTR або його фрагмента.
31. Спосіб модулювання активності CFTR у біологічному зразку, при якому проводять стадію приведення зазначеного CFTR у контакт зі сполукою за будь-яким з пп. 1-18.
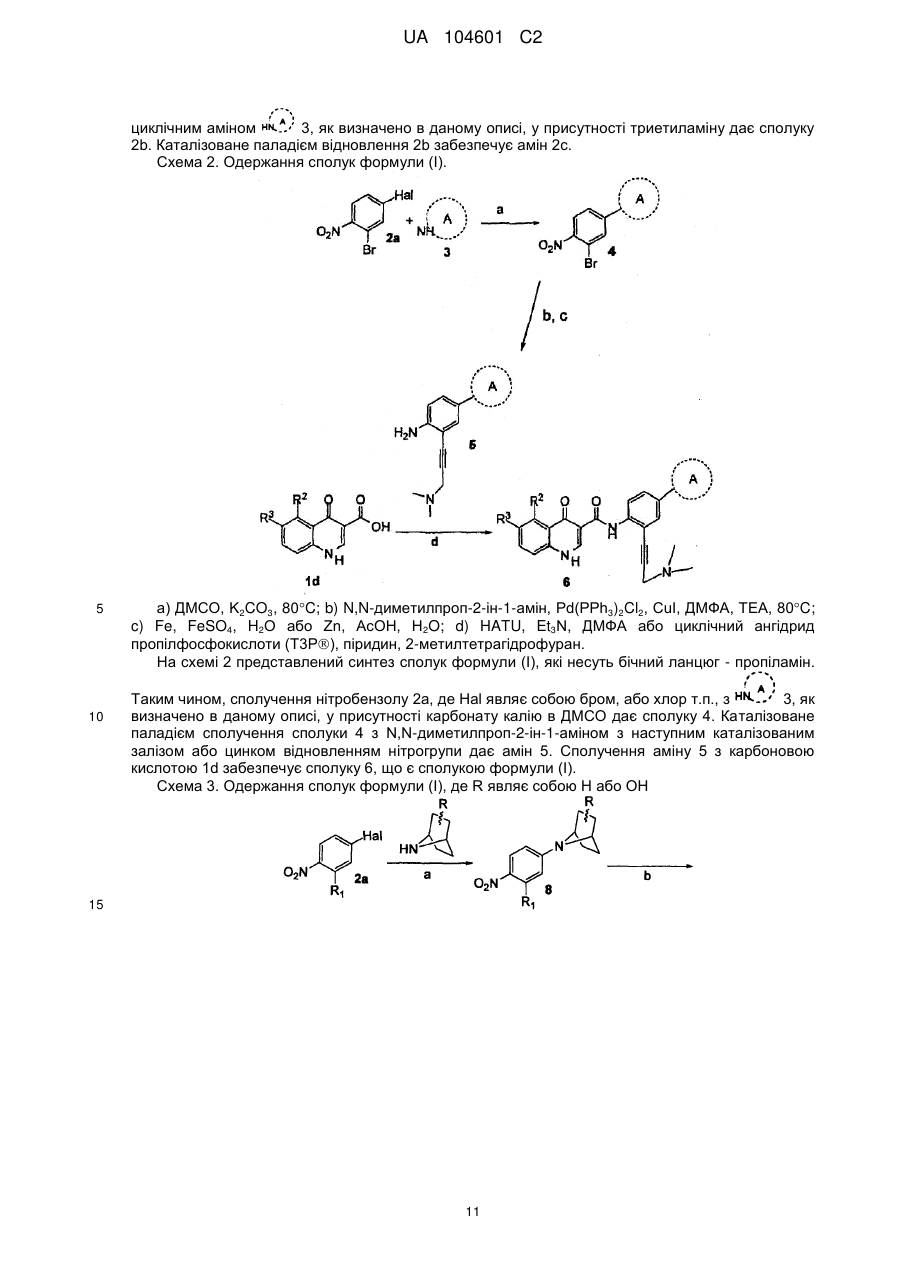
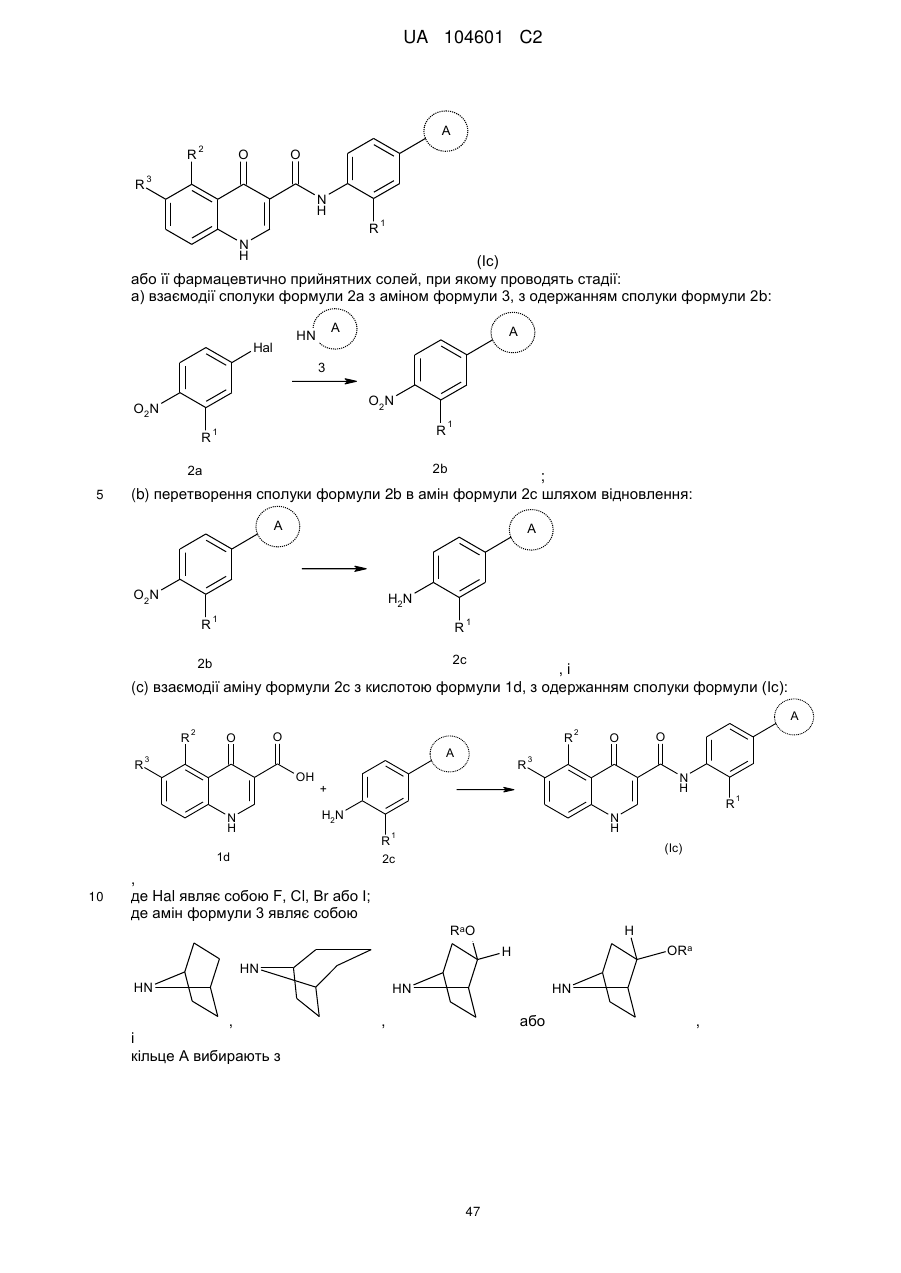
32. Спосіб одержання сполуки формули (Іс)
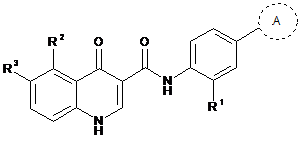 (Іс)
(Іс)
або її фармацевтично прийнятних солей, при якому проводять стадії:
а) взаємодії сполуки формули 2а з аміном формули 3, з одержанням сполуки формули 2b:
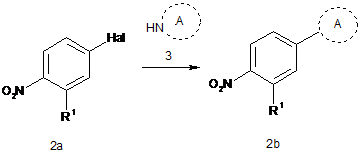 ;
;
(b) перетворення сполуки формули 2b в амін формули 2с шляхом відновлення:
 , і
, і
(c) взаємодії аміну формули 2с з кислотою формули 1d, з одержанням сполуки формули (Іс):
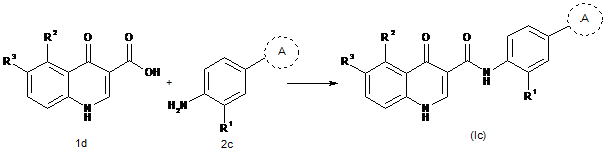 ,
,
де Hal являє собою F, Сl, Вr або І;
де амін формули 3 являє собою
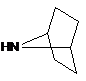 ,
, 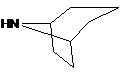 ,
,  або
або 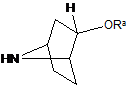 ,
,
і
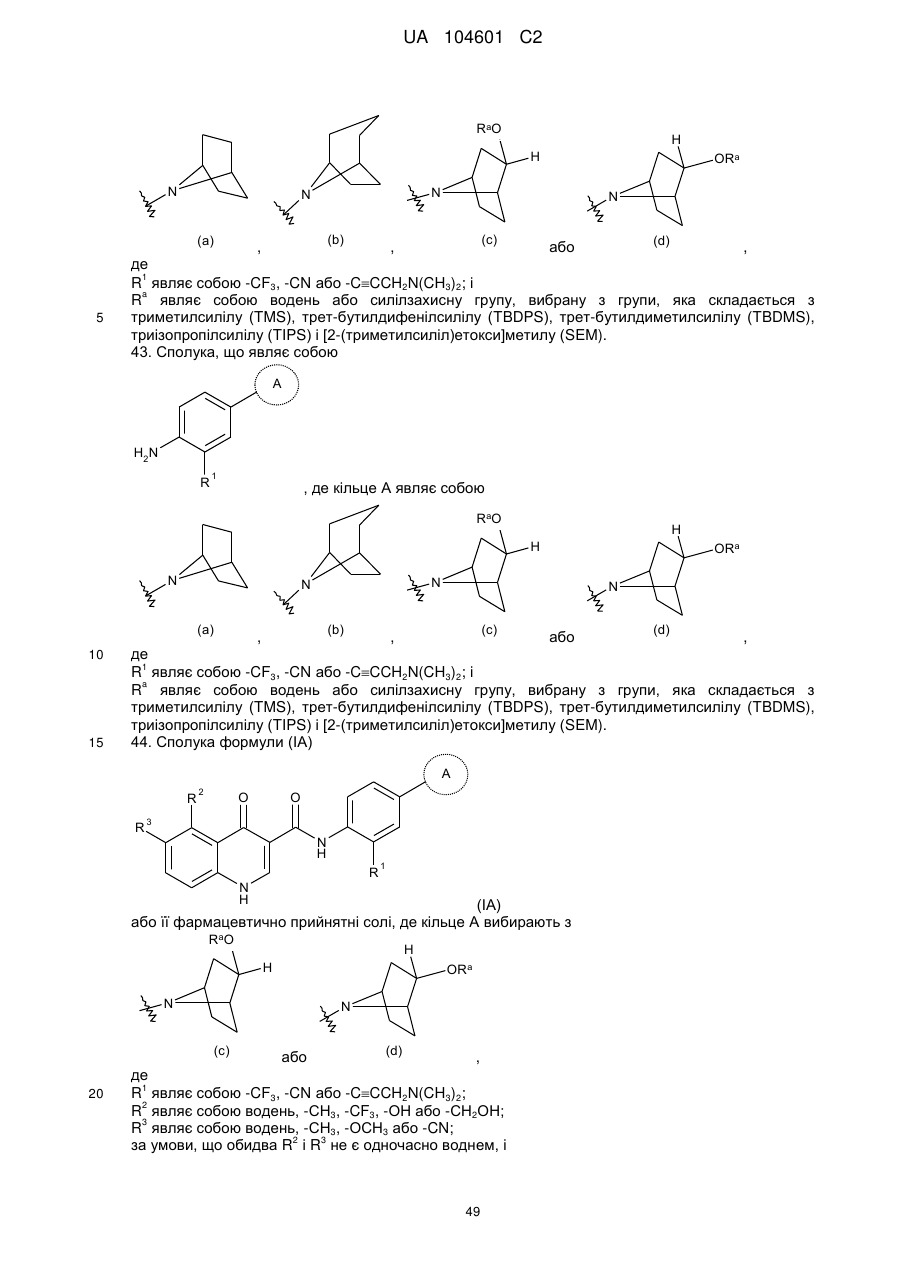
кільце А вибирають з
 ,
,  ,
, 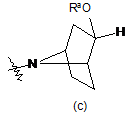 або
або 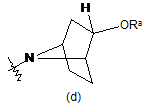 ,
,
де
R1 являє собою -CF3, -CN або -CºCCH2N(CH3)2;
R2 являє собою водень, -СН3, -CF3, -ОН або -СН2ОН;
R3 являє собою водень, -СН3, -ОСН3 або -CN;
за умови, що обидва R2 і R3 не є одночасно воднем, і
Ra являє собою або водень силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM).
33. Спосіб за п. 32, де амін формули 3 на стадії (а) одержують in situ з аміногідрохлориду.
34. Спосіб за п. 33, де Ra являє собою TBDMS.
35. Спосіб за п. 34, де стадію (а) здійснюють в ацетонітрилі в присутності триетиламіну.
36. Спосіб за п. 32, де стадію (b) здійснюють у присутності паладієвого каталізатора, причому розчинник включає метанол або етанол.
37. Спосіб за п. 32, де стадію (b) здійснюють у воді в присутності Fe і FeSO4 або Zn і АсОН.
38. Спосіб за п. 32, де стадію (с) здійснюють у розчиннику в присутності гексафторфосфату О-(7-азабензотриазол-1-іл)-N,N,N'N'-тетраметилуронію (HATU) і триетиламіну або в розчиннику в присутності циклічного ангідриду пропілфосфокислоти (Т3Р®) і піридину.
39. Спосіб за п. 38, де розчинник на стадії (с) включає N,N-диметилформамід, етилацетат або 2-метилтетрагідрофуран.
40. Спосіб за п. 39, де Ra являє собою TBDMS.
41. Спосіб за п. 32, при якому додатково проводять стадію зняття захисної групи, коли кільце А являє собою
 або
або  , де Ra являє собою силілзахисну групу, з одержанням сполуки формули (І), де кільце А являє собою
, де Ra являє собою силілзахисну групу, з одержанням сполуки формули (І), де кільце А являє собою
 або
або  .
.
42. Сполука, що являє собою
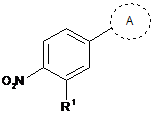 , де кільце А являє собою
, де кільце А являє собою
 ,
,  ,
,  або
або  ,
,
де
R1 являє собою -CF3, -CN або -CºCCH2N(CH3)2; і
Ra являє собою водень або силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM).
43. Сполука, що являє собою
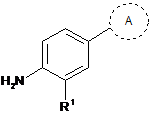 , де кільце А являє собою
, де кільце А являє собою
 ,
,  ,
,  або
або  ,
,
де
R1 являє собою -CF3, -CN або -CºCCH2N(CH3)2; і
Ra являє собою водень або силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM).
44. Сполука формули (ІА)
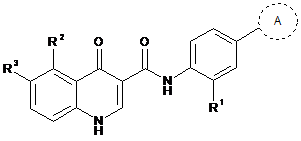 (ІА)
(ІА)
або їїфармацевтично прийнятні солі, де кільце А вибирають з
 або
або  ,
,
де
R1 являє собою -CF3, -CN або -CºCCH2N(CH3)2;
R2 являє собою водень, -СН3, -CF3, -ОН або -СН2ОН;
R3 являє собою водень, -СН3, -ОСН3 або -CN;
за умови, що обидва R2 і R3 не є одночасно воднем, і
Ra являє собою силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM).
Текст
Реферат: Даний винахід стосується модуляторів регулятора трансмембранної провідності при муковісцидозі ("CFTR"), їх композицій і способів їхнього застосування. Даний винахід також стосується способів лікування захворювань при використанні модуляторів CFTR. UA 104601 C2 (12) UA 104601 C2 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 Перехресне посилання на споріднені заявки По даній заявці вимагається пріоритет згідно з 35 U.S.C. § 119 попередньої заявки на патент США із серійним № 61/107830, поданої 23 жовтня 2008 року і озаглавленої «Модулятори регулятора трансмембранної провідності при муковісцидозі», повний зміст якої включений в даний опис за допомогою посилання. Галузь техніки винаходу Даний винахід належить до модуляторів регулятора трансмембранної провідності при муковісцидозі («CFTR»), до їхніх композицій і до способів з їх використанням. Даний винахід також належить до способів лікування захворювань, які використовують модулятори CFTR. Передумови створення винаходу Транспортери АТФ-зв’язувальних касет є сімейством мембранних білків-транспортерів, що регулюють транспорт широкого ряду фармакологічних агентів, потенційно токсичних лікарських засобів і ксенобіотиків, а також аніонів. Вони є гомологічними мембранними білками, які зв'язуються з клітинним аденозинтрифосфатом (АТФ) і використовують його для своїх специфічних активностей. Деякі з цих транспортерів були відриті як білки множинної лікарської резистентності (подібно до глікопротеїну MDR1-P або білка множинної лікарської резистентності MRP1), які захищають злоякісні ракові клітини від хіміотерапевтичних засобів. До даного часу було ідентифіковано 48 таких транспортерів і підрозділено на 7 сімейств на основі ідентичності їхніх послідовностей і їхньої функції. Одним із членів сімейства транспортерів АТФ-зв’язувальних касет, які звичайно асоціюються із захворюванням, є цАМФ/АТФ-опосередкований аніонний канал CFTR. CFTR експресується в множині типів клітин, які включають абсорбуючі і секреторні епітеліальні клітини, у яких він регулює потік аніонів через мембрану, а також активність інших іонних каналів і білків. В епітеліальних клітинах нормальне функціонування CFTR є важливим для підтримки транспорту електролітів по всьому організмі, включаючи тканини дихальних шляхів і травного тракту. CFTR складається приблизно з 1480 амінокислот, які кодують білок, що складається з тандемного повтору трансмембранних доменів, кожний з яких містить шість трансмембранних спіралей і нуклеотидзв’язувального домену. Два трансмембранних домени з'єднані за допомогою великого, полярного, регуляторного (R)-домену з множиною сайтів фосфорилування, що регулюють активність каналу і спрямований рух із клітин і в клітини. Кодуючий CFTR ген був ідентифікований і секвенований (див. Gregory, R.J. et al. (1990) Nature 347: 382-386; Rich, D.P. et al (1990) Nature 347: 358-362), Riordan, J.R. et al. (1989) Science 245: 1066-1073). Дефект у цьому гені є причиною мутацій у CFTR, що приводять до муковісцидозу («CF»), найпоширенішого летального генетичного захворюванню в людей. Муковісцидозом уражене приблизно одне з кожних 2500 немовлят у Сполучених Штатах. У загальній популяції Сполучених Штатів аж до 10 мільйонів людей несуть одну копію дефектного гена без очевидних патологічних дій. Навпаки, індивідууми з двома копіями зв'язаного з CF гена, страждають наслідками, які підривають здоров'я, і летальними наслідками CF, включаючи хронічне захворювання легень. У пацієнтів з муковісцидозом мутації в CFTR, який ендогенно експресується в епітеліальних тканинах дихальних шляхів, приводять до зниження секреції аніонів в апікальній частині мембрани, викликаючи дисбаланс у транспорті іонів і рідини. Результуюче зниження транспорту аніонів вносить вклад у збільшення нагромадження слизу в легенях і супровідні мікробні інфекції, що, у кінцевому рахунку, є причиною смерті пацієнтів з CF. Крім захворювання дихальних шляхів, пацієнти з CF звичайно страждають на пов'язані зі шлунково-кишковим трактом проблеми і панкреатичну недостатність, що, у випадку залишення її без лікування, приводить до смерті. Крім того, більшість чоловіків з муковісцидозом є безплідними, а в групі жінок з муковісцидозом фертильність знижується. На противагу важким наслідкам двох копій зв'язаного з CF гена, індивідууми з єдиною копією зв'язаного з CF гена виявляють збільшену резистентність до холери і до зневоднювання, що є наслідком діареї, що, мабуть, пояснює відносно високу частоту зв'язаного з CF гена в популяції. Аналіз послідовності гена CFTR хромосом при CF виявив ряд викликаючих захворювання мутацій (Cutting, G.R. et al, (1990) Nature 346: 366-369; Dean, M. et al. (1990) Cell 67: 863-870; і Kerem, B-S. et al. (1989) Science 245: 1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 57: 8447-8451). До даного часу було ідентифіковано більш 1000 викликаючих захворювання мутацій у зв'язаному з CF гені (http://www.genet.sickkids.on.ca/cftr/). Найбільш широко поширеною мутацією є делеція фенілаланіну в положенні 508 амінокислотної послідовності CFTR, і її звичайно називають ΔF508-CFTR. Ця мутація зустрічається приблизно в 70 відсотків випадків муковісцидозу і пов'язана з тяжким захворюванням. 1 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 60 Делеція залишку 508 у ΔF508-CFTR перешкоджає правильному укладанню виникаючого білка. Це приводить до нездатності мутантного білка до виходу з ендоплазматичного ретикулуму і переміщенню в плазматичну мембрану. У результаті, кількість каналів, які присутні у мембрані, значно менша кількості каналів, що спостерігається в клітинах, які експресують CFTR дикого типу. На додаток до порушеного переміщення, мутація приводить до неповного відкриття каналів. Разом зменшена кількість каналів у мембрані і неповному відкритті приводять до зниження транспорту аніонів через епітелій, приводячи до порушеного транспорту іонів і рідини (Quinton, P.M. (1990), FASEB J. 4: 2709- 2727). Однак дослідження показали, що зменшена кількість ΔF508-CFTR у мембрані є функціональною, хоча й у меншому ступені, ніж у випадку CFTR дикого типу (Dolmans et al. (1991), Nature Lond. 354: 526-528; Denning et al, вище; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-12350). На додаток до ΔF508-CFTR, експресія R117H-CFTR і G551D-CFTR, інших викликаючих захворювання мутацій у CFTR, що приведуть до порушеного переміщення, синтезу і/або відкриттю каналів, може бути збільшена або зменшена зі зміною секреції аніонів і зміною прогресування і/або тяжкості захворювання. Хоча CFTR транспортує множину молекул, крім аніонів, мабуть, що його роль (транспорт аніонів, хлору і бікарбонату) представляє один елемент у важливому механізмі + транспортування іонів і води через епітелій. Інші елементи включають епітеліальні Na -канали, + - + + + + ENaС, Na /2Cl /K -котранспортер, Na -K -АТФазний насос і K -канали базолатеральної частини мембрани, які відповідальні за включення іона хлору в клітину. Ці елементи працюють разом для досягнення спрямованого транспорту через епітелій завдяки їх вибірковій експресії і локалізації в клітині. Поглинання іона хлору відбувається в + + результаті погодженої дії ENaC і CFTR, які присутні в апікальній частині мембрани, і Na -K АТФазного насоса і Cl-каналів, представлених на базолатеральній поверхні клітини. Додатковий активний транспорт іона хлору з боку просвіту приводить до нагромадження внутрішньоклітинного іона хлору, що може потім пасивно залишати клітину через Cl -іонні + - + канали, що приводить до спрямованого транспорту. Розташування Na /2Cl /K -котранспортера, + + + Na -K -АТФазного насоса і K -каналів базолатеральної частини мембрани на базолатеральній поверхні мембрани і CFTR з боку просвіту координує секрецію іона хлору за посередництвом CFTR з боку просвіту. Оскільки вода, ймовірно, ніколи сама активно не транспортується, її потік через епітеліальні тканини залежить від невеликих трансепітеліальних осмотичних градієнтів, які створюються масовим пересуванням натрію і хлору. Зроблено припущення, що порушений транспорт бікарбонату внаслідок мутацій у CFTR є причиною порушень певних секреторних функцій. Див., наприклад, «Cystic fibrosis: impaired bicarbonate secretion and mucoviscidosis,» Paul M. Quinton, Lancet 2008; 372: 415-417. Мутації в CFTR, які пов'язані з помірною дисфункцією CFTR, також виражені в пацієнтів зі станами, що мають визначені прояви захворювань, однакові зі станами при CF, але не задовольняють діагностичним критеріям відносно CF. Такі стани включають уроджене двосторонню відсутність сім’явиносних проток, ідіопатичний хронічний панкреатит, хронічний бронхіт і хронічний риносинусит. Інші захворювання, при яких мутантний CFTR, як думають, є фактором ризику поряд з генами-модифікаторами або факторами навколишнього середовища, включають первинний склерозуючий холангіт, алергійний бронхолегеневий аспергільоз і астму. Також було встановлено, що сигаретний дим, гіпоксія і фактори навколишнього середовища, які індукують сигналізацію про гіпоксію, погіршують функцію CFTR і можуть вносити вклад у певні форми респіраторного захворювання, такі як хронічний бронхіт. Захворювання, що можуть бути зумовлені порушеною функцією CFTR, але не задовольняють діагностичним критеріям відносно CF, визначають як CFTR-споріднені захворювання. Крім муковісцидозу, модулювання активності CFTR може допомогти у випадку інших захворювань, не викликаних безпосередньо мутаціями в CFTR, таких як пов'язані з порушенням секреції захворювання й інші, пов'язані з порушенням укладання білків захворювання, опосередковані CFTR. CFTR регулює потік іонів хлору і бікарбонату через епітеліальні тканини з багатьох клітин для контролювання руху рідини, розчинності білків, в'язкості слизу й активності ферментів. Дефекти в CFTR можуть бути причиною закупорювання дихальних шляхів або проток багатьох органів, включаючи печінку і підшлункову залозу. Підсилювачами є сполуки, що підсилюють відкриваючу активність CFTR, який присутній у клітинній мембрані. Будь-яке захворювання, у яке залучене згущення слизу, порушення регуляції рідини, порушення виведення слизу або закупорка проток, що приведуть до запалення і руйнування тканини, може бути кандидатом на лікування підсилювачами. Вони включають, але, не обмежуючи ними, хронічне обструктивне захворювання легень (COPD), астму, викликане палінням COPD, хронічний бронхіт, риносинусит, запор, сухість очей і синдром Шегрена, шлунково-стравохідний рефлюкс, жовчні конкременти, пролапс прямої кишки 2 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 60 і запальне захворювання кишечнику. COPD характеризується обмеженням повітряного потоку, що є прогресуючим і неповністю оборотним. Обмеження повітряного потоку обумовлено підвищеною секрецією слизу, емфіземою і бронхіолітом. Активатори мутантного CFTR або CFTR дикого типу можуть запропонувати можливе лікування підвищеної секреції слизу і порушеного виведення війчастим епітелієм, яке є частим при COPD. Зокрема, збільшення секреції аніонів через CFTR може сприяти переміщенню рідини в рідкий шар на поверхні дихальних шляхів для гідратування слизу й оптимізації в'язкості перициліарної рідини. Це може привести до збільшення виведення війчастим епітелієм і ослаблення симптомів, пов'язаних з COPD. Крім того, за допомогою запобігання інфекції, що відбувається, і запалення завдяки поліпшенню очищення дихальних шляхів, модулятори CFTR можуть запобігати або сповільнювати руйнування паренхіми дихальних шляхів, що служить відмітною ознакою емфіземи, і зменшувати або реверсувати збільшення кількості секретуючих слиз клітин і розмір, при якому підвищена секреція слизу недостатньо розкладається, при захворюваннях дихальних шляхів. Сухість очей характеризується зменшенням продукції слізної рідини й аномальних профілів ліпідів, білків і муцину в слізній плівці. Є багато причин сухості око, деякі з яких включають вік, лазерну корекцію зору методом ЛАСИК, артрит, лікарські засоби, хімічні/термічні опіки, алергії і такі захворювання, як муковісцидоз і синдром Шегрена. Збільшення секреції аніонів через CFTR може підвищити транспорт рідини з ендотеліальних клітин роговиці і секреторних залоз, що оточують око, для збільшення гідратації роговиці. Це може допомогти в ослабленні симптомів, пов'язаних із сухістю очей. Синдром Шегрена є аутоімунним захворюванням, при якому імунна система атакує створюючі вологість залози по всьому організму, включаючи око, рот, шкіру, тканину дихальних шляхів, печінку, піхву і кишечник. Симптоми включають сухість очей, рота і піхви, а також захворювання легень. Захворювання також супроводжується ревматоїдним артритом, системним червоним вовчаком, системною склеродермією і поліміпозитом/дерматоміозитом. Вважають, що порушене, здійснюване білком переміщення є причиною захворювання, для лікування якого можливості обмежені. Модулятори активності CFTR можуть зволожувати різні органи, уражені захворюванням, і можуть допомогти послабити пов'язані з ним симптоми. Індивідууми з муковісцидозом мають повторювані епізоди кишкової непрохідності і більш високі частоти випадання прямої кишки, жовчних конкрементів, шлунково-стравохідного рефлюксу, шлунково-кишкових злоякісних новоутворень і запального захворювання кишечнику, що означає, що функції CFTR можуть відігравати важливу роль у запобіганні таких захворювань. Як обговорювалося вище, вважається, що делеція залишку 508 у ΔF508-CFTR перешкоджає правильному укладанню виникаючого білка, приводячи до нездатності такого мутантного білка до виходу з ендоплазматичного ретикулуму і переміщення в плазматичну мембрану. У результаті, у плазматичній мембрані присутні недостатні кількості зрілого білка, і транспорт іона хлору в епітеліальних тканинах значно знижується. Між іншим, було показано, що такий клітинний процес порушеного процесування CFTR ендоплазматичною мережею лежить в основі не тільки захворювання CF, але і широкого кола інших окремих і спадкоємних захворювань. Два можливих образи неправильноїроботи ендоплазматичної мережі мають місце або при втраті зв'язку з експортом білків з ендоплазматичного ретикулуму, що приводить до їх деструкції, або при накопиченні цих дефектних/неправильно укладених білків у ендоплазматичному ретикулумі [Aridor M, et al., Nature Med., 5(7), pp 745-751 (1999); Shastry, B.S., et al., Neurochem. International, 43, pp 1-7 (2003); Rutishauser, J., et al., Swiss Med Wkly, 132, pp 211-222 (2002); Morello, JP et al, TIPS, 21, pp. 466-469 (2000); Bross P., et al., Human Mut, 14, pp. 186-198 (1999)]. Захворюваннями, пов'язаними з першим класом неправильної роботи ендоплазматичного ретикулуму, є муковісцидоз (через неправильно укладений ΔF508-CFTR, який обговорювався вище), спадкоємна емфізема (через α1-антитрипсин; не варіантів PiZ), спадкоємний гемохроматоз, дефекти коагуляції-фібринолізису, такі як дефіцит білка С, спадкоємна хвороба Квінке типу 1, дефекти процесування ліпідів, такі як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомальні хвороби нагромадження, такі як хвороба I-клітин/псевдо-Гурлера, мукополісахаридози (через лізосомальне процесування ферментів), хвороба Сандхоф/Тея-Сакса (через β-гексозаміназу), хвороба Криглер-Наджара типу II (через УДФ-глюкуронилтрансферазу), поліендокринопатія/гіперінсулінемія, цукровий діабет (через рецептор інсуліну), карликовість Ларона (через рецептор гормону росту), дефіцит мієлопероксидази, первинний гіпопаратиреоз (через препропаратиреоїдний гормон), меланома (через тирозиназу). Захворюваннями, пов'язаними з останнім із двох названих класів неправильної роботи ендоплазматичного ретикулуму, є гліканоз CDG типу 1, спадкоємна емфізема (через α1-антитрипсин (варіанта PiZ варіант), уроджений гіпертиреоз, остеопсатироз (через проколаген тип I, II, IV), спадкоємна гіпофібриногенемія (через фібриноген), дефіцит 3 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 альфа 1-антихимотрипсину (ACT) (через α1-антихімотрипсин), нецукровий діабет (DI), нейрогенний DI (через гормон вазопресину/V2-рецептор), нефрогенний DI (через аквапорин II), синдром Шарко-Марі-Тута (через периферичний мієліновий білок 22), хвороба ПерліцеусаМерцбахера; нейродегенеративні захворювання, такі як хвороба Альцгеймера (через βAPP і пресеніліни), хвороба Паркінсона, бічний аміотрофічний склероз, прогресуючий над’ядерний параліч, хвороба Піка, декілька поліглутамінових неврологічних розладів, таких як, хвороба Хантінгтона, спіномозочкова атаксія типу I, спінальна і бульбарна м'язова атрофія, денторубропалідолюїсова атрофія і міотонічна дистрофія, а також губчаті енцефалопатії, такі як спадкоємна хвороба Крейтцфельдта-Якоба (через дефект процесування пріонних білків), хвороба Фабрі (через лізосомальну α-галактозидазу А), синдром Страусслера-Шейнкера (через дефект у процесування Prp), безплідність і панкреатит, недостатність підшлункової залози, остеопороз, остеопенія, синдром Горема, порушення каналів для іонів хлору, уроджена міотонія (форми Томсена і Беккера), синдром Бартеру типу III, хвороба Дента, стартова хвороба, епілепсія, лізосомальні хвороби накопичення, синдром Ангельмана, первинна циліарна дискінезія (PCD), PCD зі зворотним розташуванням внутрішніх органів (також відома як синдром Картагенера), PCD без зворотного розташування внутрішніх органів і циліарної аплазії, і захворювання печінки. Інші захворювання, що спричиняє мутація в CFTR, включають чоловічу безплідність, викликану уродженою двосторонньою відсутністю сім’явиносних проток (CBAVD), захворювання легень легкого ступеня, ідіопатичний панкреатит і алергійний бронхолегеневий аспергільоз (ABPA). Див., “CFTR-opathies: disease phenotypes associated with cystic fibrosis transmembrane regulator gene mutations,” Peader G. Noone and Michael R. Knowles, Respir. Res. 2001, 2: 328-332 (включений у даний опис за допомогою посилання). Крім збільшення активності CFTR, зниження секреції аніонів під дією модуляторів CFTR може бути корисним для лікування секреторних діарей, при яких транспорт води з епітелію різко збільшується в результаті активованого засобом, що підсилює секрецію, транспорту іона хлору. Механізм включає підвищення цАМФ і стимулювання CFTR. Хоча існує множина причин діареї, основні наслідки діарейних захворювань, які є наслідком надмірного транспорту іона хлору, є спільними для всіх і включають зневоднювання, ацидоз, порушення росту і смерть. Гострі і хронічні діареї представляють основну медичну проблему в багатьох регіонах світу. Діарея є і важливим фактором у недоїданні, і ведучою причиною смерті (5 мільйонів випадків смерті в рік) у дітей молодших п'яти років. Секреторні діареї також є небезпечним станом у пацієнтів із синдромом набутого імунодефіциту (СНІД) і хронічним запальним захворюванням кишечнику (IBD). У шістнадцяти мільйонів туристів у країни, що розвиваються, із промислово розвинених країн щороку розвивається діарея, при цьому тяжкість і число випадків діареї змінюється в залежності від країни і району подорожі. Відповідно, існує потреба в потужних і вибіркових підсилювачах CFTR: форм дикого типу і мутантних форм CFTR людини. Ці мутантні форми включають, але без обмеження, ΔF508del, G551D, R117H, 2789+5G->A. Існує потреба в модуляторах активності CFTR і їхніх композиціях, які можуть бути використані для модулювання активності CFTR у мембрані клітини ссавця. Існує потреба в способах лікування захворювань, викликаних мутацією в CFTR, з використанням таких модуляторів активності CFTR. Існує потреба в способах модулювання активності CFTR у мембрані клітини ссавця ex vivo. КОРОТКИЙ ОПИС СУТІ ВИНАХОДУ В даний час виявлено, що сполуки даного винаходу і їх фармацевтично прийнятні композиції можуть бути використані як модулятори активності CFTR. Сполуки мають загальну формулу (I): 1 2 3 або їх фармацевтично прийнятні солі, де R , R , R і A описані загалом і по класах і підкласах нижче. 4 UA 104601 C2 5 Дані сполуки і фармацевтично прийнятні композиції можуть бути використані при лікуванні або ослабленні тяжкості ряду захворювань, порушень або станів, пов'язаних з мутаціями в CFTR. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Загальний опис сполук даного винаходу Даний винахід належить до сполук формули (I), корисних як модулятори активності CFTR: або їх фармацевтично прийнятних солей, де кільце А вибирають з 10 15 20 25 30 35 40 45 50 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем. Сполуки і визначення Сполуки даного винаходу включають сполуки, описані загалом вище, і додатково проілюстровані класами, підкласами і типами, описаними в даному описі. Як використано в даному описі, крім випадків, що вказують інше, варто застосовувати наступні визначення. Як використано в даному описі, термін «ABC-транспортер» означає білок ABC-транспортер або його фрагмент, що включає щонайменше один сайт зв'язування, причому зазначений білок або його фрагмент присутній in vivo або in vitro. Як використано в даному описі, термін «домен зв'язування» означає домен ABC-транспортера, що може зв'язуватися з модулятором. Див., наприклад, Hwang, T.C. et at, J. Gen. Physiol. (1998): 111(3), 477-90. Як використано в даному описі, термін «CFTR» означає регулятор трансмембранної провідності при муковісцидозі або провідності з мутацією, здатний до регуляції активності, що включає, але без обмеження, ΔF508 CFTR, R117H CFTR і G551D CFTR (див., наприклад, http://www.genet.sickkids.on.ca/cftr/, заради мутацій у CFTR). Як використано в даному описі, термін «модулювання» означає збільшення або зменшення вимірюваної кількості. Як використано в даному описі, термін «нормальний CFTR» або «нормальна функція CFTR» означає CFTR подібно до дикого типу без якого-небудь погіршення унаслідок факторів навколишнього середовища, таких як паління, забруднення або що-небудь, що викликає запалення в легенях. Як використано в даному описі, термін «ослаблений CFTR» або «ослаблена функція CFTR» означає більш слабкий, ніж нормальний CFTR або більш слабкий, ніж нормальна функція CFTR. Для цілей даного винаходу хімічні елементи визначені відповідно до періодичної таблиці елементів, варіантом CAS, Handbook of Chemistry and Physics, 75th Ed. Крім того, загальні принципи органічної хімії описані в "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999, і "Маrсh's Advanced Organic Chemistry", 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, повний зміст яких включений, тим самим, за допомогою посилання. Комбінованими замісниками, що передбачаються даним винаходом, переважно є такі, які приводять до утворення стабільних або хімічно можливих сполук. Як використано в даному описі, термін «стабільні» належить до сполук, що не змінюються в значній мірі після піддавання умовам, що роблять можливим їхнє одержання, виявлення і переважно їхнє виділення, очищення і використання з однією або декількома цілями, описуваними в даному описі. У деяких варіантах здійснення стабільна сполука або хімічно можлива сполука являє собою сполуку, яка не змінюється в значній мірі після зберігання при температурі, яка становить 40ºC або менше, за відсутності вологи або інших хімічно активних умов, протягом щонайменше тижня. 5 UA 104601 C2 5 10 15 20 25 30 Як використано в даному описі, термін «захисна група» належить до агента, який використовується тимчасово для блокування одного або декількох бажаних реакційноздатних сайтів у багатофункціональній сполуці. У певних варіантах здійснення захиснагрупа має одну або декілька, або переважно усі, з наступних властивостей: a) взаємодіє вибірково з гарним виходом з одержанням захищеної речовини, яка є стійкою до реакцій, що мають місце в одному або декількох інших реакційноздатних сайтах; і b) є такою, що вибірково видаляється з гарним виходом реагентами, які не руйнують відновлену функціональну групу. Приклади захисних груп докладно представлені в Greene, T.W., Wuts, P. G у "Protective Groups in Organic Synthesis", Third Edition, John Wiley & Sons, New York: 1999, і інших виданнях цієї книги, повний зміст яких включений, тим самим, за допомогою посилання. Якщо не зазначене інше, мається на увазі, що представлені в даному описі структури також включають всі ізомерні (наприклад, енантіомерні, діастереомерні і геометричні (або конформаційні)) форми структури; наприклад, R- і S-конфігурації для кожного асиметричного центра, (Z) і (E) ізомери відносно подвійного зв'язку і (Z) і (E) конформаційні ізомери. Отже, одиничні стереохімічні ізомери, а також суміші енантіомерних, діастереомерних і геометричних (або конформаційних) форм сполук даного винаходу входять в обсяг даного винаходу. Якщо не зазначене інше, усі таутомерні форми сполук даного винаходу входять в обсяг даного винаходу; наприклад, сполуки формули (I) можуть існувати у вигляді таутомерів: Крім того, якщо не зазначене інше, також мається на увазі, що представлені в даному описі структури також включають сполуки, які відрізняються тільки присутністю одного або декількох ізотопно збагачених атомів. Наприклад, сполуки, які мають представлені структури, крім заміни 13 14 водню дейтерієм або тритієм або заміну вуглецю збагаченим С або C вуглецем, входять в обсяг даного винаходу. Такі сполуки можуть бути використані, наприклад, як аналітичні засоби або зонди у біологічних аналізах. Такі сполуки, особливо сполуки, що містять атоми дейтерію, можуть виявляти модифіковані метаболічні властивості. Опис сполук, які приводяться як приклади Даний винахід надає сполуку формули (I): або її фармацевтично прийнятні солі, де кільце А вибирають з 1 35 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем. В одному варіанті здійснення кільце А являє собою 6 . UA 104601 C2 В одному варіанті здійснення кільце А являє собою В іншому варіанті здійснення кільце А являє собою 5 10 15 . . У ще одному варіанті здійснення кільце А являє собою . 1 В одному варіанті здійснення R являє собою -CF3. 1 В іншому варіанті здійснення R являє собою -CN. 1 В іншому варіанті здійснення R являє собою -CCCH2N(CH3)2. 2 В одному варіанті здійснення R являє собою -CH3. 2 В іншому варіанті здійснення R являє собою -CF3. 2 В іншому варіанті здійснення R являє собою -OH. 2 В іншому варіанті здійснення R являє собою -CH2OH. 3 В одному варіанті здійснення R являє собою -CH3. 3 В одному варіанті здійснення R являє собою -OCH3. 3 В іншому варіанті здійснення R являє собою -CN. 2 3 В одному варіанті здійснення R являє собою водень, і R являє собою -CH3, -OCH3 або -CN. 2 3 В іншому варіанті здійснення R являє собою -CH3, -CF3, -OH або -CH2OH, і R являє собою водень. 1 20 У декількох варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою водень, і R являє собою -CH3, -OCH3 або -CN. В інших варіантах 1 1 здійснення R являє собою -CN. В інших варіантах здійснення R являє собою -CCCH2N(CH3)2. 3 3 3 В одному варіанті здійснення R являє собою -CH3, або R являє собою -OCH3, або R являє собою -CN. 1 25 У декількох варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою -CH3, -CF3, -OH або -CH2OH, і R являє собою водень. В інших 1 1 варіантах здійснення R являє собою -CN. У ще додаткових варіантах здійснення R являє 2 2 собою -CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R являє собою 2 2 -CF3, або R являє собою -OH, або R являє собою -CH2OH. 1 30 У декількох варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою водень, і R являє собою -CH3, -OCH3 або -CN. В інших варіантах 1 1 здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє собою 3 3 CCCH2N(CH3)2. В одному варіанті здійснення R представляє -OCH3, або R являє собою -CH3, 3 або R являє собою -CN. 1 35 У наступних варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою -CH3, -CF3, -OH або -CH2OH, і R являє собою водень. В інших 1 1 варіантах здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє 2 2 собою -CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R являє собою 2 2 -CF3, або R являє собою -OH, або R являє собою -CH2OH. 1 У декількох варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою водень, і R являє собою -CH3, -OCH3 або -CN. В інших варіантах 7 UA 104601 C2 1 1 здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє собою 3 3 CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R представляє -OCH3, 3 або R являє собою -CN. 1 5 У наступних варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою -CH3, -CF3, -OH або -CH2OH, і R являє собою водень. В інших 1 1 варіантах здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє 2 2 собою -CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R являє собою 2 2 -CF3, або R являє собою -OH, або R являє собою -CH2OH. 1 10 У наступних варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою водень, і R являє собою -CH3, -OCH3 або -CN. В інших варіантах 1 1 здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє собою 3 3 CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R представляє -OCH3, 3 або R являє собою -CN. 1 15 У наступних варіантах здійснення даного винаходу кільце А являє собою , R являє 2 3 собою -CF3, R являє собою -CH3, -CF3, -OH або -CH2OH, і R являє собою водень. В інших 1 1 варіантах здійснення R являє собою -CN. В ще додаткових варіантах здійснення R являє 2 2 собою -CCCH2N(CH3)2. В одному варіанті здійснення R являє собою -CH3, або R являє собою 2 2 -CF3, або R являє собою -OH, або R являє собою -CH2OH. Приклади сполуки даного винаходу представлені нижче в таблиці 1. 20 8 UA 104601 C2 Загальні схеми синтезу 9 UA 104601 C2 Сполуки даного винаходу легко одержати за допомогою способів, відомих у даній галузі і представлених на схемах 1-3. Схема 1. Одержання сполук формули (I). 5 10 15 20 25 а) (CO2R)2CH=CH(OR), толуол, нагрівання; b) Даутерм або дифеніловий ефір, кип'ятіння зі зворотним холодильником, атмосфера N2; c) Видалення блокуючої галогенової (наприклад, -Cl) групи, у випадку її присутності, Pd/C, H2, EtOH; d) Видалення захисної групи R лугом або кислотою; e) CH3CN, Et3N, нагрівання; f) Pd/C, H2, EtOH; g) HATU, Et3N, ДМФА або циклічний ангідрид пропілфосфокислоти (T3P), піридин, 2-метилтетрагідрофуран. На схемі 1 представлений конвергентний підхід до одержання сполук формули (I) із заміщених бензольних похідних 1a і 2a. У кінцевому перетворенні утворення аміду через сполучення карбонової кислоти 1d з аміном 2c, з одержанням сполуки формули (I) може бути досягнуте при використанні або гексафторфосфату О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (HATU) і триетиламіну в N,N-диметилформаміді (ДМФА), або циклічного ангідриду пропілфосфокислоти (T3P) і піридину в 2-метилтетрагідрофурані. Карбонову кислоту 1d одержують з відповідного заміщеного бензольного похідного 1a шляхом проведення послідовності реакцій з ініційованої нагріванням конденсації сполуки 1a із придатним малонатом (CO2R)2CH=CH(OR), де R являє собою алкільну групу, таку як метил, етил або т. п., з одержанням сполуки 1b. Сполука 1b перетворюють у карбонову кислоту 1d за допомогою тристадійної послідовності реакцій, що включає внутрішньомолекулярну циклізацію при нагріванні при кип'ятінні зі зворотним холодильником у Даутермі або дифеніловому ефірі (стадія b), з наступним видаленням (якщо потрібно) блокуючої галогенової групи (стадія c) в умовах каталізованого паладієм дегалогенування і каталізованого кислотою або лугом омилення (стадія d). Порядок стадій зняття захисної групи й омилення може бути зворотним; тобто стадія c може мати місце до або після стадії d, як представлено на схемі 1. Знову звертаючи до схеми 1, амінобензольне похідне 2c можна одержати з нітробензолу 2a за допомогою тристадійної послідовності реакцій. Таким чином, сполучення нітробензолу 2a з 10 UA 104601 C2 циклічним аміном 3, як визначено в даному описі, у присутності триетиламіну дає сполуку 2b. Каталізоване паладієм відновлення 2b забезпечує амін 2c. Схема 2. Одержання сполук формули (I). 5 10 a) ДМСО, K2CO3, 80C; b) N,N-диметилпроп-2-ін-1-амін, Pd(PPh3)2Cl2, CuI, ДМФА, TEA, 80C; c) Fe, FeSO4, H2O або Zn, AcOH, H2O; d) HATU, Et3N, ДМФА або циклічний ангідрид пропілфосфокислоти (T3P), піридин, 2-метилтетрагідрофуран. На схемі 2 представлений синтез сполук формули (I), які несуть бічний ланцюг - пропіламін. Таким чином, сполучення нітробензолу 2a, де Hal являє собою бром, або хлор т.п., з 3, як визначено в даному описі, у присутності карбонату калію в ДМСО дає сполуку 4. Каталізоване паладієм сполучення сполуки 4 з N,N-диметилпроп-2-ін-1-аміном з наступним каталізованим залізом або цинком відновленням нітрогрупи дає амін 5. Сполучення аміну 5 з карбоновою кислотою 1d забезпечує сполуку 6, що є сполукою формули (I). Схема 3. Одержання сполук формули (I), де R являє собою H або OH 15 11 UA 104601 C2 5 10 15 20 25 30 35 40 a) ДМСО, K2CO3, нагрівання або CH3CN, TEA, нагрівання; b) PGX, такий як TBDMSCl, основа, така як імідазол, ДМФА; c) H2, Pd/C, EtOH; d) HATU, Et3N, ДМФА або циклічний ангідрид пропілфосфокислоти (T3P), піридин, 2-метилтетрагідрофуран; e) зняття PG, наприклад, HCl, EtOH. PG=захисна група; X= відхідна група. На схемі 3 представлений синтез сполуки формули (I), де 3 являє собою 7азабіцикло[2.2.1]гептан, який необов'язково несе гідроксильну групу в екзо- або ендо-положенні - положення 2. Гідроксизаміщені аддукти (+)-ендо-7-азабіцикло[2.2.1]гептан-2-ол, (-)-ендо-7азабіцикло[2.2.1]гептан-2-ол, (+)-екзо-7-азабіцикло[2.2.1]гептан-2-ол і (-)-екзо-7азабіцикло[2.2.1]гептан-2-ол можна одержати, використовуючи методики, описані в Fletcher, S.R. et al., "Total Synthesis and Determination of the Absolute Configuration of Epibatidine", J. Org. Chem, 59, pp. 1771-1778 (1994). Сам по собі 7-азабіцикло[2.2.1]гептан комерційно доступний від Tyger Scientific Inc. 324 Stokes Avenue Ewing, NJ, 08638 США. Таким чином, як і при використанні ряду перетворень, підсумованих на схемах 1 і 2, сполучення сполуки 2a з біцикло[2.2.1]аміном 7 забезпечує сполуку 8. Якщо в сполуці 8 присутня гідроксильна група, може бути необхідним захист гідроксильної групи захисною групою до здійснення наступних перетворень. Таким чином, обробка сполуки 8 третбутилдиметилсилілхлоридом з використанням відомих умов забезпечує захищену сполуку 9 до здійснення відновлення нітрогрупи, з одержанням аміну 10. Утворення аміду з використанням сполуки 1d (див. схему 3) і видалення гідроксизахисної групи (при необхідності) забезпечує сполуку 11, яка є сполукою формули (I). Застосування, складання композицій і введення Фармацевтично прийнятні композиції В одному аспекті даного винаходу надані фармацевтично прийнятні композиції, які містять будь-яку зі сполук, розкритих у даному винаході, і необов'язково містять фармацевтично прийнятний носій, ад’ювант або середовище. У певних варіантах здійснення дані композиції необов'язково додатково включають один або декілька додаткових терапевтичних засобів. Також варто розуміти, що деякі зі сполук даного винаходу можуть знаходитися у вільній формі для лікування або, при необхідності, у вигляді фармацевтично прийнятного похідного або його проліків. Згідно із даним винаходом, фармацевтично прийнятне похідне або проліки включає, але без обмеження, фармацевтично прийнятні солі, складні ефіри, солі таких ефірів або будь-який інший аддукт або похідне, який(е) після введення потребуючому цього пацієнту здатний забезпечити, прямо або опосередковано, сполуку, описану в даному описі в інших випадках, або його метаболіт або залишок. Як використано в даному описі, термін «фармацевтично прийнятна сіль» належить до таких солей, що, за результатами ретельної медичної оцінки, підходять для застосування для приведення в контакт із тканинами людей і нижчих тварин без надмірної токсичності, подразнення, алергійної реакції і т. п. і відповідають прийнятним співвідношенням користь/ризик. Під «фармацевтично прийнятною сіллю» мається на увазі будь-яка нетоксична сіль або сіль ефіру сполуки даного винаходу, що, після введення реципієнту, здатна забезпечити, прямо або опосередковано, сполуку даного винаходу або її активний відносно інгібування метаболіт або залишок. 12 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтично прийнятні солі добре відомі в даній галузі техніки. Наприклад, S.M. Berge і ін. докладно описують фармацевтично прийнятні солі в J. Pharmaceutical Sciences, 1977, 66, 119, який включений у даний опис за допомогою посилання. Фармацевтично прийнятні солі сполук даного винаходу включають такі, які одержують на основі придатних неорганічних і органічних кислот і основ. Прикладами фармацевтично прийнятних, нетоксичних кислотноадитивних солей є солі, утворені аміногрупою з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, фосфорна кислота, сірчана кислота і хлорна кислота, або з органічними кислотами, такими як оцтова кислота, щавлева кислота, малеїнова кислота, винна кислота, лимонна кислота, бурштинова кислота або малонова кислота, або при використання інших методів, використовуваних у даній галузі техніки, таких як іонообмін. Інші фармацевтично прийнятні солі включають: адипат, альгігат, аскорбат, аспартат, бензолсульфонат, безоат, бісульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропіонат, диглюконат, додецилсульфат, едизилат (етандисульфонат), етансульфонат, формат, фумарат, глюкогептонат, гліцерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гідройодид, 2-гідроксіетансульфонат, лактобіонат, лактат, лаурат,лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталінсульфонат, нікотинат, нітрат, олеат, оксалат, пальмітат, памоат, пектинат, персульфат, 3-фенілпропіонат, фосфат, пікрат, півалат, пропіонат, стеарат, сукцинат, сульфат, тартрат, тіоціанат, паратолуолсульфонат, ундеканоат, валерат і т. п. Солі, отримані на основі придатних основ, + включають солі лужних металів, лужноземельних металів, амонію і N (C1-4алкіл)4. У даному винаході також передбачається утворення четвертинних основ на основі будь-яких основних азотовмісні груп сполук, розкритих у даному винаході. За допомогою такого утворення четвертинних основ можна одержати розчинні у воді або маслі або дисперговані продукти. Репрезентативні солі лужних або лужноземельних металів включають натрій, літій, калій, кальцій, магній і т. п. Додаткові фармацевтично прийнятні солі включає, при необхідності, нетоксичні катіони амонію, четвертинного амонію й аміну, утворені з використанням протиіонів, таких як галогенід, гідроксид, карбоксилат, сульфат, фосфат, нітрат, (нижчий алкіл)сульфонат і арилсульфонат. Як описано вище, фармацевтично прийнятні композиції даного винаходу, крім того, містять фармацевтично прийнятний носій, ад’ювант або середовище, що, як використано в даному описі, включає будь-який і всі розчинники, розріджувачі або будь-яке інше рідке середовище, диспергуючі або суспендуючі засоби, поверхнево-активні речовини, агенти для додання ізотонічності, загусники або емульгатори, консерванти, тверді зв'язувальні речовини, лубриканти і т. п., що підходять для конкретної бажаної дозованої форми. У Rеміngtоn's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описані різні носії, використовувані при складанні фармацевтично прийнятних композицій, і відомі способи їхнього одержання. Крім випадків, коли яке-небудь загальноприйняте середовище-носій несумісне зі сполуками даного винаходу, наприклад, у результаті виклику будь-якого небажаного біологічного ефекту або іншої негативної взаємодії з якою-небудь іншою сполукою(ами) фармацевтично прийнятної композиції, її застосування, як передбачається, входить в обсяг даного винаходу. Деякі приклади матеріалів, що можуть служити як фармацевтично прийнятні носії, включають, але не обмежуються ними, іонообмінні смоли, оксид алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як сироватковий альбумін людини, буферуючі речовини, такі як фосфати, гліцин, сорбінова кислота або сорбат калію, неповні гліцеридні суміші рослинних насичених жирних кислот, води, солей або електролітів, таких як протамінсульфат, динатрійгідрофосфат, калійгідрофосфат, хлорид натрію, солі цинку, колоїдний діоксид кремнію, трисилікат магнію, полівінілпіролідон, поліакрилати, воски, блокспівполімери поліетилен-поліоксипропілену, ланолін, цукри, такі як лактоза, глюкоза і сахароза; крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль; целюлозу і її похідні, такі як натрійкарбоксиметилцелюлоза, етилцелюлоза й ацетат целюлози; порошкоподібну трагакантову камедь; солод; желатин; тальк; ексципієнти, такі як масло какао і воски для супозиторіїв; олії, такі як арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, маслинова олія, кукурудзяна олія і соєва олія; гліколі, такі як пропіленгліколь або поліетиленгліколь; складні ефіри, такі як етилолеат і етиллаурат; агар; буферуючі агенти, такі як гідроксид магнію і гідроксид алюмінію; альгінову кислоту; апірогенну воду; ізотонічний розчин; розчин Рінгера; етиловий спирт і забуферені фосфатом розчини, а також інші нетоксичні сумісні лубриканти, такі як лаурилсульфат натрію і стеарат магнію, а також забарвлюючі агенти, розділяючі засоби, покривні речовини, підсолоджувачі, коригенти й ароматизируючі агенти, 13 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 60 консерванти й антиоксиданти можуть також бути присутніми у композиції, відповідно до оцінки розроблювача складання композицій. Застосування сполук і фармацевтично прийнятних композицій У ще одному аспекті даний винахід надає спосіб лікування або ослаблення тяжкості стану, захворювання або порушення, у яке залучена мутація в CFTR. У певних варіантах здійснення даний винахід забезпечує спосіб лікування стану, захворювання або порушення, у яке залучена недостатність активності CFTR, що включає введення композиції, яка містить сполуку формули (I), потребуючому цього суб'єкту, переважно ссавцю. У певних варіантах здійснення даний винахід надає спосіб лікування захворювань, пов'язаних з ослабленням функції CFTR унаслідок мутацій у гені, що кодує CFTR, або факторів навколишнього середовища (наприклад, диму). Такі захворювання включають муковісцидоз, хронічний бронхіт, рецидивуючий бронхіт, гострий бронхіт, чоловічу безплідність, викликану уродженою двосторонньою відсутністю сім’явиносних проток (CBAVD), жіночу безплідність, викликану уродженою відсутністю матки і піхви (CAUV), ідіопатичний хронічний панкреатит (ICP), ідіопатичний рецидивуючий панкреатит, ідіопатичний гострий панкреатит, хронічний риносинусит, первинний склерозуючий холангіт, алергійний бронхолегеневий аспергільоз, діабет, сухість очей, запор, алергійний бронхолегеневий аспергільоз (ABPA), кісткові захворювання (наприклад, остеопороз) і астму. У певних варіантах здійснення даний винахід надає спосіб лікування захворювань, зв'язаних з нормальною функцією CFTR. Такі захворювання включають хронічне обструктивне захворювання легень (COPD), хронічний бронхіт, рецидивуючий бронхіт, гострий бронхіт, риносинусит, запор, панкреатит, включаючи хронічний панкреатит, рецидивуючий панкреатит і гострий панкреатит, недостатність підшлункової залози, чоловічу безплідність, викликану уродженою двосторонньою відсутністю сім’явиносних проток (CBAVD), захворювання легень легкого ступеня, ідіопатичний панкреатит, захворювання печінки, спадкоємну емфізему, жовчні конкременти, шлунково-стравохідний рефлюкс, шлунково-кишкові злоякісні новоутворення, запальне захворювання кишечнику, запор, діабет, артрит, остеопороз і остеопенію. У певних варіантах здійснення даний винахід надає спосіб лікування захворювань, пов'язаних з нормальною функцією CFTR, що включають спадкоємний гемохроматоз, дефекти коагуляції-фібринолізису, такі як дефіцит білка С, спадкоємну хворобу Квінке типу 1, дефекти процесування ліпідів, такі як сімейна гіперхолестеринемія, хіломікронемія типу 1, абеталіпопротеїнемія, лізосомальні хвороби нагромадження, такі як хвороба I-клітин/псевдоГурлера, мукополісахаридози, хворобу Сандхоф/Тея-Сакса, хворобу Криглер-Наджара типу II, поліендокринопатію/гіперінсулінемію, цукровий діабет, карликовість Ларона, дефіцит мієлопероксидази, первинний гіпопаратиреоз, меланому, гліканоз CDG типу 1, уроджений гіпертиреоз, остеопсатироз, спадкоємну гіпофібриногенемію, дефіцит альфа 1антихімотрипсину (ACT), нецукровий діабет (DI), нейрогенний DI, нефрогенний DI, синдром Шарко-Марі-Тута, хворобу Перліцеуса-Мерцбахера, нейродегенеративні захворювання, такі як хвороба Альцгеймера, хвороба Паркінсона, бічний аміотрофічний склероз, прогресуючий над’ядерний параліч, хворобу Піка, декілька поліглутамінових неврологічних розладів, таких як хвороба Хантінгтона, спіномозочкова атаксія типу I, спінальна і бульбарна м'язова атрофія, денторубропалідолюїсова атрофія і міотонічна дистрофія, а також губчаті енцефалопатії, такі як спадкоємна хвороба Крейтцфельдта-Якоба (через дефект процесування пріонних білків), хворобу Фабрі, синдром Страусслера-Шейнкера, синдром Горема, порушення каналів для іонів хлору, уроджену міотонію (форми Томсена і Беккера), синдром Бартеру типу III, хворобу Дента, стартову хворобу, епілепсію, лізосомальну хворобу накопичення, синдром Ангельмана, первинну циліарну дискінезію (PCD), PCD зі зворотним розташуванням внутрішніх органів (також відому як синдром Картагенера), PCD без зворотного розташування внутрішніх органів і циліарної аплазії, або хворобу Шегрена, що включає стадію введення зазначеному ссавцю ефективної кількості композиції, яка містить сполуку даного винаходу. Відповідно до альтернативного переважного варіанта здійснення даний винахід надає спосіб лікування муковісцидозу, що включає стадію введення зазначеному ссавцю ефективної кількості композиції, що містить сполуку даного винаходу. Відповідно до даного винаходу «ефективною кількістю» сполуки або фармацевтично прийнятної композиції є така кількість, яка ефективна для лікування або ослаблення тяжкості одного або декількох захворювань, порушень або станів, приведених вище. Сполуки і композиції, відповідно до способу даного винаходу, можна вводити з використанням будь-якої кількості і будь-якого шляху введення, який ефективний для лікування або ослаблення тяжкості одного або декількох захворювань, порушень або станів, приведених вище. 14 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 У певних варіантах здійснення сполуки і композиції даного винаходу корисні при лікуванні або ослабленні тяжкості муковісцидозу в пацієнтів, у яких демонструється залишкова активність CFTR в апікальній мембрані епітеліальних клітин дихальних шляхів і недихальних шляхів. Присутність залишкової активності CFTR на епітеліальній поверхні можна легко виявити, використовуючи відомі в даній галузі методи, наприклад, стандартні електрофізіологічні, біохімічні або гістохімічні методи. У таких методах активність CFTR розпізнають з використанням in vivo або ex vivo електрофізіологічних методів, вимірювання концентрацій Cl у поті або слині або ex vivo біохімічних або гістохімічних методів для перевірки густини CFTR на клітинній поверхні. Використовуючи такі методи, можна легко визначити залишкову активність CFTR у пацієнтів, гетерозиготних або гомозиготних по ряду різних мутацій, включаючи пацієнтів, гомозиготних або гетерозиготних по мутації, яка найбільш часто зустрічається, ΔF508. В іншому варіанті здійснення сполуки і композиції даного винаходу корисні при лікуванні або ослабленні тяжкості муковісцидозу в пацієнтів, у яких є залишкова активність CFTR, індукована або збільшена з використанням фармакологічних способів або генної терапії. Такі способи збільшують кількість CFTR, який присутній на клітинній поверхні, тим самим індукуючи раніше відсутню активність CFTR у пацієнта або збільшуючи існуючий рівень залишкової активності CFTR у пацієнта. В одному варіанті здійснення сполуки і композиції даного винаходу корисні при лікуванні або ослабленні тяжкості муковісцидозу в пацієнтів у рамках певних генотипів, що демонструють залишкову активність CFTR, наприклад, з мутаціями класу III (з порушенням регуляції або відкривання), мутаціями класу IV (зі зміною провідності) або мутаціями класу V (зі зменшенням синтезу) (Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV, and V cystic fibrosis Transmembrane Conductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6: 521-529, 2000). Інші генотипи пацієнтів, що демонструють залишкову активність CFTR, включають пацієнтів, гомозиготних по одному з цих класів або гетерозиготних з будь-яким іншим класом мутацій, включаючи мутації класу I, мутації класу II або мутацію, яка не класифікована. В одному варіанті здійснення сполуки і композиції даного винаходу корисні при лікуванні або ослабленні тяжкості муковісцидозу в пацієнтів у рамках визначених клінічних фенотипів, наприклад, з помірно-слабким клінічним фенотипом, що звичайно знаходиться в зв'язку з кількістю залишкової активності CFTR в апікальній мембрані епітеліальних клітин. Такі фенотипи включають пацієнтів, що демонструють недостатність підшлункової залози, або пацієнтів, у яких діагностований ідіопатичний панкреатит і уроджена двостороння відсутність сім’явивідних проток, або з захворюванням легень легкого ступеня. Точно необхідна кількість буде змінюватися від суб'єкта до суб'єкта в залежності від виду, віку і загального стану суб'єкта, серйозності інфекції, конкретного агента, його способу введення і т. п. Сполуки даного винаходу переважно складають у композиції в одиничній дозованій формі для полегшення введення й однорідності дози. Використовуваний в даному описі вираз «одинична дозована форма» належить до фізично дискретної одиниці агента, призначеної для пацієнта, що піддається лікуванню. Однак варто розуміти, що рішення відносно загального добового застосування сполук і композицій даного винаходу буде прийматися лікуючим лікарем за результатами ретельної медичної оцінки. Конкретний рівень ефективної дози для будь-якого конкретного пацієнта або організму буде залежати від ряду факторів, що включають порушення, які піддається лікуванню, і тяжкість порушення; активність конкретної використовуваної сполуки; конкретну використовувану композицію; вік, масу тіла, загальний стан здоров'я, стать і харчування пацієнта; час уведення, шлях введення і швидкість виведення конкретної використовуваної сполуки; тривалість лікування; лікарські засоби, використовувані в комбінації або одночасно з конкретною використовуваною сполукою, і подібні фактори, добре відомі в галузі медицини. Як використано в даному описі, термін «пацієнт» означає тварину, переважно ссавця і найбільш переважно людини. Фармацевтично прийнятні композиції даного винаходу можна вводити людям і іншим тваринам орально, ректально, парентерально, інтрацистернально, інтравагінально, внутрішньоочеревинно, місцево (у вигляді порошків, мазей, крапель або пластиру), трансбукально, у вигляді аерозолю для ротової порожнини або носа і т. п., у залежності від тяжкості інфекції, що піддається лікуванню. У певних варіантах здійснення сполуки даного винаходу можуть вводитися орально або парентерально на рівнях доз, що складають приблизно від 0,01 мг/кг до приблизно 50 мг/кг і переважно приблизно від 0,5 мг/кг до приблизно 25 мг/кг маси тіла суб'єкта на день, один або декілька разів на день, для одержання бажаного терапевтичного ефекту. 15 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рідкі дозовані форми для орального введення включають, але без обмеження, фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії й еліксири. Крім активних сполук, рідкі дозовані форми можуть містити інертні розріджувачі, звичайно використовувані в даній галузі техніки, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, олії (зокрема, бавовняна, арахісова, кукурудзяна олія, соняшникова олія, маслинова, рицинова і кунжутна олія), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколи й ефіри сорбіту і жирної кислоти, і їхні суміші. Крім інертних розріджувачів, пероральні композиції можуть також містити ад’юванти, такі як змочувальні засоби, емульгатори і суспендуючі агенти, підсолоджувачі, коригенти й ароматизуючі агенти. Ін’єктовані препарати, наприклад, стерильні ін’єктовані водні або масляні суспензії, можна одержати відповідно до відомої технології, використовуючи придатні диспергатори або змочувальні речовини і суспендуючі засоби. Стерильним ін’єктованим препаратом також може бути стерильний ін’єктований розчин, суспензія або емульсія в нетоксичному, придатному для парентерального введення розріджувачі або розчиннику, наприклад, у вигляді розчину в 1,3бутандіолі. Серед прийнятних середовищ і розчинників, що можуть використовуватися, знаходяться вода, розчин Рінгера, U.S.P. і ізотонічний розчин хлориду натрію. Крім того, стерильні, нелеткі масла звичайно використовуються як розчинник або суспендуюче середовище. Для цього ланцюга може бути використане будь-яке позбавлене смаку нелетке масло, включаючи синтетичні моно- і дигліцериди. Крім того, при готуванні ін’єктованих препаратів використовуються жирні кислоти, такі як олеїнова кислота. Ін’єктовані препарати можна стерилізувати, наприклад, шляхом фільтрації через фільтр, який містить бактерії, або шляхом включення стерилізуючи засобів у форму стерильних твердих препаратів, які можна розчинити або диспергувати у стерильній воді або іншому стерильному ін’єктованому середовищі безпосередньо перед застосуванням. Для пролонгування ефекту сполуки даного винаходу часто необхідним є уповільнення абсорбції сполуки з місця підшкірної або внутрішньом'язової ін'єкції. Це можна виконати шляхом використання рідкої суспензії кристалічного або аморфного матеріалу з поганою розчинністю у воді. Швидкість абсорбції сполуки далі залежить від її швидкості розчинення, що, у свою чергу, може залежати від розміру кристала і кристалічної форми. Альтернативно, досягти уповільненої абсорбції форми сполуки, що вводиться парентерально, можна шляхом розчинення або суспендування сполуки в масляному середовищі. Ін’єктовані форми уповільненого усмоктування можна створити шляхом утворення включених у мікрокапсули матриць сполуки в біоруйнованих полімерах, таких як полілактид-полігліколід. У залежності від співвідношення сполуки і полімеру і природи конкретного використовуваного полімеру можна контролювати швидкість вивільнення сполуки. Приклади інших біоруйнованих полімерів включають полі(ортоефіри) і полі(ангідриди). Ін’єктовані препарати уповільненого усмоктування можна також одержати шляхом захоплення сполуки в ліпосоми або мікроемульсії, які сумісні з тканинами організму. Композиції для ректального або вагінального введення переважно являють собою супозиторії, які можна одержати шляхом змішування сполук даного винаходу з придатними, не викликаючими подразнення ексципієнтами або носіями, такими як масло какао, поліетиленгліколь або віск для супозиторіїв, які є твердими при температурі навколишнього середовища, але є рідкими при температурі тіла і тому розплавляються в прямій кишці або вагінальній порожнини і вивільняють активну сполуку. Тверді дозовані форми для орального введення включають капсули, таблетки, пігулки, порошки і гранули. У таких твердих дозованих формах активна сполука змішана з щонайменше одним інертним, фармацевтично прийнятним ексципієнтом або носієм, таким як цитрат натрію або дикальційфосфат, і/або a) заповнювачами або наповнювачами, такими як крохмалі, лактоза, сахароза, глюкоза, маніт і кремнієва кислота, b) зв'язувальними речовинами, такими як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза й аравійська камедь, c) зволожувачами, такими як гліцерин, d) дезінтегруючими агентами, такими як агар-агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, певні силікати і карбонат натрію, e) сповільнювачами розчинення, такими як парафін, f) прискорювачами абсорбції, такими як четвертинні амонієві сполуки, g) змочувальними речовинами, такими як, наприклад, цетиловий спирт і гліцеролмоностеарат, h) абсорбентами, такими як каолін і бентонітова глина, і і) лубрикантами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколи, лаурилсульфат натрію і їхні суміші. У випадку капсул, таблеток і пігулок дозована форма може також включати буферуючі агенти. 16 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 Тверді композиції схожого типу можуть також використовуватися як наповнювачі у м'якій і твердій желатиновій капсулах, використовуючи такі ексципієнти, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі і т. п. Тверді дозовані форми у вигляді таблеток, драже, капсул, пігулок і гранул можна одержати з покриттями й оболонками, такими як ентеросолюбильні покриття й інші покриття, добре відомі в галузі складання фармацевтичних препаратів. Вони можуть необов'язково містити компоненти, що додають матовості, і також можуть мати такий склад, що вони вивільняють активний інгредієнт(и) тільки або переважно у певній частині кишечнику необов'язково уповільненим чином. Приклади сполук для впровадження, що можуть використовуватися, включають полімерні речовини і воски. Тверді композиції схожого типу можуть також використовуватися як наповнювачі у м'якій і твердій желатиновій капсулах, використовуючи такі ексципієнти, як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі і т. п. Активні сполуки можуть також можуть бути в інкапсульованій формі разом з одним або декількома ексципієнтами, приведеними вище. Тверді дозовані форми у вигляді таблеток, драже, капсул, пігулок і гранул можна одержати з покриттями й оболонками, такими як ентеросолюбильні покриття, що контролюють вивільнення покриття й інші покриття, добре відомі в галузі складання фармацевтичних препаратів. У таких твердих дозованих формах активна сполука може бути змішана з щонайменше одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі дозовані форми можуть також включати, як використовується на практиці, додаткові речовини, відмінні від інертних розріджувачів, наприклад, лубриканти для виготовлення таблеток і інші речовини для виготовлення таблеток, такі як стеарат магнію і мікрокристалічна целюлоза. У випадку капсул, таблеток і пігулок дозовані форми також можуть містити буферуючі агенти. Вони можуть необов'язково містити агенти, що додають мутності, а також можуть бути складені в композицію таким чином, що вони вивільняють активний інгредієнт(и) тільки або переважно у певній частині кишечнику, необов'язково, уповільненим чином. Приклади композицій для впровадження, що можуть використовуватися, включають полімерні речовини і воски. Дозовані форми для місцевого або черезшкірного введення сполуки даного винаходу включають мазі, пасти, креми, лосьони, гелі, порошки, розчини, аерозолі, дозовані форми для інгаляції або пластири. Активний компонент змішують у стерильних умовах з фармацевтично прийнятним носієм і будь-якими необхідними консервантами або буферами, у залежності від вимог. Також передбачається, що в об’єм даного винаходу входять офтальмологічні препарати, вушні краплі й очні краплі. Крім того, даним винаходом передбачається застосування черезшкірних пластирів, що мають додаткову перевагу, яка полягає в забезпеченні контрольованої доставки сполуки в організм. Такі дозовані форми готують шляхом або розчинення диспергування сполуки в належному середовищі. Можуть також використовуватися підсилювачі абсорбції для збільшення проникнення сполуки через шкіру. Швидкість можна контролювати або забезпеченням контролюючої швидкості мембрани, або диспергування сполуки в полімерній матриці або гелі. Активність сполуки, використовуваної в даному винаході як модулятор CFTR, можна проаналізувати відповідно до способів, в основному описаним у даній галузі й у прикладах даного опису. Також варто розуміти, що сполуки і фармацевтично прийнятні композиції даного винаходу можуть бути використані в комбінованих терапіях, тобто сполуки і фармацевтично прийнятні композиції можуть вводитися одночасно з призначенням одного або декількох інших необхідних терапевтичних засобів або медичних процедур, до такого призначення або після нього. При конкретній комбінації терапій (терапевтичних засобів або процедур), використовуваних при комбінованому введенні, варто враховувати сумісність необхідних терапевтичних засобів і/або процедур і бажаний терапевтичний ефект, що повинний бути досягнутий. Також варто розуміти, що за допомогою використовуваних терапій може бути досягнутий бажаний ефект відносно того самого порушення (наприклад, сполука даного винаходу може вводитися одночасно з іншим засобом, який використовується для лікування того ж порушення), або з їх допомогою можуть бути досягнуті різні ефекти (наприклад, контроль будь-яких несприятливих ефектів). Як використано в даному описі, додаткові терапевтичні засоби, що звичайно призначають для лікування або попередження конкретного захворювання або стану, відомі як «придатні для захворювання або стану, що піддається лікуванню». В одному варіанті здійснення додатковий засіб вибирають з муколітичного засобу, бронходилататора, антибіотика, протиінфекційного агента, протизапального засобу, модулятора CFTR, відмінного від сполуки даного винаходу, або пов'язаного з живленням 17 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовини. У наступному варіанті здійснення додатковим засобом є модулятор CFTR, який відрізняється від сполуки даного винаходу. В одному варіанті здійснення додатковим засобом є антибіотик. Приклади антибіотиків, корисних у даному винаході, включають тобраміцин, включаючи інгаляційний порошок тобраміцину (TIP), азитроміцин, азтреонам, включаючи аерозольну форму азтреонаму, амікацин, включаючи його ліпосомальні препарати, ципрофлоксацин, включаючи його препарати, що підходять для ведення за допомогою інгаляції, левофлоксацин, включаючи його препарати у вигляді аерозолю, і комбінації двох антибіотиків, наприклад, фосфоміцину і тобраміцину. В іншому варіанті здійснення додатковим засобом є муколітичний засіб. Приклади муколітичних засобів, корисних у даному винаході, включають Pulmozyme®. В іншому варіанті здійснення додатковим засобом є бронходилататор. Приклади бронходилататорів включають альбутерол, метапротенерол сульфат, пірбутерол ацетат, салметерол або тетрабуліну сульфат. В іншому варіанті здійснення додатковий засіб ефективний при відновленні рідкого шару на поверхні нижніх дихальних шляхів. Такі засоби збільшують переміщення солі в клітини і з них, що створює можливість для більшої гідратації слизу в нижніх дихальних шляхах і, отже, більш легке очищення. Такі засоби, що приводяться як приклади, включають гіпертонічний сольовий розчин, денуфозол тетранатрій ([[(3S,5R)-5-(4-аміно-2-оксопіримідин-1-іл)-3-гідроксіоксалан-2іл]метоксигідроксифосфорил]-[[[(2R,3S,4R,5R)-5-(2,4-діоксопіримідин-1-іл)-3,4дигідроксіоксалан-2-іл]метоксигідроксифосфорил]оксигідроксифосфорил]гідрофосфат) або бронхітол (інгаляційний препарат маніту). В іншому варіанті здійснення додатковим засобом є протизапальний засіб, тобто засіб, який може зменшити запалення в легенях. Такі засоби, що приводяться як приклади, корисні в даному винаході, включають ібупрофен, докозагексаневу кислоту (DHA), силденафіл, інгаляційний глутатіон, піоглітазон, гідроксихлорохін або симавастатин. В іншому варіанті здійснення додатковий засіб знижує активність блокатора епітеліальних натрієвих каналів (ENaC), або прямо шляхом блокування каналу, або опосередковано шляхом модуляції протеаз, що приводять до збільшення активності ENaC (наприклад, серинових протеаз, які активують канали протеаз). Такі засоби, що приводяться як приклади, включають камостат (інгібітор трипсиноподібної протеази), QAU145, 552-02, GS-9411, INO-4995, Aerolytic і амілорид. Додаткові засоби, що знижують активність блокатора епітеліальних натрієвих каналів (ENaC), можна знайти, наприклад, у публікації заявки PCT WO2009/074575, повний зміст якої включений в даний опис у всій своїй повноті. Серед інших описаних у даному описі захворювань комбінації модуляторів CFTR, таких як сполуки формули I, і засобів, що знижують активність ENaC, корисні при лікуванні синдрому Ліддала, запального або алергійного захворювання, включаючи муковісцидоз, первинної циліарної дискінезії, хронічного бронхіту, хронічного обструктивного захворювання легень, астми, інфекцій дихальних шляхів, карциноми легені, ксеростомії і сухого кератокон’юнктивіту, інфекцій дихальних шляхів (гострих і хронічних; вірусних і бактеріальних) і карциноми легені. Комбінації модуляторів CFTR, таких як сполуки формули I, і засобів, що знижують активність ENaC, також корисні при лікуванні захворювань, опосередкованих блокуванням епітеліального натрієвого каналу, що також включають відмінні від респіраторних захворювань захворювання, пов'язані з анормальною регуляцією рідини через епітелій, у які можливо залучена анормальна фізіологія протективних поверхневих ліпідів на його поверхні, наприклад, ксеростомію (сухість у роті) або сухий кератокон’юнктивіт (сухість очей). Крім того, блокування епітеліального натрієвого каналу в нирці може бути використане для стимуляції діурезу і, тим самим, виклику гіпотензивного ефекту. Астма включає як уроджену (неалергійну) астму, так і набуту (алергійну) астму, астму легкого ступеня, астму середнього ступеня, астму тяжкого ступеня, бронхіальну астму, астму, викликану фізичним навантаженням, професійну астму й астму, викликану після бактеріальної інфекції. Лікування астми також варто розуміти, як установлене для суб'єктів, наприклад, у віці менше 4 або 5 років, що виявляють симптоми стерторозного дихання і діагностованих або які діагностовані як «страждаючі на стридор немовлята», поширюється на категорію пацієнтів основної медичної проблеми і в даний час часто означуваних як астматики початкової або ранньої стадії. (Для зручності цей конкретний астматичний стан називають «синдромом страждаючого на стридор немовляти».) Про профілактичну ефективність при лікуванні астми буде свідчити зменшення частоти або тяжкості симптоматичного приступу, наприклад, гострого астматичного або звужуючого просвіт бронхів приступу, поліпшення легеневої функції або зниження підвищеної реактивності дихальних шляхів. Про неї може, крім того, свідчити 18 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 55 зниження вимоги відносно іншої, симптоматичної терапії, тобто терапії для або яка призначена для обмеження або переривання симптоматичного приступу при його виникненні, наприклад, протизапальної (наприклад, кортикостероїда) або розширюючої бронхи терапії. Профілактична користь при астмі може бути, зокрема, явною в суб'єктів, схильних до «значного зниження максимальної швидкості видиху в ранкові години». «Значне зниження максимальної швидкості видиху в ранкові години» є визнаним астматичним синдромом, який спільний у значного відсотка астматиків і характеризується приступом астми, наприклад, приблизно між 4 і 6 ранку, тобто в момент часу, звичайно значно віддалений від будь-якої раніше призначеної симптоматичної терапії для астми. Хронічне обструктивне захворювання легень включає хронічний бронхіт або пов'язану з ним задишку, емфізему, а також загострення підвищеної реактивності дихальних шляхів після іншої лікарської терапії, зокрема, іншої інгаляційної лікарської терапії. У деяких варіантах здійснення комбінації модуляторів CFTR, таких як сполуки формули I, і засобів, що знижують активність ENaC, корисні при лікуванні бронхіту будь-якого типу або генезу, включаючи, наприклад, гострий, арахісовий, катаральний, крупозний, хронічний або астенічний бронхіт. В іншому варіанті здійснення додатковим засобом є модулятор CFTR, який відрізняється від сполуки формули I, тобто засіб, що робить ефект модулювання активності CFTR. Такі засоби, що приводяться як приклади, включають аталурен ("PTC124®"; 3-[5-(2-фторфеніл)-1,2,4оксадіазол-3-іл]бензойна кислота), синапултид, ланковутид, депелестат (інгібітор рекомбінатної еластати нейтрофілів людини), кобіпростон (7-{(2R,4a,5R,7a)-2-[(3S)-1,1-дифтор-3метилпентил]-2-гідрокси-6-оксооктагідроциклопента[b]пиран-5-іл}гептанова кислота) або (3-(6(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпірин-2-іл)бензойну кислоту. В іншому варіанті здійснення додатковим засобом є (3-(6-(l-(2,2дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпиридин-2-іл)бензойна кислота. В іншому варіанті здійснення додатковим засобом є поживна речовина. Такі речовини, що приводяться як приклади, включають панкреліпазу (заміну панкреатичного ферменту), що включає Pancrease®, Pancreacarb®, Ultrase® або Creon®, Liprotomase® (у минулому Trizytek®), Aquadeks® або інгаляційний глутатіон. В одному варіанті здійснення додатковою, поживною речовиною є панкреліпаза. Кількість додаткового терапевтичного засобу, який присутній у композиціях даного винаходу, не буде перевищувати кількість, що звичайно вводять у композицію, яка містить такий терапевтичний засіб як єдиний активний інгредієнт. Переважна кількість додаткового терапевтичногозасобу в розкритих у даному винаході композиціях буде коливатися приблизно від 50% до 100% від кількості, яка звичайно присутня у композиції, що містить цей засіб як єдиний активний інгредієнт. Сполуки даного винаходу або їх фармацевтично прийнятні композиції можуть бути також включені в сполуки для покриття імплантованого медичного пристрою, такого як протези, штучні клапани, судинні трансплантати, стенти і катетери. Відповідно, даний винахід в іншому аспекті включає композицію для покриття імплантованого пристрою, що містить сполуку даного винаходу, описану вище загалом і по класах і підкласах у даному описі, і носій, що підходить для покриття зазначеного імплантованого пристрою. У ще одному аспекті даний винахід включає імплантований пристрій, покритий композицією, що містить сполуку даного винаходу, описану вище загалом і по класах і підкласах у даному описі, і носій, що підходить для покриття зазначеного імплантованого пристрою. Придатні покривні матеріали і звичайне одержання імплантованих пристроїв з покриттям описані в патентах США 6099562, 5886026 і 5304121. Покривними матеріалами звичайно є біосумісні полімерні матеріали, такі як полімер гідрогелю, поліметилдисилоксан, полікапролактон, поліетиленгліколь, полімолочна кислота, етиленвінілацетат і їхні суміші. Покриття можуть необов'язково бути додатково покриті придатним верхнім шаром фторсилікону, полісахаридів, поліетиленгліколю, фосфоліпідів або їх комбінаціями для додавання композиції властивостей контрольованого вивільнення. Інший аспект даного винаходу належить до способу модулювання активності CFTR у біологічному або зразку в пацієнта (наприклад, in vitro або in vivo), що включає введення пацієнту сполуки формули (I) або композиції, що містить зазначену сполуку, або приведення зазначеного біологічного зразка в контакт із зазначеною сполукою або композицією. Як використано в даному описі, термін «біологічний зразок» включає, але без обмеження, культури клітин або їхні екстракти; матеріал, отриманий за допомогою біопсії від ссавця, або екстракти з нього; і кров, слину, сечу, екскременти, сперму, сльози або інші рідини організму або їхні екстракти. 19 UA 104601 C2 5 10 15 20 25 30 35 40 45 50 Модулювання CFTR у біологічному зразку може бути використане для множини цілей, які відомі фахівцю в даній галузі техніки. Приклади таких цілей включають, але без обмеження, вивчення CFTR у біологічних і патологічних явищах і порівняльній оцінці нових модуляторів CFTR. У ще одному варіанті здійснення запропонований спосіб модулювання активності аніонного каналу in vitro або in vivo, що включає стадію приведення зазначеного каналу в контакт зі сполукою формули (I). У переважних варіантах здійснення аніонним каналом є канал для іона хлору або канал для бікарбонату. В інших переважних варіантах здійснення аніонним каналом є канал для іона хлору. Відповідно до альтернативного варіанта здійснення в даному винаході запропонований спосіб збільшення кількості функціонального CFTR у мембрані клітини, що включає стадію приведення зазначеної клітини в контакт зі сполукою формули (I). Відповідно до іншого переважного варіанта здійснення активність CFTR визначають шляхом вимірювання трансмембранної різниці потенціалів. У способах вимірювання трансмембранної різниці потенціалів у біологічному зразку може бути використаний будь-який з відомих у даній галузі техніки способів, такий як оптичне вимірювання мембранного потенціалу або інші електрофізіологічні методи. При оптичному вимірюванні мембранного потенціалу використовують чутливі до різниці потенціалів FRET-сенсори, описані Gonzalez і Tsien (див. Gonzalez, J. E. and R. Y. Tsien (1995) "Voltage sensing by fluorescence resonance energy transfer in single cells." Biophys J 69(4): 12721280, і Gonzalez, J. E. and R. Y. Tsien (1997); "Improved indicators of cell membrane potential that use fluorescence resonance energy transfer" Chem Biol 4(4): 269-1277), у комбінації з апаратурою для вимірювання зміни флуоресценції, такий як зчитуючий пристрій з вольтрометровим/іонним зондом (VIPR) (див. Gonzalez, J. E., K. Oades, et al. (1999) "Cell-based assays and instrumentation for screening ion-channel targets" Drug Discov Today 4(9): 431-439). Такі чутливі до різниці потенціалів вимірювання основані на зміні резонансного перенесення енергії флуоресценції (FRET) між розчинним у мембрані, чутливим до різниці потенціалів барвником, DiSBAC2(3), і флуоресцентним фосфоліпідом, CC2-DMPE, який прикріплений до зовнішнього шару плазматичної мембрани і діє як донор для FRET. Зміни в мембранному потенціалі (Vm) є причиною перерозподілу негативно зарядженого DiSBAC2(3) по плазматичній мембрані і зміни ступеня перенесення енергії з CC2-DMPE, відповідно. Зміни емісії TM флуоресценції можна відслідковувати, використовуючи VIPR II, який являє собою об'єднані маніпулятор з рідиною і флуоресцентний детектор, сконструйований для проведення основаних на клітинах скринінгів у 96- або 384-ямкових титраційних мікропланшетах. В іншому аспекті даний винахід надає набір для застосування при вимірюванні активності CFTR або його фрагмента в біологічному зразку in vitro або in vivo, що складається з (і) композиції, що містить сполуку формули (I), або будь-якого з вищевказаних варіантів її здійснення; і (ii) інструкції відносно a) приведення композиції в контакт із біологічним зразком і b) вимірювання активності зазначеного CFTR або його фрагмента. В одному варіанті здійснення набір, крім того, включає інструкції відносно a) приведення додаткової сполуки в контакт із біологічним зразком; b) вимірювання активності зазначеного CFTR або його фрагмента в присутності зазначеної додаткової сполуки і c) порівняння активності CFTR у присутності додаткової сполуки з активністю CFTR у присутності сполуки формули (I). У переважних варіантах здійснення набір застосовують для вимірювання густини CFTR. Для можливості більш повного розуміння розкритого в даному описі винаходу представлені наступні приклади. Варто розуміти, що ці приклади представлені винятково з ілюстративною метою і не повинні розглядається як обмеження даного винаходу яким-небудь чином. Способи і проміжні продукти для одержання сполук формули (I) Інший аспект даного винаходу належить до способу одержання сполуки формули (Ic): або її фармацевтично прийнятних солей, що включає: а) взаємодію кислоти формули 1d з аміном формули 2c, з одержанням сполуки формули (Ic): 20 UA 104601 C2 , де: кільце А вибирають з 5 10 15 20 де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем, і а R являє собою водень або силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM). В одному варіанті здійснення взаємодію кислоти формули 1d з аміном формули 2c здійснюють у розчиннику в присутності гексафторфосфату О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (HATU) і триетиламіну або в розчиннику в присутності циклічного ангідриду пропілфосфокислоти (T3P) і піридину. Більш конкретно, розчинник включає N,Nдиметилформамід, етилацетат або 2-метилтетрагідрофуран. а В іншому варіанті здійснення R являє собою водень або TBDMS. а В іншому варіанті здійснення R являє собою TBDMS. В іншому варіанті здійснення спосіб включає додаткову стадію зняття захисної групи, наприклад, коли кільце А являє собою 25 30 або а , де R являє собою силілзахисну групу, з одержанням сполуки формули (Ic), де кільце А являє собою або . Як правило, для видалення силілзахисної групи необхідна обробка такою кислотою, як оцтова кислота або розведена мінеральна кислота або т. п., хоча можуть використовуватися інші реагенти, такі як джерело іона фтору (наприклад, тетрабутиламонійфторид). Спосіб одержання аміну формули 2c зі сполуки формули 2a включає стадії: (a) взаємодії сполуки формули 2a з аміном формули 3, з одержанням сполуки формули 2b: де: Hal являє собою F, Cl, Br або I; і амін формули 3 являє собою , , або (b) відновлення сполуки формули 2b до аміну формули 2c: 21 ,і UA 104601 C2 5 . В одному варіанті здійснення способу одержання аміну формули 2c амін формули 3 на стадії (a) одержують in situ з відповідної четвертинної амонієвої солі, такої як амінгідрохлоридна сіль, хоча також можуть використовуватися інші амонієві солі (наприклад, сіль трифтороцтової кислоти). В одному варіанті здійснення стадія (a) призначена для одержання аміну формули 2c, коли а 10 15 20 25 30 амін формули 3 являє собою або , і R являє собою водень або TBDMS. а Більш конкретно, R являє собою TBDMS. В іншому варіанті здійснення стадію (a) здійснюють у полярному апротонному розчиннику в присутності основи - третинного аміну. Приклади третинних амінів, що можуть використовуватися, включають триетиламін, діізопропілетиламін, 1,5-діазабіцикло[4.3.0]нон-5ен (DBN), 1,8-діазабіцикло[5.4.0]ундек-7-ен (DBU), 1,4-діазабіцикло[2.2.2]октан (DABCO) і піридин. Приклади розчинників, що можуть використовуватися, включають N,Nдиметилформамід, диметилсульфоксид або ацетонітрил. В одному варіанті здійснення підставою третинного аміну є триетиламін. В іншому варіанті здійснення стадію (a) здійснюють в ацетонітрилі в присутності триетиламіну. В іншому варіанті здійснення температура реакції на стадії (a) становить приблизно від 75ºC до приблизно 85ºC. В іншому варіанті здійснення час реакції на стадії (a) становить приблизно від 2 до приблизно 30 годин. В одному варіанті здійснення способу одержання аміну формули 2c стадію (b) здійснюють у полярному протонному розчиннику або в суміші полярних протонних розчинників у присутності паладієвого каталізатора. Коли паладій є каталізатором, розчинником на стадії (b) звичайно є полярний протонний розчинник, такий як спирт. Більш конкретно, розчинник включає метанол або етанол. В іншому варіанті здійснення стадію (b) здійснюють у полярному протонному розчиннику, такому як вода, у присутності Fe і FeSО4 або Zn і AcOH. Інший аспект даного винаходу належить до способу одержання сполуки формули (Ic): або її фармацевтично прийнятних солей, що включає стадії: а) взаємодії сполуки формули 2а з аміном формули 3, з одержанням сполуки формули 2b: (b) перетворення сполуки формули 2b в амін формули 2c шляхом відновлення: 35 ;і (c) взаємодії аміну формули 2c з кислотою формули 1d, з одержанням сполуки формули (Ic): 22 UA 104601 C2 , де Hal являє собою F, Cl, Br або I; амін формули 3 являє собою кільце А вибирають з 5 10 15 , або , , , або , де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем, і а R являє собою водень або силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM). В одному варіанті здійснення амін формули 3 на стадії (a) одержують in situ з відповідної четвертинної амонієвої солі, такої як амінгідрохлоридна сіль, хоча також можуть використовуватися інші амонієві солі (наприклад, сіль трифтороцтової кислоти). В одному варіанті здійснення стадія (a) призначена для одержання аміну формули 2c, коли а 20 25 30 35 40 45 , амін формули 3 являє собою або , і R являє собою водень або TBDMS. а Більш конкретно, R являє собою TBDMS. В іншому варіанті здійснення стадію (a) здійснюють у полярному апротонному розчиннику в присутності основи третинного аміну. Приклади третинних амінів, що можуть використовуватися, включають триетиламін, діізопропілетиламін, 1,5-диазабіцикло[4.3.0]нон-5ен (DBN), 1,8-діазабіцикло[5.4.0]ундек-7-ен (DBU), 1,4-діазабіцикло[2.2.2]октан (DABCO) і піридин. В одному варіанті здійснення підставою третинного аміну є триетиламін. В іншому варіанті здійснення стадію (a) здійснюють в ацетонітрилі в присутності триетиламіну. В іншому варіанті здійснення температура реакції на стадії (a) становить приблизно від 75ºC до приблизно 85ºC. В іншому варіанті здійснення час реакції на стадії (a) становить приблизно від 2 до приблизно 30 годин. В одному варіанті здійснення способу одержання аміну формули 2c стадію (b) здійснюють у полярному протонному розчиннику або в суміші полярних протонних розчинників у присутності паладієвого каталізатора. Коли паладій є каталізатором, розчинником на стадії (b) звичайно є полярний протонний розчинник, такий як спирт. Більш конкретно, розчинник включає метанол або етанол. В іншому варіанті здійснення стадію (b) здійснюють у полярному протонному розчиннику, такому як вода, у присутності Fe і FeSО4 або Zn і AcOH. В одному варіанті здійснення стадії (с) взаємодія кислоти формули 1d з аміном формули 2c здійснюють у розчиннику в присутності гексафторфосфату О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (HATU) і триетиламіну або в розчиннику в присутності циклічного ангідриду пропілфосфокислоти (T3P) і піридину. Більш конкретно, розчинник включає N,Nдиметилформамід, етилацетат або 2-метилтетрагідрофуран. а В іншому варіанті здійснення R являє собою водень або TBDMS. а В іншому варіанті здійснення R являє собою TBDMS. 23 UA 104601 C2 В іншому варіанті здійснення спосіб включає додаткову стадію зняття захисної групи, наприклад, коли кільце А представляє або , де R а являє собою силілзахисну групу, з одержанням сполуки формули (Ic), де кільце А являє собою 5 . Як правило, для видалення силілзахисної групи потрібна обробка такою кислотою, як оцтова кислота або розведена мінеральна кислота або т. п., хоча можуть використовуватися інші реагенти, такі як джерело іона фтору (наприклад, тетрабутиламонійфторид). Інший аспект даного винаходу належить до сполуки, що являє собою кільце А являє собою 10 15 20 або , де , , або , де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; і а R являє собою силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM). Інший аспект даного винаходу належить до сполуки, що являє собою кільце А являє собою , де , , або , де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; і а R являє собою силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM). Інший аспект даного винаходу належить до сполуки формули (IA): 24 UA 104601 C2 або її фармацевтично прийнятних солей, де 5 10 вибирають з або , де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем, і а R являє собою силілзахисну групу, вибрану з групи, яка складається з триметилсилілу (TMS), трет-бутилдифенілсилілу (TBDPS), трет-бутилдиметилсилілу (TBDMS), триізопропілсилілу (TIPS) і [2-(триметилсиліл)етокси]метилу (SEM). Інший аспект даного винаходу належить до сполуки формули (I): або її фармацевтично прийнятних солей, де кільце А вибирають з 15 20 , , або , де 1 R являє собою -CF3, -CN або -CCCH2N(CH3)2; 2 R являє собою водень, -CH3, -CF3, -OH або -CH2OH; 3 R являє собою водень, -CH3, -OCH3 або -CN; 2 3 за умови, що обидва R і R не є одночасно воднем, отриманому за будь-яким з описаних у даному описі способів. Інший аспект даного винаходу належить до сполуки, вибраної із групи, яка складається з: 25 UA 104601 C2 і 5 10 , отриманому за будь-яким з описаних у даному описі способів. ПРИКЛАДИ Проміжний продукт 1: 4-оксо-5-(трифторметил)1,4-дигідрохінолін-3-карбонова кислота (17) Синтез вказаної в заголовку сполуки представлений на схемі 4. Схема 4 26 UA 104601 C2 5 10 15 20 25 30 35 40 45 Одержання діетил-2-((2-хлор-5-(трифторметил)феніламіно)метилен)малонату (14) У тригорлій, круглодонній колбі об’ємом 1 л, оснащеній конденсуючою системою ДінаСтарка, в атмосфері азоту об’єднували 2-хлор-5-(трифторметил)анілін 12 (200 г, 1,023 моль), діетил-2-(етоксиметилен)малонат 13 (276 г, 1,3 моль) і толуол (100 мл). Розчин нагрівали при помішуванні до 140ºC, і цю температуру підтримували протягом 4 год. Реакційну суміш охолоджували до 70C і повільно додавали гексан (600 мл). Суспензію, що утворилася, перемішували і давали їй нагрітися до кімнатної температури. Тверду речовину відділяли фільтруванням, промивали 10% етилацетатом у гексані (2 400 мл) і потім сушили у вакуумі, з одержанням білої твердої речовини (350 г, 94% вихід) як бажаний продукт конденсації - діетил2-((2-хлор-5-(трифторметил)феніламіно)метилен)малонату 14. 1 H ЯМР (400 MГц, ДМСО-d6) δ 11,28 (д, J=13,0 Гц, 1H), 8,63 (д, J=13,0 Гц, 1H), 8,10 (с, 1H), 7,80 (д, J=8,3 Гц, 1H), 7,50 (дд, J=1,5, 8,4 Гц, 1H), 4,24 (кв, J=7,1 Гц, 2H), 4,17 (кв, J=7,1 Гц, 2H), 1,27 (м, 6H). Одержання етил-8-хлор-4-оксо-5-(трифторметил)-1,4-дигідрохінолін-3-карбоксилату (15) У тригорлу колбу об’ємом 1 л уливали Даутерм® (200 мл, 8 мл/г), який піддавали дегазації при 200ºC протягом 1 год. Розчинник нагрівали до 260ºC, і в нього порціями завантажували протягом 10 хв. діетил-2-((2-хлор-5-(трифторметил)феніламіно)метилен)малоат 14 (25 г, 0,07 моль). Суміш, що утворилася, перемішували при 260ºC протягом 6,5 годин (год), і побічний продукт, що утворився - етанол видаляли дистиляцією. Суміші давали повільно охолоджуватися до 80ºC. Повільно протягом 30 хвилин (хв.) додавали гексан (150 мл), і потім додаткові 200 мл гексану додавали однією порцією. Завис перемішували до досягнення його кімнатної температури. Тверду речовину відфільтровували, промивали гексаном (3150 мл) і потім сушили у вакуумі, з одержанням етил-8-хлор-4-оксо-5-(трифторметил)-1,4-дигідрохінолін3-карбоксилату 15 у вигляді жовтувато-коричневої твердої речовини (13,9 г, 65% вихід). 1 H ЯМР (400 MГц, ДМСО-d6) δ 11,91 (с, 1H), 8,39 (с, 1H), 8,06 (д, J=8,3 Гц, 1H), 7,81 (д, J=8,4 Гц, 1H), 4,24 (кв., J=7,1 Гц, 2H), 1,29 (т, J=7,1 Гц, 3H). Одержання етил-4-оксо-5-(трифторметил)-1H-хінолін-3-карбоксилату (16) У тригорлу колбу об’ємом 5 л завантажували етил-8-хлор-4-оксо-5-(трифторметил)-1,4дигідрохінолін-3-карбоксилат 15 (100 г, 0,3 моль), етанол (1250 мл, 12,5 мл/г) і триетиламін (220 мл, 1,6 моль). У посудину потім завантажували 10 г 10% Pd/C (50% вологи) при 5C. Реакційну суміш енергійно перемішували в атмосфері водню протягом 20 із при 5C, після чого реакційну суміш концентрували до об’єму приблизно 150 мл. Продукт, етил-4-оксо-5-(трифторметил)-1Hхінолін-3-карбоксилат 16, у вигляді суспензії з Pd/C, забирали безпосередньо на наступну стадію. Одержання 4-оксо-5-(трифторметил)-1,4дигідрохінолін-3-карбонової кислоти (17) Етил-4-оксо-5-(трифторметил)-1H-хінолін-3-карбоксилат 16 (58 г, 0,2 моль, груба реакційна суспензія, що містить Pd/C) суспендували в NaOH (814 мл 5M, 4,1 моль) у колбі об’ємом 1 л зі зворотним холодильником і нагрівали до 80ºC протягом 18 год, з наступним додатковим нагріванням до 100ºC протягом 5 год. Теплу реакційну суміш фільтрували через упакований целіт для видалення Pd/C, і целіт промивали 1н NaOH. Фільтрат підкислювали приблизно до рН 1, з одержанням густого, білого осаду. Осад відфільтровували, потім промивали водою і холодним ацетонітрилом. Тверду речовину потім сушили у вакуумі, з одержанням 4-оксо-5(трифторметил)-1,4-дигідрохінолін-3-карбонової кислоти 17 у вигляді білої твердої речовини (48 г, 92% вихід). 1 H ЯМР (400,0 MГц, ДМСО-d6) δ 15,26 (с, 1H), 13,66 (с, 1H), 8,98 (с, 1H), 8,13 (дд, J=1,6, 7,8 Гц, 1H), 8,06-7,99 (м, 2H). Проміжний продукт 2: 4-(7-азабіцикло)[2.2.1]гептан-7-іл)-2-(трифторметил)анілін (21) 27 UA 104601 C2 Синтез вказаної в заголовку сполуки представлений на схемі 5. Схема 5 5 10 15 20 25 30 35 40 45 Одержання 7-[4-нітро-3-(трифторметил)феніл]-7-азабіцикло[2.2.1]гептану (20) У колбу, що містить гідрохлорид 7-азабіцикло[2.2.1]гептану 7a (4,6 г, 34,43 ммоль, отриманий від Tyger Scientific Inc., 324 Stokes Avenue, Ewing, NJ, 08638 США) в атмосфері азоту додавали розчин 4-фтор-1-нітро-2-(трифторметил)бензолу 18 (6,0 г, 28,69 ммоль) і триетиламін (8,7 г, 12,00 мл, 86,07 ммоль) в ацетонітрилі (50 мл). Колбу з реакційною сумішшю нагрівали при 80C в атмосфері азоту протягом 16 год. Реакційній суміші давали охолоджуватися, і потім неї розподіляли між водою і дихлорметаном. Органічний шар промивали 1M HCl, сушили над Na2SO4, фільтрували і випарювали досуха. Очищення хроматографією на силікагелі (0-10% етилацетату в гексанах) давало 7-[4-нітро-3-(трифторметил)феніл]-7-азабіцикло[2.2.1]гептан 19 (7,2 г, 88% вихід) у вигляді жовтої твердої речовини. 1 H ЯМР (400,0 MГц, ДМСО-d6) δ 8,03 (д, J=9,1 Гц, 1H), 7,31 (д, J=2,4 Гц, 1H), 7,25 (дд, J=2,6, 9,1 Гц, 1H), 4,59 (с, 2H), 1,69-1,67 (м, 4H), 1,50 (д, J=7,0 Гц, 4H). Одержання 4-(7-азабіцикло[2.2.1]гептан-7-іл)-2-(трифторметил)аніліну (20) У колбі, із завантаженим 7-[4-нітро-3-(трифторметил)феніл]-7-азабіцикло[2.2.1]гептаном 19 (7,07 г, 24,70 ммоль) і 10% Pd/C (0,71 г, 6,64 ммоль), створювали вакуум, і потім у неї швидко впускали азот. Додавали етанол (22 мл), і колбу з реакційною сумішшю підключали до водню з балона. Після інтенсивного перемішування протягом 12 через реакційну суміш пропускали азот, і Pd/C видаляли фільтруванням. Фільтрат концентрували до темної олії при зниженому тиску, і залишок очищали хроматографією на силікагелі (0-15% етилацетату в гексанах), з одержанням 4-(7-азабіцикло[2.2.1]гептан-7-іл)-2-(трифторметил)аніліну 20 у вигляді пурпурової твердої речовини (5,76 g, 91% вихід). 1 H ЯМР (400,0 MГц, ДМСО-d6) δ 6,95 (дд, J=2,3, 8,8 Гц, 1H), 6,79 (д, J=2,6 Гц, 1H), 6,72 (д, J=8,8 Гц, 1H), 4,89 (с, 2H), 4,09 (с, 2H), 1,61-1,59 (м, 4H) і 1,35 (д, J=6,8 Гц, 4H). Проміжний продукт 3: 2-аміно-5-(7-азабіцикло[2.2.1]гептан-7-іл) бензонітрил (23) Синтез вказаної в заголовку сполуки представлений на схемі 6. Схема 6 Одержання 5-(7-азабіцикло[2.2.1]гептан-7-іл)-2-нітробензонітрилу (22) До розчину 5-фтор-2-нітробензонітрилу 21 (160 мг, 0,96 ммоль) в ацетонітрилі (1 мл) повільно додавали гідрохлорид 7-азабіцикло[2.2.1]гептану 7a (129 мг, 0,96 ммоль) і триетиламін (244 мг, 335,7 мкл, 2,41 ммоль). Реакційну суміш перемішували при 60C протягом 4 год. Реакцію гасили водою, підкисляли 1н HCl до pН 1 і екстрагували дихлорметаном (310 мл). Об'єднані органічні шари промивали водою, сушили над Na2SO4, фільтрували і випарювали, з одержанням 5-(7-азабіцикло[2.2.1]гептан-7-іл)-2-нітробензонітрилу 22 (205 мг, 87% вихід). РХ/МС (рідинна хроматографія/мас-спектрометрія) m/z (відношення маси до заряду) 244,3 + [M+H] , час утримування 1,69 хв. (RP-C18, 10-99% CH3CN/0,05% ТФОК протягом 3 хв.). Одержання 2-аміно-5-(7-азабіцикло[2.2.1]гептан-7-іл)бензонітрилу (23) У колбу, із завантаженим 5-(7-азабіцикло[2.2.1]гептан-7-іл)-2-нітробензонітрилом 22 (205 мг, 0,8427 ммоль) і 10% Pd/C (41 мг, 0,39 ммоль), швидко впускали азот і потім у ній створювали вакуум. В атмосфері азоту додавали метанол (4 мл), і колбу підключали до водню з балона. Після перемішування протягом 15 хв. Pd/C видаляли фільтруванням, розчинник видаляли при зниженому тиску, з одержанням 2-аміно-5-(7-азабіцикло[2.2.1]гептан-7-іл)бензонітрилу 23 (170 мг, 95% вихід). 1 H ЯМР (400,0 MГц, ДМСО-d6) δ 7,02 (дд, J=2,8, 9,0 Гц, 1H), 6,87 (д, J=2,7 Гц, 1H), 6,68 (д, J=9,0 Гц, 1H), 5,36 (с, 2H), 4,09 (с, 2H), 1,59 (д, J=6,8 Гц, 4H), 1,34 (д, J=6,8 Гц, 4H). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюModulators of cystic fibrosis transmembrane conductance regulator
Автори російськоюBinch, Hayley, Fanning, Lev, T.,D., Hurley, Dennis, Sheth, Urvi, Silina, Alina, Yang, Xiaoqing, Botfield, Martyn, Grootenhuis, Peter, D.,J., Van Goor, Fredrick, Numa, Mehdi, Michel Djamel
МПК / Мітки
МПК: A61P 11/00, A61K 31/439, C07D 451/02
Мітки: муковісцидозі, провідності, трансмембранної, модулятори, регулятора
Код посилання
<a href="https://ua.patents.su/52-104601-modulyatori-regulyatora-transmembranno-providnosti-pri-mukoviscidozi.html" target="_blank" rel="follow" title="База патентів України">Модулятори регулятора трансмембранної провідності при муковісцидозі</a>
Попередній патент: Комбінована терапія із застосуванням пептиду епоксикетону
Наступний патент: Спосіб одержання виробу з шоколаду з заповненим центром
Випадковий патент: Пристрій для дисперсійно-слідкувального аналізу у реальному часі активного спектра короткочасних нестаціонарних процесів