Піразинові похідні як enac блокатори
Номер патенту: 111595
Опубліковано: 25.05.2016
Автори: Хант Пітер, Хоушем Кетрин, Бхелей Гурдіп, Сміт Нікола, Едвардс Лі
Формула / Реферат
1. Сполука, вибрана з групи, що складається з
дипропілкарбамоїлметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти;
[(2-гідроксіетил)метилкарбамоїл]метилового ефіру [4-(3-{2-[(Z)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти;
циклогексилоксикарбонілметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
циклогексилоксикарбонілметилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти;
диметилкарбамоїлметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
дипропілкарбамоїлметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
тpeт-бутоксикарбонілметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
бензилоксикарбонілметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
діетилкарбамоїлметилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
2-оксо-2-піперидин-1-ілетилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
дипропілкарбамоїлметилового ефіру [2-хлор-4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
2-оксо-2-(2-трифторметилпіролідин-1-іл)етилового ефіру 3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти;
2-(2-оксопіперидин-1-іл)етилового ефіру [2-хлор-4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
2-морфолін-4-іл-2-оксоетилового ефіру [4-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]дец-8-ил}-3-оксопропіл)феноксі]оцтової кислоти;
дипропілкарбамоїлметилового ефіру 1-[(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)метил]циклобутанкарбонової кислоти;
дипропілкарбамоїлметилового ефіру 3-[3-(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}феніл)уреїдо]пропіонової кислоти та
2-оксо-2-(2-трифторметилпіролідин-1-іл)етилового ефіру 1-[(3-{2-[(Е)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4.5]декан-8-карбоніл}бензолсульфоніламіно)метил]циклобутанкарбонової кислоти;
або її фармацевтично прийнятна сіль або сольват.
2. Сполука або сіль за п. 1, що має структуру:
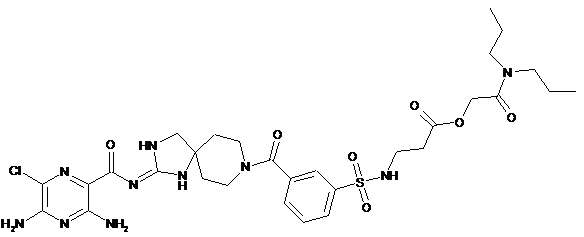 ,
,
або її фармацевтично прийнятна сіль.
3. Сполука або сіль за п. 2, де сполука являє собою сукцинатну сіль.
4. Сполука або сіль за п. 1, що має структуру:
 ,
,
або її фармацевтично прийнятна сіль.
5. Сполука або сіль за п. 1, що має структуру:
 ,
,
або її фармацевтично прийнятна сіль.
6. Сполука або сіль за п. 1, що має структуру:
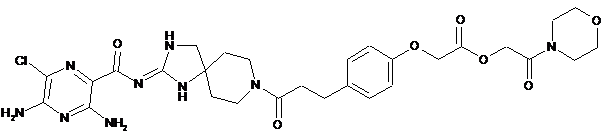 ,
,
або її фармацевтично прийнятна сіль.
7. Сполука або сіль за п. 1, що має структуру:
 ,
,
або її фармацевтично прийнятна сіль.
8. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-7 та одну або більше фармацевтично прийнятних допоміжних речовин, розріджувачів та/або носіїв.
9. Фармацевтична композиція за п. 8 у комбінації з одним або більше іншими терапевтичними засобами.
10. Фармацевтична композиція за п. 9, у якій інший терапевтичний засіб вибраний з модифікаторів функції CFTR та макролідних антибіотиків.
11. Сполука за будь-яким з пп. 1-7 для застосування як фармацевтичного препарату.
12. Сполука за будь-яким з пп. 1-7 для застосування у лікуванні або попередженні захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів.
13. Сполука для застосування за п. 12, де захворювання або стан вибраний з кістозного фіброзу, первинної циліарної дискінезії та хронічного обструктивного захворювання легенів.
Текст
Реферат: (72) Винахідник(и): Бхелей Гурдіп (GB/GB), Едвардс Лі (GB/GB), Хоушем Кетрін (GB/GB), Хант Пітер (GB/GB), Сміт Нікола (GB/GB) (73) Власник(и): НОВАРТІС АГ, Lichtstrasse 35, CH-4056 Basel, Switzerland (CH) (74) Представник: Ошарова Iрина Олександрiвна, реєстр. №9 (56) Перелік документів, взятих до уваги експертизою: wo 2009/074575 A2, 18.06.2009 WO 2009/150137 A2, 17.12.2009 JH LI ET AL: "Stereoselective blockade of amphibian epithelial sodium channels by amiloride analogs", JOURNAL OF FARMACOLOGY AND EXPERIMENTAL THERAPEUTICS, AMERICAN SOCIETY FOR PHARMACOLOGY AND EXPERIMENTAL THERAPEUTICS, US, vol. 267, no. 3, 1 December 1993 (1993-12-01), pages 10811084, XP008093856, ISSN: 0022-3565 UA 111595 C2 (12) UA 111595 C2 1 2 3 4 5 6 Сполуки формули (І) та їх фармацевтично прийнятні солі та сольвати, де R , R , R , R , R , R , 7 8 9 10 R , R , R та R приймають значення, як зазначено у описі, є придатними для лікування захворювань, опосередкованих блокадою епітеліальних натрієвих каналів. Також описують фармацевтичні композиції, які містять сполуки, та способи одержання даних сполук. UA 111595 C2 5 10 15 20 25 30 35 40 45 Даний винахід відноситься до органічних сполук та їх застосування як лікарських препаратів, зокрема, для лікування запальних, обструктивних або алергічних захворювань та станів, особливо запального або обструктивного захворювання дихальних шляхів, або гідратації слизової оболонки. У одному аспекті даний винахід відноситься до сполуки формули I: або її фармацевтично прийнятної солі або сольвату, де 1 R являє собою H, галоген, C1-C8-алкільну, C1-C8-галогеналкільну, C1-C8-галогеналкокси, C3C15-карбоциклічну групу, нітро, ціано, C6-C15-членну ароматичну карбоциклічну групу або C1-C8алкіл, заміщений C6-C15-членною ароматичною карбоциклічною групою; 2 3 4 5 кожен R , R , R та R незалежно вибраний з H та C1-C6 алкілу; 6 7 8 9 16 кожен R , R , R та R незалежно вибраний з H; SO2R ; арилу, необов’язково заміщеного однією або більше Z групами; C3-C10 карбоциклічної групи, необов’язково заміщеної однією або більше Z групами; C3-C14 гетероциклічної групи, необов’язково заміщеної однією або більше Z групами; C1-C8 алкілу, необов’язково заміщеного арильною групою, яка необов’язково заміщена однією або більше Z групами, C3-C10 карбоциклічної групи, необов’язково заміщеної однією або більше Z групами, або C3-C14 гетероциклічної групи, необов’язково заміщеної однією або більше Z групами; 10 R представлений формулою 2: 11a 12a 11b 12b 11c 12c 13 -(C0-C3алкілен)-B-X-(CR R )m-(CR R )n-(CR R )p-C(O)OR , де алкіленові групи необов’язково заміщені однією або більше Z групами; B являє собою арил, необов’язково заміщений однією або більше Z групами; 15 15 15 15 X вибраний зі зв’язку, -NR (SO2)-, -(SO2)NR -, -(SO2)-, -NR C(O)-, -C(O)NR -, 15 17 15 15 NR C(O)NR -, -NR C(O)O-, -NR -, C(O)O, OC(O), C(O), O та S; 11a 11b 11c 12a 12b 12c кожен R , R , R , R , R та R незалежно вибрані з H та C1-C6 алкілу; або 11a 12a R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-8-членну циклоалкільну групу; або 11b 12b R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-8-членну циклоалкільну групу; або 11c 12c R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-8-членну циклоалкільну групу; 13 22 23 23 R вибраний з (C1-C3 алкіл)-C(O)NR R ; (C1-C3 алкіл)-C(O)OR та (C1-C3 алкіл)23 22; NR C(O)R 15 17 кожен R та R незалежно вибраний з H та С1-C6 алкілу; 16 R вибраний з C1-C8 алкілу, арилу та 3-14-членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S; Z незалежно вибраний з -OH, арилу, -O-арилу, C7-C14 аралкілу, -O-C7-C14 аралкілу, C1-C6 19 21 19 21 20 19 20 19 20 алкілу, C1-C6 алкокси, -NR (SO2)R , -(SO2)NR R , -(SO2)R , -NR C(O)R , -C(O)NR R , 19 20 18 19 20 19 21 19 19 19 19 NR C(O)NR R , -NR C(O)OR , -NR R , C(O)OR , -C(O)R , SR , -OR , оксо-групи, CN, NO2 та галогену, де кожна з алкільних, алкокси, аралкільних та арильних груп необов’язково заміщена одним або більше замісниками, вибраними з OH, галогену, C 1-C4 галогеналкілу та C1C4 алкокси-групи; 18 20 22 кожен R , R та R незалежно вибраний з H та C1-C6 алкілу; 19 21 23 кожен R , R та R незалежно вибраний з H; C1-C8 алкілу; C3-C8 циклоалкілу; C1-C4 алкокси-C1-C4 алкілу; (C0-C4 алкіл)арилу, необов’язково заміщеного однією або більше групами, вибраними з C1-C6 алкілу, C1-C6 алкокси групи та галогену; (C0-C4 алкіл)-3-14-членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, оксо-групи, C1-C6 алкілу та -C(O)C1-C6 алкілу; -(C0-C4 алкіл)-O-арилу, необов’язково 1 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 заміщеного однією або більше групами, вибраними з C 1-C6 алкілу, C1-C6 алкокси групи та галогену; та (C0-C4 алкіл)-O-3-14-членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, C 1-C6 алкілу та -C(O)C1-C6 алкілу; де алкільні групи необов’язково заміщені одним або більше атомами галогену, гідроксилом, C 1-C4 алкокси групою, -C(O)NH2, -C(O)NHC1-C6алкілом або -C(O)N(C1-C6 алкіл)2; або 19 20 R та R разом з атомом азоту, з яким вони з’єднані, утворюють 5-10-членну гетероциклічну групу, причому гетероциклічна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклічна група необов’язково заміщена одним або більше замісниками, вибраними з OH; галогену; арилу; 5-10-членної гетероциклічної групи, що містить один або більше гетероатомів, вибраних з N, O та S; -S(O)2-арилу; -S(O)2-C1-C6 алкілу; C1-C6 алкілу, необов’язково заміщеного одним або більше атомами галогену; C 1-C6 алкокси, необов’язково заміщеного однією або більше OH групами або C 1-C4 алкокси; та C(O)OC1-C6 алкілу, де арильні та гетероциклічні заміщуючі групи самі необов’язково заміщені C 1-C6 алкілом, C1-C6 галогеналкілом або C1-C6 алкокси групою; або 19 21 R та R разом з атомом азоту, з яким вони з’єднані, утворюють 5-10-членну гетероциклічну групу, причому гетероциклічна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклічна група необов’язково заміщена одним або більше замісниками, вибраними з OH; галогену; арилу; 5-10-членної гетероциклічної групи, що містить один або більше гетероатомів, вибраних з N, O та S; -S(O)2-арилу; -S(O)2-C1C6 алкілу; C1-C6 алкілу, необов’язково заміщеного одним або більше атомами галогену; C 1-C6 алкокси, необов’язково заміщеного однією або більше OH групами або C 1-C4 алкокси; та C(O)OC1-C6 алкілу, де арильні та гетероциклічні заміщуючі групи самі необов’язково заміщені C1-C6 алкілом, C1-C6 галогеналкілом або C1-C6 алкокси групою; або 18 20 R та R разом з атомом азоту, з яким вони з’єднані, утворюють 5-10-членну гетероциклічну групу, причому гетероциклічна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклічна група необов’язково заміщена одним або більше замісниками, вибраними з OH; галогену; арилу; 5-10-членної гетероциклічної групи, що містить один або більше гетероатомів, вибраних з N, O та S; -S(O)2-арилу; -S(O)2-C1C6 алкілу; C1-C6 алкілу, необов’язково заміщеного одним або більше атомами галогену; C 1-C6 алкокси, необов’язково заміщеного однією або більше OH групами або C 1-C4 алкокси; та C(O)OC1-C6 алкілу, де арильні та гетероциклічні заміщуючі групи самі необов’язково заміщені C1-C6 алкілом, C1-C6 галогеналкілом або C1-C6 алкокси групою; або 22 23 R та R разом з атомом(ами), з яким(и) вони з’єднані, утворюють 5-10-членну гетероциклічну групу, причому гетероциклічна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклічна група необов’язково заміщена однією або більше Z групами; m дорівнює 0, 1, 2 або 3; n дорівнює 0, 1, 2 або 3; p дорівнює 0, 1, 2 або 3; де щонайменше один з m, n або p не дорівнює 0. 1 У іншому варіанті здійснення даного винаходу, як визначено вище, R являє собою галоген. 1 У наступному варіанті здійснення R являє собою хлор. 2 3 4 5 У іншому варіанті здійснення даного винаходу, як визначено вище, R , R , R та R являють собою H. 6 7 8 9 У іншому варіанті здійснення даного винаходу, як визначено вище, R , R , R та R являють собою H. 10 У іншому варіанті здійснення даного винаходу, як визначено вище, R являє собою -B-X11a 12a 11b 12b 13 (CR R )-(CR R )-C(O)OR . 10 15 11a 12a 11b 12b У наступному варіанті здійснення R являє собою -B-(SO2)NR -(CR R )-(CR R )13 C(O)OR . 10 15 17 У ще альтернативному наступному варіанті здійснення R являє собою -B-NR C(O)NR 11a 12a 11b 12b 13 (CR R )-(CR R )-C(O)OR . 10 У альтернативному варіанті здійснення даного винаходу, як визначено вище, R являє 11a 12a 13 собою -(C2алкілен)-B-X-(CR R )-C(O)OR , де алкіленові групи необов’язково заміщені однією або більше Z групами. У наступному варіанті здійснення алкіленові групи є незаміщеними. У ще наступному варіанті здійснення X являє собою O. 10 11a 12a 13 У ще наступному варіанті здійснення R являє собою -(CH2)2-B-O-(CR R )-C(O)OR . У іншому варіанті здійснення даного винаходу, як визначено вище, B являє собою феніл, необов’язково заміщений однією або більше Z групами. 2 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 У наступному варіанті здійснення B являє собою феніл, необов’язково заміщений галогеном; у ще наступному варіанті здійснення галоген являє собою хлор. 15 У іншому варіанті здійснення даного винаходу, як визначено вище, X вибраний з -(SO2)NR 15 17 , -NR C(O)NR - та O. 15 17 У іншому варіанті здійснення даного винаходу, як визначено вище, R та R являють собою H. 11a 11b 11c У іншому варіанті здійснення даного винаходу, як визначено вище, кожен R , R , R , 12a 12b 12c R , R та R незалежно вибраний з H та C1-C3 алкілу; або 11a 12a R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-, 4- або 5-членну циклоалкільну групу; або 11b 12b R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-, 4- або 5-членну циклоалкільну групу; або 11c 12c R та R разом з атомом вуглецю, з яким вони з’єднані, утворюють 3-, 4- або 5-членну циклоалкільну групу. У іншому варіанті здійснення даного винаходу, як визначено вище, m дорівнює 0 або 1. У іншому варіанті здійснення даного винаходу, як визначено вище, n дорівнює 0 або 1. У іншому варіанті здійснення даного винаходу, як визначено вище, p дорівнює 0 або 1. У іншому варіанті здійснення даного винаходу, як визначено вище, сума m, n та p дорівнює 0, 1, 2 або 3; у наступному варіанті здійснення сума дорівнює 1, 2 або 3; у ще наступному варіанті здійснення сума дорівнює 1 або 2. У іншому варіанті здійснення даного винаходу, як визначено вище, де X вибраний з 15 15 17 (SO2)NR - та -NR C(O)NR -, сума m, n та p дорівнює 2. У іншому варіанті здійснення даного винаходу, як визначено вище, де X являє собою O, сума m, n та p дорівнює 1. 13 У іншому варіанті здійснення даного винаходу, як визначено вище, R вибраний з (C1 алкіл)22 23 23 23 22 C(O)NR R ; (С1 алкіл)-C(O)OR та (C2 алкіл)-NR C(O)R . 13 У наступному варіанті здійснення даного винаходу, як визначено вище, R вибраний з (C1 22 23 23 алкіл)-C(O)NR R та (C1 алкіл)-C(O)OR . 13 В ще наступному варіанті здійснення даного винаходу, як визначено вище, R являє собою 22 23 (C1 алкіл)-C(O)NR R . У іншому варіанті здійснення даного винаходу, як визначено вище, 22 R вибраний з H та C1-C3 алкілу; 23 R вибраний з H; C1-C8 алкілу; C3-C8 циклоалкілу; C1-C4 алкокси-C1-C4 алкілу; (C0-C4 алкіл)арилу, необов’язково заміщеного однією або більше групами, вибраними з C 1-C6 алкілу, C1-C6 алкокси групи та галогену; (C0-C4 алкіл)-3-14-членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, оксо-групи, C1-C6 алкілу та C(O)C1-C8 алкілу; (C0-C4 алкіл)-O-арилу, необов’язково заміщеного однією або більше групами, вибраними з C1-C6 алкілу, C1-C6 алкокси групи та галогену; та (C 0-C4 алкіл)-O-3-14членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, C1-C6 алкілу та C(O)C1-C6 алкілу; де алкільні групи необов’язково заміщені одним або більше атомами галогену, гідроксилом, C 1-C4 алкокси групою, C(O)NH2, C(O)NHC1-C6алкілом або C(O)N(C1-C6 алкіл)2; або 22 23 R та R разом з атомом(ами), з яким(и) вони з’єднані, утворюють 5-7-членну гетероциклоалкільну групу, причому гетероциклоалкільна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклоалкільна група необов’язково заміщена однією або більше Z групами. 13 У іншому варіанті здійснення даного винаходу, як визначено вище, де R являє собою (C123 22 22 23 C3 алкіл)-NR C(O)R , R та R разом з атомами, з якими вони з’єднані, утворюють оксогрупу, заміщену 5-7-членною гетероциклоалкільною групою, причому гетероциклоалкільна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклоалкільна група необов’язково додатково заміщена однією або більше Z групами. У 13 23 22 23 22 наступному варіанті здійснення R являє собою (C1-C3 алкіл)-NR C(O)R , де -NR C(O)R представлений формулою 3 3 UA 111595 C2 5 10 15 20 25 де q дорівнює 0,1 або 2 та зірочка показує місце приєднання до (C 1-C3 алкільної) групи. 13 У іншому варіанті здійснення даного винаходу, як визначено вище, де R вибраний з (C1-C3 22 23 23 алкіл)-C(O)NR R та (C1-C3 алкіл)-C(O)OR ; 22 R вибраний з H та C1-C3 алкілу; 23 R вибраний з H; C1-C8 алкілу; C3-C8 циклоалкілу; C1-C4 алкокси-C1-C4 алкілу; (C0-C4 алкіл)арилу, необов’язково заміщеного однією або більше групами, вибраними з C 1-C6 алкілу, C1-C6 алкокси групи та галогену; (C0-C4 алкіл)-3-14-членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, оксо-групи, C1-C6 алкілу та C(O)C1-C6 алкілу; (C0-C4 алкіл)-O-арилу, необов’язково заміщеного однією або більше групами, вибраними з C1-C6 алкілу, C1-C6 алкокси групи та галогену; та (C 0-C4 алкіл)-O-3-14членної гетероциклічної групи, причому гетероциклічна група містить один або більше гетероатомів, вибраних з N, O та S, необов’язково заміщеної однією або більше групами, вибраними з галогену, C1-C6 алкілу та C(O)C1-C6 алкілу; де алкільні групи необов’язково заміщені одним або більше атомами галогену, гідроксилом, C 1-C4 алкокси групою, C(O)NH2, C(O)NHC1-C6 алкілом або C(O)N(C1-C6 алкіл)2; або 22 23 R та R разом з азотом, з яким вони з’єднані, утворюють 5-7-членну гетероциклоалкільну групу, причому гетероциклоалкільна група містить один або більше додаткових гетероатомів, вибраних з N, O та S, причому гетероциклоалкільна група необов’язково заміщена однією або більше Z групами. У іншому варіанті здійснення даного винаходу, як визначено вище, Z являє собою гідроксил, ціаногрупу, нітрогрупу, C1-C4-алкіл, C1-C4-алкоксигрупу, галоген, C1-C4-алкілкарбоніл, карбоксигрупу, C1-C4-алкоксикарбоніл, аміногрупу, C1-C4-алкіламіногрупу, ди-C1-C4алкіламіногрупу, C1-C4-алкіламінокарбоніл, ди-C1-C4-алкіламінокарбоніл, C1-C4алкілкарбоніламіно-групу, C1-C4-алкілкарбоніл(C1-C4-алкіл)аміно-групу, де кожна з алкільних та алкокси груп незалежно заміщена одним або більше замісниками, вибраними з гідроксилу, галогену, C1-C4-галогеналкільних та C1-C4-алкокси груп. У ще наступному варіанті здійснення даний винахід відноситься до сполуки формули Ia 30 Ia 10 або її фармацевтично прийнятної солі або сольвату, де R являє собою, як визначено вище стосовно сполуки формули I. У ще наступному варіанті здійснення даний винахід відноситься до сполуки формули Ib 35 Ib 4 UA 111595 C2 11a 12a 11b 12b або її фармацевтично прийнятної солі або сольвату, де B, R , R , R , R та R являють собою такі, як визначено вище стосовно сполуки формули I. У ще наступному варіанті здійснення даний винахід відноситься до сполуки формули Ic 13 5 Ic 11a 12a 11b 12b 13 15 або її фармацевтично прийнятної солі або сольвату, де B, R , R , R , R , R та R та 17 R являють собою такі, як визначено вище стосовно сполуки формули I. У ще наступному варіанті здійснення даний винахід відноситься до сполуки формули Id 10 Id 11a 12a 13 або її фармацевтично прийнятної солі або сольвату, де B, R , R та R являють собою такі, як визначено вище стосовно сполуки формули I. У іншому варіанті здійснення окремі сполуки згідно з даним винаходом є сполуками, перерахованими у розділі прикладів нижче. У іншому варіанті здійснення даного винаходу, забезпечується сполука формули I, яка вибрана з дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти; [(2-гідроксиетил)метилкарбамоїл]метилового ефіру [4-(3-{2-[(Z)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)-фенокси]оцтової кислоти; циклогексилоксикарбонілметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)-фенокси]оцтової кислоти; циклогексилоксикарбонілметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензол-сульфоніламіно)пропіонової кислоти; диметилкарбамоїлметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; дипропілкарбамоїлметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; трет-бутоксикарбонілметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; бензилоксикарбонілметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; діетилкарбамоїлметилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; 2-оксо-2-піперидин-1-ілетилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; дипропілкарбамоїлметилового ефіру [2-хлор-4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)-фенокси]оцтової кислоти; 2-оксо-2-(2-трифторметилпіролідин-1-іл)етилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти; 15 20 25 30 35 40 5 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-(2-оксопіперидин-1-іл)етилового ефіру [2-хлор-4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)-фенокси]оцтової кислоти; 2-морфолін-4-іл-2-оксоетилового ефіру [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8-ил}-3-оксопропіл)фенокси]оцтової кислоти; дипропілкарбамоїлметилового ефіру 1-[(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)-метил]циклобутанкарбонової кислоти; дипропілкарбамоїлметилового ефіру 3-[3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}феніл)уреїдо]пропіонової кислоти; та 2-оксо-2-(2-трифторметилпіролідин-1-іл)етилового ефіру 1-[(3-{2-[(E)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)метил]циклобутанкарбонової кислоти; або їх фармацевтично прийнятної солі або сольвату. У варіантах здійснення, приведених у даному винаході, коли визначають тільки певні перемінні, передбачається, що решта перемінних являють собою такі, як визначено у будьякому варіанті здійснення у даному винаході. Таким чином, даний винахід відноситься до комбінації обмежених або необов’язкових значень перемінних. Передбачається, що наступні терміни, як застосовують у даному винаході, мають наступні значення: "Необов’язково заміщений", як застосовують у даному винаході, означає, що-група, на яку посилаються, може бути незаміщеною або заміщеною у одному, або двох, або трьох положеннях будь-яким одним або будь-якою комбінацією радикалів, приведених у даному винаході нижче. "Галоген", як застосовують у даному винаході, означає фтор, хлор, бром або йод. "C1-C3 алкіл", "C1-C6 алкіл", "C1-C8 алкіл" та подібні, як застосовують у даному винаході, позначають алкільну групу з нормальним або розгалуженим ланцюгом, яка містить один-три, шість або вісім (або відповідну кількість) атомів вуглецю та яка може бути заміщеною, як визначено. "Арил", як застосовують у даному винаході, являє собою ароматичну карбоциклічну кільцеву систему, що містить 6-15 атомів вуглецю. Вона може бути моноциклічною, біциклічною або трициклічною, та може бути необов’язково заміщеною, як визначено. Приклади C 6-C15-арильних груп включають, але без обмеження, феніл, фенілен, бензолтриіл, інданіл, нафтил, нафтилен, нафталінтриіл та антраценіл. "Гетероцикліл" або "гетероциклічний" відноситься до 4-14-членної гетероциклічної кільцевої системи, що містить щонайменше один кільцевий гетероатом, вибраний з групи, що складається з азоту, кисню та сірки, яка може бути насиченою, частково насиченою або ароматичною (тобто гетероарилом). Приклади 4-14-членних гетероциклічних груп включають, але без обмеження, фуран, азетидин, пірол, піролідин, піразол, імідазол, триазол, ізотриазол, тетразол, тіадіазол, ізотіазол, оксадіазол, піридин, піперидин, піразин, оксазол, ізоксазол, піразин, піридазин, піримідин, піперазин, піролідин, піролідинон, піридинон, морфолін, триазин, оксазин, тетрагідрофуран, тетрагідротіофен, тетрагідротіопіран, тетрагідропіран, 1,4-діоксан, 1,4-оксатіан, індазол, хінолін, хіназолін, хіноксалін, індол, індолін, тіазол, тіофен, ізохінолін, ізоіндол, ізоіндолін, бензотіофен, бензоксазол, бензізоксазол, бензотіазол, бензізотіазол, бензофуран, дигідробензофуран, дигідроізобензофуран, бензодіоксол, бензімідазол, бензотриазол, піразолопіридин, піразолопіримідин, імідазопіридин, пурин, нафтиридин або тетрагідронафтиридин. "Гетероцикліл" або "гетероциклічний" також включає місткові гетероциклічні групи, такі як 3-гідрокси-8-азабіцикло[3,2,1]окт-8-ил та конденсовані кільцеві системи, такі як піридопіримідин. 4-14-членна гетероциклічна група може бути незаміщеною або заміщеною. "Гетероцикліл" включає гетероарильні та гетероциклоалкільні групи. "Гетероарил" являє собою ароматичну кільцеву систему, що містить від 5 до 15 кільцевих атомів, один або більше з яких являють собою гетероатом, вибраний з O, N або S. Переважно присутні один або два гетероатоми. Гетероарил (гетероциклічний арил) являє собою, наприклад, піридил, індоліл, ізоіндоліл, індазоліл, хіноксалініл, хіназолініл, хінолініл, ізохінолініл, нафтиридиніл, піридопіримідиніл, бензотієніл, бензофураніл, бензопіраніл, бензотіопіраніл, бензотриазоліл, піразолопіридиніл, фураніл, піроліл, тіазоліл, оксазоліл, ізоксазоліл, триазоліл, тетразоліл, піразоліл, імідазоліл, тієніл. Гетероарильна група може бути заміщеною або незаміщеною. "C3-C10-циклоалкіл" означає повністю насичене карбоциклічне кільце, що містить 3-10 кільцевих атомів вуглецю, наприклад, моноциклічну групу, таку як циклопропіл, циклобутил, 6 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 циклопентил або циклогексил, циклогептил, циклооктил, циклононіл або циклодецил, або біциклічну групу, таку як біциклогептил або біциклооктил. Можуть бути зазначені різні кількості атомів вуглецю з внесенням відповідної зміни для значення. Циклоалкільна група може бути заміщеною або незаміщеною. "C5-C10-циклоалкеніл" означає частково насичене карбоциклічне кільце, що містить 5-10 кільцевих атомів вуглецю, наприклад, моноциклічну групу, таку як циклопентеніл або циклогексеніл, циклогептеніл, циклооктеніл або циклононеніл, або біциклічну групу, таку як біциклогептеніл або біциклооктеніл. Кільце або кільцева система може містити більше одного вуглець-вуглець подвійного зв’язку. Можуть бути зазначені різні кількості атомів вуглецю, з внесенням відповідної зміни для значення. Циклоалкенільна група може бути заміщеною або незаміщеною. "C1-C8-галогеналкіл", як застосовують у даному винаході, означає C 1-C8-алкіл, як визначено у даному винаході вище, заміщений одним або більше атомами галогену, переважно одним, двома або трьома атомами галогену. Можуть бути зазначені різні кількості атомів вуглецю, з внесенням відповідної зміни для значення. "C1-C8-алкіламіно", як застосовують у даному винаході, означає аміно-групу, заміщену однією або двома C1-C8-алкільними групами, як визначено у даному винаході вище, які можуть бути однаковими або різними. Можуть бути зазначені різні кількості атомів вуглецю, з внесенням відповідної зміни для значення. "C1-C8-алкокси", як застосовують у даному винаході, означає алкокси групу з нормальним або розгалуженим ланцюгом, яка містить 1-8 атомів вуглецю. Можуть бути зазначені різні кількості атомів вуглецю, з внесенням відповідної зміни для значення. У всьому описі та у формулі винаходу, яка слідує за ним, якщо контекст не потребує іншого, повинно бути зрозуміло, що слово "включає" або варіанти, такі як "включаючи", означає включення зазначеного цілого або стадії або-групи цілих або стадій, але не виключення будьякого іншого цілого або стадії або-групи цілих або стадій. Як застосовують у даному винаході, термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають біологічну активність та властивості сполук даного винаходу та які не є біологічно або інакше небажаними. У багатьох випадках сполуки даного винаходу можуть утворювати солі з кислотою та/або основою за рахунок присутності аміно та/або карбоксильних груп або аналогічних ним груп. Фармацевтично прийнятні солі приєднання кислоти можна отримати з неорганічними кислотами та органічними кислотами, наприклад, ацетатну, аспартатну, бензоатну, безилатну, бромідну/гідробромідну, бікарбонатну/карбонатну, бісульфатну/сульфатну, камфорсульфонатну, хлоридну/гідрохлоридну, хлортеофілонатну, цитратну, етандисульфонатну, фумаратну, глуцептатну, глюконатну, глюкуронатну, гіпуратну, гідройодидну/йодидну, ізетіонатну, лактатну, лактобіонатну, лаурилсульфатну, малатну, малеатну, малонатну, манделатну, мезилатну, метилсульфатну, нафтоатну, напсилатну, нікотинатну, нітратну, октадеканоатну, олеатну, оксалатну, пальмітатну, памоатну, фосфатну/гідрофосфатну/дигідрофосфатну, полігалактуронатну, пропіонатну, стеаратну, сукцинатну, сульфосаліцилатну, тартратну, тозилатну та трифторацетатну солі. Неорганічні кислоти, з яких отримують солі, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту та подібні. Органічні кислоти, з яких отримують солі, включають, наприклад, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, щавлеву кислоту, малеїнову кислоту, малонову кислоту, бурштинову кислоту, фумарову кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфокислоту, етансульфокислоту, толуолсульфокислоту, сульфосаліцилову кислоту, та подібні. Фармацевтично прийнятні солі приєднання основи можна отримати з неорганічними та органічними основами. Неорганічні основи, з яких можна отримати солі, включають, наприклад, амонієві солі та солі металів з колонок I-XII періодичної таблиці. У певних варіантах здійснення солі отримують з натрію, калію, амонію, кальцію, магнію, заліза, срібла, цинку та міді; особливо придатні солі включають солі амонію, калію, натрію, кальцію та магнію. Органічні основи, з яких отримують солі, включають, наприклад, первинні, вторинні та третинні аміни, заміщені аміни, включаючи заміщені аміни, що зустрічаються у природі, циклічні аміни, іонообмінні смоли та подібні. Певні органічні аміни включають ізопропіламін, бензатин, холінат, діетаноламін, діетиламін, лізин, меглумін, піперазин та трометамін. 7 UA 111595 C2 5 10 15 20 25 30 35 40 45 Фармацевтично прийнятні солі даного винаходу можна отримати з вихідної молекули, основної або кислої групи, загальноприйнятими хімічними способами. Звичайно дані солі можна отримати реакцією вільної кислотної форми даних сполук із стехіометричною кількістю підходящої основи (такої як гідроксид, карбонат, бікарбонат Na, Ca, Mg або K, або подібного), або реакцією вільної основної форми даних сполук із стехіометричною кількістю підходящої кислоти. Дані реакції звичайно здійснюють у воді або у органічному розчиннику, або у суміші двох. Звичайно застосування неводного середовища, подібного ефіру, етилацетату, етанолу, ізопропанолу або ацетонітрилу, є бажаним, при наявності можливості. Списки додаткових th підходящих солей можна знайти, наприклад, у "Remington's Pharmaceutical Sciences", 20 ed., Mack Publishing Company, Easton, Pa., (1985); та у "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2011). Крім того, сполуки даного винаходу, включаючи їх солі, можна також отримати у вигляді їх гідратів, або вони містять інші розчинники, застосовувані для їх кристалізації. Сполуки даного винаходу, тобто сполуки формули (I), які містять групи, які здатні діяти як донори та/або акцептори водневих зв’язків, можуть бути здатні утворювати співкристали з підходящими агентами, що утворюють співкристали. Дані співкристали можна отримати зі сполук формули (I) за відомими способами одержання співкристалів. Дані способи включають подрібнення, нагрівання, сумісну возгонку, сумісне плавлення або контакт у розчині сполук формули (I) з агентом, що утворює співкристали, в умовах кристалізації та виділення таким чином отриманих співкристалів. Підходящі агенти, що утворюють співкристали, включають агенти, описані у WO 2004/078163. Отже, даний винахід також відноситься до співкристалів, що містять сполуку формули (I). Як застосовують у даному винаході, термін "оптичний ізомер" або "стереоізомер" відноситься до будь-якої з різних стереоізомерних конфігурацій, які можуть існувати для зазначеної сполуки даного винаходу, та включає геометричні ізомери. Зрозуміло, що замісник може бути приєднаний при хіральному центрі атому вуглецю. Отже, даний винахід включає енантіомери, діастереомери або рацемати сполуки. "Енантіомери" являють собою пару стереоізомерів, які є дзеркальними зображеннями, що не накладаються одне на інше. 1:1 суміш пари енантіомерів являє собою "рацемічну" суміш. Термін застосовують для позначення рацемічної суміші за необхідності. "Діастереоізомери" являють собою стереоізомери, які містять щонайменше два асиметричних атоми, але які не є дзеркальними зображеннями один іншого. Абсолютну стереохімію вказують згідно із R-S системом Кана-Інгольда-Прелога. Коли сполука являє собою чистий енантіомер, стереохімію при кожному хіральному вуглеці можна вказати або R, або S. Розділені сполуки, чия абсолютна конфігурація є невідомою, можна позначити (+) або (-) в залежності від напрямку (правообертальний або лівообертальний), у якому вони обертають плоскополяризоване світло при довжині хвилі D лінії натрію. Певні зі сполук, описаних у даному винаході, містять один або більше асиметричних центрів або осей, та можуть, таким чином, давати енантіомери, діастереомери та інші стереоізомерні форми, які можна визначити, у термінах абсолютної стереохімії, як (R)- або (S)-. Мається на увазі, що даний винахід включає всі дані можливі ізомери, включаючи рацемічні суміші, оптично активні форми та проміжні суміші. Необов’язково активні (R)- та (S)-ізомери можна отримати, застосовуючи хіральні синтони або хіральні реагенти, або розділяти, застосовуючи загальноприйняті способи. Якщо сполука містить подвійний зв’язок, замісник може мати E- або Z-конфігурацію. Якщо сполука містить дизаміщений циклоалкіл, циклоалкільний замісник може мати цис- або транс-конфігурацію. Всі таутомерні форми також маються на увазі включеними. Таутомери являють собою один з двох або більше структурних ізомерів, які існують у рівновазі та легко перетворюються з однієї ізомерної форми у іншу. Більш конкретно, наприклад, сполуки формули Ia можуть існувати у одній або обох з наступних таутомерних форм: 8 UA 111595 C2 5 10 15 20 25 30 35 40 Приклади таутомерів включають, але без обмеження, сполуки, визначені у формулі винаходу. Будь-який асиметричний атом (наприклад, вуглець або подібні) сполуки (сполук) даного винаходу можуть бути присутніми у рацемічній або енантіомерно збагаченій, наприклад (R)-, (S)- або (R, S)-конфігурації. У певних варіантах здійснення кожен асиметричний атом має щонайменше 50% енантіомерний надлишок, щонайменше 60% енантіомерний надлишок, щонайменше 70% енантіомерний надлишок, щонайменше 80% енантіомерний надлишок, щонайменше 90% енантіомерний надлишок, щонайменше 95% енантіомерний надлишок або щонайменше 99% енантіомерний надлишок (R)- або (S)-конфігурації. Замісники при атомах з ненасиченими зв’язками можуть, якщо це можливо, бути присутніми у вигляді цис- (Z)- або транс- (E)-форми. Відповідно, як застосовують у даному винаході, сполука даного винаходу може бути у вигляді одного з можливих ізомерів, ротамерів, атропізомерів, таутомерів або їх сумішей, наприклад, у вигляді по суті чистих геометричних (цис або транс) ізомерів, діастереомерів, оптичних ізомерів (антиподів),рацематів або їх сумішей. Будь-які отримані у результаті суміші ізомерів можна розділити на основі фізико-хімічних відмінностей компонентів, на чисті або по суті чисті геометричні або оптичні ізомери, діастереомери, рацемати, наприклад, хроматографією та/або фракціонованою кристалізацією. Будь-які отримані у результаті рацемати кінцевих продуктів або проміжних сполук можна розділити на оптичні антиподи відомими способами, наприклад, розділенням їх діастереомерних солей, отриманих з оптично активною кислотою або основою, та вивільненням оптично активного кислої або основної сполуки. Зокрема, основну групу можна, таким чином, застосовувати для розділення сполук даного винаходу на їх оптичні антиподи, наприклад, фракціонованою кристалізацією солі, утвореної оптично активною кислотою, наприклад, винною кислотою, дибензоїлвинною кислотою, діацетилвинною кислотою, ди-O, O'-п-толуоїлвинною кислотою, мигдальною кислотою, оксибурштиновою кислотою або камфор-10-сульфокислотою. Рацемічні продукти можна також розділити хіральною хроматографією, наприклад, високоефективною рідинною хроматографією (ВЕРХ), застосовуючи хіральний адсорбент. Оскільки сполуки даного винаходу призначені для застосування у фармацевтичних композиціях, зрозуміло, що кожну з них краще забезпечувати у по суті чистій формі, наприклад, щонайменше 60% чистоти, переважно щонайменше 75% чистоти та переважно щонайменше 85%, особливо щонайменше 98% чистоти (% дані за масою). Склади з домішками сполук можна застосовувати для одержання більш чистих форм, застосовуваних у фармацевтичних композиціях; дані менш чисті склади сполук повинні містити щонайменше 1%, переважно щонайменше 5% та переважно від 10 до 59% сполуки даного винаходу. Сполуки даного винаходу можна отримати або у вільній формі, у вигляді її солі, або у вигляді її проліків. Коли і основна група і кислотна група присутні у одній молекулі, сполуки даного винаходу можуть також утворювати внутрішню сіль, наприклад, цвіттеріонні молекули. Даний винахід також відноситься до проліків сполук даного винаходу, які перетворюються in vivo у сполуки даного винаходу. Проліки являють собою активну або неактивну сполуку, яка 9 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 хімічно модифікується при in vivo фізіологічній дії, такій як гідроліз, метаболізм та подібні, до сполуки даного винаходу після введення проліків суб’єкту. Придатність та способи, застосовувані для одержання та застосування проліків, є добре відомими спеціалісту у даній галузі техніки. Проліки можна концептуально розділити на дві невиключні категорії: проліки, що є біопопередниками, та проліки, що є носіями. Див. The Practice of Medicinal Chemistry, Ch. 31-32 (Ed. Wermuth, Academic Press, San Diego, Calif., 2001). Загалом, проліки, що є біопопередниками, являють собою сполуки, які є неактивними або мають низьку активність у порівнянні з відповідною активною лікарською сполукою, які містять одну або більше захисних груп та перетворюються у активну форму метаболізмом або сольволізом. І активна лікарська форма, та будь-які метаболічні продукти, що вивільнюються, повинні мати прийнятно низьку токсичність. Проліки, що є носіями, являють собою лікарські сполуки, які містять транспортну групу, наприклад, які збільшують поглинання та/або локалізовану доставку у місце (місця) дії. Бажано для даних проліків, що є носієм, щоб зв’язок між лікарським фрагментом та транспортною групою представляв собою ковалентний зв’язок, проліки були неактивними або менш активними, ніж лікарська сполука, та будь-яка транспортна група, що вивільнилася, була прийнятно нетоксичною. Що стосується проліків, коли передбачається, що транспортна група буде посилювати поглинання, звичайно вивільнення транспортної групи повинно бути швидким. У інших випадках бажано застосовувати групу, яка забезпечує повільне вивільнення, наприклад, певні полімери або інші молекули, такі як циклодекстрини. Проліки, що є носіями, можна, наприклад, застосовувати для покращення однієї або більше з наступних властивостей: підвищена ліпофільність, збільшена тривалість фармакологічних ефектів, підвищена сайтспецифічність, знижені токсичність та побічні реакції, та/або покращення характеристик лікарського складу (наприклад, стабільності, розчинності у воді, пригнічення небажаних органолептичних або фізико-хімічних властивостей). Наприклад, ліпофільність можна підвищити етерифікацією (a) гідроксильних груп з ліпофільними карбоновими кислотами (наприклад, карбоновою кислотою, що містить щонайменше одну ліпофільну групу), або (b) карбоксигруп з ліпофільними спиртами (наприклад, спиртом, що містить щонайменше одну ліпофільну групу, наприклад, аліфатичними спиртами). Прикладами проліків є, наприклад, ефіри вільних карбонових кислот та S-ацильні похідні тіолів та O-ацильні похідні спиртів або фенолів, де ацил має значення, як визначено у даному винаході. Підходящі проліки часто являють собою фармацевтично прийнятні ефірні похідні, що перетворюються сольволізом у фізіологічних умовах у вихідну карбонову кислоту, наприклад, нижчі алкілові ефіри, циклоалкілові ефіри, нижчі алкенілові ефіри, бензилові ефіри, моно- або дизаміщені нижчі алкілові ефіри, такі як -(аміно, моно- або динижчі алкіламіно, карбокси, нижчі алкоксикарбоніл)нижчі алкілові ефіри, -(нижчі алканоїлокси, нижчі алкоксикарбоніл або динижчі алкіламінокарбоніл)нижчі алкілові ефіри, такі як півалоїлоксиметиловий ефір та подібні, звичайно застосовувані у даній галузі техніки. Крім того, аміни маскують у вигляді заміщених арилкарбонілоксиметилом похідних, які розщеплюються естеразами in vivo, вивільнюючи вільну лікарську сполуку та формальдегід (Bundgaard, J. Med. Chem. 2503 (1989)). Більше того, лікарські сполуки, що містять кислу NH групу, таку як імідазол, імід, індол та подібні, маскують N-ацилоксиметильними групами (Bundgaard, Design of Prodrugs, Elsevier (1985)). Гідроксигрупи маскують у вигляді простих або складних ефірів. EP 039051 (Sloan та Little) описує проліки, що є гідроксамовими кислотами, отриманими реакцією Маніха, їх одержання та застосування. Також передбачається, що будь-яка формула, приведена у даному винаході, представляє немічені форми, а також ізотопно-мічені форми сполук. Ізотопно-мічені сполуки мають структуру, зображену формулами, приведеними у даному винаході, за виключенням того, що один або більше атомів заміщені атомом, що має вибрану атомну масу або масове число. Приклади ізотопів, які можна вводити у сполуки даного винаходу, включають ізотопи водню, 2 3 11 13 14 15 18 31 32 вуглецю, азоту, кисню, фосфору, фтору та хлору, такі як H, H, C, C, C, N, F, P, P, 35 36 125 S, Cl, I, відповідно. Даний винахід включає різні ізотопно-мічені сполуки, як визначено у 3 13 14 даному винаході, наприклад, сполуки, у яких присутні радіоактивні ізотопи, такі як H, C та C. 14 Дані ізотопно-мічені сполуки є придатними у метаболічних дослідженнях (з C), дослідженнях 2 3 кінетики реакції (наприклад, з H або H), способах виявлення та проявлення, таких як позитронно-емісійна томографія (PET) або однофотонна емісійна комп’ютерна томографія (SPECT), включаючи аналіз на розподіл лікарського засобу або субстрату у тканинах, або у 18 радіоактивному лікуванні пацієнтів. Зокрема, F мічена сполука може бути особливо краще для PET або SPECT досліджень. Ізотопно-мічені сполуки даного винаходу та їх проліки можна звичайно отримати здійсненням способів, показаних на схемах або у прикладах та прикладах 10 UA 111595 C2 5 10 15 20 25 30 одержання, описаних нижче, заміщенням неміченого ізотопом реагенту легко доступним ізотопно-міченим реагентом. 2 Далі, заміщення більш важкими ізотопами, зокрема дейтерієм (тобто H або D), може надавати певні терапевтичні переваги, що є результатом більшої метаболічної стабільності, наприклад, підвищений in vivo період напіврозщеплення або знижені потрібні дози або збільшення терапевтичного індексу. Зрозуміло, що дейтерій у даному контексті розглядають як замісник сполуки формули (I). Концентрацію даного більш важкого ізотопу, зокрема дейтерію, можна визначити за фактором ізотопного збагачення. Термін "фактор ізотопного збагачення", як застосовують у даному винаході, означає відношення між вмістом ізотопу та розповсюдженістю у природі зазначеного ізотопу. Якщо замісник у сполуці даного винаходу позначений як дейтерій, дана сполука має фактор ізотопного збагачення для кожного позначеного атому дейтерію щонайменше, 3500 (52,5% введення дейтерію для кожного позначеного атому дейтерію), щонайменше 4000 (60% введення дейтерію), щонайменше 4500 (67,5% введення дейтерію), щонайменше 5000 (75% введення дейтерію), щонайменше 5500 (82,5% введення дейтерію), щонайменше 6000 (90% введення дейтерію), щонайменше 6333,3 (95% введення дейтерію), щонайменше 6466,7 (97% введення дейтерію), щонайменше 6600 (99% введення дейтерію) або щонайменше 6633,3 (99,5% введення дейтерію). Ізотопно-мічені сполуки формули (I) можна звичайно отримати за загальноприйнятими способами, відомими спеціалісту у даній галузі техніки, або способами, аналогічними способам, описаним у супровідних прикладах та прикладах одержання, застосовуючи підходящі ізотопномічені реагенти замість ізотопно неміченого реагенту, застосовуваного раніше. Фармацевтично прийнятні сольвати згідно з даним винаходом включають сольвати, де розчинник кристалізації може бути ізотопно-заміщеним, наприклад, D2O, d6-ацетон, d6-DMSO. Одержання Сполуки даного винаходу можна отримати загальними шляхами одержання нижче, конкретні приклади яких описані більш детально у прикладах. Сполуки формули I можна отримати у відповідності із схемою 1. Схема 1 Альтернативно, сполуки формули I можна отримати у відповідності із схемою 2. Схема 2 11 UA 111595 C2 10а 5 10 15 20 25 30 11a 12a 11b 12b 11c 12c де R являє собою -(C0-C3алкілен)-B-X-(CR R )m-(CR R )n-(CR R )p-C(O)OН та L являє собою підходящу відхідну групу. Приведені вище загальні схеми можна застосовувати для одержання сполук формули I. Потрібні конкретні сполуки можна отримати вибором підходящих вихідних речовин, реагентів та умов реакцій. Всі вихідні речовини та реагенти у приведеній вище схемі є або наявними у продажу, або їх можна отримати, слідуючи літературним способам. Зокрема, сполуки формули II та сполуки формули IV можна отримати, як описано у міжнародній патентній заявці, опублікованій як WO 2009074575, яка включена у даний винахід за допомогою посилання. У межах обсягу даного тексту, тільки групу, що легко видаляється, яка не є складовою частиною конкретного потрібного кінцевого продукту сполук даного винаходу, позначають "захисною групою", якщо контекст не вказує інше. Захист функціональних груп даними захисними групами, самі захисні групи та реакції їх відщеплення описують, наприклад, у стандартних довідниках, таких як J. F. W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, у T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, у "The Peptides"; Volume 3 (редактори: E. Gross and J. Meienhofer), Academic Press, London та New York 1981, у "Methoden der organischen th Chemie" (Methods of Organic Chemistry), Houben Weyl, 4 edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974, у H.-D. Jakubke and H. Jeschkeit, "Aminosauren, Peptide, Proteine" (Amino acids, Peptides, Proteins), Verlag Chemie, Weinheim, Deerfield Beach, and Basel 1982, та у Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974. Характерною особливістю захисних груп є те, що їх можна легко видаляти (тобто без протікання небажаних побічних реакцій), наприклад, сольволізом, відновленням, фотолізом або альтернативно у фізіологічних умовах (наприклад, ферментативним розщепленням). Солі сполук даного винаходу, що містять щонайменше одну утворюючу сіль групу, можна отримати за способом, відомім спеціалісту у даній галузі техніки. Наприклад, солі сполук даного винаходу, що містять кислу групу, можна отримати, наприклад, реакцією сполук з металічними сполуками, такими як солі лужних металів підходящих органічних карбонових кислот, наприклад, натрієва сіль 2-етилгексанової кислоти, з органічними сполуками лужних та лужноземельних металів, такими як відповідні гідроксиди, карбонати або гідрокарбонати, такі як гідроксид, карбонат або гідрокарбонат натрію або калію, з відповідними кальцієвими сполуками або з аміаком або підходящим органічним аміном, стехіометричними кількостями або тільки невеликим надлишком переважно застосовуваного 12 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 утворюючого сіль агенту. Солі приєднання кислоти сполук даного винаходу отримують за стандартним способом, наприклад, обробкою сполук кислим або підходящим аніонообмінним реагентом. Внутрішні солі сполук даного винаходу, що містять кислі та основні групи, що утворюють сіль, наприклад, вільну карбоксильну групу та вільну аміногрупу можна отримати, наприклад нейтралізацією солей, таких як солі приєднання кислоти, до ізоелектричної точки, наприклад, слабкими основами або обробкою іонообмінними реагентами. Солі можна перетворити у вільні сполуки згідно із способами, відомими спеціалісту у даній галузі техніки. Солі металу та амонію можна перетворити, наприклад, обробкою підходящими кислотами, та солі приєднання кислоти, наприклад, обробкою підходящим основним агентом. Суміші ізомерів, отримувані згідно з даним винаходом, можна розділити за способом, відомім спеціалісту у даній галузі техніки на окремі ізомери; діастереоізомери можна розділити, наприклад, розподілом між поліфазними сумішами розчинників, перекристалізацією та/або хроматографічним розділенням, наприклад, на силікагелі або, наприклад, рідинною хроматографією середнього тиску на обернено-фазній колонці, та рацемати можна розділити, наприклад, утворенням солей з оптично активними утворюючими сіль агентами та розділенням суміші таким чином отриманих діастереоізомерів, наприклад, шляхом фракційної кристалізації або хроматографією на оптично активній речовині для колонки. Проміжні сполуки та кінцеві продукти можна обробляти та/або очищувати згідно із стандартними способами, наприклад, застосовуючи хроматографічні способи, способи розподілу, (пере-) кристалізацією та подібними. Наступне є застосовним загалом до всіх способів, приведених у даному винаході вище або нижче. Всі приведені вище стадії способу можна здійснювати в умовах реакції, які є відомими спеціалісту у даній галузі техніки, включаючи стадії, приведені конкретно, за відсутності або, звичайно, у присутності розчинників або розріджувачів, включаючи, наприклад, розчинники або розріджувачі, які є інертними для застосовуваних реагентів та розчиняють їх, за відсутності або у присутності каталізаторів, агентів для конденсації або нейтралізації, наприклад, іонообмінних + агентів, таких як катіоннообмінні агенти, наприклад, у H формі, в залежності від природи реакції та/або реагентів, при зниженій, нормальній або підвищеній температурі, наприклад, у діапазоні температур від приблизно -100C до приблизно 190C, включаючи, наприклад, від приблизно 80C до приблизно 150C, наприклад, при від -80 до -60C, при кімнатній температурі, при від 20 до 40C або при температурі кипіння із зворотним холодильником, при атмосферному тиску або у закритій посудині, за необхідності під тиском, та/або у інертній атмосфері, наприклад, у атмосфері аргону або азоту. На всіх стадіях реакцій, суміші ізомерів, які утворюються, можна розділити на окремі ізомери, наприклад, діастереоізомери або енантіомери, або на потрібні суміші ізомерів, наприклад, рацемати або суміші діастереоізомерів, наприклад, аналогічно способам, описаним у "Додаткові стадії способів". Розчинники, з яких можна вибрати розчинники, які є підходящими для будь-якої конкретної реакції, включають розчинники, приведені конкретно або, наприклад, воду, ефіри, такі як нижчі алкіл-нижчі алканоати, наприклад, етилацетат, ефіри, такі як аліфатичні ефіри, наприклад, діетиловий ефір, або циклічні ефіри, наприклад, тетрагідрофуран або діоксан, рідкі ароматичні вуглеводні, такі як бензол або толуол, спирти, такі як метанол, етанол або 1- або 2-пропанол, нітрили, такі як ацетонітрил, галогеновані вуглеводні, такі як хлористий метилен або хлороформ, аміди кислот, такі як диметилформамід або диметилацетамід, основи, такі як гетероциклічні основи, що містять азот, наприклад, піридин або N-метилпіролідин-2-он, ангідриди карбонових кислот, такі як ангідриди нижчих алканових кислот, наприклад, оцтовий ангідрид, циклічні, лінійні або розгалужені вуглеводні, такі як циклогексан, гексан або ізопентан, метилциклогексан, або суміші даних розчинників, наприклад водні розчини, якщо не зазначено інше у описані способів. Дані суміші розчинників можна також застосовувати при обробці, наприклад, хроматографією або розподілом. Сполуки, включаючи їх солі, можна також отримати у вигляді гідратів, або їх кристали можуть, наприклад, містити розчинник, застосовуваний для кристалізації. Можуть бути присутніми різні кристалічні форми. Даний винахід також відноситься до тим видів способу, у яких сполуку, отримувану як проміжну сполуку на будь-якій стадії способу, застосовують як вихідну речовину та проводять решту стадій способу, або у яких вихідна речовина утворюється в умовах реакції або застосовують у вигляді похідної, наприклад, у захищеній формі або у вигляді солі, або сполуку, отримувану за способом згідно з даним винаходом, отримують в умовах способу та обробляють далі in situ. Всі вихідні речовини, що складають елементи, реагенти, кислоти, основи, 13 UA 111595 C2 5 10 зневоднюючі агенти, розчинники та каталізатори, застосовувані для одержання сполук даного винаходу, є або наявними у продажу, або їх можна отримати органічними способами th одержання, відомими спеціалісту у даній галузі техніки (Houben-Weyl 4 Ed. 1952, Methods of Organic Synthesis, Thieme, Volume 21). Як наступний аспект даного винаходу забезпечують спосіб одержання сполук формули I або їх фармацевтично прийнятної солі або сольвату. Згідно з наступним аспектом даного винаходу забезпечують спосіб одержання сполуки формули I або її фармацевтично прийнятної солі або сольвату, що включає стадію: (a) реакції сполуки формули II 1 2 3 4 5 6 7 8 9 де R , R , R , R , R , R , R , R та R являють собою такі, як визначено вище, зі сполукою формули III 10 15 де R являють собою такі, як визначено вище, у загально прийнятих умовах реакції для конденсації кислоти та аміну; або (b) реакції сполуки формули IV 13 20 25 30 35 зі сполукою R L формули V у загально прийнятих умовах реакції, 1 2 3 4 5 6 7 8 9 13 10a де R , R , R , R , R , R , R , R , R та R являють собою такі, як визначено вище; R являє 11a 12a 11b 12b 11c 12c 11a 11b 11c собою -(C0-C3алкілен)-B-X-(CR R )m-(CR R )n-(CR R )p-C(O)OH, де B, X, R , R , R , 12a 12b 12c R , R , R , m, n та p являють собою такі, як визначено вище; та L являє собою відхідну групу. Даний винахід також включає будь-які варіанти даних способів, у яких проміжний продукт, отримуваний на будь-якій їх стадії, застосовують як вихідну речовину, та здійснюють решту стадій, або у яких вихідні речовини утворюються in situ в умовах реакції, або у яких компоненти реакції застосовують у вигляді їх солей або оптично чистих антиподів. Сполуки даного винаходу та проміжні сполуки можна також перетворити одну у іншу згідно зі способами, загалом відомими спеціалісту у даній галузі техніки. Засоби даного винаходу діють, блокуючи епітеліальні натрієві канали (ENaC). Приймаючи до уваги їх блокування епітеліальних натрієвих каналів (ENaC), сполуки формули (I), у вільній формі або у вигляді фармацевтично прийнятної солі, у даному винаході далі будуть називатися "засобами даного винаходу", що є придатними для лікування захворювань, які ж чутливими до блокади епітеліальних натрієвих каналів, зокрема, захворювань, для яких корисна гідратація слизової оболонки. Захворювання, опосередковані блокадою епітеліальних натрієвих каналів, включають захворювання, зв’язані з регуляцією об’ємів рідини по обидві сторони від епітеліальних мембран. Наприклад, об’єм поверхневої рідини дихальних шляхів є ключовим регулятором мукоциліарного кліренсу та підтримання здоров’я легенів. Блокада епітеліальних натрієвих каналів буде сприяти накопиченню рідини на слизовій стороні епітелію дихальних шляхів, 14 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом цього сприяючи кліренсу слизової та попереджаючи накопичення слизу та мокроти у легеневих тканинах (включаючи дихальні шляхи легенів). Дані захворювання включають респіраторні захворювання, такі як кістозний фіброз, первинна циліарна дискінезія, хронічний бронхіт, хронічне обструктивне захворювання легенів (ХОЗЛ), астма, інфекції дихальних шляхів (гострі та хронічні; вірусні та бактеріальні) та карцинома легенів. Захворювання, опосередковані блокадою епітеліальних натрієвих каналів, також включають захворювання, відмінні від респіраторних захворювань, які зв’язані з порушеною регуляцією рідини через епітелій, що можливо включає порушену фізіологію захисних поверхневих рідин на його поверхні, наприклад, ксеростомію (сухість у роті) або кератокон’юнктивіт (сухість очей). Крім того, блокаду епітеліальних натрієвих каналів у нирці можна застосовувати для того, щоб сприяти діурезу та, шляхом цього, викликати гіпотензивний ефект. Лікування згідно з даним винаходом може бути при клінічних проявах або профілактичним, зокрема, при клінічних проявах. Таким чином, у наступному аспекті даний винахід включає засіб даного винаходу для застосування як фармацевтичний препарат. Отже, згідно з наступним аспектом даний винахід відноситься до засобу даного винаходу для лікування або попередження захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів. Отже, згідно з наступним аспектом даний винахід відноситься до застосування засобу даного винаходу у одержанні лікарського препарату для лікування або попередження захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів. Отже, згідно з наступним аспектом даний винахід відноситься до способу попередження або лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, при якому вводять ефективну кількість засобу даного винаходу пацієнту, що потребує такого лікування. Астма включає і спадкову (неалергічну) бронхіальну астму та набуту (алергічну) бронхіальну астму, легку бронхіальну астму, помірну бронхіальну астму, важку бронхіальну астму, бронхітичну астму, бронхіальну астму фізичного навантаження, професійну бронхіальну астму та бронхіальну астму, викликану бактеріальною інфекцією. Лікування астми також слід розуміти як таке, що включає лікування суб’єктів, наприклад, молодше 4 або 5 років з симптомами астми та яким поставлений діагноз або можна поставити діагноз "діти з астмою", встановленої категорії пацієнтів основного медичного нагляду та у даний час часто визначуваної як астматики на ранній стадії. (Для зручності дане конкретне астматичне захворювання називають "дитячий астматичний синдром".) Профілактична інтенсивність лікування астми буде підтверджуватися зниженою частотою або важкістю симптоматичного загострення, наприклад, гострого астматичного або бронхоконстрикторного загострення, покращенням функціонування легенів або покращенням гіперреактивності дихальних шляхів. Вона буде додатково підтверджуватися зниженою вимогою у іншій, симптоматичній терапії, тобто терапії для або призначеної для втримання або купіювання симптоматичного загострення, коли воно виникає, наприклад, протизапальної (наприклад, кортикостероїд) або бронхорозширюючої. Профілактична користь при астмі може, зокрема, бути очевидна для суб’єктів, схильних до "значного зниження максимального об’єму видиху зранку". "Значне зниження максимального об’єму видиху зранку" являє собою загально визнаний астматичний синдром, загальний для суттєвого проценту астматиків та що характеризується нападом астми, наприклад, між 4 та 6 годинами ранку, тобто у момент часу, звичайно по суті віддалений від раніше проведеної терапії симптоматичної астми. Хронічне обструктивне захворювання легенів включає хронічний бронхіт та зв’язану з ним задишку, емфізему, а також посилення гіперреактивності дихальних шляхів внаслідок терапії іншими лікарськими засобами, зокрема, іншої інгаляційної лікарської терапії. Даний винахід також є застосовним для лікування бронхіту будь-якого типу або походження, включаючи, наприклад, гострий, арахідиновий, катаральний, крупозний, хронічний або гнійний туберкульозний бронхіт. Засоби даного винаходу можуть також бути придатні як блокатори активуємих протонами іонних каналів (ASIC). Таким чином, вони є придатними для лікування захворювань, які є чутливими до блокади активуємих протонами іонних каналів. Придатність блокатору епітеліальних натрієвих каналів для лікування захворювання, для якого корисна гідратація слизової оболонки, можна досліджувати визначенням інгібуючого ефекту блокаторів каналів на ENaC у підходящому аналізі на основі клітин. Наприклад, ізольовані клітини або конфлюентний епітелій, ендогенно експресуючий або сконструйований таким чином, щоб він надекспресував ENaC, можна застосовувати для оцінки функціонування 15 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 каналів, застосовуючи електрофізіологічні способи або дослідження потоку іонів. Див. способи, описані у Hirsh et al., J Pharm. Exp. Ther. (2004); Moody et al., Am. J. Physiol. Cell Physiol. (2005). Згідно з вищевикладеним, даний винахід також відноситься у наступному аспекті до способу попередження або лікування захворювання, чутливого до блокади епітеліальних натрієвих каналів, наприклад, захворювань, зв’язаних з регуляцією об’ємів рідини по обидві сторони від епітеліальних мембран, зокрема обструктивного захворювання дихальних шляхів, який включає введення суб’єкту, зокрема суб’єкту, що є людиною, яка цього потребує, сполуки формули (I) або її фармацевтично прийнятної солі або сольвату. У іншому аспекті даний винахід відноситься до сполуки формули (I) у вільній формі, або її фармацевтично прийнятної солі, або сольвату для попередження або лікування захворювання, чутливого до блокади епітеліальних натрієвих каналів, зокрема, обструктивного захворювання дихальних шляхів, наприклад, кістозного фіброзу та ХОЗЛ. У іншому аспекті даний винахід відноситься до застосування сполуки формули (I) у вільній формі, або її фармацевтично прийнятної солі або сольвату, для одержання лікарського засобу для попередження або лікування захворювання, чутливого до блокади епітеліальних натрієвих каналів, зокрема, обструктивного захворювання дихальних шляхів, наприклад, кістозного фіброзу та ХОЗЛ. Сполуки даного винаходу мають гарну ENaC блокуючу активність, та їх можна випробовувати у наступних аналізах. Культура клітин Бронхіальні епітеліальні клітини людини (HBEC) (Cambrex) вирощували в умовах границі розділу водного та повітряного середовищ, отримуючи добре диференційований мукоциліарний фенотип. HBEC вирощували, застосовуючи модифікацію способу, описаного Gray та колегами (Gray et al., 1996). Клітини висівали у пластикові T-162 колби та вирощували у середовищі для вирощування бронхіальних епітеліальних клітин (BEGM; Cambrex), постаченому екстрактом гіпофізу бика (52 мкг/мл), гідрокортизоном (0,5 мкг/мл), людським рекомбінантним епідермальним фактором росту (0,5 нг/мл), епінефрином (0,5 мкг/мл), трансферином (10 мкг/мл), інсуліном (5 мкг/мл), ретиноєвою кислотою (0,1 мкг/мл), трийодтироніном (6,5 мкг/мл), гентаміцином (50 мкг/мл) та амфотерецином B (50 нг/мл). Середовище заміняли кожні 48 годин 5 до 90% конфлюентності клітин. Потім клітини пересівали та засівали (8,2510 клітини/вставка) на полікарбонатні Snapwell вставки (Costar) у середовищі для диференціації, що містить 50% DMEM у BEGM з такими ж добавками, як вище, але без трийодтироніну та при кінцевій концентрації ретиноєвої кислоти 50 нМ (повністю транс-ретиноєва кислота). Клітини витримували зануреними впродовж перших 7 днів у культурі, після чого їх піддавали апікальному повітряному спряженню впродовж періоду культивування, що залишився. На даний момент середовище заміняли на DMEM:F12 середовище, що містить 2% об./об. Ultroser G, для решти частини культури. Амфотерецин B видаляли з усіх 3 фуражей середовища перед застосуванням у камері Уссинга. Клітини застосовували між 7 та 21 днями після створення апікального повітряного спряження. На всіх стадіях культивування клітини витримували при 37C у 5% CO2 у повітряному інкубаторі. Вимірювання току короткого замикання (ISC) Snapwell вставки встановлювали у камери для вертикальної дифузії (Costar) та безперервно заливали насиченим газом розчином Рінгеру (5% CO 2 у O2; pH 7,4), підтримуваним при 37C, що містить (у мМ): 120 NaCl, 25 NaHCO3,3,3 KH2PO4,0,8 K2HPO4,1,2 CaCl2,1,2 MgCl2 та 10 глюкози. Осмолярність розчину була між 280 та 300 мОсмоль/кг H 2О для всіх застосовуваних фізіологічних розчинів солі. Клітини піддавали фіксації напруги 0 мВ (model EVC4000; WPI). RT вимірювали застосуванням 1- або 2-мВ імпульсу з 30-секундними інтервалами та розраховували RT за законом Ома. Дані реєстрували, застосовуючи PowerLab робочу станцію (ADInstruments). Випробувані сполуки отримували у вигляді 10 мМ вихідного розчину у DMSO (95%). Серійні 3-разово розведені розчини отримували свіжими у підходящому середовищі (дистильована H 2O або розчин Рінгера). Початкову концентрацію додавали до апікальної камери у вигляді 1000× концентрату у 5 мкл, отримуючи у результаті кінцеву 1× концентрацію 5 мл об’єму камери Уссига. Наступні додавання сполуки здійснювали у 3,3 мкл об’ємі 1000× послідовно розведеного вихідного розчину. При закінченні експерименту «концентрація-відгук» додавали у апікальну камеру амілорид (10 мкм), забезпечуючи вимірювання чутливого до амілориду току. Амілоридний контроль IC50 встановлювали на початку кожного експерименту. Результати виражені у вигляді середнього % інгібування чутливого до амілориду ISC. 16 UA 111595 C2 5 10 15 20 25 30 35 40 Будували криві концентрація-відклик, та IC50 величини отримували, застосовуючи GraphPad Prism 3.02 або Graphpad Prism 4. Клітинні вставки звичайно аналізували двічі та IC 50 розраховували на основі даних про середній % інгібування. Сполуки прикладів у даному винаході нижче звичайно мають IC 50 величини нижче 10 мкМ, звичайно нижче 1 мкМ. Наприклад, наступні приклади мають зазначені IC50 величини. Приклад HBEC-ENaC/IC50[мкмоль І1] 1,0 0,017 1,1 0,419 1,2 0,010 1,3 0,003 1,4 0,302 2,0 0,032 2,1 0,030 2,2 0,012 2,3 0,089 2,4 0,110 3,0 0,011 4,0 0,101 4,1 0,132 4,2 0,45 5,0 0,012 5,1 0,031 5,2 0,019 Засоби даного винаходу можна вводити будь-яким підходящим шляхом, наприклад перорально, наприклад, у вигляді таблетки або капсули; парентерально, наприклад внутрівенно; місцево на шкіру; інтраназально, наприклад для лікування алергічного риніту; або, переважно, інгаляцією, зокрема, для лікування обструктивного або запального захворювання дихальних шляхів. Зокрема, засоби даного винаходу можна доставляти у вигляді складу, що інгалюється, для лікування ХОЗЛ, кістозного фіброзу або бронхіальної астми. У іншому аспекті даний винахід відноситься до фармацевтичної композиції, що містить сполуку даного винаходу та фармацевтично прийнятний носій. Фармацевтичну композицію можна формулювати для конкретних шляхів введення, таких як пероральне введення, парентеральне введення та ректальне введення та т.д. Крім того, фармацевтичну композицію даного винаходу можна отримати у твердій формі (включаючи, без обмеження, капсули, таблетки, пігулки, гранули, порошки або супозиторії) або у рідкій формі (включаючи, без обмеження, розчини, суспензії або емульсії). Фармацевтичні композиції можна піддавати загальноприйнятим фармацевтичним операціям, таким як стерилізація, та/або вони можуть містити загальноприйняті інертні розріджувачі, змащуючі агенти або буфери, а також ад`юванти, такі як консерванти, стабілізатори, змочуючі агенти, емульгатори та буфери, тощо. Звичайно фармацевтичні композиції являють собою таблетки або желатинові капсули, що містять активний інгредієнт разом з a) розріджувачами, наприклад, лактозою, глюкозою, сахарозою, манітом, сорбітом, целюлозою та/або гліцином; b) змащуючими агентами, наприклад, діоксидом кремнію, тальком, стеариновою кислотою, її магнієвою або кальцієвою сіллю та/або поліетиленгліколем; для таблеток також c) зв'язуючими, наприклад, силікатом магнію алюмінію, крохмальним клейстером, желатином, трагакантом, метилцелюлозою, натрій-карбоксиметилцелюлозою та/або полівінілпіролідоном; при бажанні d) розпушувачами, наприклад, крохмалем, агаром, альгіновою кислотою або її натрієвою сіллю, або шипучими сумішами, та/або е) абсорбентами, барвниками, ароматизаторами та підсолоджувачами. Таблетки можна покривати або плівкою або ентеросолюбільною оболонкою згідно зі способами, відомими у даній галузі техніки. Підходящі композиції для перорального введення містять ефективну кількість сполуки даного винаходу у вигляді таблеток, пастилок, водних або масляних суспензій, диспергуємих порошків або гранул, емульсії, твердих або м’яких капсул, або сиропів або еліксирів. Композиції, призначені для перорального застосування, отримують згідно з будь-яким способом, відомим у галузі одержання фармацевтичних композицій, та дані композиції можуть містити один або більше агентів, вибраних з групи, що складається з підсолоджувачів, ароматизаторів, барвників 17 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 та консервантів для того, щоб забезпечити фармацевтично першокласні та приємні на вигляд препарати. Таблетки можуть містити активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними допоміжними речовинами, які є підходящими для одержання таблеток. Дані допоміжні речовини являють собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі агенти та розпушувачі, наприклад, кукурудзяний крохмаль або альгінову кислоту; зв’язуючі, наприклад, крохмаль, желатин або аравійську камедь; та змащуючі агенти, наприклад, стеарат магнію, стеаринову кислоту або тальк. На таблетки не наносять покриття або наносять покриття відомими способами для уповільнення розкладу та поглинання у шлунково-кишковому тракті та, за допомогою чого, забезпечують пролонговану дію впродовж більш тривалого періоду часу. Наприклад, можна застосовувати уповільнюючі матеріали, такі як гліцерилмоностеарат або гліцерилдистеарат. Склади для перорального застосування можуть бути представлені у вигляді твердих желатинових капсул, у яких активний інгредієнт змішують з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м’яких желатинових капсул, у яких активний інгредієнт змішують з водою або масляним середовищем, наприклад, арахісовим маслом, рідким парафіном або оливковим маслом. Певні композиції, які вводять ін’єкцією, являють собою водні ізотонічні розчини або суспензії, та супозиторії краще отримувати з жирних емульсій або суспензій. Зазначені композиції можна стерилізувати, та/або вони можуть містити ад’юванти, такі як консерванти, стабілізатори, змочуючі агенти або емульгатори, агенти, що сприяють розчиненню, солі для регулювання осмотичного тиску та/або буфери. Крім того, вони можуть також містити інші терапевтично цінні речовини. Зазначені композиції отримують згідно із загальноприйнятими способами змішування, гранулювання або нанесення покриття, відповідно, та вони містять приблизно 0,175% або містять приблизно 1-50% активного інгредієнту. Підходящі композиції для трансдермального застосування містять ефективну кількість сполуки даного винаходу з підходящим носієм. Носії, підходящі для трансдермальної доставки, включають абсорбуємі фармакологічно прийнятні розчинники, що сприяють проходженню через шкіру хазяїна. Наприклад, трансдермальні пристрої мають вигляд пов’язки, що містить каркасний елемент, ємкість, що містить сполуку необов’язково з носіями, бар’єр, який необов’язково контролює швидкість, для доставки сполуки на шкіру хазяїна при контрольованій та завчасно визначеній швидкості впродовж тривалого періоду часу, та засоби для закріплення пристрою на шкірі. Підходящі композиції для місцевого застосування, наприклад, на шкіру та очі, включають водні розчини, суспензії, мазі, креми, гелі або спреї, наприклад, для доставки аерозолем або подібні. Дані системи для місцевої доставки будуть, зокрема, підходити для кожного застосування, наприклад, для лікування раку шкіри, наприклад, для профілактичного застосування у кремах від сонця, лосьйонах, спреях та подібних. Таким чином, вони є особливо придатними для застосування у місцевих, включаючи косметичні, складах, добре відомих у даній галузі техніки. Вони можуть містити агенти, що сприяють розчиненню, стабілізатори, агенти, що регулюють тонічність, буфери та консерванти. Як застосовують у даному винаході, місцеве застосування може також відноситися до інгаляції або інтраназального застосування. Склади можна зручно доставляти у вигляді сухого порошку (або окремо, у вигляді суміші, наприклад, сухої суміші з лактозою, або змішаних частинок компонентів, наприклад, з фосфоліпідами) з порошкового інгалятору або у вигляді спрей-аерозолю з контейнеру під тиском, пульверизатору, аерозольного інгалятору або розпилювача, із або без застосування підходящого пропеленту. Коли формою активного інгредієнта, що вводиться інгаляцією, є аерозольна композиція, пристрій для інгаляції може представляти собою аерозольний флакон, оснащений клапаном, пристосованим для доставки відміряної дози, такої як 10-100 мкл, наприклад 25-50 мкл, композиції, тобто пристрій, відомий як дозуючий інгалятор. Підходящі дані аерозольні флакони та способи наповнення у них аерозольних композицій під тиском є добре відомими спеціалісту у галузі інгаляційної терапії. Наприклад, аерозольну композицію можна вводити з металічного балону з покриттям, наприклад, як описано у EP-A-0642992. Коли форма активного інгредієнту, що вводиться інгаляцією, являє собою розпилювальну водну, органічну або водну/органічну дисперсію, пристрій для інгаляції може представляти собою відомій розпилювач, наприклад, загальноприйнятий пневматичний розпилювач, такий як розпилювач з повітряною форсункою або ультразвуковий розпилювач, який може містити, наприклад, від 1 до 50 мл, звичайно 1-10 мл, дисперсії; або кишеньковий розпилювач, що іноді називається інгалятор типу «м’який аерозоль» або «м’який спрей», наприклад, електронноконтрольований пристрій, такий як AERx (Aradigm, US) або Aerodose (Aerogen), або механічний пристрій, такий як RESPIMAT (Boehringer 18 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 Ingelheim) розпилювач, який забезпечує набагато меншими розпорошувальними об’ємами, наприклад, 10-100 мкл, ніж загальноприйняті розпилювачі. Коли формою активного інгредієнту, що вводиться інгаляцією, є форма дрібнодисперсних частинок, пристрій для інгаляції може представляти собою, наприклад, порошковий інгалятор, пристосований для доставки сухого порошку з капсули або блістера, що містять сухий порошок, що містить одиницю дозування (A) та/або (B), або багатодозовий порошковий інгалятор (MDPI), пристосований для доставки, наприклад, 3-25 мг сухого порошку, що містить одиницю дозування (A) та/або (B) при одному включенні. Композиція у вигляді сухого порошку переважно містить розріджувач або носій, такий як лактоза, та сполуку, яка сприяє захисту проти погіршення якості продукту у результаті впливу вологи, наприклад, стеарат магнію. Підходящі дані порошкові інгалятори включають пристрої, описані у US 3991761 (що включає AEROLIZER™ пристрій), WO 05/113042 (що включає BREEZHALER™ пристрій), WO 97/20589 (що включає CERTIHALER™ пристрій), WO 97/30743 (що включає TWISTHALER™ пристрій), WO 05/37353 (що включає GYROHALER™ пристрій), US6536427 (що включає DISKUS™ пристрій), WO 97/25086 (що включає DISKHALER™ пристрій), WO 95/14089 (що включає GEMINI™ пристрій), WO 03/77979 (що включає PROHALER™ пристрій) та також пристрої, описані у WO 08/51621, WO 09/117112 та US 2005/0183724. Даний винахід також включає (A) засіб даного винаходу у вільній формі або його фармацевтично прийнятну сіль або сольват, у інгальованій формі; (B) лікарський засіб, що вводиться інгаляцією, який містить дану сполуку у інгальованій формі разом з фармацевтично прийнятним носієм у інгальованій формі; (C) фармацевтичний продукт, що містить дану сполуку у інгальованій формі в сполученні з пристроєм для інгаляції; та (D) пристрій для інгаляції, що містить дану сполуку у інгальованій формі. Дози засобів даного винаходу, що застосовують при реалізації на практиці даного винаходу, будуть, звичайно, змінюватися в залежності, наприклад, від конкретного захворювання, яке піддають лікуванню, потрібного ефекту та способу введення. Загалом, підходящі добові дози для введення інгаляцією будуть порядку 0,0001-30 мг/кг, звичайно 0,01-10 мг для пацієнта, толи як підходящі добові дози для перорального введення будуть порядку 0,01-100 мг/кг. Даний винахід додатково відноситься до безводних фармацевтичних композицій та лікарських форм, що містять сполуки даного винаходу як активні інгредієнти, оскільки вода може сприяти руйнуванню певних сполук. Безводні фармацевтичні композиції та лікарські форми даного винаходу можна отримати, застосовуючи безводні інгредієнти або інгредієнти, що містять мало вологи, та умови з низьким вмістом вологи або з низькою вологістю. Безводні фармацевтичні композиції можна отримати та зберігати таким чином, щоб вони зберігались безводними. Відповідно, безводні композиції можна упаковувати, застосовуючи речовини, про які відомо, що вони перешкоджають впливу води таким чином, щоб вони могли міститися у підходящих формулярних наборах. Приклади підходящих упаковок включають, але без обмеження, герметичні упакування з фольги, пластикові упакування, контейнери з одиницями дозування (наприклад, ампули), блістерні упакування та контурні упакування. Даний винахід додатково відноситься до фармацевтичних композицій та лікарських форм, які містять один або більше засобів, які знижують швидкість, з якою сполука даного винаходу як активний інгредієнт буде розкладатися. Дані засоби, які називають у даному винаході "стабілізаторами", включають, але без обмеження, антиоксиданти, такі як аскорбінова кислота, pH буфери або сольові буфери, тощо. Сполука даного винаходу можна вводити або одночасно з, або перед або після одного або більше інших терапевтичних агентів. Сполуку даного винаходу можна вводити окремо, однаковими або різними шляхами введення або разом у одній фармацевтичній композиції як інші агенти. У одному варіанті здійснення даний винахід відноситься до продукту, що містить сполуку формули (I) та щонайменше один інший терапевтичний агент у вигляді змішаного складу для одночасного, окремого або послідовного застосування у терапії. У одному варіанті здійснення терапія являє собою лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів. Продукти, надані у вигляді комбінованого складу, включають композицію, що містить сполуку формули (I) та інший терапевтичний агент (агенти) разом у одній фармацевтичній композиції, або сполуку формули (I) та інший терапевтичний агент (агенти) у окремих формах, наприклад, у вигляді набору. У одному варіанті здійснення даний винахід відноситься до фармацевтичної композиції, що містить сполуку формули (I) та інший терапевтичний агент (агенти). Необов’язково, 19 UA 111595 C2 5 10 15 20 25 30 35 40 45 фармацевтична композиція може містити фармацевтично прийнятну допоміжну речовину, як описано вище. У одному варіанті здійснення даний винахід відноситься до набору, що містить дві або більше окремих фармацевтичних композицій, щонайменше одна з яких містить сполуку формули (I). У одному варіанті здійснення набір містить засоби для окремого зберігання зазначених композицій, такі як контейнер, розділений флакон або розділене упакування з фольги. Прикладом даного набору є блістерне упакування, як звичайно застосовують для упакування таблеток, капсул та подібних. Набір даного винаходу можна застосовувати для введення різних лікарських форм, наприклад, пероральних та парентеральних, для введення окремих композицій через різні інтервали дозування або для титрування окремих композицій відносно одна іншої. Для полегшення дотримання режиму дозування набір даного винаходу звичайно містить настанову щодо введення. Сполуки формули (I) та їх фармацевтично прийнятні солі та сольвати мають перевагу, що полягає в тому, що вони є більш селективними, мають більш швидкий початок дії, є більш ефективними, краще поглинаються, є більш стабільними, є більш стійкими до метаболізму, мають знижений 'харчовий ефект', мають покращений профіль безпеки або мають інші більш бажані властивості (наприклад, відносно розчинності або гігроскопічності), ніж сполуки попереднього рівня техніки. Зокрема, сполуки даного винаходу мають покращений профіль стабільності у плазмі людини. Забезпечуючи сполуки, які мають покращений профіль стабільності у плазмі людини, даний винахід відноситься до сполук, які ефективно блокують епітеліальні натрієві канали (ENaC) з покращеними фармакокінетичними властивостями. Стабільність сполук даного винаходу у плазмі людини вимірювали наступним чином: Стабільність у плазмі людини Кров відбирали у здорових добровольців у літій-гепаринові пробірки та плазму отримували розділенням за допомогою центрифугування кров’яних клітин при 1500g. Плазму щонайменше 3 індивідів змішували та застосовували для визначення стабільності сполук. Сполуки отримували у 100% DMSO при концентрації 10 мМ та послідовно розводили до концентрації 100 мкМ. Інкубування проводили при кінцевій концентрації 1 мкМ та ініціювали додаванням 3 мкл 100 мкМ вихідного розчину сполуки у 297 мкл плазми, попередньо нагрітій у водній бані при 37C, з наступним нетривалим змішуванням струшуванням. 50 мкл аліквоти плазми відбирали у 4 моменти часу впродовж 1-годиного періоду інкубування та реакції відразу припиняли осадженням білків, що досягається додаванням аліквоти плазми до раніше приготовленого 96-лункового планшету, що містить 150 мкл ацетонітрилу, який включає підходящий внутрішній стандарт. Зразки, оброблені ацетонітрилом, перемішували струшуванням з наступним центрифугуванням впродовж 20 хвил. при 1500g для видалення осаджених білків. Початкові концентрації сполуки (у момент часу = 0 хвил.) визначали додаванням сполуки до попередньо деактивованої плазми при тій же концентрації, як застосовувана у інкубуванні. Потім надосадову рідину видаляли, розводили 1:1 водою та аналізували на залишок сполуки рідинною хроматографією-тандемною мас-спектрометрією (Waters Acquity UPLC, Applied Biosystems API4000). Константу швидкості розкладання у плазмі сполук розраховували апроксимацією відношення площин піків сполуки: внутрішній стандарт до функції розкладу по експоненті, та час напіврозкладу розраховували діленням натурального логарифму 2 на константу швидкості розкладу (Microsoft Excel). Наступні приклади мають зазначені величини часу напіврозкладу у плазмі людини. Приклад Час напіврозкладу у плазмі людини 1,0 2 1,2 3 1,3 4 2,0 1 2,1 5 3,0 2 4,0 28 4,1 3 4,2 4 5,0 5 5,1 2 5,2 39 20 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 У комбінаційних терапіях даного винаходу сполука даного винаходу та інший терапевтичний агент можуть бути отримані та/або сформульовані одним і тим же або різними виробниками. Більше того, сполука даного винаходу та інший терапевтичний агент можна об’єднувати у комбінаційній терапії: (i) перед відкриттям комбінаційного продукту терапевтом (наприклад, у випадку набору, що містить сполуку даного винаходу та інший терапевтичний агент); (ii) самим терапевтом (або під керівництвом терапевта) незадовго до введення; (iii) самим пацієнтом, наприклад, у процесі послідовного введення сполуки даного винаходу та іншого терапевтичного агенту. Відповідно, даний винахід відноситься до застосування сполуки формули (I) для лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де лікарський засіб отримують для введення з іншим терапевтичним агентом. Даний винахід також відноситься до застосування іншого терапевтичного агенту для лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де лікарський засіб вводять зі сполукою формули (I). Даний винахід також відноситься до сполуки формули (I) для застосування у способі лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де сполуку формули (I) отримують для введення з іншим терапевтичним агентом. Даний винахід також відноситься до іншого терапевтичного агенту для застосування у способі лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де інший терапевтичний агент отримують для введення зі сполукою формули (I). Даний винахід також відноситься до сполуки формули (I) для застосування у способі лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де сполуку формули (I) вводять з іншим терапевтичним агентом. Даний винахід також відноситься до іншого терапевтичного агенту для застосування у способі лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де інший терапевтичний агент вводять зі сполукою формули (I). Даний винахід також відноситься до застосування сполуки формули (I) для лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де пацієнт раніше (наприклад, у межах 24 годин) піддавався лінуванню іншим терапевтичним агентом. Даний винахід також відноситься до застосування іншого терапевтичного агенту для лікування захворювання або стану, опосередкованого блокадою епітеліальних натрієвих каналів, де пацієнт раніше (наприклад, у межах 24 годин) піддавався лінуванню сполукою формули (I). У одному варіанті здійснення інший терапевтичний агент вибраний з протизапальної, бронхорозширюючої, антигістамінової, протизастійної та протикашлевої лікарської речовини, зокрема для лікування кістозного фіброзу або обструктивних або запальних захворювань дихальних шляхів, таких як захворювання, приведені вище у даному винаході, наприклад, як агенти, потенціюючі терапевтичну активність даних лікарських засобів або як засоби для зниження потрібної дози або потенціальних побічних ефектів даних лікарських засобів. Відповідно, даний винахід включає як додатковий аспект комбінацію блокатору епітеліальних натрієвих каналів даного винаходу з осмотичними агентами (гіпертонічний розчин NaCl для внутрівенного введення, декстран, маніт, ксилітол), модифікуючими CFTR функцію агентами, і дикого типу, і мутантними (коректуючими та потенціюючими агентами), наприклад, агентами, описаними у WO 2007/021982, WO 2006/099256, WO 2006/127588, WO 2004/080972, WO 2005/026137, WO 2005/035514, WO 2005/075435, WO 2004/111014, WO 2006/101740, WO 2004/110352, WO 2005/120497 та US 2005/0176761, протизапальним, бронхорозширюючим, антигістаміновим, протикашлевим, антибіотиком або DNase лікарською речовиною, причому зазначений блокатор епітеліальних натрієвих каналів та вказана лікарська речовина можуть бути у одній або різних фармацевтичних композиціях. Підходящі модифікуючі CFTR функцію агенти включають CFTR потенціюючи агенти, зокрема сполуку VX-770 формули 21 UA 111595 C2 5 10 15 20 25 30 35 40 Підходящі антибіотики включають макролідні антибіотики, наприклад, тобраміцин (TOBI™). Підходящі DNase лікарські речовини включають дорназу альфа (Pulmozyme™), добре очищений розчин рекомбінантної людської дезоксирибонуклеази I (rhDNase), яка селективно розщеплює ДНК. Дорназу альфа застосовують для лікування кістозного фіброзу. Інші підходящі комбінації блокаторів епітеліальних натрієвих каналів з протизапальними агентами являють собою комбінації з антагоністами хемокінових рецепторів, наприклад, CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 та CCR10, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, зокрема CCR-5 антагоністами, такими як антагоністи Шерінга-Плау SC351125, SCH-55700 та SCH-D; антагоністи Такеда, такі як хлорид N-[[4-[[[6,7-дигідро-2-(4метилфеніл)-5H-бензоциклогептен-8-іл]карбоніл]аміно]феніл]метил]тетрагідро-N,N-диметил-2Hпіран-4-амінію (TAK-770); та CCR-5 антагоністи, описані у USP 6166037 (особливо пункти 18 та 19), WO 00/66558 (особливо пункт 8), WO 00/66559 (особливо пункт 9), WO 04/018425 та WO 04/026873. Підходящі протизапальні лікарські засоби включають стероїди, зокрема глюкокортикостероїди, такі як будесонід, дипропіонат бекламетазону, пропіонат флутиказону, циклезонід або фуроат мометазону, або стероїди, описані у WO 02/88167, WO 02/12266, WO 02/100879, WO 02/00679 (особливо стероїди прикладів 3, 11, 14, 17, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 та 101), WO 03/35668, WO 03/48181, WO 03/62259, WO 03/64445, WO 03/72592, WO 04/39827 та WO 04/66920; нестероїдні агоністи глюкокортикоїдних рецепторів, такі як агоністи, описані у DE 10261874, WO 00/00531, WO 02/10143, WO 03/82280, WO 03/82787, WO 03/86294, WO 03/104195, WO 03/101932, WO 04/05229, WO 04/18429, WO 04/19935 та WO 04/26248; LTD4 антагоністи, такі як монтелукаст та зафірлукаст; PDE4 інгібітори, такі як циломіласт (Ariflo® GlaxoSmithKline), рофлуміласт (Byk Gulden), V-11294A (Napp), BAY19-8004 (Bayer), SCH-351591 (Schering-Plough), арофілін (Almirall Prodesfarma), PD189659/PD168787 (Parke-Davis), AWD-12-281 (Asta Medica), CDC-801 (Celgene), SelCID(TM) CC-10004 (Celgene), VM554/UM565 (Vernalis), T-440 (Tanabe), KW-4490 (Kyowa Hakko Kogyo), та інгібітори, описані у WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/018431, WO 04/018449, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 та WO 04/037805; аденозинові A2B рецепторні антагоністи, такі як антагоністи, описані у WO 02/42298; та бета-2 адренорецепторні агоністи, такі як альбутерол (салбутамол), метапротеренол, тербуталін, салметерол, фенотерол, прокатерол та особливо формотерол, кармотерол та їх фармацевтично прийнятні солі, та сполуки (у вільній або сольовій або сольватній формі) формули (I) WO 0075114, який включений у даний винахід за допомогою посилання, переважно сполуки його прикладів, особливо сполука формули: що відповідає індакатеролу, та його фармацевтично прийнятні солі, а також сполуки (у вільній або сольовій або сольватній формі) формули (I) WO 04/16601 та також сполуки EP 1440966, JP 05025045, WO 93/18007, WO 99/64035, USP 2002/0055651, WO 01/42193, WO 22 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 01/83462, WO 02/66422, WO 02/70490, WO 02/76933, WO 03/24439, WO 03/42160, WO 03/42164, WO 03/72539, WO 03/91204, WO 03/99764, WO 04/16578, WO 04/22547, WO 04/32921, WO 04/33412, WO 04/37768, WO 04/37773, WO 04/37807, WO 04/39762, WO 04/39766, WO 04/45618, WO 04/46083, WO 04/80964, WO 04/108765 та WO 04/108676. Підходящі бронхорозширюючі лікарські засоби включають антихолінергічні або антимускаринові агенти, зокрема, бромід іпратропію, бромід окситропію, тіотропієві солі та CHF 4226 (Chiesi) та глікопіролат, але також сполуки, описані у EP 424021, USP 3714357, USP 5171744, WO 01/04118, WO 02/00652, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/33495, WO 03/53966, WO 03/87094, WO 04/018422 та WO 04/05285. Підходящі подвійні протизапальні та бронхорозширюючі лікарські засоби включають подвійні бета-2 адренорецепторний агоніст/мускаринові антагоністи, такі як ті, що описані у USP 2004/0167167, WO 04/74246 та WO 04/74812. Підходящі антигістамінові лікарські речовини включають гідрохлорид цетиризину, ацетамінофен, фумарат клемастину, прометазин, лоратидин, деслоратидин, дифенгідрамін та гідрохлорид фексофенадину, активастин, астемізол, азеластин, ебастин, епінастин, мізоластин та тефенадин, а також речовини, описані у JP 2004107299, WO 03/099807 та WO 04/026841. Як застосовують у даному винаході, термін "фармацевтично прийнятний носій" включає будь-який та всі розчинники, середовища для диспергування, покриваючі агенти, поверхневоактивні речовини, антиоксиданти, консерванти (наприклад, протимікробні агенти, протигрибкові агенти), ізотонічні агенти, агенти, уповільнюючі поглинання, солі, консерванти, лікарські засоби, стабілізатори лікарських засобів, зв’язуючі, допоміжні речовини, розпушувачі, змащуючі агенти, підсолоджувачі, ароматизатори, барвники та подібні, та їх комбінації, як відомо спеціалісту у th даній галузі техніки (див., наприклад, Remington's Pharmaceutical Sciences, 18 Ed. Mack Printing Company, 1990, pp.1289-1329). За виключенням випадків, коли будь-який загальноприйнятий носій є несумісним з активним інгредієнтом, передбачається його застосування у терапевтичних або фармацевтичних композиціях. Термін "терапевтично ефективна кількість" сполуки даного винаходу відноситься до кількості сполуки даного винаходу, яка викликає біологічну або медичну відповідь у суб’єкта, наприклад, зниження або інгібування активності ферменту або білку, або полегшення симптомів, полегшення захворювань, уповільнення або пом’якшення розвитку захворювання або попередження захворювання, тощо. У одному необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка при введенні суб’єкту є ефективною для (1) щонайменше часткового полегшення, інгібування, попередження та/або амеліорації стану або розладу або захворювання (i) опосередкованого епітеліальними натрієвими каналами або (ii) пов’язаного з активністю епітеліальних натрієвих каналів або (iii) що характеризується активністю (нормальною або порушеною) епітеліальних натрієвих каналів; або (2) зниження або інгібування активності епітеліальних натрієвих каналів. У іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка при введенні у клітину, або тканину, або неклітинний біологічний матеріал, або середовище, є ефективною для щонайменше часткового зниження або інгібування активності епітеліальних натрієвих каналів. Як застосовують у даному винаході термін "суб’єкт" відноситься до тварини. Звичайно тварина являє собою ссавця. Суб’єкт також відноситься, наприклад, до приматів (наприклад, людей), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей, риб, птахів та т.п. У певних варіантах здійснення суб’єкт являє собою примата. У ще іншому варіанті здійснення суб’єкт являє собою людину. Як застосовують у даному винаході, терміни "інгібітор", "інгібувати" або "інгібування" відносяться до полегшення або пригнічення зазначеного стану, симптому або розладу, або захворювання, або значного зниження вихідної активності біологічної активності або процесу. Як застосовують у даному винаході, термін "лікувати" або "лікування" будь-якого захворювання або розладу відноситься у одному варіанті здійснення до полегшення захворювання або розладу (тобто уповільнення, або зупинки, або зниження розвинення захворювання або щонайменше одного з його клінічних симптомів). У іншому варіанті здійснення "лікувати" або "лікування" відноситься до полегшення або амеліорації щонайменше одного фізичного параметру, включаючи параметри, які можуть бути непомітні для пацієнта. У ще іншому варіанті здійснення "лікувати" або "лікування" відноситься до модулювання захворювання або розладу, або фізично (наприклад, стабілізація симптому, що сприймається), фізіологічно (наприклад, стабілізація фізичного параметру), або обома. У ще іншому варіанті здійснення "лікувати" або "лікування" відноситься до попередження або уповільнення виникнення, або розвинення, або прогресування захворювання або розладу. 23 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як застосовують у даному винаході, суб’єкт є "потребуючим" лікування, якщо даний суб’єкт буде отримувати користь біологічно, медично або у нього буде покращуватися якість життя при даному лікуванні. Як застосовують у даному винаході, будь-які терміни, використовувані у контексті даного винаходу (особливо у контексті формули винаходу), слід розуміти як такі, що включають форми і однини, і множини, якщо не зазначено інше у даному винаході або явно не протирічить контексту. Всі способи, описані у даному винаході, можна здійснювати у будь-якому підходящому порядку, якщо не зазначено інше у даному винаході або явно не протирічить контексту. Застосування будь-якого та всіх прикладів або вирази для приведення прикладів (наприклад, "такий як"), що є у даному винаході, маються на увазі тільки для кращого висвітлення даного винаходу та не є обмежуючими обсяг даного винаходу, зазначений у формулі винаходу. Даний винахід проілюстровано наступними прикладами. ПРИКЛАДИ Посилаючись на приклади, які слідують далі, сполуки кращих варіантів здійснення отримують, застосовуючи способи, описані у даному винаході, або інші способи, які є відомими у даній галузі техніки. Повинно бути зрозуміло, що органічні сполуки згідно з кращими варіантами здійснення можуть мати властивість таутомерії. Оскільки хімічні структури у описі можуть представляти тільки одну з можливих таутомерних форм, повинно бути зрозуміло, що кращі варіанти здійснення включають будь-яку таутомерну форму зображеної структури. Зрозуміло, що даний винахід не обмежується варіантами здійснення, приведеними у даному винаході для ілюстрації, але включає всі їх форми, які попадають у обсяг приведеного вище опису. Загальні умови: Мас-спектри отримували у LCMS системах, застосовуючи електроспрей-іонізацію. Вони представляли собою або комбінації Agilent 1100 ВЕРХ/Micromass Platform мас-спектрометр або комбінації Agilent 1200 HPLC/Agilent 6130 квадрупольний мас-спектрометр, або Waters Acquity + UPLC з SQD мас-спектрометр. [M+H] відноситься до моноізотопних молекулярних мас. ЯМР спектри отримували на наявному у відкритому доступі Bruker AVANCE 400 NMR спектрометрі, застосовуючи ICON-NMR. Спектри реєстрували при 298K та відносили до стандарту, застосовуючи пік розчиннику. Деякі протони не спостерігали через дуже широку природу їх обмінних резонансів. Наступні приклади передбачаються для ілюстрації даного винаходу, та не слід розглядати їх як обмежуючі його. Температури приведені у градусах Цельсію. Якщо не зазначено інше, всі випарювання проводять при зниженому тиску. Структури кінцевих продуктів, проміжних сполук та вихідних речовин підтверджують стандартними аналітичними способами, наприклад, мікроаналізом та спектроскопічними характеристиками, наприклад, МС, ІЧ, ЯМР. Застосовувані скорочення є скороченнями, загально прийнятими у даній галузі техніки. Якщо не визначено, терміни приймають їх загально прийняті значення. Скорочення: розшир - розширений д - дуплет DCM - дихлорметан DSC - диференційна скануюча калориметрія DMF - N,N-диметилформамід DMI - 1,3-диметил-2-імідазолідинон DMSO - диметилсульфоксид EDCI - N-(3-диметиламінопропіл)-N'-етилкарбодіімід EtOAc - етилацетат год. - година(години) HOBt - 1-гідроксибензотриазол ВЕРХ - високоефективна рідинна хроматографія РХ-MС - рідинна хроматографія-мас-спектрометрія MeOH - метанол MS - мас-спектрометрія м - мультиплет 2-МeTHF - 2-метилтетрагідрофуран хвил. - хвилина(и) мл - мілілітр(мілілітри) 24 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 60 m/z - відношення маси до заряду ЯМР - ядерний магнітний резонанс iPrOH - ізопропанол ppm - частин на мільйон PS - полімерна підкладка PEAX PE - аніоннобмінник (наприклад, Isolute® PE-AX колонки фірми Biotage) Rt - час утримання с - синглет SCX-2 сильний катіонообмінник (наприклад, Isolute® SCX-2 колонки фірми Biotage) т - триплет TEA - триетиламін TFA - трифтороцтова кислота THF - тетрагідрофуран Посилаючись на приклади, які слідують далі, сполуки кращих варіантів здійснення отримують, застосовуючи способи, описані у даному винаході, або інші способи, які є відомими у даній галузі техніки. Різні вихідні речовини, проміжні сполуки та сполуки кращих варіантів здійснення можна виділити та очистити, за необхідності, застосовуючи загальноприйняті способи, такі як осадження, фільтрування, кристалізація, упарювання, перегонка та хроматографія. Якщо не зазначено інше, всі вихідні речовини отримують з комерційних джерел та застосовують без додаткового очищення. Солі можна отримати зі сполук за відомими способами утворення солей. Повинно бути зрозуміло, що органічні сполуки згідно з кращими варіантами здійснення можуть мати властивість таутомерії. Оскільки хімічні структури у описі можуть представляти тільки одну з можливих таутомерних форм, повинно бути зрозуміло, що кращі варіанти здійснення включають будь-яку таутомерну форму намальованої структури. Якщо не зазначено інше, аналітичні ВЕРХ умови були наступними: Спосіб 2minLC_v002 Колонка Waters BEH C18 502,1 мм, 1,7 мкм Температура колонки 50C Елюенти A: H2O, B: метанол, обидва містять 0,1% TFA Швидкість потоку 0,8 мл/хвил. Градієнт 0,20 хвил. 5% B; 5% - 95% B впродовж 1,30 хвил., 0,25 хвил. 95% B Спосіб 2minLC_v003 Колонка Waters BEH C18 502,1 мм, 1,7 мкм Температура колонки 50C Елюенти A: H2О, B: ацетонітрил, обидва містять 0,1% TFA Швидкість потоку 0,8 мл/хвил. Градієнт 0,20 хвил. 5% B; 5% - 95% B впродовж 1,30 хвил., 0,25 хвил. 95% B Спосіб 10minLC_v002 Колонка Waters BEH C18 502,1 мм, 1,7 мкм Температура колонки 50C Елюенти A: H2О, B: метанол, обидва містять 0,1% TFA Швидкість потоку 0,8 мл/хвил. Градієнт 0,20 хвил. 5% B; 5% - 95% B впродовж 7,80 хвил., 1,00 хвил. 95% B Спосіб 10minLC_v003 колонка Waters BEH C18 502,1 мм, 1,7 мкм Температура колонки 50C Елюенти A: H2О, B: ацетонітрил, обидва містять 0,1% TFA Швидкість потоку 0,8 мл/хвил. Градієнт 0,20 хвил. 5% B; 5% - 95% B впродовж 7,80 хвил., 1,00 хвил. 95% B Спосіб (i) Колонка Agilent Zorbax SB-C18 (Rapid resolution) 302,1 мм, 3,5 мкм Температура колонки 30C Елюенти B: H2О, C: ацетонітрил, обидва містять 0,1% мурашину кислоту Швидкість потоку 0,8 мл/хвил. Градієнт 1 хвил. 5% C; 5% - 95% C впродовж 5 хвил., 3,00 хвил. 95% C Спосіб (ii) Колонка SB-C18 504,6 мм, 1,8 мкм Температура колонки 30C 25 UA 111595 C2 5 10 15 20 25 30 35 40 45 Елюенти A: H2О, B: ацетонітрил, обидва містять 0,1% мурашину кислоту Швидкість потоку 1 мл/хвил. Градієнт 1 хвил. 2% B; 2% - 70% B впродовж 4 хвил., 70% - 90% B впродовж 0,1 хвил., 4,9 хвил. 95%B. Приклади сполук даного винаходу включають: Одержання цільових сполук Приклад 1.0 Сукцинатна сіль дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти Стадія 1: дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}-бензол-сульфоніламіно)пропіонової кислоти Зазначену у заголовку сполуку можна отримати або за способом A, або B. Спосіб A: До перемішуваного розчину 3-(2-дипропілкарбамоїл-метоксикарбонілетилсульфамоїл)бензойної кислоти (Проміжна сполука AA) (7,0 г, 16,89 ммоль) у DMF при кімнатній температурі додавали гідрохлорид [1,3,8-триазаспіро[4,5]дец-(2E)-иліден]амід 3,5-діаміно-6хлорпіразин-2-карбонової кислоти (WO 09074575, приклад 38, стор.123) (8,20 г, 16,89 ммоль) з наступним додаванням N-метилморфоліну (7,43 мл, 67,6 ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж 10 хвил. та обробляли HATU (6,42 г, 16,89 ммоль) однією порцією. Суміш перемішували при кімнатній температурі впродовж додаткових 10 хвил., та потім реакцію припиняли додаванням льодяної води (500 мл). Отриманий у результаті твердий залишок збирали фільтрацією та розчиняли у DCM. Розчин промивали водою (1500 мл), сушили (MgSO4) та концентрували у вакуумі, отримуючи неочищене помаранчеве масло. Очищення хроматографією на діоксиді кремнію, елююючи DCM/iPA (2% TEA), забезпечувало одержання зазначеної у заголовку сполуки у вигляді гексафторфосфатної + солі; РХ-MС Rt 3,72 хвил.; 721,5 [M+H] , спосіб 10minLC_v003; 1 Н ЯМР (400 МГц, ДМCO-d6) 8,52 (1H, розшир. c), 8,35 (1H, розшир. c), 7,88 (2H, дт), 7,77 (1H, c), 7,72-7,65 (2H, м), 6,72 (2H, розшир. c), 4,73 (2H, c), 3,80 (1H, розшир. c), 3,61 (1H, розшир. c), 3,43 (3H, розшир. c), 3,17-3,09 (4H, м), 3,04 (2H, т), 2,53 (2H, під ДМCO), 1,78 (2H, розшир. с), 1,69 (2H, розшир. c), 1,56-1,38 (4H, м), 0,84 (3H, т), 0,78 (3H, т). Спосіб B: До перемішуваного розчину 3-(2-дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойної кислоти (Проміжна сполука AA) (6,1 г, 12,60 ммоль) у THF (50 мл) додавали послідовно воду (25 мл), N-метилморфолін (7 мл, 63 ммоль) та HOBt гідрат (2,9 г, 18,9 ммоль). Температуру всередині колби підтримували 20C. Додавали гідрохлорид [1,3,8триазаспіро[4,5]дец-(2E)-иліден]аміду 3,5-діаміно-6-хлорпіразин-2-карбонової кислоти (WO 09074575, приклад 38, сторінка 123) (65% чистота, 6,3 г, 12,6 ммоль) та перемішували до утворення прозорого розчину. Додавали EDCI·HCl (3,6 г, 18,9 ммоль), та реакційну суміш перемішували при кімнатній температурі впродовж 24 годин. Додавали до реакційної суміші 2MeTHF (200 мл) та 2% водний Na2CO3 (150 мл). Шари розділяли та водну фазу промивали додатковим 2-MeTHF (100 мл). Об’єднані органічні фази промивали 2% водним Na2CO3 (200 мл) та водою (2200 мл). Додавали ацетонітрил (100 мл), та розчин концентрували при 30C до об’єму 70 мл. Додавали ацетонітрил (300 мл), та розчин знову концентрували при 30C до об’єму 150 мл. Розчин нагрівали до 50C та додавали до отриманого у результаті розчину 26 UA 111595 C2 5 10 15 20 25 30 35 40 45 50 55 малеїнову кислоту (1,62 г). Відразу утворювався не зовсім білий осад, температуру знижували до кімнатної впродовж 1 години. Твердий залишок збирали фільтрацією, отримуючи дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти у вигляді малеатної солі; додавали DCM (200 мл) та 2% водний Na 2CO3 (200 мл), та перемішували до повного розчинення твердого залишку. Органічний шар відділяли, промивали водою (2100 мл) + та концентрували у вакуумі, отримуючи зазначену у заголовку сполуку. РХ-MС 722,1 [M+H] , 1 спосіб (i); Н ЯМР (400 МГц, ДМCO-d6) 9,12-7,57 (4H, розшир. ), 7,88 (1H, м), 7,77 (1H, м), 7,70 (1H, м), 7,68 (1H, м), 7,05-6,50 (2H, розшир. c), 6,95-6,20 (1H, розшир. c), 4,73 (2H, c), 3,81-3,39 (2H, м), 3,61-3,31 (2H, м), 3,43 (2H, розшир. c), 3,15-3,11 (4H, м), 3,04 (2H, т), 2,51 (2H, т), 1,791,69 (м, 4H), 1,51-1,43 (4H, м), 0,84 (3H, т), 0,78 (3H, т). Стадія 2: сукцинатна сіль дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти Зазначену у заголовку сполуку можна отримати або за способом C, або D. Спосіб C: Бурштинову кислоту (409 мг, 3,47 ммоль) додавали до розчину дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти (стадія 1, спосіб B) (2,50 г, 3,47 ммоль) у ацетонітрилі (25 мл) та воді (1,5 мл) при 50C. Отриманий у результаті прозорий розчин охолоджували до кімнатної температури впродовж 30 хвил. Кристалізація починалася при температурі всередині колби ~30C. Отриману у результаті суспензію перемішували при кімнатній температурі впродовж 16 годин. Кристали збирали фільтрацією, та залишок на фільтрі промивали сумішшю ацетонітрил/вода (95:5) та сушили при 50C у вакуумі, отримуючи зазначену у заголовку сполуку. Спосіб D: Суміш, що містить бурштинову кислоту (0,50 г, 4,23 ммоль) та ацетон (20 г), нагрівали до 45C до одержання прозорого розчину та потім фільтрували (0,2 мкм PTFE фільтр). У другій реакційній колбі дипропілкарбамоїлметиловий ефір 3-(3-{2-[(E)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти (стадія 1, спосіб B) (3,00 г, 4,16 ммоль) та ацетон (30 г) нагрівали до 45C до одержання прозорого розчину, та потім фільтрували (0,2 мкм PTFE фільтр). Розчин бурштинової кислоти (0,50 г, 4,23 ммоль) у ацетоні (20 мл) гріли при 45C впродовж 1 години та обробляли частиною розчину дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5діаміно-6-хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8карбоніл}бензолсульфоніламіно)-пропіонової кислоти у ацетоні (1,62 г розчину) впродовж 10 хвил. Отриману у результаті суміш обробляли суспензією зародків кристалів дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2-карбоніліміно]1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)-пропіонової кислоти (як отримано, застосовуючи спосіб C, 20 мг) у ацетоні (300 мг) та перемішували при 45C впродовж 30 хвил. Решту розчину дипропілкарбамоїлметилового ефіру 3-(3-{2-[(E)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8-триазаспіро[4,5]декан-8-карбоніл}бензолсульфоніламіно)пропіонової кислоти у ацетоні (31,38 г) додавали до суміші впродовж 5 годин, та нагрівання продовжували при 45C впродовж 1 години. Суспензію охолоджували до 25C впродовж 1 години та перемішували впродовж додаткового 1 години. Суспензію фільтрували через скляну фриту, та залишок на фільтрі промивали ацетоном (25 г). Залишок на фільтрі сушили при 1 50C, отримуючи зазначену у заголовку сполуку; HPLC Rt 4,02 хвил., спосіб ii; Н ЯМР (400 МГц, ДМCO-d6) 7,87 (1H, м), 7,78 (1H, м), 7,69 (1H, м), 7,68 (1H, м), 6,85 (2H, розшир. c), 4,73 (2H, c), 3,84-3,20 (6H та вода, розшир. максимум), 3,17-3,09 (4H, м), 3,04 (2H, т), 2,53 (2H, под ДМCO), 2,39 (4H, c), 1,80 (2H, розшир. c), 1,70 (2H, розшир. c), 1,55-1,37 (4H, м), 0,85 (3H, т), 0,78 (3H, т) (будь ласка, зверніть увагу: два обмінних сукцинатних протони та 3-4 кислих NH резонанси не спостерігались безпосередньо через дуже широку природу деяких з обмінних резонансів; температура плавлення Tm (DSC)=149C. Сполуки наступних зведених у таблицю прикладів (таблиця 1) отримували за способом, аналогічним прикладу 1.0, замінюючи 3-(2дипропілкарбамоїлметоксикарбонілетилсульфамоїл)бензойну кислоту (проміжна сполука AA) на підходящу проміжну сполуку (одержання якої описане у даному винаході раніше, або воно комерційно доступне). 27 UA 111595 C2 Таблиця 1 Приклад + Назва [M+H] /ЯМР Н ЯМР (400 МГц, ДМCO-d6) 8,67 (1H, c), 8,44 (1H, м), 7,45 (1H, м), 7,16 (2H, д), 6,88 (2H, д), 5,76 (1H, c), 4,97 (1H, c), 4,89 (1H, м), 4,81 (2H, д), 3,75 (1H, м), 3,68-3,4 (6H, м), 2,96 (1H, c), 2,83 (2H, c), 2,75 (2H, т), 2,61 (2H, т), 1,67 (4H, м). РХ-МC Rt 1,04 хвил.; + 646,5 [М+H] , спосіб 2minlC_v002. 1 Н ЯМР (400 МГц, ДМCO-d6) 8,988,27 (2H, розшир. максимум), 7,436,40 (NH2, розшир. максимум), 7,17 (2H, д), 6,86 (2H, д), 4,85 (2H, c), 4,774,71 (3H, м), 3,76-3,65 (1H, м), 3,623,57 (1H, м), 3,50-3,41 (2H, м), 3,393,33 (1H, м), 2,75 (2H, т), 2,59 (2H, т), 1,79-1,74 (2H, м), 1,71-1,59 (6H, м), 1,51-1,19 (7H, м). РХ-МC Rt 1,31 + хвил.; 671,3/673,3 [М+H] , спосіб 2minlC_v002. 1 Н ЯМР (400 МГц, ДМCO-d6) 8,52 (NH, розшир. c), 8,35 (NH, розшир. с), 7,88 (2H, дт), 7,77 (1H, c), 7,72-7,66 (2H, м), 6,71 (NH2, розшир. c), 4,734,67 (1H, м), 4,59 (2H, c), 3,79 (1H, розшир. с), 3,61 (1H, розшир. c), 3,43 (3H, розшир. c), 3,02 (2H, т), 2,55 (2H, т), 1,82-1,57 (8H, м), 1,47-1,17 (6H, м). + РХ-МC Rt 3,99 хвил.; 720,5 [М+H] , спосіб 10minLC_v003. 1 Н ЯМР (400 МГц, ДМCO-d6) 8,45 (2H, розшир. c), 7,16 (2H, д), 6,88 (2H, д), 6,77 (NH2, розшир. c), 4,80 (2H, c), 4,01 (2H, c), 3,71-3,62 (1H, м), 3,613,52 (1H, м), 3,45-3,35 (4H, м), 2,917 (3H, c), 2,82 (3H, c), 2,75 (2H, т), 2,59 (2H, т), 1,68-1,54 (4H, м). РХ-МC Rt + 3,07 хвил.; 616,4/618,4 [М+H] , спосіб 10minLC_v002. 1 1.1 [(2-гідроксиетил)метилкарбамоїл]метиловий ефір [4-(3-{2-[(Z)-3,5-діаміно-6хлорпіразин-2-карбоніліміно]-1,3,8триазаспіро[4,5]дец-8-ил}-3оксопропіл)фенокси]оцтової кислоти 1.2 циклогексилоксикарбонілметиловий ефір [4-(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8ил}-3-оксопропіл)фенокси]оцтової кислоти 1.3 циклогексилоксикарбонілметиловий ефір 3(3-{2-[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]декан8-карбоніл}-бензолсульфоніламіно)пропіонової кислоти 1.4 диметилкарбамоїлметиловий ефір [4-(3-{2[(E)-3,5-діаміно-6-хлорпіразин-2карбоніліміно]-1,3,8-триазаспіро[4,5]дец-8ил}-3-оксопропіл)фенокси]оцтової кислоти) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazine derivatives as enak bolckers
Автори англійськоюBhalay, Gurdip, Edwards, Lee, Howsham, Catherine, Hunt, Peter, Smith, Nichola
Автори російськоюБхэлэй Гурдип, Эдвардс Ли, Хоушем Кетрин, Хант Питер, Смит Никола
МПК / Мітки
МПК: C07D 241/26, C07D 487/10, A61K 31/497, A61P 11/00, C07D 403/12
Мітки: похідні, блокатори, піразинові
Код посилання
<a href="https://ua.patents.su/52-111595-pirazinovi-pokhidni-yak-enac-blokatori.html" target="_blank" rel="follow" title="База патентів України">Піразинові похідні як enac блокатори</a>
Попередній патент: Гетероциклічна сполука і її застосування
Наступний патент: Пірометалургійна установка
Випадковий патент: Спосіб одночасного оцукрювання і ферментації












