Послідовність днк, що кодує поліпептид, який має активність білка g1 і який здатний зв’язуватись або взаємодіяти прямо або опосередковано з mort-1 і/або з будь-якими білками, що зв’язуються з mort-1, і здатний
Номер патенту: 74529
Опубліковано: 16.01.2006
Автори: Варфоломєєв Євгєній, Гольцев Юра, Бродянскій Вадім, Ковалєнко Андрєй, Валлах Девід
Формула / Реферат
1. Послідовність ДНК, яка кодує поліпептид, що має активність білка G1, при тому, що зазначений поліпептид:
(і) здатний зв'язуватися або взаємодіяти прямо або опосередковано з MORT-1 і/або з будь-якими білками, що зв’язуються з MORT-1, або з іншими внутрішньоклітинними білками-медіаторами/модуляторами; і
(іі) здатний опосередковувати внутрішньоклітинний вплив, опосередкований FAS-R або p55-TNF-R, aбo інших цитотоксичних медіаторів чи індукторів;
при тому, що зазначена послідовність ДНК вибрана з групи, що включає:
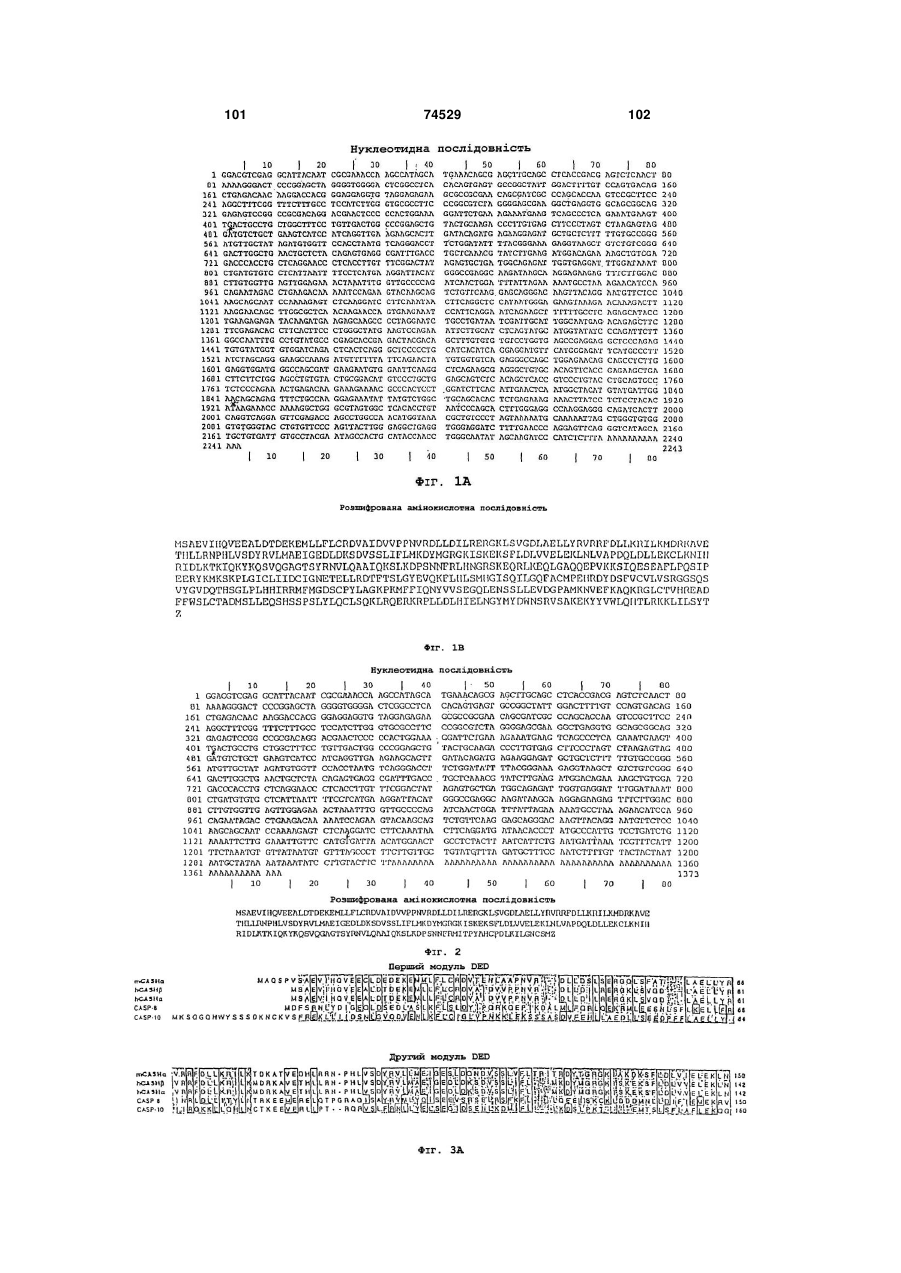
(a) послідовність ДНК, що кодує ізоформу G1, що має амінокислотну послідовність, наведену у Фіг.1;
(b) послідовність ДНК, що кодує ізоформу G1, що має амінокислотну послідовність, наведену у Фіг.2;
(c) послідовність ДНК, що кодує принаймні частину поліпептиду, що має амінокислотну послідовність, наведену у Фіг.1 або Фіг.2;
(d) послідовність ДНК, що включає принаймні частину послідовності, наведеної у Фіг.1, і кодує принаймні одну ізоформу білка G1 - ізоформу G1![]() ;
;
(e) послідовність ДНК, що включає принаймні частину послідовності, наведеної у Фіг.2 і кодує принаймні одну ізоформу білка G1 - ізоформу G1![]() ;
;
(f) послідовність ДНК, похідну від сегмента, що кодує нативну ізоформу білка G1;
(g) послідовність ДНК, що кодує фрагмент, аналог або похідну поліпептиду, що кодується послідовністю ДНК за будь-яким з (a)-(f);
(h) послідовність ДНК, здатну гібридизуватися з послідовністю за будь-яким з (а)-(g) в умовах середньої жорсткості та яка кодує біологічно активну ізоформу білка G1; і
(і) послідовність ДНК, яка є виродженою згідно з генетичним кодом відносно до послідовностей ДНК, за будь-яким з (a)-(h), і яка кодує біологічно активну ізоформу білка G1.
2. Послідовність ДНК за п.1, що використовується для приготування фармацевтичної композиції для модуляції впливу на клітини ліганду FAS-R або TNF чи інших білків для лікування септичного шоку, відторгнення трансплантата, гострого гепатиту, діабету, розсіяного склерозу або СНІДу.
3. Вектор, що включає послідовність ДНК за п.1.
4. Вектор за п. 3, здатний експресуватися в еукаріотичній або в прокаріотичній клітині-хазяїні.
5. Вектор за пп. 3 або 4, що являє собою рекомбінантний вектор на основі вірусу тварини, що містить послідовність ДНК, яка кодує поверхневий вірусний білок (ліганд), здатний зв'язуватися зі специфічним поверхнево-клітинним рецептором, що несе FAS-R або p55-R і другу послідовність, що включає послідовність ДНК за п. 1.
6. Вектор за п. 5, який відрізняється тим, що поверхнево-клітинний рецептор є специфічним відносно до пухлинних клітин, ВІЛ-інфікованих клітин або інших хворих клітин.
7. Вектор за п. 5, що використовується для приготування фармацевтичної композиції для модуляції впливу на клітини ліганду FAS-R або TNF або інших білків для лікування септичного шоку, відторгнення трансплантата, гострого гепатиту, діабету, розсіяного склерозу або СНІДу.
8. Вектор за п. 6, що використовується для приготування фармацевтичної композиції для лікування пухлин, СНІДу або інших захворювань, що проявляються у виробленні специфічних поверхнево-клітинних рецепторів.
9. Клітина-хазяїн, що несе вектор за будь-яким з пп. 3-6, яка є еукаріотичною або прокаріотичною.
10. Спосіб одержання поліпептиду, який має активність білка G1, що включає вирощування трансформованої клітини-хазяїна за п. 9 в умовах, придатних для експресії зазначеного поліпептиду, забезпечення посттрансляційних модифікацій, якщо вони необхідні, для одержання зазначеного поліпептиду і виділення зазначеного поліпептиду.
11. Поліпептид, що має активність білка G1, при тому, що зазначений поліпептид:
(і) здатний зв'язуватися або взаємодіяти прямо або опосередковано з MORT-1 і/або з будь-якими білками, що зв’язуються з MORT-1, або з іншими внутрішньоклітинними білками-медіаторами/модуляторами; і
(іі) здатний опосередковувати внутрішньоклітинний вплив, опосередкований FAS-R або p55-TNF-R, aбo інших цитотоксичних медіаторів чи індукторів;
при тому, що зазначена послідовність ДНК вибрана з групи, що включає:
(a) послідовність ДНК, що кодує ізоформу G1, що має амінокислотну послідовність, наведену у Фіг.1;
(b) послідовність ДНК, що кодує ізоформу G1, що має амінокислотну послідовність, наведену у Фіг.2;
(c) послідовність ДНК, що кодує принаймні частину поліпептиду, що має амінокислотну послідовність, наведену у Фіг.1 або Фіг.2;
(d) послідовність ДНК, що включає принаймні частину послідовності, наведеної у Фіг.1 і яка кодує принаймні одну ізоформу білка G1 - ізоформу G1![]() ;
;
(e) послідовність ДНК, що включає принаймні частину послідовності, наведеної у Фіг.2 і яка кодує принаймні одну ізоформу білка G1 - ізоформу G1![]() ;
;
(f) послідовність ДНК, похідну від сегмента, що кодує нативну ізоформу білка G1;
(g) послідовність ДНК, що кодує фрагмент, аналог або похідну поліпептиду, що кодується послідовністю ДНК за будь-яким з (a)-(f);
(h) послідовність ДНК, здатну гібридизуватися з послідовністю за будь-яким з (а)-(g) в умовах середньої жорсткості та яка кодує біологічно активну ізоформу білка G1; і
(і) послідовність ДНК, яка є виродженою згідно з генетичним кодом відносно до послідовностей ДНК, за будь-яким з (a)-(h), і яка кодує біологічно активну ізоформу білка G1,
або одержаний у спосіб за п.10.
12. Поліпептид за п. 11, що використовується для приготування фармацевтичної композиції для модуляції впливу на клітини ліганду FAS-R чи TNF або інших білків для лікування септичного шоку, відторгнення трансплантата, гострого гепатиту, діабету, розсіяного склерозу або СНІДу.
13. Антитіло, специфічне відносно до поліпептиду за п. 11.
14. Антитіло за п. 13, що використовується для приготування фармацевтичної композиції для модуляції впливу на клітини ліганду FAS-R або TNF або інших білків для лікування септичного шоку, відторгнення трансплантата, гострого гепатиту, діабету, розсіяного склерозу або СНІДу.
15. Спосіб модулювання загибелі клітин або запальних процесів in vitro, що включає обробку зазначених клітин одним або більшою кількістю поліпептидів за п. 11, при тому, що зазначена обробка вказаних клітин включає введення всередину вказаних клітин зазначеного одного чи більшої кількості поліпептидів у формі, придатній для їх внутрішньоклітинного введення або введення всередину зазначених клітин послідовності ДНК за п.1 у формі придатного вектора, що містить зазначену послідовність, при тому, що зазначений вектор здатний забезпечувати введення зазначеної послідовності всередину вказаних клітин таким чином, що зазначена послідовність експресується у зазначених клітинах.
16. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro, який включає обробку зазначених клітин одним чи більшою кількістю поліпептидів за п. 11, при тому, що зазначена обробка зазначених клітин включає введення всередину зазначених клітин вказаних одного чи більшої кількості поліпептидів у формі, придатній для їх внутрішньоклітинного введення або введення всередину зазначених клітин послідовності ДНК за п. 1, що кодує зазначені один чи більшу кількість поліпептидів у формі придатного вектора, що містить зазначену послідовність, при тому, що зазначений вектор здатний забезпечувати введення зазначеної послідовності всередину зазначених клітин таким чином, що зазначена послідовність експресується у зазначених клітинах.
17. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro за п. 16, який відрізняється тим, що зазначена обробка клітин включає введення всередину зазначених клітин одного із зазначених поліпептидів, послідовності ДНК, що кодує один з значених поліпептидів у формі придатного вектора, що містить зазначену послідовність, при тому, що зазначений вектор здатний забезпечувати введення зазначеної послідовності всередину зазначених клітин таким чином, що зазначена послідовність експресується у зазначених клітинах.
18. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro за пп. 16 або 17, який відрізняється тим, що зазначена обробка зазначених клітин здійснюється шляхом трансфекції зазначених клітин рекомбінантним вектором на основі вірусу тварини за п. 5.
19. Спосіб модулювання загибелі клітин або запальних процесів in vitro, що включає обробку зазначених клітин одним або більшою кількістю інгібіторів одного або більше кількості білків/ферментів, що опосередковують зазначену загибель клітин або запальні процеси, при тому, що зазначені інгібітори вибирають з групи, що включає:
(і) один або більшу кількість поліпептидів за п. 11, що здатні пригнічувати зазначені клітинну загибель або запальні процеси; і
(іі) інгібітори одного або більшої кількості поліпептидів за п. 11, коли зазначені один або більша кількість поліпептидів підсилюють/обумовлюють або опосередковують зазначені клітинну загибель або запальні процеси.
20. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro, який включає обробку зазначених клітин антитілом за п. 13, при тому, що зазначена обробка проводиться з використанням придатної композиції, що включає зазначене антитіло відносно до зазначених клітин, при тому, що, коли білок G1 чи його частини експозиційовані на зовнішній поверхні зазначених клітин, зазначена композиція створюється для позаклітинного застосування, а коли зазначені білки G1 є внутрішньоклітинними, то зазначена композиція створюється для внутрішньоклітинного застосування.
21. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro, що включає обробку зазначених клітин олігонуклеотидною послідовністю, що кодує антисмислову послідовність відносно до принаймні частини послідовності ДНК, за п.1, при тому, що зазначена олігонуклеотидна послідовність здатна блокувати експресію білка G1.
22. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини, що містять FAS-R або p55-R, in vitro за п. 21, який відрізняється тим, що зазначена олігонуклеотидна послідовність вводиться у зазначені клітини за допомогою вектора за п.5, при тому, що зазначена друга послідовність зазначеного вірусу кодує зазначену олігонуклеотидну послідовність.
23. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини in vitro, який включає застосування рибозимної процедури, при якій вектор, що кодує рибозимну послідовність, здатну взаємодіяти з послідовністю клітинної мРНК, що кодує поліпептид за п.11, вводять всередину зазначених клітин у формі, що забезпечує експресію зазначеної рибозимної послідовності у зазначених клітинах, і при тому, що, коли зазначена рибозимна послідовність експресується у зазначених клітинах, то вона взаємодіє з зазначеною послідовністю клітинної мРНК і розщеплює зазначену послідовність мРНК, що призводить до інгібування експресії зазначеного поліпептиду у зазначених клітинах.
24. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини in vitro за будь-яким з пп. 16-18, 20-23, який відрізняється тим, що зазначений поліпептид здатний зв'язуватися прямо або опосередковано з MORT-1 і/або з будь-якими білками, що зв’язуються з MORT-1, при тому, що MORT-1, в свою чергу, специфічно зв'язується з FAS-ІС, або які здатні зв'язуватися прямо або опосередковано з MORT-1, і/або з будь-якими білками, що зв’язуються з MORT-1, при тому, що MORT-1, в свою чергу, зв'язується TRADD, який, в свою чергу, зв'язується з р55-1С.
25. Спосіб модулювання загибелі клітин або запальних процесів in vitro за будь-яким з пп. 15 або 19, який відрізняється тим, що зазначений поліпептид здатний зв'язуватися прямо або опосередковано з MORT-1 і/або з будь-якими білками, що зв’язуються з MORT-1, при тому, що MORT-1, в свою чергу, специфічно зв'язується з FAS-ІС, або, які здатні зв'язуватися прямо або опосередковано з MORT-1, і/або з будь-якими білками, що зв’язуються з MORT-1, при тому, що MORT-1, в свою чергу, зв'язується TRADD, який, в свою чергу, зв'язується з р55-1С.
26. Спосіб виділення й ідентифікації поліпептиду за п.11, який включає застосування дигібридного дріжджового методу, в якому послідовність, що кодує зазначений білок MORT-1 і/або білок, що зв’язується з MORT-1, знаходиться в складі одного гібридного вектора, а послідовність з кДНК або з геномної бібліотеки ДНК знаходиться у складі другого гібридного вектора, при тому, що вектори потім використовують для трансформації дріжджових клітин-хазяїнів, і позитивно трансформовані клітини виділяють шляхом наступної екстракції зазначеного другого гібридного вектора з метою одержання послідовності, що кодує білок, що зв'язується з зазначеним білком MORT-1 і/або з білками, що зв’язують MORT-1.
27. Спосіб модулювання впливу ліганду FAS-R або TNF на клітини in vitro за будь-яким з пп. 16-18, 20-23, який відрізняється тим, що зазначений поліпептид є принаймні однією з ізоформ G1, одним з його аналогів, фрагментом або похідною.
28. Спосіб модулювання загибелі клітин або запальних процесів in vitro за будь-яким з пп. 15 або 19, який відрізняється тим, що зазначений поліпептид є принаймні однією з ізоформ G1, одним з його аналогів, фрагментом або похідною.
29.Спосіб виділення й ідентифікації поліпептиду за п. 26, який відрізняється тим, що зазначений поліпептид є принаймні однією з ізоформ G1, одним з його аналогів, фрагментом або похідною.
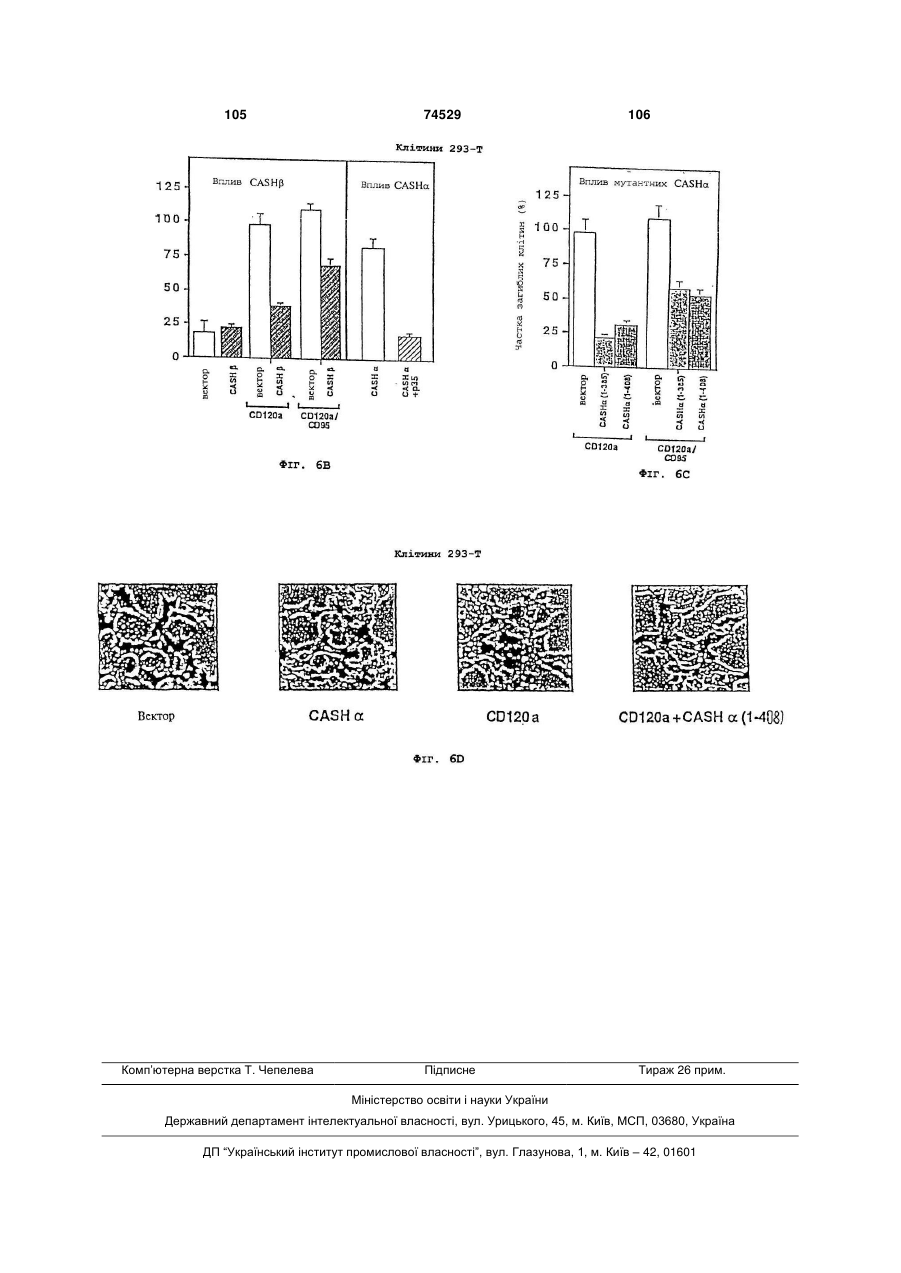
30. Спосіб модулювання індуковуваного MORT-1 впливу або впливу білка, що зв’язується з MORT-1, або індуковуваного іншими білками впливу на клітини in vitro, який включає обробку зазначених клітин у спосіб за будь-яким з пп. 15-29 послідовністю ДНК за п. 1 або поліпептидом за п. 11, при тому, що зазначена обробка призводить до посилення або пригнічення зазначеного впливу, опосередковуваного MORT-1 або білком, що зв’язується з MORT-1, або іншого впливу, опосередковуваного білками і тим самим також впливу FAS-R або p55-R або інших цитотоксичних медіаторів або індукторів, що опосередковують цей вплив.
31. Спосіб модулювання індуковуваного MORT-1 впливу або впливу білка, що зв’язується з MORT-1, або індуковуваного іншими білками впливу на клітини in vitro за п. 30, який відрізняється тим, що зазначений поліпептид є тією частиною поліпептиду, яка специфічно залучена у зв'язування з MORT-1 або з білком, що зв’язується з MORT-1, або з іншим білком.
32. Спосіб модулювання індуковуваного MORT-1 впливу або впливу білка, що зв’язується з MORT-1, або індуковуваного іншими білками впливу на клітини in vitro за пп. 30 або 31, який відрізняється тим, що зазначений поліпептид є будь-якою з ізоформ G1, здатною підсилювати вплив, обумовлений MORT-1, або білком, що зв’язується з MORT-1, або інший вплив на клітини, зв'язаний з білками, і тим самим вплив FAS-R або p55-R або інших цитотоксичних медіаторів або індукторів, що впливають на клітини.
33. Спосіб модулювання апоптотичних процесів або процесів запрограмованої загибелі клітин in vitro, який включає обробку зазначених клітин одним чи більшою кількістю поліпептидів за п. 11, при тому, що зазначена обробка зазначених клітин включає введення всередину зазначених клітин зазначених одного чи більшої кількості поліпептидів у формі, придатній для їх внутрішньоклітинного введення або введення всередину зазначених клітин послідовності ДНК за п. 1 у формі придатного вектора, що містить зазначену послідовність, при тому, що зазначений вектор здатний забезпечувати введення зазначеної послідовності всередину зазначених клітин таким чином, що зазначена послідовність експресується в зазначених клітинах.
34. Спосіб скринінгу ліганду, здатного зв'язуватися з поліпептидом за п. 11, який включає контактування афінного хроматографічного матрикса, до якого приєднаний зазначений поліпептид, із клітинним екстрактом так, що ліганд зв'язується зі зазначеним матриксом, з наступною елюцією, виділенням і аналізом зазначеного ліганду.
35. Спосіб скринінгу послідовності ДНК, що кодує ліганд, здатний зв'язуватися з поліпептидом за п. 11, який включає застосування дигібридного дріжджового методу, в якому послідовність ДНК, що кодує зазначений поліпептид, входить до складу одного гібридного вектора, а послідовності з кДНК або з геномної бібліотеки ДНК входять до складу другого гібридного вектора, трансформація зазначеними векторами зазначених дріжджових клітин-хазяїв, виділення позитивно трансформованих клітин і екстракція зазначеного другого гібридного вектора з метою одержання послідовності ДНК, що кодує зазначений ліганд.
36. Спосіб ідентифікації й одержання ліганду, здатного модулювати клітинну активність, що модульована/опосередкована MORT-1 або білками, що зв’язуються з MORT-1, який включає:
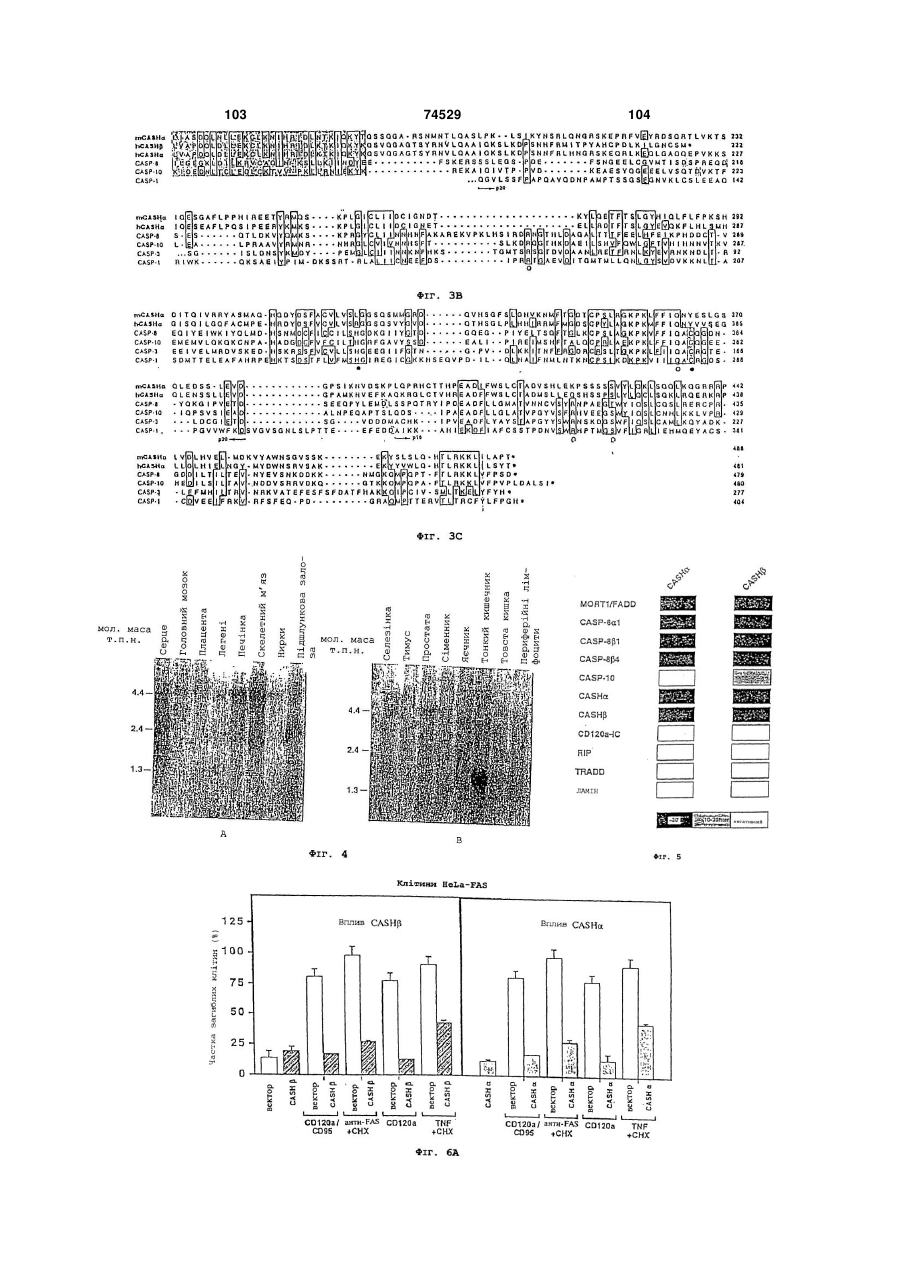
(a) скринінг ліганду, здатного зв'язуватися з поліпептидом, що включає принаймні частину MORT-1 або білків, що зв’язуються з MORT-1, що вибираються з білків МАСН, білків Mch4 і інших білків, що зв’язуються з MORT-1;
(b) ідентифікацію та охарактеризування ліганду, іншого, ніж MORT-1, або зазначених білків, що зв’язуються з MORT-1, або частин рецептора із сімейства рецепторів TNF/NGF, виявленого при проведенні зазначеного скринінгу по здатності до зазначеного зв'язування; і
(c) одержання зазначеного ліганду в, по суті, виділеній і очищеній формі.
37. Спосіб ідентифікації і одержання ліганду, здатного модулювати клітинну активність, що модулюється або опосередковується поліпептидом за п. 11, який включає:
(a) скринінг ліганду, здатного зв'язуватися з поліпептидом, що включає поліпептид, який кодується послідовністю ДНК за будь-яким з (а)-(с) за п.1;
(b) ідентифікацію й охарактеризування ліганду, іншого, ніж MORT-1, або білків, що зв’язуються з MORT-1, або частин рецептора з сімейства рецепторів TNF/NGF, виявлених при зазначеному скринінгу по здатності до зазначеного зв'язування; і
(с) одержання зазначеного ліганду в, по суті, виділеній і очищеній формі.
38. Спосіб ідентифікації і одержання ліганду, здатного модулювати клітинну активність, що модулюється/опосередковується білком G1, що включає:
(a) скринінг ліганду, здатного зв'язуватися з поліпептидом, що включає поліпептид, який кодується послідовністю ДНК за будь-яким з (а)-(с) за п.1;
(b) ідентифікацію й охарактеризування ліганду, іншого, ніж MORT-1 або білків, що зв’язуються з MORT-1, або частин рецептора з сімейства рецепторів TNF/NGF, виявлених при зазначеному скринінгу по здатності до зазначеного зв'язування; і
(c) одержання зазначеного ліганду в, по суті, виділеній і очищеній формі.
39. Спосіб ідентифікації і одержання молекули, здатної прямо або опосередковано модулювати клітинну активність, що модулюється/опосередковується білком G1, який включає:
(a) скринінг молекули, здатної модулювати активності, що модулюються/опосередковуються білком G1;
(b) ідентифікацію й охарактеризування зазначеної молекули; і
(c) одержання зазначеної молекули в, по суті, виділеній і очищеній формі.
40. Спосіб ідентифікації і одержання молекули, здатної прямо або опосередковано модулювати клітинну активність, що модулюється/опосередковується поліпептидом за п. 11, який включає:
(a) скринінг молекули, здатної модулювати активності, що модулюються/опосередковуються поліпептидом за п. 11;
(b) ідентифікацію й охарактеризування зазначеної молекули; і
(c) одержання зазначеної молекули в, по суті, виділеній і очищеній формі.
41. Фармацевтична композиція, що включає як активний інгредієнт речовину, вибрану з групи, яка складається з послідовності ДНК за п. 1, вектора за пп. 5 чи 6, поліпептиду за п. 11, або антитіла за п. 13 і, необов'язково, фармацевтично придатного носія.
42. Діагностична композиція, що включає антитіло за п. 13.
Текст
1. Послідовність ДНК, яка кодує поліпептид, що має активність білка G1, при тому, що зазначений поліпептид: (і) здатний зв'язуватися або взаємодіяти прямо або опосередковано з MORT-1 і/або з будь-якими білками, що зв’язуються з MORT-1, або з іншими внутрішньоклітинними білкамимедіаторами/модуляторами; і (іі) здатний опосередковувати внутрішньоклітинний вплив, опосередкований FAS-R або p55-TNFR, aбo інших цитотоксичних медіаторів чи індукторів; при тому, що зазначена послідовність ДНК вибра UA (21) 99105391 (22) 26.02.1998 (24) 16.01.2006 (86) PCT/IL98/00098, 26.02.1998 (31) 120367 (32) 03.03.1997 (33) IL (31) 120759 (32) 01.05.1997 (33) IL (46) 16.01.2006, Бюл. № 1, 2006 р. (72) Валлах Девід , IL, Гольцев Юра , RU, Ковалєнко Андрєй , RU, Варфоломєєв Євгєній , RU, Бродянскій Вадім , RU (73) ЙЄДА РІСЕРЧ ЕНД ДІВЕЛОПМЕНТ КО. ЛТД., IL (56) DATABASE EMBL NUCLEOTIDE ebi, Hinston, UK AC N №94588, EST, Homosapiens, 1996 HILLIER J.: "The WashU Merck EST Project" XP002071906. DATABASE EMBL NUCLEOTIDE EBI, Hinxton, UK AC N №AA149562, EST, Homo sapiens, 15 December 1996 HILLIER, J.: "The WashU Merck EST Project" XPOO2071907. DATABASE EMBL NUCLEOTIDE EBI, Hinxton, UK AC № C05730, EST, Homo sapiens, 1996 TADEKA, J.: "Human pancreatic islet cDNA" XP002071908. CHINNALYAN A. M. ET AL.: "THE CELL-DEATH MACHINE", CURRENT BIOLOGY, vol. 6, no. 5, 1 May 1996, pages 555-562, XP002063885. GOLTSEV Y.V. ET AL.: "CASH, a novel caspase homologue with death effector domains", J.BIOL. 2 (19) 1 3 74529 4 на з групи, що включає: поліпептиду і виділення зазначеного поліпептиду. (a) послідовність ДНК, що кодує ізоформу G1, що 11. Поліпептид, що має активність білка G1, при має амінокислотну послідовність, наведену у Фіг.1; тому, що зазначений поліпептид: (b) послідовність ДНК, що кодує ізоформу G1, що (і) здатний зв'язуватися або взаємодіяти прямо має амінокислотну послідовність, наведену у Фіг.2; або опосередковано з MORT-1 і/або з будь-якими (c) послідовність ДНК, що кодує принаймні частину білками, що зв’язуються з MORT-1, або з іншими поліпептиду, що має амінокислотну послідовність, внутрішньоклітинними білкаминаведену у Фіг.1 або Фіг.2; медіаторами/модуляторами; і (d) послідовність ДНК, що включає принаймні час(іі) здатний опосередковувати внутрішньоклітинтину послідовності, наведеної у Фіг.1, і кодує приний вплив, опосередкований FAS-R або p55-TNFR, aбo інших цитотоксичних медіаторів чи індуктонаймні одну ізоформу білка G1 - ізоформу G1 ; рів; (e) послідовність ДНК, що включає принаймні часпри тому, що зазначена послідовність ДНК вибратину послідовності, наведеної у Фіг.2 і кодує прина з групи, що включає: наймні одну ізоформу білка G1 - ізоформу G1 ; (a) послідовність ДНК, що кодує ізоформу G1, що (f) послідовність ДНК, похідну від сегмента, що має амінокислотну послідовність, наведену у Фіг.1; кодує нативну ізоформу білка G1; (b) послідовність ДНК, що кодує ізоформу G1, що (g) послідовність ДНК, що кодує фрагмент, аналог має амінокислотну послідовність, наведену у Фіг.2; або похідну поліпептиду, що кодується послідовні(c) послідовність ДНК, що кодує принаймні частину стю ДНК за будь-яким з (a)-(f); поліпептиду, що має амінокислотну послідовність, (h) послідовність ДНК, здатну гібридизуватися з наведену у Фіг.1 або Фіг.2; послідовністю за будь-яким з (а)-(g) в умовах се(d) послідовність ДНК, що включає принаймні часредньої жорсткості та яка кодує біологічно активну тину послідовності, наведеної у Фіг.1 і яка кодує ізоформу білка G1; і принаймні одну ізоформу білка G1 - ізоформу (і) послідовність ДНК, яка є виродженою згідно з G1 ; генетичним кодом відносно до послідовностей (e) послідовність ДНК, що включає принаймні часДНК, за будь-яким з (a)-(h), і яка кодує біологічно тину послідовності, наведеної у Фіг.2 і яка кодує активну ізоформу білка G1. принаймні одну ізоформу білка G1 - ізоформу 2. Послідовність ДНК за п.1, що використовується G1 ; для приготування фармацевтичної композиції для модуляції впливу на клітини ліганду FAS-R або (f) послідовність ДНК, похідну від сегмента, що TNF чи інших білків для лікування септичного шокодує нативну ізоформу білка G1; ку, відторгнення трансплантата, гострого гепатиту, (g) послідовність ДНК, що кодує фрагмент, аналог діабету, розсіяного склерозу або СНІДу. або похідну поліпептиду, що кодується послідовні3. Вектор, що включає послідовність ДНК за п.1. стю ДНК за будь-яким з (a)-(f); 4. Вектор за п.3, здатний експресуватися в еукарі(h) послідовність ДНК, здатну гібридизуватися з отичній або в прокаріотичній клітині-хазяїні. послідовністю за будь-яким з (а)-(g) в умовах се5. Вектор за пп.3 або 4, що являє собою рекомбіредньої жорсткості та яка кодує біологічно активну нантний вектор на основі вірусу тварини, що місізоформу білка G1; і тить послідовність ДНК, яка кодує поверхневий (і) послідовність ДНК, яка є виродженою згідно з вірусний білок (ліганд), здатний зв'язуватися зі генетичним кодом відносно до послідовностей специфічним поверхнево-клітинним рецептором, ДНК, за будь-яким з (a)-(h), і яка кодує біологічно що несе FAS-R або p55-R і другу послідовність, що активну ізоформу білка G1, включає послідовність ДНК за п.1. або одержаний у спосіб за п.10. 6. Вектор за п.5, який відрізняється тим, що по12. Поліпептид за п.11, що використовується для верхнево-клітинний рецептор є специфічним відприготування фармацевтичної композиції для моносно до пухлинних клітин, ВІЛ-інфікованих клітин дуляції впливу на клітини ліганду FAS-R чи TNF або інших хворих клітин. або інших білків для лікування септичного шоку, 7. Вектор за п.5, що використовується для приговідторгнення трансплантата, гострого гепатиту, тування фармацевтичної композиції для модуляції діабету, розсіяного склерозу або СНІДу. впливу на клітини ліганду FAS-R або TNF або ін13. Антитіло, специфічне відносно до поліпептиду ших білків для лікування септичного шоку, відторгза п.11. нення трансплантата, гострого гепатиту, діабету, 14. Антитіло за п.13, що використовується для розсіяного склерозу або СНІДу. приготування фармацевтичної композиції для мо8. Вектор за п.6, що використовується для пригодуляції впливу на клітини ліганду FAS-R або TNF тування фармацевтичної композиції для лікування або інших білків для лікування септичного шоку, пухлин, СНІДу або інших захворювань, що прояввідторгнення трансплантата, гострого гепатиту, ляються у виробленні специфічних поверхневодіабету, розсіяного склерозу або СНІДу. клітинних рецепторів. 15. Спосіб модулювання загибелі клітин або запа9. Клітина-хазяїн, що несе вектор за будь-яким з льних процесів in vitro, що включає обробку зазнапп.3-6, яка є еукаріотичною або прокаріотичною. чених клітин одним або більшою кількістю поліпеп10. Спосіб одержання поліпептиду, який має актитидів за п.11, при тому, що зазначена обробка вність білка G1, що включає вирощування трансвказаних клітин включає введення всередину вкаформованої клітини-хазяїна за п.9 в умовах, призаних клітин зазначеного одного чи більшої кількодатних для експресії зазначеного поліпептиду, сті поліпептидів у формі, придатній для їх внутрішзабезпечення посттрансляційних модифікацій, ньоклітинного введення або введення всередину якщо вони необхідні, для одержання зазначеного зазначених клітин послідовності ДНК за п.1 у фор 5 74529 6 мі придатного вектора, що містить зазначену посрюється для позаклітинного застосування, а коли лідовність, при тому, що зазначений вектор здатзазначені білки G1 є внутрішньоклітинними, то ний забезпечувати введення зазначеної послідовзазначена композиція створюється для внутрішності всередину вказаних клітин таким чином, що ньоклітинного застосування. зазначена послідовність експресується у зазначе21. Спосіб модулювання впливу ліганду FAS-R або них клітинах. TNF на клітини, що містять FAS-R або p55-R, in 16. Спосіб модулювання впливу ліганду FAS-R або vitro, що включає обробку зазначених клітин олігоTNF на клітини, що містять FAS-R або p55-R, in нуклеотидною послідовністю, що кодує антисмисvitro, який включає обробку зазначених клітин одлову послідовність відносно до принаймні частини ним чи більшою кількістю поліпептидів за п.11, при послідовності ДНК, за п.1, при тому, що зазначена тому, що зазначена обробка зазначених клітин олігонуклеотидна послідовність здатна блокувати включає введення всередину зазначених клітин експресію білка G1. вказаних одного чи більшої кількості поліпептидів 22. Спосіб модулювання впливу ліганду FAS-R у формі, придатній для їх внутрішньоклітинного або TNF на клітини, що містять FAS-R або p55-R, in vitro за п.21, який відрізняється тим, що зазнавведення або введення всередину зазначених клітин послідовності ДНК за п.1, що кодує зазначена олігонуклеотидна послідовність вводиться у чені один чи більшу кількість поліпептидів у формі зазначені клітини за допомогою вектора за п.5, при придатного вектора, що містить зазначену послітому, що зазначена друга послідовність зазначедовність, при тому, що зазначений вектор здатний ного вірусу кодує зазначену олігонуклеотидну посзабезпечувати введення зазначеної послідовності лідовність. всередину зазначених клітин таким чином, що за23. Спосіб модулювання впливу ліганду FAS-R або значена послідовність експресується у зазначених TNF на клітини in vitro, який включає застосування клітинах. рибозимної процедури, при якій вектор, що кодує 17. Спосіб модулювання впливу ліганду FAS-R або рибозимну послідовність, здатну взаємодіяти з TNF на клітини, що містять FAS-R або p55-R, in послідовністю клітинної мРНК, що кодує поліпепvitro за п.16, який відрізняється тим, що зазначетид за п.11, вводять всередину зазначених клітин на обробка клітин включає введення всередину у формі, що забезпечує експресію зазначеної ризазначених клітин одного із зазначених поліпептибозимної послідовності у зазначених клітинах, і дів, послідовності ДНК, що кодує один з значених при тому, що, коли зазначена рибозимна послідополіпептидів у формі придатного вектора, що місвність експресується у зазначених клітинах, то тить зазначену послідовність, при тому, що зазнавона взаємодіє з зазначеною послідовністю клічений вектор здатний забезпечувати введення тинної мРНК і розщеплює зазначену послідовність зазначеної послідовності всередину зазначених мРНК, що призводить до інгібування експресії заклітин таким чином, що зазначена послідовність значеного поліпептиду у зазначених клітинах. експресується у зазначених клітинах. 24. Спосіб модулювання впливу ліганду FAS-R або 18. Спосіб модулювання впливу ліганду FAS-R TNF на клітини in vitro за будь-яким з пп.16-18, 2023, який відрізняється тим, що зазначений поліабо TNF на клітини, що містять FAS-R або p55-R, in vitro за пп.16 або 17, який відрізняється тим, пептид здатний зв'язуватися прямо або опосередщо зазначена обробка зазначених клітин здійснюковано з MORT-1 і/або з будь-якими білками, що ється шляхом трансфекції зазначених клітин резв’язуються з MORT-1, при тому, що MORT-1, в комбінантним вектором на основі вірусу тварини свою чергу, специфічно зв'язується з FAS-ІС, або за п.5. які здатні зв'язуватися прямо або опосередковано 19. Спосіб модулювання загибелі клітин або запаз MORT-1, і/або з будь-якими білками, що льних процесів in vitro, що включає обробку зазназв’язуються з MORT-1, при тому, що MORT-1, в чених клітин одним або більшою кількістю інгібітосвою чергу, зв'язується TRADD, який, в свою черрів одного або більше кількості білків/ферментів, гу, зв'язується з р55-1С. що опосередковують зазначену загибель клітин 25. Спосіб модулювання загибелі клітин або запаабо запальні процеси, при тому, що зазначені інгільних процесів in vitro за будь-яким з пп.15 або 19, який відрізняється тим, що зазначений поліпепбітори вибирають з групи, що включає: (і) один або більшу кількість поліпептидів за п.11, тид здатний зв'язуватися прямо або опосередкощо здатні пригнічувати зазначені клітинну загивано з MORT-1 і/або з будь-якими білками, що бель або запальні процеси; і зв’язуються з MORT-1, при тому, що MORT-1, в (іі) інгібітори одного або більшої кількості поліпепсвою чергу, специфічно зв'язується з FAS-ІС, або, тидів за п.11, коли зазначені один або більша кільякі здатні зв'язуватися прямо або опосередковано кість поліпептидів підсилюють/обумовлюють або з MORT-1, і/або з будь-якими білками, що опосередковують зазначені клітинну загибель або зв’язуються з MORT-1, при тому, що MORT-1, в запальні процеси. свою чергу, зв'язується TRADD, який, в свою чер20. Спосіб модулювання впливу ліганду FAS-R або гу, зв'язується з р55-1С. TNF на клітини, що містять FAS-R або p55-R, in 26. Спосіб виділення й ідентифікації поліпептиду vitro, який включає обробку зазначених клітин анза п.11, який включає застосування дигібридного титілом за п.13, при тому, що зазначена обробка дріжджового методу, в якому послідовність, що проводиться з використанням придатної композикодує зазначений білок MORT-1 і/або білок, що ції, що включає зазначене антитіло відносно до зв’язується з MORT-1, знаходиться в складі одного зазначених клітин, при тому, що, коли білок G1 чи гібридного вектора, а послідовність з кДНК або з його частини експозиційовані на зовнішній поверхгеномної бібліотеки ДНК знаходиться у складі друні зазначених клітин, зазначена композиція ствогого гібридного вектора, при тому, що вектори по 7 74529 8 тім використовують для трансформації дріжджочувати введення зазначеної послідовності всеревих клітин-хазяїнів, і позитивно трансформовані дину зазначених клітин таким чином, що зазначеклітини виділяють шляхом наступної екстракції на послідовність експресується в зазначених клізазначеного другого гібридного вектора з метою тинах. одержання послідовності, що кодує білок, що зв'я34. Спосіб скринінгу ліганду, здатного зв'язуватися зується з зазначеним білком MORT-1 і/або з білз поліпептидом за п.11, який включає контактуванками, що зв’язують MORT-1. ня афінного хроматографічного матрикса, до якого 27. Спосіб модулювання впливу ліганду FAS-R або приєднаний зазначений поліпептид, із клітинним TNF на клітини in vitro за будь-яким з пп.16-18, 20екстрактом так, що ліганд зв'язується зі зазначе23, який відрізняється тим, що зазначений поліним матриксом, з наступною елюцією, виділенням пептид є принаймні однією з ізоформ G1, одним з і аналізом зазначеного ліганду. його аналогів, фрагментом або похідною. 35. Спосіб скринінгу послідовності ДНК, що кодує 28. Спосіб модулювання загибелі клітин або запаліганд, здатний зв'язуватися з поліпептидом за льних процесів in vitro за будь-яким з пп.15 або 19, п.11, який включає застосування дигібридного дріякий відрізняється тим, що зазначений поліпепжджового методу, в якому послідовність ДНК, що тид є принаймні однією з ізоформ G1, одним з його кодує зазначений поліпептид, входить до складу аналогів, фрагментом або похідною. одного гібридного вектора, а послідовності з кДНК 29.Спосіб виділення й ідентифікації поліпептиду за або з геномної бібліотеки ДНК входять до складу п.26, який відрізняється тим, що зазначений подругого гібридного вектора, трансформація зазналіпептид є принаймні однією з ізоформ G1, одним ченими векторами зазначених дріжджових клітинз його аналогів, фрагментом або похідною. хазяїв, виділення позитивно трансформованих 30. Спосіб модулювання індуковуваного MORT-1 клітин і екстракція зазначеного другого гібридного впливу або впливу білка, що зв’язується з MORTвектора з метою одержання послідовності ДНК, що 1, або індуковуваного іншими білками впливу на кодує зазначений ліганд. клітини in vitro, який включає обробку зазначених 36. Спосіб ідентифікації й одержання ліганду, здаклітин у спосіб за будь-яким з пп.15-29 послідовнітного модулювати клітинну активність, що модустю ДНК за п.1 або поліпептидом за п.11, при тольована/опосередкована MORT-1 або білками, що му, що зазначена обробка призводить до посизв’язуються з MORT-1, який включає: лення або пригнічення зазначеного впливу, (a) скринінг ліганду, здатного зв'язуватися з поліопосередковуваного MORT-1 або білком, що пептидом, що включає принаймні частину MORT-1 зв’язується з MORT-1, або іншого впливу, опосеабо білків, що зв’язуються з MORT-1, що вибираредковуваного білками і тим самим також впливу ються з білків МАСН, білків Mch4 і інших білків, що FAS-R або p55-R або інших цитотоксичних медіазв’язуються з MORT-1; торів або індукторів, що опосередковують цей (b) ідентифікацію та охарактеризування ліганду, вплив. іншого, ніж MORT-1, або зазначених білків, що 31. Спосіб модулювання індуковуваного MORT-1 зв’язуються з MORT-1, або частин рецептора із впливу або впливу білка, що зв’язується з MORTсімейства рецепторів TNF/NGF, виявленого при 1, або індуковуваного іншими білками впливу на проведенні зазначеного скринінгу по здатності до клітини in vitro за п.30, який відрізняється тим, зазначеного зв'язування; і що зазначений поліпептид є тією частиною полі(c) одержання зазначеного ліганду в, по суті, видіпептиду, яка специфічно залучена у зв'язування з леній і очищеній формі. MORT-1 або з білком, що зв’язується з MORT-1, 37. Спосіб ідентифікації і одержання ліганду, здатабо з іншим білком. ного модулювати клітинну активність, що модулю32. Спосіб модулювання індуковуваного MORT-1 ється або опосередковується поліпептидом за впливу або впливу білка, що зв’язується з MORTп.11, який включає: 1, або індуковуваного іншими білками впливу на (a) скринінг ліганду, здатного зв'язуватися з поліклітини in vitro за пп.30 або 31, який відрізняється пептидом, що включає поліпептид, який кодується тим, що зазначений поліпептид є будь-якою з ізопослідовністю ДНК за будь-яким з (а)-(с) за п.1; форм G1, здатною підсилювати вплив, обумовле(b) ідентифікацію й охарактеризування ліганду, ний MORT-1, або білком, що зв’язується з MORTіншого, ніж MORT-1, або білків, що зв’язуються з 1, або інший вплив на клітини, зв'язаний з білками, MORT-1, або частин рецептора з сімейства рецепі тим самим вплив FAS-R або p55-R або інших циторів TNF/NGF, виявлених при зазначеному скритотоксичних медіаторів або індукторів, що вплинінгу по здатності до зазначеного зв'язування; і вають на клітини. (с) одержання зазначеного ліганду в, по суті, виді33. Спосіб модулювання апоптотичних процесів леній і очищеній формі. або процесів запрограмованої загибелі клітин in 38. Спосіб ідентифікації і одержання ліганду, здатvitro, який включає обробку зазначених клітин одного модулювати клітинну активність, що модулюним чи більшою кількістю поліпептидів за п.11, при ється/опосередковується білком G1, що включає: тому, що зазначена обробка зазначених клітин (a) скринінг ліганду, здатного зв'язуватися з полівключає введення всередину зазначених клітин пептидом, що включає поліпептид, який кодується зазначених одного чи більшої кількості поліпептипослідовністю ДНК за будь-яким з (а)-(с) за п.1; дів у формі, придатній для їх внутрішньоклітинного (b) ідентифікацію й охарактеризування ліганду, введення або введення всередину зазначених іншого, ніж MORT-1 або білків, що зв’язуються з клітинпослідовності ДНК за п.1 у формі придатноMORT-1, або частин рецептора з сімейства рецепго вектора, що містить зазначену послідовність, торів TNF/NGF, виявлених при зазначеному скрипри тому, що зазначений вектор здатний забезпенінгу по здатності до зазначеного зв'язування; і 9 74529 10 (c) одержання зазначеного ліганду в, по суті, видіся/опосередковується поліпептидом за п.11, який леній і очищеній формі. включає: 39. Спосіб ідентифікації і одержання молекули, (a) скринінг молекули, здатної модулювати активздатної прямо або опосередковано модулювати ності, що модулюються/опосередковуються поліклітинну активність, що модулюєтьпептидом за п.11; ся/опосередковується білком G1, який включає: (b) ідентифікацію й охарактеризування зазначеної (a) скринінг молекули, здатної модулювати активмолекули; і ності, що модулюються/опосередковуються білком (c) одержання зазначеної молекули в, по суті, виG1; діленій і очищеній формі. (b) ідентифікацію й охарактеризування зазначеної 41. Фармацевтична композиція, що включає як молекули; і активний інгредієнт речовину, вибрану з групи, яка (c) одержання зазначеної молекули в, по суті, вискладається з послідовності ДНК за п.1, вектора за діленій і очищеній формі. пп.5 чи 6, поліпептиду за п.11, або антитіла за п.13 40. Спосіб ідентифікації і одержання молекули, і, необов'язково, фармацевтично придатного носія. здатної прямо або опосередковано модулювати 42. Діагностична композиція, що включає антитіло клітинну активність, що модулюєтьза п.13. Даний винахід в цілому стосується галузі науки, що вивчає рецептори, які належать до суперсімейства TNF/NGF-рецепторів, і контроль за їх біологічними функціями. Суперсімейство TNF/NGFрецепторів включає такі рецептори як рецептор факторів некрозу пухлин р55 і р75 (т. зв. "TNF-R", що також позначаються, відповідно, як CD120a і CD120b: в даному тексті вони позначатимуться як p55-R і p75-R) та рецептори FAS-лігандів (що також позначаються як FAS/APO1 чи FAS-R, або CD95, а в даному тексті вони позначатимуться як FAS-R) та інші. Конкретніше, цей винахід стосується нових білків, що зв'язуються з іншими білками, які самі зв'язуються з білком MORT-1 (або FADD): вони також називаються MORT-1-зв'язними білками, або стосується білків, які прямо зв'язуються з білком MORT-1, а конкретніше винахід стосується одного такого білка, який позначено тут як G1 (також позначається як "CASH" для "гомолога каспази", але далі буде називатися як "G1"), який зв'язується з MORT1-зв'язним білком Mch4 (що також позначається/називається як CASP-10) і, повидимому, зв'язується з іншим MORT1-зв'язним, що називається MACH (що також позначається/називається як CASP-8), і, ймовірно, сам прямо зв'язується з MORT-1. Відповідно, даний винахід, в принципі, стосується нових білків, які здатні модулювати або опосередковувати функції MORT-1 прямо чи непрямо або інших білків, що зв'язуються з MORT-1 прямо чи непрямо. Зокрема, цей винахід стосується білка G1, його одержання та його використання, а також деяких нових ізоформ G1, їх одержання та використання. Фактор некрозу пухлин (TNF- ) і лімфотоксин (TNF- ) (далі абревіатура TNF буде стосуватись і TNF-α, і TNF- ) є багатофункціональними прозапальними цитокінами, які утворюються в основному моноядерними фагоцитуючими клітинами, що справляють різноманітні ефекти на клітини [Wallach, 1986, In "Interferon 7", ed. by I.Gresser, Acad. Press, London, pp.83-122; і Beutler & Cerami, 1987). I TNF-α, і TNF- виявляють свою активність шляхом зв'язування з специфічними поверхневоклітинними рецепторами. Деякі з їх проявів, певно, є позитивними для організму: наприклад, вони можуть руйнувати пухлинні клітини або клітини, заражені вірусами, і зумовлювати протибактеріальну активність гранулоцитів. В цьому випадку TNF є факторами захисту організму проти пухлин і інфекційних агентів і беруть участь в загоєнні ран. Таким чином, TNF можуть використовуватись в якості протипухлинного засобу, при застосуванні якого він зв'язується з своїми рецепторами на поверхні пухлинних клітин і таким чином ініціює події, що ведуть до загибелі пухлинних клітин. Також TNF можуть використовуватись в якості протиінфекційних агентів. Однак, і TNF-α, і TNF- також мають негативні прояви. Існують докази того, що надлишкове продукування TNF- може відігравати основну патогенетичну роль у розвитку деяких захворювань. Наприклад, дія TNF- , в першу чергу на судинну систему, відома як головна причина розвитку симптомів септичного шоку [Тгасеу et аl., 1986]. При деяких захворюваннях TNF може зумовлювати істотну втрату ваги (кахексію) шляхом пригнічення активності адипоцитів призводячи до анорексії, що привело до позначення TNF- як кахетину. Також було описано, що TNF- є медіатором пошкоджень тканин при ревматичних захворюваннях [Beutler & Сеrаmі, 1987] і основним медіатором пошкоджень, що спостерігаються при синдромі "трансплантат проти хазяїна" [Piquet et аl., 1987]. Крім того, TNF відомий як учасник запального процесу і багатьох інших захворювань. Два рецептори, що чітко розрізняються і незалежно екс-пресуються - р55 і р75 TNF-R - які специфічно зв'язують і TNF- , і TNF- , ініціюють та (або) опосередковують описані вище біологічні прояви TNF. Ці два рецептори включають різні за структурою внутрішньоклітинні домени, що вказує на відмінність їх сигнальної активності [див. Hohmann et al., 1989; Engelmann et al., 1990; Brockhaus et al., 1990; Leotscher et al., 1990; Schall et al., 1990; Nophar et al., 1990; Smith et al., 1990; і Heller et al., 1990]. Однак доки точно не встановлені клітинні механізми, за якими діють, наприклад, різні білки і, по-видимому, інші фактори, втягнуті в внутрішньоклітинну передачу сигналів на рецептори р55 і р75 TNF-R. При цьому існує внутрішньоклітинний сигнальний шлях, який є активним зазвичай після зв'язування рецепторів свого 11 74529 12 своїй поверхні і можуть бути вбиті опосередковано ліганду, тобто TNF ( або ), і який асоційований з дією цього рецептора. Припускається, що неконтзапуском каскаду реакцій, що, врешті-решт, прирольована індукція такої загибелі є фактором ткаводять до відповіді клітин на TNF, що спостерінинних пошкоджень при певних захворюваннях, гається. наприклад, руйнування клітин печінки при гостроЗ точки зору зазначеної вище цитотоксичної дії му гепатиті. Відповідно, виявлення шляхів стримуTNF в більшості вивчених до нинішнього часу типів вання цитотоксичної активності FAS-R може мати клітин даний прояв опосередковується в основнотерапевтичне значення. му рецептором р55 TNF-R. Антитіла до позакліЗ іншого боку, оскільки було також виявлено, тинних доменів (тобто доменів зв'язування ліганщо деякі клітини злоякісних пухлин і клітини, зараду) рецептора р55 TNF-R самі можуть жені ВІЛ, несуть FAS-R на своїй поверхні, антитіла опосередковувати цитотоксичну дію [див. ЕР до FAS-R або ліганду FAS-R можуть використову412486], що корелює з ефективністю перехресного ватись для контролю опосередковуваної FAS-R зшивання рецептора з антитілами, що розглядацитотоксичної дії на такі клітини і завдяки цьому ється як перший етап в запуску внутрішньоклітинслужити способом боротьби з клітинами злоякісного сигнального механізму. Далі, мутаційний ананих пухлин або клітинами, зараженими ВІЛ [див. ліз [Brakebusch et al., 1992; Tartaglia et al., 1993] Itoh et al., 1991]. Відкриття ще якихось шляхів підпоказав, що біологічні функції р55 TNF-R залежать силення цитотоксичної активності FAS-R також від складання його внутрішньоклітинного домену: може мати терапевтичне значення. відповідно, було підтверджено, що запуск внутріОчевидно, має місце нагальна необхідність шньоклітинного сигнального механізму, який веде розробки способу модулювання клітинних відповідо цитотоксичної дії TNF, є наслідком зв'язування двох або більшого числа внутрішньоклітинних додей на TNF ( або β) і ліганд FAS-R. Наприклад, при описаних вище патологіях, коли спостерігаєтьменів р55 TNF-R. Більше того, TNF ( і β) є гомотся надекспресія TNF або ліганду FAS-R, бажаним римером, а оскільки це так, було підтверджено, що стає пригнічення цитотоксичної дії, що індукується індукція внутрішньоклітинного сигнального механіTNF або лігандом FAS-R, в той час як при інших зму через р55 TNF-R відбувається завдяки його ситуаціях, наприклад, при загоєнні пошкоджень, здатності зв'язуватися і утворювати поперечні бажаним виявляється підсилення дії TNF, або у зшивки з молекулами рецепторів, тобто утворювавипадку з FAS-R у відношенні пухлинних або ВІЛти агрегації рецепторів. заражених клітин бажаним є підсилення ефекту, Іншим членом суперсімейства TNF/NGFщо викликається FAS-R. рецепторів є FAS-рецептор (FAS-R), що також наЗаявниками було запропоновано ряд відповідзивають FAS-антигеном: це поверхнево-клітинний них підходів [див., наприклад, заявки на європейбілок, що експресується в різних тканинах і виявські патенти №№ ЕР-186833, ЕР-308378, ЕРляє схожість з рядом інших поверхнево-клітинних 398327 і ЕР-412486], спрямованих на контроль рецепторів, включаючи TNF-R і NGF-R. Рецептор негативної дії TNF шляхом пригнічення зв'язуванFAS-R опосередковує загибель клітин по типу ня TNF на їх рецепторах з використанням антитіл апоптозу [Itoh et al., 1991] і, по-видимому, працює до TNF або з використанням розчинних рецепторів як негативний селектор авто-реактивних ТTNF (тобто достатніх для розчинення позаклітинлімфоцитів: тобто в ході визрівання Т-лімфоцитів них доменів таких рецепторів) з метою створення FAS-R опосередковує апоптотичну загибель Тконкуренції за зв'язування TNF на рецепторах клітин, що розпізнають власні антигени. Також Ірr TNF-R, розташованих на клітинних поверхнях. було встановлено, що мутація в гені FAS-R (мутаКрім того, на основі того, що зв'язування TNF з їх ції Ірr) зумовлюють лімфопроліферативний розлад рецепторами є необхідним для прояву відповідних у мишей, що нагадує системний червоний вовчак, індукованих ефектів TNF, заявники пропонували який є автоімунним захворюванням людини підходи [див., наприклад, ЕРО-568925], скеровані [Watanabe-Fukunaga et al., 1992]. Лігандом для на модулювання дії TNF шляхом зміни активності рецептора FAS-R, як припускається, є молекула, рецепторів TNF-R. що асоціюється з клітинною поверхнею, яку неКоротко, заявка ЕРО-568925 стосується спосуть, окрім інших типів клітин, Т-кілери (або цитособу модулювання передачі сигналу і (або) розтоксичні Т-лімфоцити - CTL): відповідно, коли такі щеплення TNF-R таким чином, щоб пептиди або CTL контактують з клітинами, що несуть FAS-R, інші молекули могли взаємодіяти або з самим ревони здатні індукувати апоптотичну загибель кліцептором, або з ефекторними білками, які взаємотин, що несуть FAS-R. Крім того, було сформовано діють з цим рецептором, внаслідок чого забезпемоноклональне антитіло, що є специфічним щодо чується модуляція нормальної функції TNF-R. [В FAS-R, це моноклональне антитіло здатне індукузаявці ЕРО-568925] описана конструкція і подана вати загибель несучих FAS-R клітин по типу апопхарактеристика різних мутантних форм р55 TNF-R, тозу, включаючи мишачі клітини, трансформовані що мають мутації в складі позаклітинного, трансвнесенням кДНК, що кодує FAS-R людини [Itoh et мембранного і внутрішньоклітинного доменів р55 al., 1991]. TNF-R. В цьому випадку були ідентифіковані діляПри тому, що цитотоксична дія лімфоцитів нки цих доменів в складі р55 TNF-R, що є ключоопосередковується взаємодією ліганду, що продувими з точки зору забезпечення функцій рецептокується лімфоцитами, з широко розповсюдженим ра, тобто зв'язування свого ліганду (TNF) і поверхнево-клітинним рецептором FAS-R (CD95), подальшої передачі сигналу й запуску внутрішньоякий здатен запускати механізм загибелі клітин, клітинного сигнального механізму, які, врештітакож було встановлено, що різні інші нормальні решт, і приводять до проявів дії TNF на клітини, клітини, окрім Т-лімфоцитів, експресують FAS-R на 13 74529 14 що спостерігаються. Крім того, також описаний ряд рівень інтенсивності експресії рецепторів може підходів до виділення й ідентифікації білків, пептиприводити до опосередкування незалежних від дів або інших факторів, що здатні зв'язуватися з лігандів сигнальних механізмів [Boldin et al., 1995]. різними ділянками зазначених вище доменів TNFДеякі прояви цитотоксичності у лімфоцитів R, білки, пептиди та інші фактори яких можуть втяопосередковуються взаємодією ліганду, що вирогуватись в регулювання або модулювання активбляється лімфоцитом, з рецептором FAS-R (CD95) ності рецептора TNF-R. Також [в заявці ЕРО- широко розповсюдженим поверхнево-клітинним 568925] подано ряд підходів до виділення і клонурецептором, який здатний опосередковувати загивання послідовностей ДНК, які кодують такі білки і бель клітин [також див. Nagata & Golstein, 1995], і пептиди, для конструювання експресувальних векця загибель клітин моноядерними фагоцитами торів, призначених для продукування таких білків і втягує комплекс "ліганд-рецептор" в складі TNF і пептидів, та одержання антитіл або їх фрагментів, його рецептора p55-R (CD120), що структурно поякі взаємодіють з TNF-R або з названими вище дібний до комплексу рецептора FAS-R і його лігабілками і пептидами, що зв'язуються з різними нду [також див. Vandenabeele et al., 1995]. Як і у сегментами TNF-R. Однак, [заявка ЕРО-568925] не випадку з іншими проявами, які індукуються за уточнює параметри білків і пептидів, діючих відноучастю рецепторів, індукція загибелі клітин за учасно зв'язування з внутрішньоклітинним доменом стю рецепторів TNF і FAS-R відбувається шляхом рецепторів TNF-R (наприклад, р55 TNF-R), і не серії міжбілкових взаємодій, які починаються зі описує "дигібридний дріжджовий підхід" для видізв'язування білка ліганду і рецептора з можливою лення та ідентифікації таких білків або пептидів, активацією ферментних ефекторних функцій, які у що зв'язуються з внутрішньоклітинними доменами випадку, що аналізується, визначають неферменрецепторів TNF-R. Також [в заявці ЕРО-568925] тні міжбілкові взаємодії, що ініціюють сигнал про немає опису білків або пептидів, здатних зв'язувазагибель клітин: зв'язування тримерних TNF або тися з внутрішньоклітинним доменом рецептора молекул лігандів рецептора FAS-R з їх рецептораFAS-R. ми, що відбувається внаслідок взаємодії їх внутріТаким чином, якщо бажаним є пригнічення дії шньоклітинних доменів [Brakebusch et al., 1992; TNF або ліганду FAS-R, повинно бути бажаним Tartaglia et al., 1993; Itoh & Nagata, 1993], що визменшити кількість чи рівень активності TNF-R або значається властивістю "загибель-доменів" (або FAS-R на поверхні клітин, у той час як збільшення "загибель-ефекторних доменів", DED) самозв'язукількості або рівня активності TNF-R або FAS-R ватись [Boldin et al., 1995a], та індукція зв'язування повинно бути бажаним тоді, коли прагнуть підсидвох цитоплазматичних білків (що також можуть лення дії TNF або ліганду FAS-R. В зв'язку з цим зв'язуватися один з одним) з внутрішньоклітиннибули секвеновані та проаналізовані промотори ми доменами рецепторів - білка MORT-1 (або генів, які кодують і p55 TNF-R, і р75 TNF-R: і були FADD) з FAS-R [Boldin et al., 1995b; Chinnaiyan et виявлені деякі ключові мотиви послідовностей, al., 1995; Kischkel et al., 1995] та білка TRADD з для яких була встановлена специфічність відносно p55-R [Hsu et al., 1995; Hsu et al., 1996]. Три білки, до різних транскрипційних факторів: це означає, що зв'язуються з внутрішньоклітинним доменом що експресія цих рецепторів TNF-R може контроFAS-R і p55-R по їх "загибель-домену", втягнуті в люватися на рівні відповідних промоторів - тобто індукцію клітинної загибелі рецепторами через пригнічення транскрипції з промотору веде до утворення гетеро-зв'язаних гомологічних сегментів зменшення кількості цих рецепторів, а підсилення і також здатні незалежно опосередковувати клітранскрипції з цих промоторів - до збільшення кітинну загибель незалежно один від одного, були лькості цих рецепторів [ЕР-606869 і WO 95/31206]. ідентифіковані з застосуванням процедури дигібТакож ще немає повідомлень про дослідження ридного дріжджового скринінгу. Один з цих білків регуляції FAS-R на рівні промотору гену, що кодує MORT-1 [Boldin et al., 1995b], також відомий як цей рецептор. FADD [Chinnaiyan et al., 1995] специфічно зв'язуХоча і відомо, що рецептори факторів некрозу ється з FAS-R. Інший такий білок - TRADD [також пухлин (TNF) і структурно схожий рецептор FAS-R див. Hsu et al., 1995, 1996] - зв'язується з p55-R, а у відповідь на стимуляцію лігандами, що вироблятретій такий білок - RIP [також див. Stanger et al., ються лейкоцитами, опосередковують деструктив1995] - зв'язується і з FAS-R, і з p55-R. Крім того, ну активність в межах клітин, що приводить до їх що вони зв'язуються з FAS-R і p55-R, ці білки тавласної загибелі, механізми такого опосередковакож здатні зв'язуватися один з одним, що може ного впливу досі остаточно неясні. Аналіз мутації зумовлювати функціональний механізм "перехревказує на те, що FAS-R і рецептор р55 TNF (p55-R) сного обміну інформацією" між рецепторами FASвтягують різні ділянки своїх внутрішньоклітинних R і p55-R. Такі зв'язування відбуваються за участю доменів в сигнальні механізми цитотоксичності консервативного сегменту послідовності - т. зв. [Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh & "модуля загибель-домена" (також що позначається Nagata, 1993]. Ці сегменти (т.зв. "загибель-домени" як "DED" за "Death Effector Domain" - "загибельабо "загибель-ефекторні домени", або "DED") хаефекторний домен"), - звичайного для рецепторів і рактеризуються схожістю амінокислотних послідобілків, що зв'язуються з ними. Більше того, хоча в вностей. "Загибель-домени" в складі FAS-R і p55-R дигібридному дріжджовому тесті білок MORT-1 виявляють тенденцію до самозв'язування. Таке їх виявляв спонтанну зв'язуваність на FAS-R, в клісамозв'язування, як припускають, сприяє утворентинах ссавців таке зв'язування мало місце лише ню агрегацій рецепторів, необхідних для ініціації після стимуляції рецептора: це підтверджує, що сигнальних механізмів [див. Song et al., 1994; MORT-1 бере участь в процесі ініціації сигнального Wallach et al., 1994; Boldin et al., 1995], а високий механізму FAS-R. Білок MORT-1 не містить яко 15 74529 16 гось мотиву в своїй амінокислотній послідовності, et al., 1996; Ahmad et al., 1997]. характерного для прояву каталітичної активності: Недавно було виділено, клоновано й охарактобто його здатність опосередковувати загибель теризовано одну таку протеазу і її різні ізоформи клітин, як припускають, не ґрунтується на активно(включаючи інгібіторні форми), позначену MACH сті самого MORT-1, а, скоріше за все, зумовлюєть(також позначається CASP-8), що є MORT1ся активацією деяких інших білків (білка), що зв'язв'язним білком та служить модулятором MORT-1 зують MORT-1 і діють далі вниз по сигнальному і, відповідно, FAS-R і p55-R, і яка також може діяти каскаду. Експресія в клітинах мутантних варіантів незалежно від MORT-1; також було описане можMORT-1, що втратили N-кінцеву частину молекуливе використання даної протеази, зокрема, в нали, як було показано, блокує цитотоксичність, що ведених в докладному списку матеріалів, що циіндукується FAS/AP01 (FAS-R) або p55-R [Hsu et туються, спільних заявок, які водночас очікують al., 1996; Chinnaiyan et al., 1996]: це вказує на те, рішення, [на ізраїльський патент №№114 615, що цей N-кінцевий сегмент передає сигнал про 114986, 115319, 116588 і 117932, а також у відпозагибель клітин від обох рецепторів через міжбілвідному РСТ - № PCT/US96/10521], рівно як і в кові взаємодії. недавній публікації заявників [Boldin et al., 1996]. Недавні дослідження виявили групи цитоплаІнша така протеаза, включаючи її ізоформи (вклюзматичних тіолових протеаз, які демонструють чаючи інгібіторні форми), позначена Mch4 (що таструктурну схожість з протеазою CED3 вільно жикож позначається CASP10), також недавно була вучої нематоди Caenorhabditis elegans і з конвервиділена і охарактеризована заявниками даного винаходу (неопубліковані матеріали) та іншими тазою ICE інтерлейкіну-1 людини в зв'язку з різдослідниками [Fernandes-Alnemri et al., 1996; ними фізіологічними параметрами процесів Srinivasula et al., 1996]. Цей білок Mch4 також є загибелі клітин [див. огляди Kumar, 1995 і Henkart, MORT1-зв'язним білком, що служить для модуля1996]. Також є ряд вказівок про те, що протеази ції активності MORT-1 і, відповідно, по-видимому, (протеаза) цього сімейства можуть брати участь в як модулятор FAS-R і p55-R, і який також може прояві цитотоксичності клітин, що індукується за діяти незалежно від MORT-1. Таким чином, подроучастю рецепторів FAS-R і TNF-R. Для специфічбиці, що стосуються всіх аспектів властивостей, них пептидних інгібіторів протеаз і двох білківхарактеристик і шляхів використання Mch4 подані блокаторів їх функцій, що кодуються вірусами в названих вище публікаціях, що повністю включебілка вірусу коров'ячої віспи crmA та бакуловірусні до списку цитування даного винаходу. ного білка р35 - було показане забезпечення захиТакож треба зазначити, що каспази MACH сту клітин від прояву цитотоксичності [Enari et al., (CASP-8) і Mch4 (CASP10), що включають схожі 1995; Los et al., 1995; Tewari et al., 1995; Xue et al., "продомени" [див. Boldin et al., 1996; Muzio et al., 1995; Beidler et al., 1995]. Швидке розщеплення 1996; Fernandes-Alnemri et al., 1996; Vincent & Dixit, деяких специфічних клітинних білків, як припуска1997], взаємодіють за допомогою своїх "продомеють, дією протеаз сімейства CED3/ICE може бути нів" з MORT-1: ця взаємодія опосередковується продемонстроване в клітинах невдовзі після стимотивом "загибель-домена" або "загибельмуляції рецепторів FAS-R або TNF-R. ефекторними доменами" (DED), які знаходяться в Необхідно зазначити, що ці протеази сімейстN-кінцевій частині MORT-1 і наявні в дуплікованова CED3/ICE, які також називаються каспазами, му вигляді в складі MACH (CASP-8) і Mch4 (CASPпродукуються у вигляді неактивних попередників і 10) [див. Boldin et al., 1995b; Chinnalyan et al., активуються шляхом протеолітичного розщеплен1995]. ня в ході індукції загибелі клітин. Ці каспази є конТакож заслуговує на згадування те, що, з точсервативними цистеїновими протеазами, що розки зору сказаного вище, різні білки, ферменти і щеплюють специфічні клітинні білки нижче від рецептори, втягнуті у внутрішньоклітинні сигнальні залишків аспарагінової кислоти і, відповідно, відігпроцеси, що приводять до загибелі клітин, одеррають ключову роль в усіх відомих до нинішнього жували неодинакові найменування. Для подоланчасу процесах запрограмованої загибелі клітин. ня можливих неточностей пропонується поданий Окрім їх гомологічних С-кінцевих ділянок, з вмісту нижче список різних найменувань, включаючи нові яких утворюються зрілі форми протеаз, білкинайменування, які приймаються у зв'язку з новими попередники включають унікальні N-кінцеві сегместандартами, для кожного з даних білків або їх нти. Взаємодії цих "продоменів" зі специфічними складових, а також подані найменування, прийняті регуляторними молекулами забезпечує диферендо використання в цьому тексті з урахуванням ційовану активацію різних каспаз за участю різних відповідної зручності. сигналів індукції загибелі клітин [Boldin et al., 1996; Muzio et al., 1996; Duan & Dixit, 1997, Van Criekinge Звичайне найменування або найменування, з яким описаний вперше Рецептор p55TNF Рецептор p75TNF Рецептор FAS MORT-1 MACH Mch4 Інші найменування P55-R P75-R FAS-R, FAS/APO1 FADD FLICE1, Mch5 FLICE2 Нове стандартне найменування CDl20a CDl20b CD95 CASP-8 CASP-10 Найменування, що використовується тут P55-R P75-R FAS-R MORT-1 MACH Mch4 17 74529 18 Продовження таблиці Gl "загибель-домен" протеази CYD3/ICE "загибель-доменний мотив" мотив", "загибель-ефекторний (DED), "MORT-модулі" каспази Об'єктом цього винаходу є подання нових білків, включаючи всі їх ізоформи, аналоги, фрагменти або похідні, що здатні зв'язуватися з MORT1зв'язними білками, такими як, наприклад, названі вище білки Мсh4 і MACH та їх ізоформи, або здатні зв'язуватися з самим MORT-1. З урахуванням того, щосам білок MORT-1 зв'язується з внутрішньоклітинним доменом рецептора FAS-R, нові білки відповідно до цього винаходу завдяки зв'язуванню з MORT1-зв'язними білками і, відповідно, непрямо з MORT-1, або завдяки прямому зв'язуванню з білком MORT-1, здатні таким чином пригнічувати внутрішньоклітинні сигнальні механізми, ініційовані зв'язуванням FAS-ліганду на його рецепторі: тобто таким чином нові білки відповідно до цього винаходу є модуляторами опосередкованого FAS-R впливу на клітини. Білок MORT-1 також втягнутий у модулювання впливу TNF на клітини через його участь в модуляції p55-R: відповідно, нові білки згідно з цим винаходом також розглядаються як модулятори впливу TNF на клітини, здійснюваного через рецептор p55-R. Також, по аналогії з охарактеризованим вище модулюванням впливу на клітини, що опосередковується рецепторами FAS-R і p55-R, білки відповідно до цього винаходу також можуть бути медіаторами або модуляторами інших цитотоксичних медіаторів або індукторів шляхом дії на загальні або сполучені внутрішньоклітинні сигнальні механізми, в яких беруть участь Τ білки відповідно до цього винаходу - наприклад, G1 і його ізоформи. Ці нові білки відповідно до цього винаходу позначені білками "G1" і, як зазначалося вище, включають власне білок G1 (розглянутий нижче), всі його ізоформи, аналоги, фрагменти і похідні. Іншим об'єктом винаходу є подання антагоністів (наприклад, антитіл, пептидів, органічних сполук або навіть деяких ізоформ вищезазначених нових білків G1, їх ізоформ, аналогів, фрагментів і похідних, що можуть використовуватись для пригнічення сигнального механізму або, більш конкретно, прояв цитотоксичності, якщо це є бажаним. Подальшим об'єктом даного винаходу є використання названих вище нових білків G1, їх ізоформ, аналогів, фрагментів і похідних з метою виділення і охарактеризування додаткових білків або факторів, що можуть бути втягнуті в регулювання активності рецепторів, наприклад, інших протеаз, що розщепляють нові білки з перетворенням їх на біологічно активні, і (або) з метою виділення і ідентифікації інших рецепторів, розташованих до початку сигнальних процесів, що зв'язують ці нові білки, їх аналоги, фрагменти і похідні (наприклад, інші FAS-R або споріднені рецептори), в функціонування яких, відповідно, вони також втягуються. CASH "MORTмотив" CASΡ Gl "загибель-домен", бель-доменний "MORT-модулі" протеази CED3/ICE "загимотив", Ще одним об'єктом даного винаходу є подання інгібіторів, які можуть бути внесені в клітини з метою зв'язування або взаємодії з білком G1 і можливими ізоформами G1, що мають протеазну активність (білок G1 включає ділянку, гомологічну протеолітичним сегментам Mch4 і MACH), та інгібування їх внутрішньоклітинної активності, яка, принаймні, для деяких ізоформ G1, є протеолітичною активністю. Крім того, об'єктом даного винаходу є використання названих вище нових білків G1, їх ізоформ, аналогів, фрагментів і похідних в якості антигенів для приготування поліклональних і (або) моноклональних антитіл до них. Зі свого боку ці антитіла можуть використовуватись, наприклад, для очистки нових білків з різних джерел, таких як клітинні екстракти або трансформовані клітинні лінії. Далі, ці антитіла можуть використовуватись з метою діагностики, наприклад, для ідентифікації розладів, пов'язаних з аномальним функціонуванням клітинних процесів, опосередкованих FAS-R або іншими спорідненими рецепторами. Іншим об'єктом цього винаходу є надання фармацевтичних композицій, що включають названі вище білки G1, їх ізоформи або аналоги, фрагменти чи похідні, рівно як і фармацевтичні композиції, які включають названі вище антитіла або інші антагоністи. Згідно з цим винаходом виділений новий білок - G1, який здатний зв'язуватися або взаємодіяти з Mch4, що сам зв'язується з MORT-1, який, в свою чергу, зв'язується з внутрішньоклітинним доменом FAS-R. Також G1 може взаємодіяти з іншим MORT1-зв'язним білком, що називається MACH, і також може бути здатним зв'язуватися або взаємодіяти прямо з MORT-1. Білок G1, по-видимому, функціонує як модуляторний фактор механізму загибелі клітин, що ініціюється зв'язуванням FASліганду на рецепторі FAS-R на поверхні клітин, що, по-видимому, забезпечується наявністю у нього протеолітичного сегменту, схожого з протеолітичними сегментами Mch4 і MACH: відповідно, білок G1 також може бути активною внутрішньоклітинною протеазою. Далі, залежно від процесів транскрипції і трансляції в ході експресії G1, особливо по його протеолітичному сегменту, деякі ізоформи G1 можуть бути експресовані з виключенням активного протеолітичного сегменту і таким чином можуть служити в якості антагоністів протеолітичної активності, що опосередковується, наприклад, участю Mch4 і MACH. Протеази сімейства CED3/ICE можуть бути втягнуті в процеси апоптозу, опосередковувані FAS-R. Білок MORT-1 (або FADD) зв'язується з внутрішньоклітинним доменом FAS-R в ході активації цього рецептора, а новий білок G1 відповідно до цього винаходу зв'язується 19 74529 20 з MORT1-зв'язними білками, такими як Мсп4 і, форми білка G1 були одержані згідно з цим винаймовірно, також MACH, або прямо з білком MORTходом (див. нижче приклад 1). Дві з цих ізоформ 1. Білок G1, клонований та охарактеризований були виділені і клоновані: вважається, що вони згідно з цим винаходом, може існувати у вигляді являють собою два варіанти альтернативного множинних ізоформ, деякі з яких включають сегсплайсингу нового білка, позначеного G1 (або мент гомології з CED3/ICE, що має протеолітичну CASH). Ці дві ізоформи були названі G1 (або активність (протеолітичний домен), схожий з таким CASH ) для більш довгої ізоформи та G1 (або у Mch4 і у деяких ізоформ MACH, і які можуть зуCASH ) для більш короткої ізоформи (оскільки мовлювати загибель клітин у випадку експресії в існує більше однієї короткої ізоформи, то дану коних. Таким чином, активація цього нового гомолога ротку ізоформу G1 позначають як G1 1, а іншу CED3/ICE (тобто різних ізоформ G1, що включакоротку ізоформу - як G1 2: див. нижче Приклад ють протеолітичний домен) за участю FAS-R 1). Кожна з цих ізоформ G1 - α і β включає два N(шляхом прямої або непрямої взаємодії з MORTкінцеві "загибель-домени''/MORT-модулі та може 1), по-видимому, формує ефекторний компонент зв'язуватися одна з одною опосередковано через опосередковуваного FAS-R механізму загибелі ці "загибель-доменні мотиви", а також може зв'язуклітин. ватися з MORT-1, Mch4 і MACH опосередковано Більше того, білок G1 також функціонує в якочерез ці ж "загибель-доменні мотиви". Більш довга сті ефекторного компонента механізму загибелі ізоформа G1 має унікальний С-кінцевий сегмент клітин, що ініціюється зв'язуванням TNF на рецеп(порівняно з короткою ізоформою G1 ), при тому, торі p55-R на поверхні клітин: в цьому випадку що цей унікальний С-кінцевий сегмент характеришляхом непрямого зв'язування MORT-1 з білком зується гомологією послідовності з такою в сегмеTRADD - білком, що сам зв'язується з внутрішньонті протеазної активності каспаз. З точки зору біоклітинним доменом p55-R [Hsu et al., 1995]: після логічної активності, більш коротка ізоформа G1 цього або водночас з цим відбувається зв'язуванпригнічує загибель клітин і цитотоксичність, опосеня білка G1 з MORT1-зв'язними білками, такими редковувану рецепторами p55-R і FAS-R, в той час як, наприклад, Mch4 чи MACH, або зв'язування з як, навпроти, більш довга ізоформа G1 має цитоMORT-1 прямо з перетворенням G1 на активну токсичну дію відносно до принаймні деяких типів протеазу, втягнуту в опосередкування клітинної клітин (наприклад, клітин лінії 293) при тому, що ця загибелі. цитотоксичність залучає їх протеазо-гомологічний Також слід зазначити, що, хоча G1 виявляє, сегмент. Однак слід зазначити, що довга ізоформа принаймні деякі параметри послідовності, ключові G1 також може інгібувати цитотоксичність, оподля функціонування протеаз CED3/ICE, він, однак, середковувану рецепторами p55-R і FAS-R в інших має і ряд відмітних характеристик послідовності, типах клітин (наприклад, клітин HeLa). Ці дані вищо можуть забезпечити йому унікальний і, позначають, що білок G1 (а саме його різні ізофорвидимому, тканино/клітиноспецифічний характер ми) діють як ослаблювачі-інгібітори і (або) індуктоактивності. ри-підсилювачі сигнальних механізмів клітинної Таким чином, згідно з цим винаходом, надазагибелі, опосередковуваних рецепторами p55-R і ється новий білок, позначений G1. Цей білок G1 FAS-R. було виділено і клоновано з застосуванням дигібТакож слід зазначити, що заради простоти поридного скринінгу і був охарактеризований як мозначення різних ізоформ G1, наприклад G1 і G1 , лекула, що зв'язується з Mch4. Як зазначалося часто в цьому тексті буде застосовуватися проста вище, Mch4 є MORT1-зв'язним білком, що здатний позначка "G1", але при цьому повинно бути зрозузапускати клітинну загибель, хоча, однак, також міло, що в цих випадках поняття "G1" позначатиме треба зазначити, що деякі ізоформи Mch4 мають всі ізоформи G1 - тобто воно позначатиме і індукпротилежну активність, а саме вони інгібують знитори-підсилювачі цитотоксичності, і інгібіторищення клітин. Крім того, секвену-вання G1 показаослаблювачі клітинної цитотоксичності. Коли ж ло, що цей білок включає в складі своєї N-кінцевої маються на увазі специфічні ізоформи G1, вони частини два так званих "MORT-МОДУЛІ" (MM), які будуть і називатися у відповідний спосіб, напритакож виявляються в складі MORT1-зв'язних білків клад, G1 або G1 . З урахуванням сказаного, коли Mch4 і MACH. Ці "MORT-модулі" в складі G1, як використовується збірне позначення "С1", що стоприпускають, надають йому здатність зв'язуватися сується різних ізоформ, воно часто позначатиз Mch4, а також можуть бути фактором прямого меться в даному тексті як "модулятор": це означає, зв'язування з MORT-1 і зв'язування з MACH або з що він може виявляти і інгібіторну, і підсилювальну специфічними ізоформами MACH (специфічними дію відносно до біологічної функції, що обгововаріантами сплайсингу MACH). В амінокислотній рюється. послідовності G1 услід за N-кінцевим сегментом, З точки зору сказаного вище стає ясно, як це що включає "MORT-модулі", також знаходиться було описано вище і буде розглянуто нижче, що довгий сегмент, який виявляє схожість з протеоліG1 є модулятором активності MORT-1 і, відповідтичним сегментом MACH і Mch4. Більше того, вино, модулятором клітинних ефектів, опосередкоходячи з даних початкового аналізу ймовірної ловуваних рецепторами FAS-R і p55-R, а також, покалізації послідовності гену G1 на хромосомах видимому, іншими рецепторами з сімейства рецелюдини, стало ясно, що ген G1 знаходиться на пторів TNF/NGF та інших, що можуть брати участь хромосомі №2 в тісній близькості від локалізацій в схожих компонентах і механізмах внутрішньоклігенів Mch4 і MACH, що також вказує на наявність тинної передачі сигналів. зв'язку між білками Gl, Mch4 і MACH. Таким чином, оскільки G1 має протеазоБільш докладно, принаймні, три можливі ізо 21 74529 22 подібний сегмент (принаймні, в складі довгої ізоMORT1-зв'язні білки також можуть, відповідно, форми), він може прямо відповідати за цитотоксидіяти в якості непрямих медіаторів або модуляточність і запальні процеси, що викликаються або рів впливу лігандів рецептора FAS-R на клітини індукуються різними стимуляторами, включаючи ті, шляхом опосередкування або модулювання актиякі потрапляють через рецептори з складу сімейсвності MORT-1; або ж ці MORT1-зв'язні білки мотва рецепторів TNF/NGF і, певно, також інших сіжуть діяти прямо як медіатори або модулятори мейств рецепторів. зв'язаного з MORT-1 внутрішньоклітинного сигнаТакож G1 може служити в якості інгібітору цильного механізму шляхом опосередкування або тотоксичності та запальних процесів за рахунок модулювання активності MORT-1, який, як виплитого, що він входить до складу комплексу інших ває з описаного вище, має незалежну здатність білків і, відповідно, може впливати на цитотоксичактивувати клітинну цитотоксичність. Ці MORT1ну і запальну активність цих інших білків (напризв'язні білки також можуть використовуватись у клад, білків, Mch4 і MACH або навіть MOLT-1), що, будь-якій з стандартних процедур скринінгу з меврешті-решт, призводить до пригнічення їх цитототою виділення, ідентифікації і охарактеризування ксичної активності або їх активності при запаленні. додаткових білків, пептидів, факторів, антитіл тоТакож ще G1 може служити в якості підсилющо, які можуть бути втягнуті в сигнальні механізми, вача або зумовлювача клітинної цитотоксичності пов'язані з MORT-1 чи пов'язані з FAS-R, або мота запальних процесів, інших білків (наприклад, жуть бути елементами інших внутрішньоклітинних білків, Мсh4 і MACH або навіть MORT-1), за рахусигнальних процесів. Були виділені такі MORT1нок зв'язування із ними з подальшим зв'язуванням зв'язні білки, і вони описані в названих вище спільз MORT-1, або діючи незалежно від MORT-1, але в них ізраїльських заявках, що перебувають на стакожному випадку забезпечуючи цитотоксичну акдії розгляду, №№114615, 114986, 115319, 116588, тивність різних білків або їх дію з індукції запаль117932 і у відповідному РСТ №PCT/US-96/10521 (в них процесів. частині, що стосується MACH і його ізоформ) і [в Також у аналогічний спосіб білок G1 може статтях Fernandes-Alnemri et al., (1996) та служити в якості інгібітору або зумовлювача інших Srinivasula et al., (1996)] (в частині, що стосується внутрішньоклітинних медіаторів або модуляторів, Mch4 та інших "Mch''-білків). Один з таких MORT1втягнутих в механізми, в яких активно бере участь зв'язних білків - білок, що раніше згадувався сам G1. MACH - був спочатку клонований, секвенований і Білок MORT-1 (абревіатура "Mediator of частково охарактеризований як такий, що має такі Receptor Toxicity" - медіатор токсичності, рецептопараметри: кДНК MACH кодує відкриту рамку рів – [Boldin et al., 1995b]) здатний зв'язуватися з ORF-B; MACH зв'язується з MORT-1 по дуже жорсвнутрішньоклітинним доменом FAS-R. Цей FASткому і високоспецифічному типу; МАСН-зв'язний зв'язний білок, як припускають, діє в якості медіасайт в складі MORT-1 покладений вище від "загитора або модулятора дії ліганду рецептора FAS-R бель-доменного мотиву" MORT-1; ділянка ORF-B на клітини шляхом опосередкування або модулюдля MACH є його ділянкою взаємодії з MORT-1; і вання внутрішньоклітинних сигнальних механізмів, MACH характеризується здатністю до самозв'язуякі зазвичай запускаються після зв'язування ліганвання і сам по собі може індукувати клітинну цитоду FAS-R на поверхні клітин. Додатково до специтоксичність. Крім того, пізніше проведені досліфічності з FAS-зв'язування, для MORT-1 було подження, також відображені в названих вище казано наявність інших параметрів (див. прикладспільних заявках, що перебувають на стадії розгпосилання 1): наприклад, в його складі є сегмент, ляду, а також [в публікації Boldin et al., (1996)], погомологічний сегментам "загибель-доменів" (DD) в казали, що дійсно MACH існує у вигляді серії ізоскладі р55-TNF-R і FAS-R (p55-DD і FAS-DD) - відформ. Більше того, названа вище ORF-B MACH повідно, він також здатний до самозв'язування. насправді є однією з ізоформ MACH, позначеною Також MORT-1 сам по собі здатний активувати як MACH 1. В названих вище публікаціях, що стоклітинну цитотоксичність: така активність, посуються білка Mch4, було показано, що цей білок видимому, зв'язана з здатністю до самозв'язувантакож зв'язується з MORT-1 (або FADD) і прямо ня. Також було виявлено, що ко-експресія сегменвтягнутий в клітинну цитотоксичність за участю ту MORT-1, який включає послідовність, гомологіMORT-1 або незалежну від нього, що зв'язується з чну "загибель-домену" (MORT-DD - наявний в Сйого протеолітичною активністю. кінцевій частині MORT-1), істотною мірою порушує Відповідно, даний винахід подає послідовність процеси загибелі клітин, що індукуються FAS, чого ДНК, що кодує білок G1, його аналоги або фрагможна очікувати виходячи з здатності до зв'язументи, здатні зв'язуватися або взаємодіяти прямо вання з "загибель-доменом" в складі FAS-IC. Крім або опосередковано з MORT-1 і (або) з MORT1того, за тих самих умов експерименту, було виявзв'язними білками, такими, як, наприклад, Мсh4 лено, що ко-експресія частини МОРТ-1, яка не або MACH, при тому, що зазначений білок G1, містить сегменту MORT-DD (N-кінцева частина його аналоги або фрагменти здатні опосередковуMORT-1, амінокислоти 1-117: "головна частина вати внутрішньоклітинний ефект, опосередковаMORT-1") , призводить в результаті до відсутності ний FAS-R або p55-TNF-R, або що зазначений перешкод FAS-індукованій клітинної загибелі, а то білок G1, його аналоги або фрагменти здатні таі до деякого зростання цитотоксичності, що індукукож модулювати або опосередковувати внутрішється FAS. ньоклітинні ефекти активності інших білків, з якими Відповідно, досить ймовірним є те, що MORTвони можуть зв'язуватися прямо або непрямо. 1 також зв'язується з іншими білками, залучені в Зокрема, даний винахід подає послідовність внутрішньоклітинні сигнальні механізми. Ці ДНК, що вибирається з групи, яка включає: 23 74529 24 a) послідовність кДНК, похідну від сегменту, тей ДНК або білків, що кодуються ними, згідно з що кодує нативний білок G1; цим винаходом, при тому, що, окрім іншого, таке b) послідовності ДНК, здатні гібридизувати з використання передбачає таке: послідовністю (а) в умовах середнього степеня (A) Спосіб модулювання загибелі клітин або жорсткості і які кодують біологічно активний бізапальних процесів, що включає обробку зазначелок G1; і них клітин одним чи більшою кількістю білків G1, їх с) послідовності ДНК, які є виродженими внааналогів, фрагментів або похідних відповідно до слідок зміни генетичного коду в послідовностях цього винаходу, як описувалося вище, притому, ДНК, визначених в пп.(а) та (b) і які кодують біолощо зазначена обробка зазначених клітин включає гічно активний білок G1. внесення у зазначені клітини одного чи більшої Іншим спеціальним варіантом названої вище кількості білків, їх аналогів, фрагментів або похідпослідовності ДНК відповідно до цього винаходу є них у формі, підхожій для їх внутрішньоклітинного послідовність ДНК, що включає, принаймні, частивведення, або внесення у зазначені клітини нуклену послідовності, яка кодує, принаймні, одну з ізоотидної послідовності, яка кодує один чи більше форм білка G1. Інший варіант названої вище посчисло зазначених білків, їх аналогів, фрагментів чи лідовності ДНК - це послідовність, яка кодує білок похідних у формі підхожого вектору, що несе названу послідовність так, щоб зазначений вектор G1, поданий на Фіг.1 (ізоформа G1 ). Інший подіббув здатний забезпечувати включення названої ний варіант - це друга ізоформа білка G1, наведепослідовності у зазначені клітини таким чином, на на Фіг.2 (ізоформа G1 ). щоб названа послідовність експресувалась в заЦей винахід подає білки G1, їх аналоги, фрагзначених клітинах; і менти або похідні, які кодуються будь-якими з на(B) Спосіб модулювання загибелі клітин або званих вище послідовностей ДНК відповідно до запальних процесів, що включає обробку зазначецього винаходу, при тому, що зазначені білки, їх них клітин одним чи більшим числом інгібіторів аналоги, фрагменти або похідні здатні зв'язуватиодного чи більшої кількості білків/ферментів, які ся або взаємодіяти прямо чи непрямо з MORT-1 і опосередковують загибель зазначених клітин або (або) з будь-якими MORT1-зв'язними білками, тазапальні процеси, при тому, що зазначені інгібітокими, як, наприклад, Mch4 або MACH, і опосередри вибирають з групи, яка включає: (1) один чи ковувати внутрішньоклітинний ефект, опосередкобільшу кількість білків G1, їх аналогів, фрагментів ваний FAS-R чи p55-TNF-R, або активністю будьабо похідних відповідно до цього винаходу, здатні яких інших медіаторів чи індукторів цитотоксичносінгібувати загибель зазначених клітин або запальні ті, з якими названі білки G1, їх аналоги, фрагменти процеси; та (2) інгібітори одного чи більшої кількоабо похідні здатні прямо або непрямо зв'язусті білків G1 відповідно до цього винаходу, при ватися. тому, що зазначені один або більше число білків Спеціальний варіант цього винаходу пов'язаG1 зміцнюють/посилюють або опосередковують ний з білками G1, їх аналогами, фрагментами і загибель зазначених клітин або запальні процеси. похідними. Інший варіант подає будь-яку ізоформу Більш конкретно, названі вище способи відпобілка G1, їх аналоги, фрагменти і похідні. відно до цього винаходу включають такі спеціальні Також цим винаходом подаються вектори, коваріанти: дуючі названий вище білок G1 та його аналоги, 1) спосіб модулювання впливу ліганду FAS-R фрагменти або похідні відповідно до цього винаабо TNF на клітини, що несуть рецептори FAS-R ходу, що включають названі вище послідовності або p55-R, який включає обробку зазначених кліДНК відповідно до цього винаходу, так, що ці вектин одним чи більшою кількістю білків G1, їх анатори здатні експресуватись в підхожих прокаріотилогів, фрагментів або похідних відповідно до цього чних або еукаріотичних клітинах-хазяхнах; трансвинаходу, здатних зв'язуватися з MORT1формовані еукаріотичні або прокаріотичні клітинизв'язними білками, такими як Mch4 або MACH, хазяїни, що несуть такі вектори; і спосіб одержанпритому, що, в свою чергу, зв'язаний з ними ня білка G1 або його аналогів, фрагментів чи похіМОРТ-1 прямо зв'язується з внутрішньоклітинним дних відповідно до цього винаходу шляхом виродоменом FAS-R, або здатних зв'язуватися прямо щування таких трансформованих клітин-хазяїнів в або опосередковано з MORT-1 або з MORT1умовах, підхожих для експресії зазначеного білка, зв'язними білками так, як описане вище, при тому, його аналогів, фрагментів чи похідних і ефективщо в цьому випадку MORT-1 зв'язується з TRADD, них з точки зору посттрансляційних модифікацій який, в свою чергу, зв'язується з внутрішньоклізазначеного білка у випадку, якщо необхідно одетинним доменом p55-R, що завдяки цьому забезржувати зазначений білок і екстрагувати зазначепечує здатність модулювати/опосередковувати ний експресований білок, його аналоги, фрагменти активність зазначених рецепторів FAS-R або p55чи похідні з культурального середовища з зазнаR, при тому, що названа обробка зазначених кліченими трансформованими клітинами або з клітин включає внесення у зазначені клітин одного чи тинних екстрактів, одержаних з зазначених трансбільшої кількості білків, їх аналогів, фрагментів формованих клітин. Всі наведені визначення або похідних в формі, придатній для їх внутрішпередбачають включення всіх ізоформ білка G1. ньоклітинного введення, або внесення в зазначені В іншому варіанті цей винахід також подає анклітин послідовності ДНК, що кодує зазначені один титіла або їх активні похідні чи фрагменти, специчи більшу кількість білків, їх аналогів, фрагментів фічні відносно до білка G1, його аналогів, фрагмечи похідних у формі підхожого вектору, який несе нтів і похідних відповідно до цього винаходу. зазначену послідовність, так, що названий вектор В ще одному варіанті цей винахід подає різні здатний забезпечувати потрапляння зазначеної шляхи використання названих вище послідовнос 25 74529 26 послідовності в названі клітини таким чином, щоб ражених вірусом ВІЛ, чи з рецептором інших хвозазначена послідовність експресувалась в зазнарих клітин, а також послідовність, що кодує білок, чених клітинах; який вибирається з білка G1, його аналогів, фраг2) спосіб модулювання впливу ліганду FAS-R ментів і похідних відповідно до цього винаходу, або TNF на клітини згідно з п.(1), описаним вище, таким чином, що у разі експресії зазначені пухлинпри тому, що зазначена обробка клітин включає ні, ВІЛ-заражені або інші хворі клітини стають здавнесення в названі клітини зазначеного білка G1 тними знищувати названі клітини; і або його аналогів, фрагментів чи похідних у формі, (b) інфікування зазначених пухлинних або запридатній для внутрішньоклітинного введення або ражених вірусом ВІЛ клітин, чи інших хворих клітин внесення в названі клітини послідовності ДНК, що названим в п.(а) вектором; кодує зазначений білок G1 або його аналоги, фра7) спосіб модулювання впливу ліганду FAS-R гменти чи похідні у вигляді підхожого вектору, що або TNF на клітини, що включає застосування ринесе зазначену послідовність, так, щоб названий бозимної процедури, в якій вектор, що кодує рибовектор забезпечував попадання зазначеної послізимну послідовність, здатну взаємодіяти з клітиндовності в названі клітини таким чином, щоб заною послідовністю мРНК, яка кодує білок G1 значена послідовність експресувалась в зазначевідповідно до цього винаходу, вносять в зазначені них клітинах; клітини в такій формі, що дозволяє експресувати 3) спосіб згідно з п.(2), описаним вище, притозазначену рибозимну послідовність в названих му, що зазначена обробка названих клітин здійсклітинах, і при тому, що зазначена рибозимна поснюється шляхом трансфекції зазначених клітин лідовність експресується в зазначених клітинах рекомбінантим вірусним вектором, який включає так, що взаємодіє з зазначеною клітинною послітакі етапи: довністю мРНК та розщепляє зазначену послідов(а) конструювання рекомбінантного вектору віність мРНК, внаслідок чого відбувається інгібуванрусу тварини, що несе послідовність, яка кодує ня експресії зазначеного білка G1 в зазначених вірусний поверхневий білок (ліганд), який здатний клітинах; зв'язуватися з специфічним поверхнево-клітинним 8) спосіб, що вибирається з методів відповідно рецептором на поверхні клітин, які несуть рецепдо цього винаходу, при тому, що послідовність, яка тори FAS-R або p55-R, і другу послідовність, яка кодує зазначений білок G1, включає, принаймні кодує білок, що вибирається з білка G1, його анаодну з ізоформ G1, аналоги, фрагменти і похідні логів, фрагментів і похідних, так, що при експресії будь-якої з поданих винаходом форм, що здатні в зазначених клітинах забезпечується здатність до зв'язуватися прямо або непрямо з MORT-1 або з модуляції-опосередкування активності зазначених MORT1-зв'язними білками, такими, як, наприклад, FAS-R або p55-R; і Mch4 або MACH, при тому, що зв'язаний із ними (b) інфікування зазначених клітин названим в MORT-1, в свою чергу, специфічно зв'язується з п.(а) вектором; FAS-IC, або які здатні зв'язуватися прямо або не4) спосіб модулювання впливу ліганду FAS-R прямо з MORT-1 або названими вище MORT1або TNF на клітини, що несуть рецептори FAS-R зв'язними білками, при тому, що зв'язаний із ними або p55-R, що включає обробку зазначених клітин MORT-1, в свою чергу, зв'язується з TRADD або, в антитілами або їх активними фрагментами, або їх свою чергу, зв'язується з р55-ІС; похідними згідно з цим винаходом так, що зазна9) спосіб виділення та ідентифікації білків відчена обробка здійснюється шляхом внесення підповідно до цього винаходу, здатних зв'язуватися хожої композиції, яка включає зазначені антитіла, прямо або непрямо з білком MORT-1 або з їх активні фрагменти або їх похідні в зазначені MORT1-зв'язними білками, що включає застосуклітини, притому, що, коли, принаймні частина вання дигібридного дріжджового тесту, в якій посбілка G1 з'являється на поверхні клітини, зазначелідовність, що кодує зазначені білок MORT-1 або на композиція формується для позаклітинного MORT1-зв'язні білки, входить до складу одного застосування, а коли зазначені білки G1 повністю гібридного вектору, а послідовність з бібліотек внутрішньоклітинні, то зазначена композиція форкДНК або геномної ДНК входить до складу другого мується для внутрішньоклітинного внесення; гібридного вектору, притому, що вектори потім 5) спосіб модулювання впливу ліганду FAS-R використовують для трансформації дріжджових або TNF на клітини, що несуть FAS-R або p55-R, клітин-хазяїв і виділяються позитивні трансформоякий включає обробку зазначених клітин олігонуквані клітини з подальшим екстрагуванням зазналеотидною послідовністю, що кодує антисмислову ченого другого гібридного вектору з метою одерпослідовність відносно до, принаймні, частини жання послідовності, яка кодує білок, що послідовності білка G1 відповідно до цього виназв'язується з зазначеними білком MORT-1 або з ходу, притому, що зазначена олігонуклеотидна MORT1-зв'язними білками; послідовність здатна блокувати експресію біл10) спосіб згідно з будь-яким з пп.(1)-(9), опика G1; саних вище, при тому, що зазначений білок G1 є 6) спосіб за п.(2), описаному вище, для обрободнією з ізоформ G1, аналогом, фрагментом або ки пухлинних клітин, або клітин, інфікованих ВІЛ, похідним будь-якої з них; чи інших хворих клітин, який включає: 11) спосіб згідно з будь-яким з пп.(1)-(10), опи(a) конструювання рекомбінантного вектору вісаних вище, при тому, що білок G1 або будь-які з русу тварини, що несе послідовність, яка кодує його ізоформ, аналогів, фрагментів або похідних вірусний поверхневий антиген, здатний зв'язувазалучені в модулювання клітинного ефекту, опотися з специфічним рецептором поверхні пухлинсередковуваного або модульованого будь-яким них клітин або з рецептором поверхні клітин, заіншим цитотоксичним медіатором або індуктором, 27 74529 28 з яким зазначені білок G1, його ізоформа, аналог, (c) одержання зазначеного ліганду в достатньо фрагмент або похідна здатні зв'язуватися прямо ізольованому і очищеному вигляді; або непрямо; (5) спосіб ідентифікації і одержання ліганду, 12) спосіб скринінгу інших сполук, таких як, наздатного модулювати клітинну активність, модуприклад, пептиди, органічні сполуки, антитіла тольовану/опосередковану білком G1, що включає: що з метою одержання специфічних лікарських (a) скринінг ліганду, здатного зв'язуватися, препаратів, які були б здатні пригнічувати активпринаймні, з частиною послідовності G1 , поданої ність G1, наприклад, пригнічувати протеазну актина Фіг.1, або з послідовністю G1 , наведеною вність ізоформи G1 , пригнічуючи таким чином на Фіг.2; клітинну цитотоксичність або посилюючи цитоток(b) ідентифікація і охарактеризування ліганду, сичність за рахунок пригнічення активності G1 . окрім MORT-1 або MORT1-зв'язних білків чи часВаріанти названого вище способу скринінгу за тин рецептора, що входить в сімейство рецепторів п.(12) включають: TNF/NGF, знайденого за допомогою зазначеного (1) спосіб скринінгу ліганду, здатного зв'язуваетапу скринінгу за здатністю до зазначеного зв'ятися з білком G1 відповідно до цього винаходу так, зування; і як це було описано вище, який включає контакту(c) одержання зазначеного ліганду в по суті вання матриксу в афінній хроматографії, до якого ізольованому і очищеному вигляді; приєднаний зазначений білок, з клітинним екстрак(6) спосіб ідентифікації і одержання молекули, том так, що внаслідок цього ліганд зв'язується з здатної прямо або опосередковано модулювати зазначеним матриксом з подальшою елюцією, клітинну активність, модульовану/опосередковану виділенням і аналізом зазначеного ліганду; G1, який включає: (2) спосіб скринінгу послідовності ДНК, яка ко(a) скринінг молекули, здатної модулювати акдує ліганд, здатний зв'язуватися з білком G1 відтивність G1, що виявляється в модуляції опосереповідно до цього винаходу, що включає застосудкуванні; вання дигібридного дріжджового тесту, в якому (b) ідентифікація та охарактеризування зазнапослідовність, яка кодує зазначений білок, входить ченої молекули; і до складу одного гібридного вектору, а послідов(c) одержання зазначеної молекули в по суті ності з бібліотек кДНК або геномної ДНК входять ізольованому і очищеному вигляді; до складу другого гібридного вектору, з трансфор(7) спосіб ідентифікації і одержання молекули, мацією дріжджових клітин-хазяїв зазначеними векздатної прямо або непрямо модулювати клітинну торами з подальшим виділенням позитивних транактивність, модульовану/опосередковану білком сформованих клітин і екстрагуванням зазначеного G1 відповідно до цього винаходу, що включає: другого гібридного вектору з метою одержання (a) скринінг молекули, здатної модулювати акпослідовності, що кодує зазначений ліганд; тивність зазначеного білка G1, що виявляється в (3) спосіб ідентифікації і продукування ліганду, модуляції/опосередкуванні; здатного модулювати клітинну активність моду(b) ідентифікація і охарактеризування зазнальовану/опосередковану білком MORT-1 або ченої молекули; і MORT1-зв'язним білком, який включає: (c) одержання зазначеної молекули в по суті (а) скринінг ліганду, здатного зв'язуватися з ізольованому і очищеному вигляді. поліпептидом, що включає принаймні частину білЦей винахід також надає фармацевтичну комка MORT-1 або MORT1-зв'язних білків, що вибипозицію, призначену для модулювання впливу раються з білків MACH, білків Mch4 та інших ліганду FAS-R або TNF на клітини або впливу MORT1-зв'язних білків; будь-яких інших цитотоксичних медіаторів чи інду(b) ідентифікація та охарактеризування ліганкторів на клітини так, як це було описано вище, що ду, окрім MORT-1 або зазначених MORT1-зв'язних включають в якості активного інгредієнта один з білків чи частин рецептора, що входить в сімейстнаведених далі компонентів: во рецепторів TNF/NGF, знайденого за допомогою (і) білок G1 згідно з цим винаходом і його біозазначеного етапу скринінгу за здатністю до залогічно активні фрагменти, аналоги, похідні сумізначеного зв'язування; і шей; (c) одержання зазначеного ліганду в по суті (іі) рекомбінантний вектор вірусу тварини, що ізольованому і очищеному вигляді; кодує білок, здатний зв'язуватися на поверхнево(4) спосіб ідентифікації і одержання ліганду, клітинному рецепторі і який кодує білок G1 або здатного модулювати клітинну активність білка G1 його біологічні активні фрагменти чи аналоги згідвідповідно до цього винаходу, що виявляється в но з цим винаходом; модуляції або опосередкуванні, який включає: (ііі) олігонуклеотидну послідовність, що кодує (a) скринінг ліганду, здатного зв'язуватися з анти-смислову послідовність відносно до послідополіпептидом, що включає, принаймні, частину вності білка G1 відповідно до цього винаходу, при тому, що зазначений олігонуклеотид може бути послідовності G1 , наведеної на Фіг.1, або, придругою послідовністю в складі вірусного вектору наймні, частину послідовності G1 , наведеної згідно з п.(іі), описаним вище. на Фіг.2; Також (b) ідентифікація і охарактеризування ліганду, I. Спосіб модулювання MORT-1-індукованого окрім MORT-1 або MORT1-зв'язних білків чи часвпливу або MORT1-зв'язним білково-індукованого тин рецептора, що входить в сімейство рецепторів впливу, або впливу будь-якого іншого цитотоксичTNF/NGF, знайденого за допомогою зазначеного ного медіатора чи індуктора на клітини, який вклюетапу скринінгу за здатністю до зазначеного зв'ячає обробку зазначених клітин згідно з способом зування; і 29 74529 30 за будь-яким з пп.(1)-(10), описаних вище з виконадаються, виходячи з поданого нижче докладнористанням білків G1, їх аналогів, фрагментів чи го опису цього винаходу. похідних або з використанням послідовностей, що Слід зазначити, що, по мірі використання, такі кодують білки G1, їх аналоги або фрагменти, при терміни - "модулювання впливу FAS-ліганду або тому, що зазначена обробка веде в результаті до TNF на клітини" і "модулювання впливу MORT-1 підсилення або пригнічення названого впливу, або MORT1-зв'язного білка на клітини" - розумівикликаного MORT-1, і таким чином впливу, опоються як такі, що стосуються впливу як in vitro, так середковуваного рецепторами FAS-R і p55-R, або і in vivo, а, крім того, також передбачають і пригнізазначених інших цитотоксичних медіаторів чи чення (інгібування), та підсилення/зумовлювання. індукторів. Фіг.1А є схематичним зображенням первинної II. Спосіб згідно з описаним вище, при тому, нуклеотидної послідовності, що кодує одну з ізощо зазначені білок G1, його аналог, фрагмент чи форм білка G1, докладно описаної в прикладі 1. похідна є тією частиною білка G1, яка специфічно Фіг.1В є схематичним зображенням розшифбере участь в зв'язуванні з MORT-1 або з MORT1рованої амінокислотної послідовності ізоформи, зв'язними білками, або з зазначеними іншими циподаної на Фіг.1А. тотоксичними медіатором чи індуктором, або при Фіг.2 є схематичним зображенням первинної тому, що зазначена послідовність білка G1 кодує нуклеотидной послідовності і розшифрованої аміту частину білка G1, що специфічно бере участь в нокислотної послідовності другої ізоформи білка зв'язуванні з MORT-1 чи з MORT1-зв'язними білG1, докладно описаної в прикладі 1. ками, або з іншими цитотоксичними медіатором Фіг.3 є схемою порівняння амінокислотних поабо індуктором. слідовностей сплайсингових варіантів білка G1 III. Спосіб згідно з описаним вище, при тому, (або CASH) людини (hCASH , hCASH ) і миші що зазначений білок G1 є будь-якою з ізоформ G1, (CASH ), а також консервативних мотивів, знайа зазначені ізоформи здатні посилювати пов'язадених в складі цих білків. На Фіг.3 здійснене параний з MORT-1 вплив або зв'язаний з іншими цитолельне зіставлення амінокислотних послідовностоксичними медіатором або індуктором вплив, тей G1 миші (mCASH ) , G1 людини (hCASH ) завдяки цьому також посилюючи вплив на клітини, та G1 (hCASH ) , CASP-8 (MACH/FLICEl/Mch5), зв'язані з рецепторами FAS-R або p55-R, або CASP-10 (Mch4/FLICE2), CASP-3 вплив на клітини іншого цитотоксичного медіатора (СРР32/апопаїн/Yаmа) і CASP-1 (ICE). CASP-1 і або індуктора. CASP-3 показані без їх продоменних сегментів. В IV. Спосіб згідно з описаним вище, при тому, кожнійпослідовності амінокислотні залишки прощо білок G1 є будь-якою, з ізоформ G1, а зазначенумеровані справа. Переривчасті лінії вказують на ні ізоформи здатні пригнічувати вплив, пов'язаний розриви послідовностей, зроблені з метою оптиміз MORT-1, або пов'язаний з іншим цитотоксичним зації зіставлення. Затінені модулі "загибельмедіатором чи індуктором вплив на клітини, завдядоменів" (DED). Обведені амінокислоти, що виявки цьому також пригнічуючи вплив на клітини, зв'яляються ідентичними більш ніж в трьох білках. В заний з рецепторами FAS-R або p55-R, або вплив межах ділянок "протеазної гомології" амінокислона клітини іншого цитотоксичного медіатора або ти, зіставлені з залишками в складі CASP-1 так, індуктора. що їх участь в забезпеченні каталітичної активносЯк видно з всього сказаного вище, а також і з ті була підтверджена з застосуванням кристалогдокладного опису нижче, G1 також може викорисрафічної рентгенографії, позначені так: залишки, товуватись поза зв'язком з білком MORT-1 з метою які, як припускають, беруть участь в каталізі і відобробки (лікування) клітин або тканин. Виділення повіді-дають гістидину-237 та цистеїну-285 в склабілків G1, їх ідентифікація і характеристика можуть ді CASP-1, інтенсивно затемнені та позначені заздійснюватись за допомогою будь-якої з стандартбарвленими колами під стовпчиком зіставлення. них пошукових технологій, що використовуються Залишки, що утворюють карман зв'язування для для виділення та ідентифікації білків, наприклад, карбоксилатного бокового ланцюга Pl-Asp і відпоза допомогою дигібридного дріжджового тесту, відають аргініну-179, глутаміну-238, аргініну-341 і методів афінної хроматографії і будь-яких інших серину-347 в складі CASP-1, затемнені менше і добре відомих стандартних процедур, які застосопозначені незабарвленими колами. Відомі і вияввуються для подібних цілей. лені в експериментах сайти розщеплення по Asp-X Більше того, деякі ізоформи білка G1 можуть і сайти потенційного розщеплення, знайдені в одвключати лише протеазоподібний сегмент (що накових положеннях в G1 (CASH), затінені. Горивиявляє гомологію з описаними вище протеазними зонтальні стрілки вказують на N- та С-термінальні сегментами в складі інших відомих протеаз), але кінці малої і великої субодиниць CASP-1. С-кінці за відсутності реальної протеазної активності, білків позначені зірочками. внаслідок чого такі ізоформи можуть служити в Фіг.4 (А і В) відтворюють авторадіограми, одепершу чергу в якості інгібіторів так, як це було опиржані в ході ідентифікації транскриптів G1 за досано вище. помогою методу Нозерн-блотингу в різних тканиДалі, оскільки G1 або будь-яка з його ізоформ нах людини (серце, головний мозок, плацента, можуть бути втягнуті в модуляцію внутрішньоклілегені, печінка, скелетні м'язи, нирки, підшлункова тинних механізмів, не зв'язаних з MORT-1, то G1 залоза, селезінка, тимус, простата, сіменники, яєабо будь-яка з його ізоформ можуть використовучники, тонкий кишечник, товстий кишечник і лімватись для модулювання сигналів в будь-яких інфоцити периферійної крові-PBL). Тестування із ших внутрішньоклітинних шляхах і механізмах. застосуванням методу Нозерн-блотингу проводиІнші аспекти і варіанти цього винаходу також лось так: помічений ізотопно зонд мРНК, що відпо 31 74529 32 відає "загибель-домену" (DED) в складі G1 (згідно тестували їх за допомогою фазо-контрастного мікроскопу. В усіх проілюстрованих експериментах з нуклеотидами 482-1070 в складі G1 [див. Фіг.2], загибель клітин оцінювали через 24 години після тобто сегменту, спільному для обох клонованих трансфекції клітин HeLa-Fas і через 20 годин після сплайсингових варіантів G1 [CASH]), був одержатрансфекції клітин 293-Т. Наведені дані (середнє ± ний з використанням РНК-полімерази Т7 S.D.; n усереднено принаймні по трьом експери(Promega) і застосований для аналізу множинних ментам) є відсотком забарвлених в синій колір тканинних точок людини (Clontech), які включають клітин, які підраховують з урахуванням демонполі(А)+-РНК (2мкг на одну лінію), що походять з страції ними блебінгу ("пухирчастості") мембран. різних тканин людини. Цей винахід в одному з своїх аспектів стосуФіг.5 є схематичним поданням результатів ється нових білків G1, що здатні зв'язуватися або аналізу взаємодії G1 (CASH ) і G1 (CASH ) з взаємодіяти прямо чи непрямо з MORT-1 або з іншими білками, що включають "загибель-домени" MORT1-зв'язними білками, такими, як, наприклад, (DED) в трансфікованих клітинах дріжджів - наприMch4 або MACH, завдяки цьому, зв'язуючись з клад, MORT-1/FADD, MACH 1 (CASP-8 1), внутрішньоклітинним доменом рецептора FAS-R, з MACH 1 (CASP-8 1), MACH 4 (CASP-8 4), Mch4 яким зв'язується MORT-1, або, зв'язуючись з внут(CASP-10), G1 (CASH ), G1 (CASH ), p55-R рішньоклітинним доменом рецептора p55TNF-R, з (p55-IC), TRADD, RIP та ламін (як негативний коняким зв'язується білок TRADD, з яким, в свою чертроль). Параметри зв'язування G1 (CASH ) , так гу, зв'язується білок MORT-1. Відповідно, білки G1 само як і G1 (CASH ), були оцінені в репортерзгідно з цим винаходом розглядаються в якості ному штамі дріжджів SFY526 (Clontech) з викорисмедіаторів або модуляторів FAS-R, відіграючи затанням ДНК-зв'язувального домену в складі вектовдяки цьому роль, наприклад, в сигнальних мехара pGBT9-GAL4 і активаторних доменів в складі нізмах, що ініціюються зв'язуванням ліганду FAS з векторів pGAD1318 і pGADGH-GAL4. Кількісний рецептором FAS-R, a також відіграючи роль в сиганаліз зв'язування в клітинах дріжджів в тесті по нальних механізмах, що ініціюються зв'язуванням експресії -галактозидази був проведений так, як TNF на рецепторі p55-R. До групи білків G1 відпоце описано в прикладах-посиланнях 1-3. Одержані відно до цього винаходу включено новий білок G1 результати виражені в часі, необхідному для одета його ізоформи. ржання чіткого забарвлення. В усіх тестованих Більш конкретно, згідно з цим винаходом повипадках ідентичні результати були одержані тоді, дано новий білок G1 (який також називається коли тестовані нуклеотидні вставки були приміщеCASH), який, очевидно, є гомологом протеази ні в обох комбінаціях в межах ДНК-зв'язувального CED3 нематоди. Цей новий білок G1, хоча і є блидомену і конструкцій активаторного домену плаззькоспорідненим, при цьому виявляє певні відзнамід. Жодна з тестованих вставок не взаємодіяла з ки щодо структури і субстратної специфічності: рядом контрольних білків, включаючи внутрішньовідповідно, він може виконувати якоюсь мірою віклітинні домени p55-R (CD120a), p75-R (CD120b), дмінні функції в клітинах ссавців. Дійсно, відомі CD40, ламін, і порожні GALA вектори. два різних типи активності протеаз. Основною фуФіг.6 (Α-D) подає результати оцінки впливу мункцією ICE (що також називається CASP-1) здатантних варіантів G1 (CASH ), G1 (CASH ) і ється процесування попередника IL-1 , в той час G1 (CASH ) на життєздатність клітин та індукцію як для CED3 було чітко показане функціонування в клітинної загибелі. Кількісний аналіз загибелі кліякості ефектора запрограмованої клітинної загитин, індукованої в клітинах HeLa-Fas (дані схемабелі. Ця остання функція також, як вважається, є тично показані у вигляді діаграми на Фіг.6А) і в функцією, принаймні, деяких гомологічних білків клітинах 293-Т (дані схематично подані у вигляді ссавців, наприклад, деяких ізоформ білків MACH діаграми на Фіг.6В і 6С) шляхом трансфекції цих (що також називаються CASP-8), описаних в наклітин визначеними конструкціями, був проведезваних вище спільних, перебуваючих на стадії ний так, як це описано в Прикладі 1. Клітини (5 105 розгляду патентних заявках, а також згаданих ви5 клітин 293-Т або 3 10 клітин HeLa в розрахунку ще споріднених білків Мсh4 (що також називаютьна 6-сантиметрові чашки) були у перемежувалься CASP-10) , з якими білок G1 відповідно до цього ний спосіб трансфіковані з використанням кДНК винаходу зв'язується. Амінокислотна послідовність певних білків разом з плазмідою pCMV- G 1 за МАСН 1 показує тісну спорідненість з СРР32 (що допомогою методу осадження в розчині фосфату також називаються CASP-3), який є найбільш бликальцію. Кожну чашку трансфікували 5мкг конструзьким з відомих гомологом ссавців CED3. Субкції р(кДНК); якщо ж трансфекція здійснювалася стратна специфічність MACH також схожа з такою двома диференційованими конструкціями, то по у СРР32, за винятком того, що МАСН 1, по2,5мкг кожної з них плюс 1,5мкг вектора, що ексвидимому, характеризується більш обмеженою пресує -галактозидазу. Клітини промивали протясубстратною специфічністю порівняно з СРР32. гом 6-10 годин після трансфекції і потім інкубували Протеаза СРР32 більш прийнятно розщепляє пепще 14 годин без додаткової обробки. Моноклонатиди, що є субстратом, по відповідному сайту в льне антитіло до CD95 (анти-FAS-R) (СН11 [Oncor, складі полі-(АДФ-рибозо)-полімерази (PARP), а Gaithersburg, MD], 0,5мкг/мл) і рекомбінантний також ще виявляє протеолітичну активність відноTNF людини (100нг/мл) були додані до клітин сно до пептидів, що відповідають сайту розщеподночасно разом з циклогексимідом (10мкг/мл) з лення протеазою ICE в складі попередника інтерподальшою інкубацією протягом ще 4 годин. Потім лейкіну-1 . Однак, як здається, МАСН 1 здатна клітини забарвлювали з використанням 5-бром-4розщепляти винятково PARP-відповідну послідовхлор-3-індоксил- -D-галактопіранозиду (X-G 1) й ність. Таке співвідношення МАСН 1 з СРР32 і 33 74529 34 CED3 та відсутність його схожості з ICE відповідає механізмів дії зв'язаних з рецепторами білків, які мають інші каталітичні властивості, здається ймотому припущенню, що МАСН 1 подібно до CED3 є вірним, що зв'язування G1 з Мсh4 або G1 з MACH регулятором клітинної загибелі. МАСН 1 у той же (або ізоформою МАСН 1) і, в свою чергу, зв'язучас виявляє ряд параметрів послідовності, які відвання Мсh4 або MACH з MORT-1, або ж пряме різняють його від CED3 і від СРР32, так само як і зв'язування G1 з MORT-1 дозволяє стимулювати від інших членів сімейства CED3/ICE. С-кінцева протеазну активність G1 і (або) Meh і (або) MACH в частина МАСН 1, розташована вище його ділянки, ході зв'язування FAS-ліганду на рецепторі FAS-R. гомологічної CED3/ICE, показує відсутність будьТакож це може дозволяти активувати протеазу якої схожості з всіма аналогічно розташованими рецептором p55-R за рахунок зв'язування MORT-1 сегментами будь-якого з відповідних гомологів. з TRADD, який, в свою чергу, зв'язується з p55-R. Крім того, є і ряд унікальних характеристик посліДля інших членів сімейства протеаз CED3/ICE довності і в межах сегменту гомології з протеазами був виявлений прояв повної своєї активності лише сімейства CED3/ICE. Наявність таких відмінностей після протеолітичного процесингу, який відбувапідтверджує, що МАСН 1 належить до відокремється або шляхом саморозщеплення, або під леної еволюційної гілки даного сімейства і що його впливом протеаз цього ж сімейства (огляд Kumas, участь в контролі клітинної загибелі певною мірою 1995; Henkart, 1996). Наприклад, як це було довідрізняється від такого, описаного раніше для кладно описано в названих вище спільних, перегомологів з сімейства CED3/ICE. Також білок G1 буваючих на стадії розгляду патентних заявках в відповідно до цього винаходу і його ймовірні ізозв'язку з MACH, цитотоксична дія внаслідок коформи показують деякі чіткі відмінності в межах експресії двох основних продуктів МАСН 1, що сегменту гомології з протеазами CED3/ICE в склапотенційно саморозщепляються, на протилежність ді послідовності G1, а раз так, то такі відмінності відсутності цитотоксичності в клітинах у випадку можуть представляти унікальні характеристики, експресії повнорозмірної ділянки гомології що відбивають специфічність активності G1 в кліCED3/ICE, погоджується з ймовірністю того, що тинах ссавців. МАСН 1 також виявляє свою повну активність Одна важлива відмінність може стосуватися тільки після процесингу. Ферментна активність, що механізму, за яким здійснюється регулювання спостерігається в лізатах бактерій, які експресують протеази. Будучи втягнутою і в онтогенетично реповно-розмірний сегмент, по-видимому, відбиває гульовані процеси клітинної загибелі, і в індукованаявність автопроцесингу даного білка, що відбуний рецепторами імунний цитоліз, розщеплення вається в таких умовах, або процесингу, здійснюбілків протеазами сімейства CED3/ICE має піддаваного деякими бактеріальними протеазами. Доки ватись регулюванню як сигналами, що формуютьнеясно, за яким механізмом такий процесинг прося всередині клітини, так і сигналами, що прихотікає в клітинах ссавців і як він може здійснюватидять з рецепторів, які знаходяться на зовнішній ся при опосередкуванні рецепторами FAS-R і p55поверхні клітини. В онтогенетичних процесах кліR, а також доки ще точно не визначено, яким є тинної загибелі активація таких протеаз, як припускають, включає механізми, що впливають на ексвідносний внесок протеаз-ної активності МАСН 1 пресію генів, внаслідок чого відбувається в цитотоксичність, яка індукується FAS-R і TNF. підсилення синтезу цих протеаз, так само як і зниОцінка такого внеску ускладнена тим, що має місження інтенсивності синтезу деяких білків, таких як це також експресія MACH 1, в складі якої відсутній BCL-2, який є антагоністом апоптотичної індукції. сегмент гомології з CED3/ICE, яка веде до вираОднак це точно не відповідає випадку, коли цитоженої цитотоксичності. Мабуть, такий прояв цитотоксичність опосередковується рецепторами FASтоксичності відбиває здатність MACH 1 зв'язуваR або TNF-R. Клітини можуть бути знищені за учатися з МАСН 1. Через таку здатність стю ліганду TNF-R або FAS-R навіть тоді, коли трансфіковані молекули MACH можуть внаслідок активність білкового синтезу всередині них повнісагре-гованості призводити до конформаційних змін тю заблокована (в дійсності вони можуть бути молекул МАСН 1, що є загрозливим для трансфізнищені в цьому випадку з більшою ефективністю) кованої клітини. Такий механізм може також зумоі залишаються стимуло-залежними і в таких умовлювати цитотоксичність, що спостерігається тоді, вах. Активація протеаз сімейства CED3/ICE рецепколи в клітинах надекспресовані молекули, які діторами TNF і FAS-R також може відбуватися по ють до MACH (білки MORT1, TRADD або "загимеханізму, який є незалежним від білкового синтебель-домени" в складі або p55-R, або FAS-R). В зу. Унікальні параметри послідовності МАСН 1 той самий час, однак, не можна виключити того, можуть дозволити йому брати участь в роботі тащо цитотоксичність, яка спостерігається при індуккого механізму. У подібний спосіб унікальні харакції експресії MACH або молекул, що діють до її теристики послідовності білка G1 відповідно до прояву, також відбиває, окрім протеолітичної актицього винаходу також погоджуються з його ймовівності гомологічного CED3/ICE сегменту в складі рною здатністю брати участь в роботі такого мехаMACH, активацію деяких інших механізмів, які, як нізму. припускають, беруть участь в цитотоксичному Таким чином, новий білок G1 може бути ще прояві FAS-R і p55-R (наприклад, активацію нейтодним членом недавно виявленої групи протеаз, ральної або кислої сфінгомієліназ). Також не можщо включає названу вище протеазу MACH (і її на виключати і того, що протеолітична активність ізоформи) та Мсh4, для яких була встановлена сегменту гомології CED3/ICE служить іншим функзв'язність, або прямо, або через білок-адаптор, з ціям, окрім індукції цитотоксичності. Для більш внутрішньоклітинним доменом поверхневочіткого розуміння функції МАСН 1 необхідно було клітинного рецептора. Відповідно до взаємодії 35 74529 36 б ідентифікувати ендогенні білкові субстрати, які ту, ця ізоформа, яка діє як інгібітор сигнальних механізмів клітинної загибелі. розщепляються внаслідок активації МАСН 1. ВідЧерез унікальну здатність рецепторів FAS-R і криття шляхів порушення активності МАСН 1, TNF-R зумовлювати клітинну загибель, так само як наприклад, шляхом експресування молекулі здатність рецепторів TNF опосередковувати різні інгібіторів, також може внести вклад в розуміння інші типи активності, пов'язані з пошкодженням функцій цього білка і завдяки цьому сприяти з'ясутканин, порушення функцій цих рецепторів може ванню шляхів регулювання його активності, якщо мати негативні наслідки для організму. Дійсно, для це є бажаним. обох типів функцій цих рецепторів - надлишкової і Відповідно, білок G1 відповідно до цього винанедостатньої - була продемонстрована участь в ходу і його ймовірні ізоформи можуть бути активпатологічних проявах різних захворювань. Ідентиними в аналогічному ключі у порівнянні з вище фікація молекул, які беруть участь в сигнальній зазначеними білками MACH за наявності або відактивності цих рецепторів, і відкриття шляхів мосутності прямої взаємодії з іншими білками, а саме дулювання функцій цих молекул являє собою моG1 може діяти прямо шляхом зв'язування з MORTжливий ключовий прийом, необхідний для нових 1 або діяти непрямо через зв'язування з Мсh4 і лікувальних методологій відносно до таких захво(або) MACH і, в свою чергу, шляхом зв'язування рювань. З точки зору передбачуваної важливої Мсh4 і (або) MACH з MORT-1 або згідно з іншим, ролі G1 в токсичності, що зумовлюється участю доки ще точно не встановленим механізмом, спеFAS-R і TNF, вважається, зокрема, важливим цифічним для білка G1. У подібний спосіб регулюстворити ліки, які могли б блокувати протеолітичну вання активності G1 може бути аналогічною тій, функцію таких молекул, що раніше було виконано що раніше була охарактеризована для білків відносно до інших представників сімейства протеMACH. аз CED3/ICE. Унікальні параметри послідовності Таке може існувати всередині клітин, які ексгомологічного CED3/ICE сегменту в складі G1 мопресують природні інгібітори G1 відносно до прожуть дозволити створювати ліки, які б порушували теазної активності, що виявляється цим білком. їх захищеність від цитотоксичності, що зумовлюІснування ізоформ, які утворюються внаслідок ється надлишковою імунною активністю, без поальтернативного сплайсингу, характерних для рушення фізіологічних процесів загибелі клітин, в інших членів сімейства CED3/ICE, було визначене які втягнуті інші члени сімейства CED3/ICE. як фактор фізіологічного обмеження функцій цих Як відзначалося вище, G1 або будь-які з його протеаз. Для деяких з ізоформ таких інших протеізоформ також можуть бути втягнуті в модулюваназ повідомлялось про їх активність в якості прироня інших внутрішньоклітинних сигнальних механідних інгібіторів повнорозмірних ізоформ, що, певзмів, таких як, наприклад, дія інших цитотоксичних но, зумовлюється формуванням неактивних медіаторів або індукторів чи інших білків, діючих гетеродимерів між ними. Це може бути справедпоза залежністю від зв'язування з MORT-1 або з ливим також і для G1 та його деяких ймовірних MORT1-незалежно-зв'язними білками. Далі, G1 ізоформ, наприклад, таких ізоформ, в яких потенабо, принаймні, його ізоформи, які включають проційний N-кінцевий сайт розщеплення відсутній. теазо-подібний сегмент, але без реальної протеаЕкспресія таких інгібіторних ізоформ може визназної активності, можуть бути втягнуті в первинну чати роботу механізму клітинного самозахисту інгібіторну функцію: тобто пригнічувати ті механізпроти цитотоксичності, що зумовлюється FAS-R і ми (наприклад, сигнальні механізми в загальних TNF. або цитотоксичних механізмах), в яких G1 або його G1 може мати ще й інші функції: наприклад, ізоформи беруть участь або шляхом прямого зв'яG1 або будь-яка з його ізоформ можуть справляти зування з учасниками цих механізмів, або шляхом вплив посилення або зміцнення на інші білки, які непрямого зв'язування з іншими білками, які, в мають ферментну активність, наприклад, на просвою чергу, зв'язуються з учасниками цих механітеолітичну активність різних ізоформ Mch4 і змів. MACH; така підсилювальна або зміцнююча активОтже, цей винахід також стосується послідовність здійснюється за механізмом, в якому G1 виності ДНК, що кодує білок G1, і білків G1, які кодуступає в якості індуктора зв'язування інших білків з ються такими послідовностями ДНК. MORT-1 (наприклад, білків Мсh4 і MACH). Крім Більше того, цей винахід також стосується потого, G1 або будь-яка з його ізоформ також можуть слідовностей ДНК, які кодують біологічно активні відігравати роль, не пов'язану з цитотоксичністю, аналоги, фрагменти і похідні білка G1, так само як але можуть виступати в якості "притулку" для моі аналоги, фрагменти і похідні, що ними кодуються. лекул (т. зв. "депо-сайта") , які залучені в дію FASОдержання таких аналогів, фрагментів і похідних R і TNF, не пов'язану з проявом цитотоксичності. проводиться за допомогою стандартних методик Деякі з специфічних ізоформ G1 відповідно до [див., наприклад, методичний посібник Sambrook цього винаходу проілюстровані нижче в прикладі et al., 1989], за допомогою яких в послідовностях 1. Одна з них G1 , (CASH ), - виділена у людини й ДНК, які кодують білок G1, один чи більше число миші (відповідно, hG1 /hCASH і mG1 /mCASH ), кодонів може бути делетоване, додане або заміочевидно, являє собою 1мг варіанту сплайсингу, нене іншими з подальшим одержанням аналогів, що включає протеазний гомологічний сегмент і, що мають, принаймні, одну заміну амінокислотнопринаймні, в деяких типах клітин (наприклад, в го залишку порівняно з нативним білком. клітинах 293Т) має цитотоксичну активність. Інша Поліпептид або білок, який "по суті відповідає" ізоформа, позначена G1 (CASH ), виділена у білку G1, включає не тільки білок G1, але також і людини, по-видимому, є коротким варіантом поліпептиди або білки, що є аналогами G1. сплайсингу без протеазного гомологічного сегмен 37 74529 38 Met Leu; Tyr; Ile Аналогами, які істотною мірою відповідають Phe Met; Leu; Tyr білку G1, є поліпептиди, в складі яких одна чи біSer Thr льше число амінокислот нативної амінокислотної Thr Ser послідовності G1 заміщені іншою амінокислотою, Trp Tyr делетовані і (або) вставлені, внаслідок чого одерTyr Trp; Phe жуваний білок виявляє по суті такий самий або Val Ile; Leu більший рівень біологічної активності порівняно з білком G1, якому він відповідає. З іншого боку, інша група заміщень в складі З метою забезпечення відповідності білку G1 білка G1 подана такими заміщеннями, коли припо суті зміни в амінокислотній послідовності білків наймні один амінокислотний залишок в складі поG1, таких як його ізоформи, повинно бути відносно ліпептиду вилучається і інший залишок вноситься невеликим. Хоча кількість замін може бути більше на його місце згідно з таблиці 1В. Типи заміщень, десяті, більш прийнятно, щоб вона не перевищущо можуть здійснюватись в складі поліпептиду, вала десяти замін, ще більш прийнятно, щоб чисможуть ґрунтуватися на аналізі частоти амінокисло замін не було більше п'яти, а найбільш прийнялотних замін між гомологічними білками у різних тно - не більше трьох таких замін. При тому, що видів організмів, такі як ті, що подані в таблицях 1будь-які методики можуть використовуватись для 2 [у Schuiz et al., 1978, Principles of Protein виявлення біологічно активних білків, які істотною Structure, Springer-Verlag, New York, NY, і на мал.3мірою відповідають білкам G1, одним з таких ме9 у Creighton Т. Є., 1983, Proteins: Structure and тодів є використання стандартної процедури мутаMolecular Properties, Freeman & Co., San Francisco, генезу відносно до ДНК, що кодує білок, з одерCA]. Ґрунтуючись на подібних аналізах, альтернажанням в результаті малого числа модифікацій. тивні консервативні заміщення визначені тут як Білки, які експресуються такими клонами, потім заміни в межах однієї з таких п'яти груп: можуть піддаватись скринінгу за їх здатністю зв'язуватися з різними MORT1-зв'язними білками, таТаблиця 1В кими, як, наприклад, Mch4 і MACH, або навіть прямо з MORT-1, і (або) за їх FAS-R - і р55-R1 Маленькі аліфатичні, неполярні або слабополярні опосередковувальній активності та (або) здатності залишки: Ala, Ser, Thr (Pro, Gly) опосередковувати активність будь-яких інших вну2 Полярні, негативно заряджені залишки та їх аміди: трішньоклітинних механізмів у такий спосіб, як це Asp, Asn, Glu, Gln 3 Полярні, позитивно заряджені залишки: His, Arg, Lys було описано вище. 4 Великі аліфатичні неполярні залишки: Met, Leu, Ilе, Під "консервативними" змінами розуміють ті Val (Cys) зміни, які, як очікується, не повинні змінювати ак5 Великі ароматичні залишки: Phe, Туr, Trp тивність білка і які зазвичай піддаються скринінгу в першу чергу, оскільки вони, як очікується, не призТри амінокислотні залишки, взяті в наведеній водять до істотної зміни розміру, заряду або конвище таблиці в дужки, характеризуються специфіфігурації даного білка і, отже, як також очікується, чною роллю в просторовій архітектурі білків. Гліне призводять до зміни його біологічних властицин є єдиною амінокислотою, позбавленою будьвостей. якого бокового ланцюга і таким чином забезпечує Консервативні заміщення в білках G1 включарухливість ланцюга. Це, однак, має тенденцію до ють такий аналог, в якому, принаймні, один аміноутворення будь-якої іншої вторинної структури, кислотний залишок в складі поліпептиду заміщеокрім -спіральної. Пролін завдяки своїй незвиний у консервативний спосіб іншою чайній геометрії забезпечує щільність упаковки амінокислотою. Більш прийнятно виконувати такі ланцюга і в принципі забезпечує тенденцію до заміщення згідно з переліком, наведеним в таблиутворення структур типу -площин, хоча в деяких ця 1А: такі заміщення можуть бути визначені шлявипадках залишок цистеїну може приймати участь хом рутинного експериментування з метою одерв утворенні дисульфідних зв'язків, що важливі для жання модифікованих структурних і просторової складчастості білка. Слід зазначити, функціональних характеристик синтезованої поліщо цитований вище Schulz et al. об'єднував назвапептидної молекули при підтриманні біологічної ні вище групи 1 і 2. Треба зазначити також, що активності, характерної для білка G1. тирозин, завдяки його потенціалу до утворення Таблиця 1А водневого зв'язку, виявляє істотну спорідненість з серином і треоніном, тощо. Вихідний залишок Приклади заміщення Консервативні амінокислотні заміщення згідно Ala Gly; Ser з цим винаходом, наприклад, такі, що описані виArg Lys ще, добре відомі в даній галузі техніки і, як очікуAsn Gin; His ється, повинні підтримувати біологічні і структурні Asp Glu властивості даного поліпептиду після заміщення Cys Ser амінокислот. Більшість делецій і замін згідно з цим Gin Asn винаходом є такими, що не призводять до радикаGlu Asp льних змін характеристик даного білка або поліпеGly Ala; Pro птидної молекули. Під "характеристиками" розуміHis Asn; Gin ються як зміни у вторинній структурі, наприклад, Ile Leu; Val наявність α-спіралей або -площин, так і зміни в Leu Ile; Val Lys Arg; Gln; Glu біологічній активності, наприклад, зв'язування з 39 74529 40 MORT1-зв'язними білками чи з MORT-1, або опоMORT1-зв'язними білками або навіть такі ж або середкування впливу на клітини ліганду FAS-R чи кращі властивості щодо зв'язування з MORT-1 і TNF. такі ж або кращі характеристики відносно до сигПриклади проведення амінокислотних замін в нальних механізмів порівняно з природними білскладі білків, що можуть використовуватись для ками G1. одержання аналогів білків G1 для використання в На генетичному рівні ці аналоги в принципі цьому винаході, включають будь-які відомі методи, одержують шляхом сайт-спрямованого мутагенезу такі як наведені [в патентах США RE-33653, відносно нуклеотидів в складі ДНК, що кодує білок 4959314, 4588585 і 4737462 у Mark et al.; 5116943 G1, завдяки цьому одержуючи ДНК, яка коду дау Koths et al.; 4965195 у Namen et al.; 4879111 у ний аналог, з подальшим синтезом цієї ДНК і ексChong et al.; і 5017 691 у Lee et al.; та лізинпресією рекомбінантного поліпептиду в клітинній заміщені білки, подані патентом США 4904584 культурі . Як правило аналоги виявляють такі ж (Shaw et al.)]. або покращені якісні показники біологічної активОкрім консервативних заміщень, що обговоності порівняно з білком, що трапляється в прирорювалися вище, які не повинні скільки-небудь істоді: [Ausubel et al., 1987-1995, Current Protocols in тно змінювати активність білка G1, та консерватиMolecular Biology, Greene Publ. & Wiley Intersci., вні заміщення, і менш консервативні і "більш New York, NY; Sambrook et al., 1989, Molecular випадкові" зміни, що ведуть до збільшення біологіCloning: A Laboratory Manual, Cold Spring Harbor чної активності аналогів білків G1, також входять Lab., Cold Spring Harbor, NY]. до обсягу цього винаходу. Приготування білка G1 згідно з викладеним тут Коли треба визначити точний прояв заміщення або альтернативної нуклеотидної послідовності, або делецій, фахівцю в цій галузі техніки повинно що кодує такий самий поліпептид, яка відрізняєтьбути ясно, що такий прояв заміщення (заміщень), ся від природної послідовності через зміни, що делецій (поділів) тощо може оцінюватись за доповраховують відому виродженість генетичного коду, могою стандартних тестів на зв'язування і загиможе здійснюватись шляхом сайт-специфічного бель клітин. Проведення скринінгу з використанмутагенезу ДНК, яка кодує раніше приготований ням таких стандартних тестів не включає будьаналог або нативний варіант білка G1. Сайтяких непідхожих експериментів. специфічний мутагенез дозволяє одержувати анаПрийнятними аналогами є ті з них, які зберігалоги шляхом використання специфічних олігонукють, принаймні, здатність зв'язування з MORT1леотидних послідовностей, що кодують послідовзв'язними білками, як це відзначалося вище, або з ність ДНК з бажаною мутацією, а також достатнє MORT-1, чи з іншими білками, завдяки цьому згідчисло сусідніх нуклеотидів з одержанням затравно з описаним вище опосередковуючи активність кової послідовності достатнього розміру і складнорецепторів FAS-R і p55-R або інших білків, які було сті, необхідних для утворення стабільного дуплекназвано вище. Таким чином, можуть бути одержані са по обидві сторони від делеційного з'єднання, аналоги, що виявляють так званий "домінантно"що перетинається". Зазвичай більш прийнятною є негативний ефект", а саме аналоги, які дефектні затравка, яка складається приблизно з 20-25 нукабо за зв'язуванням з MORT1-зв'язними білками леотидів при тому, що приблизно 5-10 комплемен(наприклад, Mch4 або MACH), або за зв'язуванням туючих нуклеотидів з кожного боку послідовності з MORT-1, або з іншими білками, або за подальшій замінюються. В цілому, методика сайтсигнальній або протеазній активності після такого специфічного мутагенезу добре відома у цій галузі зв'язування. Такі аналоги можуть використовуватехніки, прикладом чого служить публікація тись, наприклад, для пригнічення впливу ліганду Adelman et al., 1983 (DNA, 2, 183) , дані що вклюFAS-R або впливу інших білків за рахунок конкуречені в цей текст шляхом цитування. нції з природними MORT1-зв'язними білками або Треба прийняти до уваги, методика сайтіншими білками. Наприклад, здається ймовірним, специфічного мутагенезу зазвичай використовує фаговий вектор, що існує як в одноланцюжковій, що ізоформи МАСН-МАСН 2 і МАСН 3 - є "притак і в дволанцюжковій формах. Звичайні вектори, родними" аналогами, що служать в якості інгібітощо використовуються в методі спрямованого мурів активності MACH за рахунок конкуренції по тагенезу, включають такі вектори, як фаг М13, назв'язуванню активних (про-теазних) ізоформ приклад, так, як це описано Месингом з співавт. MACH з MORT-1, що здається істотним для акти[Messing et al., 1981, 3d Cleveland Symp. on вації цих ізоформ MACH. Оскільки в результаті Macromolecules & Recombinant DNA, ed. A. Walton, активні ізоформи MACH не можуть зв'язуватися з Elsevier, Amsterdam], дані якого включені тут у виMORT-1, внутрішньоклітинні сигнальні механізми, гляді цитування. Ці фаги є легко доступними на що опосередковуються рецепторами FAS-R і p55комерційній основі і їх використання в принципі R, також виявляться пригніченими. У подібний добре відомо фахівцям у цій галузі техніки. З іншоспосіб G1 або будь-яка з його ізоформ також мого боку, також для одержання одноланцюжкової жуть служити в якості інгібіторів впливу FASДНК можуть використовуватись плазмідні вектори, ліганду за рахунок конкуренції з різними MORT1що несуть одноланцюжковий фаговий сайт початзв'язними білками по зв'язуванню з MORT-1 або за ку реплікації [Veira et al., 1987, Methods Enzymol., рахунок взаємодії з ними таким шляхом, який від153, 3]. вертає їх зв'язування з MORT-1. Також можуть В цілому, сайт-специфічний мутагенез згідно з бути одержані так звані "домінантно-позитивні" описаним тут здійснюють спочатку шляхом одераналоги G1, які будуть служити для підсилення жання одноланцюжкового вектору, який включає в впливу FAS-ліганду або TNF. Вони можуть мати межах своєї послідовності послідовність ДНК, яка таку ж саму або кращу здатність до зв'язування з 41 74529 42 кодує необхідний поліпептид. Олігонуклеотидну ДНК добре відомі у цій галузі техніки і можуть визатравку, що несе послідовність, яку мутовано у користовуватись згідно з цим винаходом без зайбажаний спосіб, одержують синтетичним шляхом вих експериментів, ґрунтуючись на порадах, навеза допомогою автоматичного ДНКдених в цьому тексті. Відомі методи ампліфікації олігонуклеотидного синтезу. Цю затравку потім ДНК або РНК включають, але цим не обмежуютьвідпалюють з одноланцюжковим вектором, що ся, полімеразну ланцюгову реакцію (ПЛР) і подібні містить білок-кодуючу послідовність, і піддають ампліфікаційні процеси [див., наприклад, патенти впливу ДНК-полімеризуючих ферментів, таких як США 4683195, 4683202, 4800159, 4965188 (Mullis фрагмент Кльонова полімерази І кишкової паличet al.), 4795699 і 4921794 (Tabor et al.), 5142033 ки, з метою завершення синтезу ланцюга, який (Innis), 5122464 (Wilson et al.), 5091310 (Innis), несе дану мутацію. Таким чином, як і послідов5066584 (Gyllensten et al.), 4889818 (Gelfand et al.), ність, що мутувала, другий ланцюг несе бажану 4994370 (Silver et al.), 4766067 (Biswas), 4656134 мутацію. Такий гетеродуплексний вектор потім (Ringold) і посібник Innis et al. [eds.], PCR Protocols: використовують для трансформації підхожих кліA Guide to Method and Amplification], а також амптин, таких як клітини JM101 Е. соlі, а клони відбиліфікація по РНК-посередникам, що ґрунтується на рають за включенням рекомбінантних векторів, що використанні РНК, яка є антисмисловою відносно несуть мутантну послідовність. до послідовності-мішені і використовується в якосПісля того, як такий клон відібраний, мутантті матриці для синтезу дволанцюжкової ДНК [паний білок G1 може бути виділено і внесено до тент США 5130238 - Malek et al.: торгова марка складу підхожого вектору, зазвичай до складу траNASBA] та імунна ПЛР, що є комбінацією ДНКнсформаційного або експресувального вектору ампліфікації з міченням антитіл [Ruzicka et al., такого типу, що може використовуватись для тра1993, Science, 260, 487; Sano et al., 1992, Science, нсфекції підхожого організму-хазяїна. 258, 120; Sano et al., 1991, Biotechniques, 9, 1378], Відповідно, ген або нуклеїнова кислота, які копри тому, що повний зміст патентів і статей, що дують білок G1, також можуть бути виявлені, одецитуються, повністю включений у вигляді посиржані і (або) модифіковані in vitro, in situ і (або) in лань. vivo шляхом використання відомих методик ампУ аналогічний спосіб біологічно активні фрагліфікації ДНК або РНК, таких як полімеразна ланменти білків G1 (наприклад, такі як будь-які білки цюгова реакція (ПЛР) і хімічний олігонуклеотидний G1 чи його ізоформи) можуть бути одержані так, як синтез. ПЛР дозволяє ампліфікувати (збільшувати це було описано вище щодо одержання аналогів кількісно) специфічні послідовності ДНК шляхом білків G1. Підхожими фрагментами білків G1 є ті, повторення реакцій за участю ДНК-полімерази. Ця що зберігають притаманну білку G1 здатність опореакція може використовуватись замість клонусередковувати біологічну активність рецепторів вання: всі, що в цьому випадку вимагається, - це FAS-R і p55-R або інших білків так, як це було опизнати склад нуклеотидної послідовності. З метою сано вище. Відповідно, можуть бути одержані такі здійснення ПЛР формують затравки, які є комплефрагменти білків G1, що мають "домінантноментарними до послідовності, що цікавить. Потім негативну" або "домінантно-позитивну" дію згідно з ці затравки генерують за допомогою автоматизоописаним вище для характеристики аналогів. Слід ваного синтезу ДНК. Оскільки затравки можуть зазначити, що ці фрагменти являють собою спецібути сформовані так, щоб вони гібридизували з альний тип аналогів відповідно до цього винаходу, частиною конкретного гену, можуть бути створені а саме вони визначають ділянки білків G1, що є такі умови, за яких можливим стає пропускання похідними від повної послідовності білка G1 (напомилок в комплементарності основ. Ампліфікація приклад, від послідовності будь-якого G1 або їх таких ділянок, що несуть помилки, може призводиізоформ), при тому, що така частина або фрагмент ти до синтезу мутантного продукту, внаслідок чого мали будь-яку з вище названих бажаних характеутворюється пептид, який має нові властивості ристик. Такий фрагмент може бути, наприклад, (тобто по суті - це сайт-спрямований мутагенез). пептидом. [Див. також посібник Ausubel et al.], що цитувався У подібний спосіб похідні можуть бути одержавище, глава 16. Також шляхом об'єднання синтезу ні шляхом стандартних модифікацій бокових груп комплементарної ДНК (кДНК) з використанням одного чи більшої кількості амінокислотних залишзворотної транскриптази і методу ПЛР РНК може ків в складі білка G1, його аналогів чи фрагментів використовуватись в якості вихідного матеріалу або шляхом з'єднання білка G1, його аналогів або для синтезу позаклітинного домену рецептора фрагментів з іншою молекулою, наприклад, антипролактину з виключенням етапу клонування. тілом, ферментом, рецептором тощо, що добре Більше того, затравки для ПЛР можуть бути відомо у цій галузі техніки. Відповідно, під понятсконструйовані так, щоб включати нові рестрикційтям "похідних" в даному тексті розуміють похідні, ні сайти або інші елементи, такі як термінуючі коякі можуть бути одержані з функціональних груп, дони по кінцям генного сегменту, призначеного що знаходяться на бокових ланцюгах амінокислодля ампліфікування. Таке приміщення рестрикційтних залишків або N-, або С-кінцевих груп за доних сайтів по 5'- і 3'-кінцям генної послідовності, помогою відомих методик, і вони включені в цей що ампліфікується, дає змогу спрямовано одержувинахід. Похідні можуть бути хімічними складовивати генні сегменти, які кодують білок G1 або його ми, такими як вуглеводні або фосфатні залишки, фрагменти, сформовані так, щоб бути придатними внаслідок чого одержувана фракція матиме таку ж для літування на інші послідовності і (або) клонуюабо більш високу біологічну активність порівняно з чі сайти в складі векторів. білками G1. ПЛР та інші методи ампліфікації РНК і (або) Наприклад, похідні можуть включати аліфати 43 74529 44 чні ефіри карбоксильних груп, аміди карбоксильвектор був би здатний зв'язуватися такими клітиних груп, одержані в результаті реакцій з амонієм нами, що несуть FAS-R або p55-R; і ген, який коабо з первинними чи вторинними амінами, Nдує білок G1. Таким чином, експресія на поверхні ацильні похідні або вільні аміногрупи амінокислотвірусу антигену, який зв'язується на поверхні кліних залишків, утворені ацильними складовими тини-мішені, дозволить точно спрямовувати цей (наприклад, алканоїльні групи або ароїльні групи з вірус на пухлинну клітину або іншу клітину, що вуглецевим кільцем) або 0-ацильні похідні вільних несе FAS-R або p55-R для того, щоб після цього гідроксильних груп (наприклад, в залишках серину послідовність, яка кодує білок G1 (наприклад, посабо треоніну), утворені ацильними складовими. лідовність G1 ) було внесено всередину клітин за Термін "похідна" повинен включати лише ті допомогою цього вірусу і, відповідно, експресовапохідні, що не змінюють одну амінокислоту на іншу но в цих клітинах, що в результаті приведе до підз 20 природних амінокислот. силення впливу ліганду FAS-R або TNF і далі приХоча білок G1 є білком або поліпептидом, він є веде до загибелі пухлинних клітин або інших послідовністю амінокислотних залишків. Поліпепклітин, що несуть FAS-R або p55-R, якщо їх бажатид, що включає більш довгу послідовність, який но знищити. Конструювання такого рекомбінантномістить повну послідовність білка G1, згідно з приго тваринного вірусу здійснюється за допомогою йнятими тут визначеннями, повинен також вклюстандартних процедур [див., наприклад, Sambrook чатися в параметри такого поліпептиду, оскільки et al., 1989]. Іншим можливим шляхом внесення додання не впливають на основні і нові характерипослідовності білка G1 (наприклад, або білка G1, стики винаходу: тобто, якщо воно зберігає або або будь-якої з його ізоформ) є внесення у формі посилює біологічну активність білка G1 або якщо олігонуклеотидів, які можуть поглинатись клітиною подовжений поліпептид може бути згодом розщез подальшою їх експресією всередині неї. плений з одержанням білка або поліпептиду, що Ще одним шляхом підсилення такої клітинної має біологічну активність білка G1. Таким чином, цитотоксич-ності може бути пригнічення активності наприклад, цей винахід також включає злиті білки, ізоформ G1 (наприклад, G1 ), які самі по собі є які складаються з білка G1 та інших амінокислот інгібіторами клітинної цитотоксичності. Шляхи інгіабо пептидів. бування таких ізоформ G1 численні і включають ті, Новий білок G1, його аналоги, фрагменти і пощо розглянуті в поданому нижче п.(2) у зв'язку з їх хідні придатні для використання в ряді напрямків, застосуванням для специфічного пригнічення інгінаприклад: біторних ізоформ білка G1, таких як, наприклад, (1) Білок G1, його аналоги, фрагменти і похідні ізоформа G1 . можуть використовуватись для міметування або (2) Вони можуть використовуватись для пригпідсилення функцій MORT1-зв'язних білків, таких нічення впливу на клітини ліганду FAS-R, або TNF, як, наприклад, Мсп4 або MACH (включаючи їх різні або іншого білка, наприклад, в таких випадках, як ізоформи) або навіть самого MORT-1 і, отже, лігапошкодження тканин при септичному шоку, відторнду FAS-R чи TNF, або інших білків в випадках, гненні при синдромі "трансплантат проти хазяїна" коли бажаним є підсилення впливу ліганду FAS-R або гострому гепатиті, тобто тоді, коли бажаним є чи TNF, або іншого білка, як, наприклад, при заблокування індукованих лігандом FAS-R або TNF стосуванні з протипухлинною, протизапальною, внутрішньоклітинних сигналів з FAS-R або з p55-R, проти-ВІЛ і т. і. метою, при досягненні якої бажаабо сигналів, що індукуються іншими білками. У ною є індукція цитотоксичності за участю ліганду цьому випадку можливим є, наприклад, внесення FAS-R чи TNF, або інших білків. В цьому випадку до клітин за допомогою стандартних процедур білок G1, його аналоги, фрагменти або похідні, що олігонуклеотидів, що мають антисмислові кодуючі посилюють вплив ліганду FAS-R, або TNF, або послідовності відносно до послідовності, яка кодує іншого білка, тобто цитотоксичну дію, можуть внобілок G1, що забезпечує ефективне блокування ситись в клітини за допомогою стандартних протрансляції мРНК, які кодують білок G1, і завдяки цедур, відомих до цього часу. Наприклад, тоді, цьому блокування його експресії, що веде до приколи білок G1 є повністю внутрішньоклітинним (як гнічення впливу ліганду FAS-R, чи TNF, або іншого це припускається) і повинен вноситись лише всебілка. Такі олігонуклеотиди можуть бути внесені в редину клітин, в яких бажаним є прояв впливу ліклітини з використанням вище описаного способу ганду FAS-R, або TNF, або іншого білка, необхідно конструювання рекомбінантних тваринних вірусів, застосовувати спеціальну систему для внутрішдруга вбудована послідовність в складі яких є даньоклітинного впровадження білка. Одним з шляною олігонуклеотидною послідовністю. хів для вирішення такої задачі є створення рекомДалі, як вже зазначалось вище і нижче буде бінантного тваринного вірусу, наприклад, розглянуто в якості прикладу, була виділена припохідного від Vaccinia, до складу ДНК якого повиннаймні одна ізоформа білка G1, що розглядається ні бути вбудовані такі два гени: ген, який кодує в якості "природного інгібітору" клітинної цитотокліганд, що зв'язується з поверхнево-клітинними сичності - це G1 1. Відповідно, така ізоформа білрецепторами, які специфічно експресуються дака G1 може вводитись в клітини прямо або з виконими клітинами, наприклад, такий ліганд як антиристанням підхожого вектору, що несе ген gp120 СНІДу (ВІЛ), який специфічно зв'язуєтьнуклеотидну послідовність, яка кодує цю ізоформу: ся на деяких типах клітин (на CD4 лімфоцитах і отже, у разі експресії в цих клітинах ця ізоформа споріднених лейкозних клітинах), або ж будь-як G1 буде працювати як інгібітор цитотоксичності. інший ліганд, який специфічно зв'язується з клітиІнша можливість надається використанням аннами, що несуть рецептори FAS-R або p55-R, татитіл, специфічних відносно до білка G1 щодо інгіким чином, щоб такий рекомбінантний вірусний бування його внутрішньоклітинної сигнальної ак 45 74529 46 тивності. цеси. У випадку такого застосування білок G1, йоЩе одним шляхом пригнічення впливу ліганду го аналоги, фрагменти або похідні відповідно до FAS-R або TNF є нещодавно розроблений "рибоцього винаходу можуть бути окремо приєднані до зимний підхід". Рибозими - це молекули РНК, які матриксів для афінної хроматографії і потім піддамають каталітичну активність, спрямовану на розні контакту з клітинними екстрактами або ізольощеплення молекул РНК. Рибозими можуть бути ваними білками чи факторами, які, як припускають, штучно сконструйовані таким чином, щоб селектиберуть участь в внутрішньоклітинних сигнальних вно розщепляти РНК-мішень, наприклад, мРНК, процесах. По закінченні процедури афінної хромаяка кодує білок G1 відповідно до цього винаходу. тографії інші білки або фактори, які виявилися Такі рибозими повинні характеризуватися послідозв'язаними з білком G1 або з його аналогами, фравністю, специфічною відносно до мРНК білка G1 і гментами чи похідними відповідно до цього винамають бути здатними взаємодіяти з нею (шляхом ходу, можуть елююватись, виділятись і бути охакомплементарного зв'язування) з подальшим розрактеризованими. щепленням мРНК, внаслідок чого відбувається (5) Як зазначалося вище, білок G1 або його зменшення (або повне припинення) експресії білка аналоги, фрагменти чи похідні відповідно до цього G1, а міра зменшення експресії залежить від рівня винаходу можуть також використовуватись в якості інтенсивності експресії рибозиму в клітині-мішені. антигенів (імуногенів) з метою продукування спеДля внесення до вибраної клітини рибозимів (нацифічних до них антитіл. Ці антитіла також можуть приклад, в клітини, що несуть рецептори FAS-R використовуватись з метою очистки даного білка або р55-R) може використовуватись будь-який G1 (наприклад, власнеG1 або будь-якої з його підхожий вектор, наприклад, плазміда, вектори на ізоформ) як з клітинних екстрактів, так і з ліній основі вірусів тварин (ретровіруси), які зазвичай трансформованих клітин, що продукують білок G1 використовуються для подібних цілей (див. також або його аналоги чи фрагменти. Крім того, ці антип.(1), описаний вище, де описані вірусні вектори, тіла можуть використовуватись для діагностичних які включають в якості другої вбудовуваної посліцілей для ідентифікації розладів, пов'язаних з довності кДНК, кодуючу послідовність рибозиму, аномальним функціонуванням систем ліганду що вибирається). Як огляди методів застосування FAS-R або TNF, наприклад, надлишкового або рибозимів [див. Chen et al., 1992; Zhao & Pick, недостатнього клітинного впливу, що індукується 1993; Shore et al., 1993; Joseph & Burke, 1993; лігандом FAS-R або TNF. Таким чином, при тому, Shimayama et al., 1993; Cantor et al., 1993; що такі захворювання пов'язані з порушенням фуBarinaga, 1993; Crisell et al., 1993 і Koizumi et al., нкціонування системи внутрішньоклітинних сигна1993]. льних механізмів, яка залучає білок MORT-1 або (3) Білок G1, його аналоги, фрагменти або побудь-які інші, наприклад, названі вище MORT1хідні також можуть використовуватись для видізв'язні білки або власне білок G1, то такі антитіла лення, ідентифікації і клонування інших білків того будуть служити важливим діагностичним засобом. ж типу, тобто тих, що зв'язуються з внутрішньокліТакож необхідно відзначити, що виділення, тинним доменом рецептора FAS-R або з функціоідентифікація і охарактеризування білка G1 відпонально спорідненими рецепторами, або тих, які відно до цього винаходу може здійснюватись з зв'язуються з описаними вище MORT1-зв'язними використанням будь-якої з відомих стандартних білками, або тих, що зв'язуються з білком MORT-1 процедур скринінгу. Наприклад, в якості однієї з і завдяки цьому зв'язуються з функціонально спотаких процедур скринінгу дигібридний дріжджовий рідненими рецепторами, такими, як FAS-R і p55-R, тест, описаний в даному тексті, використовувався і, відповідно, втягнуті в внутрішньоклітинні сигнадля ідентифікації білка MORT-1 і в подальшому льні процеси. В цьому випадку може використовурізних MORT1-зв'язних білків і білка G1 відповідно ватись названа вище система дигібридного дріждо цього винаходу. Також, як описано вище і буде джового скринінгу, або може використовуватись описано далі, можуть застосовуватись і інші підхонещодавно розроблена система блотгібридизації ди, такі як афінна хроматографія, методики гібрипо Саузерну з подальшим ПЛР-клонуванням в дизації ДНК тощо, які добре відомі у цій галузі технежорстких умовах [Wilks et al., 1989]. В цій публініки в зв'язку з виділенням, ідентифікацією і кації були описані ідентифікація і клонування двох охарактеризуванням білка G1 відповідно до цього потенційних протеїнтирозинкіназ з застосуванням винаходу або з виділенням, ідентифікацією і охаСаузерн-блот-гібридизації в нежорстких умовах з рактеризуванням інших білків, факторів, рецептоподальшим ПЛР-клонуванням, що ґрунтується на рів і подібного, що здатні зв'язуватися з білком G1 відомій послідовності основного кіназного мотиву. відповідно до цього винаходу. Такий підхід може застосовуватись відповідно до Як вже вказувалося вище, білок G1 може вицього винаходу з використанням послідовності користовуватись для продукування антитіл, спебілка G1 при ідентифікації і клонуванні тих білків, цифічних відносно до білків G1, наприклад, віднощо споріднені з MORT1-зв'язними білками. сно до G1 та його ізоформ. Ці антитіла або їх (4) Ще одним підходом до використання білка фрагменти можуть використовуватись так, як це G1 або його аналогів, фрагментів чи похідних віддокладніше буде описане нижче, і повинно бути повідно до цього винаходу є використання їх в зрозуміло, що в таких випадках ці антитіла або їх афінній хроматографії з метою виділення і іденфрагменти - ті, які є специфічними відносно до тифікація інших білків або факторів, з якими вони білків G1. можуть зв'язуватися, наприклад, білка MORT-1, Ґрунтуючись на даних цього винаходу про те, MORT1-зв'язних білків або інших білків чи фактощо принаймні деякі з білків G1 або їх можливі ізорів, втягнутих в внутрішньоклітинні сигнальні проформи є протеазами, подібними до протеаз сімей 47 74529 48 ства CED3/ICE, для цих білків G1 і їх ізоформ понах через короткий час після стимуляції рецептора дається таке спеціальне медичне застосування: FAS-R, так само як і інших апоптотичних процесів було виявлено, що вже існують специфічні інгібі[Kaufmann, 1989; Kaufmann et al., 1993; Lazebnik et тори інших протеаз CED3/ICE, які здатні проникати al., 1994], і ефективно розщепляється протеазою в клітину і можуть ефективно блокувати запрограСРР32 (яка є членом сімейства протеаз CED3/ICE) мовану загибель клітин. Отже, згідно з цим винаі протеазами MACH (а також, ймовірно, протеазаходом можна сформувати такі інгібітори, що змоми G1). жуть запобігати загибелі клітин, що індукується З урахуванням важливості наявності залишку лігандом FAS-R або TNF - тобто той механізм, в Asp в положенні Р1 в складі субстрату, тетрапепякому бере участь протеаза G1. Далі, з точки зору тиди, що мають аспарагінову кислоту в четвертоунікальних параметрів послідовностей цих нових му положенні та різне поєднання амінокислот в протеаз G1, представляється можливим конструперших трьох положеннях, можуть бути швидко ювати такі інгібітори, які були б високоспецифічскриновані за зв'язуванням з активним сайтом ними щодо впливу TNF і ліганду FAS-R на клітини. протеаз G1 з використанням, наприклад, методу, Дані цього винаходу також подають шлях вивченрозробленого Гейзеном [Geysen, 1985; Geysen et ня механізму, в якому "протеаза, що знищує клітиal., 1987], в якому велике число пептидів, прикріпни" активується у відповідь на ліганд FAS-R і TNF: лених на твердому носії, скринують на специфічну відповідно, це дозволяє розробляти лікарські превзаємодію з антитілами. Зв'язування протеаз парати, які змогли б контролювати міру такої актиMACH з специфічними пептидами може бути вивації. Існує досить багато захворювань, при лікуявлене за допомогою різних добре відомих фахівванні яких такі ліки могли б надати значну цям у цій галузі техніки методів, таких як ізотопне допомогу. Серед таких захворювань - гострий гемічення протеаз G1 тощо. Було показано, що з патит, при якому гострі ураження тканини печінки, застосуванням цього методу за Гейзеном можна по-видимому, відбивають загибель печінкових кліпротестувати принаймні 4000 пептидів за один тин, опосередковану лігандом рецептора FAS-R; робочий день. індукована автоімунною відповіддю загибель кліОскільки певні переваги може мати конструювання пепти-дних інгібіторів, які вибірково пригнітин, така як загибель -клітин островків Лангерганчують протеази G1 без будь-яких завад фізіологічса підшлункової залози, що веде до діабету; загиним процесам, пов'язаним з загибеллю клітин, в бель клітин в ході відторгнення пересадженої яких беруть участь інші члени сімейства протеаз тканини (наприклад, нирок, серця і печінки); загиCED3/ICE, пул пептидів, що зв'язуються з протеабель олігодендроцитів головного мозку при розсізами G1, для аналізу в такому тесті, що був опияному склерозі; і пригнічувана при СНІДі самозасаний вище, може бути синтезовано далі у вигляді гибель Т-лімфоцитів, внаслідок чого флуорогенного пептидного субстрату, призначенозабезпечується розмноження вірусу СНІДу і, отже, го для тестування вибіркового розщеплення пророзвиток власне СНІДу. теазами G1 за відсутності розщеплення іншими Як зазначалось вище, цілком можливо, що G1 протеазами сімейства CED3/ICE. Пептиди, для або одна чи більше число його можливих ізоформ яких визначене вибіркове розщеплення протеаза(наприклад, ізоформа G1 ) може служити в якості ми G1, можуть потім бути модифіковані з метою "природного" інгібітору протеази G1 або ізоформ підсилення внутрішньоклітинної проникності і інгіпротеази G1, і це також можна використати так, як бувальної активності відносно до G1вище зазначалось для специфічних інгібіторів таопосередковуваноі загибелі клітин, як в оборотноких протеаз G1. Також інші сполуки, такі як пептиму, так і в необоротному режимі дії. Торнбері з ди, органічні сполуки, антитіла тощо, можуть бути співавт. [Thornberry et al., 1994] повідомили, що піддаватись скринінгу з метою одержання специтетрапептид-(ацилокси)-метилкетон Ac-Tyr-Valфічних лікарських засобів, здатних інгібувати проAla-Asp-CH2OC(O)-[2,6-(CF3)2] Ph є сильним інактеази G1. тиватором протеази ICE. У подібний спосіб Міліген Не обмежуючий такого застосування приклад з співавт. [Milligan et al., 1995] повідомили, що теттого, як пептидні інгібітори протеаз G1 могли б рапептидні інгібітори, які включають хлорметилкебути одержані і скриновані, ґрунтується на раніше тонову або альдегідну групи, відповідно, необоропроведених дослідженнях пептидних інгібіторів тно і оборотно інгібують протеазу ICE. Крім того, протеази ICE або ICE-подібних протеаз, субстратбуло показано інгібування ICE бензилоксикарбокної специфічності ICE і стратегій аналізу епітопів з сил-Аsр-СН2ОС(О)-2,6-дихлорбензолом (DCB) використанням синтезу пептидів. Мінімальною [Mashima et al., 1995]. Відповідно, тетрапептиди, умовою для ефективного розщеплення пептиду які селективно зв'язуються з протеазами G1, мопротеазою ICE, як було встановлено, є наявність жуть бути модифіковані з використанням, напричотирьох амінокислот ліворуч від сайта розщепклад, альдегідної групи, хлорметилкетонової, лення при жорсткій більшій прийнятності наявності (ацилокси)-метилкетонової або СН2ОС(O)-DCBзалишку аспарагінової кислоти в положенні Р1 і груп при вирішенні задачі створення пептидного достатності наявності метиламіну праворуч від інгібітору активності протеази G1. залишку P1 [Sleath et al., 1990; Howard et al., 1991; Оскільки деякі специфічні інгібітори інших проThornberry et al., 1992]. Більш того, було встановтеаз сімейства CED3/ICE характеризуються внутлено, що флуорогенний пептидний субстрат (що є рішньоклітинною проникністю, то внутрішньоклітетрапептидом) - ацетил-Asp-Glu-Val-Asp-a-(4тинна проникність пептидних інгібіторів потребує метилкумарил-7-амід) - скорочено Ac-DEVD-AMC, підсилення. Наприклад, пептиди можуть бути моякий відповідає послідовності АДФдифіковані або перетворені на свої похідні хімічрибозополімерази (PARP), розщепляється в кліти 49 74529 50 ним шляхом з метою підсилення їх проникності так само як і, по-видимому, N-кінець тетрапептидчерез клітинну мембрану і полегшення транспорного інгібітору можуть бути модифіковані або витування таких пептидів через мембрану в цитокористані для одержання похідних сполук, наприплазму. Мураніші з співавт. [Muranishi et al., 1991] клад, шляхом приєднання молекули біотину, з повідомили про одержання похідного тиротропінометою підсилення проникності цих пептидних інгівого рилізинг-гормону з використанням лауринової біторів через клітинну мембрану. кислоти з утворенням ліпофільного лауроїльного Крім того, у цій галузі техніки відомо, що злитпохідного, що має гарні характеристики прохотя бажаної пептидної послідовності з сигнальною дження через клітинні мембрани. Закарія з співавт. (лідерною) пептидною послідовністю з одержан[Zacharia et al., 1991] також повідомили, що окисням "химерного поліпептиду" може використовувалення метіоніну в сульфоксид і заміщення пептидтись для транспортування такого "химерного поліного зв'язку його кетометиленовим ізоефіром пептиду" через клітинну мембрану в цитоплазму (СОСН2) веде до полегшення транспорту пептиду цієї клітини. через клітинну мембрану. Є ряд модифікацій похіЯк повинно бути добре зрозуміло фахівцям, дних, які добре відомі фахівцям у цій галузі тех.що вивчають пептиди, вважається, що пептидні ніки. інгібітори протеолітичної активності згідно з цим Крім того, ліки або пептидні інгібітори, що здавинаходом повинні включати пептидоміметичні тні пригнічувати активність G1 відносно до загибелікарські засоби або інгібітори, які можуть піддавалі клітин, або їх можливі ізоформи можуть бути тись швидкому скринінгу по зв'язуванню з протеаз'єднані або включені в комплекси разом з молезою G1 з метою одержання по можливості найкулами, які забезпечать більш легке проникнення більш стабільних інгібіторів. всередину клітини. Також повинно бути зрозуміло, що такі ж спо[Патент США 5149782] представляє з'єднання соби полегшення або підсилення транспорту пепмолекули, призначеної для транспортування через тидних інгібіторів через клітинні мембрани, що клітинну мембрану, з мембрано-сполучним агенобговорювалися вище, також є застосовними відтом, таким як слітогенні поліпептиди, поліпептиди, носно до самого білка G1 або самих його ізоформ, які утворюють іонні канали, інші мембранні поліпетак само як і інших білків та пептидів, що справляптиди і жирні кислоти з довгим ланцюгом, наприють свій вплив всередині клітин. клад, міристинова кислота і пальмітинова кислота. Що стосується антитіл, про які говориться у Ці агенти, які сполучаються з мембраною, вбудоцьому тексті, термін "антитіло" включає в себе вують молекулярний кон'югат всередину ліпідного поліклональні антитіла, моноклональні антитіла бішару плазмалеми і полегшують його проникнен(mAbs), химерні антитіла, антиідіопатичні (анти-Id) ня в цитоплазму. антитіла до антитіл, що можуть бути помічені в Лоу з співавт. [(Low et al.) в патенті США розчинній або зв'язаній формі, так само як і їх 5108921] розглядають прийнятні способи трансфрагменти, одержані у будь-який з відомих спосомембранної доставки молекул, таких як (не обмебів, таких як (не обмежуючись цим) ферментне жуючись цим) білки і нуклеїнові кислоти, основані розщеплення, пептид-ний синтез або рекомбінанна механізмі опосередкованої рецепторами ендотні технології. цитозної активності. Ці рецепторні системи є сисПоліклональні антитіла - це гетерогенні попутемами, що розпізнають галактозу, манозу, маноляції молекул антитіл, виділених з сироватки твазо-6-фосфат, трансферин, асіалог-лікопротеїн, рин, імунізованих якимось антигеном. Моноклонатранскобаламін (вітамін В12), α-2-макроглобуліни, льне антитіло включає по суті гомогенну інсулін та інші пептидні фактори росту, такі як епіпопуляцію антитіл, специфічних відносно до антидермальний фактор росту (EGF). Лоу з співавт. генів, при тому, що ці популяції включають по суті вказує, що харчові рецептори, такі як рецептори схожі епітопи сайтів зв'язування. Моноклональні біотину і фолатів, можуть здебільшого використоантитіла можуть бути одержані з використанням вуватися для інтенсифікації транспорту через кліметодів, відомих фахівцям у цій галузі техніки: тинну мембрану, завдяки особливостям локаліза[див., наприклад, Kohler & Milstein, 1975, Nature, ції і численності біотинових і фолатних рецепторів 256, 495-497; патент США 4376110; Ausubel et al., на поверхні більшості клітин і пов'язаних з цими eds. Harlow & Lane 1988, Antibodies: A Laboratory рецепторами процесами трансмембранного транManual, Cold Spring Harbor Lab. та Colligan et al., спорту. Таким чином, комплекс, утворений сполуCurrent Protocols in Immunology, eds. Greene Publ. кою, призначеною для транспортування в цитоAssoc. & Wiley Interscience, NY (1992-96)], повний плазму, і лігандом, таким як біотин чи фолат, зміст яких подано в даному тексті у вигляді посиконтактують з клітинною мембраною, що несе біолань. Такі антитіла можуть належати до будь-якого тинові або фолатні рецептори з метою ініціації класу імуноглобулінів - IgG, IgM, IgE, IgA, GILD - і механізму трансмембранного транспорту, опосебудь-якого їх підкласу. Гібридоми, що продукують редкованого цими рецепторами, завдяки цьому, моноклональні антитіла відповідно до цього виназабезпечуючи входження бажаної сполуки в кліходу, можуть культивуватись in vitro, in situ або in тину. vivo. Одержання високих титрів моноклональних Для протеази ICE відома здатність до толераантитіл in vitro або in situ робить такий підхід ще нтності відносно до вільного заміщення по полобільш прийнятним для їх одержання. женню Р2, і така толерантність до вільних заміХимерні антитіла є молекулами, в складі яких щень використовувалась при розробці ефективної, різні частини походять від різних видів тварин, високовибірної афінної мітки, що містить біотин наприклад, такі як антитіла, що включають варіа[Thornberry et al., 1994]. Відповідно, положення Р2, бельні домени, виділені з моноклональних антитіл 51 74529 52 миші, і константні домени імуноглобулінів людини. нальні антитіла. Далі, антиідіотипові моноклональХимерні антитіла в першу чергу використовуються ні антитіла можуть бути з'єднані з носієм, таким як для зниження імуногенності при їх застосуванні і гемоціанін слизовика (KLH), і використані для імудля збільшення виходу продукту, наприклад, коли нізації нових мишей лінії BALB/c. Сироватка цих мишачі моноклональні антитіла характеризуються мишей міститиме анти-антиідіотпичні антитіла, що більш високим виходом з гібридом, але більш вимають властивості зв'язуватися з вихідним моноксокою імуногенністю в клітинах людини, тому хилональним антитілом, специфічним відносно до мерні "людсько-мишачі" моноклональні антитіла і епітопу описаного вище білка G1 або його аналоможуть використовуватись. Химерні антитіла і гів, фрагментів чи похідних. способи їх одержання добре відомі в науці: [Cabilly Антиідіотипові моноклональні антитіла, таким et al., 1984, Proc. Natl. Acad. Sei. USA, 81, 3273чином, мають свої власні ідіотипові епітопи, тобто 3277; Morrison et al., 1984, Proc. Natl. Acad. Sei. "ідіотопи", подібні за структурою до епітопу, що USA, 81, 6851-6855; Boulianne et al., 1984, Nature, його оцінювали, такого як GRB білка-а. 312, 643-646; Cabilly et al., заявка на європейський Термін "антитіло" також означає як інтактні патент №125023 (опублікована 14 листопада молекули, так і їх фрагменти, такі як, наприклад, 1984p.); Neuberger et al., 1985, Nature, 314, 268Fab і F(ab')2, які здатні зв'язуватися з антигеном. 270; Taniguchi et al., заявка на європейський паФрагменти Fab і F(ab')2 позбавлені Fc-домену інтент №171496 (опублікована 19 лютого 1985p.); тактного антитіла, легше вивільнюються з циркуMorrison et al., заявка на європейський патент ляції і можуть мати менший рівень неспецифічного №173494 (опублікована 5 березня 1986p.); тканинного зв'язування порівняно з інтактним анNeuberger et al., заявка РСТ WO 8601533 (опублітитілом [Wahl et al., 1983, J. Nucl. Med., 24, 316кована 13 березня 1986p.); Kudo et al., заявка на 325]. європейський патент №184187 (опублікована 11 Повинно бути зрозуміло, що Fab і F(ab')2 та червня 1986p.); Sahagan et al., 1986, J. Immunol, інші фрагменти антитіл, які є застосовними відпо137, 1066-1074; Robinson et al., заявка на міжнаровідно до цього винаходу, можуть використовувадний патент WO 8702671 (опублікована 7 травня тись для виявлення і кількісного аналізу білка G1 1987p.); Liu et al., 1987, Proc. Natl. Acad. Sei. USA, згідно з способами, описаними тут для інтактних 84, 3439-3443; Sun et al., 1987. Proc. Natl. Acad. молекул антитіл. Такі фрагменти зазвичай одерSei. USA, 84, 214-218; Better et al., 1988, Science, жують шляхом протеолітичного розщеплення, ви240: 1041-1043; і Harlow & Lane, Antibodies: A користовуючи такі ферменти, як папаїн (при одерLaboratory Manual], цитовано вище. Ці роботи повжанні фрагментів Fab) або пепсин (при одержанні ністю включені до даного тексту у вигляді пофрагментів F(ab')2). силань. Якщо говориться, що антитіло є "здатним до Антиідіотипове (анти-Id) антитіло - це антитіло, зв'язування", це означає здатність специфічно що розпізнає унікальні детермінанти, в принципі реагувати з молекулою таким чином, що відбувазв'язані з антиген-зв'язним сайтом антитіла. Антиіється зв'язування цієї молекули з антитілом. Тердіотипове антитіло може бути приготоване шляхом мін "епітоп" означає ту частину будь-якої молекуімунізації тварини того же виду й генетичного типу ли, що може бути зв'язана антитілом і яка також (наприклад, інбредної лінії мишей) в якості джереможе розпізнаватись цим антитілом. Епітопи або ла моноклонального антитіла, по відношенню до "антигенні детермінанти" як правило складаються якого одержують антиідіотипове антитіло. Імунізоз хімічно активних поверхневих угруповань молевана тварина має розпізнавати та реагувати на кул, таких як бокові ланцюги амінокислот чи цукрів, ідіотипові детермінанти імунізуючого антитіла і мають специфічні тривимірні структурні характешляхом продукування антитіла відносно до цих ристики, так само як і специфічні параметри заряідіотипових детермінантів (анти-Id антитіло). [Див., ду. наприклад, патент США 4699880], що включений у "Антиген" - це молекула або частина молекувигляді посилання. ли, здатна бути зв'язаною з антитілом і до того ж Антиідіотипове антитіло також може бути одездатна індукувати у тварини продукування антитіржане у вигляді "імуногену" з метою індукції імунла, здатного зв'язуватися з епітопом цього антигеної відповіді ще в одній тварині, що продукує т. зв. ну. Антиген може мати або один, або більше число анти-антиідіотипове антитіло. Анти-антиідіотипове епітопів. Специфічна реакція, названа вище, ознаантитіло може бути за параметрами епітопу іденчає, що антиген буде реагувати при додержанні тичним до вихідного моноклонального антитіла, високого рівня розпізнавання з відповідним йому яке індукувало анти-Id. Таким чином, за допомоантитілом і з одним з множини інших антитіл, які гою використання антитіл до ідіотипових детерміможуть зв'язуватися іншими антигенами. нантів моноклонального антитіла можна ідентифіАнтитіла, включаючи фрагменти антитіл, що є кувати інші клони, що екс-пресують антитіла, які застосовними відповідно до цього винаходу, момають ідентичну специфічність. жуть використовуватись для якісного і кількісного Відповідно, моноклональні антитіла, які було іншого виявлення білка G1 в пробі або для виявсформовано до білків G1, їх аналогів, фрагментів лення присутності клітин, що експресують білок G1 або похідних відповідно до цього винаходу, мовідповідно до цього винаходу. Це може супровожуть використовуватись для індукції антиідіотиподжуватися імунофлуоресцентними методиками, вих антитіл в підхожих тваринах, таких як миші які використовують помічене у флуоресцентний лінії BALB/c. Клітини селезінки таких імунізованих спосіб антитіло (див. нижче), сполучене з застосумишей використовують для одержання анти-Id ванням світлової мікроскопії, протокової цитометгібридом, які секретують антиідіотипові моноклорії або флуорометрії для такого виявлення. 53 74529 54 Антитіла (або їх фрагменти), застосовні відпоти за допомогою рутинних експериментів. відно до цього винаходу, можуть використовуваАктивність щодо зв'язування даного набору тись на гістологічному рівні з застосуванням імуантитіл, згідно з викладеним вище у цьому винанофлуоресцентного або імуно-електронного ході, може бути визначена з використанням добре мікроскопів для виявлення in situ білка G1 відповівідомих методів. Фахівці у цій галузі техніки модно до цього винаходу. Виявлення in situ може жуть визначити умови проведення швидких і оптисупроводжуватися виділенням гістологічного зразмальних тестів для кожного з визначень виходячи ка у пацієнта і переносу поміченого у флуоресценз проведення рутинних експериментів. тний спосіб антитіла на такий зразок. Більш приІнші етапи, такі як промивання, перемішуванйнятним є перенос антитіла (або фрагменту) ня, струшування, фільтрування і подібне можуть шляхом внесення поміченого антитіла (або фрагдодаватись в тести так, як рекомендується виробменту) в біологічний зразок. З використанням такої никами або вимагається конкретною ситуацією. процедури стає можливим визначити не лише Одним з способів, у який антитіла згідно з цим присутність білка G1, але й оцінити його розподіл в винаходом можуть бути помічені, є з'єднання андосліджуваній тканині. З використанням цього вититіла з ферментом з використанням в ферментанаходу фахівці у цій галузі техніки можуть легко тивному імуноте-стуванні (ЕІА). Цей фермент, в зрозуміти, що будь-який з великої групи гістологічсвою чергу, коли згодом піддається впливу відпоних методів (таких як методики забарвлення ткавідного субстрату, буде реагувати з цим субстранин) можуть бути модифіковані з метою проведентом таким чином, щоб утворювати хімічний компоня подібного виявлення in situ. нент, який може бути виявлений, наприклад, Такі тести на виявлення білка G1 відповідно спектрофотометрично, флуорометрично або візудо цього винаходу зазвичай включають інкубацію ально. Ферменти, які можуть використовуватись біологічного зразка, такого як біологічна рідина, для виявлення помічених антитіл, включають, не тканинний екстракт, свіжоодержані клітини, такі як обмежуючись цим, малатдегідрогеназу, нуклеазу лімфоцити чи лейкоцити, або клітини, які інкубувастафілококу, ізомеразу 5-стероїдів, алкогольдегілись в тканинній культурі, в присутності поміченого дрогеназу дріжджів, αантитіла, що маркується, здатного ідентифікувати гліцерофосфатдегідрогеназу, триозофосфатізобілок G1 і виявлення антитіла будь-яким з ряду меразу, пероксидазу редьки, лужну фосфатазу, методів, добре відомих у цій галузі техніки. аспарагіназу, глюкозооксидазу, -галактозидазу, Біологічний зразок може оброблятись за дорибонуклеазу, уреазу, каталазу, глюкозо-6помогою твердої підкладки або носієм, таким як фосфатдегідрогеназу, глюкоамілазу та ацетилхонітроцелюлоза, або іншою твердою підкладкою чи лінестеразу. Виявлення може супроводжуватися носієм, що здатні імобілізовувати клітини, клітинні колориметричним методом, що ґрунтується на частинки або розчинні білки. Підкладка або носій використанні субстрату, хромогенного для даного можуть потім промиватись підхожими буферами з ферменту. Виявлення також може супроводжуваподальшою обробкою поміченим антитілом, що тися візуальним порівнянням міри ферментної виявляється, згідно з цим винаходом, так, як це реакції субстрату порівняно з стандартами, пригобуло описано вище. Твердофазна підкладка або тованими в аналогічний спосіб. носій можуть потім бути промиті буфером в другий Виявлення може супроводжуватися викорисраз з метою вилучення антитіла, яке не зв'язалось. танням будь-якого з ряду інших імунотестів. НаКількість зв'язаної мітки на зазначених твердій приклад, шляхом застосування ізотопного мічення підкладці або носії може потім визначатись за доантитіл або фрагментів антитіл стає можливим помогою стандартних методик. виявляти R-РТРазу з застосуванням RIA "Твердофазною підкладкою", "твердофазним (paдіоімуноаналізу). Якісний опис методу RIA моносієм", "твердою підкладкою", "твердим носієм", жна знайти в посібнику "Laboratory Techniques & "підкладкою" або "носієм" називаються будь-які Biochemistry in Molecular Biology" [Work, T. S. et al., підкладки чи носії, здатні зв'язувати антиген або 1978, North Holland Publ. Co., NY] з конкретною антитіла. Добре відомі підкладки або носії вклюувагою до розділу, що має заголовок "Введення в чають скло, полістирен, поліпропілен, поліетилен, радіоімунний аналіз і схожі методики", написаному декстран, нейлон-амілази, природні й синтетичні Т. Чардом (Т. Chard), який включено сюди у вигляцелюлози, поліакриламіди, габро та магнетит. ді посилання. Радіоактивні ізотопи можуть бути Природа носія може бути або частково розчинною, виявлені у такі способи, як використання лічильниабо він може бути нерозчинним, виходячи з цілей ка Гейгера або сцинтиляційного лічильника, або за даного винаходу. Матеріал підкладки візуально допомогою авторадіографічного аналізу. може мати будь-яку можливу структурну конфігуТакож можливим є помітити антитіло згідно з рацію, доки приєднана молекула здатна зв'язувати цим винаходом за допомогою флуоресцентної антиген або антитіло. Таким чином, конфігурація сполуки. Коли помічене у флуоресцентний спосіб підкладки або носія може бути сферичною, кулеантитіло піддають впливу світла з підхожою довподібною, циліндричною, як внутрішня поверхня жиною хвилі, його присутність може бути виявлена тест-пробірки, або зовнішня поверхня палички. З за флуоресценцією. Серед найбільш часто застоіншого боку, поверхня може бути плоскою, такою совуваних для мічення флуоресцентних сполук як у пластинки, тест-стрічки тощо. Більш прийнятфлуоресцеїнізотіоціанат, родамін, фікоеритрин, ними підкладками або носіями є полістиренові пікоціанін, алоцикоціанін, о-фтальдегід і флуоресгранули (кульки). Фахівці у цій галузі техніки мокамін. жуть підібрати інші підхожі носії для зв'язування Антитіло також може бути виявлене шляхом антигену або антитіла, або ж можуть це встановимічення з використанням флуоресціюючих мета 55 74529 56 лів-емітентів, таких як 152Е або інших з групи лантіла, що не увійшло до складу комплексу. Присуттаноїдів. Ці метали можуть приєднуватись до анність поміченого антитіла, зв'язаного з твердою титіла з використанням таких груп, що хелатують підкладкою або носієм, потім визначають так, як метали, як діетилентриамінпентаоцтова кислота це здійснюється в стандартному "форвард(ЕТРА). сендвіч"-тесті. Антитіло також може бути одержане шляхом В "зворотному" тесті використовується постуйого з'єднання з хемолюмінісцентною речовиною. пове додання спочатку розчину поміченого антитіПотім присутність поміченого за хемолюмінісцентла до рідкого зразка з подальшим доданням непоним типом антитіла визначають шляхом виявленміченого антитіла, зв'язаного з твердою ня наявності люмінісценції, що виникає в процесі підкладкою або носієм після підхожого періоду проходження хімічної реакції. Прикладами конкреінкубації. Після другої інкубації тверду підкладку тно застосовуваних для мічення хемолюмінісціюпромивають у стандартний спосіб до звільнення її ючих сполук є, люмінол, ізолюмінол, тероматичний від залишків тестованого зразка і розчину помічеакридиновий ефір, імідазол, акридинова сіль і щаного антитіла, що не прореагувало. Визначення влевий ефір. поміченого антитіла, зв'язаного з твердою підкладТакож для мічення антитіла відповідно до цьокою або носієм, потім здійснюють так само, як і в го винаходу можуть використовуватись біолюміні"одночасному" і "форвард"-тестах. сцентні сполуки. Біолюмінісценція є варіантом хеБілки G1 відповідно до цього винаходу можуть молюмінісценції, що виявляється в біологічних бути одержані з застосуванням будь-якої з існуюсистемах, в яких білок, що має каталітичну активчих стандартних процедур рекомбінантної ДНК ність, підвищує ефективність хемолюмінісцентної [див., наприклад, Sambrook et al., 1989 і Ausubel et реакції. Присутність біолюмінісцентного білка виal., 1987-95, цитовано вище], в яких підхожі еукарізначають виявленням наявності люмінісценції. отичні і прокаріотичні клітини-хазяї, добре відомі у Важливими біолюмінісцентними сполуками для цій галузі техніки, трансформують з використанцілей мічення є люциферин, люцифераза та еквоням підхожих еукаріотичних і прокаріотичних векрин. торів, які включають послідовності, що кодують Молекула антитіла відповідно до цього винадані білки. Відповідно, цей винахід також стосуєтьходу може бути адаптована для використання в ся таких експресувальних векторів і трансформоімунометричному тестуванні, також відомому як ваних організмів-хазяїв, призначених для продуку"двосайтове" або "сендвіч"-тестування. В типововання цих білків відповідно до цього винаходу. Як му імунометричному тесті деяку кількість непомізазначалося вище, ці білки також включають їх ченого антитіла (або фрагменту антитіла) зв'язуактивні аналоги, фрагменти та похідні, і, таким ють з твердою підкладкою чи носієм і деяку чином, вектори, що їх кодують, також включають кількість поміченого розчинного антитіла додають вектори, які кожують аналоги і фрагменти цих білтаким чином, щоб було можливо виявляти і (або) ків, а трансформовані організми-хазяї включають кількісно оцінювати потрійний комплекс між антитакі, що продукують ці аналоги і фрагменти. Похітілом на твердій фазі, антигеном та поміченим дні цих білків, що продукуються такими трансфорантитілом. мованими організмами-хазяїнами, є похідними, Звичайно і більш прийнятно імунометричні теодержаними шляхом стандартної модифікації цих сти включають "форвард"-тести, в яких антитіло, білків або їх аналогів чи фрагментів. зв'язане з твердою фазою, в першу чергу контакЦей винахід також стосується фармацевтичтує з тестованим зразком з метою виділення антиних композицій, що включають рекомбінантні векгену з зразка і утворення бінарного комплексу "антори на основі вірусів тварин, які кодують білки G1, тиген-антитіло" в твердій фазі. Після підхожого так, що такий вектор також кодує поверхневий періоду інкубації тверду підкладку або носій провірусний антиген, здатний зв'язуватися на специмивають з метою вилучення залишку рідкої проби, фічній клітині-мішені (наприклад, на пухлинних включаючи антиген, який не прореагував, якщо він клітинах) з поверхневими білками з метою спрязалишився, і потім контактують з розчином, що мування внесення послідовностей білків G1 всемістить невідому кількість поміченого антитіла (яке редину клітин. Додатково фармацевтичні компофункціонує в якості "репортерної молекули"). Пісзиції відповідно до цього винаходу включають в ля періоду другої інкубації, необхідної для формуякості активного компонента (а) олігонуклеоти-дну вання комплексу поміченого антитіла і антигену, послідовність, що кодує антисмислову послідовзв'язаного з твердою підкладкою чи носієм через ність відносно до послідовності, що кодує білок непомічене антитіло, потім тверду підкладку або G1, або (b) ліки, що блокують протеолітичну актиносій промивають в другий раз з метою вилучення вність білка G1 чи його ізоформ. поміченого антитіла, яке не прореагувало. Фармацевтичні композиції згідно з цим винаІнший тип "сендвіч"-методу, що також може ходом включає кількість активного компонента, використовуватись з антигенами відповідно до достатню для досягнення поставленої перед ним цього винаходу, - це застосування так званих "одмети. Додатково фармацевтичні композиції моночасних" і "зворотних" тестів. "Одночасний" тест жуть включати підхожі, фармацевтично прийнятні включає однократний етап інкубації, в якому і анносії, що включають наповнювачі і підхожі компотитіло, зв'язане з твердою підкладкою або носієм, і ненти, які полегшують процесинг активних компопомічене антитіло додають до тестованого зразка нентів в складі препаратів, що можуть використов один і той самий час. По закінченні інкубації твевуватись у фармацевтичні способи і які можуть рду підкладку або носій промивають з метою вистабілізувати такі препарати, призначені для ввелучення залишку рідкого зразка і поміченого антидення пацієнтам, що їх потребують, згідно з добре 57 74529 58 відомими фахівцям у цій галузі техніки прийомами. в токсичності, опосередковуваній FAS/AP01 і TNF, Білок G1 і його ізоформи або ізотипи, як приздається важливим створювати лікарські засоби, пускається, повинні експресуватися в різних ткаякі б блокували можливу протеолітичну функцію нинах на чітко неоднаковому рівні і, по-видимому, білка G1, що раніше було вже зроблене для інших при різних параметрах ізотипів аналогічно експребілків з складу сімейства CED3/ICE [Thornberry et сії білка MACH і його різних ізотипів, як це описано al., 1994; Miller et al., 1995; Mashima et al., 1995; в зазначених вище спільних, перебуваючих на Milligan et al., 1995; Enari et al., 1995; Los et al., стадії розгляду заявках. Ці відмінності можуть, по1995]. Унікальні параметри послідовності гомолога видимому, зумовлювати тканиноспецифічні параCED3/ICE, по-видимому, присутнього в молекулах метри відповіді на ліганд FAS/AP01 та TNF. Як і у G1, можуть дати змогу приготувати лікарські засовипадку з іншими гомологами CED3/ICE [Wang et би, які у специфічний спосіб подавляли б їх активal., 1994; Alnemri et al., 1995], заявники раніше вже ність. Такі ліки можуть забезпечувати захист від показали (згідно з згаданими вище патентними надлишкової, пов'язаної з імунітетом цитотоксичзаявками), що у ізоформ MACH, які включають ності за участю G1 без будь-яких завад фізіологічнеповні сегменти гомології з CED3/ICE (наприклад, ним процесам клітинної загибелі, в яких беруть МАСНα3), виявляється ефект інгібування активноучасть інші протеази сімейства CED3/ICE. сті молекул МАСНα і МАСНα2, які одночасно ексІнші аспекти цього винаходу будуть видні з напресуються; для них теж було встановлено блокуведених нижче прикладів. вання індукції загибелі за участю FAS/AP01 і p55Тепер винахід буде більш докладно описувати R. Експресія таких інгібіторних ізоформ в клітинах наведені далі приклади, що не є його обмеженням, може визначати механізм клітинного самозахисту і супутні ним креслення. від цитотоксичності, опосередковуваної FAS/AP01 Також треба зазначити, що такі процедури: і TNF. Аналогічний інгібувальний ефект також при(і) дигібридний скринінг і дигібридний тест на пускається принаймні у однієї з ізоформ білка G1. експресію -галактозидази; Високий рівень гетерогенності ізоформ MACH і (іі) індукована експресія, метаболічне мічення також передбачувана аналогічна гетерогенність та імунопреципітація білків; ізоформ G1, яка за рівнем істотно переважає гете(ііі) зв'язування in vitro; рогенність ізоформ будь-яких інших протеаз сі(iv) оцінка цитотоксичності; і мейства CED3/ICE, повинні дозволяти здійснення (ν) Нозерн-блотинг і секвенування, названі нитонкої настройки функцій активних ізоформ MACH, жче в прикладах-посиланнях 1 [див. також Boldin а, по аналогії, також і у активних ізоформ G1, згідet al., 1995b], 2 і 3 [див. також Boldin et al., 1996], но з цим винаходом. відносно до MORT-1 і MORT1-зв'язних білків (наТакож можливим є те, що деякі з ймовірних приклад, MACH), відповідно, рівною мірою застоізоформ G1 виявляють інші функції. Наприклад, совні (з деякими модифікаціями) до відповідного раніше виявлена заявниками, (що зазначалося виділення, клонування і охарактеризування G1 і вище) здатність MACH 1 зв'язуватися і з MORT-1, його ймовірних ізоформ відповідно до цього винаі МАСНα1 підтверджує, що ця ізоформа може дійходу. Ці процедури, таким чином, повинні бути сно посилювати активність каталітично активних прийняті як повне подання таких процедур, що ізоформ. Середня цитотоксичність, що спостерігавикористовувались для виділення, клонування і ється в культурах ліній 293-EBNA і MCF7, трансфіохарактеризування G1 згідно з цим винаходом, що кованих цією ізоформою, і більш істотний цитотокдетально розглянуте нижче в прикладі 1. (Наведесичний ефект, що виявляється в клітинах HeLa, ні нижче приклади-посилання 1-3 також подані в мабуть відбиває активацію молекул МАСНα, що формі, схожій або еквівалентній тій, що характерендогенно експресуються, із зв'язування з трансна для спільних, перебуваючих на стадії розгляду [заявок на ізраїльський патент №№114615, фікованими молекулами MACH 1, Можливо, деякі 114986, 115319, 116588 і 117932], так само як і для з ізоформ MACH також можуть діяти як "деповідповідної [РСТ-заявки №PCT/US96/10521]). Бісайти" для молекул, що беруть участь в інших, не льше того, у вище поданому розділі "Стислий опис пов'язаних з цитотоксичністю, проявах рецепторів креслень" вже були включені деякі подробиці ексFAS/AP01 і TNF. Отже, в аналогічний спосіб білокпериментальних процедур, здійснених згідно з цим G1 і (або) його ізоформи також можуть мати таку ж винаходом, і вони утворюють частину нижче навепосилювальну активність або служити в якості деного прикладу 1 з точки зору повного подання "депо-сайтів" для інших таких молекул. цього винаходу, відповідно, і повинні розглядатися Завдяки унікальній здатності рецепторів разом з тим, що викладено в прикладі 1. FAS/AP01 і TNF зумовлювати загибель клітин, так Приклад-посилання 1. само як і здатності рецепторів TNF опосередковуКлонування та виділення білка MORT-1, що вати інші типи активності, пов'язані з пошкоджензв'язується з внутрішньоклітинним доменом реценями тканин, порушення функцій цих рецепторів птора FAS-R можуть бути негативними для організму. Проте, і (1) Дигібридний скринінг та дигібридний тест для надлишкової, і для недостатньої функцій цих на експресію -галактозидази рецепторів було продемонстровано участь в патогенезі деяких захворювань [Vassalli, 1992; Nagata З метою виділення білків, що взаємодіють з & Golstein, 1995]. Ідентифікація молекул, що бевнутрішньоклітинним доменом рецептора FAS-R, руть участь в сигнальній функції рецепторів і відквикористовувалась дигі-бридна дріжджова систериття шляхів модуляції активності таких молекул ма [Fields & Song, 1989]. Коротко, ця дигібридна можуть привести до нових лікувальних підходів. З система є основаним на дріжджах генетичним тесточки зору передбачуваної ключової ролі білка G1 том, призначеним для виявлення специфічних 59 74529 60 міжбілкових взаємодій in vivo шляхом відновлення Lab. Inc., США. у вигляді компонентів дигібридної еукаріотичного активатору транскрипції, такого як системи Matchmaker №РТ1265-1). КоGAL4, що включає два поділені домени - ДНКтрансфіковані дріжджі вибирали за їх здатністю зв'язувального і активаторного доменів: ці домени рости в середовищі без гістидилу (HIS середовиу випадку експресії взаємозв'язування утворюють ще), вирощені колонії виявлялися позитивними відновлений білок GAL4 і здатні зв'язуватися з трансформантами. Вибрані дріжджові клони потім вищерозташованою активаторною послідовністю, тестували за їх здатністю експресувати ген lacZ, яка, в свою чергу, активує промотор, що контротобто за активністю LACZ у них, яку визначали лює експресію гена-репортера, такого як lacZ або доданням X-gal в культуральне середовище, що HIS3, експресія якого може бути легко виявлена в катаболізувався -галактозидазою (ферментом, клітинах, що культивуються. В цій системі гени, які що кодується геном lacZ) в забарвлений у синій кодують передбачувані взаємодіючі білки, клонуколір продукт. Таким чином, сині колонії є індикають в окремі експресувальні вектори. В складі одтором активного гену lacZ. Для забезпечення акного експресу-вального вектору послідовність гена тивності гену lacZ необхідним є те, щоб активатор одного з передбачуваних білків клонована поряд з транскрипції GAL4 був наявним в активній формі в послідовністю, що кодує ДНК-зв'язувальний домен складі трансформованих клонів, а саме, щоб ДНКGAL4 з метою утворення гібридного білка, який зв'язувальний домен GAL4, який кодується вище має в складі ДНК-зв'язувальний домен GAL4; до зазначеним гібридним вектором, точно сполучався складу іншого вектору входиться послідовність, з активаторним доменом GAL4, що кодується іняка кодує другий передбачуваний білок поряд з шим гібридним вектором. Таке поєднання можлипослідовністю, що кодує активаторний домен во лише тоді, коли два білки, злиті з кожним з доGAL4 з метою одержання гібридного білка, що менів GAL4, здатні стабільно взаємодіяти включає активаторний домен GAL4. Два гібридні (зв'язуватися) один з одним. Таким чином, гістивектори потім одночасно трансформують в клітидин-позитивні і сині (LACZ+) колонії, які були видіни-хазяї дріжджів штаму, що несуть ген-репортер лені, - це колонії, що були ко-трансфіковані вектоlacZ або HIS3, який перебуває під контролем прором, що кодує домен FAS-IC, і вектором, який моторного сегменту, що має сайти зв'язування кодує білковий продукт, зв'язаний походженням з GAL4. Лише ті трансформовані клітини-хазяї (коклітинами HeLa людини, здатний стабільно зв'язутрансформанти), в яких два гібридні білки експреватися з FAS-IС. совані та здатні взаємодіяти один з одним, виявПлазмідна ДНК з названих вище дріжджових ляються здатними експресувати ген-репортер. У колоній з His+, LACZ+ була виділена і елекропороразі використання гена-репортера lacZ клітинивана в клітини Е. соlі штаму НВ101 за допомогою хазяї, які експресують цей ген, забарвлюються в стандартних процедур з подальшим відбором трасиній колір при доданні в культуральне середовинсформантів Leu+ і ампіцилін-резистентних: ці ще X-gal. Отже, сині колонії є індикаторами того трансформанти є тими, що несуть гібридний векфакту, що два клоновані білки-"кандидати" здатні тор pGAD-GH, який включає кодуючі послідовності взаємодіяти один з одним. і AmpR і Leu2. Такі трансформанти, таким чином, є З використанням дигібридної системи внутріклонами, що несуть послідовності, які кодують нові шньоклітинний домен FAS-IC був окремо клоноваідентифіковані білки, здатні зв'язуватися з FAS-IC. ний до складу вектору pGBT9 (що несе послідовПотім плазмідну ДНК виділяли з цих трансформоність, яка кодує ДНК-зв'язувальний домен GAL4, ваних клітин Е. соlі і повторно тестували шляхом: надану Clontech, США: див. нижче) з метою одер(a) їх ретрансформації з використанням вихіджання злитого білка, що включає ДНКної гібридної плазміди, що включає внутрішньоклізв'язувальний домен GAL4. Для клонування FAS-R тинний домен FAS-R (гібридна плазміда pGBT9, до складу pGBT9 застосовували клон, який кодує що несе FAS-IС) штаму дріжджів HF7 так, як це повнорозмірну послідовність кДНК FAS-R [WO було описано вище. В якості контролю вектори, що 95/31544], з складу якого внутрішньоклітинний донесуть сторонню білок-кодуючу послідовність, намен (1С) було вирізано із застосуванням стандарприклад, pGBT9 або рАСТ-ламін, використовували тних процедур з використанням різних рестриктаз, для ко-трансформації разом з плазмідою, що копотім виділено з застосуванням стандартних продує FAS-IC-зв'язний білок (тобто MORT-1). Потім цедур і вбудовано у вектор pGBT9, відкритий по ко-трансформовані клітини дріжджів тестували по своїм множинним сайтам клонування (MCS) з виросту в безгістидиновому середовищі без або з користанням відповідних підхожих рестриктаз. різним вмістом 3-амінотріазолу; та Слід зазначити, що домен FAS-IC займає аміноки(b) ретрансформації плазмідної ДНК і вихідної слотні залишки 175-319 інтактного FAS-R: цей сегібридної плазміди з FAS-IC і контрольних плазмід, гмент, що включає амінокислоти 175-319, які є описаних в п.(а) , в дріжджові клітини-хазяї штаму доменом FAS-IC, і були вбудовані до складу векSFY526 і аналіз активності LACZ+ ефективність тору pGBT9. утворення -галактозидазни, тобто забарвлення в Описаний вище гібридний (химерний) вектор синій колір). потім ко-трансфікували разом з елементами бібліРезультати описаних вище тестів показали, отеки кДНК клітин HeLa людини, клонованими у що параметри зростання колоній на середовищі вектор pGAD-GH, що несе актива-торний домен без гістидину були ідентичними параметрами акGAL4, в клітини-хазяї дріжджів штаму HF7c (всі тивності LACZ, що оцінювалися за появою забарназвані вище вектори - pGBT9 і pGAD-GH, що вленості колоній: тобто колонії His+ виявлялися включає частини бібліотеки кДНК клітин HeLa, а теж LACZ+. Далі, активність LACZ в рідкій культурі також штам дріжджів придбали в фірмі Clontech (як більш прийнятних умовах вирощування) оціню
ДивитисяДодаткова інформація
Назва патенту англійськоюCash (caspase homologue) with “death-effector" domain, modulators of fas-receptor functions
Назва патенту російськоюCash (гомолог каспазы) с "гибель-эффекторным" доменом, модуляторы функций fas-рецепторов
МПК / Мітки
МПК: A61P 35/00, C12N 5/10, C12N 1/19, A61K 48/00, A61K 35/76, C12N 9/64, C12Q 1/68, C12N 1/21, A61K 38/00, A61P 31/18, C12N 9/00, A61K 31/7105, C12N 15/12, G01N 33/50, C12N 15/09, G01N 33/15, A61P 43/00, C12N 1/15
Мітки: білками, послідовність, mort-1, активність, кодує, має, поліпептид, взаємодіяти, опосередкованої, зв'язуватись, здатний, будь-якими, зв'язуються, прямої, білка, днк
Код посилання
<a href="https://ua.patents.su/53-74529-poslidovnist-dnk-shho-kodueh-polipeptid-yakijj-maeh-aktivnist-bilka-g1-i-yakijj-zdatnijj-zvyazuvatis-abo-vzaehmodiyati-pryamo-abo-oposeredkovano-z-mort-1-i-abo-z-bud-yakimi-bilkami.html" target="_blank" rel="follow" title="База патентів України">Послідовність днк, що кодує поліпептид, який має активність білка g1 і який здатний зв’язуватись або взаємодіяти прямо або опосередковано з mort-1 і/або з будь-якими білками, що зв’язуються з mort-1, і здатний</a>
Попередній патент: Спосіб спорядження кумулятивного перфоратора
Наступний патент: Пристрій для поштучної видачі піддонів із стопи
Випадковий патент: Спосіб визначення швидкості вводу порошкового дроту в сталерозливний ківш