Комбінована терапія нефукозильованим анти-cd20 антитілом з бендамустином
Формула / Реферат
1. Застосування нефукозильованого анти-CD20 антитіла з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) у положенні Asn297 для одержання лікарського засобу для лікування раку у комбінації з бендамустином, де зазначеним раком є рак, який експресує CD20, і тим, що зазначене антитіло містить амінокислотну послідовність варіабельної області важкого ланцюга (VH), представлену у SEQ ID NО:7, і амінокислотну послідовність варіабельної області легкого ланцюга (VL), представлену у SEQ ID NO:20.
2. Застосування за п. 1, яке відрізняється тим, що кількість фукози становить від 40 до 60 %.
3. Застосування за п. 1 або 2, яке відрізняється тим, що зазначений рак, який експресує CD20, є В-клітинною неходжкінською лімфомою (НХЛ).
4. Застосування за одним із пп. 1-3, яке відрізняється тим, що вводять один або декілька додаткових інших цитотоксичних, хіміотерапевтичних або протиракових агентів, або сполук, або застосовують іонізуючу радіацію, що підвищує дію таких агентів.
5. Застосування за одним із пп. 1-4, яке відрізняється тим, що зазначене антитіло вводять у дозі 800-1200 мг на 1,8, 15 добу 6-тижневого циклу дозування та потім у дозі від 800 до 1200 мг на 1 добу 4-х тижневого циклу, який може тривати до 5 разів, і бендамустин вводятьу дозі від 80 мг/м2 до 110 мг/м2 на 1 і 2 добу 4-х тижневого циклу, який може тривати до 6 разів.
6. Нефукозильоване анти-CD20 антитіло з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 для лікування раку у комбінації з бендамустином, де зазначеним раком є рак, який експресує CD20, і тим, що зазначене антитіло містить амінокислотну послідовність варіабельної області важкого ланцюга (VH), представлену у SEQ ID NO:7, і амінокислотну послідовність варіабельної області легкого ланцюга (VL), представлену у SEQ ID NO: 20.
7. Антитіло за п. 6, яке відрізняється тим, що кількість фукози становить від 40 до 60 %.
8. Антитіло за пп. 6 або 7, де зазначений рак, який експресує CD20, є В-клітинною неходжкінською лімфомою (НХЛ).
9. Антитіло за одним із пп. 6-8, де вводять один або декілька додаткових інших цитотоксичних, хіміотерапевтичних або протиракових агентів, або сполук, або застосовують іонізуючу радіацію, що підвищує дію таких агентів.
10. Антитіло за одним із пп. 6-9, яке відрізняється тим, що зазначене антитіло вводять у дозі 800-1200 мг на 1, 8, 15 добу 6-тижневого циклу дозування та потім у дозі від 800 до 1200 мг на 1 добу 4-х тижневого циклу, який може тривати до 5 разів, і бендамустин вводять у дозі від 80 мг/м2 до 110 мг/м2 на 1 і 2 добу 4-х тижневого циклу, який може тривати до 6 разів.
Текст
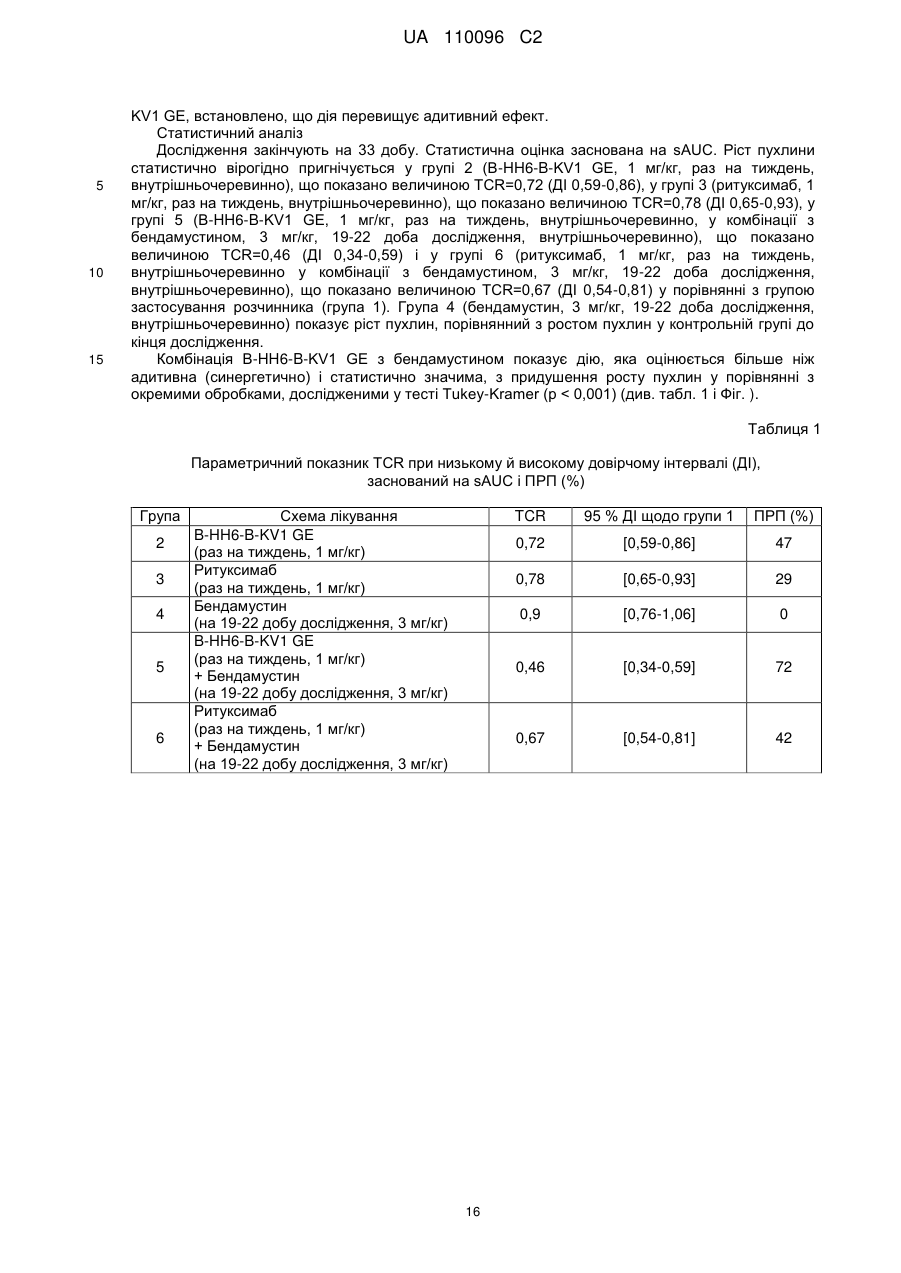
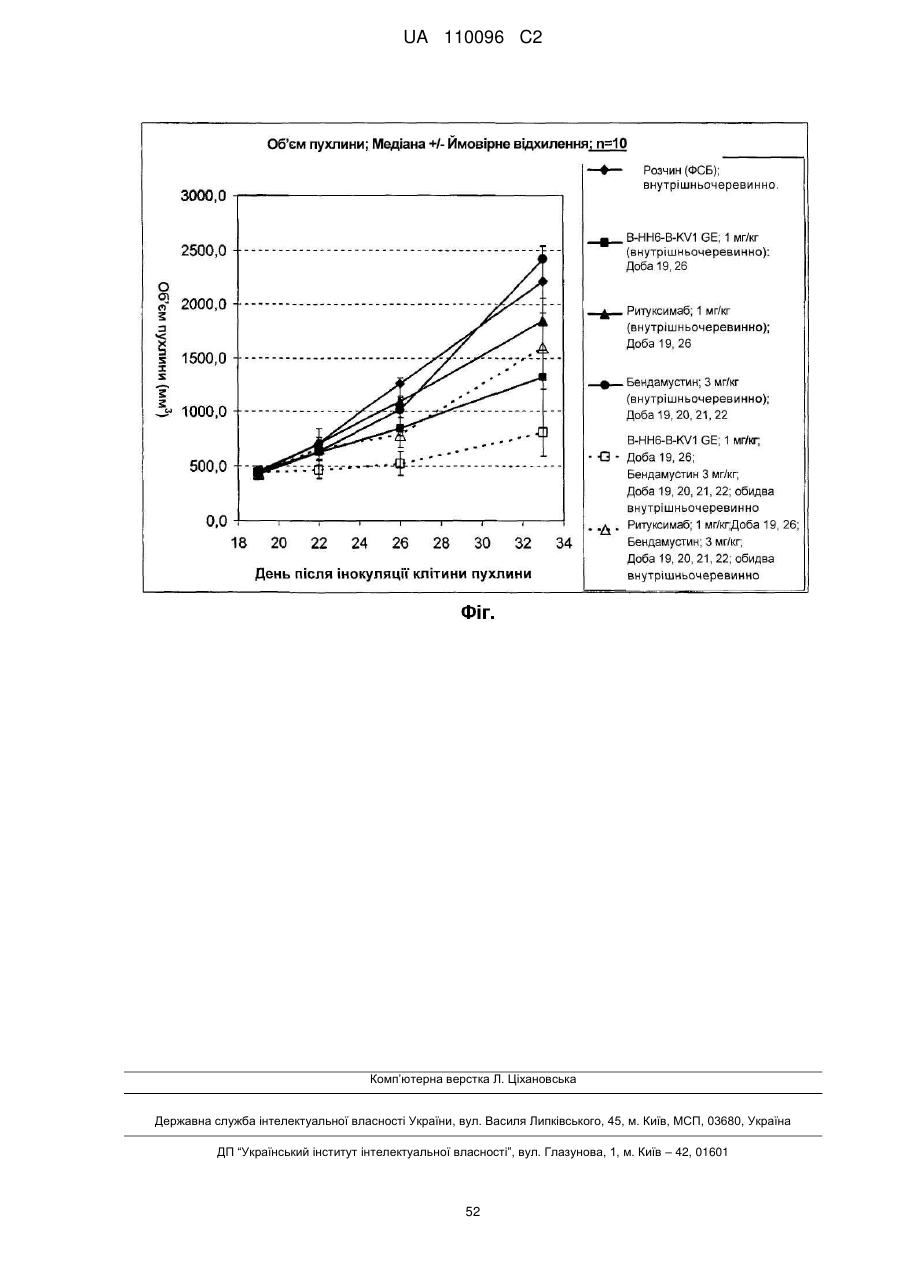
Реферат: Винахід належить до застосування нефукозильованого анти-CD20 антитіла з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) у положенні Asn297 для одержання лікарського засобу для лікування раку у комбінації з бендамустином, де зазначеним раком є рак, який експресує CD20. UA 110096 C2 5 10 15 20 25 30 35 40 45 Даний винахід відноситься до комбінованої терапії нефукозильованим антиcd20антитілом з бендамустином для лікування раку. Передумови створення винаходу Нефукозильовані антитіла Опосередковані клітинами ефекторні функції моноклональних антитіл можуть бути посилені за рахунок конструювання їх олігосахаридного компонента згідно з описом у роботі Umaña P. та ін., Nature Biotechnol, 17, 1999, сс. 176-180, і у патенті US 6602684. Антитіла типу IgG1, які найбільше часто застосовуються в імунотерапії раку, є глікопротеїнами з консервативним сайтом N-зв'язаного глікозилування за положенням Asn297 у кожному домені CH2. Два складних біантених олігосахариди, приєднаних до Asn297, сховані між доменами CH2, формуючи просторові контакти з поліпептидним каркасом, і їх наявність важлива для опосередкування антитілом ефекторних функцій, наприклад, антитіло-залежної клітинної цитотоксичності (antibody dependent cellular cytotoxicity – ADCC) (Lifely M.R. та ін., Glycobiology, 5, 1995, сс. 813-822; Jefferis R. Та ін., Immunol. Rev., 163, 1998, сс. 59-76; Wright A., Morrison S.L., Trends Biotechnol., 15, 1997, сс. 26-32). У публікації Umaña P. та ін., Nature Biotechnol, 17, 1999, сс. 176-180, і у WO 99/154342 показано, що надекспресія у клітинах яєчника китайського хом'ячка (Chinese hamster ovary – CHO) ферменту ß(1,4)- N-ацетилглюкозамінілтрансферази III (acetylglucosaminyltransferase III – Gntiii), глікозилтрансферази, що каталізує формування роздвоєних олігосахаридів, суттєво підвищує in vitro ADCC-дію антитіл. Зміна у композиції вуглеводу N297 або його елімінація також впливає на Fc-зв'язування з Fcγr і C1q (Umaña P. та ін., Nature Biotechnol, 17, 1999, сс. 176-180; Davies J. та ін., Biotechnol. Bioeng., 74, 2001, сс. 288294; Mimura Y. та ін., J. Biol. Chem., 276, 2001, сс. 45539-45547; Radaev S. та ін., J. Biol. Chem., 276, 2001, сс. 16478-16483; Shields R.L. та ін., J. Biol. Chem., 276, 2001, сс. 6591-6604; Shields R.L. та ін., J. Biol. Chem., 277, 2002, сс. 26733-26740; Simmons L.C. та ін., J. Immunol. Methods, 263, 2002, сс. 133-147). Обговорення досліджень дії нефукозильованих і фукозильованих антитіл, у тому числі антиCD20 антитіл, опубліковане, наприклад, у наступних роботах: Iida S. та ін., Clin. Cancer Res., 12, 2006, сс. 2879-2887; Natsume A. та ін., J. Immunol. Methods, 306, 2005, сс. 93-103; Satoh M. та ін., Expert Opin. Biol. Ther., 6, 2006, сс. 1161-1173; Kanda Y. та ін., Biotechnol. Bioeng., 94, 2004, сс. 680-688; Davies J. та ін., Biotechnol. Bioeng., 74, 2001, сс. 288-294. CD20 і анти-CD20 антитіла Інтенсивно досліджують молекулу CD20 (яку також називають антигеном диференціації, специфічним для В-лімфоцитів людини, або Bp35), яка є гідрофобним трансмембранним білком, локалізованим на попередниках В-лімфоцитів і на зрілих В-лімфоцитах (Valentine M.A. та ін., J. Biol. Chem., 264, 1989, сс. 11282-11287; Einfeld D.A. та ін., EMBO J., 7, 1988, сс. 711-717; Tedder T.F. та ін., Proc. Natl. Acad. Sci. U.S.A., 85, 1988, сс. 208-212; Stamenkovic I. та ін., J. Exp. Med., 167, 1988, сс. 1975-80; Tedder T.F. та ін., J. Immunol. 142, 1989, сс. 2560-2568). CD20 експресується на більше ніж 90 % В-клітин неходжкінської лімфоми (НХЛ) (Anderson K.C. та ін., Blood 63, 1984, сс. 1424-1433), але він не виявлений на кровотворних стовбурних клітинах, попередниках В-клітин, нормальних плазматичних клітинах або на інших здорових тканинах (Tedder T.F. та ін., J. Immunol. 135(2), 1985, сс. 973-979). Існує два різні типи анти-CD20 антитіл, що суттєво відрізняються за способом зв'язування CD20 і за біологічними діями (Cragg M.S. та ін., Blood, 103, 2004, сс. 2738-2743; Cragg M.S. та ін., Blood, 101, 2003, сс. 1045-1051). Антитіла I типу, наприклад, ритуксимаб, активно діють у комплемент-опосередкованій цитотоксичності, а антитіла II типу, наприклад, тоситумомаб (B1), 11B8, AT80 або гуманізовані антитіла B-Ly1, ефективно ініціюють загибель клітин-мішеней через каспаза-незалежний апоптоз із супутньою експозицією фосфатидилсерину. Загальні відмітні властивості анти-CD20 антитіл типу I і типу II підсумовані у табл. 1. Таблиця 1 Властивості анти-CD20 антитіл I і II типу Анти-CD20 антитіла I типу Епітоп CD20 I типу Локалізують CD20 на ліпідних рафтах Підвищена CDC (у випадку ізотипу IgG1) Дія ADCC (у випадку ізотипу IgG1) Анти-CD20 антитіла II типу Епітоп CD20 II типу Не локалізують CD20 на ліпідних рафтах Знижена CDC (у випадку ізотипу IgG1) Дія ADCC (у випадку ізотипу IgG1) 50 1 UA 110096 C2 Продовження таблиці 1 Властивості анти-CD20 антитіл I і II типу Повною мірою мають з'єднувальну здатність Гомотипове агрегування Знижена з'єднувальна здатність Посилене гомотипове агрегування Сильна індукція загибелі клітин із перехресним Індукція апоптозу при перехресному зв'язуванні зв'язуванням 5 10 15 20 25 30 35 40 45 50 Бендамустин Бендамустином (торговельні назви рибомустин і трианда, а також SDX-105) є азотистим іпритом, який застосовують для лікування хронічного лімфолейкозу (ХЛЛ) (Kath R. та ін., Cancer Res. Clin. Oncol., 127, 2001, сс. 48-54) і В-клітинної неходжкінської лімфоми (НХЛ). Він належить до групи лікарських засобів, які називають алкілуючими агентами. Бендамустин у цей час також досліджують в якості засобу лікування саркоми (Bagchi S., Lancet Oncol., 8, 2007, с. 674). Бендамустин застосовують в якості терапевтичного агента разом із іншими агентами, включаючи ритуксимаб (Cheson B.D. та ін., J Clin Oncol., 27(9), 2009, сс. 1492-501; Knauf W., Expert Rev Anticancer Ther., (2)9, 2009, сс. 165-174; Plosker G.L. та ін., Drugs. 68(18), 2008, сс. 2645-2660). Короткий опис винаходу Зненацька було встановлено, що комбінація бендамустину з нефукозильованим анти-CD20 антитілом проявляє синергетичне (наприклад, навіть більше ніж адитивні) антипроліферативні дії у порівнянні з комбінацією з ритуксимабом, що не є нефукозильованим анти-CD20 антитілом. Даний винахід включає застосування нефукозильованого анти-CD20 антитіла з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 для одержання лікарського засобу для лікування раку у комбінації з бендамустином. Іншим об'єктом за даним винаходом є спосіб лікування хворого раком пацієнта шляхом введення нефукозильованого анти-CD20 антитіла з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 у комбінації з бендамустином пацієнтові, що потребує такого лікування. Іншим об'єктом за даним винаходом є нефукозильоване анти-CD20 антитіло з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 для лікування раку у комбінації з бендамустином. В одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 % від загальної кількості олігосахаридів (цукрів) за положенням Asn297. В іншому варіанті здійснення даного винаходу кількість фукози становить 0 % від загальної кількості олігосахаридів за положенням Asn297. В одному з варіантів здійснення даного винаходу нефукозильованим анти-CD20 антитілом є антитіло IgG1. В іншому варіанті здійснення даного винаходу зазначене нефукозильоване анти-CD20 антитіло є гуманізованим антитілом B-Ly1 і зазначеним раком є рак, який експресує CD20, який в одному з варіантів здійснення даного винаходу є В-клітинною неходжкінською лімфомою (НХЛ). В одному з варіантів здійснення даного винаходу гуманізоване антитіло B-Ly1 вводять у дозі від 800 дo 1200 мг на 1, 8, 15 добу 6-тижневого циклу дозування та потім у дозі від 800 до 1200 2 мг на 1 добу до п'яти 4-тижневих циклів дозування, і бендамустин вводять у дозі від 80 мг/м дo 2 110 мг/м на 1 і 2 добу до шести 4-тижневих циклів дозування. В одному з варіантів здійснення даного винаходу передбачена композиція, що включає анти-CD20 нефукозильоване антитіло з кількістю фукози 60 % або менше і бендамустин, для лікування раку. Докладний опис винаходу Даний винахід включає застосування нефукозильованого анти-CD20 антитіла ізотипу IgG1 або IgG3 (переважно ізотипу IgG1) з кількістю фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 для одержання лікарського засобу для лікування раку у комбінації з бендамустином. В одному з варіантів здійснення даного винаходу нефукозильоване анти-CD20 антитіло зв'язує CD20 з величиною KD oт 10-9 дo 10-13 молей/л. В одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 % від загальної кількості олігосахаридів (цукрів) за положенням Asn297. Поняття "антитіло" охоплює різні форми антитіл, включаючи, але ними не обмежуючись, цілі 2 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла, антитіла людини, гуманізовані антитіла й генетично сконструйовані антитіла, наприклад, моноклональні антитіла, химерні антитіла або рекомбінантні антитіла, а також фрагменти таких антитіл, довжина яких така, що зберігаються відмітні властивості за даним винаходом. Поняття "моноклональне антитіло" або "композиція моноклонального антитіла" у контексті даного винаходу відносяться до препарату молекул антитіла єдиного амінокислотного складу. Відповідно, поняття "моноклональне антитіло людини" відноситься до антитіл, що проявляють окрему з'єднувальну специфічність, і містить варіабельні й константні області, які походять від послідовностей імуноглобулінів зародкової лінії людини. В одному з варіантів здійснення даного винаходу моноклональні антитіла людини виробляються гібридомою, яка включає В-клітини, отримані від трансгенної тварини, але не від людини, наприклад, трансгенної миші з геномом, що включає трансген важкого ланцюга людини й трансген легкого ланцюга людини, гібридизовані з безсмертними клітинами. Поняття "химерне антитіло" відноситься до моноклонального антитіла, що включає варіабельну область, наприклад, область зв'язування, від одного джерела або виду й щонайменше частину константної області, похідної від іншого джерела або виду, особливо отриману методами рекомбінації ДНК. Особливо кращі химерні антитіла, що включають варіабельну область миші й константну область людини. Такі химерні антитіла миші/людини є продуктом експресованих генів імуноглобуліну, що включають сегменти ДНК, які кодують варіабельні області імуноглобуліну миші, і сегменти ДНК, які кодують константні області імуноглобуліну людини. До інших форм "химерних антитіл", які охоплювані даним винаходом, відносяться ті, у яких клас або підклас модифікований або змінений у порівнянні з вихідним антитілом. Такі "химерні" антитіла також називаються "антитілами переключеного класу". До методів одержання химерних антитіл відносяться загальноприйняті методи рекомбінантної ДНК і генної трансфекції, відомі у даній галузі. Див., наприклад, Morrison S.L. та ін., Proc. Natl. Acad Sci. USA 81, 1984, сс. 6851-6855; US 5202238 і US 5204244. Поняття "гуманізоване антитіло" відноситься до антитіл, у яких каркасна ділянка або "комплементарність-детерміновані області (complementarity determining regions – CDR)» модифіковані для включення області CDR імуноглобуліну іншої специфічності у порівнянні зі специфічністю вихідного імуноглобуліну. У кращому варіанті здійснення даного винаходу CDR миші пересаджують у каркасну ділянку антитіла людину для одержання "гуманізованого антитіла". Див., наприклад, Riechmann L. та ін., Nature 332, 1988, сс. 323-327; Neuberger M.S. та ін., Nature 314, 1985, сс. 268-270. У контексті даного винаходу поняття "антитіло людини" відноситься до антитіл, що містять варіабельні й константні області, похідні від послідовностей імуноглобуліну зародкової лінії людини. Антитіла людини відомі у даній галузі (van Dijk M.A., van de Winkel J.G., Curr. Opin. Pharmacol. 5, 2001, сс. 368-374). Ґрунтуючись на такому підході, можуть бути отримані антитіла людини проти великої кількості різноманітних мішеней. Приклади антитіл людини описані, наприклад, Kellermann S.A. та ін., Curr Opin Biotechnol. 13, 2002, сс. 593-597. Поняття "рекомбінантне антитіло людини" у контексті даного винаходу охоплює всі антитіла людини, які отримані, експресовані, створені або виділені методами рекомбінації, наприклад, антитіла, виділені з клітини-хазяїна, наприклад, клітини NS0 або CHO, або від тварини (наприклад, миші), трансгенної за генами імуноглобуліну, або антитіла, експресовані з використанням вектора рекомбінантної експресії, трансфекованого у клітину-хазяїна. Такі рекомбінантні антитіла людини мають варіабельні й константні області, похідні від послідовностей імуноглобуліну зародкової лінії у перегрупованій формі. Рекомбінантні антитіла людини за даним винаходом були піддані соматичному гіпермутуванню in vivo. Відповідно амінокислотні послідовності областей VH і VL рекомбінантних антитіл є послідовностями, які хоча й походять від послідовностей, близьких до послідовностей VH і VL зародкової лінії людини, природно можуть бути відсутні у спектрі антитіл зародкової лінії людини in vivo. У контексті даного винаходу поняття "зв'язування" або "специфічне зв'язування" відносяться до специфічного зв'язування антитіла з епітопом пухлинного антитіла у дослідженні in vitro, переважно у дослідженні методом плазмонного резонансу (фірма BIAcore, GE-Healthcare Упсала, Швеція) з очищеним антигеном дикого типу. Спорідненість зв'язування виражається у термінах "ka" (константа швидкості асоціації антитіла з комплексу антитіло/антиген), "k D" (константа дисоціації) і "KD" (kD/ka). Зв'язування або специфічне зв'язування означає -8 -9 -13 з'єднувальну спорідненість (KD) 10 молей/л або менше, переважно від 10 M дo 10 молей/л. Відповідно нефукозильоване антитіло за даним винаходом специфічно зв'язується з пухлинним -8 -9 антигеном з з'єднувальною спорідненістю (KD) 10 молей/л або менше, переважно від 10 до -13 10 молей/л. Поняття "молекула нуклеїнової кислоти" у контексті даного винаходу відноситься до 3 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекул ДНК і молекул РНК. Молекула нуклеїнової кислоти може бути одноланцюговою або дволанцюговою, але переважно дволанцюговою ДНК. Поняття "константні домени" означає, що вони не залучені безпосередньо у зв'язування антитіла з антигеном, але беруть участь у прояві ефекторних функцій (ADCC, зв'язування комплементу та CDC). Поняття "варіабельна область" (варіабельна область легкого ланцюга (VL), варіабельна область важкого ланцюга (VH)), яке застосовується у даному винаході, означає кожну з пар легкого та важкого ланцюгів, залучену безпосередньо у зв'язування антитіла з антигеном. Домени варіабельних легкого та важкого ланцюгів людини мають одну загальну структуру, і кожний домен включає чотири каркасні ділянки (framework region – FR), послідовності яких у високому ступені консервативні, які сусідствують з трьома "гіперваріабельними областями" (або комплементарність-детермінуючими областями–complementarity determining regions, CDR). Каркасні ділянки приймають конформацію бета-шару і області CDR можуть формувати петлі, що поєднують структуру бета-шару. Області CDR у кожному ланцюзі підтримуються в їхній тривимірній структурі каркасними ділянками й формують разом із областями CDR з сайту зв'язування антигена іншого ланцюга. У контексті даного винаходу поняття "гіперваріабельна область" або "антигензв'язуюча частина антитіла" відноситься до амінокислотних залишків антитіла, які відповідальні за зв'язування антигену. Гіперваріабельна область включає амінокислотні залишки з « комплементарність-детермінуючих областей (complementarity determining regions – CDR)». Поняття "каркасна ділянка (framework region – FR)» відноситься до тих варіабельних доменних областей, які відмінні від залишків гіперваріабельних областей, відповідно описаному у даному винаході. Таким чином, легкі та важкі ланцюги антитіла включають у напрямку від N- до C-кінця домени FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. Особливо CDR3 важкого ланцюга є областю, яка найбільшою мірою впливає на зв'язування антигена. Області CDR і FR визначають за стандартом, описаним у кн.: Kabat та ін. "Sequences of Proteins of Immunological Interest", 1991, 5-е вид., Міністерство охорони здоров'я й соціального забезпечення США, Національний інститут здоров'я, Бетесда, Меріленд, і/або за тими залишками, які походять з "гіперваріабельної петлі". Бендамустин є 4-[5-[біс(2-хлоретил)аміно]-1-метилбензімідазол-2-іл]бутановою кислотою. Торговельні назви цієї сполуки "рибомустин" і "треанда"; бендамустин також відомий за назвою SDX-105. Бендамустин являє собою азотистий іприт, який застосовують для лікування хронічного лімфолейкозу (ХЛЛ) (Kath R. та ін., J. Cancer Res. Clin. Oncol., 127, 2001, сс. 48-54) і В-клітинної неходжкінської лімфоми (НХЛ). Він належить до групи ліків, які називають алкілуючими агентами, і також досліджується для лікування саркоми (Bagchi S., Lancet Oncol., 8, 2007, с. 674). Поняття "нефукозильоване антитіло" відноситься до антитіла ізотипу IgG1 або IgG3 (переважно ізотипу IgG1) зі зміненим типом глікозилування в області Fc у положенні Asn297, що має знижений рівень залишків фукози. Глікозилування IgG1 або IgG3 людини локалізоване у положенні Asn297 у вигляді корового біантеного складного олігосахаридного глікозилування, що закінчується двома залишками Gal. Ці структури позначають як залишки гліканів G0, G1 (α1,6 або α1,3) або G2 залежно від кількості кінцевих залишків Gal (Raju T.S., Bioprocess Int., 1 2003, сс. 44-53). Тип глікозилування CHO частин антитіла Fc описаний, наприклад, у роботі Routier F.H., Glycoconjugate J., 14, 1997, сс. 201-207. Антитіла, які рекомбінантно експресуються у клітинах-хазяїнах СНО без глікомодифікації, звичайно фукозильовані за положенням Asn297 у кількості щонайменше 85 %. Слід ураховувати, що у контексті даного винаходу поняття нефукозильованого антитіла передбачає антитіло, в якого немає фукози у властивому йому характері глікозилування. У більшості випадків відомо, що типове положення глікозилованого залишку в антитілі займає аспарагін за положенням 297 у системі нумерації EU ("Asn297"). Поняття "система нумерації EU" або "індекс EU" звичайно застосовують стосовно залишку у константній області важкого ланцюга імуноглобуліну (наприклад, індекс EU представлений у кн.: Kabat та ін. "Sequences of Proteins of Immunological Interest", 1991, 5-е вид., Міністерство охорони здоров'я й соціального забезпечення США, Національний інститут здоров'я, Бетесда, Меріленд). Таким чином, нефукозильоване антитіло за даним винаходом означає антитіло ізотипу IgG1 або IgG3 (переважно ізотипу IgG1), в якому кількість фукози становить 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297 (це означає, що щонайменше 40 % або більше олігосахаридів в області Fc за положенням Asn297 фукозильовано). В одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 % олігосахаридів в області Fc за положенням Asn297. В іншому варіанті здійснення даного 4 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу кількість фукози становить 50 % або менше, і в ще одному варіанті здійснення даного винаходу кількість фукози становить 30 % або менше від кількості олігосахаридів в області Fc за положенням Asn297. В іншому варіанті здійснення даного винаходу кількість фукози становить 0 % від кількості олігосахаридів в області Fc за положенням Asn297. Відповідно до даного винаходу поняття "кількість фукози" означає кількість зазначеного олігосахариду (фукози) в олігосахаридному ланцюжку (ланцюжку цукру) за положенням Asn297 щодо суми всіх олігосахаридів (цукрів), приєднаних до Asn 297 (наприклад, комплексних, гібридних і утримуючих велику кількість манози структур), вимірюване методом MALDI-TOF спектрометрії й розраховане в якості середньої величини (докладний метод визначення кількості фукози описаний, наприклад, у WO 2008/077546). Крім того, в одному з варіантів здійснення даного винаходу олігосахариди області Fc роздвоєні. Нефукозильоване антитіло за даним винаходом може експресуватися у глікомодифікованій клітині-хазяїні, сконструйованої для експресії щонайменше однієї нуклеїнової кислоти, що кодує поліпептид, який має дію GnTIII, у кількості, достатній для часткового фукозилування олігосахаридів в області Fc. В одному з варіантів здійснення даного винаходу поліпептид, який має дію GnTIII, є гібридним поліпептидом. В іншому варіанті дія α1,6-фукозилтрансферази клітини-хазяїна може бути знижена або елімінована згідно з US 6946292 для одержання глікомодифікованих клітин-хазяїнів. Ступінь фукозилування антитіла може бути визначена, наприклад, або умовами ферментації (наприклад, часом ферментації), або комбінуванням щонайменше двох антитіл з різним ступенем фукозилування. Такі нефукозильовані антитіла й відповідні способи глікоінженірингу описані у WO 2005/044859, WO 2004/065540, WO 2007/031875, Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176-180; WO 99/154342, WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2005/011735, WO 2005/027966, WO 97/028267, US2006/0134709, US2005/0054048, US2005/0152894, WO 2003/035835, WO 2000/061739. Такі глікоінженерні антитіла мають підвищену величину ADCC. Інші методи глікоінженірингу, за допомогою яких одержують нефукозильовані антитіла за даним винаходом, описані, наприклад, у роботах Niwa R. та ін., J. Immunol. Methods, 306, 2005, сс. 151-160; Shinkawa T. та ін., J Biol Chem, 278, 2003, сс. 3466-3473; WO 03/055993 або US 2005/0249722. Таким чином, одним із об'єктів даного винаходу є застосування нефукозильованого антиCD20 антитіла ізотипу IgG1 або IgG3 (переважно ізотипу IgG1), що специфічно зв'язується з CD20 і містить кількість фукози 60 % або менше від загальної кількості олігосахаридів (цукрів) за положенням Asn297, для одержання лікарського засобу для лікування раку у комбінації з бендамустином. В одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 % від загальної кількості олігосахаридів (цукрів) за положенням Asn297. Антиген CD20 (який також називають В-лімфоцитарним антигеном CD20, B-лімфоцитарним поверхневим антигеном B1, Leu-16, Bp35, BM5 і LF5; послідовність позначена номером P11836 у базі даних Swissprot) є гідрофобним трансмембранним білком з молекулярною масою приблизно 35 кДа, розташованим на попередниках В-лімфоцитів і на зрілих В-лімфоцитах. (Valentine M.A. та ін., J. Biol. Chem., 264(19), 1989, сс. 11282-11287; Tedder T.F. та ін., Proc. Natl. Acad. Sci. U.S.A., 85, 1988, сс. 208-212; Stamenkovic I. та ін., J. Exp. Med., 167, 1988, сс. 1975-80; Einfeld D.A. та ін., EMBO J., 7, 1988, сс. 711-717; Tedder T.F. та ін., J. Immunol., 142, 1989, сс. 2560-2568). Відповідний ген людини являє собою трансмембранний 4-доменний підродини A представник 1, який також позначають MS4A1. Цей ген кодує представника сімейства трансмембранних 4А генів. Представники цього сімейства, що формується, відрізняються загальними структурними властивостями й подібними границями сплайсування інтрона/екзона й проявляють унікальні варіанти експресії серед клітин кровотворення й нелімфоїдних тканин. Цей ген кодує молекулу на поверхні В-лімфоцитів, яка бере участь у розвитку й диференціації B-клітин у клітині плазми. Представник цього сімейства локалізований за положенням 11q12, серед кластера представників сімейства. Інший сплайсинг цього гена приводить до двох варіантів транскрипта, які кодують той самий білок. Поняття "антиген CD20" і "CD20" у контексті даного винаходу застосовують взаємозамінно і до них відносять які-небудь варіанти, ізоформи та гомологи CD20 людини інших видів, які природно експресуються клітинами або експресуються на поверхні клітин, які трансфековані геном CD20. Зв'язування антитіла за даним винаходом з антигеном CD20 опосередковує знищення клітин, які експресують CD20 (наприклад, клітин пухлини), шляхом інактивування CD20. Знищення клітин, які експресують CD20, може відбуватися за одним або декількома з наступних механізмів: індукції загибелі клітин/апоптозу, ADCC і CDC. До синонімів CD20, які застосовують у даній галузі, відносяться B-лімфоцитний антиген CD20, B-лімфоцитний поверхневий антиген B1, Leu-16, Bp35, BM5 і LF5. Поняття "анти-CD20 антитіло" у контексті даного винаходу відноситься до антитіла, яке 5 UA 110096 C2 специфічно зв'язується з антигеном CD20. Залежно відз'єднувальних властивостей і біологічної дії анти-CD20 антитіл стосовно антигена CD20 можуть бути виділено два типи анти-CD20 антитіл (анти-CD20 антитіла I і II типу) згідно Cragg M.S. та ін., Blood, 103, 2004, сс. 2738-2743; і Cragg M.S. та ін., Blood, 101, 2003, сс. 1045-1051, див. табл. 2. 5 Таблиця 2 Властивості анти-CD20 антитіл I і II типу Анти-CD20 антитіла I типу Епітоп CD20 I типу Локалізуються CD20 на ліпідних рафтах Підвищена цитотоксичність CDC (у випадку ізотипу IgG1) Дія ADCC (у випадку ізотипу IgG1) Повною мірою властива здатність до зв'язування Гомотипове агрегування Анти-CD20 антитіла II типу Епітоп CD20 II типу Не локалізуються CD20 на ліпідних рафтах Знижена цитотоксичність CDC (у випадку ізотипу IgG1) Дія ADCC (у випадку ізотипу IgG1) Знижена здатність до зв'язування Посилене гомотипове агрегування Індукція високої загибелі клітин Індукція апоптозу при перехресному зв'язуванні перехресного зв'язування 10 15 20 25 30 35 40 45 без До прикладів анти-CD20 антитіл II типу відносяться, наприклад, гуманізоване B-Ly1 антитіло IgG1 (химерне гуманізоване антитіло IgG1, описане у WO 2005/044859), 11B8 IgG1 (описане у WO 2004/035607) і AT80 IgG1. Звичайно анти-CD20 антитіла II типу ізотипу IgG1 проявляють відмітні властивості CDC. Анти-CD20 антитіла II типу мають знижену цитотоксичність CDC (у випадку ізотипу IgG1) у порівнянні з антитілами I типу ізотипу IgG1. До прикладів анти-CD20 антитіл I типу відносяться, наприклад, ритуксимаб, HI47 IgG3 (ECACC, гібридома), антитіло 2C6 IgG1 (описане у WO 2005/103081), 2F2 IgG1 (описане у WO 2004/035607 і WO 2005/103081) і 2H7 IgG1 (описане у WO 2004/056312). Нефукозильовані анти-CD20 антитіла за даним винаходом в одному з варіантів здійснення даного винаходу є анти-CD20 антитілами II типу, у більше конкретному варіанті здійснення даного винаходу анти-CD20 антитіло II типу є нефукозильованим гуманізованим антитілом BLy1. Нефукозильовані анти-CD20 антитіла за даним винаходом мають підвищену антитілозалежну клітинну цитотоксичність (antibody dependent cellular cytotoxicity – ADCC) на відміну від анти-CD20 антитіл, що не мають знижений вміст фукози. Поняття "нефукозильоване анти-CD20 антитіло з підвищеною антитілозалежною клітинною цитотоксичністю (antibody dependent cellular cytotoxicity – ADCC)» у контексті даного винаходу означає нефукозильоване анти-CD20 антитіло, що має підвищену цитотоксичність ADCC, яку визначають яким-небудь прийнятним методом, відомим фахівцям у даній галузі. Одним із відомих методів аналізу ADCC in vitro є наступний: 1) в аналізі використовують клітини-мішені, про яких відомо, що вони експресують антигенмішень, яка розпізнається антигензв'язуючою областю антитіла; 2) в аналізі використовують мононуклеарні клітини периферичної крові людини (МКПК), виділені з крові випадковим чином вибраних здорових донорів, як ефекторні клітини; 3) аналіз проводять за наступним протоколом: i) МКПК виділяють, використовуючи стандартні процедури центрифугування у градієнті 6 щільності, і суспендують до щільності 5 × 10 клітин/мл у культуральному середовищі RPMI; ii) клітини-мішені вирощують стандартними методами роботи з тканинними культурами, збирають на експонентній фазі росту при життєздатності більше 90 %, промивають у 51 середовищі для культур клітин RPMI, мітять 100 мікрокюрі Cr, промивають двічі середовищем 5 для культур клітин і ресуспендують у середовищі для культур клітин при щільності 10 клітин/мл; iii) 100 мікролітрів зазначеної вище підсумкової суспензії клітин-мішеней переносять у кожну ямку 96-ямкового планшета для мікротитрувань; iv) антитіло серійно розводять від 4000 нг/мл дo 0,04 нг/мл у середовищі для культур клітин і по 50 мікролітрів одержуваних розчинів антитіла вносять до клітин-мішеней у 96-ямковий планшет для мікротитрувань, проводячи дослідження антитіла у трьох різних концентраціях, що перекривають зазначений вище діапазон концентрацій; v) для контролів максимального вивільнення (МВ) у три додаткові ямки планшета, що містять мічені клітини-мішені, вносять 50 мкл 2 % (VN) водного розчину неіонного детергенту 6 UA 110096 C2 5 10 15 20 25 30 35 40 45 (фірма Nonidet, Sigma, Сент-Луїс) замість розчину антитіла (пункт iv вище); vi) для контролів спонтанного вивільнення (СВ) у три додаткові ямки планшета, що містять мічені клітини-мішені, вносять по 50 мкл середовища RPMI для культур клітин замість розчину антитіла (пункт iv вище); vii) 96-ямковий планшет для мікротитрування потім центрифугують у режимі 50 × g протягом 1 хв та інкубують протягом 1 год. при 4 °C; viii) 50 мікролітрів суспензії МКПК (пункт i вище) вносять у кожну ямку для одержання співвідношення ефекторних клітин до клітин-мішеней 25:1 і планшети поміщають в інкубатор в атмосферу 5 % CO2 при 37 °C на 4 год.; ix) супернатант без клітин з кожної ямки збирають і підраховують експериментальновивільнену радіоактивність (ЕВР), використовуючи лічильник гамма-випромінювання; x) відсоток специфічного лізису розраховують для кожної концентрації антитіла за формулою (ЕВР-МВ)/(МВ-СВ) × 100, де ЕВР середню радіоактивність підраховують (див. вище пункт ix) для такої концентрації антитіла, МВ означає середню радіоактивність (див. вище пункт ix), розраховану для контролів МВ (див. вище п. V), і СВ означає середню радіоактивність (див. вище пункт ix), розраховану для контролів СВ (див. вище пункт vi); 4) "підвищена цитотоксичність ADCC" виражається або у вигляді підвищення максимального відсотка специфічного лізису, що спостерігається у дослідженому вище діапазоні концентрації антитіла, і/або зниження концентрації антитіла, необхідної для досягнення половини від максимального відсотка специфічного лізису, що спостерігається у дослідженому вище діапазоні концентрації антитіла. Підвищення величини ADCC щодо величини ADCC, вимірюваної за допомогою зазначеного вище аналізу, опосередкованої тим же антитілом, виробленим тим же типом клітин-хазяїнів, використовуючи ті ж стандартні методи одержання, очищення, переробки й зберігання, які відомі фахівцям у даній галузі, але які не виробляються клітинами-хазяїнами, сконструйованими для надекспресії GnTIII. Зазначена "підвищена цитотоксичність ADCC" може бути отримана глікоінжинірингом зазначених антитіл, що означає підвищення зазначених природних опосередкованих клітинами ефекторних функцій моноклональних антитіл шляхом інжинірингу їх олігосахаридного компонента згідно з описом у роботах Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176-180, та US 6602684. Поняття "комплементзалежної цитотоксичності (complement-dependent cytotoxicity – CDC)» відноситься до лізису клітин-мішеней пухлини людини антитілом за даним винаходом у присутності комплементу. CDC вимірюють переважно обробкою препарату клітин, які експресують CD20, анти-CD20 антитілом за даним винаходом у присутності комплементу. CDC виявляють, якщо антитіло індукує у концентрації 100 нM лізис (загибель клітин) 20 % або більш 51 пухлинних клітин через 4 год. Аналіз здійснюють переважно з Cr або Eu міченими пухлинними 51 клітинами й вимірюють Cr або Eu, що вивільнилися. Контролі включають інкубування пухлинних клітин-мішеней з комплементом, але без антитіла. Антитіло, яке називають ритуксимабом (контрольне антитіло; приклад анти-CD20 антитіла I типу), є генетично сконструйованим химерним моноклональним антитілом людини гамма 1, що містить константний домен миші та спрямований проти антигену людини CD20. Таке химерне антитіло містить константні домени гамма 1 людини і позначається "C2B8" в US 5736137. Ритуксимаб схвалений для лікування пацієнтів із рецидивуючою або такою, що не піддається лікуванню, злоякісною або фолікулярною CD20-позитивною В-клітинною неходжкінською лімфомою (НХЛ). Дослідження механізму дії in vitro показують, що ритуксимаб проявляє залежну від комплементу людини цитотоксичність (complement--dependent cytotoxicity – CDC) (Reff M.E. та ін., Blood, 83(2), 1994, сс. 435-445). Крім того, він проявляє істотну дію у дослідженнях з вимірювання антитілозалежної клітинної цитотоксичності (ADCC). Ритуксимаб не відноситься до нефукозильованих антитіл. 50 Антитіло Ритуксимаб (не відноситься до нефукозильованих антитіл) Дикого типу нефукозильоване глікоінженерне гуманізоване антитіло B-Ly1 (BHH6-B-KV1) (не відноситься до нефукозильованих антитіл) Нефукозильоване глікоінженерне гуманізоване антитіло B-Ly1 (B-HH6-B-KV1 GE) Кількість фукози >85 % >85 % 45-50 % Поняття "гуманізоване антитіло B-Ly1" відноситься до гуманізованого антитіла B-Ly1, описаного у WO 2005/044859 і WO 2007/031875, яке отримане з моноклонального анти-CD20 7 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла B-Ly1 миші (варіабельна область важкого ланцюга миші (VH): SEQ ID NO: 1; варіабельна область легкого ланцюга миші (VL): SEQ ID NO: 2 - див. Poppema S. і Visser L., Biotest Bulletin 3, 1987, с. 131-139) за рахунок химеризації з константною областю людини з IgG1 і наступною гуманізацією (див. WO 2005/044859 і WO2007/031875). Такі "гуманізовані антитіла B-Ly1" докладно описані у WO 2005/044859 і WO 2007/031875. В одному з варіантів здійснення даного винаходу "гуманізоване антитіло B-Ly1" має варіабельну область важкого ланцюга (VH), вибрану з групи послідовностей від SEQ ID NO:3 дo SEQ ID NO:20 (від B-HH2 дo B-HH9 і від B-HL8 дo B-HL17 у WO 2005/044859 і WO 2007/031875). Особливо кращі Seq. ID No. 3, 4, 7, 9, 11, 13 і 15 (B-HH2, B-HH3, B-HH6, B-HH8, B-HL8, B-HL11 і B-HL13 з WO 2005/044859 і WO 2007/031875). В одному специфічному варіанті здійснення даного винаходу "гуманізоване антитіло B-Ly1" містить варіабельну область легкого ланцюга (VL) послідовності SEQ ID No. 20 (B-KV1 з WO 2005/044859 і WO 2007/031875). В іншому специфічному варіанті здійснення даного винаходу "гуманізоване антитіло B-Ly1" містить варіабельну область важкого ланцюга (VH) послідовності SEQ ID NO:7 (B-HH6 з WO 2005/044859 і WO 2007/031875) і варіабельну область легкого ланцюга (VL) послідовності SEQ ID No. 20 (B-KV1 з WO 2005/044859 і WO 2007/031875). Крім того, в одному з варіантів здійснення даного винаходу гуманізоване антитіло B-Ly1 є антитілом IgG1. Згідно з даним винаходом такі нефукозильовані гуманізовані B-Ly1 антитіла є глікоінженерними (glycoengineered – GE) в області Fc відповідно до процедур, описаних у WO 2005/044859, WO 2004/065540, WO2007/031875, Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176-180, і WO99/154342. В одному з варіантів здійснення даного винаходу використовуване анти-CD20 антитіло є нефукозильованим глікоінженерним гуманізованим антитілом B-Ly1, яке позначають B-HH6-B-KV1 GE. Такі глікоінженерні гуманізовані B-Ly1 антитіла мають змінений тип глікозилування області Fc, переважно маючи знижений рівень залишків фукози. В одному з варіантів здійснення даного винаходу кількість фукози становить 60 % або менше від загальної кількості олігосахаридів у положенні Asn297 (в одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 %, в іншому варіанті здійснення даного винаходу кількість фукози становить 50 % або менше, у ще одному з варіантів здійснення даного винаходу кількість фукози становить 30 % або менше, і у ще одному іншому варіанті здійснення даного винаходу кількість фукози становить 0 %). Крім того, в одному зі специфічних варіантів здійснення даного винаходу олігосахариди в області Fc роздвоєні. Такі глікоінженерні гуманізовані B-Ly1 антитіла мають підвищену ADCC. Олігосахаридний компонент може суттєво вплинути на властивості, значимі для ефективності терапевтичного глікопротеїну, у тому числі на фізичну стабільність, стійкість до впливу протеази, взаємодії з імунною системою, фармакокінетичні показники та специфічну біологічну дію. Такі властивості можуть залежати не тільки від наявності або відсутності олігосахаридів, але також від їхніх специфічних структур. Деякі узагальнення між структурою олігосахаридів і функцією глікопротеїну можуть бути отримані. Наприклад, певні олігосахаридні структури опосередковують швидкий кліренс глікопротеїнів із кров'яного русла через взаємодії зі специфічними з'єднувальними білки вуглеводами, хоча інші можуть бути зв'язані антитілами та індукують імунні реакції. (Jenkins N. та ін., Nature Biotechnol., 14, 1996, сс. 975-981). Клітини ссавців є чудовими хазяїнами для вироблення терапевтичних глікопротеїнів через їхню здатність глікозилувати білки у найбільше прийнятній формі для застосування людьми. (Cumming D.A. та ін., Glycobiology, 1, 1991, сс. 115-130; Jenkins N. та ін., Nature Biotechnol., 14, 1996, сс. 975-981). Бактерії дуже рідко глікозилують білки, але подібно іншим типам звичайних хазяїнів, наприклад, клітин дріжджів, міцеліальних грибів, комах і рослин, дають варіанти глікозилування, асоційовані зі швидким кліренсом із кров'яного русла, небажаними імунними реакціями й у деяких особливих випадках зі зниженою біологічною дією. Серед клітин ссавців найбільше часто протягом двох останніх десятиліть використовують клітини яєчника китайського хом'ячка (Chinese hamster ovary – CHO). Крім одержання стабільних варіантів глікозилування ці клітини дозволяють виробляти стійке покоління генетично стабільних високо продуктивних клональних клітинних ліній. Вони можуть культивуватися до високих щільностей у простих біореакторах, використовуючи середовища без сироватки, і дозволяють створювати безпечні й відтворені біопроцеси. До інших звичайно використовуваних клітин тварин відносяться клітини нирки дитинчати хом'ячка (baby hamster kidney – BHK), NSO- і SP2/0-клітини мієломи миші. Раніше досліджували продуктивність трансгенних тварин. (Jenkins N. та ін., Nature Biotechnol., 14, 1996, сс. 975-981). Усі антитіла містять вуглеводні структури у консервативних положеннях константних областей важкого ланцюга, причому кожний ізотип має у своєму розпорядженні відмітне складання N-зв'язаних вуглеводних структур, які варіабельно впливають на складання білка, 8 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 секрецію або функціональну дію. (Wright A., Monison S.L., Trends Biotech., 15, 1997, сс. 26-32). Структура приєднаного N-зв'язаного вуглеводу суттєво варіює залежно від ступеня процесингу й може включати велику кількість манози, багаторазово розгалужена подібно біантенному комплексу олігосахаридів. (Wright A., Morrison S.L., Trends Biotech., 15, 1997, сс. 26-32). Звичайно є гетерогенний процесинг серцевинних олігосахаридних структур, приєднаних до певного сайту глікозилування таким чином, що навіть моноклональні антитіла існують у вигляді множини глікоформ. Крім того, показано, що великі відмінності у глікозилуванні антитіла є у клітинних ліній і спостерігають навіть мінорні відмінності для даної клітинної лінії, вирощеної у різних умовах культивування. (Lifely M.R. та ін., Glycobiology, 5(8), 1995, сс. 813-822). Один зі способів істотного збільшення ефективності дії, зберігаючи при цьому простий спосіб одержання при ймовірній відсутності істотних небажаних побічних ефектів, полягає у підвищенні природних опосередкованих клітинами ефекторних функцій моноклональних антитіл шляхом інжинірингу їх олігосахаридного компоненту згідно з описом у роботах Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176-180, та US 6602684. Антитіла типу IgG1, які звичайно використовують в імунотерапії раку, є глікопротеїнами з консервативним N-зв'язаним сайтом глікозилування за положенням Asn297 у кожному домені CH2. Два складних біантених олігосахариди, приєднаних до Asn297, занурені між доменами CH2, формуючи просторові контакти з поліпептидним каркасом, та їх наявність важлива для антитіла для опосередкування ефекторних функцій, наприклад, антитілозалежної клітинної цитотоксичності (ADCC) (Lifely M.R. та ін., Glycobiology, 5, 1995, сс. 813-822; Jefferis R. та ін., Immunol. Rev., 163, 1998, сс. 59-76; Wright A., Morrison S.L., Trends Biotechnol., 15, 1997, сс. 26-32). Раніше було показано, що надекспресія у клітинах яєчника китайського хом'ячка CHO ß(1,4)N-ацетилглюкозамінілтрансферази I11 ("GnTII17y") – глікозилтрансферази, що каталізує формування розгалужених олігосахаридів, суттєво підвищує дію ADCC in vitro антинейробластомного химерного моноклонального антитіла (chce7), яке виробляється сконструйованими клітинами CHO. (Див. Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176180; і WO 99/154342, сутність яких включена у даний винахід у вигляді посилань). Антитіло chce7 належить до великого класу некон'югованих моноклональних антитіл, які мають підвищену спорідненість і специфічність відносно пухлин, але занадто слабкі для клінічного застосування при одержанні стандартними промисловими лініями клітин, що втратили фермент GnTIII (Umana P. та ін., Nature Biotechnol. 17, 1999, сс. 176-180). Це дослідження вперше показало, що значні підвищення дії ADCC можуть бути отримані шляхом інжинірингу клітин, що виробляють антитіла, для експресії GnTIII, що також приводить до підвищення у пропорції константна область (Fc)-асоційованих розгалужених олігосахаридів, включаючи розгалужені нефукозильовані олігосахариди, вище рівнів, установлених у природних антитіл. Поняття "рак" у контексті даного винаходу включає лімфоми, лімфоцитарні лейкози, рак легенів, недрібноклітинний рак легенів (non small cell lung – NSCL), бронхоальвеолярноклітинний рак легенів, рак костей, рак підшлункової залози, рак шкіри, рак голови або шиї, шкірну або внутрішньоочну меланому, рак матки, рак яєчника, рак прямої кишки, рак анальної області, рак шлунка, рак товстої кишки, рак грудей, рак матки, рак фалопієвих труб, карциному ендометрію, карциному шийки матки, карциному піхви, карциному вульви, хворобу Ходжкіна, рак стравоходу, рак тонкого кишечнику, рак ендокринної системи, рак щитовидки, рак паращитовидної залози, рак надниркових залоз, саркому м'яких тканин, рак уретри, рак пеніса, рак простати, рак сечового міхура, рак нирки або сечоводу, карциному клітин нирки, карциному ниркової балії, мезотеліому, гепатоклітинний рак, рак жовчного міхура, неоплазми центральної нервової системи (ЦНС), пухлини хребта, гліоми стовбура мозку, мультиформну гліобластому, астроцитому, шваному, епендимому, медулобластому, менінгіому, плоскоклітинну карциному, аденому гіпофіза, включаючи версії яких-небудь зі зазначених вище форм раку, що не піддаються лікуванню, або комбінацію одного або декількох зазначених вище форм раку. В одному з варіантів здійснення даного винаходу поняття "рак" відноситься до раку, який експресує CD20. Поняття "експресія антигену CD20" означає істотний рівень експресії антигену CD20 у клітині, переважно на поверхні T- або B-клітин, більше переважно В-клітин, з пухлини або раку, відповідно, переважно пухлини, що не є щільною. Пацієнти з "раком, який експресує CD20" можуть бути визначені за допомогою стандартних методів, відомих у даній галузі. Наприклад, експресія антигену CD20 може бути виміряна, використовуючи імуногістохімічний метод визначення (immunohistochemical – IHC), метод FACS або засноване на ПЛР виявленні відповідної іРНК. Поняття "рак, який експресує CD20" у контексті даного винаходу відноситься до всіх форм раку, в яких ракові клітини демонструють експресію антигену CD20. Переважно рак, який 9 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресує CD20, у контексті даного винаходу відноситься до лімфом (переважно до В-клітинної неходжкінської лімфоми (НХЛ)) і лімфоцитарних лейкозів. До таких лімфом і лімфоцитарних лейкозів відносяться, наприклад, a) фолікулярна лімфома, б) дрібноклітинна лімфома, що не ділиться/лімфома Беркітта (включаючи ендемічну лімфому Беркітта, спорадичну лімфому Беркітта и неберкіттську лімфому), в) лімфоми клітин маргінальної зони (включаючи екстранодальну лімфому з В-клітин маргінальної зони (асоційовану зі слизовою та лімфоїдною тканиною лімфому), вузлову лімфому з В-клітин маргінальної зони селезінки), г) лімфома клітин мантії, д) великоклітинна лімфома (включаючи В-клітинну дифузійну великоклітинну лімфому, змішаноклітинну дифузійну В-великоклітинну лімфому, імунобластичну лімфому, первинну медіастинальну В-клітинну лімфому, ангіоцентричну лімфому – легеневу В-клітинну лімфому), е) волосатоклітинний лейкоз, ж) лімфоцитарна лімфома, макроглобулінемія Вальденстрема, з) гострий лімфолейкоз, хронічний лімфолейкоз (ХЛЛ)/лімфома малих лімфоцитів, В-клітинний пролімфоцитарний лейкоз, і) неоплазми плазматичних клітин, мієлома плазматичних клітин, множинна мієлома, плазмацитома, к) хвороба Ходжкіна. В іншому варіанті здійснення даного винаходу раком, який експресує CD20, є В-клітинна неходжкінська лімфома (НХЛ). В іншому варіанті здійснення даного винаходу раком, який експресує CD20, є лімфома клітин мантії, гострий лімфоцитарний лейкоз, хронічний лімфолейкоз (ХЛЛ), B-клітинна дифузійна великоклітинна лімфома, лімфома Беркітта, волосатоклітинний лейкоз, фолікулярна лімфома, множинна мієлома, лімфома маргінальної зони, посттрансплантаційний лімфопроліферативний розлад, ВІЧ-асоційована лімфома, макроглобулінемія Вальденстрема або первинна лімфома ЦНС. Поняття "спосіб лікування" або його еквівалент стосовно, наприклад, до раку, означає процедуру або курс дій, який призначений для зниження або елімінації числа ракових клітин у пацієнта або для полегшення симптомів раку. "Спосіб лікування раку" або іншого проліферативного розладу не обов'язково означає, що ракові клітини або інший розлад насправді може бути еліміновано, що число клітин або розлад насправді може бути знижене, або що симптоми раку або іншого розладу насправді можуть бути полегшені. Часто спосіб лікування раку може бути здійснений навіть при низькій ймовірності успіху, але який, одержуючи історію хвороби та оцінку ймовірності виживання пацієнта, проте вважаючи доцільним індукувати загальний цілющий курс лікування. Поняття "спільне введення" і "вводяться разом" відносяться до введення зазначеного нефукозильованого анти-CD20 антитіла та бендамустину у вигляді єдиного складу або у вигляді двох різних складів. Спільне введення може бути одночасним або послідовним у тому або іншому порядку, причому переважно є період часу, коли обидва (або всі) діючі агенти одночасно проявляють свої біологічні дії. Зазначене анти-CD20 нефукозильоване антитіло та бендамустин вводяться спільно або одночасно, або послідовно (наприклад, внутрішньовенно шляхом безперервної інфузії (однієї для анти-CD20 антитіла й згодом іншої для бендамустину). Якщо обидва терапевтичних агента вводяться спільно й послідовно, дозу вводять або у ту же добу, або у вигляді двох окремих введень, або один із агентів вводять в 1 добу, а другий агент одночасно вводять на 2-7 добу, переважно на 2-4 добу. Таким чином, поняття "послідовно" означає протягом 7 діб після дози першого компонента (бендамустину або антитіла), переважно протягом 4 діб після введення дози першого компонента; і поняття "одночасно" означає введення у той самий час. Поняття "спільне введення" стосовно до підтримуючих доз зазначеного нефукозильованого анти-CD20 антитіла та бендамустину означає, що підтримуючі дози можуть бути або спільно вводитися одночасно, якщо цикл лікування відповідає обом лікарським засобам, наприклад, щотижня. Або бендамустин, наприклад, вводять, наприклад, кожні 1-3 доби, і зазначене нефукозильоване антитіло вводять щотижня. Або підтримуючі дози одночасно вводять одну за іншою або протягом однієї, або протягом декількох доби(діб). Якщо очевидно, що антитіла вводять пацієнтові у "терапевтично ефективній кількості" (або просто "ефективній кількості"), яке означає кількість відповідної сполуки або комбінації, яка може викликати біологічну або медичну відповідь тканини, системи, тварини або людини, яке підібране дослідником, ветеринаром, медиком або іншим клініцистом. Кількість спільного введення зазначеного нефукозильованого анти-CD20 антитіла та бендамустину і розрахунок часу спільного введення може залежати від типу (виду, статі, віку, маси тіла тощо) і стану пацієнта, що зазнає лікування, і тяжкості захворювання або стану, що зазнає лікування. Зазначене нефукозильоване анти-CD20 антитіло та бендамустин спільно вводять відповідним чином пацієнтові у деякий час або протягом серій лікування. Якщо проводять введення внутрішньовенно, первісний час інфузії для зазначеного нефукозильованого анти-CD20 антитіла або бендамустину може бути більше, ніж час для послідовних інфузій, наприклад, приблизно 90 хв для первісної інфузії та приблизно 30 хв для 10 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 наступних інфузій (якщо первісна інфузія добре переноситься). Залежно від типу і тяжкості захворювання кількість приблизно від 1 мкг/кг дo 50 мг/кг (наприклад, 0,1-20 мг/кг) зазначеного нефукозильованого анти-CD20 антитіла й від 1 мкг/кг дo 50 мг/кг (наприклад, 0,1-20 мг/кг) бендамустину являє собою первісну розглянуту дозу для спільного введення обох лікарських засобів пацієнтові. В одному з варіантів здійснення даного винаходу краща доза зазначеного нефукозильованого анти-CD20 антитіла (переважно нефукозильованого гуманізованого антитіла B-Ly1) може перебувати у діапазоні приблизно від 0,05 мг/кг дo приблизно 30 мг/кг. Таким чином, одна або декілька доз, що становлять приблизно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг, 10 мг/кг або 30 мг/кг (або яка-небудь їхня комбінація), можуть вводитися пацієнтові одночасно. В одному з варіантів здійснення даного винаходу доза бендамустину може бути у діапазоні від 0,01 мг/кг до приблизно 30 мг/кг, наприклад, від 0,1 мг/кг дo 10,0 мг/кг. Залежно від типу (виду, статі, віку, маси тощо) і стану пацієнта і від типу нефукозильованого анти-CD20 антитіла дози та схеми введення зазначеного нефукозильованого антитіла та бендамустину можуть відрізнятися, наприклад, зазначене нефукозильоване анти-CD20 антитіло може вводитися, наприклад, кожні 1-3 тижні, а бендамустин може вводитися щодня або кожні 2-10 доби. Також може вводитися первісна підвищена ударна доза з наступним введенням однієї або декількох більше низьких доз. В одному з кращих варіантів здійснення даного винаходу краща доза зазначеного нефукозильованого анти-CD20 антитіла (переважно нефукозильоване гуманізоване антитіло BLy1) може становити від 800 дo 1200 мг на 1, 8, 15 добу 6-тижневого циклу дозування і потім у дозі від 800 до 1200 мг на 1 добу до п'яти 4-тижневих циклів дозування, і краща доза 2 2 бендамустин може становити, наприклад, від 80 мг/м до 110 мг/м (в одному з варіантів 2 2 здійснення даного винаходу 110 мг/м , в іншому варіанті здійснення даного винаходу 90 мг/м ) на 1 і 2 добу (введення внутрішньовенно й протягом 30 хв на 1 і 2 добу) до шести 4-тижневих циклів дозування. В іншому варіанті доза зазначеного нефукозильованого анти-CD20 антитіла може становити від 800 дo 1200 мг (наприклад, 1000 мг) на 1 добу до восьми 3-тижневих циклів дозування. В одному з варіантів здійснення даного винаходу лікарський засіб застосовний для попередження або зниження метастазування або подальшого поширення захворювання у таких пацієнтів із раком, переважно з раком, який експресує CD20. Лікарський засіб застосовний для підвищення тривалості виживання таких пацієнтів, підвищуючи безпрогресивне виживання таких пацієнтів, підвищення тривалості відповіді, приводячи до статистично істотного та клінічно значимого поліпшення стану у підданих лікуванню хворих, яке виражається у тривалості виживання, безпрогресивного виживання, швидкості відповіді або тривалості відповіді. В одному зі специфічних варіантів здійснення даного винаходу лікарський засіб застосовний для підвищення швидкості відповіді у групі пацієнтів. У контексті даного винаходу додаткові інші цитотоксичні, хіміотерапевтичні або протиракові агенти або сполуки, які підвищують дію таких агентів (наприклад, цитокіни), можуть застосовуватися у лікуванні раку комбінацією нефукозильованого анти-CD20 антитіла та бендамустину. Такі молекули відповідним чином містяться у комбінації у кількостях, які ефективні для призначеної мети. В одному з варіантів здійснення даного винаходу зазначене лікування комбінацією нефукозильованого анти-CD20 антитіла та бендамустину застосовують без таких додаткових цитотоксичних, хіміотерапевтичних або протиракових агентів або сполук, які підвищують дію таких агентів. До таких агентів, наприклад, відносяться: алкілуючі агенти або агенти з алкілуючою дією, наприклад, циклофосфамід (CTX; наприклад, продукт cytoxan®), хлорамбуцил (CHL; наприклад, продукт leukeran®), цисплатин (Cisp; наприклад, продукт platinol®), бусульфан (наприклад, продукт myleran®), мелфалан, кармустин (BCNU), стрептозотоцин, триетиленмеламін (TEM), мітоміцин C та ін.;антиметаболіти, наприклад, метотрексат (MTX), етопозид (VP16; наприклад, продукт vepesid®), 6-меркаптопурин (6MP), 6-тіогуанін (6TG), цитарабін (Ara-C), 5-фторурацил (5-FU), капецитабін (наприклад, продукт Xeloda®), дакарбазин (DTIC) та ін.; антибіотики, наприклад, актиноміцин D, доксорубіцин (DXR; наприклад, продукт adriamycin®), даунорубіцин (дауноміцин), блеоміцин, мітраміцин та ін.; алкалоїди, наприклад, алкалоїди борвинка, наприклад, вінкристин (VCR), вінбластин та ін.; та інші протипухлинні агенти, наприклад, паклітаксел (наприклад, продукт taxol®) і похідні паклітакселу, цитостатики, глюкокортикоїди, наприклад, дексаметазон (DEX; наприклад, продукт decadron®) і кортикостероїди, наприклад, преднізон, нуклеозиди – інгібітори ферментів, наприклад, гідроксисечовина, ферменти, що виснажують амінокислоти, наприклад, аспарагіназа, лейковорин і інші похідні фолієвої кислоти, а також подібні різноманітні протиракові агенти. Агенти, що приводяться нижче, також можуть застосовуватися в якості додаткових агентів: арніфостин (наприклад, продукт ethyol®), 11 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 дактиноміцин, мехлоретамін (азотистий іприт), стрептозоцин, циклофосфамід, ломустин (CCNU), ліпосомний доксорубіцин (наприклад, продукт doxil®), гемцитабін (наприклад, продукт gemzar®), ліпосомний даунорубіцин (наприклад, продукт daunoxome®), прокарбазин, мітоміцин, досетаксел (наприклад, продукт taxotere®), алдеслейкін, карбоплатин, оксаліплатин, кладрибін, камптотецин, CPT 11 (іринотекан), 10-гідроксі 7-етил-камптотецин (SN38), флоксуридин, флударабін, іфосфамід, ідарубіцин, месна, інтерферон бета, інтерферон альфа, мітоксантрон, топотекан, лейпролід, мегестрол, мелфалан, меркаптопурин, плікаміцин, мітотан, пегаспаргас, пентостатин, піпоброман, плікаміцин, тамоксифен, теніпозид, тестолактон, тіогуанін, тіотепа, азотистий іприт, винорелбін, хлорамбуцил. Краще лікування комбінацією нефукозильованого анти-CD20 антитіла та бендамустину застосовують без таких додаткових агентів. Застосування цитотоксичних і протиракових агентів, описаних вище, а також антипроліферативних специфічних відносно мішені протиракових лікарських засобів, наприклад, інгібіторів протеїнкінази у хіміотерапевтичних режимах, звичайно добре охарактеризоване в області протиракової терапії, та їх застосування у контексті даного винаходу підпадає під ті ж розгляди для моніторингу стійкості та ефективності й для контролю шляхів введення і доз із деякими коректуваннями. Наприклад, реальні дозування цитотоксичних агентів можуть варіювати залежно від відповіді культивованих клітин пацієнта, визначеного за допомогою методів гістологічних культур. У цілому доза може бути знижена у порівнянні з кількістю, яка застосовується при відсутності інших додаткових агентів. Звичайно дози ефективного цитотоксичного агента можуть перебувати у діапазонах, рекомендованих виробником, і, якщо це випливає з відповідей in vitro або з відповідей, отриманих на тваринних моделях, можуть бути знижені приблизно до величини одного порядку концентрації або кількості. Таким чином, реальна доза може залежати від оцінки лікаря, стану пацієнта та ефективності способу терапії, заснованого на здатності до відповіді in vitro первинно культивованих злоякісних клітин або гістокультури зразка тканини, або відповідях, які спостерігаються у відповідних тваринних моделей. У контексті даного винаходу може застосовуватися ефективна кількість іонізуючої радіації й/або радіофармацевтичний агент може застосовуватися додатково до лікування раку, який експресує CD20, комбінацією нефукозильованого анти-CD20 антитіла та бендамустину. Джерело радіації може бути або зовнішнім, або внутрішнім для пацієнта, що зазнає лікування. Якщо джерело радіації зовнішнє для пацієнта, лікування проводять як терапію зовнішнім радіоактивним пучком. Якщо джерело радіації внутрішнє для пацієнта, лікування називають брахітерапією або близькофокусною променевою терапією. Радіоактивні атоми для застосування у контексті даного винаходу можуть бути вибрані з групи, що включає, але ними перелік не обмежується, радій, цезій-137, іридій-192, америцій-241, золото-198, кобальт-57, мідь-67, технецій-99, йод-123, йод-131 та індій-111. Також можливо мітити антитіла такими радіоактивними ізотопами. Краще лікування комбінацією нефукозильованого анти-CD20 антитіла та бендамустину застосовують без такої іонізуючої радіації. Радіаційна терапія є стандартним лікуванням для знищення нерезектабельних або неоперабельних пухлин і/або метастазів пухлин. Поліпшені результати спостерігають при радіаційній терапії, комбінованій з хіміотерапією. Радіаційна терапія заснована на принципі, що радіація у високій дозі, застосована у цільовій області, може призвести до загибелі репродуктивних клітин і у пухлинних, і у здорових тканинах. Режим дозування радіації звичайно виражають у термінах дози поглиненої радіації (греях, Гр), часу та фракціонування і він повинен бути ретельно визначений онкологом. Кількість радіації, яку отримує пацієнт, може залежати від різних обставин, але двома найбільше важливими є розташування пухлини і зв'язок з іншими важливими структурами або органами тіла та від ступеня поширення пухлини. Типовим курсом лікування пацієнта, що зазнає радіаційної терапії, може бути схема лікування протягом періоду з 1-6 тижнів із загальною дозою 10-80 Гр, введених пацієнтові при одиничному добовому ступені опромінення приблизно 1,8-2,0 Гр, 5 діб на тиждень. У кращому варіанті здійснення даного винаходу є синергізм, якщо пухлини пацієнта обробляють комбінованим лікуванням за даним винаходом і радіацією. Інакше кажучи, придушення росту пухлини за допомогою агентів, що включають комбінацію за даним винаходом, підвищене при комбінуванні радіації, необов'язково з додатковими протираковими або хіміотерапевтичними агентами. Параметри ад'ювантної радіаційної терапії представлені, наприклад, у WO 99/60023. Нефукозильовані анти-CD20 антитіла можуть вводитися пацієнтові відомими методами, наприклад, внутрішньовенним введенням у вигляді болюса або безперервної інфузії протягом певного часу, внутрішньом'язовим, внутрішньочеревинним, внутрішньоспиномозковим, підшкірним, внутрішньосуглобним, підоболонковим або внутрішньосиновіальним шляхом. В одному з варіантів здійснення даного винаходу такі антитіла вводять внутрішньовенно або 12 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 підшкірно. Бендамустин може вводитися пацієнтові відомими способами, наприклад, внутрішньовенним введенням у вигляді болюса або безперервної інфузії протягом певного часу, внутрішньом'язовим, внутрішньочеревинним, внутрішньоспиномозковим, підшкірним, внутрішньосуглобним, підоболонковим або внутрішньосиновіальним або пероральним шляхом. Відповідно до одного з варіантів здійснення даного винаходу таке антитіло вводять внутрішньовенно або внутрішньочеревинно. У контексті даного винаходу поняття "фармацевтично прийнятний носій" відноситься до якого-небудь або до всіх матеріалів, сумісних з фармацевтичним введенням, що включають розчинники, диспергуючі середовища, покривні матеріали, антибактеріальні та протигрибкові агенти, ізотонічні та затримуючі всмоктування агенти, а також інші матеріали і сполуки, сумісні з фармацевтичним введенням. За винятком тих випадків, коли які-небудь традиційні середовища або агенти несумісні з діючою сполукою, їх застосування розглядають у композиціях даного винаходу. Додаткові діючі сполуки також можуть бути включені у композиції. Фармацевтичні композиції Фармацевтичні композиції можуть бути отримані шляхом переробки анти-CD20 антитіла і/або бендамустину за даним винаходом з фармацевтично прийнятними неорганічними або органічними носіями. Лактоза, кукурудзяний крохмаль або їх похідні, тальк, стеаринові кислоти або їх солі тощо можуть застосовуватися, наприклад, в якості таких носіїв для таблеток, таблеток з покриттям, драже і твердих желатинових капсул. Відповідними носіями для м'яких желатинових капсул є, наприклад, рослинні олії, воски, жири, напіврідкі і рідкі поліоли тощо. Однак залежно від природи діючої речовини не потрібні носії, звичайно необхідні у випадку м'яких желатинових капсул. Відповідними носіями для одержання розчинів і сиропів є, наприклад, вода, поліоли, гліцерин, рослинні олії тощо. Прийнятними носіями для супозиторіїв є, наприклад, природні або гартівні масла, воски, жири, напіврідкі і рідкі поліоли тощо. Крім того, фармацевтичні композиції можуть містити консерванти, розріджувачі, стабілізатори, зволожуючі агенти, емульгатори, підсолоджувачі, барвники, ароматизатори, солі для зміни осмотичного тиску, буфери, маскуючі агенти або антиоксиданти. Вони також можуть містити інші речовини терапевтичного призначення. В одному з варіантів здійснення даного винаходу композиція включає й зазначене нефукозильоване анти-CD20 антитіло зі вмістом фукози 60 % або менше (в одному з варіантів здійснення даного винаходу зазначене антитіло є нефукозильованим гуманізованим антитілом B-Ly1), і бендамустин для застосування у лікуванні раку, зокрема, рак, який експресує CD20. Зазначена фармацевтична композиція може включати один або декілька фармацевтично прийнятних носіїв. Даний винахід додатково передбачає фармацевтичну композицію, зокрема для застосування відносно раку, що включає (i) ефективну кількість першого агента – нефукозильованого анти-CD20 антитіла зі вмістом фукози 60 % або менше (в одному з варіантів здійснення даного винаходу нефукозильоване гуманізоване антитіло B-Ly1), і (ii) ефективну кількість другого агента – бендамустину. Така композиція необов'язково включає фармацевтично прийнятні носії й/або ексципієнти. Фармацевтичні композиції нефукозильованого анти-CD20 антитіла, яка одна застосовується відповідно до даного винаходу, одержують для зберігання шляхом змішування антитіла необхідного ступеня чистоти з необов'язковими фармацевтично прийнятними носіями, е ексципієнтами або стабілізаторами (кн.: "Remington's Pharmaceutical Sciences", 1980, 16 вид., під ред. Osol A.) у формі ліофілізованих складів або водних розчинів. Прийнятні носії, ексципієнти або стабілізатори є нетоксичними для реципієнтів у застосовуваних дозах і концентраціях і до них відносяться буфери, наприклад, фосфатний, цитратний та інших органічних кислот; антиоксиданти, включаючи аскорбінову кислоту та метіонін; консерванти (наприклад, октадецилдиметилбензиламоній хлорид; гексаметоній хлорид; бензалконій хлорид, бензетоній хлорид; фенол, бутил або бензиловий спирт; алкілпарабени, наприклад, метил- або пропілпарабен; катехол; резорцин; циклогексанол; 3-пентанол; m-крезол); низькомолекулярні поліпептиди (містять приблизно менше 10 залишків); білки, наприклад, сироватковий альбумін, желатин або імуноглобуліни; гідрофобні полімери, наприклад, полівінілпіролідон; амінокислоти, наприклад, гліцин, глутамін, аспарагін, гістидин, аргінін або лізин; моносахариди, дисахариди та інші вуглеводи, включаючи глюкозу, манозу або декстрини; хелатуючі агенти, наприклад, EDTA; цукри, наприклад, сахароза, маніт, трегалоза або сорбіт; формуючі солі протиіони, наприклад, натрій; комплекси металів (наприклад, комплекси Zn-білка); і/або неіонні поверхневоактивні TM TM агенти, наприклад, TWEEN , PLURONICS або поліетиленгліколь (ПЕГ). Фармацевтичні композиції бендамустину можуть бути близькі описаним вище композиціям 13 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 для нефукозильованого анти-CD20 антитіла. У ще одному з варіантів здійснення даного винаходу нефукозильоване анти-CD20 антитіло та бендамустин переробляють у два різних склади. Діючі інгредієнти також можуть бути поміщені у мікрокапсули, отримані, наприклад, методами одержання коацерватів або шляхом об'єднання, наприклад, гідроксиметилцелюлози або полі(метилметакрилатних)мікрокапсул і желатинових мікрокапсул, відповідно, у колоїдні системи доставки лікарських засобів (наприклад, у ліпосоми, альбумінові мікрокапсули, мікроемульсії, наночастинки і нанокапсули) або у мікроемульсії. Такі методи описані у кн.: е "Remington's Pharmaceutical Sciences", 1980, 16 вид., під ред. Osol A. Можуть бути отримані препарати стійкого вивільнення. Відповідними прикладами препаратів стійкого вивільнення є напівпроникні матриці твердих гідрофобних полімерів, що містять антитіло, матриці яких представлені у вигляді частинок певної форми, наприклад, у вигляді плівок або мікрокапсул. До прикладів матриць стійкого вивільнення відносяться поліефіри, гідрогелі (наприклад, полі(2-гідроксиметилметакрилат), або полівініловий спирт), полілактиди (US 3773919), співполімери L-глутамінової кислоти та гамма-етил-L-глутамату, етиленвініл ацетат, що не розкладається, співполімери молочної кислоти і гліколевої кислоти, що TM розкладаються, наприклад, продукт LUPRON DEPOT (ін'єкційні мікросфери, які складаються з співполімеру молочної кислоти і гліколевої кислоти і лепроліду ацетату) і полі-D-(-)-3гідроксимасляна кислота. Склади для застосування введенням in vivo повинні бути стерильними. Це може бути легко виконане фільтрацією через стерильну мембрану. Даний винахід додатково передбачає спосіб лікування раку, що включає введення пацієнтові, який потребує такого лікування, (i) ефективної кількості першого агента (нефукозильованого анти-CD20 антитіла, що містить 60 % фукози або менше; в одному з варіантів здійснення даного винаходу нефукозильованого гуманізованого антитіла B-Ly1); та (ii) ефективної кількості другого агента (бендамустину). В одному з варіантів здійснення даного винаходу кількість фукози становить від 40 % до 60 %. Переважно зазначений рак є раком, який експресує CD20. Переважно зазначений рак, який експресує CD20, є В-клітинною неходжкінською лімфомою (НХЛ). Переважно зазначеним нефукозильованим анти-CD20 антитілом є анти-CD20 антитіло II типу. Переважно зазначене антитіло є гуманізованим антитілом B-Ly1. Переважно зазначене гуманізоване антитіло B-Ly1 вводять у дозі від 800 дo 1200 мг на 1, 8, 15 добу 6-тижневого циклу дозування і потім у дозі від 800 до 1200 мг на 1 добу до п'яти 42 2 тижневих циклів дозування, і бендамустин вводять у дозі від 80 мг/м дo 110 мг/м на 1 і 2 добу до шести 4-тижневих циклів дозування. У контексті даного винаходу поняття "пацієнт" переважно відноситься до людини, яка потребує лікування нефукозильованим анти-CD20 антитілом (наприклад, пацієнта з раком, який експресує CD20) для якої-небудь мети, і більше переважно людини, яка потребує такого лікування для лікування раку, або передракового стану, або ушкодження. Однак поняття "пацієнт" також може відноситися до тварин, але не до людини, переважно до ссавців, наприклад, собак, кішок, коней, корів, свиней, овець і приматів, за винятком людини, а також до інших тварин. Даний винахід також передбачає нефукозильоване анти-CD20 антитіло для лікування раку у комбінації з бендамустином. Даний винахід також включає нефукозильоване анти-CD20 антитіло з кількістю фукози 60 % або менше і бендамустин для застосування у лікуванні раку. Переважно зазначене нефукозильоване анти-CD20 антитіло є гуманізованим антитілом BLy1. Переважно раком є рак, який експресує CD20, більше переважно В-клітинна неходжкінська лімфома (НХЛ). Переважно зазначене гуманізоване антитіло B-Ly1 вводять у дозі від 800 дo 1200 мг в 1, 8, 15 добу 6-тижневого циклу дозування і потім у дозі oт 800 дo 1200 мг на 1 добу до п'яти 42 2 тижневих циклів дозування, і бендамустин вводять у дозі oт 80 мг/м дo 110 мг/м на 1 і 2 добу до шести 4-тижневих циклів дозування. Приклади, що приводяться нижче, і фігури передбачені для полегшення розуміння даного винаходу, рамки охоплення якого встановлені у формулі винаходу. Очевидно, що модифікації можуть бути зроблені у ході описаних нижче процедур без відхилення від суті даного винаходу. 14 UA 110096 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переліки послідовностей SEQ ID NO: 1 амінокислотна послідовність варіабельної області важкого ланцюга (VH) моноклонального анти-CD20 антитіла B-Ly1 миші. SEQ ID NO: 2 амінокислотна послідовність варіабельної області легкого ланцюга (VL) моноклонального анти-CD20 антитіла B-Ly1 миші. SEQ ID NO: 3-19 амінокислотна послідовність варіабельної області важкого ланцюга (VH) гуманізованих антитіл B-Ly1 (з B-HH2 пo B-HH9, B-HL8 і з B-HL10 пo B-HL17). SEQ ID NO: 20 амінокислотні послідовності варіабельної області легкого ланцюга (VL) гуманізованого B-Ly1 антитіла B-KV1. Опис фігур Фіг. Протипухлинна дія in vivo комбінованого лікування нефукозильованим анти-CD20 антитілом II типу (B-HH6-B-KV1 GE) з бендамустином (у порівнянні з комбінацією ритуксимабу (фукозильованого анти-CD20 антитіла I типу) з бендамустином) і порівняння з відповідними монотерапіями. Експериментальні методи Протипухлинна дія комбінованого лікування анти-CD20 антитілом II типу (B-HH6-B-KV1 GE) з бендамустином Досліджувані агенти Нефукозильоване анти-CD20 антитіло B-HH6-B-KV1 GE (нефукозильоване гуманізоване антитіло B-Ly1, глікоінженерне антитіло B-HH6-B-KV1, див. WO2005/044859 і WO2007/031875) одержують у вигляді вихідного розчину (9,4 мг/мл) від фірми Glycart, Schlieren, Швейцарія. Буфер для антитіла включає гістидин, трегалозу і полісорбат 20. Розчин антитіла розводять відповідним чином у ФСБ із вихідного розчину для ін'єкцій. Ритуксимаб (мабтера) для клінічного використання одержують від фірми Hoffmann La Roche, Базель. Бендамустин (продукт Ribomustin®) здобувають на фірмі Mundipharma Gmbh, Limburg an der Lahn, Німеччина. Необхідні розведення роблять з комерційного вихідного розчину 2,5 мг/мл. Лінії клітин і умови культивування Лінію клітин лімфоми клітин мантії людини Z138 звичайним чином культивують у середовищі DMEM, збагаченої 10 % фетальної сироватки теляти (фірма PAA Laboratories, Австрія) і 2 мM Lглутаміном, при 37 °C у насиченій вологою атмосфері з 8 % CO2. Четвертий пасаж використовують для трансплантації. Проводять спільну ін'єкцію клітин і продукту Matrigel. Тварини Самок бежевих мишей лінії SCID у віці 3-4 тижня на момент поставки (фірма Charles River, Sulzfeld, Німеччина) тримають у специфічних умовах, що виключають патогени, при добовому ритмі 12 год. світла / 12 год. темряви відповідно до схвалених правил (GV-Solas; Felasa; TierschG). Протокол дослідження розглядається і затверджується місцевою владою. Придбаних тварин витримують у карантинному відсіку приміщення для тварин протягом одного тижня для звикання до нового середовища проживання і для спостереження. Безперервний моніторинг стану здоров'я проводять на регулярній основі. Дієтичну їжу (Provimi Kliba 3337) і воду (підкислену до ph 2,5-3) надають за потребою. Моніторинг У тварин щодня контролюють клінічні симптоми і виявляють побічні ефекти. Протягом усього експерименту двічі на тиждень визначають масу тіла тварин, і після визначення стадії захворювання циркулем вимірюють об'єм пухлини. Лікування тварин Лікування тварин починають у день рандомізації через 19 діб після інокуляції пухлинних клітин. Гуманізоване нефукозильоване анти-CD20 антитіло B-HH6-B-KV1 GE або ритуксимаб вводять внутрішньочеревинно в якості окремих агентів один раз в 7 діб на 19 і 26 добу дослідження у призначеній дозі 1 мг/кг. У ті ж дні вводять відповідний розчинник. Бендамустин вводять внутрішньочеревинно на 19, 20, 21 і 22 добу у кількості 3 мг/кг. У групах комбінованої терапії хіміотерапевтичний агент вводять через 8 год. після введення обох антитіл на 19 добу. Дослідження придушення росту пухлин in vivo До кінця експерименту на 33 добу після інокуляції клітин пухлини відзначають придушення росту пухлини (ПРП), зазначене у табл. 1, у тварин, що одержують ритуксимаб, анти-CD20 антитіло B-HH6-B-KV1 GE, комбінацію ритуксимабу та бендамустину або комбінацію анти-CD20 антитіла та бендамустину, відповідно, у порівнянні з контрольною групою. У даному експерименті лікування тільки одним бендамустином не показує якої-небудь протипухлинної дії. Шляхом порівняння групи, підданої лікуванню комбінацією анти-CD20 антитілом B-HH6-BKV1 GE/бендамустином, із групою, в якій лікують тільки одним анти-CD20 антитілом B-HH6-B 15 UA 110096 C2 5 10 15 KV1 GE, встановлено, що дія перевищує адитивний ефект. Статистичний аналіз Дослідження закінчують на 33 добу. Статистична оцінка заснована на sAUC. Ріст пухлини статистично вірогідно пригнічується у групі 2 (B-HH6-B-KV1 GE, 1 мг/кг, раз на тиждень, внутрішньочеревинно), що показано величиною TCR=0,72 (ДІ 0,59-0,86), у групі 3 (ритуксимаб, 1 мг/кг, раз на тиждень, внутрішньочеревинно), що показано величиною TCR=0,78 (ДІ 0,65-0,93), у групі 5 (B-HH6-B-KV1 GE, 1 мг/кг, раз на тиждень, внутрішньочеревинно, у комбінації з бендамустином, 3 мг/кг, 19-22 доба дослідження, внутрішньочеревинно), що показано величиною TCR=0,46 (ДІ 0,34-0,59) і у групі 6 (ритуксимаб, 1 мг/кг, раз на тиждень, внутрішньочеревинно у комбінації з бендамустином, 3 мг/кг, 19-22 доба дослідження, внутрішньочеревинно), що показано величиною TCR=0,67 (ДІ 0,54-0,81) у порівнянні з групою застосування розчинника (група 1). Група 4 (бендамустин, 3 мг/кг, 19-22 доба дослідження, внутрішньочеревинно) показує ріст пухлин, порівнянний з ростом пухлин у контрольній групі до кінця дослідження. Комбінація B-HH6-B-KV1 GE з бендамустином показує дію, яка оцінюється більше ніж адитивна (синергетично) і статистично значима, з придушення росту пухлин у порівнянні з окремими обробками, дослідженими у тесті Tukey-Kramer (p < 0,001) (див. табл. 1 і Фіг. ). Таблиця 1 Параметричний показник TCR при низькому й високому довірчому інтервалі (ДІ), заснований на sAUC і ПРП (%) Група 2 3 4 5 6 Схема лікування B-HH6-B-KV1 GE (раз на тиждень, 1 мг/кг) Ритуксимаб (раз на тиждень, 1 мг/кг) Бендамустин (на 19-22 добу дослідження, 3 мг/кг) B-HH6-B-KV1 GE (раз на тиждень, 1 мг/кг) + Бендамустин (на 19-22 добу дослідження, 3 мг/кг) Ритуксимаб (раз на тиждень, 1 мг/кг) + Бендамустин (на 19-22 добу дослідження, 3 мг/кг) TCR ПРП (%) 0,72 [0,59-0,86] 47 0,78 [0,65-0,93] 29 0,9 [0,76-1,06] 0 0,46 [0,34-0,59] 72 0,67 16 95 % ДІ щодо групи 1 [0,54-0,81] 42 UA 110096 C2 17 UA 110096 C2 18 UA 110096 C2 19 UA 110096 C2 20 UA 110096 C2 21 UA 110096 C2 22 UA 110096 C2 23 UA 110096 C2 24 UA 110096 C2 25 UA 110096 C2 26 UA 110096 C2 27 UA 110096 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCombination therapy of afucosylated anti-cd20 antibody with bendamustine for cancer treatment
Автори англійськоюHerting, Frank, Klein, Christian
Назва патенту російськоюКомбинированная терапия нефукозилированным анти-cd20 антителом с бендамустином
Автори російськоюХертинг Франк, Кляйн Кристиан
МПК / Мітки
МПК: A61P 35/00, A61K 31/4184, C07K 16/28, A61K 39/395
Мітки: антитілом, анти-cd20, комбінована, терапія, бендамустином, нефукозильованим
Код посилання
<a href="https://ua.patents.su/54-110096-kombinovana-terapiya-nefukozilovanim-anti-cd20-antitilom-z-bendamustinom.html" target="_blank" rel="follow" title="База патентів України">Комбінована терапія нефукозильованим анти-cd20 антитілом з бендамустином</a>
Попередній патент: Система і спосіб керування даними для інтерактивного цифрового кіно
Наступний патент: Терапевтичний агент для лікування розладів настрою
Випадковий патент: Вузол робочих валків прокатного стана