Інгібітори серин-протеаз, фармацевтична композиція, спосіб інгібування активності та спосіб лікування або профілактики вірусної інфекції гепатиту с
Номер патенту: 66767
Опубліковано: 15.06.2004
Автори: Фармер Люк Дж., Бхісетті Говінда Рао, Тунг Роджер Д., Дайнінджер Девід Д., Мурко Марк А., Харбесон Скотт Л.
Формула / Реферат
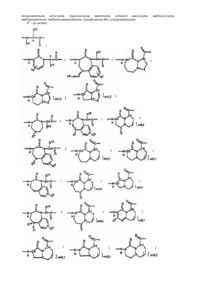
1. Інгібітор серин-протеаз, що є сполукою загальної структурної формули (II):
де W є:
m дорівнює 0 або 1;
кожен R2 являє собою незалежно водень, алкільну, алкенільну, арильну, аралкільну, аралкенільну, циклоалкільну, циклоалкілалкільну, циклоалкенільну, циклоалкенілалкільну, гетероциклільну, гетероциклілалкільну, гетероциклілалкенільну, гетероарильну або гетероаралкільну групу, або дві R2 -групи, які пов'язані з одним і тим ж атомом азоту, створюють разом із цим атомом азоту 5-7-членну моноциклічну гетероциклічну кільцеву систему; де будь-який атом вуглецю з R2 може бути за бажанням заміщений J;
J являє собою алкільну, арильну, аралкільну, алкокси-, арилокси-, аралкокси-, циклоалкільну, циклоалкокси-, гетероциклільну, гетероциклілокси-, гетероциклілалкільну, кето-, гідрокси-, аміно-, алкіламіно-, алканоїламіно-, ароїламіно-, аралканоїламіно-, карбокси-, карбоксіалкільну, карбоксіамідоалкільну, гало-, ціано-, нітро-, формільну, ацильну, сульфонільну або сульфонамідну групу і може бути за бажанням заміщений 1-3 J1-групами;
J1 являє собою алкільну, арильну, аралкільну, алкокси-, арилокси-, гетероциклільну, гетероциклілокси-, кето-, гідрокси-, аміно-, алканоїламіно-, ароїламіно-, карбокси-, карбоксіалкільну, карбоксіамідоалкільну, гало-, ціано-, нітро-, формільну, сульфонільну або сульфонамідну групу;
L являє собою алкільну, алкенільну або алкінільну групу, де будь-який водень може бути за бажанням заміщений галогеном, і де будь-який атом водню або галогену, пов'язаний з будь-яким кінцевим атомом вуглецю, може бути за бажанням заміщений сульфогідрильною або гідроксильною групою;
А1 є зв'язок або
,
R5 і R6 незалежно являють собою водень, алкільну, алкенільну, арильну, аралкільну, аралкенільну, циклоалкільну, циклоалкілалкільну, циклоалкенільну, гетероциклільну, гетероциклілалкільну, гетероарильну або гетероаралкільну групу і можуть бути за бажанням заміщені 1-3 J-групами;
Х - зв'язок, -C(H)(R7)-, -O-, -S- або -N(R8)-;
R7 являє собою водень, алкільну, алкенільну, арильну, аралкіл, гетероциклільну, гетероциклілалкільну, гетероарильну або гетероаралкільну групу і може бути за бажанням заміщений 1-3 J-групами;
R8 являє собою водень, алкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкільну, гетероарильну, гетероаралкільну, аралканоїльну, гетероцикланоїльну, гетероаралканоїльну, -C(O)R14, -SO2R14 або карбоксіамідну групу і може бути за бажанням заміщений 1-3 J-групами; або R8 і Z разом із атомами, з якими вони пов'язані, створюють вміщуючу азот моно- або біциклічну кільцеву систему за бажанням заміщену 1-3 J-групами;
R14 являє собою алкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкільну, гетероарильну або гетероаралкільну групу;
Y - зв'язок, -CH2-, -C(O)-, -C(O)C(O)-, -S(O)-, -S(O)2- або -S(O)(NR7)-, де R7 такий, як визначено вище;
Z являє собою алкільну, арильну, аралкільну, циклоалкільну, циклоалкілалкільну, гетероциклільну, гетероциклілалкільну, гетероарильну, гетероаралкільну групу, -OR2 або -N(R2)2, де будь-який атом вуглецю може бути за бажанням заміщений J, де R2 такий, як визначено вище;
А2 - зв'язок або
R9 являє собою алкільну, циклоалкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкіл, гетероарильну, гетероаралкільну, карбоксіалкільну або карбоксамідоалкільну групу і може бути за бажанням заміщений 1-3 J-групами;
М являє собою алкільну, циклоалкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкільну, гетероарильну або гетероаралкільну групу, за бажанням заміщену 1-3 J-групами, де будь-який алкільний атом вуглецю може бути заміщений гетероатомом;
V - зв'язок, -CH2-, -C(H)(R11)-, -O-, -S- або -N(R11)-;
R11 являє собою водень або С1-3 алкіл;
К - зв'язок, -О-, -S-, -C(O)-, -S(O)-, -S(O)2- або -S(O)(NR11)-, де R11 такий, як визначено вище;
Т являє собою -R12, -алкіл-R12, -алкеніл-R12, -алкініл-R12, -ОR12, -N(R12)2, C(O)R12, -C(=NOалкіл)R12 або
R12 являє собою водень, арильну, гетероарильну, циклоалкільну, гетероциклільну, циклоалкіліденільну або гетероциклоалкіліденільну групу і може бути за бажанням заміщений 1-3 J-групами, або перший R12 і другий R12, разом з азотом, з яким вони пов'язані, створюють моно- або біциклічну кільцеву систему, за бажанням заміщену 1-3 J-групами;
R10 являє собою алкільну, циклоалкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкільну, гетероарильну, гетероаралкільну, карбоксіалкільну або карбоксіамідоалкільну групу і може бути за бажанням заміщений 1-3 водневими J-групами з 1-3 атомами водню;
R15 являє собою алкільну, циклоалкільну, арильну, аралкільну, гетероциклільну, гетероциклілалкільну, гетероарильну, гетероаралкільну, карбоксіалкільну або карбоксіамідоалкільну групу і може бути за бажанням заміщений 1-3 J-групами; і
R16 являє собою водень, алкільну, арильну, гетероарильну, циклоалкільну або гетероциклільну групу.
2. Сполука за п. 1, де R5 і R6 являють собою водень.
3. Сполука за п. 2, де А2 є
і R9 являє собою алкіл.
4. Сполука за п. 3, де R9 являє собою ізопропіл.
5. Сполука за п. 4, де L являє собою алкільну, алкенільну або алкінільну групу, у якій будь-який водень може бути за бажанням заміщений галогеном, і у якій будь-який атом водню або галогену, пов'язаний з будь-яким кінцевим атомом вуглецю, може бути за бажанням заміщений сульфогідрильною або гідроксильною групою.
6. Сполука за п. 5, де L являє собою тригалометил, сульфгідрил або алкіл, заміщений тригалометилом, сульфгідрилом або гідроксигрупою.
7. Сполука за п. 6, де:
Х є -О- або -N(Н)-; і
Y є -CH2-, -C(O)- або -S(O)2-.
8. Сполука за п. 7, де V є -N(H)- і К є -С(О)- або -S(O)2-.
9. Сполука за п. 3, де
А2 - зв'язок,
L - етил;
Х є -O-;
Y є -СН2-;
V є -N(H)-; і
K є -С(О)- або -S(O)2-.
10. Сполука за п. 9, де М - ізопропіл.
11. Сполука за п. 10, де Z - арильна або гетероарильна група.
12. Сполука за п. 11, де Z - феніл.
13. Сполука за п. 12, де Т є -R12, -алкіл-R12, -алкеніл-R12, -ОR12, -N(R12)2, -C(=NOалкіл)R12 або
.
14. Сполука за п. 1, де А1 є
і R5 і R6 - водень;
А2 є
і R9 - ізопропіл;
L - етил;
Х є -O- або -N(H)-;
Y є -СН2-, -С(О)- або -S(O)2-;
V є -N(H)-; і
K є - С(О)-.
15. Сполука за п. 14, де М - ізопропіл.
16. Сполука за п. 15, де Z - арильна або гетероарильна група.
17. Сполука за п. 16, де Т - арил або гетероарил.
18. Сполука за п. 17, де Т - піразин.
19. Сполука за п. 14, де Х - -О- і Y є -СН2-.
20. Сполука за п. 19, де Z - арильна або гетероарильна група.
21. Сполука за п. 20, де Z - арильна група.
22. Сполука за п. 21, де М - ізопропіл.
23. Сполука за п. 14, де Т є -R12, -OR12, -N(R12)2 або
24. Сполука за п. 23, де М - алкільна, гетероаралкільна, арильна, циклоалкілалкільна, аралкільна або аралкільна група, де один з алкільних атомів вуглецю заміщений О або S.
25. Сполука за п. 24, де М - пропіл, метил, піридилметил, бензил, нафтилметил, феніл, імідазолілметил, тіофенілметил, циклогексилметил, фенетил, бензилтіометил або бензилоксіетил.
26. Сполука за п. 25, де Т - арильна або гетероарильна група.
27. Сполука за п. 26, де Т - піразин.
28. Сполука за п. 1, де А2 є
29. Сполука за п. 28, де М - ізопропіл і К є -С(О)-.
30. Сполука за п. 29, де Т є -R12, -алкіл-R12, -алкеніл-R12, -ОR12, -N(R12)2, -C(=NOалкіл)R12 або
.
31. Сполука за п. 1, де Z - феніл, де будь-який атом вуглецю може бути за бажанням заміщений J.
32. Фармацевтична композицiя, яка містить сполуку по будь-якому з пп. 1-31 і фармацевтично прийнятний носій.
33. Спосіб інгібування активності серин-протеази у пацієнта, який відрізняється тим, що містить стадію введення пацієнтові сполуки за будь-яким із пп. 1-31.
34. Спосіб за п. 33, який відрізняється тим, що серин-протеаза являє собою HCV NS3 протеазу.
35. Спосіб лікування або профілактики вірусної інфекції гепатиту С у пацієнта, який відрізняється тим, що містить стадію введення пацієнтові/ссавцеві сполуки за будь-яким із пп. 1-31.
36. Спосіб за п. 35, який відрізняється тим, що згадану сполуку застосовують із фармацевтично прийнятним носієм у фармацевтично прийнятній композиції.
Текст
Цей винахід відноситься до нового класу сполук, які використовуються як інгібітори протеаз, зокрема як інгібітори серин-протеаз, точніше як інгібітори протеазі NS3 вірусу гепатиту С. Як такі, вони діють шляхом впливу на життєвий цикл вірусу гепатиту С (HVC) і корисні також як антивірусні препарати. Цей винахід відноситься також до фармацевтичних композицій, які містять ці сполуки. Сполуки і фармацевтичні композиції по даному винаходу особливо добре підходять для інгібування активності протеази NS3 HCV і, отже, можуть ефективно використовуватись як лікарські препарати проти вірусу гепатиту С і інших вірусів, для проліферації яких необхідна серин-протеаза. Цей винахід відноситься також до способів інгібування активності протеаз, включаючи NS3 протеазу вірусу гепатиту С і інші серинпротеази, з застосуванням сполук по даному винаходу і родинних сполук. Інфекція, що викликається вірусом гепатиту С (HCV), становить серйозну медичну проблему. HCV визнається збудником більшості випадків не-А, не-В гепатиту; сероросповсюдженість серед населення земного шару оцінюється у 1% [Purcell, R. Η., «Hepatits C virus: Historical perspective and current concepts» FEMS Microbiology Reviews 14, pp. 181-192 (1994); Van der Poel, C. L., «Hepatitis С Virus. Epidemiology, Transmission and Prevention in Hepatitis С Virus. Current Studies in Hematology and Blood Transfusion», H. W. Reesink, Ed., (Basel: Kerger), pp. 137-163 (1994)]. Тільки у США інфікованими можуть стати чотири мільйона індивідуумів [Alter, Μ. J. and Mast, Ε. Ε., «The Epidemiology of Virial Hepatitis in the united States», Gastroenterol. Clin. North Am. 23, pp. 437-455 (1994)]. Після першого впливу HCV гострий клінічний гепатит розвивається тільки приблизно у 20% інфікованих індивідуумів, тоді як у інших інфекція, мабуть, розв'язується спонтанно. Проте, у більшості випадків вірус викликає хронічну інфекцію, яка персистує десятиріччя [Iwarson, S. «The Natural Course of Chronic Hepatitis», FEMS Microbiology Reviews 14, pp. 201-204 (1994)]. Це звичайно приводить до рецидивуючего і прогресуючого запального процесу у печінці, який часто закінчується більш тяжкими захворюваннями, такими як цироз і печіночно-клітинний рак [Kew, Μ. С, «Hepatitis C and Hepatocellular Carcinoma», FEMS Microbiology Reviews 14, pp. 211-220 (1994)]; Saito, I., et al. «Hepatitis С Virus Infection is Associated with the Development of Hepatocellular Carcinoma», Proc. Natl. Acad. Sci. USA, 87, pp. 6547-6549 (1990)]. На жаль, поки немає ефективних способів запобігання інвалідизуючого прогресування хронічної інфекції HCV. Геном HCV кодує поліпротеїн з 3010-3033 амінокислот [Choo, Q. - L., Et al. «Genetic Organization and Diversity of the Hepatitis С Virus», Proc. Natl. Acad. Sci. USA, 88, pp. 2451-2455 (1991); Kato, N. Et al., «Molecular Cloning of the Human Hepatitis С Virus Genome From Japanese Patients with Non-A, Non-B Hepatitis», Proc. Natl. Acad. Sci. USA, 87, pp. 9524-9528 (1990); Takamizawa, A. Et al., «Structure and Organization of the Hepatitis С Virus Genome Isolated From Human Carriers», J. Virol., 65, pp. 1105-1113 (1991)]. Неструктурні (NS) протеїни HCV припустимо становлять істотну ланку каталітичного механізму реплікації вірусу. NS протеїни одержують шляхом протеолітичного розщеплення поліпротеїну [Bartenschlager, R. et al., «Nonstructural Protein 3 of the Hepatitis С Virus Encodes a Serine-Type Proteinase Required for Cleavage at the NS3/4 and NS4/5 Junction», J. Virol., 67, pp. 3835-3844 (1993); Grakoui, A. Et al. «Characterization of the Hepatitis С Virus-Encoded Serine Proteinase: Determination of Proteinase-Dependent Polyprotein Cleavage Sites», J. Virol., 67, pp. 2832-2843 (1993); Grakoui, A. Et al. «Expression and Identification of Hepatitis С Virus Poliprotein Cleavage Products», J. Virol., 67, pp. 1385-1395 (1993); Tomei, L. Et al., «NS3 is a serine protease required for processing of hepatitis С virus polyprotein», J. Virol., 67, pp. 4017-4026 (1993)]. NS протеїн 3 (NS3) HCV має активність серин-протеази, яка допомагає переробляти більшість вірусних ферментів, і тому вважається істотно важливим для реплікації і інфективності вірусу. Відомо, що мутації у протеазі NS3 вірусу жовтої гарячки знижують інфективність вірусу [Chambers, Т. J. et al., «Evidence that the N-terminal Domain of Nonstructural Protein NS3 From Yellow Fever Virus is a Serine Protease Responsible for Site-Specific Cleavages in the Viral Poliproteine», Proc. Natl. Acad. Sci. USA, 87, pp. 8898-8902 (1990)]. Показано, що перші 181 амінокислот NS3 (залишки 1027-1207 вірусного поліпротеїна) містять серинпротеазний домен NS3, який обробляє всі чотири подальших місця поліпротеїна HCV [С. Lin et al., «Hepatitis С Virus NS3 Serine Proteinase: Trans-Cleavage Requirements and ProcessinGKinetics», J. Virol., 68, pp. 81478157 (1994)]. Серин-протеаза NS3 HCV, а також пов'язаний з нею кофермент NS4A, допомагає обробляти всі вірусні ферменти і тому вважається істотно важливою для реплікації вірусу. Така обробка, мабуть, аналогічна тій, яку здійснює аспартилпротеаза вірусу імунодефіциту людини, яка також задіяна у обробці вірусних ферментів інгібіторів протеази ВІЛ, які подавляють синтез вірусного білка і є ефективними антивірусними препаратами. Це свідчить про те, що переривання цій стадії життєвого циклу вірусу є характерною особливістю терапевтично активних лікарських препаратів, реалізація якої має бути бажаною метою для розробників нових лікарських препаратів. На жаль, приходиться констатувати, що у теперішній час відсутні інгібітори серин-протеази, які використовувались б як анти-HCV препарати. Більш того, сучасне розуміння інфекції HVC не забезпечує будь-яких інших задовільних анти-HCV засобів або лікувань. Єдиним встановленим способом лікування хвороби, яку викликано HCV, є лікування інтерфероном. Проте, інтерферон дає істотні побічні ефекти (Janssen et al., 1994; Renault and Hoofnagle, 1989) [Janssen, H. L. Α., et al. «Suicide Associated with Alfa-Interferon Therapy for Chronic Viral Hepatitis», J. Hepatol., 21, pp. 241-243 (1994)]; Renault, P. F. and Hoofnagle, J. H., «Side effects of alpha interferon». Seminars in Liver Disease 9, 273-277 (1989)] і приводять до довгострокової ремісії тільки у частині (~25%) випадків [Weiland, О. «Interferon Therapy in chronic Hepatitis С Virus Infection», FEMS Microbiol. Rev., 14, pp. 279-288 (1994)]. Крим того, перспективи появи ефективних анти-HCV вакцин залишаються неясними. Таким чином, відчувається гостра потреба у розробці більш ефективного анти-HCV лікування. Такі інгібітори повинні були б мати терапевтичний потенціал як інгібітори протеаз, зокрема як інгібітори серинпротеази, а більш точно - як інгібітори протеаз NS3 HCV. Кажучи конкретно, такі сполуки можуть використовуватись як антивірусні препарати, зокрема такі, які направлені проти HCV. Цей винахід стосується сполук, а також їх фармацевтично сприйнятних похідних, які можуть використовуватись як інгібітори протеаз, зокрема як інгібітори серин-протеази, а більш точно - як інгібітори NS3 HCV протеази. Ці сполуки можуть використовуватись самостійно або у комбінації з імуномодуляторами, такими як a-, b- або g-интерферони; іншими антивірусними препаратами, такими як рибавірин і амантадин; іншими інгібіторами протеази гепатиту С; інгібіторами інших елементів життєвого циклу HCV, включаючи геліказу, полімеразу, металопротеазу, або внутрішнім введенням рибосом - як окремо узятими, так і у любих сполученнях. Цей винахід також стосується способів інгібування активності протеаз, зокрема серин-протеаз, а більш точно - протеази NS3 HCV. Цей винахід стосується і фармацевтичних композицій, що містять сполуки по даному винаходу, а також багатокомпонентних композицій, що містять додаткові імуномодулятори, такі як a-, b- або g- інтерферони, інші антивірусні препарати, такі як рибавірин і амантадин; інші інгібітори протеази гепатиту С; інгібітори інших елементів життєвого циклу HCV, включаючи геліказу, полімеразу, металопротеазу, або внутрішнє введення рибосом - як окремо узяті, так і у будь-яких сполученнях. Винахід також стосується способів використання сполук, описаних тут, і інших родинних сполук для подавлення HCV. Для більш повного розуміння описаного тут винаходу, представляється наступний детальний його опис. В цьому описі використовуються такі скорочення: Позначення Реактив або фрагмент Abu аміномасляна кислота Ac ацетил AcOH оцтова кислота Bn бензил Boc терт-бутилоксикарбоніл Bz бензоіл Cbz карбобензилокси GDI карбонілдіімідазол DCE 1,2-дихлоретан DCM дихлорметан DIEA діізопропілетиламін DMA диметилацетамід DMAP диметиламінопіридин DMF диметилформамід DPPA дифенілфосфорилазид DMSO диметилсульфоксид Et етил EtOAc етил ацетат FMOC 9-фторенілметоксикарбоніл HbtU О-бензотриазоліл-N,Ν,Ν',Ν'тетраметилуронію гексафторфосфат HOBt N-гідроксибензотриазол HPLC високоефективна рідкісна хроматографія Me метил MS мас-спектрометрія NMP N-метил піролідон ND не визначається Pip піперидин Prz піперазин PyBrop бромо-trіs-піролідинофосфонію гексафторфосфат Pyr піридин THF тетрагідрофуран ΤFA трифтороцтова кислота TFE трифторетанол Тоl толуол В описі використовуються такі терміни: Якщо явно не затверджується інше, то використовувані тут терміни "-SO2" і "-S(O)2" відносяться до сульфону або похідного сульфону (тобто обидві ці групи пов'язані з S), а не до сульфінатного ефіру. Термін "заміщений" відноситься до заміщення одного або більш водневих радикалів у даній структурі на радикал, обраний з приведеної групи. Якщо більше ніж один водневий радикал може бути заміщений радикалом, обраним з однієї і тієї ж приведеної групи, то заміщуючі радикали можуть бути однаковими або різними у всіх положеннях. Використовуваний тут термін "аміно" відноситься до трьохвалентного азоту, який може бути первинним або заміщеними 1-2 алкільними групами. Термін "алкіл" або "алкан", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до насиченого аліфатичного вуглеводневого радикала з прямим або розгалуженим ланцюжком, який містить вказане число атомів вуглецю або, якщо ця кількість не обумовлюється, переважно від 1 до 10 атомів вуглецю, а більш переважно від 1 до 5 атомів вуглецю. Приклади алкільних радикалів містять, але не обмежуються ними, метил, етіл, n-пропіл, ізопропіл, n-бутил, ізобутил, сек-бутил, терт-бутил, пентил, ізоаміл, n-гексил і т.п. Термін "алкеніл" або "алкен", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до моно- або поліненасиченого аліфатичного вуглеводневого радикалу з прямим або розгалуженим ланцюжком, який містить вказане число атомів вуглецю або, якщо ця кількість не обумовлюється, переважно від 2 до 10 атомів вуглецю, а більш переважно від 2 до 5 атомів вуглецю. Приклади алкенільних радикалів містять, але не обмежуються ними, етеніл, Е- і Z-пропеніл, Е- і Z-пентеніл, Е- і Z-гексеніл, Ε,Ε-, Ε,Ζ-, Ζ,Ε і Ζ,Z-гексадієніл і т. п. Термін "алкініл" або "алкін", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до моно- або поліненасиченого аліфатичного вуглеводневого радикалу з прямим або розгалуженим ланцюжком, який містить вказане число атомів вуглецю або, якщо ця кількість не обумовлюється, переважно від 2 до 10 атомів вуглецю, а більш переважно від 2 до 5 атомів вуглецю, і у якому не менше як один з ненасичених аліфатичних вуглеводневих радикалів містить потрійний зв'язок. Приклади алкінільних радикалів містять, але не обмежуються ними, етиніл, пропініл, ізобутиніл, пентиніл, гексиніл, гексинініл і т.п. Термін "арил", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до радикала з ароматичним вуглецевим кільцем, вміщуючим вказану кількість атомів вуглецю, яке можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Переважні арильні групи мають від 6 до 14 атомів вуглецю, а більш переважні - від 6 до 10 атомів вуглецю. Приклади арильних радикалів містять, але не обмежуються ними, феніл, нафтил, антраценіл і т.п. Термін «вуглецеве кільце», використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до сталого неароматичного 3-8-членного вуглецевого кільця-радикалові, яке може бути насиченим, мононенасиченим або поліненасиченим і яке можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Вуглецеве кільце може приєднуватись до будь-якого ендоциклічного атому вуглецю, що дає сталу структуру. Термін "циклоалкіл" або "циклоалкан", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до сталого неароматичного 3-8-членного вуглецевого кільця-радикалові, яке є насиченим і яке можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Циклоалкільний радикал може приєднуватись до будь-якого ендоциклічного атому вуглецю, що дає сталу структуру. Переважні вуглецеві кільця мають 5-6 атомів вуглецю. Приклади карбоциклічних радикалів містять, але не обмежуються ними, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, індан, тетрагідронафталін і т.п. Термін "циклоалкеніл" або "циклоалкен", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до сталого вуглеводневого кільця-радикалові, яке містить не менше як один ендоциклічний подвійний зв'язок вуглець-вуглець. Таке вуглецеве кільце можна приєднати до будь-якого циклічного атому вуглецю, що дає сталу структуру. Якщо число атомів вуглецю не обумовлюється, циклоалкенільний радикал переважно має від 5 до 7 атомів вуглецю. Приклади циклоалкенільних радикалів містять, але не обмежуються ними, циклопентеніл, циклогексеніл, циклопентадієпіл, інденіл і т. п. Термін "циклоалкіліденіл", використовуваний окремо або у сполученні з будь-яким іншим терміном, відноситься до сталого радикала з циклічним вуглеводневим ядром, яке містить не менше як один екзоциклічний подвійний зв'язок вуглець-вуглець і у якому циклічне вуглеводневе ядро можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Таке вуглецеве кільце можна приєднати до будь-якого циклічного атому вуглецю, що дає сталу структуру. Якщо число атомів вуглецю не обумовлюється, циклоалкіліденільний радикал переважно має від 5 до 7 атомів вуглецю. Приклади циклоалкіліденільних радикалів містять, але не обмежуються ними, циклопентиліденіл, циклогексиліденіл, циклопентеніліденіл і т.п. Досвідчений практик повинен знати, що деякі групи можуть класифікуватись і як циклоалкани, і як арильні групи. Приклади таких груп містять інданілову і тетрагідронафтильну групи. Термін "моноциклічне ядро" або "моноциклічний", використовуваний окремо або у сполученні з будьяким іншим терміном, якщо не обумовлюється інше, відноситься до 5-7-членної кільцевої системи. Термін "біциклічне ядро" або "біциклічний", використовуваний окремо або у сполученні з будь-яким іншим терміном, якщо не обумовлюється інше, відноситься до 6-11-членної кільцевої системи. Термін "трициклічне ядро" або "трициклічний", використовуваний окремо або у сполученні з будь-яким іншим терміном, якщо не обумовлюється інше, відноситься до 11-15-членної кільцевої системи. Термін "гетероцикл" або "гетероциклічний", використовуваний окремо або у сполученні з будь-яким іншим терміном, якщо не обумовлено інше, відноситься до сталого 5-15-членного моно-, бі-, три- або гетероциклічного ядра, яке є насиченим або частково ненасиченим, але не ароматичним, і яке можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Кожне гетероциклічне ядро складається з одного або більш атомів вуглецю і з 1-4 гетероатомів, обраних з групи, що включає азот, кисень і сірку. Використовувані тут терміни "гетероатоми азоту і сірки" містять будь-яку любу окислену форму азоту і сірки, а також кватернизовану форму будь-якого основного азоту. Гетероцикл можна приєднати до будь-якого ендо-циклічного вуглецю або гетероатому, що приводить до створення сталої структури. Переважні гетероцикли, визначення яких приведено вище, містять, наприклад, імідазолідиніл, індазоліноліл, пергідропіридазил, піролініл, піролідиніл, піперидиніл, піразолініл, піперазиніл, морфолініл, тіаморфолініл, b-карболініл, тіазолідиніл, тіаморфолініл сульфон, оксопіперидиніл, оксопіролідиніл, оксоазепініл, азепініл, фуразаніл, тетрагідропіраніл, тетрагідрофураніл, оксатіоліл, дитіоліл, тетрагідротіофеніл, діоксаніл, діоксоланіл, тетрагідрофуротетрагідрофураніл, тетрагідропіранотетрагідрофураніл, тетрагідрофуродигідрофураніл, тетрагідропіранодигідрофураніл, дигідропіраніл, дигідрофураніл, дигідрофуротетрагідрофураніл, дигідропіранотетрагідрофураніл, сульфоланіл і т.п. Термін "гетероарильний" або "гетероароматичний", використовуваний окремо або у сполученні з будьяким іншим терміном, якщо інше не обумовлюється, відноситься до сталого 3-7-членного моноциклічного гетероциклічного ядра, яке є ароматичним і яке можна за бажанням зростити, наприклад через бензольну групу, з 1-3 циклоалкільними, ароматичними, гетероциклічними або гетероароматичними кільцями. Кожне гетероароматичне кільце містить один або більш атомів вуглецю і від 1 до 4 гетероатомів, обраних з групи, що включає азот, кисень і сірку. Використовувані тут терміни "гетероатоми азоту і сірки" містять будь-яку окислену форму азоту і сірки, а також кватернизовану форму будь-якого основного азоту. Гетероароматичне кільце можна приєднати до будь-якого ендоциклічного вуглецю або гетероатому, що приводить до створення сталої структури. Переважні гетероароматичні ядра, визначення яких приведено вище, містять, наприклад, бензімідазоліл, імідазоліл, хіноліл, ізохіноліл, індоліл, індазоліл, піридазил, піридил, піроліл, піразоліл, піразиніл, хіноксоліл, піраніл, піримідиніл, піридазиніл, фурил, тієніл, триазоліл, тіазоліл, тетразоліл, бензофураніл, оксазоліл, бензоксазоліл, ізоксазоліл, ізотіазоліл, тіадиазоліл, тіофеніл і т.п. Термін "галоген" відноситься до радикала з фтору, хлору, брому або йоду. Переважні галогенові радикали містять фтор і хлор. В хімічних формулах використовуються круглі дужки, щоб показати: 1) присутність більше ніж одного атому або групи, пов'язаних з одним і тим ж атомом або групою; 2) точку відгалуження у ланцюжку (тобто група або атом, розташовані безпосередньо перед відкриваючою круглою дужкою, зв'язуються безпосередньо з групою або атомом, розташованими одразу ж після закриваючої круглої дужки). Прикладом першого використання є "N(R1)2", означаючий, що дві групи R1 пов'язані з атомом азоту. Прикладом другого використання є "-C(O)R1", означаючий атом кисню і R1, пов'язані з атомом вуглецю, як у наступній структурі: Далі в опису "В" позначає атом бору. Цей винахід відноситься до сполук, які можуть використовуватись як інгібітори протеаз, зокрема як інгібітори серин-протеаз, а більш точно як інгібітори протеази NS3 HCV. Як такі, вони діють шляхом впливу на життєвий цикл вірусу гепатиту С і інших вірусів, для проліферації яких необхідна серин-протеаза. Отже, такі сполуки корисні як антивірусні препарати. Відповідно, у одному втіленні, цей винахід стосується сполуки з такою структурною формулою (І): де: G1 - це тіол, гідроксильна група, тіометил, алкеніл, алкініл, трифторметил, С1-2 алкокси-група, С1-2 алкілтіо-група або С1-3 алкільна група, причому С1-3 алкільна група за бажанням може бути заміщена тіолом, гідроксильною групою, тіометилом, алкенільною групою, алкінільною групою, трифторметилом, С1-2 алкоксильною групою або С1-2 алкілтіо-групою. W 1 - це: G2 - це алкільна, арильна, аралкільна група або моно-, бі- або трициклічний гетероцикл, який за бажанням може бути заміщений 1-3 групами, обраними з алкільної, алкенільної, алкінільної, аралкільної, алкоксильної, алкеноксильної, арилоксильної, гетероциклільної, гетероциклілалкільної, аралкоксильної, гетероциклілалкоксильної, оксо-, гідроксильної, аміно-, алканоиламіно-, алкоксикарбоніламіно-, уреидо-, карбоксильної, гетероциклілоксиалкільної, арилоксиалкільної, гетероциклілкарбонільної, ароил-, арилсульфонільної, гетероциклілсульфонільної, гетероциклілсульфоніламіно-, арилсульфоамідо-, аралкілсульфонамідо-, гетероциклілалканоїльної, карбоксиалкільної, карбоксиамідоалкільної, алкенсульфонільної, сульфонамідо-, галогено-, ціано- або галогеноалкільної груп. G4 - це алкіл, алкеніл, алкініл, циклоалкіл, циклоалкілалкіл, циклоалкілалкеніл, арил, аралкіл, аралкеніл, гетероцикліл, гетероциклілалкіл, гетероциклілалкеніл, гідроксиалкіл, алкоксиалкіл, алкілтіоалкіл, арилтіоалкіл або гетероциклілтіоалкіл. Кожний Q1 - це гідроксильна, алкоксильна або арилоксильна група, або кожний Q1 - це атом кисню. Разом з бором, з яким вони пов'язані, створюється 5-7-членне кільце, атоми якого є вуглець, азот або кисень. U - це водень, G9-C(O)-, G9-SO2-, G9-C(О)-С(O)-, (G9)2-N-SO2-, (G9)2N-C(O)- або G9-O-C(O)-. G9 - це водень, алкіл, карбоксиалкіл, алкеніл, арил, аралкіл, аралкеніл, циклоалкіл, циклоалкілалкіл, циклоалкеніл, гетероцикліл, гетероциклілалкіл або гетероциклілалкеніл, які за бажанням можуть бути замінені на 1-3 групи, обрані з алкільної, алкенільної, аралкільної, алкоксильної, алкеноксильної, арилоксильної, гетероциклільної, карбоксиалкільної, карбоксиамідоалкільної, алкілсульфонільної груп або сульфонамідогрупи; або дві групи G9, разом з атомом азоту, з яким вони пов'язані, створюють 4-10-членну, вміщуючу азот, моно- або біциклічну, насичену або частково насичену кільцеву систему, у якій 1-2 з атомів, що створюють кільце, представляють собою N, S або О, а інші атоми, що створюють кільце, представлені С; ця кільцева система за бажанням може бути заміщена одною або двома групами, обраними з такого переліку: алкільна, алкенільна, аралкільна, алкоксильна, алкеноксильна, арилоксильна, аралкоксильна, гетероциклільна, кето-група, гідрокси-група, аміногрупа, алканоїл аміногрупа, карбоксиалкільна, карбокси-амідоалкільна, сульфонільна або сульфоамідогрупа. Ε4 - це зв'язок: карбокси-група, де: G13 це циклоалкілалкільна, аралкільна, гетероциклілалкільна, аралкоксиалкільна, гетероциклілалкоксиалкільна, аралкілтіоалкільна або гетероциклілалкілтіоалкільна групи, які за бажанням можуть бути заміщені на 1-2 алкільні, алкенільні, аралкільні, алкоксильні, алкеноксильні, арилоксильні, аралкоксильні, гетероциклільні, оксо-, гідрокси-, аміно-, алканоиламіно-, карбокси-, карбоксиалкільні, карбоксиамідоалкільні, сульфонільні або сульфонамідогрупи. G14 - це водень, алкільна, алкенільна, гідроксильна, алкоксильна групи або -CH2-G8, де G8 - це арильна, аралкільна, карбоциклільна або гетероциклільна група, причому кільцева частина кожної з арильної, аралкільної груп або гетероциклу за бажанням може бути замінена на 1-3 групи, обрані з такого переліку: алкільна, алкенільна, аралкільна, алкоксильна, алкеноксильна, арилоксильна, гетероциклільна, гетероциклілалкільна, аралкоксильна, гетероциклілалкоксильна, оксо-, гідроксильна, аміно-, алканоиламіно, алкоксикарбоніламіно-, уреідо-, карбоксильна, карбоксиалкільна, карбоксиамідоалкільна, алкансульфонільна, сульфонамідо-, галогено-, ціано- або галогеноалкільна групи; або якщо Ε4 представляє собою: G13 і G14, разом з атомами, з якими вони пов'язані (вуглець і азот, відповідно), створюють азотвміщуючу гетероциклічну кільцеву систему, що має 4-7 членів, яка за бажанням може містити один або два додаткових гетероатома. Така результуюча кільцева система за бажанням може зрощуватись з додатковою карбоциклічною або гетероциклічною кільцевою системою зі створенням біциклічної кільцевої системи, що містить 7-11 атомів. Моноциклічна або біциклічна кільцева система за бажанням може бути заміщена одною або двома групами, обраними з оксо-, гідроксильної, алкільної, алкенільної, арильної, аралкільної, алкеноксильної, арилоксильної, аралкілоксильної, галогенової або нітрогрупи. Кожен Q3 - це галоген, нітро-, ціано-, алкільна, алкенільна, аралкільна, алкоксильна, алкеноксильна, арилоксильна, аралкоксильна, гетероциклільна, гетероциклілалкільна, гідроксильна, аміно-, алкіламіно-, алканоїламіно-, карбоксильна, карбоксиалкільна, карбоксиамідоалкільна, алкілсульфонільна, арилсульфонільна, аралкілсульфонільна, алкілсульфонамідо-, арилсульфонамідоабо аралкілсульфонамідо-група, де алкільна, алкенільна, арильна або гетероциклічна групи за бажанням можуть бути заміщені 1-3 групами, обраними з кето-, гідроксильної, нітро-, ціано-, галогенової, аміно-, алкільної, алкоксильної або алкілтіо-групи. Якщо Q3 не пов'язаний з яким-небудь конкретним атомом, він може пов'язуватись з будь-яким заміщуваним атомом. Q4 - це незалежно алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, алканоил, арилкарбоніл, аралкілкарбоніл, алкоксикарбоніл, арилоксикарбоніл, аралкілоксикарбоніл, алкілсульфоніл, арилсульфоніл, аралкілсульфоніл, алкіламінокарбоніл, ариламінокарбоніл, аралкіламінокарбоніл, у якому будь-яка із згаданих алкільної, циклоалкільної, арильної, аралкільної, гетероциклільної груп за бажанням може бути заміщена одною або більш групами, незалежно обраними з кето-, гідроксильної, нітро-, ціано-, галогенової, аміно-, алкільної, алкоксильной або алкілтіо-групи. Q5 - це арил або ароматичний гетероцикл, у якому: арильний або ароматичний гетероцикл є моноциклічним, біциклічним або трициклічним, що має 5-14 атомів і за бажанням може бути заміщений 1-3 групами, обраними з гідроксильної, нітро-, ціано-, галогенової, аміно-, алкільної, алкоксильної, алканоїл-, алкіламіно- або алкілтіо-групи. Ε5 - це зв'язок або у якій G15 - це алкіл, алкеніл, циклоалкілалкіл, аралкіл, гетероциклілалкіл, карбоксиалкіл або карбоксиамідоалкіл, де кільце будь-якої аралкільної або гетероциклілалкільної групи за бажанням може бути заміщено 1-2 алкільними, алкенільними, аралкільними, алкоксильними, алкеноксильними, арилоксильними, аралкоксильними, гетероциклільними, оксо-, гідроксильними, аміно-, алканоіламіно-, карбоксильними, карбоксиалкільними, карбоксиамідоалкільними, сульфонільними або сульфонамідогрупами. Ε6 - це зв'язок або у якій G16 - це водень, алкіл, алкеніл, аралкіл або циклоалкілалкіліл. Е7 - це зв'язок або у якій G17 - це алкіл, який за бажанням може бути заміщений карбоксильною групою; алкіл переважно є С1-3 алкілом. Е8 - це зв'язок або у якій G18 - це алкіл, який за бажанням може бути заміщений карбоксильною групою; алкіл переважно є С1-3 алкілом. Кожен Ζ1 - це незалежно О або Н2 при тій умові, що не більше ніж дві Ζ1 групи представляють собою Н2 у цій сполуці. Переважними сполуками з структурною формулою (І) є такі сполуки, у яких не менше як одне заміщення визначається таким чином: G1 - це вініл, ацетиленіл, -СН3, -CF3, -CH2CH3, -CH2CF3, -SCH3, -SH, -CH2SH-CH2OH; G13 - це розгалужений алкіл С3-6 або G13 і G14, разом з тими атомами, з якими вони пов'язані (вуглець і азот, відповідно), створюють азот-вміщуючу гетероциклічну кільцеву систему, що має 4-7 членів, яка за бажанням може містити 1-2 додаткових гетероатома, причому моноциклічна або біциклічна кільцева система за бажанням може бути заміщена одною або двома групами, обраними з оксо-, гідроксильної, алкільної, алкенільної, арильної, аралкільної, алкільної, алкеноксильної, арилоксильної, аралкілоксильної, галогенової або нітрогрупи; і Z1 дорівнює 0. Більш переважними сполуками з структурною формулою (І) є такі, у яких G1 представляє собою -SH, CH2SH, -CF3 або -CF2CF3. Найбільш переважними сполуками з структурною формулою (І) є такі, у яких G1 представляє собою -SH або -CF3. Згідно з іншим втіленням цей винахід стосується сполуки з структурною формулою (І), у якій W 1 має вигляд, визначений нижче, тоді як W і інші заміщуючі групи такі, як описано вище. Згідно з іншим втіленням цей винахід стосується сполуки з структурною формулою (II): В цих сполуках: W представляє собою: m дорівнює 0 або 1. Кожен R1 представляє собою гідроксильну, алкоксильну або арилоксильну групу або кожен R1 представляє собою атом кисень і разом з бором, з яким всі вони пов'язані, створює 5-7-членне кільце, атоми якого є вуглець, азот або кисень. Кожен R2 представляє собою незалежно водень, алкіл, алкеніл, арил, аралкіл, аралкеніл, циклоалкіл, циклоалкілалкіл, циклоалкеніл, циклоалкенілалкіл, гетероцикліл, гетероциклілалкіл, гетероциклілалкеніл, гетероарил або гетероаралкіл або дві групи R2, які пов'язані з одним і тим ж атомом азоту, створюють разом з цим атомом азоту 5-7-членну моноциклічну гетероциклічну кільцеву систему; будь-який атом R2 за бажанням може бути заміщений на J. J представляє собою алкільну, арильну, аралкільну, алкоксильну, арилоксильну, аралкоксильну, циклоалкільну, циклоалкоксильну, гетероциклільну, гетероциклілокси-, гетероциклілалкільну, кето-, гідроксильну, аміно-, алкіламіно-, алканоїламіно-, ароїламіно-, аралканоїламіно-, карбоксильну, карбоксиалкільну, карбоксиамідоалкільну, галогенову, ціано-, нітро-, формільну, ацильну, сульфонільну або сульфонамідогрупу, яка за бажанням може бути заміщена 1-3 групами J1. J1 представляє собою алкільну, арильну, аралкільну, алкоксильну, арилоксильну, гетероциклільну, гетероциклілокси-, кето-, гідроксильну, аміно-, алканоїламіно-, ароїламіно-, карбоксильну, карбоксиалкільну, карбоксиамідоалкільну, галогенову, ціано-, нітро-, формільну, сульфонільну або сульфонамідогрупу. L представляє собою алкіл, алкеніл або алкініл, у якому будь-який водень, пов'язаний з атомами вуглецю, за бажанням може бути заміщений галогеном і у якому будь-який атом водню або галогену, пов'язаний з будь-яким термінальним атомом вуглецю, за бажанням може бути заміщений сульфгідрильною або гідроксильною групою. А1 - це зв'язок R4 - це алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, карбоксиалкіл або карбоксиамідоалкіл, який за бажанням може бути заміщений 1-3 групами J. R5 і R6 - це незалежно водень, алкіл, алкеніл, арил, аралкіл, аралкеніл, циклоалкіл, циклоалкілалкіл, циклоалкеніл, гетероцикліл, гетероциклілалкіл, гетероарил або гетероаралкіл і за бажанням може бути замінений 1-3 групами J. Χ - це зв'язок: -C(H)(R7)-, -О-, -S- або -N(R8)-. R7 - це водень, алкіл, алкеніл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил або гетероаралкіл і за бажанням може бути замінений 1-3 групами J. R8 - це водень, алкіл, алкеніл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, аралканоїл, гетероцикланоїл, гетероаралканоїл, -C(O)R14, -SO2R14 або карбоксиамідогрупа і за бажанням може бути замінений 1-3 групами J; або R8 і Z, разом з атомами, з якими вони пов'язані, створюють азот-вміщуючу моно- або біциклічну кільцеву систему, за бажанням заміщувану на 1-3 групи J. R14 - це алкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил або гетероаралкіл. Υ - це зв'язок: -СН2-, -С(О)-, -C(O)C(О)-, -S(О)-, -S(О)2-або -S(О)(NR7)-, де R7 має вигляд, визначений вище. Ζ - це алкіл, арил, аралкіл, циклоалкіл, циклоалкілалкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, -OR2 або -N(R2)2, У якому будь-який атом вуглецю за бажанням може бути заміщений на J і у якому R2 має такий вигляд, як визначено вище. А2 - це зв'язок або R9 - це алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, карбоксиалкіл або карбоксиамідоалкіл і за бажанням може бути заміщений 1-3 групами J. Μ - це алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил або гетероаралкіл і за бажанням може бути заміщений 1-3 групами J, у якому будь-який алкільний атом вуглецю може бути заміщений гетероатомом. V - це зв'язок: -СН2-, -C(H)(R11)-, -О-, -S- або -N(R11)-. R11 - це водень або алкіл С1-3. К - це зв'язок: -О-, -S-, -С(О)-, -S(O)-, -S(O)2- або -S(О)(NR11)-, де R11 має вигляд, визначений вище. Τ - це -R12, -алкіл-R12, -алкеніл-R12, -алкініл-R12, -OR12, -N(R12)2, -C(O)R12, -С(=Nоалкіл)R12 або Кожен R12 - це водень, арил, гетероарил, циклоалкіл, гетероцикліл, циклоалкіліденіл або гетероциклоалкіліденіл і за бажанням може бути заміщений 1-3 групами J, або перший R12 і другим R12 разом з азотом, з яким вони пов'язані, створюють моно- або біциклічну кільцеву систему, яка за бажанням може бути заміщена 1-3 групами J. R10 - це алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, карбоксиалкіл або карбоксиамідоалкіл і за бажанням може бути заміщений 1-3 групами J. R15 - це алкіл, циклоалкіл, арил, аралкіл, гетероцикліл, гетероциклілалкіл, гетероарил, гетероаралкіл, карбоксиалкіл або карбоксиамідоалкіл і за бажанням може бути заміщений 1-3 групами J. R16 - це водень, алкіл, арил, гетероарил, циклоалкіл або гетероцикліл. Переважно W представляє собою Більш переважно W представляє собою Найбільш переважно W представляє собою Переважно J - це алкільна, алкоксильна, арилоксильна, aрильна, аралкільна, аралкоксильна, галогенова, гетероарильна, ціано-, аміно-, нітро-, гетероциклільна, ацильна, карбоксильна, карбоксиалкільна, алкіламіно-, гідроксильна, гетероциклілілкільна, аралканоиламіно-, ароиламіно-, алканоиламіно-, форміл- або кето-група. Більш переважно J - це t-бутил, метил, трифторметил, метокси, етокси, трифторметокси, карбокси, феніл, бензил, фенокси, бензилокси, фтор-, хлор-, бром-, ізоксазоліл, піридиніл, пілеридиніл, карбоксиметил, карбоксиетил, диалкіламіно-, морфолінілметил, фенілацетиламіно- або ациламіногрупа. Переважно J1 - це алкокси, алкіл, галоген або арил. Більш переважно J1 - це алкокси С1-3, хлор-, алкіл С1-3 або феніл. Переважно L - це алкіл, алкеніл, алліл або пропаргіл. Більш переважно L - це тригалометил, сульфгідрил або алкіл, заміщений тригалометилом, сульфгідрилом або гідроксильною групою. Переважно R4 - це алкіл, аралкіл або циклоалкілалкіл, або циклоалкіл. Більш переважно R4 - це фенілалкіл або циклоалкіл. Найбільш переважно R4 - це ізобутил, циклогексилалкіл або фенетил. Переважно R5 і R6 представляють собою водень. Переважно X - це -О- або -N(R8)-. Переважно R8 представляє собою водень. Переважно Υ - це -СН2-, -С(О)-, -С(О)С(О)- або -S(О)2-· Переважно R2 - це водень, фтор, трифторметил, алкіл, арил, аралкіл, гетероаралкіл, гетероцикліл або гетероциклілалкіл. Переважно Ζ - це алкіл, арил, аралкіл, гетероцикліл, циклоалкіл, гетероарил, OR2 або N(R2)2, де R2 - це переважно аралкіл або алкеніл. Більш переважно Ζ - це феніл, 1,4-бензодіоксаніл, 1,3-бензодіоксоліл, бензотіазоліл, нафтил, бензил, оксадиазоліл, ізоксазоліл, хіноліл, бензотіофеніл, тіазоліл, циклогексил, бутил, нафтил, діоксоланіл, бензил, піридиніл, морфолініл, Ν-анілініл, N-амінобензотіазол, N-амінобензодіоксол, N-амінонафтилен, Nбензиламін, N-амінопіридин, бензилокси-, аллілокси-або фенетил і за бажанням може бути заміщений на J. Найбільш переважно Ζ - це нафтил, 3,4-дихлорфеніл, 2-карбометоксифеніл. Переважно R9 представляє собою алкіл. Більш переважно R9 представляє собою пропіл. Найбільш переважно R9 представляє собою ізопропіл. Переважно Μ представляє собою алкіл, гетероаралкіл, арил, циклоалкілалкіл або аралкіл, у якому один з алкільних атомів вуглецю заміщений на О або S. Більш переважно Μ - це пропіл, метил, піридилметил, бензил, нафтилметил, феніл, імідазолілметил, тіофенілметил, циклогексилметил, фенетил, бензилтіометил або бензилоксиетил. Переважно V - це -N(R11)-. Переважно R11 - це водень. Переважно К - це -С(О)- або -S(О)2-. Переважно Τ - це -R12, -алкіл-R12, -алкеніл-R12, -OR12, -N(R12)2, -С(=Noалкіл)12 або Більш переважно Τ - це - R12 або -алкіл-R12. Переважно R12 - це арил або гетероарил і за бажанням може бути заміщений 1-3 групами J. Більш переважно R12 - це 1-нафтил, ізохіноліл, індоліл або 2-алкокси-1-нафтил. Переважно R10 - це алкіл, заміщений карбоксильною групою. Більш переважно R10 - це алкіл С1-3, заміщений карбоксильною групою. Переважно R15 - це алкіл, заміщений карбоксильною групою. Більш переважно R15 - це алкіл С1-3, заміщений карбоксильною групою. В переважному втіленні сполуки з структурною формулою (II) А1 - це: а А2 - це зв'язок. Переважно, у цьому переважному втіленні, щоб X рівнявся 0. Більш переважно Υ - це -СН2-. Як варіант Υ - це -С(O)-. Як варіант Υ - це -С(O)-, a Z - це -N(R2)2. Як варіант, у цьому переважному втіленні, X - це -N(R8)-. Більш переважно Υ - це -С(О)-. Як варіант Υ - це -S(O)2-. Як варіант Υ - це -С(O)-, a Z - це -N(R2)2. Як варіант, у цьому переважному втіленні, X - це -N(R8)-, де R8 - це -C(O)R14 або -S (O)2R14. Більш переважно, якщо R8 -це -C(O)R14, a Y - -С(О)-. Як варіант Υ - це -S(O)2-. Як варіант Υ - це -С(О)-, a Z - це -N(R2)2. Більш переважно, якщо R8 - це -S(O)2R14, Y - -С(О)-, а Ζ - -N(R2)2. Більш переважне втілення даного винаходу стосується сполук з структурною формулою (II), у якій А1 це: де X - це -O-, a Y - це -СН2-; А2 - це: V - це -(NR11) - і К - це -С(О)-. В іншому більш переважному втіленні даного винаходу йдеться про сполуки з структурною формулою (II), у якій A1 - це: де X - це 0, а Y - це СН2; А2 - це: V - це -(NR11) - і К - це -S(O)2-. В іншому більш переважному втіленні даного винаходу йдеться про сполуки з структурною формулою (II), у якій А1 - це: де X - це O, а Y - це -СН2-; А2 - це зв'язок; V - це - (NR11) - і К - це -С(O)-. В іншому більш переважному втіленні даного винаходу йдеться про сполуки з структурною формулою (II), у якій А1 - це: де X - це O, а Υ - це -СН2-; А2 - це зв'язок; V - це -(NR11)- і К - це -S(O)2-. Переважно у цих більш переважних втіленнях W представляє собою: Більш переважно W представляє собою: Найбільш переважно W представляє собою: Переважно у цих більш переважних втіленнях, щоб L був алкілом, алкенілом, аллілом або пропаргілом. Більш переважно, щоб L був тригалометилом, сульфгідрилом або алкілом, заміщеним тригалометилом, сульфгідрильною або гідроксильною групою. В іншому переважному втіленні сполуки з структурною формулою (II) А1 - це a A2 - це зв'язок. Переважні групи у цьому переважному втіленні такі, як описані вище. В іншому переважному втіленні сполуки з структурною формулою (II) А1 - це а А2 - це Переважні, більш переважні і найбільш переважні групи у цьому переважному втіленні такі, як описані вище. Цей винахід передбачає, що багато направлених проти активного мета інгібіторів протеази NS3 можуть бути пептидоміметичними по своїй природі і, отже, можуть бути одержані з природного субстрату. Тому переважні заміщуючи групи у пептидоміметичних інгібіторах по даному винаходу містять ті, які відповідають основній або боковим ланцюжкам, що зустрічаються у природі субстратів або синтетичним субстратам з високою афінністю до даного ферменту (низький Кm). В іншому переважному втіленні сполуки з структурною формулою (II) А1 - це зв'язок. Переважні, більш переважні і найбільш переважні сполуки у цьому переважному втіленні такі, як описані вище. Досвідчений практик повинен знати, що деякі групи можуть бути класифіковані або як гетероциклічні, чи як гетероароматичні залежно від точки приєднання. Сполуки по даному винаходу можуть містити один або більш асиметричних атомів вуглецю і, отже, можуть зустрічатись у вигляді рацематів або рацемичних сумішей, одиночних енантіомерів, диастереомерних сумішей і індивідуальних диастереомерів. Всі такі ізомірні форми цих сполук прямо включені у цей винахід. Кожен стереогенний вуглець може мати конфігурацію R або S. Комбінації заміщуючих груп і змінних, передбачені цим винаходом, такі, що всі вони забезпечують створення сталих сполук. Термін «сталий», як він використовується у даному описі, відноситься до сполук, які мають сталість, достатню для забезпечення їх одержання, і які зберігають цілісність сполуки протягом достатнього часу, щоб вона могла використовуватись для детально описаних тут дій (наприклад, для терапевтичного або профілактичного введення ссавцю або для застосування у афінній хроматографії). Звичайно, такі сполуки сталі при температурі 40°С або нижче, у відсутності вологи або інших агресивних умов протягом не менше ніж 1 тижня. Сполуки по даному винаходу можуть бути синтезовані за допомогою звичайного обладнання. їх перевагою є те, що вихідні матеріали є легко доступними. Описані тут сполуки по даному винаходу, включаючи сполуки з структурними формулами (І) і (II), визначені таким чином, що вони містять і одержувані з них фармацевтично сприйнятні похідні і проліки. «Фармацевтично сприйнятні похідні або проліки» означає будь-яку фармацевтично сприйнятну сіль, ефір, сіль ефіру або іншу похідну сполуки по даному винаходу, яка після введення реципієнтові здатна забезпечити (прямо або непрямо) сполуки по даному винаходу. Відповідно, цей винахід стосується також проліків з сполук по даному винаходу, які є похідними, розробленими для поліпшення біологічних властивостей, таких як оральне всмоктування, кліренс, метаболізм або розподіл у організмі. Такі похідні добре відомі у медицині. Як має бути зрозуміло досвідченому практику, сполуки по даному винаходу можуть бути модифіковані шляхом надання їм відповідних функціональних груп для посилення виборчих біологічних властивостей. Такі модифікації відомі у фармацевтиці і містять такі, які збільшують біологічне проникання у дану біологічну систему (наприклад, кров, лімфатична система, центральна нервова система), підвищують оральну біодоступність, збільшують розчинюваність, що дозволяє використати ін'єкційний спосіб введення, змінюють метаболізм і змінюють швидкість екскреції. Термін «захищена» використовується тоді, коли розроблена функціональна група приєднується до відповідної хімічної групи (захисної групі). Приклади придатних захисних аміногруп описані у таких джерелах, як Т. W. Green & P. G. M. Wuts, Protective Groups in Organic Synthesis, 2d. Ed., John Wiley & Sons (1991); L. Fieser & M. Fieser, Fieser and Fieser’s Reagents for Organic Synthesis, John Wiley and Sons (1994); L. Paquette, ed. Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995), у тому числі на прикладі деяких конкретних сполук, використовуваних у даному винаході. Особливо сприятливими похідними і проліками є ті, які збільшують біодоступність сполук по даному винаходу, коли такі сполуки вводяться ссавцю (наприклад, забезпечуючи орально вводимої сполуці більш швидке всмоктування у кров), мають більш сприятливі швидкості кліренса або метаболічні профілі, або які посилюють доставку батьківської сполуки у потрібне місце (наприклад, головний мозок або лімфатичну систему). Переважні проліки містять похідні, у яких структурам по формулах (І) і (II) надається група, яка посилює водорозчинюваність або активний транспорт через мембрану кишечнику. Фармацевтично сприйнятні солі сполук по даному винаходу містять ті, які одержані з фармацевтично сприйнятних неорганічних і органічних кислот і основ. Приклади придатних кислих солей містять ацетат, адипат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, формат, фумарат, глюкогептаноат, гліцерофосфат, гліколат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, лактат, малеат, малонат, метансульфонат, 2нафталінсульфонат, нікотинат, нітрат, оксалат, пальмоат, пектинат, персульфат, 3-фенілпропіонат, фосфат, пікрат, півалат, пропіонат, саліцилат, сукцинат, сульфат, тартрат, тіоціанат, тосілат і ундеканоат. Iнші кислоти, такі як щавлева, хоч самі не є фармацевтично сприйнятними, можуть використовуватись для одержання солей, застосовуваних як проміжні продукти при приготуванні сполук по даному винаходу і їх фармацевтично сприйнятних кислих солей. Солі, одержані з відповідних основ, містять солі лужних металів (наприклад, натрію і калію), лужноземельних металів (наприклад, магнію), амонію, а також N-(С1-4 алкіл)4+ солі. Цей винахід передбачає також кватернізацію будь-яких основних азотвміщуючих груп описаних тут сполук. За допомогою такої кватернізації можна одержати водо- або маслорозчинені продукти, а також продукти, що можуть бути дісперговані. Загалом, сполуки з структурними формулами (І) і (II) одержують за допомогою методів, проілюстрованих у Прикладах 1-8. Проте, як має бути зрозуміло фахівцеві, представлені тут схеми синтезу не вичерпують всіх можливих способів одержання сполук, описаних тут і складаючих предмет даної заявки. Інші способи будуть очевидними для середнього фахівця у цій області. Крим того, різні стадії синтезу, описані тут, можуть виконуватись у іншій послідовності або у іншому порядку, щоб одержати бажані сполуки. Не зв'язуючись теоретичними міркуваннями, ми вважаємо, що сполуки по даному винаходу взаємодіють ковалентно або нековалентно з активним місцем протеази NS3 HVC і інших серинпротеаз, інгібуючи здатність цього ферменту розщепляти природні або синтетичні субстрати. Нековалентні взаємодії мають ту перевагу, що вони забезпечують відносно більшу специфічність інгібування і не подавляють інші небажані мішені, наприклад цистеїнпротеази. Завдяки цьому, ці сполуки будуть мати більш високий терапевтичний індекс при введенні ссавцю, ніж ковалентні інгібітори протеази, які можуть взаємодіяти з широким колом протеаз і викликати небажані токсичні ефекти. З іншого боку, ковалентні взаємодії мають ту перевагу, що вони мають більш високий інгібуючий потенціал, дозволяючи вводити більш низькі дози і тим самим пом'якшуючи проблеми, пов'язані з відсутністю специфічності. Нові сполуки по цьому винаходу є відмінними інгібіторами протеаз, зокрема серинпротеаз, а більш точно протеази NS3 HVC. Відповідно, ці сполуки здатні знаходити і подавляти протеази, зокрема серинпротеази, а більш точно протеазу NS3 HVC. Як такі, ці сполуки надають вплив на життєвий цикл вірусів, включаючи HVC, і, отже, корисні як антивірусні препарати. Ступінь подавлення може визначатись різними способами, такими як описані у Прикладі 11. Термін «антивірусний препарат» відноситься до сполуки або лікарського препарату, який має активність, направлену на інгібування вірусів. Такі препарати містять інгібітори зворотної транскріптази (включаючи нуклеозидні і ненуклеозидні аналоги) і інгібітори протеаз. Переважно інгібітор протеаз є інгібітором протеази HVC. Термін «лікування», як він використовується тут, відноситься до ослаблення симптомів будь-якого конкретного розладу у пацієнта або поліпшення, що піддається оцінці показника, що асоціюється з конкретним розладом. Термін «пацієнт», як він використовується тут, відноситься до ссавця, включаючи людину. Таким чином, згідно іншому втіленню, цей винахід стосується фармацевтичних композицій, включаючих сполуки з структурною формулою (І) або (II) або його фармацевтично сприйнятну сіль; додатковий препарат, обраний з, але не включаючий, імуномодулятор, такий як a-, b- або g-інтерферон; інші антивірусні препарати, такі як рибавірин або амантадин; інші інгібітори протеази HVC; інгібітори інших мішеней у життєвому циклі HVC, таких як геліказа, полімераза або металопротеаза; або їх комбінації і будь-який фармацевтично сприйнятний носій, ад'ювант або розчинник. Інше втілення стосується композицій, вміщуючих сполуки з структурною формулою (І) або (II) або його фармацевтично сприйнятну сіль; і фармацевтично сприйнятний носій, ад’ювант або розчинник. Така композиція може за бажанням включати додатковий агент, обраний з імуномодуляторів, таких як a-, b- або g-інтерферон; інші антивірусні препарати, такі як рибавірин; інші інгібітори протеази HCV; інгібітори гелікази HCV; або їх комбінації. Термін «фармацевтично сприйнятний носій або ад'ювант» відноситься до носія або ад'юванту, який можна вводити пацієнтові, разом з сполукою по даному винаходу, і який не руйнує його фармакологічну активність і є нетоксичним при введенні у дозах, достатніх для діставки терапевтичної кількості сполуки. Фармацевтично сприйнятні носії, ад'юванти і розчинники, які можуть використовуватись у фармацевтичних композиціях по даному винаходу, містять, але не обмежуються ними, іонообмінні матеріали, глінозем, алюмінію стеарат, лецитин, самоемульгуючі системи діставки лікарських препаратів (СЕСДЛП), такі як da-токоферол, поліетиленгліколь 1000 сукцинат, сурфактанти, використовувані у фармацевтичних дозових формах, такі як Твіни або інші подібні полімерні матриці, сироваточні білки, такі як альбумін сироватки людини, буферні речовини, такі як фосфати, гліцин, сорбінова кислота, калію сорбат, парциальні гліцеридні суміші насичених рослінних жирних кислот, вода, соль або електроліти, такі як протамін сульфат, динатрию гідрофосфат, калію гідрофосфат, натрій хлорид, солі цинку, колоїдний кремнезем, магній трисилікат, полівініл піролідон, речовина на основі целюлози, поліетилен гліколь, натриєва сіль карбоксиметилцелюлози, поліакрилати, воски, полімери поліетилен-поліоксипропіленового блока, поліетилен гліколь і ланолін. Циклодекстрини, такі як a-, b- або g-циклодекстрин, або хімічно модифіковані похідні, такі як гідроксиалкілциклодекстрини, включаючи 2- і 3-гідроксипропіл-bциклодекстрини, або інші солюбілізовані похідни також можуть з успіхом використовуватись для посилення діставки сполук з структурними формулами (І) або (II). Фармацевтичні композиції по даному винаходу можуть вводитись орально, парентерально, у вигляді інгаляційного аерозолю, місцево, ректально, назально, буккально, вагінально або за допомогою імплантованого резервуара. Ми віддаємо перевагу оральному введенню або введенню шляхом ін'єкції. Фармацевтичні композиції по даному винаходу можуть містити будь-які звичайні нетоксичні фармацевтично сприйнятні носії, ад'юванти або розчинники. В деяких випадках рН складу можна регулювати за допомогою фармацевтично сприйнятних кислот, основ або буферів, щоб посилити сталість сполуки у даному складі або його лозової форми. Термін «парентеральне», як він використовується тут, містить підшкірне, внутрішньошкіряне, внутрішньовенне, внутрішньом'язове, внутрішньосуглобове, інтрасиновіальне, інтрастернальне, інтратекальне, всередину поразки і інтракраніальне введення у вигляді ін'єкцій або вливання. Фармацевтичні композиції можуть бути у вигляді стерильного ін'єкуємого препарату, наприклад у вигляді стерильної ін'єкційної водної або маслянистої суспензії. Така суспензія може бути приготовлена згідно з методами, відомими у цій області, з використанням придатних диспергуючих або змочуючих речовин (таких як, наприклад, Твін 80) і суспендуючих речовин. Стерильний ин'єкуємий препарат може також представляти собою стерильний ин'єкуємий розчин або суспензію у нетоксичному парентерально сприйнятному розріджувачі або розчиннику, наприклад розчині у 1,3-бутандіолі. Серед сприйнятних носіїв і розчинників, які можуть використовуватись, знаходяться манітол, вода, розчин Рингера і ізотонічний розчин натрію хлориду. На додаток, стерильні нелетючі масла звичайно використовуються як розчинники або середовища для суспендування. Для цієї мети може використовуватись будь-яке легке нелетюче масло, включаючи синтетичні моно- або дигліцериди. Жирні кислоти, такі як олеїнова кислота, і її гліцеридні похідни використовуються при виготовленні ин'єкуємих препаратів, як і природні фармацевтично сприйнятні масла, такі як оливкове і касторове, і особливо їх поліоксиетиловані варіанти. Такі масляні розчини або суспензії також можуть містити розріджувачі або диспергатори у вигляді спіртів з довгим ланцюжком, аналогічних описаним у Pharmacopeia Helvetica (Ph. Helv.), або подібного спірту, або карбоксиметилцелюлози, або подібних диспергуючих агентів, які звичайно використовуються у складі фармацевтично сприйнятних дозових форм, таких як емульсії і/або суспензії. В рецептурі можуть також використовуватись інші широко застосовувані сурфактанти, такі як Твіни або Спани, і/або інші подібні емульгатори або підсилювачі біодоступності, які звичайно використовуються при виробництві фармацевтично сприйнятних твердих, рідких або інших дозових форм. Фармацевтичні композиції по даному винаходу можна орально вводити у будь-якій орально сприйнятній дозовій формі, включаючи, але не обмежуючись ними, капсули, таблетки, а також водні суспензії і розчини. На випадок таблеток для орального застосування, звичайно використовувані носії містять лактозу і кукурудзяний крохмаль. Мастильні агенти, такі як магнію стеарат, також звичайно вводяться до складу. Склади для орального введення у вигляді капсул у якості розріджувачів звичайно містять лактозу і висушений кукурудзяний крохмаль. Якщо водні суспензії вводяться орально, активний інгредієнт комбінується з емульгуючими і диспергуючими агентами. Якщо бажано, можуть додаватись підсолоджуючі і/або ароматизуючі і/або фарбуючі агенти. Фармацевтичні композиції по даному винаходу можна також вводити у вигляді супозиторію для ректального введення. Такі композиції можуть готуватись шляхом змішування сполуки по даному винаходу з придатним, не викликаючим подразнення наповнювачем, який є твердим при кімнатній температурі, але рідким при ректальній температурі, щоб він плавився у прямій кишці і вивільняв активні інгредієнти. Такі матеріали містять, але не обмежуються ними, масло какао, бджоліний віск і поліетиленгліколі. Місцеве застосування фармацевтичних композицій по даному винаходу особливо корисно, коли бажане лікування стосується легко доступних дільниць або органів. Для нанесення на шкіру фармацевтична композиція повинна представляти собою мазь, вміщуючу активні інгредієнти, суспендовані або розчинені у носії. Носії для місцевого застосування сполук по даному винаходу містять, не обмежуючись ними, мінеральне масло, вазелінове масло, білу нафту, пропілен гліколь, поліоксиетилен, поліоксипропілен, віск і воду. Як варіант, фармацевтична композиція може представляти собою лосьйон або крем, вміщуючі активні інгредієнти, суспендовані або розчинені у носії. Придатні носії містять, не обмежуючись ними, мінеральне масло, сорбіт моностеарат, полісорбат 60, цетилові ефіри, віск, цетеариловий спірт, 2-октилдодеканол, бензиловий спірт і воду. Фармацевтичні композиції по даному винаходу можна застосовувати шляхом місцевого введення у нижній відділ кишкового тракту у вигляді ректальних суппозиториїв або клізми. Трансдермальні накладки також включені у цей винахід. Фармацевтичні композиції по даному винаходу можуть вводитись у вигляді назального аерозолю або інгаляції. Такі композиції готуються методами, добре відомими у галузі фармацевтики, і можуть представляти собою розчини у сольовому розчині з використанням бензилового спірту або інших придатних консервантів, підсилювачів всмоктування для збільшення біодоступності, фтор-вуглеців і/або інших солюбілізуючих або диспергуючих агентів, відомих у цій галузі. Дозові рівні від приблизно 0,01 до приблизно 100мг/кг ваги тіла у день, переважно від 0,5 до 75мг/кг ваги тіла у день, описаних тут сполук інгібіторів протеази використовуються у вигляді монотерапії для профілактики і лікування хвороб, які викликаються вірусами, зокрема вирусом гепатиту С. Як правило, фармакологічні композиції по даному винаходу будуть вводитись від 1 до приблизно 5 раз у день або, як варіант, у вигляді безперервного вливання. Таке введення може використовуватись як хронічна або гостра терапія. Кількість активного інгредієнта, який може комбінуватись з наповнювачами у складі дозової форми, буде варіюватись залежно від реципієнта і конкретного способу введення. Типовий препарат буде містити від приблизно 5% до приблизно 95% активного сполуки (в/в). Переважно такі препарати містять 20-80% активної сполуки. Якщо композиції по даному винаходу представляють собою комбінацію сполуки з структурною формулою (І) або (II) з однією або більш додатковою терапевтичною або профілактичною речовиною, то ця сполука і ця додаткова речовина повинні бути у дозо-вих рівнях між 10 і 100%, а більш переважно між 1080% від тієї дози, яка звичайно вводиться на випадок монотерапії. Згідно з однім втіленням фармацевтичні композиції по даному винаходу містять додатковий імуномодулятор. Приклади додаткових імуномодуляторів містять, не обмежуючись ними, a-, b- або gінтерферони. Згідно з іншим втіленням фармацевтичні композиції по даному винаходу можуть містити додатково антивірусний препарат. Приклади антивірусних препаратів містять рибавірин і амантадин. Згідно з ще однім втіленням фармацевтичні композиції по даному винаходу можуть містити додатково інші інгібітори протеази HCV. Згідно з ще однім втіленням фармацевтичні композиції по даному винаходу можуть додатково включати інгібітор інших мішеней у життєвому циклі HCV, таких як геліказа, полімераза або металопротеаза. Після досягнення поліпшення стану пацієнту може вводитись підтримуюча доза сполуки, композиції або комбінації по даному винаходу, якщо це необхідно. Відповідно, доза або частота введення можуть бути знижені як функція симптомів до рівня, при якому поліпшений стан зберігається. Після ослаблення симптомів до бажаного рівня лікування має бути припинено. Проте, пацієнтам може зажадатись інтермітуюче лікування на довгостроковій основі при поверненні симптомів хвороби. Як зрозуміло фахівцеві, можуть зажадатись більш низькі або більш високі дози, ніж приведені тут. Конкретна доза і схема лікування для кожного індивідуального пацієнта будуть залежати від різноманітних факторів, включаючи активність використовуваної сполуки, вік, вагу тіла, загальний стан здоров'я, стать, раціон харчуванн, час введення, швидкость екскреції, комбінацію з іншими лікарськими препаратами, тяжкість і течію інфекції, схильність пацієнта до даної інфекції і рішення лікуючого лікаря. Коли такі сполуки або їх фармацевтично сприйнятні солі знаходяться у одному складі з фармацевтично сприйнятним носієм, то результуюча композиція може вводитись in vivo ссавцям, таким як людина, для інгібування активності серинпротеаз, зокрема протеази NS3 HCV, або для лікування або попередження вірусної інфекції, зокрема вірусної інфекції HCV. Для такого лікування можуть також використовуватись сполуки по даному винаходу у комбінації з препаратами, які містять, не обмежуючись ними: імуномодулятори, такі як a-, b- або g-інтерферони; інші антивірусні препарати, такі як рибавірин і амантадин; інші інгібітори протеази NS3 HCV; інгібітори інших мішеней у життєвому циклі HCV, таких як геліказа, полімераза або металопротеаза, або внутрішнє введення рибосом; або їх комбінації. Ці додаткові препарати можуть комбінуватись з сполукими по даному винаходу при створенні однієї дозової форми. Як варіант, ці додаткові препарати можуть вводитись ссавцю окремо як частина множинної дозової форми. Відповідно, інше втілення цього винаходу стосується методів подавления активності серинпротеази у ссавців шляхом введення сполуки з структурною формулою (І) або (II) і такими заміщуючими групами, як визначено вище. Переважно серинпротеаза представляє собою NS3 HCV. В іншому втіленні цей винахід стосується методів подавления HCV або активності NS3 HCV у ссавця, включаючих стадію введення вказаному ссавцю сполуки з структурною формулою (І) або (II) і такими заміщуючими групами, як визначено вище. В ще одном втіленні цей винахід стосується методів зниження активності серинпротеази у ссавця, включаючих стадію введення вказаному ссавцю будь-якої з фармацевтичних композицій і комбінацій, описаних вище. Якщо ця фармацевтична композиція містить тільки сполуки по даному винаходу як активний інгредієнт, то такі методи можуть додатково передбачати стадію введення вказаному ссавцю препарату, обраного з імуномодулятора, антивірусного препарату, інгібітора протеази HCV або інгібітора інших мішеней у життєвому циклі HCV. Такий додатковий препарат може вводитись ссавцю до введення композиції інгібітора HCV, одночасно з ним або після нього. В переважному втіленні ці методи використовуються для зниження активності протеази NS3 HCV у ссавця. Якщо ця фармацевтична композиція містить як активний інгредієнт тільки сполуки по даному винаходу, то такі методи можуть додатково передбачати стадію введення вказаному ссавцю препарату, обраного з імуномодулятора, антивірусного препарату, інгібітора протеази HCV або інгібітора інших мішеней у життєвому циклі HCV, таких як геліказа, полімераза або металопротеаза. Такий додатковий препарат може вводитись ссавцю до введення композицій по даному винаходу, одночасно з ними або після них. В іншому переважному втіленні ці методи використовуються для подавления реплікації вірусу у ссавця. Такі методи використовуються у лікуванні або профілактиці, наприклад, вірусних захворювань, таких як HCV. Якщо ця фармацевтична композиція містить як активний інгредієнт тільки сполуки по даному винаходу, то такі методи можуть додатково передбачати стадію введення вказаному ссавцю препарату, обраного з імуномодулятора, антивірусного препарату, інгібітора протеази HCV або інгібітора інших мішеней у життєвому циклі HCV. Такий додатковий препарат може вводитись ссавцю до введення композиції по даному винаходу, одночасно з нею або після її. Сполуки, описані тут, можуть використовуватись також як лабораторні реактиви. Сполуки по даному винаходу можуть також використовуватись для лікування або попередження вірусної контамінації матеріалів і, отже, для зниження ризику вірусної інфекції у лабораторного або медичного персоналу або у пацієнтів, які контактують з такими матеріалами. Ці матеріали містять, не обмежуючись ними, біологічні матеріали, такі як кров, тканина і т.п.; хірургічні інструменти і одяг; лабораторні прилади і одяг; а також апарати і матеріали для збору крові. Для того щоб цей винахід було більш зрозумілим, приведені наступні приклади. Ці приклади слугують тільки для цілей ілюстрації і ні в якому разі не обмежують область застосування даного винаходу. Загальні матеріали і методи В Прикладі 1 представлена загальна методологія синтезу, використовувана для одержання сполук по даному винаходу. Більш конкретні методології для одержання сполук по даному винаходу, включаючи сполуки 1-198, представлені у Прикладах 2-9. Дані ВЕРХ, приведені у Таблицях 1-7, виражені як градиент розчинника; час утримування; і % чистота. У всіх методах використалась деіонізована вода. Правильні (М+Н)+ і/або (Μ+Na)+ молекулярні іони для всіх сполук були одержані за допомогою матричної лазерної десорбційної мас-спектрометрії (Kratos MALDI І) або електророзпилювальної масспектрометрії (MICROMASS Quatro II)· Приклад 1 Численні амінокислоти, використовувані у синтезі пептидильних і пептидоміметиних сполук по даному винаходу, можна придбати, наприклад, у Sigma Chemical Company або Bachem Feinchemikalien AG (Швейцарія). Ті амінокислоти, які придбати не можна, можна одержати, використовуючи відомі способи синтезу («Kinetics Resolution of Unnatural and Rarely Occurinn Amino Acids: Enantioselective Hydrolysis of NAcyl Amino Acids Catalyzed by Acylase I», Chenault, H. K. et. ΑΙ., J. Am. Chem. Soc. Ill, 6354-6364 (1989) і приведених у цьому джерелі посилань; «Synthesis of b-g-Unsaturated Amino Acids by the StreckeK Reaction», Greenlee, W. J., J. Org. Chem. 49, 2632-2634 (1984); «Recent Stereoselective Synthetic Approaches to Betaamino Acids», Cole, D. Tetrahedron 50; 9517 (1994); «The Chemistry of Cyclic Alrha Imino Acides», Mauger, А. В.; Volume 4 of «Chemistry and Biochemistry of Amino Acids, Peptides, and Proteins», Weinstein, B. Editor, Marcel DekkeK (1977); «Recent Progress in the Synthesis and Reactions of Substituted Piperidines», Org. Prep. Procerure Int. 24, 585-621 (1992) на які тут робляться посилання). Деякі сполуки з структурною формулою (І) або (II) можуть бути синтезовані з амінокислот методами, які добре відомі у галузі синтезу пептидів і органічних хімічних сполук. Приклади таких методів синтезу описані у Bodansky and Bodansky, «The Practice of Peptide Synthesis», Springer-Verlag, Berlin, Germany (1984), «The Peptides», Gross and Meinhofer, eds; Academic Press, 1979, Vols. I-III, and Stewart, J. M. and Young, J. D., «Solid Phase Peptide Synthesis, Second Edition», Pierce Chemical Company, Rockford, IL (1984) ; and «Recent Advances in the Generation of Molecular Diversity», Moos, W. H., Green, G. D. and Pavia, M. R. In «Annual Reports in Medicinal Chemistry», Vol. 28, pp. 315-324; Bristol, J. Α., ed.; Academic Press, San Diego, CA (1993), на які тут робляться посилання. Звичайно, для синтезу фази розчину a-амін амінокислоти, яка має бути приєднана, захищається уретаном, таким як Вос, Cbz, Fmoc або Alloc, тоді як вільна карбоксильна група активується реакцією з карбодіімідом, таким як DCC, EDC або DIC, за бажанням у присутності каталізатора, такого як НОВТ, HOAt, HOSu або DMAP. Придатні також і інші методи, які проходять через проміжні стадії активованих складних ефірів, кислотних галідів, активованих ферментів амінокислот і ангідрідів, включаючи фосфонієві реактиви, такі як ВОР, Ру-ВОР, N-карбоксиангідріди, симетричні ангідріди, змішані карбонові ангідріди, карбонофосфінові і карбоно-фосфорні ангідріди. Після створення пептиду захісна група може бути видалена методами, описаними у зазначених вище посиланнях, такими як гідрогенування у присутності палладієвого, платинового або родієвого каталізатора, обробка натрієм у рідкому аміаку, соляній, фтористоводневій, бромистоводневій, мурав'їній, трифторметансульфоновій або трифторуксусній кислоті, вторинними амінами, іоном фторіду, триметилсиліловими галідами, включаючи бромід і йодид, або лугами. Автоматизація процесу синтезу з використанням описаних вище методів може бути здійснена на серійном обладнанні, включаючому, але не обмежуючись ними, Advanced Chemtech 357 FBS і 496 MOS; Tecan CombiTec і Applied Biosystems 433A у числі іншого обладнання. Конкретне застосування цих методів і їх еквівалентів залежно від цільової сполуки буде очевидним для фахівців у цій галузі. Модифікації хімічних процесів і вибір обладнання не виходять за рамки компетенції середнього фахівця. Приклад 2 Сполуки 1-26 (Таблиця 1) були одержані, як показано на Схемі 1. На Схемі 1 і подальших схемах слово Resin у кружку означає Смола (прим, перекладача). Синтез 301-306 Стадія А. Синтез 301. 4-метил-бензгідриламінова смола (1,05ммоль/г, 20,0г) поміщали у воронку з матованого скла і промивали диметилформамідом (3х75мл), 10% (о/о) діізопропілетиламіном (DIEA) у диметилформаміді (2х75мл) і нарешті диметилформамідом (4х75мл). Достатня кількість диметилформаміду додавалась до смоли, щоб одержати суспензію, а потім 300 (8,0г; 20,8ммоль, одержаного з (2S) 2-(t-бутилоксикарбоніламіно)-бутиральдегиду згідно з А. М. Murphy et al. J. Am. Chem. Soc, 114, 3156-3157 (1992)), 1-гідроксибензотриазола гідрат (НОВТ-Н2О; 3,22г; 21,0ммоль), Обензотриазол-Ν,Ν,Ν,Ν'-тетраметилуронию гексафторфосфат (HBTU; 8,0г; 21,0ммоль) і DIEA (11,0мл; 63ммоль). Реакційна суміш перемішувалась протягом ночі при кімнатній температурі, для чого використався шейкер. Смола виділялась на воронці з матованого скла за допомогою аспіраційної фільтрації і промивалась диметилформамідом (3х75мл). Аміногрупи, що не прореагували, потім видалялись за допомогою реакції смоли з 20% (о/о) оцтовим ангідрідом/диметилформамідом (2х50мл) безпосередньо у воронці (10хв/промивання). Смола промивалась диметилформамідом (3х75мл) і дихлорметаном (3х75мл) перед сушкою протягом ночі під вакуумом, щоб одержати 300а (26,3г; 81% вихід). Захисна група t-Boc видалялась з смоли за допомогою синтезатора пептидів Advanced ChemTech 396 по такій методиці. Смола 300а (0,05ммоль) спучувалась промиванням дихлорметаном (3x1мл) з подальшим відщепленням захисної групи t-Boc шляхом впливу 50% (ο/ο) ΤFA/дихлорметаном (1,0мл) протягом 10хв (при струшуванні), а потім свіжим реактивом (1мл) протягом 30хв. Смола потім промивалась дихлорметаном (3x1мл), потім DMF (3x1мл), потім 10% DIEA/диметилформамідом (о/о) (2x1мл) і нарешті Nметилпіролідоном (3x1мл), щоб одержати смолу 301. Стадія В. Синтез 303. Ця сполука одержувалась з смоли 301 (0,05ммоль) за допомогою синтезатора пептидів Advanced ChemTech 396. Смола 301 ацилувалася розчином 0,4М 302 і 0,4М НОВТ у Nметилпіролідоні (0,5мл), розчином 0,4М HBTU у N-метилпіролідоні (0,5мл) і розчином 1,6М DIEA у N метилпіролідоні (0,35мл); реакція протікала при струшуванні протягом 4 годин при кімнатній температурі. Реакція сполучення повторювалась. Смола потім промивалась диметилформамідом (3x1мл), а потім дихлорметаном (3x1мл), щоб одержати 303. Стадія С. Синтез 305. Синтез пов'язаної з смолою сполуки завершувався за допомогою синтезатора пептидів Advanced ChemTech 396. Смола 303 промивалась дихлорметаном (3х1мл), після чого відщеплювалася захисна група t-Boc шляхом впливу 50% (о/о) ΤFA/дихлорметаном (1,0мл) протягом 10хв (при струшуванні), а потім свіжим реактивом (1мл) протягом 30хв. Смола потім промивалась дихлорметаном (3х1мл), потім DMF (3х1мл), потім 10% DIEA/диметилформамідом (о/о) (2х1мл) і нарешті Ν-метилпіролідоном (3x1мл), щоб одержати смолу 304. Ця смола потім ацилувалася розчином 0,4М Fmoc-валіна і 0,4М НОВТ у Ν-метилпіролідоні (0,5мл), розчином 0,4М HBTU у N-метилпіролідоні (0,5мл) і розчином 1,6М DIEA у N-метилпіролідоні (0,35мл); реакція протікала при струшуванні протягом 4 годин при кімнатній температурі. Реакція сполучення повторювалась. Автоматизовані цикли складались з: (1) промивання смоли диметилформамідом (3x1мл); (2) відщеплення захисних груп 25% (о/о) піперидином у диметилформаміді (1мл) протягом 3хв, а потім свіжим реактивом (1мл) протягом 10хв; (3) промивання смоли диметилформамідом (3x1мл) і Nметилпіролідоном (3x1мл) перед реакцією сполучення, як описано вище. Таким способом забезпечувалось сполучення Fmoc-валіна і піразин-2-карбонової кислоти. Стадія D. Синтез 306. Перед відщепленням смола промивалась сумішшю 1:1 дихлорметан/метиловий спірт (3x1мл), а потім висушувалась під вакуумом. Альдегід відщешювался від смоли шляхом обробки 95% TFA/5% Н2О (0/0, 1,5мл) протягом 30хв при кімнатній температурі або шляхом обробки тетрагідрофураном /30% формаліном/ 1N HCІ 9:1:1 (0:0:0) протягом 1 години при кімнатній температурі. Після промивання смоли реактивом для відщеплювання (1мл), об'єднані фільтрати розводились водою і ліофілізувалися, щоб одержати неочищену сполуку 306 у вигляді білого порошку. Ці сполуки очищувались за допомогою напівпрепаративної ВЕРХ з зверненою фазою на колонці Waters DeltaPak 300 А С18 (15мкм, 30х300мм) з елююванням при лінійному градиєнті ацетонітрилу, вміщуючому 0,1% TFA (о/о), за 45хв при витратній швидкості 20мл/хв. Фракції, вміщуючі бажаний продукт, збирались і ліофілізувались, щоб одержати 306. Приклад 3 Сполуки 27-29 (Таблиця 1) були одержані, як показано на Схемі 2. Стадія А. Синтез 301. Дивись Стадію А, Схема 1 методології. Стадія В. Синтез 308. Смола 301 (6,0г; 0,65ммоль/г; 3,9ммоль) спучувалась у воронці з матованого скла промиванням дихлорметаном (3х50мл). Захисна група Вос потім відщеплювалася 50% (о/о) TFA/дихлорметаном (50мл) протягом 10хв (при періодичному перемішуванні), а потім протягом 30хв свіжим реактивом (50мл). Потім смола промивалась дихлорметаном (3х50мл), диметилформамідом (2х50мл), 10% DIEA/диметилформамідом (о/о) (2х50мл) і нарешті N-метилпіролідоном (3х50мл). Після перенесення смоли у 100-мл колбу, додавався Ν-метилпіролідон, щоб одержати суспензію, потім 307 (2,83г; 8,0ммоль), НОВТ.Н2О (1,22г; 8,0ммоль), HBTU (3,03г; 8,0ммоль) і DIEA (4,2мл; 24ммоль). Реакційна суміш перемішувалась протягом ночі при кімнатній температурі, для чого використався шейкер. Виділення смоли і видалення аміногруп, що не прореагували, 20% (о/о) оцтовим ангідрідом у диметилформаміді здійснювались як описано для 301, щоб одержати 308 (6,86г - кількісний вихід). Стадія С. Синтез 309. Ця сполука одержувалась з смоли 308 (0,15ммоль) з використанням синтезатора Tecan CombiTek. Смола 308 (0,076ммоль) промивалась диметилформамідом (2,5мл) протягом 5хв, а потім свіжим реактивом (2мл) протягом 20хв. Одержана смола промивалась диметилформамідом (3х2,5мл) і Νметилпіролідоном (3х2,5мл) перед ацилуванням розчином 0,4М Fmoc-валіну і 0,4М НОВТ у Nметилпіролідоні (0,8мл), розчином 0,4М ΗОΒΤ у N-метилпіролідоні (0,8мл) і розчином 1,6М DIEA у Νметилпіролідоні (0,6мл); реакція протікала при струшуванні протягом 8 годин при кімнатній температурі. Реакція сполучення повторювалась . Операції по відщепленню захисних груп і сполучення повторювались, щоб додати другий залишок валіну і останній залишок піразин-2-карбонової кислоти. Ця смола потім промивалась дихлорметаном (3х2,5мл), щоб одержати смолу 309. Стадія D. Синтез 310. До смоли 309 додавали 1:1 пірідін /дихлорметан (о/о) (1мл), 0,8М диметиламінопірин у диметилформаміді (0,2мл) і розчин 0,2М Z-COCІ у дихлорметані (1,5мл). Реакція протікала при струшуванні протягом 8 годин при кімнатній температурі. Реакція ацилування повторювалась. Одержана смола промивалась дихлорметаном (3х2,5мл), диметилформамідом (3х2,5мл), дихлорметаном (3х2,5мл) і нарешті сумішшю 1:1 дихлорметан/метиловий спірт (3х2,5мл), щоб одержати смолу 310. Стадія Е. Синтез 311. Перед відщепленням смола промивалась сумішшю 1:1 дихлорметан/метиловий спірт (3x1мл), а потім висушувалась під вакуумом. Альдегід відщеплювался від смоли шляхом обробки тетрагідрофураном/формаліном/оцтовою кислотою/1Ν НС1 5:1:1:1 (о:о:о:о) протягом 1 години при кімнатній температурі. Після промивання смоли реактивом для відщеплювання (1мл), об'єднані фільтрати розводились водою і ліофілізувались, щоб одержати неочищену сполуку 311 у вигляді білого порошку. Це сполуки очищалось за допомогою полупрепаративной ВЕЖХ з зверненої фазою на колонці Waters DeltaPak 300 А С18 (15мкм, 30х300мм) з елююванням при лінійному градиєнті ацетонитрила, вміщуючому 0,1% TFA (о/о), за 45хв при витратної швидкості 20мл/хв. Фракції, вміщуючі бажаного продукту, збирались і ліофілізувались, щоб одержати 311. Приклад 4 Сполуки 30-56 (Таблиця 1) були одержані, як показано на Схемі 3. Стадія А. Синтез 301. Дивись Стадію А, Схема 1 методології. Стадія В. Синтез 308. Дивись Стадію В, Схема 2 методології. Стадія С. Синтез 312. Цю сполуку одержували з смоли 308 (0,15ммоль) за допомогою синтезатора Tecan CombiTec. Смола 308 промивалась толуолом (3х2,5мл), а потім суспендувалась у толуолі (1,0мл). До одержаного додавався або розчин 0,8М R3 d-ізоціанату у толуолі (1,0мл), а потім 0,8М DIEA у толуолі (1,0мл), або розчин 0,8М Из d-карбонової кислоти з 0,8М DIEA у толуолі (1,0мл), а потім 0,8М дифенілфосфорилазид у толуолі (1,0мл). Реакція протікала при струшуванні протягом 8 годин при 55°С. Одержана смола потім промивалась толуолом (3х2,5мл) і диметилформамідом (4х2,5мл), щоб одержати смолу 312. Стадія D. Синтез 313. Дивись Стадію D, Схема 2 методології. Стадія Є. Синтез 314. Дивись Стадію Е, Схема 2 методології. Приклад 5 Сполуки 57-70 (Таблиця 1) були одержані, як показано на Схемі 4. Стадія А. Синтез 301. Дивись Стадію А, Схема 1 методології. Стадія В. Синтез 316. Цю сполуку було одержано з смоли 301 (0,05ммол) за допомогою пептидного синтезатора Advanced ChemTech 396. Смола 301 ацилувалась розчином 0,4М 315 і 0,4М НОВТ у Nметилпіролідоні (0,5мл), розчином 0,4М HBTU у N-метилпіролідоні (0,5мл) і розчином 1,6М DIEA у Nметилпіролідоні (0,35мл), і реакція протікала при струшуванні 4 години при кімнатній температурі. Реакція сполучення повторювалась. Одержана смола потім промивалась диметилформамідом (3х1мл), потім дихлорметаном (3x1мл). Захисна група Вос потім відщеплювалась 50% (о/о) TFA/дихлорметаном (1,0мл) протягом 10хв при перемішуванні, а потім протягом 30хв свіжим реактивом (1,0мл). Одержана смола потім промивалась дихлорметаном (3х1,0мл), диметилформамідом (2х1,0мл), 10% DIEA/диметил-формамідом (о/о) (2х1,0мл), диметилформамідом (3х1,0мл) і нарешті дихлорметаном (3х1,0мл), щоб одержати 316. Стадія С. Синтез 317а. Смола 316 ацилувалась розчином 0,4М Ζ-СО2Н у N-метилпіролідоні (0,5мл), розчином 0,4М HBTU у Ν-метилпіролідоні (0,5мл) і розчином 1,6М DIEA у Ν-метилпіролідоні (0,35мл), і реакція протікала при струшуванні 4 години при кімнатній температурі. Реакція сполучення повторювалась. Одержана смола потім промивалась диметилформамідом (3х1мл), щоб одержати 317а. Стадія С. Синтез 317b. Смола 316 ацилувалась розчином 0,5М Ζ-СOСI у диметилформаміді (1мл) і 1,6М DIEA у N-метилпіролідоні (0,35мл), і реакція протікала при струшуванні 2 години при кімнатній температурі. Стадія ацилування повторювалась. Одержана смола промивалась диметилформамідом (3X2,5мл), щоб одержати смолу 317B. Стадія С Синтез 317с. Смола 316 реагувала з 1,0М Z-сульфонілхлорідом у дихлорметані (0,5мл) і 1М пірідині у дихлорметані (0,60мл) протягом 4 годин при кімнатній температурі. Ця реакція повторювалась. Одержана смола промивалась дихлорметаном (3X1,0мл), а потім диметилформамідом (3X1,0мл), щоб одер жати смолу 317с. Стадія С. Синтез 317d. Смола 316 реагувала з 0,5М Z-изоціанатом у диметилформаміді (1,2мл) протягом 8 годин при кімнатній температурі . Ця реакція повторювалась. Одержана смола промивалась диметилформамідом (3X1,0мл), щоб одержати смолу 317d. Стадія С. Синтез 317е. Смола 316 реагувала з 0,5М Z-CHO у диметилформаміді (1,2мл) у присутності оцтової кислоти (0,1мл) і натрія ціаноборогідрида (200мг) протягом 4 годин при кімнатній температурі. Ця реакція повторювалась. Одержана смола промивалась диметилформамідом (3X1,0мл), щоб одержати смолу 317е. Стадія D. Синтез 318. Синтез цієї пов'язаної з смолою сполуки здійснювався за допомогою синтезатора пептидів Advanced ChemTech 396. Автоматизовані цикли, описані для Стадії 3, Схема 1 використовували, щоб додати Fmoc-валін, потім ще раз Fraoc-валін і, нарешті, піразин-2-карбонову кислоту. Стадія Е. Синтез 319. Дивись Стадію Е, Схема 2 методології. Приклад 6 Сполуки 81-100 і 127-142 (Таблиці 3 і 4) були приготовлені, як показано на Схемі 5. Стадія А. Синтез 301. Дивись Стадію А, Схема 1 методології. Стадія В. Синтез 320. Синтез цієї пов'язаної з смолою сполуки здійснювався за допомогою синтезатора пептидів Advanced ChemTech 396, починаючи із смоли 165 (0,05ммоль). Автоматизовані цикли, описані для Стадії 3, Схема 1 використовувалась для додавання Fmoc-A1, потім Fmoc-валіна і, нарешті, термінальної Fmoc-амінокислоти. Група Fmoc видалялась вже описаним способом 25% піперидіном/диметилформамідом (о/о), щоб одержати смолу 166. Стадія С. Синтез 321а. Смола 320 ацилувалась розчином 0,4М Т-СО2Н і 0,4М НОВТ у Nметилпіролідоні (0,5мл), розчином 0,4М HBTU у N-метилпіролідоні (0,5мл) і розчином 1,6М DIEA у Nметилпіролідоні (0,35мл), реакція протікала при струшуванні протягом 4 годин при кімнатній температурі. Ця реакція зчеплення повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 321а. Стадія С Синтез 321b. Смола 320 ацилувалась 0,5М Т-СОСl у диметилформаміді (1мл) і 1,6М DIEA у Nметилпіролідоні (0,35мл), реакція протікала при струшуванні протягом 2 годин при кімнатній температурі. Стадія ацилування повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 321b. Стадія С Синтез 321с. Смола 320 вступала у реакцію з 1,0М Т-сульфоніла хлорідом у дихлорметані (0,5мл) і 1М піридином у дихлорметані (0,60мл), яка продовжувалась 4 години при кімнатній температурі. Ця реакція повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 303с. Стадія С. Синтез 321d. Смола 320 вступала у реакцію з 0,5М Т-ізоціанатом у диметилформаміді (1,2мл), яка продовжувалась 8 годин при кімнатній температурі. Ця реакція повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 321d. Стадія D. Синтез 322. Альдегід відщеплювался від смоли і повністю позбавлялся захисних груп у результаті обробки 95% TFA/5% H2O (0/0, 1,5мл) протягом 45хв при кімнатній температурі. Після промивання смоли свіжим реактивом для відщеплювання (1мл), об'єднані фільтрати додавались до холодної суміші 1:1 ефір/пентан (12мл), і одержаний осад відділявся за допомогою центрифугування і декантування. Потім осад розчиняли у 10% ацетонітрилі / 90% Н2О / 0,1% TFA (15мл) і ліофілізували, щоб одержати неочищений 322 у вигляді білого порошку. Цю сполуку очищали за допомогою напівпрепаративної ВЕРХ із зверненою фазою на колонці Waters DeltaPak 300 А С18 (15мкм, 30x300мм) з елююванням при лінійному градиєнті ацетонитрилу, вміщуючому 0,1% TFA (о/о), за 45хв при витратній швидкості 20мл/хв. Фракції, вміщуючі бажаний продукт, збирались і ліофілізувалися, щоб одержати 322. Приклад 7 Сполуки 143-197 (Таблиця 6) були приготовлені, як показано на Схемі 6. Стадія А. Синтез 301. Дивись Стадію А, Схему 1 методології. Стадія В. Синтез 326. Цю сполуку було одержано з смоли 301 (0,50ммоль) за допомогою синтезатора пептидів Applied Biosystems моделі 433А. Амінокислоти, захищені Na-Fmoc, додавались до смоли 301 послідовно шляхом стандартних циклів сполучення з використанням HBTU і HOBt у якості добавок до Nметилпіролідону, щоб одержати смолу 326. Стадія С. Синтез 327а. Цей синтез був здійснений з використанням синтезатора пептидів Advanced ChemTech 396. Смола 326 (0,05ммоль) була позбавлена захисних груп за допомогою обробки 25% (о/о) піперидином у диметилформаміді (1мл) протягом 3хв, а потім свіжим реактивом (1мл) протягом 10хв. Одержана смола промивалась диметилформамідом (3x1мл) і N-метилпіролідоном (3x1мл). Далі смола ацилувалась розчином 0,4М Т-СО2Н і 0,4М НОВТ у N-метилпіролідоні (0,5мл), розчином 0,4М HBTU у Nметилпіролідоні (0,5мл), і розчином 1,6М DIEA у N-метилпіролідоні (0,35мл), і реакція при струшуванні продовжувалась 4 години при кімнатній температурі. Ця реакція сполучення повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 327а. Стадія С. Синтез 327b. Цей синтез був здійснений з використанням синтезатора пептидів Advanced ChemTech 396. Смола 326 (0,05ммоль) була позбавлена захисних груп за допомогою обробки 25% (о/о) піперидином у диметилформаміді (1мл) протягом 3хв, а потім свіжим реактивом (1мл) протягом 10хв. Одержана смола промивалась диме тилформамі дом (3x1мл) і N-метилпіролідоном (3x1мл). Далі смола ацилувалась з використанням 0,5М Т-СОСl у диметилформаміді (1мл) і 1,6М DIEA у N-метилпіролідоні (0,35мл) протягом 2 годин при кімнатній температурі. Ця реакція сполучення повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 327b. Стадія С. Синтез 327с. Цей синтез був здійснений з використанням синтезатора пептидів Advanced ChemTech 396. Смола 326 (0,05ммоль) була позбавлена захисних груп за допомогою обробки 25% (о/о) піперидином у диметилформаміді (1мл) протягом 3хв, а потім свіжим реактивом (1мл) протягом 10хв. Одержана смола промивалась диметилформамідом (3x1мл) і дихлорметаном (3x1мл). Потім смола вступала у реакцію з 1,0М Т-сульфоніла хлорідом у дихлорметані (0,60мл), яка продовжувалась 4 години при кімнатній температурі. Ця реакція повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметана/метилового спірту (о/о) (3x1мл), щоб одержати смолу 327с Стадія С. Синтез 327d. Цей синтез був здійснений з використанням синтезатора пептидів Advanced ChemTech 396. Смола 326 (0,05ммоль) була позбавлена захисних груп за допомогою обробки 25% (о/о) піперидином у диметилформаміді (1мл) протягом 3хв, а потім свіжим реактивом (1мл) протягом 10хв. Одержана смола промивалась диметилформамідом (3x1 мл) . Потім смола вступала у реакцію з 0,5М Тізоціанатом у диметилформаміді (1,2мл), яка продовжувалась 8 годин при кімнатній температурі. Ця реакція повторювалась. Потім смола промивалась диметилформамідом (3x1мл), дихлорметаном (3x1,0мл) і сумішшю 1:1 дихлорметану/метилового спірту (о/о) (3x1мл), щоб одержати смолу 327d. Стадія D. Синтез 328. Дивись Стадію D, Схему 1 методології. Приклад 8 Сполуки 79-80 і 101-123 (Таблиці 2, 3 і 4) були одержані, як показано на Схемі 7. Стадія А. Синтез 330. 2-хлорхлортритилова смола (2,2ммоль/г; 1,69 ) вступала у реакцію з 329 (0,385г; 1,1ммоль; одержаній, згідно з S. L. Harbeson et al. J. Med. Chem., 37, 2918 (1994)) у дихлорметані у присутності DIEA (0,47мл; 2,7ммоль), яка протікала при кімнатній температурі протягом 1 години. Реакція гасилась додаванням метилового спірту, після чого смола виділялась на воронці з матованого скла за допомогою аспіраційної фільтрації і промивалась дихлорметаном (3x25мл). Потім смола висушувалась протягом ночі під вакуумом, щоб одержати 330 (1,92г; 0,49мек/г) . Стадія В. Синтез 332. Синтез цієї пов'язаної з смолою сполуки здійснювався за допомогою синтезатора пептидів Applied BioSystems моделі 433А, починаючи со смоли 330 (0,74ммоль). Автоматизовані цикли, описані для Стадії 3, Схема 1 використались для додавання Fmoc-A1, потім Fmoc-A2 і, нарешті, Fmoc-A3. Група Fmoc видалялась вже описаним способом 25% піперидином /диметилформамідом (о/о), щоб одержати смолу 332. Стадія С. Синтез 333. Перед відщепленням смола промивалась сумішшю 1:1 дихлорметану/метилового спірту (3x1мл), після чого висушувалась під вакуумом. Пептид відщеплювался від смоли шляхом обробки оцтовою кислотою: трифторетанолом: дихлорметаном (1:1:3) протягом 1 години при кімнатній температурі. Після промивання смоли дихлорметаном, об'єднані фільтрати концентрувались під вакуумом, щоб одержати неочищений 333 у вигляді білого порошку (0,48г; 76%). Стадія D. Синтез 335. Сполуки 333 (0,05г; 0,058ммоль) розчинялось у диметилацетаміді (1мл), після чого до нього додавались DIEA (0,17ммоль), відповідний амін (0,20ммоль) і РуВrор (0,12ммоль). Реакція протікала при перемішуванні протягом 2 годин при 70°С. Реакційна суміш потім розводилась водою (8мл) і центрифугувалась, щоб одержати осад. Осад висушувався під вакуумом і давав неочищену сполуку 334, яка потім піддавалась окисленню безпосередньо у сполуку 335. Неочищена сполука 334 розчинялось у Nметилпіроліяоні (3мл) і вступала у реакцію з Dess-Martin періодинаном (110мг; 0,26ммоль), яка протікала протягом ночі при кімнатній температурі. Насичений водний розчин натрію бікарбоната (5мл) і 10% (в/о) водний розчин натрію тіосульфата (5мл) додавались до реакційної суміші, перемішувались, після чого додавалась вода (40мл). Осад відділявся центрифугуванням, тверда фаза висушувалась під вакуумом. При необхідності, кислотолабільні захисні групи видалялись шляхом обробки сумішшю 1:1 трифтороцтової кислоти і дихлорметану при кімнатній температурі протягом 30хв. Розчинник видалявся під вакуумом, і неочищена сполука очищалась за допомогою напівпрепаративної ВЕРХ із зверненою фазою на колонці Waters DeltaPak 300 А С18 (15мкм, 30x300мм) з елююванням при лінійному градиєнті ацетонітрилу, вміщуючому 0,1% TFA (о/о), за 45хв при витратній швидкості 20мл/хв. Фракції, вміщуючі бажаний продукт, збирались і ліофілізувались, щоб одержати 335. Приклад 9 Сполуки 71-78 і 124-126 були одержані з відповідних кислот з захищеними пептидами. Кислоти з захищеними пептидами одержувались, як було описано у Схемі 7, з використанням 2-хлорхлортритилової смоли. Ці пептидні кислоти потім сполучались з одною з наступних груп з використанням стандартної методології сполучення пептидів у фазі розчину. Посилання, у яких описано одержання цих груп, також приведені. Oleksyszyn et. ΑΙ., Synthesis, 985-986 (1979) S. Elgendy et. ΑΙ., Tetrahedron, 50, 3803-3812 (1994) Μ. R. Angelestro et. ΑΙ., Tetrahedron Letters, 33, 3265-3268 (1992) Т. Т. Curran, J. Organic Chemistry, 58, 6360-6363 (1993) E. Edwards, et. ΑΙ., J. Medicinal Chemistry, 38, 3972-3982 (1995) При необхідності, одержані продукти окислялись до кетонів за допомогою періодинану Dess Martin, як описано для Схеми 7. При необхідності, кислотолабільні захисни групи видалялись шляхом обробки сумішшю 1:1 трифтороцтової кислоти і дихлорметану при кімнатній температурі протягом 30хв. Розчинник видалявся під вакуумом, а неочищена сполука очищалась за допомогою напівпрепаративної ВЕРХ зі зверненою фазою на колонці Waters DeltaPak 300 А С18 (15мкм, 30x300мм) з елююванням при лінійному градиєнті ацетонітрилу, вміщуючому 0,1% TFA (о/о), за 45хв при витратній швидкості 20мл/хв. Фракції, вміщуючі бажаний продукт, збирались і ліофілізувались, щоб одержати готові продукти 71-78 і 124-126. Приклад 10 Сполуки 198 було одержано за допомогою модифікованої загальної методології, описаної у Прикладі 1.
ДивитисяДодаткова інформація
Назва патенту англійськоюSerine proteases inhibitors, pharmaceutical composition, a method for inhibitining activity and a method for treatment or prevention of viral infection of hepatitis c
Автори англійськоюBhisetti, Govinda, Rao
Назва патенту російськоюИнгибиторы серин-протеаз, фармацевтическая композиция, способ ингибирования активности и способ лечения или профилактики вирусной инфекции гепатита с
Автори російськоюБхисетти Говинда Рао
МПК / Мітки
МПК: C07K 5/117, C07K 7/06, C07K 5/10, C07K 5/02, C07K 7/02
Мітки: інгібітори, композиція, вірусної, спосіб, інфекції, гепатиту, інгібування, профілактики, фармацевтична, серин-протеаз, активності, лікування
Код посилання
<a href="https://ua.patents.su/54-66767-ingibitori-serin-proteaz-farmacevtichna-kompoziciya-sposib-ingibuvannya-aktivnosti-ta-sposib-likuvannya-abo-profilaktiki-virusno-infekci-gepatitu-s.html" target="_blank" rel="follow" title="База патентів України">Інгібітори серин-протеаз, фармацевтична композиція, спосіб інгібування активності та спосіб лікування або профілактики вірусної інфекції гепатиту с</a>
Попередній патент: Спосіб вилучення частини вуглеводнів з рециркуляційного потоку в процесі синтезу оцтової кислоти
Наступний патент: Гербіцидний засіб на основі арилсульфоніламінокарбонілтриазолінону
Випадковий патент: Резонансне зварювальне джерело живлення