Інгібітори тестостерон 5-a-редуктази, фармацевтична композиція та спосіб інгібування активності тестостерон 5-a-редуктази
Формула / Реферат
94119055-М
1. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь;
где R4 обозначает водород или метил, но не является водородом, если присутствует указанная необязательная пи-связь;
где R6 обозначает водород или С1-С3 насыщенный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей водород, С1-C6 алкил, C1-C6 гидроксиалкил, С1-C6 галоалкил, С2-С6 карбонилалкил, C3-C6 циклопропилалкил, С3-С6 эпоксиалкил и их ненасыщенные аналоги;
где R17α обозначает водород или низший алкил; и
где R17β обозначает третичную амино или амидогруппу.
2. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь;
где R4 обозначает водород или метил;
где R6 обозначает водород или C1-С3 насыщенный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей водород, C1-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где R17α обозначает водород или низший алкил; и
где R17β обозначает третичный амино или C3-C13 ацилтретичный амино.
3. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную
формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь:
где R4 обозначает водород или метил;
где R6 обозначает водород или C1-C3 насыщенный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей водород, C2-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где R17α выбран из группы, содержащей C1-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги; и
где R17β обозначает водород, гидрокси или заместитель, превращающийся in vivo в гидрокси.
4. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь;
где R4 обозначает водород или метил;
где R6 обозначает водород или C1-C3 насыщеный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей водород, C1-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где R17α обозначает водород или низший алкил; и
где R17β выбран из группы, содержащей ацил, карбоксамид, третичный амино или третичный амидо.
5. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь:
где R4 обозначает водород или метил;
где R6 обозначает водород или C1-C3 насыщенный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей C2-C6 алкил, C2-C6 гидроксиалкил, C2-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где R17α обозначает водород или низший алкил; и
где R17β выбран из группы, содержащей ацил, карбоксамид, третичный амино или третичный амидо.
6. Ингибитор тестостерон 5α-редуктазы, имеющий молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь;
где R4 обозначает метил;
где R6 обозначает водород или C1-C3 углеводород;
где R7 выбран из группы, содержащей водород, C1-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где Rα выбран из группы, содержащей низший алкил, циклоалкил и фрагмент, который вместе с Rβ и атомом азота, обозначеном при R17β, является 5-7-членным гетероциклическим кольцом, имеющим один гетероатом азота; и
где Rβ выбран из группы, содержащей фрагмент, который вместе с Rα и атомом азота, обозначенном при R17β, является 5-7-членным гетероциклическим кольцом, имеющим один гетероатом азота: -CORc, -CONRcRd, -CSNRcRd, -SO2Rc, -PO3RcRd (Rc и Rd являются водородом, низшим алкилом или низшим галоалкилом).
7. Ингибитор тестостерон 5α-редуктазы, выбранный из группы, содержащей:

17β-(N -н-амил-N-формамидо)-4-метил-4-аза-5α-андростан-3-он;

17β-(N -н-бутил-N-формамидо)-4-метил-4-аза-5α-андростан-3-он;
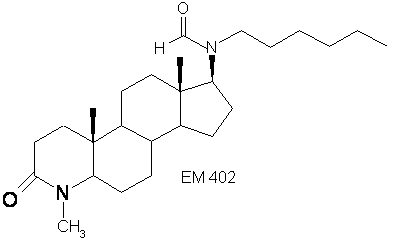
17β-(N -н-гексил-N-формамидо)-4-метил-4-аза-5α-андростан-3-он;

17β-аллил-17β-гидрокси-4-метил-4-аза-5α-андростан-3-он;

17α-пропил-17β-гидрокси-4-метил-4-аза-5α-андростан-3-он;
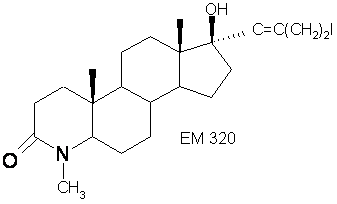
17α-(4 -йодбутинил)-17β-гидрокси-4-метил-4-аза-5α-андростан-3-он.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора тестостерон 5α-редуктазы, имеющего молекулярную формулу:
 ,
,
где пунктирная линия означает необязательную пи-связь;
где R4 обозначает водород или метил;
где R6 обозначает водород или C1-C3 насыщенный или ненасыщенный углеводород;
где R7 выбран из группы, содержащей водород, C1-C6 алкил, C1-C6 гидроксиалкил, C1-C6 галоалкил, C2-C6 карбонилалкил, C3-C6 циклопропилалкил, C3-C6 эпоксиалкил и их ненасыщенные аналоги;
где R17α обозначает водород или низший алкил; и
где R17β обозначает третичный амин или третичный аминоацил.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора 5α-редуктазы, указанного в любом из пп. 1-7.
10. Способ ингибирования активности тестостерон 5α-редуктазы, включающий назначение пациенту, нуждающемуся в этом, терапевтически эффективного количества ингибитора 5α-редуктазы, указанного в любом из пп. 1-7 или формкомпозиции, указанной в любом из пп. 8,9.
Текст
1. Ингибитор тестостерон 5a-редуктазы, имеющий молекулярную формулу 35589 ном при R17b , является 5-7-членным гетероциклическим кольцом, имеющим один гетероатом азота: -COR с, -CONRcRd, -CSNRcRd, -SO2Rc, -PO 3RcRd (Rc и Rd являются водородом, низшим алкилом или низшим галоалкилом). 7. Ингибитор тестостерон 5a-редуктазы, выбранный из группы, содержащей где пунктирная линия означает необязательную пи-связь; где R4 обозначает водород или метил, но не является водородом, если присутствует указанная необязательная пи-связь; где R6 обозначает водород или С1-С3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, C2-C6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b выбран из группы, содержащей ацил, карбоксамид, третичный амино или третичный амидо. 5. Ингибитор тестостерон 5a-редуктазы, имеющей молекулярную формулу 17b-(N-н-амил-N-формамидо)-4-мeтил-4-aзa-5aaндpocтaн-3-oн; где пунктирная линия означает необязательную пи-связь; где R4 обозначает водород или метил, но не является водородом, если присутствует указанная необязательная пи-связь; где R6 обозначает водород или С1-С3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С2-С6-алкил, С2-С6-гидроксиалкил, С2-С6-галоалкил, C2-C6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b выбран из группы, содержащей ацил, карбоксиамид, третичный амино или третичный амидо. 6. Ингибитор тестостерон 5a-редуктазы, имеющий молекулярную формулу 17b-(N-н-бутил-N-формамидо)-4-метил-4-аза-5aандростан-3-он; 17b-(N-н-гексил-N-формамидо)-4-метил-4-аза-5aандростан-3-он; 17b-аллил-17(-гидрокси-4-метил-4-аза-5a-андростан-3-он; где пунктирная линия означает необязательную пи-связь; где R4 обозначает метил; где R6 обозначает водород или С 1-С3 углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, C2-C6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где Rа выбран из группы, содержащей низший алкил, циклоалкил и фрагмент, который вместе с Rb и атомом азота, обозначенном при R17b является 5-7-членным гетероциклическим кольцом, имеющим один гетероатом азота; и где Rb выбран из группы, содержащей фрагмент, который вместе с Rа и атомом азота, обозначен 17a-пропил-17b-гидрокси-4-метил-4-аза-5a-андростан-3-он; 2 35589 где R4 обозначает водород или метил, но не является водородом, если присутствует указанная необязательная пи-связь; где R6 обозначает водород или С1-С3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, C2-C6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b обозначает третичный амин или третичный аминоацил. 9. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора 5a-редуктазы, указанного в любом из пп. 1-7. 10. Способ ингибирования активности тестостерон 5a-редуктазы, включающий назначение пациенту, нуждающемуся в этом, терапевтически эффективного количества ингибитора 5a-редуктазы, указанного в любом из пп. 1-7 или фармкомпозиции, указанной в любом из пп. 8, 9. 17a-(4-йодбутинил)17b-гидрокси-4-метил-4-аза-5aандростан-3-он. 8. Фармацевтическая композиция, содержащая фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора тестостерон 5a-редуктазы, имеющего молекулярную формулу , где пунктирная линия означает необязательную пи-связь; Данное изобретение относится к активным соединениям, фармацевтическим композициям и способам лечения андроген-опосредованных заболеваний, причем указанная композиция содержит новые ингибиторы активности тестостерон 5aредуктазы. Ингибиторы обладают хорошим сочетанием подавляющего действия на активность 5aредуктазы, низкой или отсутствующей андрогенной активностью и, при некоторых воплощениях, антиандрогенной активностью. Более конкретно, некоторые конкретные воплощения по изобретению относятся к производным 4-аза-андростанона или 4-аза-андростенона. Известные ранее ингибиторы 5a-редуктазы оказываются неспособными обеспечить сочетание (1) отсутствия андрогенной активности и (2) способности подавлять обе формы тестостерон 5aредуктазы ("5a-редуктазы"). 5a-редуктаза является ферментом, который катализирует превращение андрогена, тестостерона в значительно более сильный андроген дигидротестостерон ("ДГТ"). ДГТ является более активным андрогеном во многих целевых органах (см.: Anderson and Liao, Nature, 219, 277-279, 1968). Тот же фермент катализирует превращение андростендиона в андростандион. Ингибиторы 5aредуктазы ингибируют биосинтез продуктов, образование которых катализируется 5a-редуктазой. 5a-редуктаза была изучена на различных видах (см.: Liang et al. Endocrinology, 117, 571-579, 1985). Его выделение и структура и экспрессия кДНК, кодирующей его, были описаны (см.: Andersson and Russel. Proc. Natl. Acad. Sci., 87, 3640-3644, 1990). Недавно полученные данные продемонстрировали присутствие по меньшей мере двух различных генов, экспрессирующи х 5a-редуктазу у человека. 5a-редуктаза типа I (см.: Andersson and Russel. Proc. Natl. Acad. Sci., 87, 3640-3644, 1990) экспрессируется на низком уровне в простате человека, в то время как 5a-редуктаза типа II является преобладающей ферментной изоформой в этих тканях (см.: Andersson et. al., Nat., 354, 159161, 1991). Блокада 5a-редуктазы изучалась с точки зрения разработки фармацевтических лекарств для терапии заболеваний, таких как рак простаты. В Европейской патентной заявке № ЕР 285383 Ramusson et al. описывают лечение карциномы простаты с помощью 17-N-монозамещенного карбаноил-4-аза-5a-андрост-1-ен-3-онов. Заболевания, при которых также были исследованы ингибиторы 5a-редуктозы, включают воспаление сальной железы, плешивость (см.: Rittmaster et. al. J. Clin. Endocrinol. Metab., 65, 188-193, 1987) и доброкачественную гиперплазию простаты (см.: Metcalf. et al.,TiPS, 10, 491-495, 1989). Было доказано, что 4-аза-стероид N,N-диэтил4-метил-3-оксо-4-аза-5a-андростан-17-карбоксамид, 4-М, полезен для ингибирования образования ДГТ из тестостерона в простате крыс in vitro и in vivo (см.: Brooks et al., Endocrinology, 109, 830836, 1981), уменьшая таким образом тестостерониндуцированное увеличение веса простаты у этих животных. Было обнаружено, что другой 4-азастерон, МК-906 (Рroscar), вызывает уменьшение концентрации ДГТ в простате и 25-30%-ное уменьшение размера простаты у человека (см.: Imperato-McGinley et al., Proc. 7ist Ann. meet. Endocr. Soc., p. 332, abst 1639, 1989). Однако сообщается, что Proscar является сильным ингибитором фермента типа II, но слабым ингибитором фермента типа I (см.: Andtrsson et al., Nature, 354, 159-161, 1991). Такая слабая ингибирующая активность 5a-редуктазы типа I вероятно объясняет, почему самые высокие дозы Proscar, используе 3 35589 мые для человека, обычно не способны понизить уровни сывороточного дигидротестостерона ниже 25-35% от контроля, таким образом сохраняя очень значительную концентрацию циркулирующи х андрогенов (см.: Vermeulen et al., Thе Prostate 14, 45-53, 1989). Подавляющее действие лекарства на объем простаты у человека остается ограниченным до уровня 25-35% в течение периода времени 6 месяцев (см.: Stoner, J.Steroid Bioсhem. Мод. Biol. 37, 375-378, 1990). Таким образом, необходимо создание соединений, которые могут эффективно ингибировать как тип I, так и тип II 5a-редуктазы и, таким образом, вызывать более полное подавление циркулирующи х уровней дигидротестостерона. В патенте США № 4317817, патенте Бельгии № 883091 и патенте Великобритании № 2048888 Blohm и Metcalf рассматривают применение некоторых диазо-стероидов в качестве ингибиторов 5a-редуктазы. Metcalf et al. описывают синтез близких по структуре соединений в Tetrahedron Lett. 21, 15-18, 1980. В публикации ЕР № 343954, публикации ЕР № 375347, патенте США № 4882319, патенте США № 4937237 и J. Med. Chem. 33, 937-942, 1990, Holt et al. рассматривают применение некоторых Акольцевых арильных стероидных производных в качестве ингибиторов стероид 5a-редуктазы. В публикации ЕР № 239327 и публикации ЕР № 427434, с одной стороны, и в J. Steroid Biochem. 34, 571-575, 1989, и Biochemistry 29, 2815-2824, 1990, с другой стороны, Holt и Levy рассматривают, соответственно, применение андростен- и прегнен-3-карбоксилатных производных в качестве ингибиторов стероид-5a-редуктазы. В публикации ЕР № 375351 Holt et al. рассматривают получение замещенных фосфорной кислотой стероидов в качестве ингибиторов тестостерон 5a-редуктазы. В публикации ЕР № 271219, публикации ЕР № 314199 и публикации ЕР № 155096 Rasmusson и Reynolds рассматривают получение 17bзамещенных-4-аза-5a-андростенонов в качестве ингибиторов стероид-5a-редуктазы. Brooks et al. (Steroid 47, 1-19, 1986; Prostate 9, 65-76, 1986) сообщили о ингибирующей 5a-редуктазу и андроген- подавляющей активностях для некоторых 4-аза-стероидов. Rasmusson et al. рассматривают некоторые азастероиды в качестве ингибиторов 5a-редуктазы простаты крыс (в J. Med. Chem. 27, 19601701, 1984; те же авторы, 29, 2298-2315, 1986 и J. Biol. Chem. 259, 734-739, 1984). В публикации ЕР № 277002 Holt et al. рассматривают 17b-замещенные-4-аза-5a-андростан3-оны. В публикации ЕР № 271220 Carlin et al. рассматривают получение 17b-(N-монозамещенный карбамоил)-4-аза-5a-андростан-3-онов. В публикации ЕР № 200859 Carlin et al. рассматривают получение некоторых 4-аза-стероидпроизводных, которые, как установлено, являются ингибиторами стероид 5a-редуктазы. В международной патентной заявке WO № 91/12261 Panzeri et al. рассматривают получе ние производных 17b-замещенный-4-аза-5aандростан-3-онов. В патенте США 4396615, Steroids 38, 121-140, 1981 и Steroid Biochem. 19, 1491-1502, 1983; Petrow et al. рассматривают некоторые производные 6-метиленпрогестерона, которые, как установлено, являются ингибиторами стероид 5aредуктазы. В патенте США 4377584 (см., например, колонку 13), в патенте США 4220775 и в публикации ЕР № 414490 Rasmusson et al. расматривают некоторые 17b-замещенные-4-аза-5a-андростаноны (включая их ациламино-замещения) в качестве ингибиторов стероид 5a-редуктазы. В публикации ЕР № 052799 Alig et al. рассматривают некоторые D-гомостероиды в качестве ингибиторов стероид 5a-редуктазы. В патенте США 4191759 Johnston и Arth рассматривают N-замещенные-17b-карбамоил-андрост-4-ен-3-оны в качестве ингибиторов стероид 5a-редуктазы. В патенте Бельгии 855992 Benson и Blohm рассматривают стероидные ингибиторы тестостерон 5a-редуктазы для лечения кожных заболеваний. В патенте Канады 970692 Voight и Hsia рассматривают соединения, ингибирующие активность 5a-редуктазы. В патенте Франции 1465544 Jolly и Warnant рассматривают 4-аза-ароматические стероидные производные в качестве ингибиторов стероид 5aредуктазы. В патенте США 4087461 Robinson рассматривает некоторые алленовые стероиды в качестве ингибиторов тестостерон 5a-редуктазы. В публикации ЕР № 414529 Metcalf рассматривает некоторые 17-замещенные стероидные кислоты в качестве ингибиторов тестостерон 5aредуктазы (см., например, реферат). Смотри также Holt et al., публикация ЕР № 427434. В публикации ЕР № 298652 Bhattacharya рассматривает синтез 4-аза-DI-стероидов. В патентной заявке США № 5061803 и 5061801 Williams рассматривает способ, синтеза 17b-алканоил-3-оксо-4-аза-5a-андрост-1-енов и 3оксо-4-аза-андроcт-1-ен-17b-кетонов. В патентной заявке США № 5061803 Steinberg и Rasmusson рассматривают получение 17b-аминобензоил-4-аза-5a-андрост-1-ен-3-онов в качестве лечебных агентов при доброкачественной гипертрофии простаты. Lan-Hargest et al. рассматривают синтезы мостиковых А кольцевых стероидов в качестве ингибиторов 5a-редуктазы (Tetrahedron Lett. 28, 61176120, 1987). Weintraub et al. (в J. Med.Chem. 28, 831-833, 1985) рассматривают получение 20-гипроксиметил-4-метил-4-аза-2-окса-5a-прегнан-3-она в качестве ингибиторов тестостерон 5a-редуктазы. Kadohama et al. (Cancer Res. 44, 4947-4954, 1984) рассматривают ингибирование с помощью натрий 4-метил-3-оксо-4-аза-5a-прегнан-20 (S) карбоксилата 5a-редуктазы рака простаты. Maclndoe of al. в Steroid Biochom. 20, 10951100, 1934, рассматривают 5a-редуктазное инги 4 35589 бирующее действие некоторых 6-метиленстероидов в клетках MCF-7 рака груди человека. Liang et al. (J. Biol. Chem. 256, 7998-8005, 1981) рассматривают 17b-N,N-диэтиларбоксамоил-4-метил-4-аза-5a-андростан-3-о в качестве обратимого ингибитора 5a-редуктазы. Salomons и Doorenbos (J. Fharm. Sci. 63, 19-23, 1974) и Doorenbos et al. (J. Pharm. Sci. 60, 12341235, 1971; те же авторы, 62, 638-640, 1973; Chem. and Ind., 1322, 1970) рассматривают синтезы 17bамино-4-аза-стероидов. Nakayama et al. (J. Antibiotics XLII, 1221-1229; те же авторы, 1230-1234, 1989; те же авторы, 1235-1240, 1989) рассматривают выделение WS9659 из Streptomyces и его ингибирующую активность на тестостерон 5a-родуктазу. В публикации ЕР № 294937 и публикации ЕР № 294035 Nakai et al. рассматривают получение, соответственно, циннамоиламидных производных и производных ((бензоиламино)фенокси)бутановой кислоты в качестве ингибиторов 5a-редуктазы. Патент США 5026682 и публикация ЕР № 375349 относятся к некоторым соединениям стероид-3-фосфорной кислоты для использования в качестве ингибиторов тестостерон 5a-редуктазы. Эти патенты содержат также в своих описаниях многочисленные родственные соединения, которые определены как ингибиторы 5a-редуктазы предшествующего уровня техники. См., например, табл. 1 патента США 5026882 и обсуждение уровня техники в этом патенте. Публикация ЕР № 435321 относится к производным А-нестероидной-3-карбоновой кислоты, которая, как сообщается, проявляет свойство ингибировать 5a-редуктазы. В международной публикации WO № 91/13060 и в публикации ЕР № 458207 Okada et al. рассматривают получение производных индола в качестве ингибиторов тестостерон 5a-редуктазы. Salle, et. al. "17b-acylurea Derivatives of 4-Azasteroids as Inhibitors of Testosterone 5a-Reductase" касается исследований, рассматривающих действие на 5a-редуктазу новой серии 17b-ацилуреазамещенных производных. Патент США 5053403 описывает применение некоторых агентов, подавляющих андрогенные рецепторы вместе с определенным ингибитором фермента 5a-редуктазы при лечении или предупреждении гипертрофии сальной железы, избыточной волосатости и плешивости у м ужчин. Невозможно представить, чтобы известные ранее ингибиторы 5a-редуктазы полностью ингибировали обе формы 5a-редуктазы без проявления или стимуляции нежелательной андрогенной или другой гормональной активности. При лечении определенных заболеваний, развитие которых стимулируется активацией андрогенных рецепторов, желательно уменьшить активацию этих рецепторов. Это может осуществляться путем уменьшения доступности "агонистов", например, природных андрогенов и других соединений, способных активировать рецепторы, или путем уменьшения доступности рецепторов и/или путем блокирования доступа к рецептору соединений, которые могли бы, в противном случае, активировать их. Последнее может быть достигнуто введением "антагониста", соединения со сродством к рецептору, которое связывает рецептор и блокирует доступ агониста. В случае андрогенных рецепторов андрогенный антагонист ("антиандроген") может желательно связывать андрогенный рецептор без активации рецептора. Его физическое присутствие блокирует доступ к рецептору природных или других андрогенов, которые, достигнув рецептора, могут связывать и активировать рецептор. В соответствии с настоящим изобретением, новые ингибиторы тестостерон 5a-редуктазы применяются при лечении андроген-чувствительных заболеваний, течение которых может быть замедлено ингибированием активации андрогенных рецепторов. Соединения по изобретению ингибируют активность 5a-редуктазы, которая катализирует синтез сильного андрогена - дигидротестостерона. Поэтому желательно уменьшить способность дигидротестостерона активировать андрогенные рецепторы. Важно достигнуть этого желательного уменьшения активности 5a-редуктазы без стимулирования нежелательных эффектов при основной цели - подавлении активации андрогенных рецепторов. Следова-тельно, даже если соединение эффективно ингибирует активность 5a-редуктазы, его терапевтический эффект является пониженным, если самому ингибитору присущи андрогенные свойства, как то, что ингибитор активирует то самые рецепторы, активацию которых необходимо уменьшить. Кроме того, ингибитор должен быть устойчив к преобразованию in vivo в андрогенное соединение. Напротив, однако, ингибитор 5a-редуктазы, обладающий антиандрогенными свойствами, проявляет скорее два, чем одно, желательных эффекта при лечении андроген-опосредованных заболеваний. Во-первых, он ингибирует ферментное преобразование тоотостерона в дигидротестостерон, уменьшая таким образом количество дигидротестостерона, способного активировать андрогенные рецепторы. Во-вторых, он антагонистически блокирует андрогенные рецепторы, защищая их от активации любыми доступными андрогенами, включая какой-либо дигидротестосторон, который может быть синтезирован вопреки ингибитору. Таким образом, ингибиторы активности 5aредуктазы предпочтительно проявляют сочетание желаемых качеств, включая (А) способность осуществлять ингибирование активности 5a-редуктазы (предпочтительно обоих типов 5a-редуктазы); и (В) существенно сниженная андрогенная активность (и устойчивость к преобразованию in vitro в андроген). Желательно также, чтобы ингибиторы обладали антиандрогенными свойствами. С целью избавления от нежелательных побочных эффектов, предпочтительные ингибиторы 5aредуктазы, кроме того, обладают существенно сниженными глюкокортикоидными характеристиками. Таким образом, объектом настоящего изобретения являются улучшенные ингибиторы 5aредуктазы, которые более эффективно ингибиру 5 35589 ют активность 5a-редуктазы и, предпочтительно, ингибирует активность обоих известных типов человеческой 5a-редуктазы. Другим объектом настоящего изобретения являются фармацевтические композиции, содержащие ингибиторы 5a-редуктазы, обладающие небольшой присущей им андрогенной активностью и незначительной склонностью к преобразованию in vitro в другое соединение, обладающие присущей ему андрогенной активностью. Следующим объектом настоящего изобретения является способ лечения андроген-опосредованных заболеваний, развитию которых способствует активация андрогенных рецепторов. Такие заболевания включают, например, рак простаты, гиперплазию простаты и половые нарушения, и могут быть подвергнуты лечению представленными здесь способами, понижающими активность 5a-редуктазы. Cпособы лечения заключаются в применении ингибиторов 5a-редуктазы по данному изобретению либо самостоятельно, либо в сочетании с другим активным ингредиентом, например, антиандрогеном, в качестве части комбинированной терапии. Вышеуказанные и дальнейшие цели могут осуществляться с помощью фармацевтических композиций, содержащих ингибиторы5a-редуктазы, предлагаемые здесь, вместе с фармацевтически приемлемыми носителями и разбавителями. Указанные фармацевтические композиции назначают пациенту, страдающему от те х заболеваний, которые были обсуждены выше, развитию которых способствует активация андрогенных рецепторов. При одном воплощении предлагается фармацевтическая композиция, отличающаяся тем, что она содержит фармацевтически приемлемый разбавитель или носитель ингибитор тестостерон 5aредуктазы, имеющего молекулярную формулу тивное количество ингибитора тестостерон 5aредуктазы, имеющего молекулярную формулу где пунктирная линия означает необязательно пи связь; где R4 обозначает водород или метил; где R6 обозначает водород или С1-C3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6 эпоксиалкил и их ненасыщенные аналоги; и где R17b обозначает водород, гидрокси или заместитель, превращающийся in vivo в гидрокси. При следующем осуществлении изобретения фармацевтическая композиция отличается тем, что она содержит фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора тестостерон 5aредкутазы, имеющего молекулярную формулу где пунктирная линия означает необязательно пи связь; где R4 обозначает водород или метил; где R6 обозначает водород или С1-C3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b выбран из группы, содержащей ацил, карбоксиамид, третичный амино или третичный амидо. При следующем осуществлении изобретения фармацевтическая композиция отличается тем, что она содержит фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора тестостерон 5aредуктазы, имеющего молекулярную формулу где пунктирная линия означает необязательно пи связь; где R4 обозначает водород или метил; где R6 обозначает водород или С1-C3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b обозначает третичный амино или аминогруппу. При другом осуществлении изобретения фармацевтическая композиция отличается тем, что она содержит фармацевтически приемлемый разбавитель или носитель и терапевтически эффек 6 35589 4, 6 или 7 положениях, например, 4-метил и/или 6низший алкил и/или 7-низший алкил. При некоторых осуществлениях заместитель R17b является третичным амином, таким как -N(R19)(R20), где R19 обозначает низший алкил или галоалкил и R20 является низшим алкилом. При други х осуществлениях R17b является третичноамидным заместителем, например, ациламино заместителями, такими как -N(R25)C(О)R26, где R26 обозначает водород или низший алкил и R25 обозначает С1-С6 насыщенный или ненасыщенный углеводород, такой как циклопропил, циклогексил, бутил или изобутил. Как используется здесь, термины "третичный амин" или "третичный амидо" относятся к амино или амидозаместителям, где азот амино или амидо не является водородозамещенным. Предпочтительные заместители для азота включают, но не ограничиваются ими, ацил или низший алкил. Для предотвращения стерического взаимодействия между R17a и R17b предпочтительно, чтобы по крайней мере один из двух заместителей был водородом, гидрокси или заместителем, который преобразуется в гидрокси in vivo (например, бензоилокси, ацетокси). Углеводородные заместители могут быть насыщенными или ненасыщенными. Ненасыщенные заместители, как полагают, особенно полезны при положениях R7 и R17a. При некоторых осуществлениях R7 обозначает заместитель С 2-С6-алкил, алкенил или алкинил. При некоторых осуществлениях, особенно когда R17b обозначаeт водород, гидроксил (или его эфирные производные), R17a обозначает С 1-С6алкил, С1-C6-гидроксиалкил, С1-С6-галоалкил, С2С6-карбонилалкил, С3-С6-эпоксиалкил или их ненасыщенные аналоги. Предпочтительные незамещенные аналоги включают, например, гало или гидрокси алкинил пли алкенил заместители, особенно, когда гало или гидрокси группа находится па конце заместителя, то есть наиболее удалена от аза-стероидного D-кольца. Предпочтительна также ненасыщенность 17a заместителя при 1, 2 или 3 положении. За исключением указанных других случаев, заместители могут иметь a или b стереохимию. Необязательные пи-связи, обозначенные пунктирными линиями в молекулярной структуре, не зависят от каких-либо други х необязательных связей, имеющихся в этой структуре, присутствие одной не зависит от присутствия или отсутствия другой, если валентность не требует взаимозависимости. Соединения, рассмотренные здесь, могут входить в состав в виде их солей. Атомы азастероидных ядер, для которых не показан заместитель, могут быть необязательно далее замещены (как позволяет валентность) до такой степени, пока заместитель не оказывает неблагоприятного действия па способность соединения ингибировать активность 5a-редуктазы и не делает соединение значительно более андрогенным. Как используется здесь, термин "низший", когда описывается химический радикал, означает радикал, имеющий 3 или менее атомов. Например, "низший алкил" означает С1-С8-алкил. Любой радикал из более, чем двух атомов, может быть где R4 обозначает водород или метил; где R6 обозначает водород или С1-C3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С2-С6-алкил, С2-С6-гидроксиалкил, С2-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где R17a обозначает водород или низший алкил; и где R17b выбран из группы, содержащей ацил, карбоксиамид, третичный амино или третичный амидо. При следующем осуществлении изобретения фармацевтическая композиции отличается тем, что для ингибирования активности тестостерон 5a-редуктазы она содержит фармацевтически приемлемый разбавитель или носитель и терапевтически эффективное количество ингибитора 5a-редуктазы формулы где R4 обозначает водород или метил; где R6 обозначает водород или С1-C3 насыщенный или ненасыщенный углеводород; где R7 выбран из группы, содержащей водород, С1-С6-алкил, С1-С6-гидроксиалкил, С1-С6-галоалкил, С2-С6-карбонилалкил, С3-С6-циклопропилалкил, С3-С6-эпоксиалкил и их ненасыщенные аналоги; где Ra выбран из группы, содержащей низший алкил, циклоалкил и радикал, который вместе с R b и атомом азота, изображенном при R17b , является 57-членным гетероциклическим кольцом, имеющим один гетероароматический атом азота; и где Rb выбран из группы, содержащей радикал, который вместе с Ra и атомом азота, изображенном при R17b , является 5-7-членным гетероциклическим кольцом, имеющим один гетероароматический атом азота; -CORC, -CONRCRD, -CSNRCRD, -SO2RC, -PO 3RCRD (RC и RD являются водородом, низшим алкилом или низшим галоалкилом). Также могут быть использованы капсулы, содержащие ингибиторы 5a-редуктазы, рассмотренные здесь. Ингибиторы и композиции, содержащие их, используются в соответствии с изобретением для понижения активности 5a-редуктазы и лечения заболеваний, развитие которых вызвано активацией андрогенных рецепторов, например, как простаты, доброкачественная гиперплазия простаты, воспаление сальной железы, себорея, ненормальная волосатость, андрогенное облысение и тому подобное. При некоторых, но не при всех, осуществлениях азастероидиые ядра имеют заместитель (то есть отличный от водорода), по меньшей мере, в 7 35589 прямо- или разветвленноцепочечным, если не оговорено особо. Как рассматривается более подробно далее, носители или разбавители включают твердые или жидкие. Новые фармацевтические композиции по изобретению могут применяться для лечения андроген-опосредованных заболеваний. При систематическое введении путем инъекции, например, при лечении рака простаты, доброкачественной гиперплазии простаты и других заболеваний, в основном не действующи х на кожу, используются обычные разбавители или носители, известные специалистам в качестве фармацевтически приемлемых для систематического использования, например, физиологический раствор, вода, водный спирт или масло. Когда ингибиторы по изобретению используются для лечения андрогенопосредованных заболеваний, таких как воспаление сальной железы, себорея, ненормальная волосатость, андрогенное облысение, ингибиторы предпочтительно назначаются вместе с обычно применяемым носителем или разбавителем, таким как смесь этанола и пропиленгликоля. При обычном использовании предпочтительно, чтобы разбавитель или носитель не промотировал трансдермального проникновения активных ингредиентов в кровяной поток или другие ткани, где они могут вызывать нежелательные системные эффекты. Когда композицию готовят не для немедленного применения, обычно включают известные специалистам консервирующие вещества (например, бензиловый спирт). Когда соединение назначают с носителем для кожного или наружного пути введения, носитель может быть любым известным в косметической или медицинской практике носителем, например, каким-либо гелем, кремом, лосьоном, мазью, жидким или нежидким носителем, эмульгатором, растворителем, жидким разбавителем или другим подобным растворителем, который не оказывает вредного воздействия на кожу или другие живые ткани животного. Примеры подходящих наружных носителей включают, но не ограничиваются ими, жидкие спирты, жидкие гликоли, жидкие полиалкиленгликоли, воду, жидкие амиды, жидкие эфиры, жидкий ланолин и производные ланолина и подобные материалы. Спирты включают моно- и полигидро спирты, включая этанол, глицерин, сорбитол, изопропанол, диэтиленгликоль, пропиленгликоль, этиленгликоль, гексиленгликоль, маннитол и метоксиэтанол. Типичные носители могут также включать эфиры, например, диэтиловый и дипропиловый эфир, метоксиполиоксиэтилены, карбовоски, полиэтиленглицерины, полиоксиэтилены и сорбитолы. Обычно носители для наружного применения включают как воду, так и спирт с целью достичь максимальней гидрофильной и липофильной растворимости. Типичный носитель будет содержать 75% этанола или изопропанола и 15% воды. Носитель для наружного применения может также включать различные ингредиенты, используемые в мазях и лосьонах и хорошо известные в косметической и медицинской областях. Например, могут быть представлены ароматизаторы, антиоксиданты, отдушки, желатинирующие агенты, загущающие агенты, такие как карбоксиметил целлюлоза, поверхностно-активные вещества, стабилизаторы, смягчители, окрашивающие агенты и другие подобные агенты. Как проиллюстрировано в представленных далее примерах, композиции по настоящему изобретению могут содержать хорошо известные и используемые в настоящее время ингредиенты для образования кремов, лосьонов, гелей и мазей, которые дерматоголически приемлемы и нетоксичны. Композиция может применяться в виде геля, крема, мази, лосьона и тому подобное. Могут быть использованы сухие доставляющие системы, как описано в патентах США № 3742951, 3797494 или 4563343. Для облегчения трансдермального проникновения, когда желательны системные эффекты, также могут быть использованы растворители или средства, как это описано в патентах США № 5064654, 5071644 или 5071657. Соединение также может быть введено оральным путем. Соединение по настоящему изобретению может обычно входить в состав с обычным фермацевтическим наполнителем, например, высушенной распылительной сушкой лактозой и стератом магния, в виде таблеток или капсул для орального применения. Конечно, в случае орально вводимых форм могут быть добавлены улучшающие вкус вещества. Когда желательны капсулы для орального введения, любые фармацевтические капсулы могут быть заполнены ингибиторами 5a-редуктазы по изобретению, вместе или без дополнительных разбавителей и других добавок, обсуждаемых здесь. Активное вещество может быть помещено в таблетки или в сердцевины драже путей смешивания с твердым измельченным субстратом носителя, таким как цитрат натрия, карбонат кальция или фосфат дикальция, и связующими, такими как поливинилпирролидон, желатин или производные целлюлозы, возможно с добавлением также смазывающих веществ, таких как стеарат магния, натрий лаурил сульфат, "Карбовакс" или полиэтиленгликоль. В качестве дальнейших форм можно использовать закупоренные капсулы, например, из твердого желатина, а также закрытые мягкие желатиновые капсулы, содержащие умягчитель или пластификатор, например желатин. Закупоренные капсулы содержат активное вещество, предпочтительно в форме гранулята, например, в смеси с волокнами, такими как лактоза, сахароза, маннитол, крахмалами, таким как картофельный крахмал или амилопектин, производными целлюлозы или высокодисперсной кремниевой кислотой. В мягких желатиновых капсулах активное вещество предпочтительно растворено или суспендировано в подходящи х жидкостях, таких как растительное масло или жидкие полиэтиленгликоли. Следующие неограничивающие примеры описывают получение типичных крема, лосьона, геля или мази, соответственно. Вдобавок к указанным растворителям, специалист может выбрать другие растворители для того, чтобы приспособиться к специфическим дерматологическим потребностям. 8 35589 Пример А Типичный лосьон содержит (по весу) 5% активного соединения, 15% пропиленгликоля и 75% этанола и воды 5%. Пример В Типичный гель содержит (по весу) 5% активного соединения, 5% пропиленгликоля, 0,2% Carbomer 940 (имеющийся в распоряжении в виде Carbomer 940 R от B.F.Goodrich), 40% воды, 0,2% триэтаноламина, 2% PPG-12-Buteh-16 (имеющийся в распоряжении в виде Ucon R fluid 50 от Union Carbide), 1% гидроксипропила и 46,8% этанола (95% этанола - 5% воды). Пример С Типичная мазь содержит (по весу) 5% активного соединения, 13% пропиленгликоля, 79% петролатума, 2,9% глицерилмоностеарата и 0,1% полипарабена. Пример D Типичный крем содержит (по весу) 5% активного соединения, 0,2% пропиленпарабена, 5% ланолинового масла, 7,5% кунжутного масла, 5% цетилового спирта, 2% глицерилмоностерата, 1% триэтаноламина 5% пропиленгликоля, 0,1% Carbomer 940 R и 69,2% воды. Ингибиторы 5a-редуктазы по изобретению предпочтительно входят в состав фармацевтических композиций при обычных концентрациях для ингибиторов 5a-редуктазы. Лечащий врач может выбирать, изменять концентрацию и/или дозировку для соответствия дозы конкретной ответной реакции у каждого пациента. Когда ингибиторы активности 5a-редуктазы назначаются в соответствии с настоящим изобретением, они предпочтительно назначаются орально или парентерально. Дозировки предпочтительно колеблются от около 1 мг до около 1000 мг активного составляющего, то есть ингибитора(ов) 5a-редуктазы, в день на 50 кг веса тела, более предпочтительно от около 2,5 мг до около 500 мг в день на 50 кг веса тела. Концентрация активного составляющего варьируется известным путем в зависимости от способа введения фармацевтической композиции. Композиция, подходящая для орального введения, может предпочтительно включать по меньшей мере один ингибитор активности 5a-редуктазы, при общей концентрации всех таких ингибиторов в указанной фармацевтической композиции от 1% до 95% от веса композиции, и предпочтительно от около 5% до около 20%. Фармацевтически приемлемый разбавитель является предпочтительно крахмалом или лактозой (вместе или без татразина). В случае парентерального введения ингибитор предпочтительно добавляют при концентрации между около 2,0 мг/мл и около 50 мг/кг (предпочтительно от около 5,0 мг/мл до около 20 мг/мл) к носителю, предпочтительно выбранному из группы, содержащей физиологический раствор, воду, водный этанол и масло. При некоторых альтернативных осуществлениях фармацевтическая композиция по изобретению может входить в состав постоянного высвобождения согласно известной технике. Составы постоянного высвобождения предпочтительно получают известным способом, подходящим или для орального, внутримышечного или подкожного введения. В случае фармацевтической композиции для наружного применения ингибитор(ы) 5a-редуктазы предпочтительно входят в состав с носителем, выбранным из группы, содержащей пропиленгликоль, этанол, изопропанол и воду, в концентрации, изменяющейся от 0,5% до 10% от общего веса фармацевтической композиции. Композиция для наружного применения может быть приготовлена, например, в виде мази, геля, крема или лосьона, для применения на пораженных поверхностях кожи при необходимости дважды в день. При некоторых осуществлениях изобретения ингибиторы 5a-редуктазы по изобретению используются в сочетании с другим активным ингредиентом в качестве части комбинационной терапии. Например, новые ингибиторы могут использоваться вместе с особым антиандрогеном, который может входить в состав той же фармацевтической композиции, что и ингибитор 5a-редуктазы, или который может быть введен отдельно. Активное соединение может обладать как антиандрогенной, так и ингибирующей 5a-редуктазу активностью и может быть дополнено другим соединением для усиления каждой из обеих эти х активностей (например, другой антиандроген или другой ингибитор 5a-редуктазы). Комбинационная терапия может также включать обработку одним или более соединениями, которые ингибируют продуцирование тестостерона или его предшественника. Когда антиандроген используют в комбинационной терапии дополнительно к ингибиторам 5aредуктазы по изобретению, то антиандрогеном может быть, например: Флутамид (системный) ЕМ 248 (наружный) Антиандроген входит в состав при обычных концентрациях и вводится при общепринятых дозировках, например, при тех же концентрациях и дозах, что определены выше для ингибитора 5aредктазы. Антиандроген флутамид является коммерчески доступньм от Schering Corp. (Нью-Джерси). Антиандроген ЕМ-248 может быть синтезирован следующим образом: 9 35589 Соединение b К раствору тестостерона 1 (288,43 г, 1,0 мoль) в ледяной уксусной кислоте (3,5 л) добавляют этандитиол (85 мл, 1,01 моль) и трифторид бора (800 мл) при 10°C. Смесь перемешивают при этой температуре в течение 1 часа и выливают на лед (2 кг). Из этой водной фазы отделяют белый твердый продукт и собирают его фильтрацией, промывают водой (2´2 л) и сушат на воздухе. Кристаллизация из метанола дает чистое соединение "b". Выход: 328,26 г (90%). Соединение с Раствор b (182,3 г, 0,5 моль) в сухом дихлорметане (1,5 л) добавляют по каплям к раствору хлорхромата пиридиния (150 г, 0,7 моль), молекулярным ситам 3А (200 г) и ацетату натрия (25 г) при комнатной температуре. После завершения прибавления смесь перемешивают в течение 16 часов и затем разбавляют диэтиловым эфиром (2 л) и фильтруют сквозь силикагель в воронке со стеклофильтром. Фильтрат концентрируют в вакууме и полученный твердый продукт кристаллизуют из метанола с получением чистого соединения "с". Выход: 158,7 г (87%). Соединение d 2-(3-Бутинилокси)тетрагидро-2Н-пиран (112,5 г, 0,729 моль) добавляют по каплям к раствору метиллития (500 мл MeLi 1,4М в эфире, 0,70 моль) в 1 л безводного ТГФ при -30°С в атмосфере аргона в 5-литровой круглодонной колбе. После завершения прибавления охлаждающую баню убирают и раствор оставляют стоять при комнатной температуре в течение 4 часов. Раствор опять охлаждают до -30°С и добавляют по каплям раствор "с" (75 г, 0,207 моль) в 2,5 л безводного ТГФ. После прибавления охлаждающую баню убирают и смесь оставляют стоять при комнатной температуре в течение 16 часов. К этой смеси добавляют 100 мл раствора соли и раствор разбавляют этилацетатом, промывают раствором соли и сушат над безводным MgSO4. Растворитель упаривают, и через короткий промежуток времени кристаллизуется твердый осадок. Для завершения высаживания добавляют гексан. Твердый продукт затем фильтруют и промывают гексаном. Соединение используют в следующей стадии без дальнейшей очистки. Выход: 95,8 г (90%). Соединение е Смесь соединения d (30 г, 0,058 моль) и метидиодида (65 мл; 1 моль) в 96%-ном метаноле (750 мл) нагревают с обратный холодильником в течение 16 часов. Растворитель удаляют в вакууме и сырую смесь разбавляют етилацетатом (1 л). Органическую фазу промывают 3%-ным NaOH (3´100 мл) и сушат над безводным MgSO4. После упаривания растворителя твердый осадок промывают диэтиловым эфиром, фильтруют на воронке со стеклофильтром и промывают опять диэтиловыи эфиром. Это соединение может быть использовано в последней стадии без дальнейшей очистки. Выход 65%. 17a-(Хлорбутинил)-17b-гидрокси-4-андростен3-он (f, EM 248) Смесь соединения d (15 г, 0,04 моль), трифенилфосфина (21 г, 0,08 моль) и тетрахлорида углерода (9,3, 0,06 моль) нагревают с обратным холодильником в 1 л безводного дихлорметана в течение 10 часов. После упаривания растворите 10 35589 ля сырую смесь абсорбируют на силикагеле и хроматографируют на силикагеле (флэш) диэтиловыи эфиром:гексаном (70:30). Соединение затем очищают кристаллизацией из диэтилового эфира. Выход 85%. Комбинационная терапия, включающая ингибитор 5a-редуктазы и антиандроген, оказывает успешный эффект ингибирования активации андрогенных рецепторов путем двух различных механизмов без существенного понижения уровней тестостерона, которое может вызывать нежелательные побочные эффекты у некоторых пациентов. В соответствующих случаях, то есть, когда рак простаты или другие андроген-опосредованные заболевания не реагируют в достаточной степени на лечение, может быть применена параллельная терапия, предназначенная для понижения уровней тестостерона (например, хирургическая или химическая кастрация, например, введением агонистов LHRH или антагонистов, известных специалистам). Ингибиторы тестостерон 5a-редуктазы формулы включают, но не ограничиваются ими, представлены в табл. 1. Ингибиторы тестостерон 5a-редуктазы формулы включает, но не ограничиваются ими, представлены в табл. 2. Ингибиторы тестостерон 5a-редуктазы формулы включают, но не ограничиваются ими, указанные в табл. 1 и 2, а также соединения, представленные в табл. 3. Таблица 1 Ингибитор R1 R3 ЕМ 316 ЕМ 336 ЕМ 337 ЕМ 347 ЕМ 401 ЕМ 402 ЕМ 405 ЕМ 407 ЕМ 422 ЕМ 423 ЕМ 424 ЕМ 436 СH3 Цикло C3H5 Циклo С6Н11 C4H9 С5Н11 C6H13 Изоамил Этилпропил Изо C4H9 С3Н7 C4H9 CH2C6H5 Н Н Н Н Н Н И Н Н Н СH3 Н Ингибитор 5a-редуктазы Ki (нМ) 29 11,2 11,9 2,6 1,8 7,2 2,2 10,6 7,3 5,1 11,8 5,6 Таблица 2 Ингибитор R1 R3 ЕМ 373 ЕМ 374 EМ 390 EM 392 EM 394 EM 396 ЕМ 397 ЕМ 406 Циклo С3Н5 Циклo С3Н5 Циклo С3Н5 Циклo С3Н5 Циклo С3Н5 Циклo С3Н5 Циклo С3Н5 СН3 СН3 C6H5 C3H7 C2H5 C4H9 Изо C3H7 Циклo С6Н11 C6H5 11 Ингибитор 5a-редуктазы Ki (нМ) 0,5 2,3 7,1 13,5 3,3 14,0 3,2 8,2 35589 Таблица 3 Соединение ЕМ 316 ЕМ 336 ЕМ 337 ЕМ 347 ЕМ 401 ЕМ 402 ЕМ 405 ЕМ 407 ЕМ 422 ЕM 423 ЕМ 424 ЕМ 436 ЕМ 373 ЕМ 374 ЕМ 390 ЕМ 392 ЕМ 394 EM 396 ЕМ 397 ЕМ 408 ЕМ 409 ЕМ 322 EM 441 ЕМ 378 ЕМ 352 ЕМ 450 ЕМ 314 ЕM 420 ЕМ 346 ЕМ 448 ЕМ 465 EM 358 ЕМ 471 ЕM 321 ЕМ 320 EM 501 EM 502 EM 503 EM 548 ЕМ 561 ЕМ 572 ЕМ 591 EM 621 ЕМ 435 Стероидное ядро Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нeт Нет Нет Нет Нет Нет Нет Нет Нет Нет DІ DІ DI Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет Нет R4 R6 R7 R17a R17b CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 H CH3 Н CH3 CH3 CH3 Н Н Н Н Н CH3 CH3 Н CH3 CH3 CH3 CH3 Н CH3 CH3 CH3 H H H H H H H H H H H H H H H H H H H H H H H Н Н Н Н Н Н Н Н Н Н Н Н H H Н CH3 Н Н Н Н Н H H H H H H H H H H H H H H H H H H H H H H H H H Н Н Н Н H Н H H Н Н H Н Н H C4H8OH Н Н Н Н H H H H H H H H H H H H H H H H H H H H H C3H5 C3H5 C3H7 C3H7 H H H H CºC(CH2)2 CºC(CH2)Br CºC(CH2)3Br CºC(CH2)3I CºC(CH2)2Br CºC(CH2)2I CºC(CH2)2Cl CºC(CH2)2Cl CºC(CH2)2Cl H H H Н Н Н N(CH3)CHO N(C3H5)CHO N(C6H11)CHO N(C4Н9)СНО N(C5H11)CHO N(C6H13)CHO N(изоамил)СНО N(этилпропил)СНО N(изо-С 4Н9)СНО N(C3Н7)CHO N(C4H9)COCH3 N(C2С6H5)CHO N(цикло-С 3Н5)СОNНСН3 N(цикло-С 3Н5)СОNНС6Н5 N(цикло-С 3Н5)СОNНС3Н7 N(цикло-С 3Н5)СОNНС2Н5 N(цикло-С 3Н5)СОNНС4Н9 N(цикло-С 3Н5)СОNН(изо-С3Н7) N(цикло-С 3Н5)СОNН(цикло-С 3Н7) N(CH3)CONHC6Н5 N(CH3)CONHCН3 OH OH OH OH N(C4Н9)СOCH2Cl N(CH3)CHO N(цикло-С 3Н5)СОNНС2Н5 N(CH3)CHO OH OH OH OH OH OH OH OCOC6H5 OH N(C4Н9)СHO N(C4Н9)СHO N(C4Н9)СOCH3 N(C4Н9)SO2CH3 N(C4Н9)PO3(CH3)2 N(трет.-C6H13)CHO За исключением указанных противных случаев, ингибитор 5a-редуктазы определяют следующим методом. Используют планшеты с 24 лунками в каждом. В каждое углубление помещают 100000 клеток из клеточной линии DU 145 карциномы метастазированнон простаты человека (АТСС# НТВ 81) в среде МЕМ, содержащей 2% сыворотки теленка, обработанной декстрановым углем (dextran charcoal-treated) 1% пенициллина, 1% стрептомицина и 1% нежизненноважные аминокислоты. Через 24 часа среду удаляют и вновь помещают в 2,5 мл среды МЕМ, содержащей 2% сыворотки теленка, обработанной декстрановым углем (dextran charcoal-treated); 10 мМ тритированного 4-андростен-3,20-диона и 1% этанола. Каждое углубление имеет различную концентрацию испытуемого ингибитора 5a-редук-тазы. Клетки ингибируют в течение 24 часов при 37°С в атмосфере 5% СО2, насыщенной влагой. Внеклеточную среду затем удаляют, центрифуги-руют при 1000 RPM в течение 10 минут и декан-тируют в пробирки для исследования. К этим исследуемым пробиркам добавляют 100 мл этанола, содержащего 25 мг андростандиона, 25 мг 4 12 35589 андростаендиона, 25 мг дигидротестостерона и 25 мг тестостерона. Затем экстрагируют стероиды из смеси двумя экстракциями из 2 мл диэтилового эфира. Разделение фаз достигается вымораживанием водной фазы. Органическую фазу затем упаривают, полученный таким образом стероидный остаток растворяют в нескольких каплях метиленхлорида и наносят пятно на пластинку для ТСХ (Whatman WH 4420222). После проявления дважды смесью бензол-ацетоном (9:1) пятна проявляют с помощью УФ и газообразного йода, вырезают, помещают в отдельные пробирки для каждого стероида и экстрагируют в течение 15 минут с помощью 1 мл этанола. После добавления 10 мл сцинтиляционного коктепля (NEN 989) пробирки встряхивают и обсчитывают. Активность 5a-редуктазы является суммой преобразования 4-андростендиона в андростандион и преобразования тестостерона в дигидротестостерон. Определяют превращение третированного 4-андростерон-3,20-диона в другие стероиды в присутствии различных концентраций ингибитора и константу концентрации радиоактивного 4-андростендиона и затем используют величину IC50 (то есть концентрацию ингибитора, требуемую для 50% ингибирования активности 5aредуктазы) для расчета значения Ki ингибирования каждого соединения согласно Cheng и Prusoff (см.: Biochem. Pharmacol. 22, 3099-3108, 1973). Представленные ниже примеры не являются ограничивающими примерами способов синтеза ингибиторов 5a-редуктазы для использования по настоящему изобретению. Специалист может легко модифицировать эти синтезы известными методами для получения других ингибиторов 5aредуктазы по изобретению. Примеры синтезов предпочтительных ингибиторов активности стероид 5a-редуктазы Примеры 1 Получение 17b-(N-н-бутил-N-формамидо)-4метил-4-аза-5a-андростан-3-она (11, R= С4H9, 1 EM 347) Синтез представлен на схеме 1. Получение 17b-гидрокси-5-оксо-А-нор-3,5-секоандростан-3-овой кислоты (1). К перемешиваемой смеси тестостерон ацетата (Steraloids Inc. Wilton NH USA) (200 г, 0,605 моль) в третбутиловом спирте (2 л) добавляют раствор карбоната натрия (96,3 г, 0,908 моль) в 460 мл воды. Смесь подвергают кипячению с обратным холодильником и постепенно (1 час) добавляют раствор периодата натрия (893,8 г, 4,176 моль) и перманганат калия (70,8 г, 0,448 моль) в теплой воде (75°С) при поддержании кипения раствора. Реакцию охлаждают до 30°С и после 15 минут твердые продукты удаляют фильтрацией. Твердый осадок промывают 800 мл воды и объединенные фильтраты концентрируют при понижения давлении для удаления большей части третбутилового спирта (конечный объем 1,0 л). Водный осадок охлаждают и подкисляют до рН 3,0 концентрированным раствором соляной кислоты. Водный раствор экстрагируют метиленхлоридом (4´800 мл) и объединенную органическую фазу промывают водой, сушат и концентрируют досуха. Полученный таким образом твердый продукт под вергают ацетатному гидролизу путем кипячения с обратным холодильником с NaOH (34,3 г, 0,857 моль) в метаноле (2,0 л) в течение 12 час. Реакционную смесь концентрируют до 400 мл, разбавляют водой (600 мл) и подкисляют до рН 3. Твердый продукт фильтруют, промывают водой и сушат. Фильтрат экстрагируют метиленхлоридом (3´1,0 л) и объединенные органические фазы концентрируют до сиропа. И осадок, и сироп обрабатывают, кипящим EtOAc и охлаждают при 0°С в течение ночи с получением 125 г (выход 67%) бесцветных кристаллов; т. пл. 205…207°С. Получение 17b-гидрокси-4-метил-4-аза-андрост-3-она (3) В трубке Шленка (Schlenk ) в смесь секо кислоты 1 (8,0 г, 25,974 ммоль) в этиленгликоле (80 мл) при комнатной температуре барботируют MeNН2 до насыщения. Прозрачный желтоватый раствор нагревают постепенно (3°С/мин) до 180°С и выдергивают при этой температуре в течение 1 час. Реакционную смесь охлаждают до 10°С и при перемешивании добавляют воду (80 мл). Твердый продукт фильтруют, промывают водой (20 мл) и сушат с получением 6,1 г 3 (81%); т. пл. 181-183°С. Получение 17b-гидрокси-4-метил-4-аза-5aандростан-3-она (5) Раствор соединения 3 (6 г, 20,7 ммоль) в уксусной кислоте (99,9%, 130 мл) гидрируют в присутствии оксида платины (600 мг) при 45 рsі (фунт на квадратный дюйм), начиная от комнатной температуры и нагревая до 60°С в течение свыше 12 час. Реакционную смесь охлаждают и фильтруют. Катализатор промывают уксусной кислотой (30 мл) и объединенные фильтраты концентрируют до твердого продукта (5,5 г, 91%); т. пл. 178…180°С. 4-Метил-4-аза-5aандростан-3,17-дион (7) Следующий метод является иллюстративным. К перемешиваемому раствору соединения 5 (7,3 г, 25 ммоль) в метиленхлориде (260 мл) добавляют пиридиний хлорхромат (8,1 г, 37 ммоль) и смесь перемешивают при комнатной температуре в течение 3 часов. Содержимое пропускают через Florisil (30-60 меш.) для удаления осадка и фильтраты промывают водой (2´200 мл) и сушат. Полученный остаток очищают колоночный флэш хроматографией с получением диона 7 (4,4 г, 61%); т. пл. 126…128°С. Получение 17b-(N-бутил)амино-4-метил-4-аза5a-андростап-3-она (9, R1=С4Н9) Следующий метод является иллюстративным. К смеси диона 7 (0,150 г, 0,495 ммоль) и нбутиламина (0,040 г, 0,54 ммоль) в 1,2-дихлорэтане добавляют триацетоксиборгидрид натрия (0,156 г, 0,74 ммоль) и затем уксусную кислоту (0,03 г, 0,49 ммоль) в аргоне при комнатной температуре. Через 16 часов реакционную смесь разбавляют метиленхлоридом (15 мл) и промывают 1н водным гидроксидом натрия (2´20 мл), затем раствором соли (20 мл), сушат и растворитель удаляют с получением сырого продукта, который очищают колоночной флэш хроматографией с получением 17-N-бутил-производного (0,110 г, выход 61%). 13 35589 ром. Объединенный фильтрат концентрируют и очищают колоночной флэш хроматографией с получением продукта 11 (ЕМ 347) (0,075 г, 70%); 1 Н ЯМР (CDCl3); d 0,66 (с, 3Н), 0,74-1,42 (м, 11Н), 1,2-2,08 (м, 19Н), 2,37-2,48 (м, 2Н), 2,87 (с, 3Н), 3,04 (дд, 1Н, J=4,13 Гц), 3,2-3,4 (м, 3Н), 8,17 (с, 0,8Н), 8,24 (с, 0,2Н); 13 С Я МР (CDCl3): d 170,56; 164,54; 162,97; 68,59; 65,62; 51,99; 51,71; 44,11; 36,85; 36,40; 34,12; 32,88; 30,64; 29,68; 29,04; 28,96; 25,20; 24,37; 22,86; 20,55; 20,21; 13,77; 12,34; HRMS: рассчитано для C24H4N2O2, 388,3089; найдено 388,3147. Получение 17b-(N-н-бутил-N-форламидо)-4метил-4-аза-5a-андростан-3-она (11, R= С4Н9, 1 ЕМ 347) К раствору муравьиной кислоты (0,026 г, 0,556 ммоль) в хлороформе (1,5 мл) добавляют по каплям дициклокарбодиимид (ДЦК) (0,114 г, 0,56 ммоль) в хлороформе (1,5мл) при 0°С. Через 5 мин к вышеупомянутому раствору добавляют соединение 9 (0,10 г, 0,28 ммоль) в пиридине (2 мл). Смесь затем перемешивают 1 час при комнатной температуре. Упаривание растворителя с последующим добавлением эфира дает дициклогексил-мочевину, которую удаляют посредством фильтрации, и твердый продукт промывают эфи Схема 1 Scheme 1 Пример 2 17b-(N-н-амил-N-формамидо)-4-метил-4-аза5a-андростан-3-он (11, R1=C5H11, ЕМ 401) Синтез представлен на схеме 1. Получение 17b-(N-н-амил)амино-4-метил-4аза-5a-андростан-3-она (9, R1=C5H11). К смеси ди она 7 (3,4 г, 22,6 ммоль) и н-пентиламина (1,07 г, 12,3 ммоль) в 1,2-дихлорэтане добавляют триацетоксиборгидрид натрия (3,5 г, 16,7 ммоль) и затем уксусн ую кислоту (0,68 г, 11,2 ммоль) в аргоне при комнатной температуре. Через 16 час реакционную смесь разбавляют метиленхлоридом (150 мл) и промывают 1н водным гидроксидом натрия 14 35589 13 C ЯМP (CDCl3): d 170,6, 165,4, 163,5, 69,9, 65,6, 64,4, 51,9, 51,8, 51,3, 45,7, 44,2, 37,9, 37,5, 36,4, 34,2, 29,7, 29,1, 29,0, 28,8, 25,3, 22,2, 20,7, 13,6, 12,3,9,9, 8,1, 6,4, 6,2, MCBP (HRMS): рассчитано для C23H36N2O 2, 372,2796; найдено 372,2820. ЕМ 337: 17b-(N-циклогексил-N-формамидо)-4метил-4-аза-5a-андростан-3-он (11, R= цикло1 C6H11) Продукт получают с вы ходом 52%, и анализ ЯМР спектроскопии показывает смесь (4:1) двух конформеров, т.пл. 144…146°С; 1 НЯМР (CDCl3): d 0,70 (с, 1,5Н), 0,77 (с, 1,5Н), 0,85 (с, 1,5Н), 0,87 (с, 1,5Н), 0,81-1,41 (м, 12Н), 1,441,83(м, 13Н), 1,90-2,04 (м, 2Н), 2,40 (дд, J=4,6, 9,3 Гц, 2Н), 2,90 (с, 3Н), 2,99 (дд, J=3,2, 12,4 Гц, 1Н), 3,16 (т, J=9,7, 9,9 Гц, 0,5Н), 3,70-3,82 (м, 0,511), 4,28 (т, J=9,6, 9,9 Гц, 0,5Н), 8,3 (с, 0,5Н), 8,38 (с, 0,5Н); 13 С ЯМР (CDCl3): d 170,7, 163,5, 163,1, 77,2, 66,3, 65,7, 61,9, 55,4, 54,4, 52,4, 52,1, 44,7, 43,1, 37,2, 36,8, 36,5, 34,2, 34,1, 33,7, 32,9, 30,9, 30,6, 29,8, 29,7, 29,3, 29,1, 29,0, 27,9, 26,9, 26,2, 26,0, 25,4, 25,3, 23,2, 22,9, 20,7, 20,5, 13,0, 12,6, 12,4; HRMS: рассчитано для C26H42N2O2, 414,3246; найдено 414,3270. ЕМ 402: 17b-(N-гексил-N-формамидо)-4-метил-4-аза-5a-андростан-3-он (11, R 1=C6H13) Продукт получают с выходом 70%. Анализ ЯМР показывает смесь двух конформеров, т.пл. 101…103°С; 1 Н ЯМР (CDСl3): d 0,68 (с, 3Н), 0,86 (с, 3Н), 0,771,09 (м, 6Н), 1,22-1,42 (м, 10Н), 1,43-1,57 (м, 2H), 1,60-1,82 (м, 5Н), 1,89-2,03 (м, 4Н), 2,38-2,43 (м, 2Н), 2,89 (с, 3Н), 2,97-3,03 (дд, 1Н, J=12,4, 3,2 Гц), 3,18-3,28 (м, 2,4Н), 4,12 (т, 0,2Н, J=10Гц), 8,14 (с, 0,8Н), 8,2 (c, 0,2Н); 13 С ЯМР (CDCl3): d 170,57, 164,49, 162,97, 68,55, 65,58, 61,99, 51,95, 51,66, 51,26, 46,72, 45,66, 44,32, 44,22, 37,24, 36,8, 36,37, 34,07, 32,83, 32,43, 31,32, 29,64, 29,19, 29,04, 28,95, 28,47, 26,64, 26,35, 25,15, 24,34, 23,23, 22,84, 22,49, 20,51, 13,92, 12,32; HRMS: рассчитано C26H44O2N2 416,3382; найдено: 416,3355. EM 405: 17b-(N-изоамил-N-формамидо)-4-метил-4-аза-5a-андростан-3-он (11, R 1=изо-C5H11) Продукт получают с выходом 66%. Анализ ЯМР показывает смесь (4:1) двух конформеров, т.пл. 87…89°С; 1 Н ЯМР (СDCІ3): d 0,67(с, 3Н), 0,77-1,06 (м, 12Н), 1,21-1,57 (м, 10Н), 1,71-1,80 (м, 4Н), 1,82-1,97 (м, 3H), 2,38-2,43 (м, 2Н), 2,89 (с, 3Н), 2,97-3,01 (дд, 1H, J=2,4, 3,2 Гц), 3,20-3,29 (м, 1,8Н), 4,16 (т, 0,2Н, J=10 Гц), 8,13 (с, 0,8Н), 8,2 (с, 0,2Н); 13 С ЯМР (CDCl3): d 170,57, 164,46, 162,91, 68,49, 65,58, 51,92, 51,63, 44,19, 42,72, 37,19, 36,80, 36,35, 34,07 32,81, 29,64, 29,19, 29,04, 28,93, 26,28, 25,92, 25,15, 24,27, 22,84, 22,43 20,51, 12,77, 12,32; HRMS: рассчитано для C25H4O2N2 , 402,3245; найдено 402,3230. EМ 407: 17b-(N-этилпропил-N-формамидо)-4метил-4-аза-5a-андростан-3-он (11, R 1=изо-C5H11) Продукт получают с вы ходом 50%, и анализ ЯМР спектроскопии показывает смесь (2,33:1) двух конформеров, т.пл. 111…113°С; 1 НЯМР (CDCl3): d 0,74-1,2 (м, 15Н), 1,24-1,84 (м, 17Н), 1,95-2,1 (м, 2H), 2,41-2,42 (м, 2Н), 2,91 (с, (2´200 мл), затем раствором соли (200 мл), сушат и растворитель удаляют с получением сырого продукта, который очищают колоночной флэш хроматографией с получением 17-N-амил-производного (2,5 г, вы ход 61%). Получение 17b-(N-н-амил-N-формамидо)-4метил-4-аза-5a-андростан-3-она (11, R1=C5H11, ЕМ 401) К раствору муравьиной кислоты (0,504 г, 13,36 ммоль) в хлороформе (37 мл) добавляют по каплям дициклокарбодиимид (ДЦК) (2,75 г, 13,36 ммоль) в хлороформе (37 мл) при 0°С. Через 5 мин к вышеупомянутому раствору добавляют соединение 9 (2,5 г, 6,68 ммоль) в пиридине (20 мл). Смесь затем перемешивают 1 час при комнатной температуре. Упаривание растворителя с последующим добавлением эфира дает дициклогексил-мочевину, которую удаляют посредством фильтрации и твердый продукт промывают эфиром. Объединенный фильтрат концентрируют и очищают колоночной флэш хроматографией с получением соединения II, R1= С5Н11 (ЕМ 401) (2,5 г, 93%). Анализ ЯМР спектроскопии дает смесь (4:1) двух конфориеров, т. пл. 149…151°С; 1 Н ЯМР (CDCl3): d 0,67 (с, 3Н), 0,86 (с, 3Н), 0,821,19 (м, 6Н), 1,21-1,42 (м, 11Н), 1,56-1,57 (м, 2Н), 1,69-1,91 (м, 4Н), 1,92-1,97 (м, 3Н), 2,38-2,43 (м, 2H), 2,89 (с, 3Н), 3,00 (дд, 1Н, J=3,2, 12,4 Гц), 3,213,28 (м, 3Н), 8,14 (с, 0,8Н), 8,2 (С, 0,2Н); 13 СЯМР (CDCI3): d 170,56, 164,8, 162,97, 68,54, 65,58, 61,98, 51,66, 51,24, 46,69, 44,28, 37,24, 36,8, 36,37, 34,07, 32,83, 32,12, 29,64, 29,13, 29,04, 28,8, 28,19, 25,15, 24,33 23,22, 22,84, 22,36, 20,51, 13,94, 12,73, 12,32. HBMS: рассчитано для C25H42O2N2 402,3245; найдено 402,3242. Пример 3 По способам, аналогичным описанным в примере 1, синтезируют следующие соединения EM 316: 17b-(N-метил-N-формамидо)-4-метил4-аза-5a-андростан-3-он (11, R1=CH3) Продукт получают с вы ходом 78%, и анализ ЯМР спектроскопии показывает смесь двух конформеров, т. пл. 194…196°С; 1 Н ЯМР (CDCl3): d 0,74 (с, 2,4Н), 0,75 (с, 0,6Н), 0,88 (С, 0,6Н), 0,89 (с, 2,4Н), 0,78-1,14 (м, 3Н), 1,26-1,47 (м, 6Н), 1,60-1,90 (м, 7Н), 2,01-2,07 (м, 2Н), 2,412,46 (м, 2Н), 2,90 (с, 3Н), 2,92 (с, 3Н), 3,02-3,07 (дд, 1Н, J=12,58, 3,2 Гц), 3,32 (т, 0,8Н, J=9,6 Гц), 4,21 (т, 0,2Н, J=10 Гц), 8,15 (с, 0,8Н), 8,18 (с, 0,2Н); 13 С ЯМР (СDСІ3): d 170,45, 164,20, 163,32, 68,95, 65,43, 61,36, 51,82, 51,37, 51,12, 45,50, 44,21, 37,10, 36,66, 36,26, 33,87, 33,58, 32,70, 29,59, 29,51, 28,92, 28,83, 25,04, 23,03, 22,84, 22,74, 21,49, 20,35, 13,20, 12,61, 12,21; HRMS: рассчитано для C21H34N2O 2, 346,2620; найдено 346, 2645. EМ 336: 17b-(N-циклопропил-N-формамидо)-4метил-4-аза-5a-андростан-3-он (11, R= цикло1 C3H5) Продукт получают с вы ходом 74%, и анализ ЯМР спектроскопии показывает смесь двух конформеров, т. пл. 163…165°С; 1 Н ЯМР (CDCl3): d 0,39-0,44 (м, 0,4Н), 0,61-0,85 (м, 10H), 0,86-1,17 (м, 2H), 1,18-1,41 (м, 7Н), 1,42-1,56 (м, 1H), 1,57-2,06 (м, 6Н), 2,35 (дд, J=4,5, 9,4 Гц, 2Н, 1Н), 3,24 (т, J=8,7, 8,9 Гц, 0,4Н), 4,0 (т, J=9,2, 9,5 Гц, 0,6Н), 8,27 (с, 0,4Н), 8,33 (с, 0,6Н), 15 35589 3Н), 2,99-3,1 (м, 1,7Н), 3,95 (т, 0,3Н, J=10 Гц), 8,24 Получение 17b-(N-метил-N-формамидо)-4-ме(с, 0,3Н), 8,48 (с, 0,7Н); тил-4-аза-5a-андростан-3-она (17, = СН3, R1 13 С ЯМР (CDCl3): d 170,60, 163,86, 163,46, 66,28, ЕМ 314) 65,74, 65,62, 63.81, 52,85, 52,02, 51,89, 51,77, Следующий метод является иллюстративным. 44,94, 43,17, 37,24, 36,39, 34,22, 32,89, 29,75, К смеси формамида II, R1=СН3 (ЕМ 316) (0,10 г, 29,66, 29,07, 29,01, 28,89, 28,56, 28,47, 26,19, 0,289 ммоль) добавляют в атмосфере азота 25,32, 25,22, 23,25, 23,05, 22,98, 20,78, 13,25, бис(триметилсилил)трифторацетамид (0,305 г, 13,07, 12,36, 11,79, 11,44, 10,62; HRMS: рассчита1,185 ммоль) и 2,3-дихлор-5,6-дициан-1,4-бензоно для С 25H42O2N 2, 402,3246; найдено 402,3265. хинон (0,066 г, 0,289 ммоль) в диоксане (4 мл). ЕМ 422: 17b-(N-изо-бутил-N-формамидо)-4После 4 ч при 25°C содержимое нагревают при метил-4-аза-5a-андростан-3-он (11, R 1=изо-C4H9) 110°С в течение 24 ч. Полученный темно-красный Продукт получают с вы ходом 90%, и анализ раствор выливают в перемешиваемую смесь меЯМР показывает смесь (4:1) двух конформеров, тиленхлорида (6 мл) и 1%-ного водного раствора т.пл. 52…54°С; бисульфита натрия (1,8 мл). Гетерогенную смесь 1 фильтруют. Темно-красный органический слой НЯМР (CDCl3): d 0,67 (с, 3Н), 0,85 (с, 3Н), 0,68промывают 2 мл 2н НСl, затем раствором соли, 1,15 (м, 9Н), 1,21-1,38 (м, 6Н), 1,5-1,79 (м, 6H), сушат и концентрируют. Сырую смесь очищают 1,81-1,99 (м, 3Н), 2,38-2,42 (м, 2Н), 2,88 (с, 3Н), колоночной хроматографией с получением 41 мг 2,94-3,02 (дд, 1Н, J=12,4, 3,3 Гц), 3,1-3,15 (дд, 0,2Н, J=13,2, 5,7 Гц), 3,23 (т, 0,8Н, J=0,8 Гц), 3,32продукта 17, R1=CH3 (ЕМ 314) (41%); 1 3,39 (дд, 0,8Н, J=13,2, 6,6 Гц), 4,05 (т, 0,2Н, J=10 Н ЯМР (CDCl3): d 0,72(с, 3Н (78%)), 0,74 (с, 3Н Гц), 8,15 (с, 0,2Н), 8,29 (с, 0,8Н); (22%)), 0,85-2,15 (м, 15Н), 0,89 (с, 3Н (22%)), 0,91 13 (с, 3H (78%)), 2,89 (с, 3Н), 2,93 (с, 3Н), 3,27-3,36 (м, С ЯМР (CDCl3): d 170,57, 164,66, 162,82, 69,57, 2Н), 5,82-5,85 (м, 3Н), 6,65 (д, 1Н, J=11 Гц), 8,1452,26, 51,89, 51,83, 51,23, 45,99, 44,25, 37,16, 8,24 (м, 1H); HRMS: рассчитано для С21Р32N2 O2, 36,34, 32,о1, 29,04, 28,92, 23,03, 27,12, 26,76, 344,2463; найдено 344,2426. 25,12, 24,94, 23,05, 22,81, 20,17, 19,93, 19,78, Пример 5 12,84, 12,33; HRMS рассчитано для C24H40N2O2 По способам, аналогичном описанным в примере 388,3089; найдено 388,3069. 4, синтезируют соединения 16 (то есть ЕМ 420) с ЕМ 423: 17b-(N-н-пропил-N-формамидо)-4-меиспользованием в качестве исходных продуктов тил-4-аза-5a-андростан-3-он (11, R 1=C3H7) формамида 10 или мочевин 12 и 13. Продукт получают с вы ходом 82%, и анализ Пример 6 ЯМР показывает смесь (4:1) двух конформеров, Получение 17b-N-(1N-циклопропил-2N-фенилт.пл. 127…129°С; 1 уреа)-4-метил-4-аза-5a-андростан-3-она (13, Н ЯМР (CDCl3): d 0,65 (с, 3Н), 0,83 (с, 3Н), 0,69R1=C3H5, R2=C6H5 , ЕМ 374) 1,13 (м, 6Н), 1,19-1,81 (м, 13H), 1,86-2,0 (м, 3Н), Получение представлено на схеме 1. 2,35-2,4 (м, 2Н), 2,86 (с, 3Н), 2,94-3,0 (дд, 1H, Получение 17b-N-(1N-циклопропил-2N-фенилJ=12,4, 3,2 Гц), 3,10-3,28 (м, 1,82Н), 4,1 (т, 0,18Н, J=10 Гц), 8,11 (с, 0,82Н), 8,17 (с, 0,18Н); уреа)-4-метил-4-аза-5a-андростан-3-она (13, 13 R1=C3H5, R2=C6H5 , ЕМ 374) С ЯМР (CDCl3): d 170,51, 164,43, 162,99, 68,51, Следующий метод является иллюстративным. 65,52, 51,89, 51,62, 48,30, 45,82, 44,17, 36,32, К раствору соединения 9 (R1= цикло-С3Н5)(220 мг, 34,03, 32,78, 29,58, 28,98, 28,89, 25,11, 24,31, 0,64 ммоль) в ТГФ (100 мл) добавляют N-метил22,78, 21,61, 20,47, 12,27, 11,24; HRMS; рассчитаморфолин (0,107 мл, 0,975 ммоль) и затем фенино для C23H38N2O 2, 374,2933; найдено 374,2903. лизоцианат (0,1 мл, 0,9 ммоль) при 0°C в атмоЕМ 436: 17b-(N-бензил-N-формамидо)-4-месфере аргона. Смесь перемешивают в течение тил-4-аза-5a-андростан-3-он (11, R 1=СН2C6H5) ночи при от 0°С до комнатной температуры. Продукт получают с выходом 80%. Анализ Смесь разбавляют этилацетатом и промывают ЯМР показывает смесь (4,88:1) двух конформедважды 2н НСl, суша т и растворитель удаляют с ров, т.пл. 89…91°С; ИК g см-1 (КВг): 1640, 1610; 1 получением сырого продукта, который очищают на Н ЯМР (CDCl3): d 0,74 (с, 3Н), 0,85 (с, 3Н), 2,37колонке с получением чистого продукта 13 (ЕM 2,42 (м, 2Н), 2,87 (с, 3Н), 2,95-3,0 (дд, 1Н, J=12,5, 374) (210 мг, 73%); 3,4 Гц), 3,28 (т, 0,8H, J=9,8 Гц), 4,28 (т, 0,2Н, J=9,7 1 Н ЯМР (CDCl3): d 0,74-1,11 (м, 6Н), 0,8 (с, 3Н), Гц), 4,4 (д, 0,8Нa, J=15,5 Гц), 4,5 (д, 0,4Н, J=3,8 0,86 (с, 3Н), 1,23-2,06 (м, 14Н), 2,34-2,65 (м, 4Н), Гц), 4,79 (д, 0,8Нb, J=15,5 Гц), 7,1-7,3 (м, 5Н), 8,28 2,9 (с, 3Н), 2,99 (дд, 1Н, J=4,13 Гц), 4,06 (т, 1H, (с, 0,2Н), 8,42 (с, 0,8Н); 13 J=9,5 Гц), 7,07-7,42 (м, 5Н); С ЯМР (CDCl3); d 170,38, 165,17, 162,93, 138,76, 13 С ЯМР (CDCl3): d 170,72, 157,19, 139,09, 128,81, 137,38, 128,55, 128,34, 127,27, 126,93, 125,93, 122,77, 119,49, 65,63, 52,04, 51,10, 45,57, 38,08, 68,01, 65,42, 62,67, 51,80, 51,63, 51,20, 50,36, 36,35, 34,22, 32,79, 29,70, 29,02, 27,79, 25,244, 47,28, 45,81, 44,11, 37,39, 37,06, 36,29, 34,04, 23,43, 23,05, 20,79, 13,73, 12,35, 12,01, 9,96. 32,75, 29,61, 29,49, 28,87, 25,04, 24,65, 23,29, Пример 7 22,72, 20,54, 12,95, 12,41, 12,23; HRMS; рассчитаПо способам, аналогичным описанным в прино для C27H38N2O 2, 422,2933; найдено 422,2924. мере 6, синтезируют следующие соединения Пример 4 ЕМ 373: 17b-N-(1N-циклопропил-2N-метилПолучение 17b-(N-метил-N-формамидо)-4-меуреа)-4-метил-4-аза-5a-андростан-3-он (13, тил-4-аза-5a-андростан-3-она (17) = цикло-C3H5, R2=CH3) R1 Получение представлено на схеме 2. Продукт получают с выходом 68%, 16 35589 1 13 Н ЯМР (CDCl3): d 0,71 (с, 3Н), 0,82 (с, 3H), 1,941,98 (дд, 1H, J=12,6, 3,4 Гц), 2,28-2,33 (м, 1Н), 2,282,33 (м, 1Н), 2,35-2,40 (дд, 2Н, J=9,5, 4,8 Гц), 2,52,53 (кв, 1Н, J=10,36 Гц), 2,76 (д, 3H, J=4,8 Гц), 2,87 (с, 3Н), 2,95-3,01 (дд, 1H, J=12,5, 3,4 Гц), 3,9 (т, 1Н, J=10 Гц), 5,29 (кв, 1H, J=5 Гц); С ЯМР (CDCl3): d 170,66, 160,86, 67,74, 65,68, 52,01, 51,05, 45,16, 37,j98, 36,31, 34,16, 32,75, 29,66, 26,96, 27,37, 25,21, 23,32, 22,94, 20,68, 13,61, 12,29, 11,43, 9,51; MS: me (% отн. инт.) 344 (М57). Схема 2 Scheme 2 25,19, 23,11, 20,50, 13,10, 12,30; HRMS: рассчитано для C27H39N3O 2, 437,2804; найдено 437,2823. Пример 8 Получение 17b-N-(1N-циклопропил-2N-метилуреа)-4-метил-4-аза-5a-андростан-3-она (15, ЕМ 379) Получение аналогично получению соединений 13 по примеру 6 (см. схему 1), но с использованием фенилизотионианата в качестве реагента на стадии превращения соединения 9 в соединение 15. Пример 9 Получение 17a-аллил-17b-гидрокси-4-метил4-аза-5a-андростан-2-она (21, R3=C3H5, ЕМ 322) Получение представлено в схеме 3. Получение 17a-аллил-17b-гидрокси-4-метил4-аза-5a-андростан-3-она (21, R3=C3H5, ЕМ 322) Следующий метод является иллюстративным. К раствору соединения 7 (см. схему 1) (0,1 г, 0,328 ммоль) в ТГФ (10 мл) добавляют аллилмагнийбромид (394 мл, 0,394 ммоль) при -78°C. После прибавления содержимое перемешивают 1 час и подвергают обычной обработке с выделением сырого продукта, который очищают колоночной хроматографией с получением чистого продукта ЕМ 322 (77 мг, 67%); ЕМ 392: 17b-N-(1N-циклопропил-2N-этилуреа)4-метил-4-аза-5a-андростан-3-он (13, R1= циклоC3H5, R2=C2H5). Продукт получают с выходом 78%, 1 Н ЯМР (CDCl3): d 0,70 (с, 3H), 0,81 (с, 3Н), 1,08 (т, 3Н, J=7 Гц), 1,34 (дд, 1Н, J=12,4, 3,2 Гц), 2,25-2,31 (м, 1Н), 2,36 (дд, 1Н, J=9,5, 4,8 Гц), 2,42-2,57 (кв, 1Н, J=10 Гц), 2,36 (с, 3Н), 2,95-3,19 (дд, 1Н, J=12,5, 3,4 Гц), 3,20-3,23 (м, 2Н), 3,9 (т, 1Н, J=10 Гц), 5,27 (т, 1H,J=5 Гц); 13 С ЯМР (CDCl3): d 170,60, 160,03, 67,50, 65,55, 51,95, 50,96, 45,31, 37,95, 36,26, 35,27, 34,10, 32,70, 29,61, 28,92, 27,18, 25,17, 23,26, 22.90, 20,64, 15,47, 13,5с, 12,26, 11,64, 9,57; HRMS; рассчитано для C25H41N3O 2, 415,319; найдено 415,318. ЕМ 408: 17b-N-(1N-метил-2N-фенилуреа)-4метил-4-аза-5a-андростан-3-он (13, R1=CH3, R2=C6H5). Продукт получают с выходом 87%; 1 Н ЯМР (CDCl3): d 0,73 (с, 3Н), 0,86 (с, 3Н), 2,4 (дд, 2H, J=9,5, 4,7 Гц), 2,90 (с, 3Н), 2,96 (с, 3H), 2,96-3,0 (дд, 1H, J=12,5, 3,4 Гц), 4,24 (т, 1Н, J=10 Гц), 6,53 (с, 1Н), 6,96 (т, 1H, J=7 Гц), 7,24 (т, 2Н, J=7 Гц), 7,36 (д, 2Н, J=7Гц); 13 С ЯМР (CDCl3); d 170,66, 156,37, 139,24, 128,69, 122,70, 119,79, 65,55, 63,96, 51,92, 51,17,- 44,91, 37,35, 33,92, 32,75, 31,58, 29,66, 29,03, 28,95, 17 35589 1 13 Н ЯМР (CDCl3): d 0,68-1,0 (м, 2Н), 0,34 (с, 6Н), 1,14-1,66 (м, 11Н), 1,77-2,06 (м, 5Н), 2,14-2,2 (м, 1H), 2,28-2,36 (м, 1Н), 2,42-2,48 (м, 2Н), 2,86 (с, 3Н), 2,94-2,99 (дд, 1H, J=4,13 Гц), 5,14 (дд, 1Н, J=17,2 Гц), 5,2 (дд, 1H, J=13,2 Гц), 5,91-6,06 (м, 1Н); C ЯМР (CDCl3): d 170,70, 134,85, 118,99, 82,13, 65,70, 51,91, 50,13, 46,33, 41,75, 36,45, 35,14, 34,78, 32,94, 31,63, 29,95, 29,03, 25,31, 23,55, 20,77, 14,55, 12,37; HRMS: рассчитано для C22H35NO 2, 345,2658; найдено: 345,2658. Схема 3 Scheme 3 Пример 10 Получение 17a-пропил-17b-гидрокси-4-метил4-аза-5a-андростан-3-она (21, R3= С3Н7, ЕМ 378). То же получение, что и получение соединений 21 по примеру 9, но с использованием пропилмагнийбромида вместо аллилмагнийбромида в качестве реагента. Пример 11 Получение 17a-пропил-17b-гидрокси-4-метил4-аза-5a-андростан-3-она (20, R3=С3Н5, ЕМ 441) То же, получение, что и получение соединений 21 по примеру 9, но с использованием соединения 6 в качестве исходного продукта. Пример 12 Синтез 17a-(4-бромбутинил)-17b-гидрокси-4метил-4-аза-5a-андростан-3-она (24, Х=2, Р=В r, EM 465 ) (схема 4). Получение представлено в схеме 1 и схеме 4. Получение 17b-гидрокси-4-аза-андрост-5-ен-3она (2). Сначала согласно схеме 1 в аппарате для повышенного давления пробулькивают NH3 до насыщения в смесь секо кислоты 1 (6,0 г, 18 ммоль) в этиленгликоле (60 мл) при комнатной температуре. Прозрачный желтоват тый раствор постепенно нагревают (3°С/мин) до 180°С и выдерживают при этой температуре 1 час. Реакционную смесь охлаждают до 10°С и добавляют воду (80 мл) при перемешивании. Твердый раствор фильтруют, промывают водой (20 мл) и сушат с получением 4,5 г вещества 2. Получение 4-аза-5a-андростан-3,17-диона (6) Раствор соединения 2 (160 г, 0,5 ммоль) в уксусной кислоте (500 мл) гидрируют при 60 рsi с использованием PtO2 (15 г) в качестве катализатора при 60°C в течение 60 мин. После охлаждения и фильтрации катализатор промывают уксусной кислотой и растворитель удаляют. Остаток, растворенный в метиленхлориде, промывают 1н серной кислотой, раствором соли, насыщенным бикарбонатом натрия и раствором соли. Органическую фазу сушат, фильтруют и упаривают. Остаток хроматографируют на силикагеле. Элюирование этилацетатом/гексаном дает кристаллическое соединение, которое обрабатывают 3% метанольным гидроксидом натрия при кипячении с обратным холодильником в течение 90 минут. После обычной обработки полученный остаток растворяют в ацетоне (500 мл), охлаждают до 0°С и добавляют реагент Джонса (Jones) (раствор 8н хромовой кислоты, 65 мл). Через 15 мин добавляют изопропанол и смесь концентрируют в вакууме. Добавляют воду и смесь экстрагируют этилацетатом. Органические слои промывают раствором соли, сушат и упаривают досуха. Хроматографирование остатка на силикагеле этилацетатом/гексаном в качестве элюента дает азакетон 6 (152 г), структура которого была определена с помощью спектроскопии. 17a-(4-тетрагидропиранилоксибутинил)-17bгидрокси-4-аза-5a-андростан-3-он (22, Х=2) Согласно схеме 4 к безводному ТГФ (140 мл) при -60°C добавляют метиллитий (1,4 М, 100 мл) и раствор 4-тетрагидропиранилоксибутина (21,6 г, 140 ммоль). К этой смеси, подогретой до комнатной температуры, перемешиваемой 2 часа и охлажденной до -60°С добавляют по каплям раствор вышеуказанного азакетона (9,6 г, 30 ммоль) в ТГФ (350 мл) и смесь нагревают до комнатной температуры и перемешивают в течение 16 часов. После обычной обработки соединение 22 (х=2) очищают хроматографией и его структуру устанавливают с помощью спектроскопии. Подобным образом получают 17a-(4-тетрагидропиранилоксибутинил)-17b-гидрокси-4-метил-4-аза-5a-андростан-3она (23, х=2). 17a-(4-бромбутинил)-17b-гидрокси-4-аза-5aандростан-3-он (24, P=Br, Х=2, ЕМ 465) К раствору азадиола 24 (Р=ОН ) (179 мг, 0,5 ммоль), полученного кислотным гидролизом соединения 22, и трифенилфосфина (262 мг, 1 ммоль) в метиленхлориде (15 мл) при 0°С добавляют СВr4 (249 мг, 1 ммоль) и смесь перемешивают в течение 2 часов при комнатной температуре. Растворитель удаляют и соединение 24 (Р=В r, х=2, ЕМ 465) очищают флэш хроматографией и эту стр уктуру устанавливают с помощью спектроскопии. Подобным образом получают 17a(4-бромбутинил)-17b-гидрокси-4-метил-4-аза-5aандростан-3-он (25, Р=Вr, ЕМ 321). 18 35589 Схема 4 Scheme 4 1 Н ЯМР (CDCl3): 0,83 (с, 3Н), 0,88 (с, 3Н), 2,41-2,46 (м, 2H), 2,83 (т, 2H, J=6,84 Гц), 2,91 (с,3ЗН), 3,03,06 (дд, 1Н, J=3,4, 12,5 Гц), 3.24 (т, 13, J=3,4, 12,5 Гц), 3,24 (Т, 2Н, J=7,1 Гц); HRMS : рассчитано для C23H34INО 2, 483,1635; найдено 483,1634. Пример 13 Подобным образом, что и в примере 12, следующие соединения, представленные в табл. 4, получают с использованием различных тетрагидропиранилоксиалкинов и различных тетрагалогенидов углерода. Получение 17a-(4-иодбутинил)-17b-гидрокси4-метил-4-аза-5a-андростан-3-она (25, Р=1, ЕМ 320) К смеси 17a-(4-бромбутинил)-17b-гидрокси-4метил-4-аза-5a-андростан-3-она (25, х=2, Р=Br, ЕM 321) (200 мг, 0,471 миоль) в ацетоне (16 мл) добавляют йодид натрия (92 мг, 0,6132 ммоль) и смесь кипятят с обратным холодильником в течение 12 часов. Удаление ацетона и обычная обработка приводят к сырому продукту, который очищают колоночной хромато-графией с получением чистого продукта (ЕМ 320) (137 мг, 60%); Таблица 4 ЕМ 501 ЕМ 502 ЕМ 503 ЕМ 448 ЕМ 320 ЕМ 471 ЕМ 358 R Н СН3 СН3 Н СН3 Н Н R' Н СОС6Н5 Н Н Н Н Н Пример 14 Получение 17b-(N-н-бутил-N-формамидо)-4,6диметил-4-аза-5a-андростан-3-она (31, ЕМ 548) Получение представлено в схеме 5. Получение 17b-ацетокси-6a-метил-4-андростен-3-она (30). Тестостерон (50 г) (Schering A.G. Germany) обрабатывают диэтиленгликолем в толуоле в аппарате, снабженном дистялляционной насадкой Дина-Старка, в присутствии каталитического количества п-толуол-сульфоновой кислоты х 2 2 2 2 2 3 3 р Сl Сl Сl I I I Br при кипячении с обратным холодильником в течение 16 часов. Полученный кеталь 26 окисляют магниевой солью монопероксифталевой кислоты (Aldrich Chem. Соmр. Inc. Milwaukee Wis USA) в изопропаноле при 50°C в течение 1 часа. После удаления растворителя и кристаллизации смесь эпоксида 27 нагревают с обратным холодильником с большим избытком метилмагнийиодида в тетрагидрофуране в течение 18 часов. 6b-метилкеталь 28 подвергают снятию защитной группы 19 35589 при выдерживании в течение ночи при комнатной 17b-(N-н-бутил-N-формамидо)-4,6-диметил-4температуре со смесью ацетона/воды (9:1). Полуаза-5a-андростан-3-он (31, ЕМ 548) ченный таким образом гидроксикетон 29 моноде6-Метиленон 30 преобразуют в 17b-(N-нгидрируют нагреванием в смеси 0,1 н гидроксида бутил-N-формамидо)-4,6-диметил-4-аза-5a-андронатрия в метаноле и 17b-гидроксил ацетилируют стан-3-он (31, EM 543) аналогично способу, опиобычным способом (ангидрид уксусной кислосанному в примере 1 для превращения тестостеты/пиридин). Таким образом получают 6-меронацетата в соединение 11. тиленон 30 (27 г) с охарактеризовывают путем спектроскопии. Схема 5 Scheme 5 Пример 15 Получение 17b-(N-алкил-N-формамидо)-4-метил-7a-гидроксиалкил-4-аза-5a-андростан-3-она (34) Синтез представлен в схеме 6. Следующий метод является иллюстративным. Коммерческий 17b-ацетокси-4,6-андростадиен-3он 32 (Steraloids Inc. Wilton, NH, USA) обрабатывают 1,5 избытком TBDMSO(CH2)xCu(ON)Li (полученный из TBDMSO(CH 2) xI, трет-BuLi и CuCN) в эфире или тетрагидрофуране в присутствии три метилсилилхлорида при -78°С. Смесь нагревают до комнатной температуры и подвергают обычной обработке. Полученное соединение 33 превращают в 17b-(N-алкил-N-формамидо)-4-метил-7a-гидроксиалкил-4-аза-5
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of testosterone 5-a-reductase activity, pharmaceutical composition and a method for inhibiting activity of testosterone 5-a-reductase
Автори англійськоюLabrie Fernand, Merand Yves, Singh Shankar M.
Назва патенту російськоюИнгибиторы тестостерон 5-a-редуктазы, фармацевтическая композиция и способ ингибирования активности тестостерон 5-a-редуктазы
Автори російськоюЛабри Фернан, Меран Ив, Сингх Шанкар М.
МПК / Мітки
МПК: A61K 8/00, C07J 73/00, A61K 31/565, A61Q 19/00, A61P 35/00, A61K 31/58, A61Q 5/00
Мітки: інгібітори, 5-a-редуктази, композиція, активності, спосіб, інгібування, фармацевтична, тестостерон
Код посилання
<a href="https://ua.patents.su/22-35589-ingibitori-testosteron-5-a-reduktazi-farmacevtichna-kompoziciya-ta-sposib-ingibuvannya-aktivnosti-testosteron-5-a-reduktazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори тестостерон 5-a-редуктази, фармацевтична композиція та спосіб інгібування активності тестостерон 5-a-редуктази</a>
Попередній патент: Засіб для лікування десинхронізаційних порушень та фармацевтична композиція
Наступний патент: Спосіб одержання n-монозаміщених пара-нітро- і нітрозофеніламінів
Випадковий патент: Монорейковий електропоїзд-літак з електромагнітоаеродинамічним підвісом












