Гетероциклічні сульфонаміди, їх застосування та фармацевтичні композиції
Номер патенту: 102310
Опубліковано: 25.06.2013
Автори: О'Доннелл Крістофер Джон, Шварц Якоб Бредлі, аллашун Ренделл Джеймс, Седжелстейн Барбара Ейлеен, Флірі Антон Франц Джозеф
Формула / Реферат
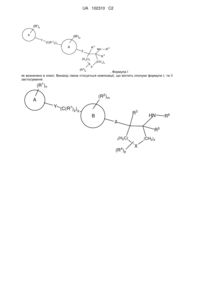
1. Сполука формули І або її фармацевтично прийнятна сіль,
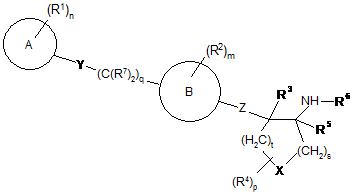 , I
, I
де кожен R1 та кожен R2 є незалежно вибраними з групи, що складається з гідрогену, галогену, гідроксилу, -CF3, -CN, -(NR8)-(C=O)-R8, -(C=O)-OR8, -(C=O)-N(R8)2, -OR8, -N(R8)2, -SO2-N(R8)2 та (С1-С6)алкілу; де згаданий (С1-С6)алкіл є необов'язково заміщеним одним, двома, трьома або чотирма R9;
m є нуль або один;
n є нуль, один, два або три;
p є нуль;
q є нуль;
s є один та t є один; або
один з s або t є один та інший з s або t є два;
R3 є гідрогеном;
кожен R4 є гідрогеном;
R5 є гідрогеном;
R6 є (С1-С6)алкіл-SО2-;
R8 є незалежно вибраним з групи, що складається з гідрогену, (С1-С6)алкілу та (С3-С10)циклоалкілу; де згаданий (С1-С6)алкіл може бути необов'язково заміщеним одним, двома або трьома галогенами;
кожен R9 є незалежно вибраним з групи, що складається з галогену та -(NR10)-SO2-R10;
R10 є незалежно вибраним з групи, що складається з гідрогену та (С1-С6)алкілу;
кільце "А" є (С6-С10)арилом, (С1-С9)гетероарилом, (С4-С10)циклоалкілом або (С1-С9)гетероциклоалкілом; де два зі згаданих R1 замісників на згаданих (С4-С10)циклоалкілі або (С1-С9)гетероциклоалкілі необов'язково можуть бути приєднаними до одного й того ж атома карбону та необов'язково можуть бути взяті разом для утворення оксогрупи, де (С6-С10)арил є фенілом, нафтилом, тетрагідронафтилом або інданілом; де (С1-С9)гетероарил є піридилом, піразинілом, піримідинілом, піридазинілом, тієнілом, фурилом, імідазолілом, піролілом, оксазолілом, тіазолілом, піразолілом, тетразолілом, триазолілом, оксадіазолілом, тіадіазолілом, хінолілом, ізохінолілом, бензотієнілом, бензофурилом або індолілом; та де (С1-С9)гетероциклоалкіл є азетидинілом, тетрагідрофуранілом, імідазолідинілом, піролідинілом, піперидинілом, піперазинілом, оксазолідинілом, тіазолідинілом, піразолідинілом, тіоморфолінілом, тетрагідротіазинілом, тетрагідротіадіазинілом, морфолінілом, оксетанілом, тетрагідродіазинілом, оксазинілом, оксатіазинілом, індолінілом, ізоіндолінілом, хінуклідинілом, хроманілом, ізохроманілом або бензоксазинілом;
кільце "В" є фенілом або піридилом;
X є -О- або >C(R4)2;
Υ відсутній; та
Ζ є -О-.
2. Сполука за пунктом 1 або її фармацевтично прийнятна сіль, де згадана сполука є сполукою формули Іа:
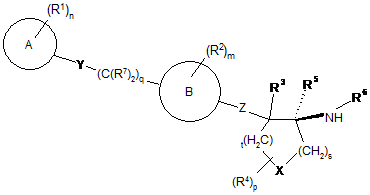 . Іa
. Іa
3. Сполука за пунктом 1 або її фармацевтично прийнятна сіль, де згадана сполука є сполукою формули Іb:
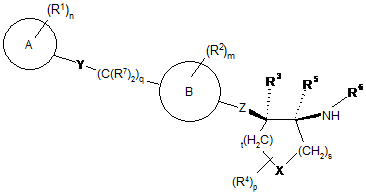 . Ib
. Ib
4. Сполука за будь-яким одним з пунктів 1-3 або її фармацевтично прийнятна сіль, де X є -О-.
5. Сполука за будь-яким одним з пунктів 1-4 або її фармацевтично прийнятна сіль, де
кільце "А" є фенілом; n є нуль, один або два;
R1 є вибраним з групи, що складається з гідрогену, галогену, гідроксилу, -CF3, -CN, -(C=O)-OR8, -(C=O)-N(R8)2, -OR8, -N(R8)2, -SO2-N(R8)2 та (С1-С6)алкілу; де згаданий (С1-С6)алкіл є необов'язково заміщеним одним, двома, трьома або чотирма R9.
6. Сполука за будь-яким одним з пунктів 1-4 або її фармацевтично прийнятна сіль, де
кільце "А" є (С1-С9)гетероарилом; n є нуль, один або два;
де R1 є вибраним з групи, що складається з гідрогену, галогену, гідроксилу, -CF3, -CN, -OR8, -N(R8)2 та (С1-С6)алкілу.
7. Сполука за будь-яким одним з пунктів 1-6 або її фармацевтично прийнятна сіль, де
кільце "В" є фенілом; m є нуль або один;
R2 є гідрогеном або галогеном.
8. Сполука за будь-яким одним з пунктів 1-7 або її фармацевтично прийнятна сіль, де R2 є гідрогеном.
9. Сполука за будь-яким одним з пунктів 1-8 або її фармацевтично прийнятна сіль, де R6 є (С1-С5)алкіл-SO2-.
10. Сполука за пунктом 1 або її фармацевтично прийнятна сіль, де згадана сполука, вибрана з групи, що складається з:
N-{1-[4-транс-({4-[(ізопропілсульфоніл)аміно]тетрагідрофуран-3-іл}окси)феніл]піролідин-3-іл}ацетаміду;
N-[(3S,4S)-4-(біфеніл-4-ілокси)тетрагідрофуран-3-іл]пропан-2-сульфонаміду;
N-{(3S,4S)-4-[(2'-ціанобіфеніл-4-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
N-{(3S,4S)-4-[4-(5-ціано-2-тієніл)фенокси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[(2'-ціанобіфеніл-4-іл)окси]циклопентил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[4-(5-ціано-2-тієніл)фенокси]циклопентил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[(2'-ціанобіфеніл-4-іл)окси]циклогексил}пропан-2-сульфонаміду;
цис-N-[4-(4-пipидин-3-iлфeнoкcи)тетрагідрофуран-3-іл]пропан-2-сульфонаміду;
цис-N-{4-[4-(2-тієніл)фенокси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
N-{(3S,4S)-4-[(2'-ціано-4'-флуорбіфеніл-4-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
N-{(3S,4S)-4-[{4'-флyopбіфеніл-4-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
N-{(3S,4S)-4-[(2'-етокси-4'-флуорбіфеніл-4-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
цис-N-[4-{[6-(5-ціано-2-тієніл)піридин-3-іл]окси}тетрагідрофуран-3-іл]пропан-2-сульфонаміду;
цис-N-{4-[4-(3-тієніл)фенокси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду;
2-цiaнo-4'-({(1R,2S)-2-[(iзoпpoпiлсульфоніл)аміно]циклопентил}окси)біфеніл-4-карбонової кислоти;
N-{(1S,2R)-2-[(2'-цiaнo-2,4'-дифлyopбіфеніл-4-іл)окси]циклопентил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[(2'-eтoкcи-2-флyopбіфеніл-4-іл)окси]циклопентил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[4-(5-цiaнo-2-тiєнiл)-3-флyopфенокси]циклопентил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[(2'-цiaнo-2-флyopбiфeнiл-4-iл)oкcи]циклoгeкcил}пpoпaн-2-сульфонаміду;
N-{(1S,2R)-2-[(2'-цiaнo-2,4'-дифлyopбіфеніл-4-іл)окси]циклогексил}пропан-2-сульфонаміду;
N-{(1S,2R)-2-[4-(5-ціaнo-2-тiєнiл)-3-флyopфенокси]циклогексил}пропан-2-сульфонаміду;
N-[(1S,2R)-2-(4-пipoлiдин-1-iлфeнoкcи)циклогексил]пропан-2-сульфонаміду;
N-[(1S,2R)-2-({6-[2-(2,2,2-тpифлyopетокси)феніл]піридин-3-іл}окси)циклогексил]пропан-2-сульфонаміду;
N-[(1S,2R)-2-({6-[2-(тpифлyopметокси)феніл]піридин-3-іл}окси)циклогексил]пропан-2-сульфонаміду; або
N-[(1S,2R)-2-{[6-{5-ціано-2-тієніл)піридин-3-іл]окси}циклогексил]пропан-2-сульфонаміду.
11. Сполука N-{(3S,4S)-4-[4-(5-ціано-2-тієніл)фенокси]тетрагідрофуран-3-іл}пропан-2-сульфонамід або її фармацевтично прийнятна сіль.
12. Сполука за пунктом 11, якою є N-{(3S,4S)-4-[4-(5-ціано-2-тієніл)фенокси]тетрагідрофуран-3-іл}пропан-2-сульфонамід.
13. Спосіб лікування або попередження у ссавців стану, вибраного з групи, що складається з гострого неврологічного та психічного розладів, нападу, церебральної ішемії, травми спинного мозку, травми голови, перинатальної гіпоксії, зупинки серця, гіпоглікемічного нейронного пошкодження, деменції, хвороби Альцгеймера, хореї Гентінгтона, бічного аміотрофічного склерозу, очних ушкоджень, ретинопатії, когнітивних розладів, ідіопатичної та викликаної лікарськими засобами хвороби Паркінсона, м'язових спазмів та розладів, пов'язаних з м'язовою еластичністю, включаючи тремор, епілепсії, судом, мігрені, нетримання сечі, толерантності до психоактивних речовин, абстиненції до психоактивних речовин, психозу, шизофренії, неспокою, розладів настрою, невралгії трійчастого нерва, зниження слуху, шуму у вухах, макулярної дегенерації очей, блювання, набряку мозку, болю, пізньої дискінезії, розладів сну, синдрому дефіциту уваги/гіперактивності, розладу дефіциту уваги та розладів поведінки, за яким ссавцю вводять сполуку за будь-яким одним з пунктів 1-12 або її фармацевтично прийнятну сіль.
14. Фармацевтична композиція, що містить сполуку за будь-яким одним з пунктів 1-12 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
15. Фармацевтична композиція, що містить сполуку за пунктом 12 та фармацевтично прийнятний носій.
Текст
Реферат: Представлений винахід стосується класу сполук, включаючи фармацевтично прийнятні солі сполук, що мають структуру формули І: UA 102310 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 102310 C2 (R1)n A Y (R2)m (C(R 7)2)q B Z R 3 R (H 2C) t (R 4)p NH R 6 5 (CH 2)s X , Формула I як визначено в описі. Винахід також стосується композиції, що містить сполуки формули І, та її застосування. (R1)n (R2)m A Y (C(R7 )2)q R3 B HN Z R5 t(H2C) (R4)p (CH2)s X R6 UA 102310 C2 5 10 15 20 25 30 Галузь винаходу Представлений винахід стосується нового класу сполук, що мають структуру формули I, як визначено тут, та фармацевтичних композицій, що містять сполуку формули I або її фармацевтично прийнятну сіль. Представлений винахід також включає способи лікування суб'єкту, за якими суб'єкту вводять терапевтично ефективну кількість сполуки формули І або її фармацевтично прийнятної солі. Ці сполуки є корисними для станів розкритих тут. Представлений винахід, крім того, включає способи одержання сполук формули І та відповідних проміжних сполук. Передумови створення винаходу Первинним нейротрансміттером збудження центральної нервової системи (ЦНС) у ссавців є амінокислота глутамат, чия передача сигналів є опосередкованою або іонотропними, або метаботропними рецепторами глутамату (GluR). Іонотропні глутаматні рецептори (iGluR) включають три підтипи, що відрізняються своїми унікальними відповідями на три селективних iGluR агоніста α-аміно-3-гідрокси-5-метилізоксазол-4-пропіонову кислоту (AMPA), N-метил-Dаспартат (NMDA) та каїнат (Parsons, C. G., Danysz, W., Lodge, D. (2002): Ionotropic Glutamate Receptors as Therapeutic Targets (Danysz, W., Lodge, D., Parsons, C. G. eds), pp 1-30, F.P. Graham Publishing Co., Tennessee). AMPA рецептори, білкові гомо- або гетеротетрамери з будьякої комбінації чотирьох субодиниць з близько 900 амінокислотних мономерів, кожна закодована з різних генів (GluA1–A4) з кожного протеїну субодиниці, що існує як один з двох сплайсованих видів, що вважаються "фліп" та "флоп" посередниками переважної більшості синаптичних передач збудження в мозку ссавців та вже давно запропоновані бути невід'ємною частиною нервової системи, що служить посередником когнітивних процесів (Bleakman, D., Lodge, D. (1998) Neuropharmacology of AMPA and Kainate Receptors. Neuropharmacology 37:1187-1204). Поєднанням різних гетеротетрамерних можливостей два сплайсованих вида формують для кожного з чотирьох iGluR мономерів та субодиниці РНК рецептору редагування гетерогенного розподілення AMPA рецепторів по всьому виділеному мозку чисельністю потенційних відповідей AMPA рецептору на цей орган (Black, M. D. (2005) Therapeutic Potential of Positive AMPA Modulators and Their Relationship to AMPA Receptor Subunits. A Review of Preclinical Data. Psychopharmacology 179:154-163). AMPA модулятори зараз стали активною мішенню для відкриття лікарських засобів (дивись Rogers, B., Schmidt, C., (2006) Novel Approaches for the Treatment of Schizophrenia, Annual Reports in Medicinal Chemistry 3-21). Реферат винаходу Представлений винахід стосується сполук, включаючи фармацевтично прийнятні солі цих сполук, що мають структурну формулу: 35 (R1)n (R2)m A Y (C(R7 )2)q R3 B HN R6 I Z R5 t(H2C) (R4)p 1 40 2 7 (CH2)s X де кожен R та кожен R , та кожен R є незалежно вибраний з групи, що складається з 8 8 8 8 8 гідрогену, галогену, гідроксилу, -CF3, -CN, -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , 8 8 8 8 8 8 8 8 -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , -SO28 N(R )2, (C1-C6)алкілу, (C6-C10)арилу, (C1-C9)гетероарилу, (C1-C9)гетероциклоалкілу та (C3C10)циклоалкілу; де кожен згаданий (C1-C6)алкіл, (C6-C10)арил, (C1-C9)гетероарил, (C1C9)гетероциклоалкіл або (C3-C10)циклоалкіл є незалежно необов'язково заміщеним одним, 9 двома, трьома або чотирма R ; w є 0, 1 або 2; 1 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 m є нуль, один, два або три; n є нуль, один, два або три; p є нуль, один, два або три; q є нуль, один, два або три; s є один та t є один; або один з s або t є один, а інший з s або t є два; 3 R є гідрогеном або (C1-C6)алкілом; 4 кожен R незалежно є вибраним з гідрогену, або (C1-C6)алкілу; де згаданий (C1-C6)алкіл може бути необов'язково заміщеним одним, двома, трьома або чотирма галогенами, -CN, або 9 OR ; 4 або дві R групи при одному й тому ж атомі карбону можуть бути взяті разом для утворення оксо (=O) радикалу або (C3-C6)спіроциклоалкілу; 5 R є гідрогеном або (C1-C6)алкілом; 6 R є (C1-C6)алкіл-(C=O)-, [(C1-C6)алкіл]2N-(C=O)-, (C1-C6)алкіл-SO2-, (C3-C10)циклоалкіл-SO2-, або [(C1-C6)алкіл]2N-SO2-; де згадані (C1-C6)алкільні залишки згаданого [(C1-C6)алкіл]2N-(C=O)та [(C1-C6)алкіл]2N-SO2- необов'язково можуть бути взяті разом з атомом нітрогену, до якого вони приєднані, щоб утворити трьох-шестичленне гетероциклічне кільце; 8 кожен R незалежно є вибраним з групи, що складається з гідрогену, (C 1-C6)алкілу, (C6C10)арилу, (C1-C9)гетероарилу, (C1-C9)гетероциклоалкілу та (C3-C10)циклоалкілу; де згаданий (C1-C6)алкіл може бути необов'язково заміщеним одним, двома або трьома замісниками, незалежно вибраними з гідрогену, галогену, -CN, перфлуор(C1-C6)алкілу, гідроксилу, аміно, (C1-C6)алкіламіно, [(C1-C6)алкіл]2аміно, (C1-C6)алкокси, перфлуор(C1-C6)алкокси, HO-(C=O)-, (C1-C6)алкіл-O-(C=O)-, формілу, (C1-C6)алкіл-(C=O)-, H2N-(C=O)-, (C1-C6)алкіл]-(NH)-(C=O)-, [(C1-C6)алкіл]2N-(C=O)-, (C1-C6)алкіл-(C=O)-O-, H(C=O)-NH-, (C1-C6)алкіл(C=O)-NH-, (C1-C6)алкіл(C=O)-[N((C1-C6)алкіл)]-, (C1-C6)алкіл-SO2-, (C1-C6)алкіл-SO2-NH-, (C1-C6)алкіл-SO2-[N((C1-C6)алкіл)]-, H2N-SO2-, [(C1-C6)алкіл]-NH-SO2- та [(C1-C6)алкіл]2N-SO2-; де згаданий (C1-C6)алкіл додатково може бути необов'язково заміщеним необов'язково заміщеним (C6-C10)арилом, (C1-C9)гетероарилом, (C1-C9)гетероциклоалкілом або (C3-C10)циклоалкілом; де згадані необов'язкові замісники можуть бути незалежно заміщеними одним, двома, трьома або чотирма радикалами, незалежно вибраними з галогену, гідроксилу, -CF3, -CN, (C1-C3)алкілу, 8 (C1-C3)алкокси та аміно; де кожен зі згаданих R (C6-C10)арильного, (C1-C9)гетероарильного, (C1-C9)гетероциклоалкільного або (C3-C10)циклоалкільного замісників необов'язково додатково можуть бути заміщеними одним, двома, трьома або чотирма радикалами незалежно вибраними з галогену, гідроксилу, -CF3, -CN, (C1-C3)алкілу, (C1-C3)алкокси та аміно; 9 кожен R є незалежно вибраним з групи, що складається з галогену, гідроксилу, -CF3, -CN, 10 10 10 10 10 10 10 10 -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , 10 10 10 10 10 10 -O-(C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR та -SO2-N(R )2; 10 кожен R є незалежно вибраним з групи, що складається з гідрогену, (C 1-C6)алкілу, (C6C10)арилу, (C1-C9)гетероарилу, (C1-C9)гетероциклоалкілу та (C3-C10)циклоалкілу; де згаданий (C1-C6)алкіл необов'язково може бути заміщеним одним, двома або трьома замісниками незалежно вибраними з гідрогену, галогену, -CN, перфлуор(C1-C6)алкілу, гідроксилу, аміно, (C1-C6)алкіламіно, [(C1-C6)алкіл]2аміно, (C1-C6)алкокси, перфлуор(C1-C6)алкокси, HO-(C=O)-, (C1-C6)алкіл-O-(C=O)-, формілу, (C1-C6)алкіл-(C=O)-, H2N-(C=O)-, (C1-C6)алкіл]-(NH)-(C=O)-, [(C1-C6)алкіл]2N-(C=O)-, (C1-C6)алкіл-(C=O)-O-, H(C=O)-NH-, (C1-C6)алкіл(C=O)-NH-, (C1-C6)алкіл(C=O)-[N((C1-C6)алкіл)]-, (C1-C6)алкіл-SO2-, (C1-C6)алкіл-SO2-NH-, (C1-C6)алкіл-SO2-[N((C1-C6)алкіл)]-, H2N-SO2-, [(C1-C6)алкіл]-NH-SO2- та [(C1-C6)алкіл]2N-SO2-; де згаданий (C1-C6)алкіл додатково також може бути необов'язково заміщеним необов'язково заміщеним (C6-C10)арилом, (C1-C9)гетероарилом, (C1-C9)гетероциклоалкілом або (C3-C10)циклоалкілом; де згадані необов'язкові замісники можуть бути незалежно заміщеними одним, двома, трьома або чотирма радикалами незалежно вибраними з галогену, гідроксилу, 10 CF3, -CN, (C1-C3)алкілу, (C1-C3)алкокси та аміно; де кожен зі згаданих R (C6-C10)арильного, (C1-C9)гетероарильного, (C1-C9)гетероциклоалкільного або (C3-C10)циклоалкільного замісників додатково можуть бути необов'язково заміщеними одним, двома, трьома або чотирма радикалами незалежно вибраними з галогену, гідроксилу, -CF3, -CN, (C1-C3)алкілу, (C1-C3)алкокси та аміно; 11 R є гідрогеном або (C1-C6)алкілом; кільце "A" є (C6-C10)арилом, (C1-C9)гетероарилом, (C4-C10)циклоалкілом або 1 (C1-C9)гетероциклоалкілом; де два зі згаданих R замісників при згаданому (C4-C10)циклоалкілі та (C1-C9)гетероциклоалкілі необов'язково можуть бути приєднаними до одного й того ж атому карбону та необов'язково можуть бути взяті разом, щоб утворити оксо; кільце "B" є (C6-C10)арилом, (C1-C9)гетероарилом, (C4-C10)циклоалкілом або 2 UA 102310 C2 5 10 15 20 25 30 (C1-C9)гетероциклоалкілом; 4 "X" є -O- або >C(R )2; 11 11 7 "Y" є >NR , -(NR )-(C=O)-, >C=O, -O- або >C(R )2; "Z" є –O-. –S-, -(S=O)- або -(SO2)-. Термін "алкіл" стосується лінійного або розгалуженого ланцюгу, що є насиченим, мононенасиченим та поліненасиченим гідрокарбоновим замісником (тобто, замісник є одержаним з гідрокарбону відщепленням гідрогену), що містить від одного до шести атомів карбону; і в іншому втіленні, від одного до чотирьох атомів карбону. Моно- та полі-ненасичені замісники, також названі алкеніли, мають від 2 до 6 атомів карбону. Алкенільна група може існувати як чиста E (напроти) форма, чиста Z (разом) форма, або будь-яка їх суміш. Поліненасичений включає кратні подвійні зв'язки та один або більше потрійних зв'язків. Такі алкільні групи, що містять потрійний зв'язок, також названі алкінільною групою, мають від 2 до 6 атомів карбону. Приклади таких насичених замісників включають метил, етил, пропіл (включаючи н-пропіл та ізопропіл), бутил (включаючи н-бутил, ізобутил, втор-бутил та третбутил), пентил, ізоаміл, гексил, тощо. Приклади ненасичених алкілів включають етеніл, 1пропеніл, 2-пропеніл (аліл), ізопропеніл, 2-метил-1-пропеніл, 1-бутеніл, 2-бутеніл, тощо. Приклади алкінілів включають етиніл, пропініл, бутиніл, 3,3-диметилбутиніл, тощо. В деяких випадках, число атомів карбону в гідрокарбоновому заміснику (наприклад, алкілі, алкенілі, циклоалкілі, циклоалкенілі, арилі, тощо) позначають префіксои "Cx-Cy-,” де x є мінімальним та y є максимальним числом атомів карбону в заміснику. Таким чином, наприклад, "C1-C6-алкіл" стосується алкільного замісника, що містить від 1 до 6 атомів карбону. Наводячи приклади далі, C3-C6-циклоалкіл стосується насиченого циклоалкілу, що містить від 3 до 6 атомів карбону кільця. Як використано тут, термін "перфлуор(C1-C6)алкіл" стосується алкільного радикалу, як описано вище, заміщеного одним або більше атомами флуору, включаючи, але не обмежуючись цим, флуорметил, дифлуорметил, трифлуорметил, 2,2,2-трифлуоретил, тощо. Термін "гідрокси" або "гідроксил" стосується – префікс "гідрокси" показує, що замісник, до якого префікс приєднаний, є заміщеним одним або більше гідрокси замісниками. Сполуки, в яких присутній атом карбону з одним або більше гідрокси замісниками, вкючають, наприклад, спирти, єноли та фенол. Термін "ціано" (також згадується як "нітрил") означає -CN, який також можуть зображувати як -C≡N. Термін "карбоніл" означає -C(O)-, >C=O, -(C=O)-, та який також можуть зображувати як: O 35 . Термін "аміно" стосується -NH2. Термін "оксо" стосується =O. Термін "алкокси" стосується алкільного лінійного до оксигену, який також може бути представлений як: –O-R, де R представляє собою алкільну групу. Приклади алкокси включають метокси, етокси, пропокси та бутокси. O O S 40 45 50 Термін "сульфоніл" стосується -S(O)2-, який також можуть зображувати як: . Таким чином, наприклад, "алкіл-сульфоніл-алкіл" стосується алкіл-S(O)2-алкілу. Приклади алкілсульфонілу включають метилсульфоніл, етилсульфоніл та пропілсульфоніл. Визначено, як використано тут, що термін "циклоалкіл" включає насичений або ненасичений (неароматичний), містокові, поліциклічні, спіроциклічні або анельовані поліциклічні 3-10-членні гідрокарбонові кільця (наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононіл, біцикло[2.2.1]гептаніл, біцикло[3.2.1]октаніл та біцикло[5.2.0]нонаніл, тощо); необов'язково заміщені 1-5 прийнятними замісниками. Переважно, циклоалкільна група містить від 3 до 6 атомів карбону. В одному з втілень циклоалкіл необов'язково може містити один, два або більше несукупних неароматичних подвійних або потрійних зв'язків. Спіроциклічні кільця є одним конкретним видом циклоалкілів, що має місце, коли кільце утворюється навколо одного атому карбону в порівнянні з анельованим кільцем, в якому кільце утворюється через два спільних атомів карбону. 3 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Визначено, як використано тут, що термін "арил" включає всі-карбон моноциклічні або з анельованим кільцем поліциклічні (тобто, кільця, які частина сусідніх пар атомів карбону) групи, що мають повністю кон'юговану π-електронну систему. Арильна група містить 6, 8, 9 або 10 атомів карбону в кільці(ях). Більш переважно, арильна група містить 6 або 10 атомів карбону в кільці(ях). Найбільш переважно, арильна група містить 6 атомів карбону в кільці(ях). Наприклад, як використано тут, термін “(C6-C10)арил" означає ароматичні радикали, що містять від 6 до 10 атомів карбону, такі як феніл, нафтил, тетрагідронафтил, антраценіл, інданил, тощо. Арильна група є необов'язково заміщеною від 1 до 5 прийнятними замісниками. Визначено, як використано тут, що термін "гетероарил" включає моноциклічні або з анельованим кільцем поліциклічні ароматичні гетероциклічні групи з одним або більше гетероатомів, вибраних з O, S та N в одному або більше зі згаданих кілець. Гетероарильна група містить від 5 до 12 атомів кільця, включаючи від одного до п'яти гетероатомів, незалежно вибраних з O, S та N. Одне або більше зі згаданих кілець згаданої гетероциклічної групи може не містити гетероатомів. Переважно, гетероарильна група містить від 5 до 10 атомів кільця, включаючи від одного до чотирьох гетероатомів. Більш переважно, гетероарильна група містить від 5 до 8 атомів кільця, включаючи один, два або три гетероатомів. Найбільш переважно, гетероарильна група містить від 6 до 8 атомів кільця, включаючи один або два гетероатоми. Наприклад, як використано тут, термін “(C1-C9)гетероарил" означає ароматичні радикали, що містять щонайменш одне кільце з гетероатомами, незалежно вибраними з O, S або N, та від 1 до 9 атомів карбону, такі як піридиніл, піразиніл, піримідиніл, піридазиніл, тієніл, фурил, імідазоліл, піроліл, оксазоліл (наприклад, 1,3-оксазоліл, 1,2- оксазоліл), тіазоліл (наприклад, 1,2тіазоліл, 1,3-тіазоліл), піразоліл, тетразоліл, триазоліл (наприклад, 1,2,3-триазоліл, 1,2,4триазоліл), оксадіазоліл (наприклад, 1,2,3-оксадіазоліл), тіадіазоліл (наприклад, 1,3,4тіадіазоліл), хіноліл, ізохіноліл, бензотієніл, бензофурил, індоліл, тощо. Гетероарильна група є необов'язково заміщеною від 1 до 5 прийнятними замісниками. Визначено, як використано тут, що термін "гетероциклоалкіл" включає моноциклічне, місткове, поліциклічне, спіроциклічне або анельоване поліциклічне насичене або ненасичене неароматичне 3-20-членне кільце, що містить 1 або більше гетероатомів, незалежно вибраних з O, S або N. Одне або більше зі згаданих кілець згаданої місткової, поліциклічної або анельованої гетероциклічної групи може не містити гетероатомів. Приклади таких гетероциклоалкільних кілець включають азетидиніл, тетрагідрофураніл, імідазолідиніл, піролідиніл, піперидиніл, піперазиніл, оксазолідиніл, тіазолідиніл, піразолідиніл, тіоморфолініл, тетрагідротіазиніл, тетрагідротіадіазиніл, морфолініл, оксетаніл, тетрагідродіазиніл, оксазиніл, оксатіазиніл, індолініл, ізоіндолініл, хінолідиніл, хроманіл, ізохроманіл, бензоксазиніл, тощо. Наступними прикладами згаданих гетероциклоалкільних кілець є тетрагідрофуран-2-іл, тетрагідрофуран-3-іл, імідазолідин-1-іл, імідазолідин-2-іл, імідазолідин-4-іл, піролідин-1-іл, піролідин-2-іл, піролідин-3-іл, піперидин-1-іл, піперидин-2-іл, піперидин-3-іл, піперазин-1-іл, піперазин-2-іл, піперазин-3-іл, 1,3-оксазолідин-3-іл, ізотіазолідинe, 1,3-тіазолідин-3-іл, 1,2піразолідин-2-іл, 1,3-піразолідин-1-іл, 1,2-тетрагідротіазин-2-іл, 1,3 тетрагідротіазин-3-іл, 1,2тетрагідродіазин-2-іл, 1,3-тетрагідродіазин-1-іл, 1,4-оксазин-2-іл, 1,2,5-оксатіазин-4-іл, тощо. Гетероциклоалкільне кільце є необов'язково заміщеним від 1 до 5 прийнятними замісниками. Якщо замісники описані як такі, що "незалежно вибрані" з групи, то кожен замісник є вибраним незалежно від іншого. Тому кожен замісник може бути однаковим з або відрізнятися від іншого(их) замісника(ів). Коли в сполуці формули І присутній асиметричний центр (надалі розуміється, що мається на увазі формула I, Ia, Ib, Ic, Id або Ie), надалі названа як "сполука за винаходом, ” сполука може існувати в формі оптичних ізомерів (енантіомерів). В одному з втілень представлений винахід включає енантиомери та суміші, включаючи рацемічні суміші сполук формули І. В іншому втіленні, для сполук формули І, що містять більше ніж один асиметричний центр, представлений винахід включає діастереомерні форми (індивідуальні діастереомери та їх суміші) сполук. Коли сполука формули І містить алкенільну групу або залишок, то можуть виникати геометричні ізомери. Представлений винахід включає таутомерні форми сполук формули І. Таутомерна ізомерія ("таутомерія") має місце, коли стуктурні ізомери є взаємнозамінними через низько енергетичний бар'єр. Це може приймати форму протонної таутомерії в сполуках формули І, що містять, наприклад, іміно, кето або оксимну групу, або так звана валентна таутомерія в сполуках, які містять ароматичний залишок. Звідси випливає, що одна сполука може демонструвати більше ніж один тип ізомерії. Різні співвідношення таутомерів в твердій та рідкій формі залежить від різних замісників в молекулі, а також конкретного способу кристалізації, що використовували для виділення сполуки. 4 UA 102310 C2 5 10 15 20 25 30 35 Придатні фармацевтично прийнятні кислотні адитивні солі сполук за представленим винаходом, коли можливо, включають такі похідні неорганічних кислот, як гідрогенхлоридної, гідрогенбромідної, гідрогенфлуоридної, борної, флуорборної, фосфорної, метафосфорної, нітратної, карбонатної, сульфонової та сульфатної кислот, та органічних кислот, таких як оцтової, бензолсульфонової, бензойної, лимонної, етансульфонової, фумарової, глуконової, гліколієвої, ізотіонової, молочної, лактобіонової, малеїнової, малонової, метансульфонової, трифлуорметансульфонової, бурштинової, толуїлсульфонової, винної та трифлуороцтової кислот. Взагалі прийнятні органічні кислоти включають, наприклад, аліфатичні, циклоаліфатичні, ароматичні, арилаліфатичні, гетероциклічні, карбоксильні та сульфонові класи органічних кислот. Крім того, коли сполуки за винаходом мають кислотний залишок, відповідні їх фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад, солі натрію або калію; солі лужно-земельних металів, наприклад, солі кальцію або магнію; та солі утворені відповідними органічними лігандами, наприклад, четвертинні амонієві солі. В іншому втіленні, основні солі утворюються з основ, які утворюють нетоксичні солі, включаючи солі алюмінію, аргініну, бензатину, холіну, діетиламіну, діоламіну, гліцину, лізину, меглюміну, оламіну, трометаміну та цинку. В одному з втілень також можуть утворюватися гемісолі кислот та основ, наприклад, гемісульфатні та гемікальцієві солі. Представлений винахід також включає ізотопно мічені сполуки, які є ідентичними до перелічених в формулі I, але в дійсності, в яких один або більше атомів замінені атомами, що мають атомну масу або масове число відмінне від атомної маси або масового числа, яку звичайно знаходять в природі. Приклади ізотопів, що можуть бути введені в сполуки за представленим винахідом, включають ізотопи гідрогену, карбону, нітрогену, оксигену, фосфору, 2 3 13 11 14 15 18 17 31 32 35 18 36 сульфуру, флуору та хлору, такі як H, H, C, C, C, N, O, O, P, P, S, F та Cl, відповідно. Сполуки за представленим винаходом та фармацевтично прийнятні солі згаданих сполук або які містять вищезгадані ізотопи та/або інші ізотопи інших атомів знаходяться в межах даного винаходу. Певні ізотопно мічені сполуки за представленим винаходом, наприклад ті, в 3 14 які введено радіоактивні ізотопи, такі як H та C, є корисними в лікарських засобах та/або в аналізі розподілення субстрату в тканинах. Особливо надається перевага міченим тритієм, 3 14 тобто, H, та карбоном-14, тобто, C, ізотопам через легкість одержання та здатність до 2 виявлення. Надалі, заміщення важчими ізотопами, такими як дейтерій, тобто, H, може дати певний терапевтичний сприятливий результат з більшою метаболічною стабільністю, наприклад збільшеним in vivo періодом напіврозпаду або зниженим дозуванням, що вимагається, та, звідси, може бути переважним в деяких випадках. Ізотопно мічені сполуки формули І за даним винаходом загалом можуть одержувати виконанням процедур, розкритих в схемах та/або в прикладах та одержаннях нижче, заміщенням легко доступним ізотопно міченим реагентом неізотопно міченого реагенту. Одне втілення представленого винаходу стосується сполук формули: 40 (R1)n (R2)m A Y (C(R7 )2)q R3 R5 R6 B NH Z t(H2C) (CH2)s X (R4)p Інше втілення представленого винахіду стосується сполук формули: 5 Ia UA 102310 C2 (R1)n (R2)m A Y (C(R7 )2)q R3 R6 R5 B Ib NH Z t(H2C) (CH2)s X (R4)p Кваліфікованому спеціалісту в даній галузі з рівня техніки буде зрозуміло, що сполуки формули І можуть існувати як альтернативні стереоізомери, включаючи наступні: (R1)n (R2)m A Y (C(R7 )2)q R3 R6 NH B R5 Z Ic t(H2C) (CH2)s 1 (R )n X (R4)p (R2)m A Y (C(R7 )2)q R3 R6 R5 B NH Z Id t(H2C) (R1)n (CH2)s X (R4)p (R2)m A Y (C(R7 )2)q R3 R6 NH B R5 Z Ie t(H2C) (R4)p (CH2)s X 5 10 Інше втілення за представленим винахідом (так звані етери) стосується сполук формули І (або Ia, Ib, Ic, Id або Ie), де "Z" є -O-. Інше втілення за представленим винахідом (так звані тіоетери) стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де "Z" є -S-. Інше втілення за представленим винахідом (так звані сульфоксиди) стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де "Z" є -(S=O)-. Інше втілення за представленим винахідом (так звані сульфони) стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де "Z" є -(SO2)-. 6 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інше втілення за представленим винахідом (так звані фурани або пірани) стосується сполук формули І (або Ia, Ib, Ic, Id або Ie), де X є –O-. Сучасні винахідники виявляють особливу зацікавленність в таких фуранах та піранах, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом (так звані циклопентили або циклогексили) 4 стосується сполук формули І (або Ia, Ib, Ic, Id або Ie), де X є >C(R )2, більш конкретно, де кожен 4 R є гідрогеном. Сучасні винахідники також виявляють особливу зацікавленність в таких циклопентилах або циклогексилах, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом стосується сполук формули І (або Ia, Ib, Ic, Id або Ie), де кільце "A" є фенілом; більш конкретно, де n є нуль, один або два; більш конкретно, 1 8 де R є вибраним з групи, що складається з гідрогену, галогену, гідроксилу, -CF3, -CN, -(C=O)R , 8 8 8 8 8 8 8 8 -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, 8 8 8 8 8 -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , -SO2-N(R )2, та (C1-C6)алкілу; де згаданий (C1-C6)алкіл є 9 необов'язково заміщеним одним, двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу зацікавленність в таких "A" фенільних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "A" є (C1-C9)гетероарилом; більш конкретно, де n є нуль, один або два; більш 1 конкретно, де R є вибраним з групи, що складається з гідрогену, галогену, гідроксилу, -CF3, 8 8 8 8 8 8 8 8 CN, -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O8 8 8 8 8 8 (C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , -SO2-N(R )2 та (C1-C6)алкілу; де згаданий 9 (C1-C6)алкіл є необов'язково заміщеним одним, двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу зацікавленність в таких "A" (C1-C9)гетероарильних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "A" є (C1-C9)гетероциклоалкілом; більш конкретно, де n є нуль, один або два; 1 та більш конкретно, де R є вибраним з групи, що складається з оксо, гідрогену, галогену, 8 8 8 8 8 8 8 гідроксилу, -CF3, -CN, -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , 8 8 8 8 8 8 8 -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , -SO2-N(R )2 та (C1-C6)алкілу; де згаданий (C1-C6)алкіл є необов'язково заміщеним одним, двома, трьома або 9 чотирма R . Сучасні винахідники також виявляють особливу зацікавленність в таких "A" (C1-C9)гетероциклоалкільних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "A" є (C4-C10)циклоалкілом; більш конкретно, де n є нуль, один або два; та 1 більш конкретно, де R є вибраним з групи, що складається з оксо, гідрогену, галогену, 8 8 8 8 8 8 8 гідроксилу, -CF3, -CN, -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , 8 8 8 8 8 8 8 -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , -SO2-N(R )2 та (C1-C6)алкілу; де згаданий (C1-C6)алкіл є необов'язково заміщеним одним, двома, трьома або 9 чотирма R . Сучасні винахідники також виявляють особливу зацікавленність в таких "A" (C4-C10)циклоалкільних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 1 або Ie), де R є (C1-C6)алкокси, (C1-C6)алкілом, ціано або галогеном та знаходяться в орто або пара положеннях відносно Y. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 2 або Ie), де кільце "B" є фенілом; більш конкретно, де m є нуль або один; більш конкретно, де R 8 8 8 8 є гідрогеном, галогеном, гідроксилом, -CF3, -CN, -(C=O)R , -O-(C=O)-R , -(NR )-(C=O)-R , -(C=O)8 8 8 8 8 8 8 8 8 OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, -(NR )-SO2-R , -S(O)wR , 8 -SO2-N(R )2 або (C1-C6)алкілом; де згаданий (C1-C6)алкіл є необов'язково заміщеним одним, 9 двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу підвищену зацікавленність в таких "B" фенільних сполуках, а саме, так як вони можуть бути сегреговані 7 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Кожне з таких втілень також створює додаткові втілення інтересу з вищеописаними втіленнями "A" кільця. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "B" є (C1-C9)гетероарилом; більш конкретно, де m є нуль або один; та більш 2 8 8 конкретно, де R є гідрогеном, галогеном, гідроксилом, -CF3, -CN, -(C=O)R , -O-(C=O)-R , 8 8 8 8 8 8 8 8 -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, 8 8 8 8 -(NR )-SO2-R , -S(O)wR , -SO2-N(R )2 або (C1-C6)алкілом; де згаданий (C1-C6)алкіл є 9 необов'язково заміщеним одним, двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу підвищену зацікавленність в таких "B" (C1-C9)гетероарильних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Кожне з таких втілень також створює додаткові втілення інтересу з вищеописаними втіленнями "A" кільця. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "B" є (C1-C9)гетероциклоалкілом; більш конкретно, де m є нуль або один; та 2 8 8 більш конкретно, де R є гідрогеном, галогеном, гідроксилом, -CF3, -CN, -(C=O)R , -O-(C=O)-R , 8 8 8 8 8 8 8 8 -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, 8 8 8 8 (NR )-SO2-R , -S(O)wR , -SO2-N(R )2 або (C1-C6)алкілом; де згаданий (C1-C6)алкіл є необов'язково 9 заміщеним одним, двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу підвищену зацікавленність в таких "B" (C1-C9)гетероциклоалкільних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Кожне з таких втілень також створює додаткові втілення інтересу з вищеописаними втіленнями "A" кільця. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де кільце "B" є (C4-C10)циклоалкілом; більш конкретно, де m є нуль або один; та більш 2 8 8 конкретно, де R є гідрогеном, галогеном, гідроксилом, -CF3, -CN, -(C=O)R , -O-(C=O)-R , 8 8 8 8 8 8 8 8 -(NR )-(C=O)-R , -(C=O)-OR , -(C=O)-N(R )2, -OR , -O-(C=O)-OR , -O-(C=O)-N(R )2, -NO2, -N(R )2, 8 8 8 8 (NR )-SO2-R , -S(O)wR , -SO2-N(R )2 або (C1-C6)алкілом; де згаданий (C1-C6)алкіл є необов'язково 9 заміщеним одним, двома, трьома або чотирма R . Сучасні винахідники також виявляють особливу підвищену зацікавленність в таких "B" (C4-C10)циклоалкільних сполуках, а саме, так як вони можуть бути сегреговані відповідно до комбінацій з іншими втіленнями, за якими "X" "циклопентили" або "циклогексили" та/або "Z" втілення є такими, що заслуговують на особливу увагу. Кожне з таких втілень також створює додаткові втілення інтересу з вищеописаними втіленнями "A" кільця. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 2 або Ie), де R є (C1-C6)алкокси, (C1-C6)алкілом, ціано або галогеном. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 2 або Ie), де R є гідрогеном. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 4 або Ie), де R є гідрогеном. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 4 або Ie), де p є два та обидва R взяті разом утворюють оксо. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 4 або Ie), де p є два та кожен R є (C1-C6)алкілом. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де q є нуль. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де Y відсутній. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id або Ie), де Y є -O-. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 7 або Ie), де Y є >C(R )2. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 6 або Ie), де R є (C1-C5)алкіл-(C=O)-. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 6 або Ie), де R є [(C1-C3)алкіл]2N-(C=O)-, де згадані (C1-C2)алкільні зхалишки необов'язково можуть бути взяті разом з атомом нітрогену, до якого вони приєднані, щоб утворити від чотирьох- до шести- членне гетероциклічне кільце. 8 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 6 або Ie), де R є (C1-C5)алкіл-SO2-. Інше втілення за представленим винахідом стосується сполуки формули І (або Ia, Ib, Ic, Id 6 або Ie), де R є (C3-C5)циклоалкіл-SO2-. Інше втілення за представленим винахідом стосуєтьсяa сполуки формули І (або Ia, Ib, Ic, Id 6 або Ie), де R є [(C1-C3)алкіл]2N-SO2-; де згадані (C1-C2)алкільні залишки необов'язково можуть бути взяті разом з атомом нітрогену, до якого вони приєднані, утворюючи чотирьох-шестичленне гетероциклічне кільце. Інше втілення за винаходом також стосується кожної з індивідуальних сполук, описаних як приклади 1-54 в розділі Приклади, даного опису винаходу, та їх фармацевтично прийнятних солей. Конкретні сполуки за винаходом, яким надається перевага, включають: [(3S, 4S)-4-(2'-ціанобіфеніл-4-ілокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; [(3S, 4S)-4-(2'-ціано-4'-флуорбіфеніл-4-ілокси)тетрагідрофуран-3-іл]амід пропан-2сульфонової кислоти; [(3S, 4S)-4-(2',4'-дифлуорбіфеніл-4-ілокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; {(3S, 4S)-4-[4-(5-ціанотіофен-2-іл)-фенокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; {(1S, 2R)-2-[4-(5-ціанотіофен-2-іл)-3-флуорфенокси]циклопентил}-амід пропан-2сульфонової кислоти; {(1S, 2R)-2-[4-(5-ціанотіофен-2-іл)фенокси]циклопентил}амід пропан-2-сульфонової кислоти; {(1S, 2R)-2-[3-флуор-4-(2-метансульфоніламіноетил)фенокси]-циклопентил}амід пропан-2сульфонової кислоти; {(3S, 4S)-4-[5-(2-ціанофеніл)піридин-2-ілокси]тетрагідрофуран-3-іл}амід пропан-2сульфонової кислоти; {(1S, 2R)-2-[6-(2-ціано-4-флуорфеніл)піридин-3-ілокси]циклогексил}амід пропан-2сульфонової кислоти; та {(1S, 2R)-2-[6-(5-ціанотіофен-2-іл)піридин-3-ілокси]циклогексил}амід пропан-2-сульфонової кислоти; або їх фармацевтично прийнятні солі. Інші конкретні сполуки за винаходом та їх фармацевтично прийнятні солі, включають наступні: [4-(4-бензилфенокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; {4-[4-(1-фенілетил)фенокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; {4-[4-(гідроксифенілметил)фенокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; [4-(4-бензоїлфенокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; [4-(4-феноксиметилфенокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; {4-[4-(піролідин-1-карбоніл)фенокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; {4-[3-флуор-4-(2-оксопіролідин-1-ілметил)фенокси]тетрагідро-фуран-3-іл}амід пропан-2сульфонової кислоти; {4-[4-(1,1-діоксо-1лямбда*6*-ізотіазолідин-2-ілметил)фенокси]-тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; [4-(4-феноксифенокси)тетрагідрофуран-3-іл]амід пропан-2-сульфонової кислоти; N-{4-[4-(пропан-2-сульфоніламіно)тетрагідрофуран-3-ілокси]-феніл}бензамід; {4-[4-(2-оксопіролідин-1-іл)фенокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; 2-[2-флуор-4-(тетрагідрофуран-3-ілокси)феніл]ізотіазолідин 1,1-діоксид; сполука з амідом пропан-2-сульфонової кислоти; N-[4-(2'-ціанобіфеніл-4-ілокси)тетрагідрофуран-3-іл]метансульфонамід; 3-[4-(2'-ціанобіфеніл-4-ілокси)тетрагідрофуран-3-іл]-1,1-диметилсульфонілсечовина; {4-[5-(2-ціанофеніл)піридин-2-ілокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти; та {4-[5-(2-ціанофеніл)піримідин-2-ілокси]тетрагідрофуран-3-іл}амід пропан-2-сульфонової кислоти. Сполуки формули І та їх фармацевтично прийнятні солі є придатними для лікування ряду неврологічних та психічних розладів, пов'язаних з дисфункцією глутамату, включаючи: гострі 9 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 неврологічні та психічні розлади, такі як церебральні дефіцити, що є результатом кардіохірургічного шунтування та пересадки тканин, напад, церебральна ішемія, травма спинного мозку, травма голови, перинатальна гіпоксія, зупинка серця, гіпоглікемічне нейронне пошкодження, деменція (включаючи СНІД-індуковану деменцію), хвороба Альцгеймера, хорея Гентінгтона, бічний аміотрофічний склероз, очні ушкодження, ретинопатія, когнітивні розлади, ідіопатична та викликана лікарськими засобами хвороба Паркінсона, м'язові спазми та розлади, пов'язані з м'язовою спастичністю, включаючи тремор, епілепсія, судоми, мігрень (у тому числі мігрень як головний біль), нетримання сечі, толерантність до психоактивних речовин, абстиненція (включаючи речовини, такі як, опіати, нікотин, тютюнові вироби, алкоголь, бензодіазепіни, кокаїн, седативні, снодійні і т.д.), психоз, шизофренія, неспокій (у тому числі генералізований тривожний розлад, соціальний тривожний розлад, панічний розлад, посттравмвтичний стесовий розлад і обсесивно-компульсивний розлад), розлади настрою (у тому числі депресія, манія, біполярні розлади), невралгія трійчастого нерва, зниження слуху, шум у вухах, макулярна дегенерації очей, блювота, набряк мозку, біль (включаючи гострі й хронічні больові стани, сильний біль, невизначений біль, невропатичний біль і посттравматичний біль), пізня дискінезія, розлади сну (включаючи нарколепсію), синдром дефіциту уваги/гіперактивності, розлад дефіциту уваги та розлади поведінки. Відповідно, в одному з втілень винахід передбачає спосіб лікування стану у ссавця, такого як людина, виьраного з станів зазначених вище, за яким ссавцю вводять ефективну кількість сполуки формули І або її фармацевтично прийнятної солі. Ссавцем є переважно ссавець, який потребує такого лікування або профілактики. Термін "лікування", як використано тут, якщо не вказано інше, означає обернення, полегшення, модулювання, інгібування прогресування, або попередження розладу або стану, до якого такий термін застосовують, або одного або більше симптомів такого розладу або стану. Термін "лікування", як використано тут, якщо не вказано інше, також стосується дії лікування, де "лікування" визначено безпосередньо вище. Як приклад, винахід передбачає спосіб лікування стану, вибраного з мігрені, тривожні розлади, шизофренію та епілепсію. Прикладами тривожних розладів є генералізований тривожний розлад, соціальний тривожний розлад, панічний розлад, посттравмвтичний стесовий розлад і обсесивно-компульсивний розлад. Як інший приклад, винахід передбачає спосіб лікування депресії, вибраний з великого депресивного розладу, хронічної депресії (дистимія), сезонної депресії (сезонний емоційний розлад), психотична депресія та післяпологова депресія. Як інший приклад, винахід передбачає спосіб лікування розладу сну, вибраний з безсоння та позбавлення сну. В іншому втіленні винахід включає способи лікування стану у ссавця, такого як людина, за яким ссавцю вводять ефективну кількість сполуки формули І або її фармацевтично прийнятної солі, де стан є вибраним з групи, що складається з атеросклеротичних серцево-судинних захворювань, цереброваскулярних захворювань та захворювань периферійних артерій. Ссавцем є переважно ссавець, що потребує такого лікування чи профілактики. Інші стани, які можуть лікувати у відповідності до представленого винаходу включають гіпертензію та ангіогенез. В іншому втіленні представлений винахід передбачає способи лікування неврологічних та психічних розладів, пов'язаних з дисфункцією глутамату, за яким ссавцю, переважно ссавцю, що цього потребує, вводять сполуку формули І або її фармацевтично прийнятну сіль в кількості, що є ефективною для лікування таких розладів. Сполука формули І або її фармацевтично прийнятна сіль або її фармацевтично прийнятна сіль необов'язково застосовують в комбінації з іншим активним агентом. Такий активний агент може бути, наприклад, атиповим антипсихотичним або AMPA потенціюючим засобом. Відповідно, інше втілення за винаходом передбачає способи лікування неврологічних та психічних розладів, пов'язаних з дисфункцією глутамату, за якими ссавцю вводять ефективну кількість сполуки формули І або її фармацевтично прийнятної солі та далі вводять інший активний агент. Як використано тут, термін "інший активний агент" стосується будь-якого терапевтичного агенту, іншого ніж сполука формули (I) або її сіль, що є придатним для лікування предметного розладу. Приклади додаткових терапевтичних агентів включають антидепресанти, антипсихотичні агенти, агенти проти болю, проти хвороби Альцгеймера та антитривожні агенти. Приклади конкретних класів антидепресантів, які можуть застосовувати в поєднанні зі сполуками за винаходом, включають інгібітори зворотного захоплення норепінефрину, селективні інгібітори зворотного захоплення серотоніну (SSRI), антагоністи NK-1 рецептору, інгібітори моноаміноксидази (MAOI), оборотні інгібітори моноаміноксидази (RIMA), інгібітори 10 UA 102310 C2 5 10 15 20 25 30 35 40 зворотного захоплення серотоніну та норепінефрину (SNRI), антагоністи кортикотропін-рилізинг фактору (CRF), антагоністи α-адренорецептору та атипові антидепресанти. Прийнятні інгібітори зворотного захоплення норепінефрину включають трициклічні третинні аміни та трициклічні вторинні аміни. Приклади прийнятних трициклічних третинних амінів та трициклічних вторинних амінів включають амітриптилін, кломіпрамін, доксепін, іміпрамін, триміпрамін, дотієпін, бутриптилін, іприндол, лофепрамін, нортриптилін, протриптилін, амоксапін, дезипрамін та мапротилін. Приклади прийнятних селективних інгібіторів зворотного захоплення серотоніну включають флуоксетин, флувоксамін, пароксетин та сертралін. Приклади інгібіторів моноаміноксидази включають ізокарбоксазид, фенелзин та транілциклопрамін. Приклади прийнятних оборотніх інгібіторів моноаміноксидази включають моклобемід. Приклади прийнятних для застосування в представленому винаході інгібіторів зворотного захоплення серотону та норепінефрину включають венлафаксин. Приклади прийнятних атипових антидепресантів включають бупропіон, літій, нефазодон, тразодон та вілоксазин. Приклади агентів проти хвороби Альцгеймера включають дімебон, антагоністи NMDA рецептору, такі як мемантин; та інгібітори холін естерази, такі як донепезил та галантамін. Приклади прийнятних классів антитревожних агентів, які можуть застосовувати в поєднанні зі сполуками за винаходом, включають бензодіазепіни та агоністик або антагоністи серотоніну 1A (5-HT1A), зокрема 5-HT1A часткові агоністи, та антагоністи кортикотропін-рилізинг фактору (CRF). Прийнятні бензодіазепіни включають алпразолам, хлордіазопоксид, клоназепам, хлоразепат, діазепам, галазепам, лоразепам, оксазепам та празепам. Прийнятні агоністи або антагоністи 5HT1A рецептору включають буспірон, флесіноксан, гепірон та іпсапірон. Прийнятні атипові антипсихотичні агенти включають паліперідон, біфепрунокс, зіпразідон, рисперідон, арипіпразол, оланзапін та кветіапін. Прийнятні агоністик нікотин ацетилхоліну включають ізпрониклін, варениклін та MEM 3454. Агенти проти болю включають прегабалін, габапентин, клонідин, неостігмін, баклофен, мідазолам, кетамін та циконотид. Винахід також стосується фармацевтичних композицій, що містять сполуку формули І або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій. Детальний опис винаходу Сполук формули І можуть одержувати способами, описаними нижче, разом зі синтетичними способами, відомими з рівня техніки в галузі органічної хімії, або модифікацією та одержанням похідних, що є добре відомими для кваліфікованого фахівця в даній галузі з рівня техніки. Протягом будь-якого з наступних циклів синтезу може бути необхідним та/аьо бажаним захистити чутливі або реакційно здатні групи в будь-якій з молекул, що розглядаються. Це може досягатися за допомогою традиційних захисних груп, таких як ті, що описані в T. W. Greene, Protective Groups in Organic Chemistry, John Wiley & Sons, 1999, що тут входить як посилання. Як зрозуміло спеціалісту, застосування формули I є перевагою та, зрозуміло, що винахід включає кожну та будь-які категорії, що підпадають нижче, як, незважаючи на індивідуально сформульовані тут. Таким чином, винахід розглядає кожну категорію окремо та будь-які й всі 1 11 комбінації таких категорій. Більш конкретно, на схемі, що наведена далі, R через R , m, n, p, q, s, t, w, A, B, X, Y та Z є такими, як визначено вище. Схема 1 11 UA 102310 C2 R3 R6 HN L2 R5 t(H2C) (CH2)s X (R4)p III (R2)m L1 R3 B HN R6 Z R5 t(H2C) (R4)p (CH2)s X II (R1)n (R2)m A Y (C(R7 )2)q R3 B HN R6 Z R5 I t(H2C) (R4)p 5 10 Схема 1 стосується одержання сполуки формули I. Посилаючись на схему 1, an арил 1 галогенід формули II, де L є йодом, бромом або трифлатом, можуть сполучати з прийнятною 1 заміщеною арил бороновою кислотою структурної формули (R )n-ArB(OH)2, де Ar представляє собою прийнятну заміщену арильну або гетероарильну групу та B є бором, за стандартними умовами реакції кросс-сполучення, яка каталізується паладієм, що є добре відомими кваліфікованому фахівцю в даній галузі з рівня техніки, що забезпечує одержання сполуки формули І. [Suzuki, A., Journal of Organometallic Chemistry, 576, 147-169 (1999), Miyaura and Suzuki, Chemical Reviews, 95, 2457-2483 (1995).] Сполук формули ІІ можуть одержувати зі 2 2 сполук формули ІII шляхом заміщенням L , де L може бути галогеном, -OSO2CH3 (-OMs), або OSO2CF3 (-OTf), реагентом (R2)m L1 15 (CH2)s X B ZH де Z є O або S. Реакцію проводять за типовими умовами в органічному розчиннику, такому як ацетонітрил, в присутності основи, такої як цезію карбонат, при підвищеній температурі, такій як 150C. У випадку, коли Z є S продукт II або I далі можуть окиснювати до одержання >S=O або >SO2 реагентом, таким як пероксид (такий як mCPBA) в розчиннику, такому як метиленхлорид при кімнатній температурі. 2 Альтернативно, сполука формули ІII може бути перетворена у сполуку формули ІI, де L є 12 UA 102310 C2 ZH та Z є O або S, нуклеофільним ароматичним заміщенням (таким як реакцією з арилоловоом, таким як SnAr) реакцією з відповідно заміщеним арильним реагентом (R2)m L1 B L2 2 5 10 15 20 25 30 35 40 45 50 де L є галогеном або -OSO2CF3 (-OTf) відповідно до способів аналогічних тим, що описані в Withbroe, G. J.; Singer, R. A.; Sieser, J. E. "Streamlined Synthesis of the Bippyphos Family of Ligands and Cross-Coupling Applications" Org. Process Res. Dev. 2008, 12, 480-489. Реакцію проводять за типовими умовами в органічному розчиннику, такому як етанол, в присутності основи, такої як калію гідроксид, каталізатора, такого як палладій (зокрема Pd2(dba)3), та ліганду, такого як 1-[2-[біс(трет-бутил)фосфіно]феніл]-3,5-дифеніл-1H-піразол (біппіфос), при підвищеній температурі, такій як 80C. 1 Альтернативно, сполуку формули І можуть одержувати зі сполуки формули ІI, де L є силільною групою (такою як триметилсиліл) спочатку перетворенням силільної групи в галогенідну, таким як реакцією з галогенуючим реагентом, таким як калію бромід/Nхлорсукцинімід (NCS) в присутності кислоти (такої як оцтова кислота) з наступним арилюванням як описано вище. Прийнятні розчинники для галогенування включають спирти, такі як метанол або етанол. Реакцію можуть проводити при температурі від близько 10 °C до близько 60 °C протягом близько 10 до близько 120 хвилин. 7 Альтернативно, сполуку формули І, де q є нуль та Y є O або NR , можуть одержувати 1 реакцією сполуки формули ІI, де L є NH2 або OH, з арилгалогенідом в присутності каталізатору. Альтернативно, коли q є два або три, кваліфікованому фахівцю в даній галузі з рівня техніки буде зрозуміло, що ряд реакцій сполучення двох прийнятно функціоналізованих алкільних груп може давати сполуку формули І. Такі реакції є в межах рівня техніки, відомого кваліфікованому фахівцю. Сполуку формули ІI можуть одержувати зі сполуки формули ІII сполученням прийнятно заміщеного арила Грін'яра в екерному розчиннику, такому як ТГФ при температурі від близько -30C до близько кімнатної температури. Каталізатор, такий як паладій або купрум, можуть полегшувати проходження реакції. Сполук формули ІII є комерційно доступними або можуть бути одержані способами добре відомими кваліфікованому фахівцю в даній галузі з рівня техніки або можуть бути одержані загальноприйнятними способами, відомими з рівня техніки (такими як ті способи, що розкриті в типових довідкових книгах, таких як COMPENDIUM OF ORGANIC SYNTHETIC METHODS, Vol. IVI (виданий Wiley-Interscience)). Сполуки формули І можуть бути розділені на енантіомерно чисті ізомери, використовуючи способи, добре відомі кваліфікованому спеціалісту в даній галузі з рівня техніки, та детально описані тут в розділі Приклади. Сполуки за даним винаходом можуть застосовувати в формі солей, похідних неорганічних або органічних кислот. Кислотні адитивні солі основних сполук за даним винаходом легко одержують обробкою основної сполуки по суті еквівалентною кількістю вибраної мінеральної або органічної кислоти у водному середовищи розчинника або прийнятного органічного розчинника, такого як метанол або етанол. При обережному випаровуванні розчинника одержують бажану сіль у вигляді твердої речовини. Основні солі можуть легко одержувати обробкою відповідних кислих сполук водним розчином, що містить бажані фармацевтично прийнятні катіони, та далі випаровуючи одержаний в результаті розчин до суха, переважно при зниженому тиску. Альтернативно, також їх можуть одержувати змішуванням разом нижчого алканольного розчину кислотної сполуки та бажаного алкоксиду лужного металу, та далі випаровуючи одержаний в результаті розчин до суха тим же способом як і раніше. В кожному випадку переважно використовують стехіометричні кількості реагентів з метою забезпечення повноту проходження реакції та одержання продукту з максимальним виходом. Коли сіль призначена для введення пацієнту (в порівнянні, наприклад, із застосуванням in vitro), сіль переважно є фармацевтично прийнятною. Термін "фармацевтично прийнятна сіль" стосується солі, яка одержана сполученням сполуки формули І з кислотою, чий аніон, або основою, чий катіон, в цілому вважається прийнятним для споживання людиною. Фармацевтично прийнятні солі є особливо корисними як продукти способу представленого 13 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 винахіду, тому що вони мають більшу розчинність у воді в порівнянні з вихідною сполукою. Для застосування в медицині солі сполук за даним винаходом є нетоксичними "фармацевтично прийнятними солями.” Типово, сполуку за винаходом вводять в кількості ефективній для лікування або попередження стану, як описано тут. Сполуки за винаходом вводять будь-яким прийнятним способом у формі фармацевтичної композиції придатної для такого способу, та в дозі ефективній для лікування або попередження стану. Терапевтично ефективні дози сполуки необхідні для лікування або попередження прогресування медичного стану легко встановлюються кваліфікованим фахівцем в даній галузі з рівня техніки, використовуючи доклінічні та клінічні підходи знайомі медичним фахівцям. Сполуки за винаходом можуть вводити перорально. Пероральне введення може включати проковтування, таким чином сполуку вводять в шлунково-кишковий тракт, або можуть застосовувати букальне або сублінгвальне введення, за яким сполуку вводять в ток крові безпосередньо з рота. В іншому втіленні сполуку за винаходом можуть вводити безпосередньо в ток крові, в м'яз або у внутрішній орган. Прийнятний спосіб для парентерального введення включає внутрішньовенне, внутрішньоартеріальне, внутрішньочеревне, інтратекальне, внутрішньошлуночкове, внутрішньоуретральне, внутрішньогрудинне, внутрішньочерепне, внутрішньом'язове та підшкірне. Прийнятні інструменти для парентерального введення включають голкові (включаючи мікроголкові) шприці, безголкові шприці та пристрої для інфузій. В іншому втіленні сполуки за винаходом можуть вводити місцево на шкіру або слизову, яке є дермальним або трансдермальним введенням. В іншому втіленні сполуки за винаходом можуть вводити інтраназально або інгаляційно. В іншому втіленні сполуки за винаходом можуть вводити ректально або вагінально. В іншому втіленні сполуки за винаходом можуть вводити безпосередньо в око або у вухо. Режим дозування для сполук та/або композицій, що містять сполуки, ґрунтується на різних факторах, включаючи тип, вік, вагу, стать та медичний стан пацієнта; важкість стану; шлях введення; та активність конкретної сполуки, що застосовують. Таким чином, режим дозування може широко варіювати. Рівні дозування порядку від близько 0,01 мг до близько 100 мг на кілограм ваги тіла на день є придатною для лікування або попередженні вищезазначених станів. В одному з втілень загальна денна доза сполуки за винаходом (введена одноразово або розділена на дози) є, як правило, від близько 0,01 до близько 100 мг/кг. В іншому втіленні загальна денна доза сполуки за винаходом становить від близько 0,1 до близько 50 мг/кг, та в іншому втіленні – від близько 0,5 до близько 30 мг/кг (тобто, мг сполуки за винаходом на кг ваги тіла). В одному з втілень дозування становить від 0,01 до 10 мг/кг/день. В іншому втіленні дозування становить від 0,1 до 1,0 мг/кг/день. Дозована одинична композиція може містити такі їх кількості або одиниці частки, що складають денну дозу. В багатьох випадках, введення сполуки повторюватимуть декілька разів на день (як правило, не більше ніж 4 рази). Багаторазові дози на день, як правило, можуть застосовувати для підвищення загальної денної дози, якщо це бажано. Для перорального введення, композиції можуть передбачатися у формі таблеток, що містять 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 75,0, 100, 125, 150, 175, 200, 250 або 500 міліграм активного інгредієнту для симптоматичного регулювання дози для пацієнта. Лікарський засіб, як правило, містить від близько 0,01 мг до близько 500 мг активного інгредієнту, або в іншому втіленні – від близько 1 мг до близько 100 мг активного інгредієнту. Внутрішньовенозно, дози можуть знаходитися в діапазоні від близько 0,1 до близько 10 мг/кг/хвилину протягом постійної швидкості інфузії. Прийнятні суб'єкти за представленим винахідом включають суб'єкти-ссавці. Ссавці за представленим винахідом включають, але не обмежуються цим, собачих, котячих, велику рогату худобу, кіз, коней, овець, свиней, гризунів, зайцеподібних, приматів, тощо, та охоплюють савців внутрішньоутробно. В одному з втілень люди є прийнятними суб'єктами. Суб'єкти люди можуть бути будь-якої статі та на будь-якій стадії розвитку. В іншому втіленні винахід включає застосування однієї або більше сполук за винаходом для виготовлення лікарського засобу для лікування або попередження станів, зазначених тут. Для лікування або попередження станів, згаданих вище, сполуку за винаходом можуть вводити як сполуку саму по собі. Альтернативно, фармацевтично прийнятні солі сполук є прийнятними для медичного застосування, тому що вони мають більшу розчинність у воді в порівнянні з вихідними сполуками. В іншому втіленні представлений винахід включає фармацевтичні композиції. Такі фармацевтичні композиції містять сполуку за винаходом або її фармацевтично прийнятну сіль 14 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 представлену з фармацевтично прийнятним носієм. Носій може бути твердим, рідким або і тим і іншим, та його можуть формулювати зі сполукою як одиничну дозовану композицію, наприклад, таблетку, яка може містити від 0,05 % до 95 % за масою активних сполук. Сполуку за винаходом можуть сполучати з прийнятними полімерами як наведеними носіями лікарських засобів. Інші фармацевтично активні речовини також можуть бути присутні. Сполуки за представленим винахідом та їх фармацевтично прийнятні солі можуть вводити будь-яким прийнятним способом, переважно у формі фармацевтичної композиції, придатній для такого способу та в дозі ефективній для лікування або попередження стану. Активні сполуки, їх фармацевтично прийнятні солі та композиції, наприклад, можуть вводити перорально, ректально, парентерально або місцево. Пероральне введення твердої дозованої форми може бути, наприклад, представлене окремими одиницями, такими як тверді або м'які капсули, драже, крохмальні капсули, пастилки для розсмоктування, або таблетки, кожна з яких містить обумовлену кількість щонайменш однієї сполуки за представленим винахідом або її фармацевтично прийнятної солі. В іншому втіленні пероральне введення може здійснюватися в формі порошку або гранул. В іншому втіленні пероральна дозована форма є сублінгвальною, така як наприклад, пастилки для розсмоктування. В таких твердих дозованих формах, сполуки формули І або їх фармацевтично прийнятні солі, як правило, комбінують з одним або більше ад'ювантом. Такі капсули або таблетки можуть містити склад з контрольованим вивільненням. У випадку капсул, таблеток та драже, дозовані форми також можуть містити буферні агенти або можуть виготовлятися з кишковорозчинними покриттями. В іншому втіленні пероральне введення може бути в рідкій дозованій формі. Рідкі дозовані форми для перорального введення включають, наприклад, фармацевтично прийнятні прийнятні емульсії, розчини, суспензії, сиропи та еліксири, що включають інертні розріджувачі, які звичайно використовують в рівні техніки (наприклад, вода). Такі композиції також містять ад'юванти, такі як зволожуючі, емульгуючі, суспендуючі, корегуючі смак (наприклад, підсоложуючі), та/або ароматизуючі агенти. В іншому втіленні представлений винахід включає парентеральну дозовану форму. "Парентеральне введення" включає, наприклад, підшкірні ін'єкції, внутрішньовенні ін'єкції, внутрішньочеревні ін'єкції, внутрішньом'язові ін'єкції, внутрішньогрудинні ін'єкції та інфузії. Ін'єкційнй лікарські засоби (наприклад, стерильні ін'єкційні водні або олійні суспензії) можуть формулювати за відомими з рівня техніки способами, використовуючи прийнятні диспергуючі, зволожуючі агенти та/або суспендуючі агенти. В іншому втіленні представлений винахід включає дозовані форми для місцевого введення. "Місцеве введення" включає, наприклад, трансдермальне введення, таке як за допомогою трансдермального пластирю або іонофорезних пристроїв, внутрішньоочне введення, або інтраназальне або інгаляційне введення. Композиції для місцевого введення також включають, наприклад, місцеві гелі, спреї, мазі та креми. Склади для місцевого введення можуть включати сполуку, яка підвищує абсорбцію або проеикнення активного інгредієнту через шкіру або інші вражені місця. Коли сполуки за даним винаходом та їх фармацевтично прийнятні солі вводять за допомогою трансдермального пристрою, введення виконуватимуть, використовуючи пластир або резервентного та пористо мембранного типу, або твердого матричного ряду. Типові склади для досягнення цієї мети включають гелі, гідрогелі, лосьйони, розчини, креми, мазі, присипки, пов'язки, піни, плівки, пластирі для шкіри, коржі, імплантанти, губки, волокна, бинти та мікроемульсії. Також можуть застосовувати ліпосоми. Типові носії включають спирт, воду, мінеральну олію, рідкий вазелин, білий вазелин, гліцерин, поліетиленгліколь та пропіленгліколь. Підсилювачі проникнення можуть включати в композицію - дивись, наприклад, J Pharm Sci, 88 (10), 955-958, Finnin and Morgan (Жовтень 1999). Склади прийнятні для місцевого введення в очі включають, наприклад, очні краплі, де сполука за даним винаходом або її фармацевтично прийнятна сіль є розчинена або суспендована в прийнятному носію. Типовий склад прийнятний для очного введення або введення у вухо може існувати в формі крапель мікронізованої суспензії або розчину в ізотонічному, pH-скоригованому, стерильному сольовому носію. Інші склади прийнятні для очного та вушного введення включають мазі, склади, що розкладаються біологічно (наприклад, гелеві губки, що розсмоктуються, колаген) та склади, що не розкладаються біологічно (наприклад, силікон), імплантанти, коржі, лінзи та аерозольні або пористі системи, такі як ніосоми або ліпосоми. Полімери, такі як зшита поліакрилова кислота, полівініловий спирт, гіалуронова кислота, целюлозний полімер, наприклад, гідроксипропілметилцелюлоза, гідроксиетилцелюлоза, або метилцелюлоза, або гетерополісахаридний полімер, наприклад, гелеутворюючу камедь, можуть включати разом з консервантами, такими як бензалконію 15 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлорид. Такі склади також можуть вводити іонофорезом. Для інтраназального введення або введення шляхом інгаляції, активні сполуки за винаходом або їх фармацевтично прийнятні солі звичайно доставляють у формі розчину або суспензії з балончика з насосом, яка є стиснута або накачена пацієнтом, або як аерозольно спреєву лікарську форму з балончика під тиском або інгалятора, з використанням прийнятного пропелента. Композиції прийнятні для інтраназального введення, як правило, вводять в формі сухого порошку (або самостійно, як суміш, наприклад, в сухій суміші з лактозою, або як змішані частинки компонентів, наприклад, змішані з фосфоліпідами, такими як фосфатидилхолін) з сухого порошкового інгалятору або як аерозольного спрею з балончика під тиском, з насосом, спреєм, розпилювачем (переважно розпилювач, що використовує електрогідродинаміку для одержання дрібнодисперсного туману), або інгалятору, з або без застосування прийнятного пропеленту, такого як 1,1,1,2-тетрафлуоретан або 1,1,1,2,3,3,3-гептафлуорпропан. Для інтраназального застосування, порошок може містити біоадгезивний агент, наприклад, хітозан або циклодекстрин. В іншому втіленні представлений винахід включає ректальну дозовану форму. Така ректальна дозована форма може бути в формі, наприклад, супозиторію. Масло какао є традиційною основою, але можуть використовуватися, як відповідні, різні варіанти. Інші матеріали носія та способи введення, що є відомими в фармацевтичній галузі з рівня техніки, також можуть бути використані. Фармацевтичні композиції за винаходом можуть виготовляти будь-яким добре відомим у фармацевтиці способом, таким як ефективна формуляція та способи введення. Наведені вище аспекти щодо ефективних формуляцій та способів введення є добре відомими в даній галузі з рівня техніки та описані в загальноприйнятих підручниках. Формуляція лікарських засобів обговорюється, наприклад, в Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania, 1975; Liberman, et al., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; rd and Kibbe, et al., Eds., Handbook of Pharmaceutical Excipients (3 Ed.), American Pharmaceutical Association, Washington, 1999. Сполуки за представленим винахідом та їх фармацевтично прийнятні солі можуть застосовувати самостійно або в поєднанні з іншими терапевтичними агентами в лікуванні або попередженні різних станів або захворювань різних стадій. Сполука(и) за представленим винаходом, їх фармацевтично прийнятні солі та інший(і) терапевтичний(і) агент(и) можуть вводити одночасно (або в одній дозованій формі або в окремих дозованих формах) або послідовно в будь-якому порядку. Прикладом терапевтичного агенту може бути, наприклад, агоніст метаботропного глутаматного рецептору. Введення двох або більше сполук "в комбінації" означає, що дві сполуки вводять досить близько по часу, так що наявність однієї змінює біологічні активності інших. Дві або більше сполуки можуть вводити одночасно, паралельно або послідовно в будь-якому порядку. До того ж, одночасне введення можуть виконувати змішуванням сполук до введення або введенням сполук в той же момент часу, але в різних анатомічних місцях або використовуючи різні шляхи введення. Вирази "паралельне введення", "спів-введення", "одночасне введення", та "вводять одночасно" означають, що сполуки вводять в комбінації. Представлений винахід надалі включає набори, що є прийнятними для застосування у виконанні способів лікування або попередження станів, описаних вище. В одному з втілень набір включає першу дозовану форму, що містить одну або більше сполук за представленим винахідом або їх фармацевтично прийнятних солей, та контейнер для дозування, в кількостях достатніх для виконання способів за представленим винаходом. В іншому втіленні набір за представленим винахідом включає одну або більше сполук за винаходом або їх фармацевтично прийнятні солі. Три сполуки за винаходом піддавали визначенню структури способом рентгеноструктурного аналізу монокристалу, для встановлення їх абсолютної стереохімії. Кристалографічні данні наведено нижче. Проводили дослідження зразків кристалів (дивись нижче характеристики набору данних та дифрактометри, що використовували при досліджені індивідуальних сполук). Пари Фріделя (Friedel) збирали з метою полегшення визначення абсолютної конфігурації. Фактори атомногог розсіювання брали з Міжнародних Таблиць по Кристалографії (International Таблиця s for Crystallography), Vol. C, pp. 219, 500, Kluwer Academic Publishers, 1992. Всі кристалографічні розрахунки виконували за допомогою SHELXTL системи, Версія 5.1, Bruker AXS, 1997. Всі дифрактометричні дані збирали при кімнатній температурі. Відповідні кристали, зібрані данні та їх обробка підсумовані в таблиці I для кожної сполуки. 16 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пробну структуру одержували прямими способами для кожної сполуки. Ці пробні структури оптимізовували за стандартними методиками. Положення гідрогену розраховували коли це було можливим. Гідрогени метилу розміщували за методиками різниці Фур'є (Fourier) та потім ідеалізували. Будь-які гідрогени при атомі нітрогену розташовували за методиками різниці Фур'є та проводили оптимізацію. Параметри гідрогену додавали до структурного фактору розрахунків, але не оптимізували. Розраховані зсуви в кінцевих циклах за методом найменших квадратів були всі менші ніж 0,1 відповідних стандартних відхилень. Кінцеві R-індекси надані для кожної структури. Кінцева різниця Фур'є не виявила відсутність або неправильне розташування електронної щільності для будь-якої з цих структур. Абсолютні конфігурації визначали за методом Flack, Acta Crystallogr., 1983 A39, 876. Координати, анізотропні температурні фактори, відстані та кути наведені нижче (таблиці 1-5) для кожної структури. Експериментальні методики Експерименти, як правило, проводили в інертній атмосфері (азот або аргон), зокрема у випадках, коли використовували оксиген- або залишок-чутливі реагенти або проміжні сполуки. Комерційно доступні розчинники або реагенти, як правило використовували без подальшого очищення, включаючи придбані безводні розчинники (як правило, продукти торгової марки SureTM Seal від компанії Aldrich Chemical Company, Milwaukee, Wisconsin). Дані мас-спектрометрії надаються з приборних даних або рідинної хроматографії – мас-спектрометрії (РХМС), хімічної іонізації при атмосферному тиску (ХІАТ) або газової хроматографії – мас-спектрометрії (ГХМС). Хімічний зсув для данних ядерно-магнітного резонансу (ЯМР) виражений в одиницях мільйонної частки (м.ч., δ) відносно залишкових сигналів від застосованих дейтерованих розчинників. Для синтезів, що зазначаються в інших прикладах, одержаннях або способах, реакційні умови (тривалість реакції та температура) можуть варіювати. Як правило, проходження реакції контролювали за допомогою тонко шарової хроматографії або мас-спектрометрії, та коли необхідно, піддавали відповідній дії. Якщо в сирій реакційній суміші присутні тверді речовини, що не були продуктом, то могли застосовувати фільтрування через Celite®. Способи очищення можуть змінюватися в залежності від експерименту: як правило, розчинники або співвідношення розчинників, що застосовують для елюєнтів/градієнтів, вибирали, щоб забезпечити відповідний Rf або час утримання. Одержання 1 Синтез цис-N-{4-[(6-бромпіридин-3-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду Стадія 1. Синтез транс-4-[(6-бромпіридин-3-іл)окси]тетрагідрофуран-3-олу. Названу сполуку стадії 1 одержували за загальною методикою для синтезу транс-4-(4бромфенокси)тетрагідрофуран-3-олу в прикладі 2, за виключенням того, що 6-бромпіридин-3-ол використовували замість 4-бромфенолу, та сирий продукт очищували способом хроматографії на силікагелі (Градієнт: від 20 % до 70 % етилацетату в гептані). Вихід: 5,24 г, 20,2 ммоль, 61 %, 1 H ЯМР (500 МГц, CDCl3) δ 3,79 (дд, J=9,9, 1,9 Гц, 1H), 3,87 (дд, J=10,4, 1,8 Гц, 1H), 4,00 (дд, J=9,9, 4,3 Гц, 1H), 4,19 (дд, J=10,4, 4,7 Гц, 1H), 4,38 (ш м, 1H), 4,59 (ш с, 1H), 4,68 (ш д, J=4,4 Гц, 1H), 7,14 (дд, J=8,7, 3,2 Гц, 1H), 7,32 (дд, J=8,7, 0,5 Гц, 1H), 8,01 (ш д, J=3,1 Гц, 1H). Стадія 2. Синтез транс-4-[(6-бромпіридин-3-іл)окси]тетрагідрофуран-3-ілметансульфонат. Названу сполуку стадії 2 одержували за загальною методикою для синтезу транс-2-(4бромфенокси)циклопентилметансульфонату в прикладі 5, за виключенням того, що транс-4-[(6бромпіридин-3-іл)окси]тетрагідрофуран-3-ол використовували замість транс-2-(4бромфенокси)циклопентанолу. Продукт одержували у вигляді твердої речовини. Вихід: 5,95 г, 1 17,6 ммоль, 87 %, H ЯМР (400 МГц, CDCl3) δ 3,07 (с, 3H), 3,94 (ш дд, J=10,5, 1,8 Гц, 1H), 4,00 (м, 1H), 4,11 (дд, J=11,1, 4,1 Гц, 1H), 4,18 (дд, J=10,6, 4,5 Гц, 1H), 4,97 (ш д, J=4,4 Гц, 1H), 5,13 (ш д, J=3,8 Гц, 1H), 7,19 (дд, J=8,7, 3,2 Гц, 1H), 7,35 (дд, J=8,7, 0,5 Гц, 1H), 8,04 (дд, J=3,2, 0,5 Гц, 1H). Стадія 3. Синтез цис-N-{4-[(6-бромпіридин-3-іл)окси]тетрагідро-фуран-3-іл}пропан-2сульфонаміду. Транс-4-[(6-бромпіридин-3-іл)окси]тетрагідрофуран-3-ілметансульфонат (591,7 мг, 1,75 ммоль), пропан-2-сульфонамід (647 мг, 5,25 ммоль) та цезію карбонат (855 мг, 2.62 ммоль) додавали в ацетонітрил (8 мл) та піддавали дії мікрохвильового випромінення протягом 55 хвилин при 150 °C. Сиру реакційну суміш об'єднували з декількома подібними реакціями, що перебігали за тих самих умов (загальна вихідна речовина, що використовували: 1,527 г, 4,515 ммоль) та струшували з насиченим водним розчином натрію бікарбонату (100 мл). Водний шар екстрагували етилацетатом, та об'єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували в вакуумі. Залишок очищували способом хроматографії на силікагелі (Градієнт: від 5 % до 40 % етилацетату в гептані), щоб одержати названу сполуку. 17 UA 102310 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Вихід: 382 мг, 1,046 ммоль, 23 %. H ЯМР (400 МГц, CDCl3) δ 1,34 (д, J=6,8 Гц, 3H), 1,36 (д, J=6,8 Гц, 3H), 3,17 (септет, J=6,8 Гц, 1H), 3,74 (дд, J=9, 9 Гц, 1H), 3,94 (дд, J=10,9, 1,5 Гц, 1H), 4,14 (дд, J=8, 8 Гц, 1H), 4,19 (дд, J=10,9, 4,3 Гц, 1H), 4,27 (м, 1H), 4,84 (м, 1H), 5,66 (д, J=9,9 Гц, 1H), 7,20 (дд, J=8,8, 3,2 Гц, 1H), 7,40 (д, J=8,8 Гц, 1H), 8,01 (д, J=3,2 Гц, 1H). Одержання 2 Синтез метил 3-ціано-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)бензоату Стадія 1. Синтез метил 3-ціано-4-{[(трифлуорметил)сульфоніл]-окси}бензоату. Розчин метил 3-ціано-4-гідроксибензоату [дивись P. Madsen et al, J. Medicinal Chemistry 2002, 45, 5755-5775] (4,18 г, 23,6 ммоль) в дихлорметані (81 мл) обробляли 4(диметиламіно)піридином (432 мг, 3,54 ммоль) та охолоджували до 0 °C. Після додавання триетиламіну (4,93 мл, 35,4 ммоль), розчин по краплям обробляли трифлуорметансульфоновим ангідридом (5,96 мл, 35,4 ммоль) та давали нагрітися до кімнатної температури. Через 2 години, реакційну суміш концентрували в вакуумі та повторно обробляли дихлорметаном та концентрували до 17 грам залишкової речовини. Цей залишок піддавали хроматографії на силікагелі (Градієнт: від 0 % до 10 % етилацетату в гептані), щоб одержати 1 продукт у вигляді безбарвної олії. Вихід: 6,50 г, 21,0 ммоль, 89 %. H ЯМР (500 МГц, CDCl3) δ 4,00 (c, 3H), 7,60 (д, J=8,8 Гц, 1H), 8,39 (дд, J=8,8, 2,1 Гц, 1H), 8,45 (д, J=2,2 Гц, 1H). Стадія 2. Синтез сполуки метил 3-ціано-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)бензоату. 4,4,4',4',5,5,5',5'-Октаметил-2,2'-бі-1,3,2-діоксаборолан (біс(пінако-лато)диборон, 5,81 г, 22,9 ммоль), метил 3-ціано-4-{[(трифлуорметил)-сульфоніл]окси}бензоат (5,90 г, 19,1 ммоль), калію ацетат (99 %, 9,46 г, 95,4 ммоль) та 1,1’-[біс(дифенілфосфіно)фероцен]паладію (II) дихлорид (1,40 г, 1,91 ммоль) додавали в дегазований діоксан (83 мл) в товстостінній реакційній колбі. Реакційну суміш запаювали та нагрівали при 100 °C протягом 18 годин, далі обробляли дихлорметаном (100 мл), добре струшували та фільтрували через Celite®. Відфільтрований осад промивали дихлорметаном (2 × 100 мл), та об'єднані фільтрати концентрували в вакуумі та піддавали хроматографії на силікагелі (Градієнт: від 0 % до 30 % етилацетату в гептані). Фракції, що містили продукт, концентрували та піддавали перекристалізації з 2-пропанолу, щоб одержати названу сполуку у вигляді білої твердої речовини. Вихід: 3,395 г, 11,82 ммоль, 62 %. 1 H ЯМР (400 МГц, CDCl3) δ 1,41 (с, 12H), 3,97 (с, 3H), 7,98 (д, J=7,8 Гц, 1H), 8,20 (дд, J=7,8, 1,6 Гц, 1H), 8,35 (ш д, J=1,6 Гц, 1H). Одержання 3 Синтез N-[(1S, 2R)-2-(4-бром-3-флуорфенокси)циклопентил]пропан-2-сульфонаміду Стадія 1. Синтез транс-2-(4-бром-3-флуорфенокси)циклопентанолу. 4-Бром-3-флуорфенол (8,00 г, 41,9 ммоль) та 6-оксабіцикло[3.1.0]гексан (8,25 мл, 95,2 ммоль) додавали в бутиронітрил (5,0 мл) та обробляли карбонатом натрію (4,04 г, 38,1 ммоль). Реакційну суміш піддавали дії мікрохвильового випрмінення протягом 2 годин при 175 °C, далі фільтрували через Celite®. Відфільтрований осад промивали етилацетатом, потім дихлорметаном, та об'єднані фільтрати концентрували при зниженому тиску, одержуючи продукт у вигляді темно коричневої олії. Цю речовину використовували без додаткового 1 очищення. Вихід: 11,59 г, >41,9 ммоль, що є кількісним. H ЯМР (400 МГц, CDCl3) δ 1,61-1,89 (м, 5H), 2,02-2,24 (м, 2H), 4,30 (м, 1H), 4,46 (м, 1H), 6,63 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,73 (дд, J=10,5, 2,8 Гц, 1H), 7,40 (дд, J=8,9, 8,0 Гц, 1H). Стадія 2. Синтез (1R, 2R)-2-(4-бром-3-флуорфенокси)циклопентил ацетату. Названу сполуку на стадії 2 одержували за загальною методикою для синтезу (1R, 2R)-2-(4бромфенокси)циклогексил ацетату в прикладі 7, за виключенням того, що транс-2-(4-бром-3флуорфенокси)-циклопентанол використовували замість транс-2-(4-бромфенокси)циклогексанолу. Менш полярна речовина з хроматографічного очищення на силікагелі забезпечувала (1R, 2R)-2-(4-бром-3-флуорфенокси)-циклопентил ацетат у вигляді олії. Вихід: 1 6,42 г, 20,2 ммоль, 48 % за 2 стадії. H ЯМР (400 МГц, CDCl3) δ 1,67-1,75 (м, 1H), 1,79-1,92 (м, 3H), 2,05-2,20 (м, 2H), 2,08 (с, 3H), 4,60 (м, 1H), 5,14 (м, 1H), 6,66 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,78 (дд, J=10,5, 2,8 Гц, 1H), 7,40 (дд, J=8,8, 8,1 Гц, 1H). Стадія 3. Синтез (1R, 2R)-2-(4-бром-3-флуорфенокси)циклопентанолу. Названу сполуку на стадії 3 одержували за загальною методикою для синтезу (1R, 2R)-2-(4бромфенокси)циклогексанолу в прикладі 7, за виключенням того, що (1R, 2R)-2-(4-бром-3флуорфенокси)циклопентил ацетат використовували замість (1R, 2R)-2-(4бромфенокси)циклогексил ацетату. Продукт одержували у вигляді жовтої олії. Вихід: 5,29 г, 19,2 1 ммоль, 95 %. H ЯМР (500 МГц, CDCl3) δ 1,62-1,68 (м, 2H), 1,71-1,90 (м, 3H), 2,04-2,11 (м, 1H), 2,15-2,22 (м, 1H), 4,30 (м, 1H), 4,47 (м, 1H), 6,63 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,73 (дд, J=10,5, 2,8 Гц, 1H), 7,40 (дд, J=8,9, 8,1 Гц, 1H). 18 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 4. Синтез (1R, 2R)-2-(4-бром-3-флуорфенокси)циклопентил метансульфонату. Названу сполуку на стадії 4 одержували за загальною методикою для синтезу транс-2-(4бромфенокси)циклопентилметансульфонату в прикладі 5, за виключенням того, що (1R, 2R)-2(4-бром-3-флуор-фенокси)циклопентанол використовували замість транс-2-(4бромфенокси)циклопентанолу. Продукт одержували у вигляді олії, яку використовували в 1 наступній стадії без очищення. МС (ГХМС) m/z 352, 354 (M+1). H ЯМР (500 МГц, CDCl3) δ 1,812,00 (м, 4H), 2,16-2,26 (м, 2H), 3,04 (с, 3H), 4,77 (м, 1H), 5,07 (м, 1H), 6,65 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,74 (дд, J=10,2, 2,8 Гц, 1H), 7,43 (дд, J=8,9, 8,0 Гц, 1H). Стадія 5. Синтез (1R, 2S)-2-азидоциклопентил 4-бром-3-флуорфенілового етеру. Названу сполуку на стадії 5 одержували за загальною методикою для синтезу цис-2азидоциклопентил 4-бромфенілового етеру в прикладі 5, за виключенням того, що (1R, 2R)-2-(4бром-3-флуорфенокси)циклопентилметансульфонат використовують замість транс-2-(4бромфенокси)циклопентилметансульфонату. Продукт виділяли у вигляді коричневої олії, яку 1 використовували на наступній стадії без очищення. H ЯМР (400 МГц, CDCl3) δ 1,66-1,75 (м, 1H), 1,88-2,08 (м, 5H), 3,74 (м, 1H), 4,65 (м, 1H), 6,66 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,75 (дд, J=10,4, 2,8 Гц, 1H), 7,42 (дд, J=8,8, 8,0 Гц, 1H). Стадія 6: Синтез (1S, 2R)-2-(4-бром-3-флуорфенокси)цикло-пентанаміну. Названу сполуку на стадії 6 одержували за загальною методикою для синтезу цис-2-(4бромфенокси)циклопентанаміну в приклад 5, за виключенням того, що (1R, 2S)-2азидоциклопентил 4-бром-3-флуорфеніловий етер використовували замість цис-2азидоциклопентил 4-бромфенілового етеру, та цис-2-(4-бромфенокси)циклопентанамін 1 використовували в наступній стадії без очищення. РХМС m/z 276,2 (M+1). H ЯМР (500 МГц, CDCl3) δ 1,5 (оч ш c, 2H), 1,57-1,66 (м, 2H), 1,80-1,87 (м, 2H), 1,93-2,01 (м, 2H), 3,36 (м, 1H), 4,41 (м, 1H), 6,63 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,71 (дд, J=10,5, 2,8 Гц, 1H), 7,40 (дд, J=8,8, 8,0 Гц, 1H). Стадія 7. Синтез N-[(1S, 2R)-2-(4-бром-3-флуорфенокси)цикло-пентил]пропан-2сульфонаміду. Названу сполуку стадії 7 одержували за загальною методикою для синтезу цис-N-[2-(4бромфенокси)циклопентил]пропан-2-сульфонаміду в прикладі 5, за виключенням того, що (1S, 2R)-2-(4-бром-3-флуорфенокси)-циклопентанамін використовували замість цис-2-(4бромфенокси)цикло-пентанамін, та хроматографічне очищення проводили з градієнтом від 0 % до 10 % метанолу в дихлорметані, щб одержати названу сполуку у вигляді незовсім білої твердої речовини. Вихід: 4,15 г, 10,9 ммоль, 54 % з (1R, 2R)-2-(4-бром-31 флуорфенокси)циклопентилацетату (5 стадій). H ЯМР (500 МГц, CDCl3) δ 1,36 (д, J=6,7 Гц, 3H), 1,39 (д, J=6,8 Гц, 3H), 1,62-1,69 (м, 1H), 1,77-1,90 (м, 3H), 1,92-2,00 (м, 1H), 2,10-2,15 (м, 1H), 3,14 (септет, J=6,8 Гц, 1H), 3,86 (м, 1H), 4,56-4,60 (м, 2H), 6,61 (ддд, J=8,9, 2,8, 1,1 Гц, 1H), 6,70 (дд, J=10,3, 2,8 Гц, 1H), 7,43 (дд, J=8,8, 8,1 Гц, 1H). Абсолютну конфігурацію N-[(1S, 2R)-2-(4бром-3-флуорфенокси)-циклопентил]пропан-2-сульфонаміду встановлювали аналогічно до стереохімії сполук в прикладі 7 та одержанні 6. Одержання 4 Синтез (2-ціано-4-флуорфеніл)боронової кислоти 2-Бром-5-флуорбензонітрил (6,00 г, 30,0 ммоль) та триізопропілборат (8,28 мл, 36,0 ммоль) розчиняли в суміші толуолу (48 мл) та тетрагідрофурану (12 мл), та розчин охолоджували на бані (суха крига)/ацетон. По краплям додавали розчин н-бутиллітію в гексані (2,5M, 14,4 мл, 36,0 ммоль) протягом 1 години, та далі реакційній суміші давали нагрітися до кімнатної температури зі струшуванням протягом 18 годин. Суміш охолоджували на крижаній бані та обробляли 2N водним розчином гідрогенхлоридної кислоти доки pH досягло 1, потім давали нагрітися до кімнатної температури, за цей час суміш розшаровувалась, шари відділяли, та водний шар двічі екстрагували етилацетатом. Об'єднані органічні шари двічі промивали, один раз насиченим водним розчином натрію хлориду, сушили над сульфатом магнію, фільтрували та концентрували в вакуумі. Одержану в результаті тверду речовину перекристалізовували із суміші етилацетат – гептан, щоб одержати (2-ціано-4-флуорфеніл)боронову кислоту у вигляді 1 білої твердої речовини. Вихід: 2,20 г, 13,3 ммоль, 44 %. H ЯМР (400 МГц, CD3OD) δ 7,43 (ддд, J=8,6, 8,6, 2,5 Гц, 1H), 7,55 (дд, J=8,8, 2,5 Гц, 1H), 7,69 (ш с, 1H). Одержання 5 Синтез N-{2-[4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]етил}метансульфонаміду Стадія 1. Синтез трет-бутил (метилсульфоніл){2-[4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан2-іл)феніл]етил}карбамату. 4,4,5,5-Тетраметил-1,3,2-діоксаборолан (4,29 мл, 29,6 ммоль) повільно додавали до суміші трет-бутил [2-(4-йодфеніл)етил]-(метилсульфоніл)карбамату (дивись J.P. Gardner, W.D. Miller, PCT Pat. Appl. Publ. WO 2001090055, 2001) (8.39 г, 19.7 ммоль), триетиламіну (9,64 мл, 69,1 19 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль) та 1,1’-[біс(дифенілфосфіно)фероцен]паладію (II) дихлориду (217 мг, 0,296 ммоль) в ацетонітрилі (50 мл), та реакційну суміш нагрівали при 75 °C протягом 4 годин. Після видалення розчинника, залишок змішували з водою (240 мл) та екстрагували метил-трет-бутиловим етером. Об'єднанні органічні шари промивали насиченим водним розчином натрію хлоридом та водою, далі сушили над сульфатом магнію, фільтрували та концентрували в вакуумі, щоб одержати синтезований трет-бутил (метилсульфоніл){2-[4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)феніл]етил}карбамат, який використовували без додаткового очищення. 1 Вихід: є кількісним. РХМС m/z 326,1 (M+1). H ЯМР (400 МГц, CDCl3) δ 1,35 (c, 12H), 2,84 (c, 3H), 2,90 (т, J=6,8 Гц, 2H), 3,42 (дт, J=6,6, 6,6 Гц, 2H), 4,18 (ш т, J=6 Гц, 1H), 7,23 (д, J=8,1 Гц, 2H), 7,78 (д, J=8,1 Гц, 2H). Стадія 2. Синтез N-{2-[4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)феніл]етил}метансульфонаміду. Трифлуороцтову кислоту (10 мл) додавали до розчину трет-бутил (метилсульфоніл){2-[4(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]етил}карбамату (з попередньої стадії взятий в кількості 19,7 ммоль) в дихлорметані (100 мл), охолодженого до 0 °C. Реакційній суміші давали нагрітися до кімнатної температури та струшували протягом 18 годин. Далі охолоджували до 0 °C та доводили до pH 10,5 4N водним розчином натрію гідроксиду. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію, фільтрували та концентрували в вакуумі. Залишок очищували хроматографією на силікагелі (Градієнт: від 0 % до 5 % метанолу в дихлорметані), одержуючи названу сполуку у вигляді не зовсім білої твердої речовини. Вихід: 2,5 г, 7,7 ммоль, 39 % за дві 1 стадії. РХМС m/z 326,1 (M+1). H ЯМР (400 МГц, CDCl3) δ 1,35 (с, 12H), 2,84 (с, 3H), 2,90 (т, J=6,8 Гц, 2H), 3,42 (дт, J=6,6, 6,6 Гц, 2H), 4,18 (ш т, J=6 Гц, 1H), 7,23 (д, J=8,1 Гц, 2H), 7,78 (д, J=8,1 Гц, 2H). Одержання 6 Синтез N-[(1S, 2R)-2-(4-бром-3-флуорфенокси)циклогексил]пропан-2-сульфонаміду Названу сполуку одержували за загальною методикою для синтезу цис-N-[2-(4бромфенокси)циклопентил]пропан-2-сульфонаміду в прикладі 5, за виключенням того, що (1S, 2R)-2-(4-бром-3-флуорфенокси)циклогексанамін використовували замість цис-2-(4бромфенокси)циклопентанаміну, та в очищенні хроматографією як градієнт використовували від 0 % до 1 % метанолу в дихлорметані. (1S, 2R)-2-(4-Бром-3-флуорфенокси)циклогексанамін синтезували за загальною методикою, описаною для синтезу (1S, 2R)-2-(4бромфенокси)циклогексанаміну в прикладі 7, за виключенням використання 4-бром-3флуорфенолу замість 4-бромфенолу. Названу сполуку одержували у вигляді білої твердої 1 речовини. H ЯМР (400 МГц, CDCl3) δ 1,33-1,53 (м, 4H), 1,35-1,38 (м, 6H), 1,78-1,89 (м, 3H), 2,042,10 (м, 1H), 3,12 (септет, J=6,8 Гц, 1H), 3,54 (м, 1H), 4,44 (д, J=9,6 Гц, 1H), 4,55 (м, 1H), 6,67 (ш дд, J=8,9, 2,8 Гц, 1H), 6,75 (дд, J=10,2, 2,7 Гц, 1H), 7,43 (дд, J=8,5, 8,5 Гц, 1H). Абсолютну конфігурацію названої сполуки встановлювали способом рентгенівської кристалографії. Одержання 7 Синтез N-{(1S, 2R)-2-[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2-сульфонаміду Стадія 1. Синтез транс-2-[(6-бромпіридин-3-іл)окси]циклогексанолу. Названу сполуку стадії 1 одержували за загальною методикою для синтезу транс-2-(4-бром3-флуорфенокси)циклопентанолу в одержанні 3, за виключенням того, що 6-бромпіридин-3-ол використовували замість 4-бром-3-флуорфенолу, та 7-оксабіцикло[4.1.0]гептан замість 6оксабіцикло[3.1.0]гексану. Сирий продукт (одержання проводили в чотирьох серіях) перекристалізовували з гептану, щоб одержати транс-2-[(6-бромпіридин-3іл)окси]циклогексанол у вигляді не зовсім білої твердої речовини. Вихід: 11,09 г, 40,75 ммоль, 1 46 %. H ЯМР (500 МГц, CDCl3) δ 1,27-1,46 (м, 4H), 1,76-1,80 (м, 2H), 2,09-2,13 (м, 2H), 2,41 (д, J=2,6 Гц, 1H), 3,74 (м, 1H), 4,00 (м, 1H), 7,17 (дд, J=8,7, 3,1 Гц, 1H), 7,37 (д, J=8,5 Гц, 1H), 8,10 (д, J=3,0 Гц, 1H). Стадія 2. Синтез цис-2-[(6-бромпіридин-3-іл)окси]циклогексанаміну. Цис-5-[(2-азидоциклогексил)окси]-2-бромпіридин, одержаний з транс-2-[(6-бромпіридин-3іл)окси]циклогексанолу за загальними методиками, описаними в прикладі 5 для перетворення транс-2-(4-бромфенокси)циклопентанолу в цис-2-азидоциклопентил 4-бромфеніловий етер (13,5 г, 45,4 ммоль), розчиняли в тетрагідрофурані (292 мл) та воді (23 мл), та розчин обробляли трифенілфосфіном (23,8 г, 90,7 ммоль). Реакційну суміш струшували протягом 18 годин при кімнатній температурі, далі розшаровували між етилацетатом (500 мл) та водою (200 мл). Водний шар екстрагували етилацетатом, та об'єднані органічні шари промивали водою (2 × 200 мл) та насиченим водним розчином натрію хлориду (200 мл). Органічний шар далі екстрагували водним 1N розчином гідрогенхлоридної кислоти (4 × 150 мл), та об'єднані водні 20 UA 102310 C2 5 10 15 20 25 30 35 40 шари промивали етилацетатом (150 мл). Водний шар потім охолоджували на крижаній бані, та повільно обробляли 2N водним розчином натрію гідроксиду, доки суміш стала мутно білою; далі її екстрагували етилацетатом (3 × 150 мл), та об'єднані органічні шари промивали насиченим водним розчином натрію хлориду (150 мл), сушили над сульфатом натрію, фільтрували та концентрували в вакуумі. Цис-2-[(6-бромпіридин-3-іл)окси]циклогексанамін одержували у 1 вигляді жовтої олії. Вихід: 8,00 г, 29,5 ммоль, 65 %. H ЯМР (500 МГц, CDCl3) δ 1,34 (д, J=6,8 Гц, 3H), 1,35 (д, J=6,7 Гц, 3H), 1,35-1,52 (м, 4H), 1,79-1,85 (м, 3H), 2,02 (м, 1H), 3,11 (септет, J=6,8 Гц, 1H), 3,53 (м, 1H), 4,59 (ш с, 1H), 4,68 (м, 1H), 7,19 (дд, J=8,7, 3,1 Гц, 1H), 7,38 (д, J=8,7 Гц, 1H), 8,07 (д, J=3,2 Гц, 1H). Стадія 3. Синтез цис-N-{2-[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2-сульфонаміду. Названу сполуку стадії 3 одержували за загальною методикою для синтезу цис-N-[2-(4бромфенокси)циклопентил]пропан-2-сульфонаміду в прикладі 5, за виключенням того, що цис2-[(6-бромпіридин-3-іл)окси]циклогексанамін використовували замість цис-2-(4-бромфенокси)циклопентанаміну, та нехтували 4-(диметиламіно)піридином. В цьому випадку хроматографію на силікагелі виконували з елюентом від 2 % метанолу в дихлорметані, щоб одержати цис-N-{2[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2-сульфонамід у вигляді бежевої піни. Вихід: 7,96 1 г, 21,1 ммоль, 72 %. H ЯМР (500 МГц, CDCl3) δ 1,34 (д, J=6,8 Гц, 3H), 1,35 (д, J=6,7 Гц, 3H), 1,35-1,52 (м, 4H), 1,79-1,85 (м, 3H), 2,02 (м, 1H), 3,11 (септет, J=6,8 Гц, 1H), 3,53 (м, 1H), 4,59 (ш с, 1H), 4,68 (м, 1H), 7,19 (дд, J=8,7, 3,1 Гц, 1H), 7,38 (д, J=8,7 Гц, 1H), 8,07 (д, J=3,2 Гц, 1H). Стадія 4. Виділення N-{(1S, 2R)-2-[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2сульфонаміду. Розділення енантиомерів, що містять цис-N-{2-[(6-бромпіридин-3іл)окси]циклогексил}пропан-2-сульфонамід (7,96 г, 21,1 ммоль) виконували хоральною хроматографією. Колонка: Chiralpak® AD-H, 2,1 × 25 см, 5 мкм; Рухома фаза: 70:30 діоксид карбону: метанол; Швидкість потоку: 65 г/хв. Першою сполукою, що елюювали, був енантіомер [N-{(1R, 2S)-2-[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2-сульфонамід] та другою, що елюювали, був бажаний продукт N-{(1S, 2R)-2-[(6-бромпіридин-3-іл)окси]циклогексил}пропан-2сульфонамід, після видалення розчинника в вакуумі. Вихід: 3,13 г, 8,30 ммоль, 39 %. Абсолютну стереохімічну структуру цих енантіомерів визначали аналогічно до прикладу 5. Одержання 8 Синтез цис-N-[4-(4-бромфенокси)тетрагідрофуран-3-іл]пропан-2-сульфонаміду Названу сполуку одержували за загальною методикою для синтезу цис-N-{4-[(6бромпіридин-3-іл)окси]тетрагідрофуран-3-іл}пропан-2-сульфонаміду в одержанні 1, за виключенням того, що транс-4-(4-бромфенокси)тетрагідрофуран-3-іл метансульфонат використовували замість транс-4-[(6-бромпіридин-3-іл)окси]тетрагідрофуран-3-іл метансульфонату, та хроматографічне очищення виконували з градієнтом від 15 % до 35 % 1 ацетону в гептані. Вихід: 238 мг, 0,65 ммоль, 31 %. H ЯМР (400 МГц, CDCl3) δ 1,30 (д, J=6,8 Гц, 3H), 1,33 (д, J=6,8 Гц, 3H), 3,11 (септет, J=6,8 Гц, 1H), 3,66 (дд, J=9,1, 8,4 Гц, 1H), 3,89 (дд, J=10,7, 1,7 Гц, 1H), 4,07-4,13 (м, 2H), 4,19 (м, 1H), 4,71 (м, 1H), 5,12 (д, J=9,6 Гц, 1H), 6,75 (д, J=9,0 Гц, 2H), 7,36 (д, J=9,0 Гц, 2H). Приклад 1 Синтез N-{1-[4-транс-({4-[(ізопропілсульфоніл)аміно]тетрагідрофуран-3іл}окси)феніл]піролідин-3-іл}ацетаміду O S HN O N O O N H 45 50 55 O (+/-) Стадія 1. Синтез транс-N-(4-гідрокситетрагідрофуран-3-іл)пропан-2-сульфонаміду. 3,6-Діоксабіцикло[3.1.0]гексан (1,90 г, 22,1 ммоль), пропан-2-сульфонамід (одержаний за способом D.C. Johnson, II and T.S. Widlanski, Тетраhedron Letters 2004, 45, 8483-8487) (3,13 г, 25,4 ммоль), калію карбонат (584 мг, 4,23 ммоль) та бензилтриетиламонію хлорид (963 мг, 4,23 ммоль) суспендували в діоксані (10 мл) та нагрівали зі зворотнім холодильником протягом 120 годин. Реакційну суміш охолоджували до кімнатної температури, фільтрували, концентрували в вакуумі та очищували хроматографією на силікагелі (Градієнт: від 40 % до 80 % етилацетату в гептані), щоб одержати транс-N-(4-гідрокситетрагідрофуран-3-іл)пропан-2-сульфонамід у 1 вигляді твердої речовини. Вихід: 3,76 г, 18,0 ммоль, 81 %. H ЯМР (400 МГц, CDCl3) δ 1,38 (д, J=6,7 Гц, 3H), 1,40 (д, J=6,7 Гц, 3H) 2,91 (д, J=3,6 Гц, 1H), 3,22 (септет, J=6,8 Гц, 1H), 3,67-3,71 13 (м, 2H), 3,82 (м, 1H), 4,08-4,12 (м, 2H), 4,40 (м, 1H), 4,77 (д, J=8,4 Гц, 1H), C ЯМР (100 МГц, 21 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 CDCl3) δ 16,44, 16,69, 54,18, 62,06, 71,47, 73,50, 77,64. Стадія 2. Синтез транс-4-[(ізопропілсульфоніл)аміно]тетрагідрофуран-3-іл метансульфонату. Триетиламін (1,99 мл, 14,3 ммоль) додавали до охолодженого (0 °C) розчину транс-N-(4гідрокситетрагідрофуран-3-іл)пропан-2-сульфонаміду (1,99 г, 9,52 ммоль) в дихлорметані (20 мл). Далі додавали метансульфоніл хлорид (0,885 мл, 11,4 ммоль) та реакційну суміш струшували при 0 °C протягом 50 хвилин. Додавали насичений водний розчин натрію бікарбонату (10 мл), та водний шар екстрагували метиленхлоридом. Об'єднані органічні шари сушили над сульфатом натрію, фільтрували, концентрували в вакуумі та очищували хроматографією на силікагелі (Градієнт: від 10 % до 50 % етилацетату в гептані), що одержати транс-4-[(ізопропілсульфоніл)аміно]тетрагідро-фуран-3-іл метансульфонат. Вихід: 2,27 г, 7,90 1 ммоль, 83 %. H ЯМР (400 МГц, CDCl3) δ 1,40 (д, J=6,8 Гц, 3H), 1,41 (д, J=6,8 Гц, 3H), 3,14 (с, 3H), 3,25 (септет, J=6,8 Гц, 1H), 3,77 (дд, J=9,5, 2,4 Гц, 1H), 3,96 (дд, J=11,3, 2,2 Гц, 1H), 4,0813 4,16 (м, 2H), 4,21 (дд, J=11,3, 5,1 Гц, 1H), 4,77 (д, J=8,0 Гц, 1H), 5,15 (м, 1H), C ЯМР (100 МГц, CDCl3) δ 16,48, 16,54, 38,28, 54,28, 59,49, 71,83, 71,87, 83,97. Стадія 3. Синтез транс-N-[4-(4-бромфенокси)тетрагідрофуран-3-іл]пропан-2-сульфонаміду. В мікрохвильовій ємності до розчину транс-4-[(ізопропілсульфоніл)аміно]тетрагідрофуран-3ілметансульфонату (546 мг, 1,90 ммоль) в ацетонітрилі (8 мл) додавали 4-бромфенол (97 %, 407 мг, 2,28 ммоль) та цезію карбонат (929 мг, 2,85 ммоль). Реакційну суміш піддавали опроміненню в мікрохвильовому реакторі при 160 °C протягом 2 годин, далі охолоджували до кімнатної температури та обробляли насиченим водним розчином натрію бікарбонату (10 мл). Реакційну суміш екстрагували етилацетатом та об'єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували в вакуумі. Залишок очищували хроматографією на силікагелі (Градієнт: від 20 % до 50 % етилацетату в гептані), одержуючи транс-N-[4-(4бромфенокси)тетрагідрофуран-3-іл]пропан-2-сульфонамід. Вихід: 626 мг, 1,72 ммоль, 91 %. 1 РХМС m/z 361,9 (M-1). H ЯМР (400 МГц, CDCl3) δ 1,38 (д, J=6,9 Гц, 3H), 1,40 (д, J=6,8 Гц, 3H), 3,19 (септет, J=6,8 Гц, 1H), 3,82 (ш д, J=8,0, 1H), 3,91 (дд, J=10,6, 1,7 Гц, 1H), 4,02-4,08 (м, 2H), 4,24 (дд, J=10,5, 4,7 Гц, 1H), 4,85 (ш д, J=4,7 Гц, 1H), 4,95 (ш д, J=8,3 Гц, 1H), 6,88 (д, J=9,0 Гц, 13 2H), 7,40 (д, J=9,0 Гц, 2H), C ЯМР (100 МГц, CDCl3) δ 16,45, 16,71, 54,14, 58,70, 71,45, 71,81, 82,07, 113,97, 117,20, 132,52, 155,75. Стадія 4. Синтез N-{1-[4-транс-({4-[(ізопропілсульфоніл)аміно]-тетрагідрофуран-3іл}окси)феніл]піролідин-3-іл}ацетаміду. До 2-метилбутан-2-олу (2,0 мл) додавали 2'-(дициклогексилфосфіно)-N, N-диметилбіфеніл2-амін (3,2 мг, 0,008 ммоль) та три(дибензиліденацетон)дипаладію (0) (2,7 мг, 0,003 ммоль). Далі реакційну суміш пурпурного кольору дегазовували протягом 20 хвилин та додавали трансN-[4-(4-бромфенокси)тетрагідрофуран-3-іл]пропан-2-сульфонамід (95 мг, 0,26 ммоль) і Nпіролідин-3-ілацетамід (67 мг, 0,52 ммоль). Далі додавали калію гідроксид (32 мг, 0,57 ммоль) та реакційну суміш дегазовували протягом додаткових 20 хвилин. Коричневого кольору реакційну суміш нагрівали до кипіння та кип'ятили зі зворотнім холодильником в атмосфері азоту та поверталися до жовтого кольору суміші. Перебіг реакції контролювали шляхом ГХМС та коли реакція завершилася, додавали насичений водний розчин натрію бікарбонату (5 мл). Водний шар екстрагували етилацетатом та об'єднані органічні шари сушили над сульфатом натрію, фільтрували, концентрували в вакуумі та очищували хроматографією на силікагелі (Градієнт: від 50 % до 70 % етилацетату в гептані), щоб одержати суміш діастереомерів N-{1-[4-транс-({4[(ізопропілсульфоніл)аміно]тетрагідро-фуран-3-іл}окси)феніл]піролідин-3-іл}ацетамід у вигляді 1 смоли. Вихід: 97,5 мг, 0,236 ммоль, 91 %. H ЯМР (400 МГц, CDCl3) δ 1,31 (д, J=6,8 Гц, 3H), 1,32 (д, J=6,8 Гц, 3H), 1,93 (с, 3H), 2,22 (м, 1H), 2,64 (ш с, 1H), 3,07-3,13 (м, 2H), 3,19 (м, 1H), 3,34-3,43 (м, 2H), 3,74 (дд, J=9,0, 1,8 Гц, 1H), 3,85 (дд, J=10,3, 1,7 Гц, 1H), 4,00-4,13 (м, 3H), 4,53 (м, 1H), 4,69 (ш с, 1H), 5,67 (д, J=8,0 Гц, 1H), 6,46 (д, J=8,8 Гц, 2H), 6,46 (1H, нечітка картина 13 ароматичного сигналу), 6,84 (д, J=9,0 Гц, 2H), C ЯМР (100 МГц, CDCl3) δ 16,37, 16,46, 22,98, 31,44, 46,32, 49,31, 53,61, 53,88, 58,67, 71,45, 71,87, 82,80, 112,72, 117,00, 143,13, 147,98, 170,23. Приклад 2 N-[(3S, 4S)-4-(біфеніл-4-ілокси)тетрагідрофуран-3-іл]пропан-2-сульфонамід HN O 55 O S O O 22 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 1. Синтез транс-4-(4-бромфенокси)тетрагідрофуран-3-олу. 3,6-Діоксабіцикло[3.1.0]гексан (100 г, 1,16 моль), 4-бромфенол (241,1 г, 1,39 моль), цезію карбонат (492 г, 1,51 моль) та бензилтриетиламонію хлорид (52,9 г, 0,23 моль) суспендували в діоксані (1 л) та нагрівали при кипінні зі зворотнім холодильником протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури та розбавляли етилацетатом, потім промивали насиченим водним розчином натрію карбонату. Водний шар екстрагували етилацетатом, та об'єднані органічні частини сушили над сульфатом натрію, фільтрували та концентрували в вакуумі, щоб одержати сирий продукт, який затвердіває при стоянні. Без очищення його використовували на наступній стадії. Вихід: 354 г, >100 %, кількісне одержання. Речовину з експерименту меншого масштабу, проведеного подібним чином, очищували хроматографією на силікагелі для визначення характеристик (Градієнт: від 10 % до 35 % етилацетату в гептані), 1 щоб одержати транс-4-(4-бромфенокси)тетрагідрофуран-3-ол у вигляді твердої речовини. H ЯМР (400 МГц, CDCl3) δ 2,09 (ш д, J=4,5 Гц, 1H), 3,83 (м, 1H), 3,91 (дд, J=10,3, 2,1 Гц, 1H), 4,05 (дд, J=10,1, 4,0 Гц, 1H), 4,26 (дд, J=10,4, 4,9 Гц, 1H), 4,41 (ш с, 1H), 4,67 (м, 1H), 6,81 (д, J=9,0 Гц, 2H), 7,40 (д, J=9,1 Гц, 2H). Стадія 2. Синтез транс-4-(4-бромфенокси)тетрагідрофуран-3-іл метансульфонату. Триетиламін (181,9 мл, 1,31 моль) додавали до розчину транс-4-(4бромфенокси)тетрагідрофуран-3-олу з попередньої стадії (354 г, розраховано 300,6 г, 1,16 моль) в метиленхлориді (2 л), та реакційну суміш охолоджували до 0 °C на крижаній бані. Далі по краплям додавали метансульфонілхлорид (101,3 мл, 1,31 моль), тримаючи при цьому реакційну суміш при температурі нижче 5 °C, та реакційну суміш струшували при кімнатній температурі протягом 18 годин. Додавали воду (1,5 л), та водний шар екстрагували метиленхлоридом. Органічні екстракти об'єднували та сушили над сульфатом натрію, фільтрували та концентрували в вакуумі, щоб забезпечити одержання продукту у вигляді коричневої олії. Вихід: 399,6 г, 1,18 моль, кількісно. Речовину з експерименту меншого масштабу, проведеного подібним чином, розтирали з етанолом для визначення характеристик. 1 H ЯМР (400 МГц, CDCl3) δ 3,10 (с, 3H), 4,00 (ш дд, J=10,4, 1,9 Гц, 1H), 4,07 (м, 1H), 4,16 (дд, J=11,1, 3,9 Гц, 1H), 4,23 (дд, J=10,5, 4,6 Гц, 1H), 4,98 (ш д, J=4,6 Гц, 1H), 5,20 (м, 1H), 6,85 (д, J=9,1 Гц, 2H), 7,42 (д, J=9,0 Гц, 2H). Стадія 3. Синтез цис-3-азидо-4-(4-бромфенокси)тетрагідрофурану. До розчину транс-4-(4-бромфенокси)тетрагідрофуран-3-іл метансульфонату (133,2 г, 0,395 моль) в диметилформаміді (3 л) додавали азид натрію (192,6 г, 2,96 моль) та реакційну суміш нагрівали при 110 °C протягом 66 годин. Реакційну суміш охолоджували до кімнатної температури та додавали воду (12 л). Дану реакцію проводили загалом тричі в такому ж масштабі, та об'єднані серії екстрагували трет-бутилметиловим етером. Далі органічні шари сушили над сульфатом натрію та концентрували в вакуумі, щоб забезпечити одержання продукту у вигляді червоно-коричневої олії, що забруднена 18 % диметилформаміду. Вихід з 1 внесенням поправки: 286,7 г, 1,01 моль, 85 %. H ЯМР (400 МГц, CDCl3) δ 3,93-3,97 (м, 2H), 4,00 (м, 1H), 4,09 (дд, J=8,7, 5,8 Гц, 1H), 4,17 (дд, J=10,0, 5,6 Гц, 1H), 4,90 (ддд, J=5,4, 5,4, 4,4 Гц, 1H), 6,83 (д, J=9,1 Гц, 2H), 7,41 (д, J=9,0 Гц, 2H). Стадія 4. Синтез цис-4-(4-бромфенокси)тетрагідрофуран-3-аміну. Розчин цис-3-азидо-4-(4-бромфенокси)тетрагідрофурану (286,7 г, 1,01 моль) в тетрагідрофурані (1,25 л) охолоджували до 0 °C та обробляли трифенілфосфіном (278 г, 1,06 моль). Реакційній суміші давали нагрітися до кімнатної температури та струшували протягом 18 годин. До реакційної суміші додавали воду (53 мл) та одержану суміш струшували при кімнатній температурі протягом 66 годин. Розчинник видаляли при зниженому тиску та залишок змішували з діетиловим етером. Рідину над осадом декантували та концентрували в вакуумі, одержуючи залишок, який фільтрували через невеликий шар з силікагелю (Градієнт: від 0 % до 5% метанолу метиленхлориді) щоб забезпечити одержання цис-4-(4бромфенокси)тетрагідрофуран-3-аміну (155 г) та 366 грам продукту з домішками. З метою одержання додаткової кількості продукту (48,5 г) проводили кислотну/основну екстракцію 1 речовини з домішками. Загальний вихід: 203,5 г, 0,788 моль, 68 % за чотирі стадії. H ЯМР (300 МГц, CDCl3) δ 3,6 (м, 1H), 3,7 (м, 1H), 3,9 (м, 1H), 4,0 (м, 1H), 4,1 (м, 1H), 4,6 (м, 1H), 6,8 (м, 2H), 7,3 (м, 2H). Стадія 5. Синтез (3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-аміну. Суміш цис-4-(4-бромфенокси)тетрагідрофуран-3-аміну (191 г, 0,74 моль) та (1S)-(+)-10камфорсульфонової кислоти (154,2 г, 0,66 моль) розчиняли в 2-пропанолі (2,4 л) та воді (100 мл) при кип'ятінні зі зворотнім холодильником. Прозорому розчину давали охолонути до кімнатної температури понад 18 годин, та одержані в результаті кристали виділяли, промивали та сушили, щоб одержати сіль (3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-аміну (+) 23 UA 102310 C2 5 10 15 20 25 30 35 40 45 50 55 60 камфорсульфонової кислоти (139,2 г, 0,284 моль) з e.н. (енантіомерним надлишком) у 85 %. Перекристалізацією з 2-пропанолу (1,2 л) та води (70 мл) одержували сіль (+)камфорсульфонової кислоти з (3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-аміном, з e.н. у 1 99 %. Вихід: 113,2 г, 0,23 моль, 31 %. H ЯМР (300 МГц, ДМСО-d6) δ 0,74 (c, 3H), 1,05 (c, 3H), 1,23 (д, половина від AB квартету J=10 Гц, 1H), 1,29 (д, половина від AB квартету, J=10 Гц, 1H), 1,76-1,94 (м, 2H), 2,19-2,28 (м, приблизно 2H), 2,35 (д, J=14,7 Гц, 1H), 2,66-2,73 (м, приблизно 1H), 2,85 (д, J=14,7 Гц, 1H), 3,78-3,84 (м, 2H), 3,96-4,10 (м, 3H), 5,04 (м, 1H), 6,99 (д, J=8,8 Гц, 2H), 7,52 (д, J=9,0 Гц, 2H), 8,23 (ш c, 3H). Додаткову сіль (3S, 4S)-4-(4бромфенокси)тетрагідрофуран-3-аміну з (+)-камфорсульфоновою кислотою (13,6 г, 27,7 ммоль) з іншого експерименту додавали та об'єднані серії (126,8 г, 0,258 моль) промивали 2N водний розчином натрію гідроксиду та тричі екстрагували метиленхлоридом. Органічні шари об'єднували та концентрували в вакуумі, забезпечуючи одержання (3S, 4S)-4-(4бромфенокси)тетрагідрофуран-3-аміну у вигляді білої твердої речовини з е.н. у 99 %. Вихід: 65,6 г, 0,254 ммоль, 98 % на стадії нейтралізації. Об'єднані маточні розчини, одержані вище, що збагачені (3R, 4R)-4-(4бромфенокси)тетрагідрофуран-3-аміном, промивали 2N розчином натрію гідроксиду та екстрагували метиленхлоридом. Об'єднані органічні шари сушили над сульфатом натрію та концентрували в вакуумі, щоб одержати залишок (156,3 г, 0,606 моль продукту та його енантіомеру). Цю сполуку змішували з (1R)-(-)-10-камфорсульфоновою кислотою (126,2 г, 0,54 моль) та розчиняли в 2-пропанолі (1,65 л) та воді (100 мл) при кип'ятінні зі зворотнім холодильником. Прозорому розчину давали охолонути до кімнатної температури понад 18 годин та одержані в результаті кристали виділяли, промивали та сушили. Це дало сіль (-)камфорсульфонової кислоти з (3R, 4R)-4-(4-бромфенокси)тетрагідро-фуран-3-аміном (152,6 г, 0,311 моль), з е.н. у 90 %. Перекристалізація, як представлено вище, дала сіль (-)камфорсульфонової кислоти з (3R, 4R)-4-(4-бромфенокси)тетрагідрофуран-3-аміном у вигляді білої твердої речовини, з е.н. у 99 %. Вихід: 132,0 г, 0,27 моль, 36 %. Маточний розчин концентрували в вакуумі, промивали 2N розчином натрію гідроксиду та екстрагували метиленхлоридом. Об'єднані органічні шари сушили над сульфатом натрію та концентрували при зниженому тиску, щоб одержати суміш (3S, 4S)-4-(4бромфенокси)тетрагідрофуран-3-аміну та його енантіомеру (67,7 г, 0,26 моль). Разом з (1S)-(+)10-камфорсульфоновою кислотою (54,6 г, 0,24 моль) даний матеріал розчиняли в 2-пропанолі (425 мл) та воді (17,5 мл) при кип'ятінні зі зворотнім холодильником. Прозорому розчину давали охолонути до кімнатної температури понад 18 годин та одержані в результаті кристали виділяли, промивали та сушили. Це дало додаткову кількість солі (+)-камфорсульфонової кислоти з (3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-аміном (48,0 г, 97,9 ммоль), з е.н. у 8993 %. Перекристалізація дала сіль (+)-камфорсульфонової кислоти з (3S, 4S)-4-(4бромфенокси)тетрагідрофуран-3-аміном (40,0 г, 81,6 ммоль, додаткові 11 %) з е.н. у 99+%. Стадія 6. Синтез N-[(3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-іл]пропан-2сульфонаміду. До розчину (3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-аміну (65,6 г, 0,254 моль) в метиленхлориді (500 мл) додавали 1,8-діазабіцикло[5.4.0]ундек-7-ен (ДБУ, 53 мл, 0,35 моль). Реакційну суміш охолоджували до 0 °C та по краплям додавали пропан-2-сульфонілхлорид (31,2 мл, 0,28 моль). Далі суміш струшували при кімнатній температурі протягом 18 годин. Проходження реакції контролювали за допомогою протонного ЯМР: додавали додаткову кількість пропан-2-сульфонілхлориду (2,8 мл, 25 ммоль) та суміш струшували при кімнатній температурі протягом додаткових 18 годин. Знову проходження реакції контролювали за допомогою ЯМР та додавали додаткову кількість пропан-2-сульфонілхлориду (2,8 мл, 25 ммоль). Через 2,5 години за даними ЯМР аналізу проходження реакції завершилося. Додавали воду (500 мл) та шари розділяли. Водний шар екстрагували метиленхлоридом, та об'єднані органічні шари сушили над сульфатом натрію, фільтрували та концентрували в вакуумі. Залишок розчиняли в метиленхлориді та промивали водним розчином гідрогенхлоридної кислоти (1N, 2 × 300 мл), сушили над сульфатом натрію, фільтрували та концентрували в вакуумі, щоб одержати N-[(3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3-іл]пропан-21 сульфонамід у вигляді оранжевої/коричневої олії. Вихід: 92,5 г, 0,254 моль, 100 %. H ЯМР (300 МГц, CDCl3) δ 1,36 (д, J=7 Гц, 3H), 1,38 (д, J=7 Гц, 3H), 3,15 (септет, J=7 Гц, 1H), 3,69 (дд, J=8,5, 8,5 Гц, 1H), 3,93 (дд, J=10,6, 1,5 Гц, 1H), 4,10-4,28 (м, 3H), 4,72-4,81 (м, 2H), 6,77 (д, J=9,1 Гц, 2H), 7,41 (д, J=9,1 Гц, 2H). Абсолютну конфігурацію цієї речовини встановлювали за допомогою рентгеноструктурного аналізу кристалу N-[(3S, 4S)-4-(4-бромфенокси)тетрагідрофуран-3іл]пропан-2-сульфонаміду, вирощеного в розчині гептан/етилацетат. Результати описані нижче. 0.90 Å набір данних (максимум sin Θ/λ=0.56) одержували на дифрактометрі Bruker APEX. 24 UA 102310 C2 Кінцевий R-індекс становив 3,61 %. Таблиця 1 Дані кристалу та уточнення структури Емпірична формула Маса за формулою Температура Довжина хвилі Кристалічна гратка Просторова група Параметри елементарної комірки Об'єм Z Густина (розрахована) Коефіцієнт поглинання F(000) Розміри кристалу Діапазон тета для набору данних Кількість відбиття Незалежні відбиття Повнота дослід. до тета = 58.95° Корекція поглинання Уточнення методу Данні / обмеження / параметри 2 Критерії відповідності на F Кінцеві R індекси [I>2сігма(I)] R індекси (всі данні) Абсолютний параметр структури Коефіцієнт екстинції Найбільший диф. пік та яма C13H18NO4SBr 364,25 298(2) K 1,54178 Å Моноклінна P2(1) a=5,9363(2) Å α= 90°. b=10,5879(3) Å β= 103.2060(10)°. c=12,8451(3) Å γ = 90°. 3 786,00(4) Å 2 3 1,539 Mг/м -1 4,921 мм 372 3 0,10 × 0,30 × 0,46 мм 3,53 до 58,95°. 3091 1793 [R(int) = 0.0354] 94,4 % Емпірична корекція поглинання Повноматричний метод найменших квадратів на 2 F 1793 / 1 / 182 1,059 R1=0,0361, wR2=0,0989 R1=0,0363, wR2=0,0991 0,07(3) 0,0186(12) -3 0,334 та -0,419 e.Å 25 UA 102310 C2 Таблиця 2 4 Атомні координати (x 10 ) та еквівалентні параметри ізотопного 3 зміщення (Å 10 ). U(екв) визначають як одну третю сліду ортогоналізованого Uij тензору. 2× 26 UA 102310 C2 Таблиця 3 Довжини зв'язку [Å] та кути [°]. Трансформації симетрії, використані, щоб генерувати еквівалентні атоми 27 UA 102310 C2 Таблиця 4 2× 3 Параметри анізотропного зміщення (Å 10 ). Експонента фактору 2 2 2 анізотропного зміщення приймає вид: -2π [h a* U11 + … + 2 h k a* b* U12] 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic sufonamides, use thereof and pharmaceuticsl compositions
Автори англійськоюFliri, Anton Franz Joseph, Gallaschun, Randall James, O'Donnell, Christopher John, Schwarz, Jacob Bradley, Segelstein, Barbara Eileen
Назва патенту російськоюГетероциклические сульфонамиды, их применение и фармацевтические композиции
Автори російськоюФлири Антон Франц Джозеф, Галлашун Ренделл Джеймс, О'Доннелл Кристофер Джон, Шварц Якоб Бредли, Седжелстейн Барбара Ейлеен
МПК / Мітки
МПК: C07C 311/07, C07D 307/22, A61K 31/4709, A61K 31/4453, C07D 213/65, C07D 295/096, C07D 333/38, A61K 31/341, A61K 31/381, C07D 409/14, C07D 307/42, C07D 405/12, A61K 31/443, C07D 409/12, A61K 31/402
Мітки: композиції, застосування, гетероциклічні, фармацевтичні, сульфонаміди
Код посилання
<a href="https://ua.patents.su/56-102310-geterociklichni-sulfonamidi-kh-zastosuvannya-ta-farmacevtichni-kompozici.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні сульфонаміди, їх застосування та фармацевтичні композиції</a>
Попередній патент: Багатофункціональний комплекс для надання банківських послуг
Наступний патент: Схема преамбули для бездротового сигналу
Випадковий патент: Пружне колесо транспортного засобу