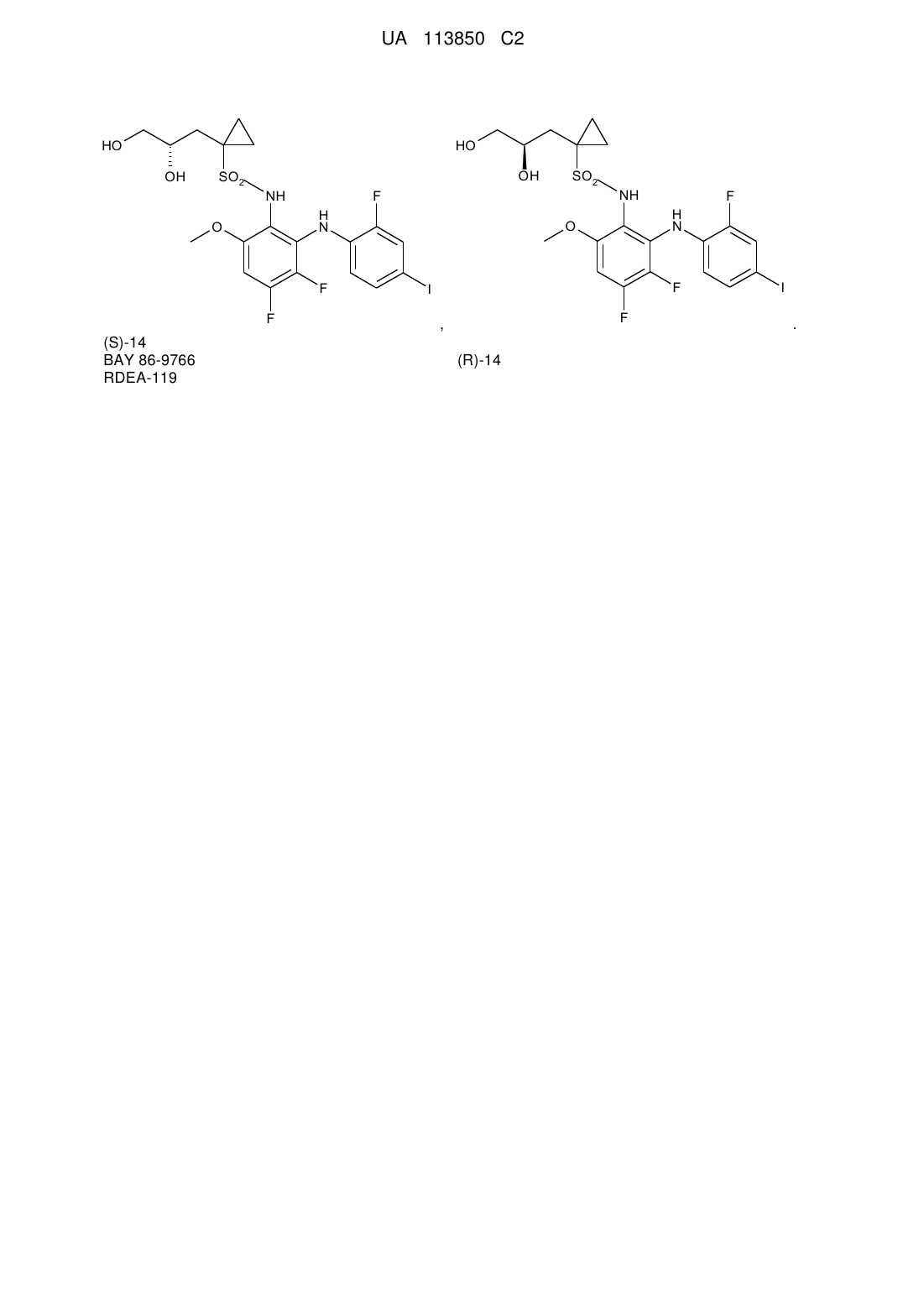
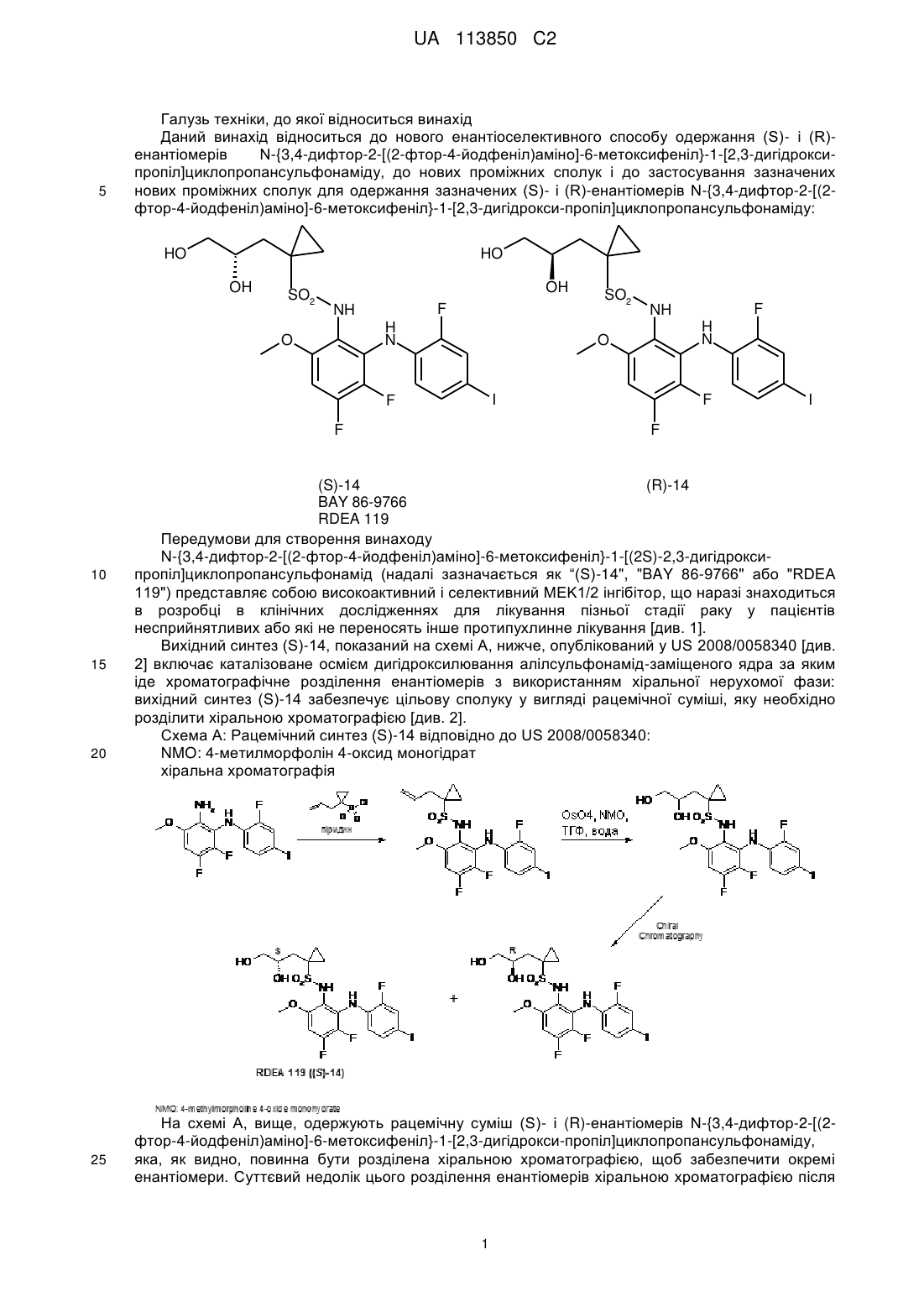
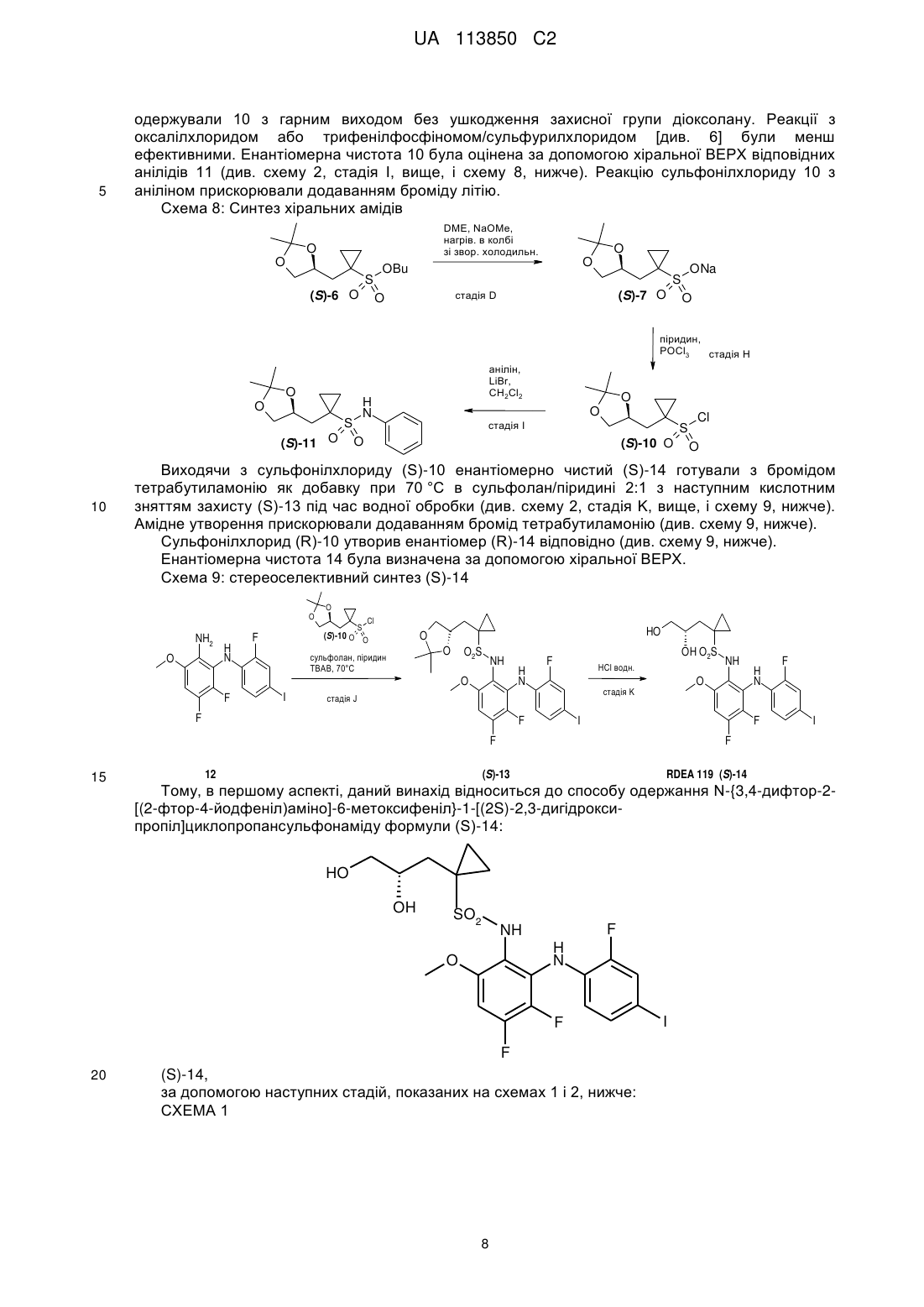
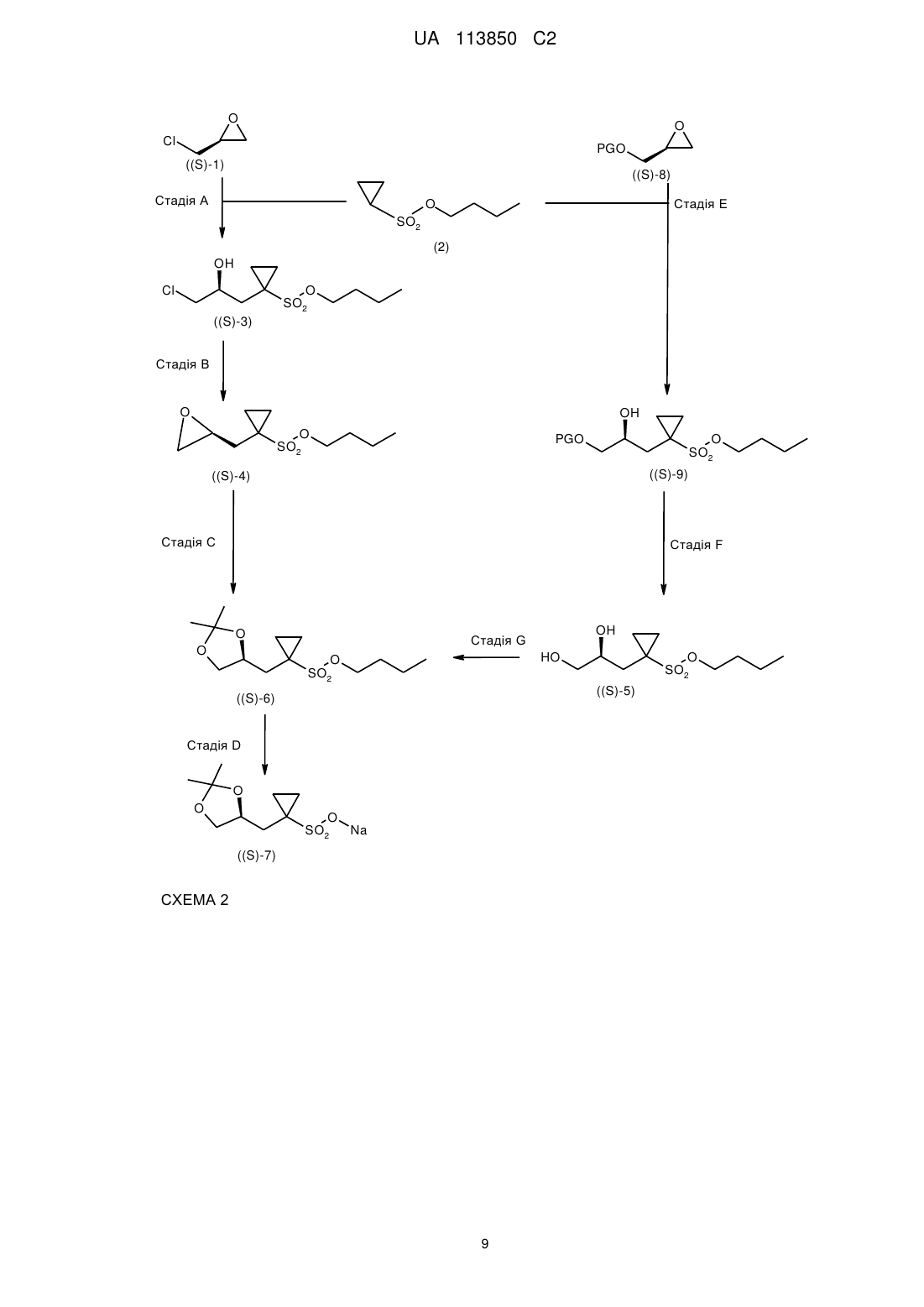
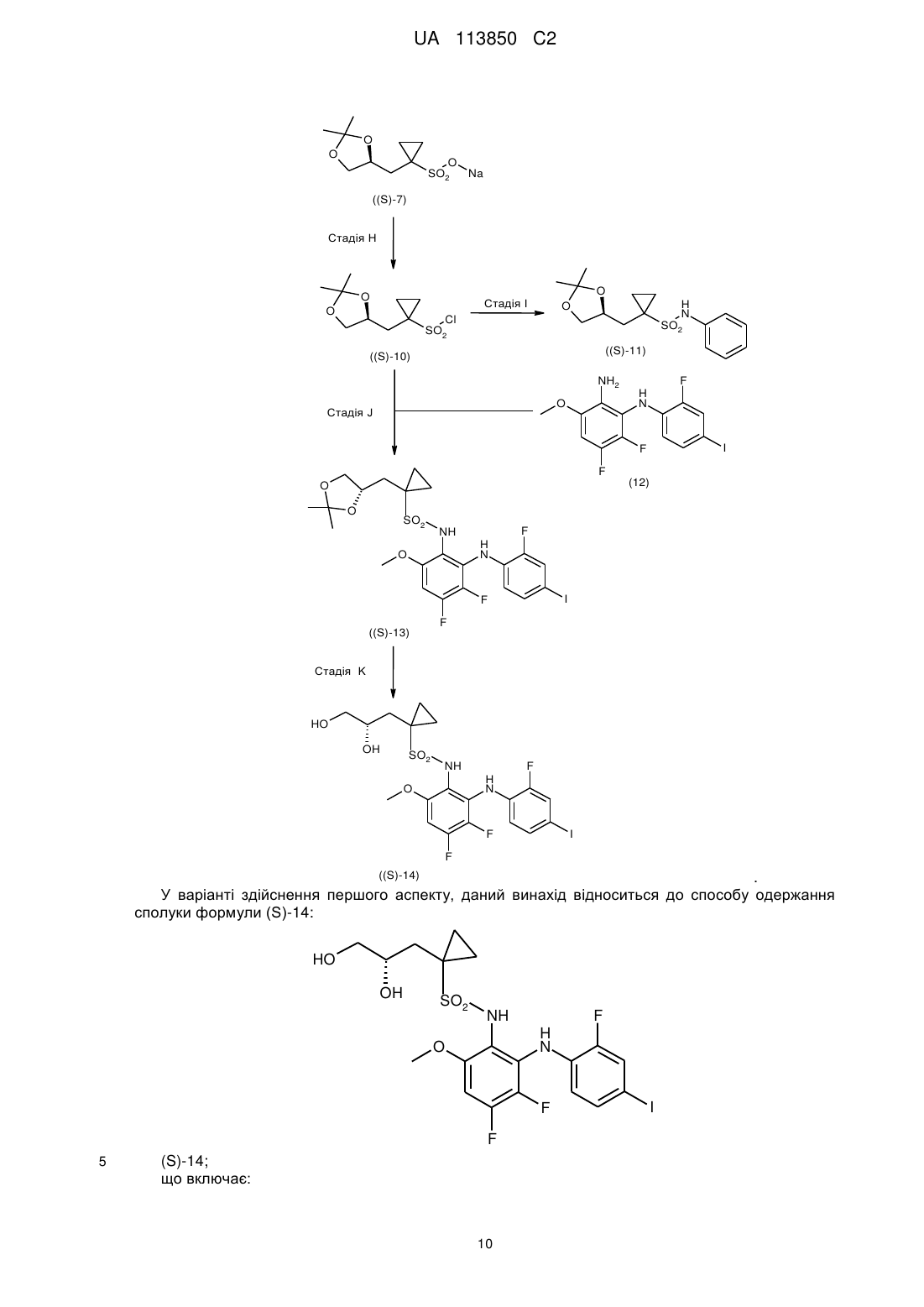
Хіральний синтез n-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідроксипропіл]циклопропансульфонамідів
Формула / Реферат
1. Сполука 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-іл]метил}циклопропансульфонілброміду (S)-10-Br:
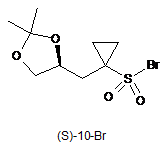 .
.
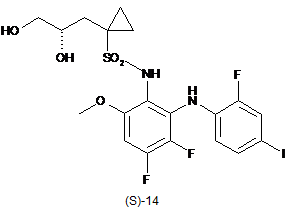
2. Спосіб одержання сполуки формули (S)-14:
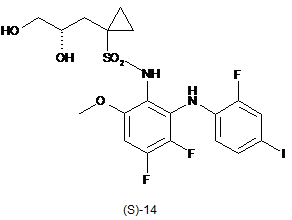 ,
,
що включає:
І) стадію,
на якій сполуку формули (S)-10:
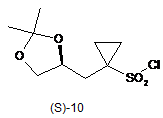
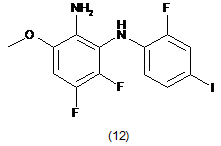
піддають взаємодії зі сполукою формули (12):
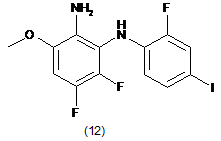
в присутності броміду, необов'язково в присутності основи, і необов'язково в розчиннику, одержуючи таким чином реакційну суміш, що містить сполуку формули (S)-13:
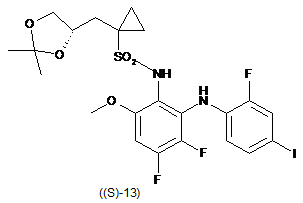 ;
;
і, потім,
II) стадію,
на якій водну мінеральну кислоту додають до зазначеної реакційної суміші, що містить сполуку формули (S)-13, одержуючи таким чином сполуку формули (S)-14.
3. Спосіб одержання сполуки формули (S)-14:
 ,
,
що включає:
І) стадію,
на якій сполуку формули (S)-10-Br
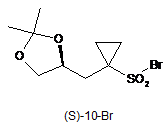
піддають взаємодії зі сполукою формули (12)
необов'язково в присутності основи, необов'язково в розчиннику, одержуючи таким чином реакційну суміш, що містить сполуку формули (S)-13:
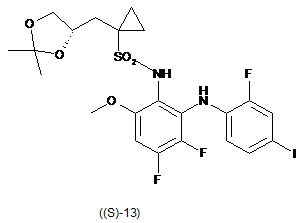 ;
;
і, потім,
II) стадію,
на якій водну мінеральну кислоту додають до зазначеної реакційної суміші, що містить сполуку формули (S)-13, одержуючи таким чином сполуку формули (S)-14.
4. Спосіб за п. 2, в якому зазначену сполуку формули (S)-10
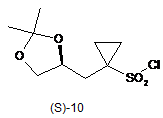
одержують тим, що сполуку формули (S)-7

піддають взаємодії з хлорувальним агентом, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-10.
5. Спосіб за п. 3, в якому зазначену сполуку формули (S)-10-Br
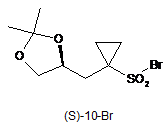
одержують тим, що сполуку формули (S)-7

піддають взаємодії з бромувальним агентом, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-10-Br.
6. Спосіб за п. 4, в якому зазначену сполуку формули (S)-7

одержують тим, що сполуку формули (S)-6
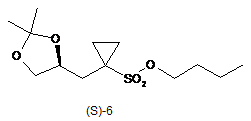
піддають взаємодії з алкоголятом натрію, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-7.
7. Спосіб за п. 6, в якому зазначену сполуку формули (S)-6

одержують тим, що сполуку формули (S)-4
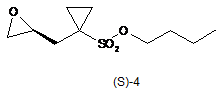
піддають взаємодії або з:
а) трифторидом бору, необов'язково у вигляді комплексу, необов'язково в розчиннику, або з
б) гідратом фосфорномолібденової кислоти, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-6.
8. Спосіб за п. 7, в якому зазначену сполуку формули (S)-4
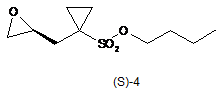
одержують тим, що сполуку формули (S)-3
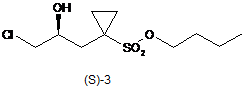
піддають взаємодії з основою, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-4.
9. Спосіб за п. 8, в якому зазначену сполуку формули (S)-3
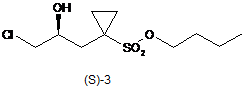
одержують тим, що:
a) сполуку формули 2
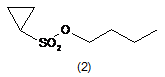
піддають взаємодії з основою для утворення депротонованої сполуки формули 2, необов'язково в розчиннику;
б) додають сполуку формули (S)-1 і трифторид бору, необов'язково у вигляді комплексу; і
в) депротоновану сполуку формули 2 піддають взаємодії зі сполукою формули (S)-1
 ,
,
одержуючи таким чином сполуку формули (S)-3.
10. Спосіб за п. 6, в якому зазначену сполуку формули (S)-6

одержують тим, що сполуку формули (S)-5
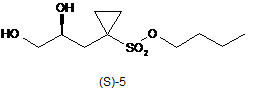
піддають взаємодії з 2,2-диметоксипропаном, необов'язково в розчиннику, і необов'язково в присутності каталізатора, одержуючи таким чином сполуку формули (S)-6.
11. Спосіб за п. 10, в якому зазначену сполуку формули (S)-5
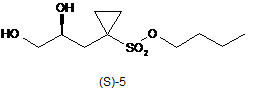
одержують тим, що сполуку формули (S)-9
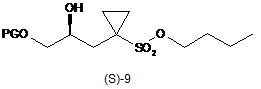 ,
,
в якій PG являє собою захисну групу, піддають взаємодії з кислотою, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-5.
12. Спосіб за п. 11, в якому зазначену сполуку формули (S)-9
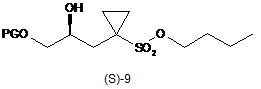 ,
,
в якій PG являє собою групу т-бутилдиметилсилілу або групу тетрагідропіранілу, одержують тим, що:
а) сполуку формули 2
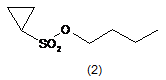
піддають взаємодії з основою для утворення депротонованої сполуки формули 2, необов'язково в розчиннику;
б) додають сполуку формули (S)-8 і трифторид бору, необов'язково у вигляді комплексу; і
в) депротоновану сполуку формули 2 піддають взаємодії зі сполукою формули (S)-8
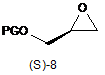 ,
,
в якій PG являє собою групу т-бутилдиметилсилілу або групу тетрагідропіранілу, одержуючи таким чином сполуку формули (S)-9.
13. Спосіб за п. 5, в якому зазначену сполуку формули (S)-7

одержують тим, що сполуку формули (S)-6

піддають взаємодії з алкоголятом натрію, необов'язково в розчиннику, одержуючи таким чином сполуку формули (S)-7.
Текст
Реферат: Даний винахід стосується нового енантіоселективного способу одержання (S)- і (R)енантіомерів N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3дигідроксипропіл]циклопропансульфонаміду, нових проміжних сполук і застосування зазначених нових проміжних сполук для одержання зазначених (S)- і (R)-енантіомерів N-{3,4дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3дигідроксипропіл]циклопропансульфонаміду: UA 113850 C2 (12) UA 113850 C2 HO HO OH OH SO2 NH F F (S)-14 BAY 86-9766 RDEA-119 NH H N O SO2 F F H N O F I F , (R)-14 I . UA 113850 C2 5 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до нового енантіоселективного способу одержання (S)- і (R)енантіомерів N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідроксипропіл]циклопропансульфонаміду, до нових проміжних сполук і до застосування зазначених нових проміжних сполук для одержання зазначених (S)- і (R)-енантіомерів N-{3,4-дифтор-2-[(2фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідрокси-пропіл]циклопропансульфонаміду: HO HO OH SO2 OH F NH H N O 20 25 H N I F I F F 15 F NH O F 10 SO2 (S)-14 (R)-14 BAY 86-9766 RDEA 119 Передумови для створення винаходу N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонамід (надалі зазначається як “(S)-14", "BAY 86-9766" або "RDEA 119") представляє собою високоактивний і селективний MEK1/2 інгібітор, що наразі знаходиться в розробці в клінічних дослідженнях для лікування пізньої стадії раку у пацієнтів несприйнятливих або які не переносять інше протипухлинне лікування [див. 1]. Вихідний синтез (S)-14, показаний на схемі A, нижче, опублікований у US 2008/0058340 [див. 2] включає каталізоване осмієм дигідроксилювання алілсульфонамід-заміщеного ядра за яким іде хроматографічне розділення енантіомерів з використанням хіральної нерухомої фази: вихідний синтез (S)-14 забезпечує цільову сполуку у вигляді рацемічної суміші, яку необхідно розділити хіральною хроматографією [див. 2]. Схема A: Рацемічний синтез (S)-14 відповідно до US 2008/0058340: NMO: 4-метилморфолін 4-оксид моногідрат хіральна хроматографія На схемі A, вище, одержують рацемічну суміш (S)- і (R)-енантіомерів N-{3,4-дифтор-2-[(2фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідрокси-пропіл]циклопропансульфонаміду, яка, як видно, повинна бути розділена хіральною хроматографією, щоб забезпечити окремі енантіомери. Суттєвий недолік цього розділення енантіомерів хіральною хроматографією після 1 UA 113850 C2 5 10 15 20 25 30 останньої стадії синтезу полягає в тому, що на додаток до стадії хірального розділення, повинні бути вироблені більше ніж у два рази більші кількості всіх проміжних продуктів, щоб отримати ту ж саму кількість (S)-14 (RDEA 119). Як зазначено вище, іншим недоліком синтезу з рівня техніки схеми A є застосування дуже токсичного тетраоксиду осмію, яке потребує додаткових зусиль, щоб видалити вміст осмію до прийнятних рівнів. Інший синтез (S)-14, показаний на схемі B, нижче, опублікований в патентній заявці PCT під WO 2011/009541 A1 [див. 7], описує хіральне одержання (R)- і (S)-N-{3,4-дифтор-2-[(2-фтор-4йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідрокси-пропіл]циклопропансульфонаміду і його захищених похідних. Схема B, нижче, демонструє синтез (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду відповідно до WO 2011/009541 A1 [див. 7]: СХЕМА B Синтез як писано в WO 2011/009541 A1 починають з комерційно доступного гліцидного спирту, який перетворюють за допомогою захисту спирту і сполучення (стадія A) з захищеним ацетиленом з наступним зняттям захисту (стадія B) і йодуванням з 9-I-BBN (стадія C), щоб забезпечити 4-йодпент-4-ен-1,2-діол, обидві HO групи якого захищені (стадія D). Групу циклопропілу вводять через алкеновий фрагмент діол-захищеного 4-йодпент-4-ен-1,2-діолу (стадія E), щоб утворити захищене похідне 3-(1-йодциклопропіл)пропан-1,2-діолу, з якого потім знімають захист (стадія F) і захищають знову (стадія G), до того як група йоду якого перетвориться в групу сульфонілхлориду на стадії H. Було винайдено, і це забезпечує основу даного винаходу, що (S)-14 може бути синтезований за допомогою хірального синтезу 1-{[(4S)-2,2-диметил-1,3-діоксолан-4ил]метил}циклопропансульфонату натрію (надалі також згадується як сполука "(S)-7"), виходячи з (S)-епіхлоргідрину (надалі також зазначається як сполука "(S)-1") і альтернативно з енантіомерно чистих похідних гліцидного спирту, як показано на схемах 1 і 2, нижче. R-Енантіомери були одержані таким самим чином. Схема 1, нижче, представляє загальну ілюстрацію стадій, застосовних в хіральному синтезі 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонату натрію ((S)-7) відповідно до даного винаходу: СХЕМА 1 2 UA 113850 C2 5 10 15 Видно, що стадії на схемі 1 відносяться до енантіоселективного синтезу (S)-7, з використанням (S)-енантіомерів всіх проміжних продуктів, залучених у зазначений синтез: як очевидно спеціалісту в даній галузі техніки, енантіоселективний синтез (R)-7 ідентичний синтезу (S)-7 як показано на схемі 1, вище, за винятком того, що в ньому використовують (R)енантіомери всіх проміжних продуктів замість (S)-енантіомерів. Виходячи з недорогих хіральних похідних епоксипропану, одержували хіральний 1-{[(4S)-2,2диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонат натрію ((S)-7) (Схема 1, вище), який перетворювали в хіральний 1-{[(4S)-2,2-диметил-1,3-діоксолан-4ил]метил}циклопропансульфонілхлорид (S)-10, який, у свою чергу, перетворювали в кінцевий продукт, N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонамід (S)-14), відповідно до схеми 2, нижче. Схема 2, нижче, представляє загальну ілюстрацію стадій, застосовних в хіральному синтезі N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонаміду ((S)-14) з 1-{[(4S)-2,2-диметил-1,3-діоксолан-4ил]метил}циклопропансульфонату натрію ((S)-7) відповідно до даного винаходу: 3 UA 113850 C2 СХЕМА 2 5 10 15 Видно, що стадії на схемі 2 відносяться до енантіоселективного синтезу (S)-14, з використанням (S)-енантіомерів всіх проміжних продуктів, залучених у зазначений синтез: як очевидно спеціалісту в даній галузі техніки, енантіоселективний синтез (R)-14 є ідентичним синтезу (S)-14, за винятком того, що в ньому використовують (R)-енантіомери всіх проміжних продуктів замість (S)-енантіомерів. Синтез RDEA 119, як зображено на схемах 1 і 2 даного винаходу надає сполуку 14, що містить 79-85 % цільового енантіомера (S)-14 (за допомогою стадій A, B, C), тому, тільки 1521 % небажаного ізомеру потребує видалення за допомогою хроматографії. Кількості проміжних продуктів і відходів, а також витрати на одержання (S)-14 таким чином суттєво знижуються з використанням синтезу, що пропонується в даному винаході. Крім того, уникають застосування токсичного тетраоксиду осмію. Крім того, синтез RDEA 119, як зображено на схемах 1 і 2 даного винаходу надає сполуку 14 у вигляді цільового енантіомера (S)-14 (за допомогою стадій E, F, G), полегшуючи технічні 4 UA 113850 C2 5 10 15 20 25 30 35 40 45 50 55 60 задачі розділення енантіомерів хіральною хроматографією, і застосування токсичного тетраоксиду осмію. Таким чином, кількості проміжних продуктів і відходів, а також витрати на одержання (S)-14 суттєво знижуються з використанням синтезу, що пропонується в даному винаході. Синтез сульфонілхлориду (S-10), зображений на схемах 1 і 2 відповідно до даного винаходу включає в себе 5 стадій (стадії A, B, C, D і H, або стадії E, F, G, D і H), включаючи одну стадію захисту (стадія C, виходячи з (S)-1, або стадія G, виходячи з (S)-8). Крім того, синтез сульфонілхлориду (S-10), зображений на схемах 1 і 2 відповідно до даного винаходу протікає з загальним виходом в >60 % з (S)-8 (стадії, E, F, G, D, H). Всі реагенти, що використовують в синтезі сульфонілхлориду (S-10), зображеному на схемах 1 і 2 відповідно до даного винаходу (фосфорилхлорид, диметоксипропан, метилат натрію) є недорогими і доступні великими партіями. Синтез сульфонілхлориду (S-10), зображений на схемах 1 і 2 відповідно до даного винаходу забезпечує хіральний 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонат натрію (S)-7, у вигляді твердого проміжного продукту, який можна очистити кристалізацією. Як видно в Експериментальній частині, Приклад 9b, було винайдено, що реакція 1-{[(4R)-2,2диметил-1,3-діоксолан-4-ил]метил}циклопропан-сульфонілхлориду (сполука (R)-10) з 5,6дифтор-N1-(4-фтор-2-йодфеніл)-3-метоксибензол-1,2-діаміном (сполука 12), у присутності 4диметиламінопіридину в піридині, при описаних умовах, забезпечувала тільки процентний вихід у 38,9 % N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-{[(4R)-2,2-диметил-1,3діоксолан-4-ил]метил}циклопропансульфонаміду (сполука (R)-13). Тим не менш, несподівано, активований бромідом спосіб даного винаходу, як показано на схемі 2, стадії J і K) забезпечує чистий (S)-14 продукт з дуже гарним виходом: як видно, особливо в Експериментальній частині, Приклад 9a, несподівано було винайдено, що реакція 1-{[(4S)-2,2-диметил-1,3-діоксолан-4ил]метил}циклопропансульфонілхлориду (сполука (S)-10) з 5,6-дифтор-N1-(4-фтор-2-йодфеніл)3-метоксибензол-1,2-діаміном (сполука 12), у присутності броміду тетрабутиламонію в піридині й сульфолані, забезпечувала, при описаних умовах, процентний вихід у 92,2 % N-{3,4-дифтор-2[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-{[(4S)-2,2-диметил-1,3-діоксолан-4ил]метил}циклопропансульфонаміду (сполука (S)-13), тим самим надаючи збільшення процентного виходу продукту у більше 50 % при безпосередньому порівнянні способу в Прикладі 9а зі способом в Прикладі 9b. Безсумнівно, це є вигідним з хімічної експериментальної точки зору, приймаючи до уваги продуктивність способу і зниження кількості домішок. Крім того, набагато є більш важливим, як видно в Експериментальній частині, Приклад 10a, несподівано було винайдено, що: реакція 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонілхлориду (сполука (S)-10) з 5,6-дифтор-N1-(4-фтор-2-йодфеніл)-3-метоксибензол-1,2-діамін (сполука 12), у присутності броміду тетрабутиламонію в піридині й сульфолані, потім, після повного перетворення в N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-{[(4S)-2,2диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонамід (сполука (S)-13), - за якою йде перемішування одержаної реакційної суміші з соляною кислотою, забезпечувала, при описаних умовах, процентний вихід у 91,6 % N-{3,4-дифтор-2-[(2-фтор-4йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідрокси-пропіл]циклопропансульфонаміду (сполука (S)-14): цей "однореакторний" спосіб Прикладу 10a безумовно є вигідним з хімічної експериментальної точки зору, в перерахунку на ефективність процесу. Крім того, несподівано було винайдено, що одержання (S)-13 з (S)-10-Br і однореакторне перетворення в R-14 протікає набагато чистіше і при температурі в 23 °C, у порівнянні з одержанням (S)-13 з (S)-10 і однореакторним перетворенням в R-14, яке протікає при температурі в 70 °C. Таким чином, спосіб одержання (S)-14 з (S)-10, що пропонується в даному винаході, зокрема однореакторний спосіб одержання (S)-14 з (S)-10, як описано і визначено в даному описі, несподівано є безумовно вигідним в технічному відношенні. Наведений нижче опис надає додаткові загальні подробиці кожної стадії, показаної на схемах 1 і 2, вище, разом з їх технічними перевагами. I. Стосовно схеми 1, стадії A, B, C, E, F, G, і D, вище: Синтез бутил 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонатів 6 Депротонування бутил циклопропансульфонату 2 з н-бутиллітієм і реакція з (S)епіхлоргідрином (S)-1 забезпечили хлороспирт 3 з гарним виходом (див. схему 1, стадію A, вище, і схему 3, нижче). Хлороспирт 3 перетворювали кількісно в епоксид 4 з водним гідроксидом натрію в тетрагідрофурані (див. схему 1, стадія B, і схему 3, нижче). Схема 3: стереоселективний синтез епоксидів 4, виходячи з (S)-епіхлоргідрину (S)-1: 5 UA 113850 C2 BF3 эфірат; HCl водн 5 Здійснення першої стадії послідовності без добавок привело до 65 % утворення побічних продуктів, викликаного конкурувальним самоалкілуванням (див. схему 4, нижче). Деякі добавки, такі як TMEDA (N, N,N',N'-тетраметилетилендіамін), DMI (1,3-диметил-2-імідазолідинон), DMPU (1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідинон), CuI, LiI були профільтровані, але не показали будь-якого суттєвого покращення: несподівано було винайдено, що 1 еквівалент ефірату трифториду бору викликав суттєве зменшення утворення побічних продуктів: Схема 4: утворення побічних продуктів S O 10 15 20 25 30 OBu 1. n-BuLi, ТГФ, -78°C 2. добавка Bu S O O OBu O + S O OLi O 2 З реакцій, здійснених з бромідом магнію, 1-бром-3-хлорпропан-2-ол виділяли у вигляді єдиного продукту, не спостерігали перетворення, коли як добавку використовували тріетилбор. З усіх випробуваних добавок ефірат трифториду бору був визначений як найбільш перспективний. Гарні результати були одержані з 1.0 еквівалентом ефірату трифториду бору, у той час як більша кількість еквівалентів призвела до утворення полімерів. Реакція ізопропіл циклопропансульфонату з (S)-2-(бензилоксиметил)оксирану у присутності 0.83 еквівалента гексаметилфосфортріаміду (HMPT) була опублікована в міжнародній патентній заявці WO 2010/145197 A1 [див. 3]. Тому що HMPT проявляє канцерогенні й мутагенні властивості, то перевагу було надано застосуванню ефірату трифториду бору замість HMPT як добавки для промислового одержання (див. схему 5, нижче). Схема 5: Пряме перетворення епоксидів 4 в діоксолани 6 (див. схему 1, стадія C, вище): Як показано з (R)-4 пряме перетворення епоксиду 4 з ацетоном, каталізованим ефіратом трифториду бору або гідратом фосфорномолібденової кислоти на виході дало діоксолан 6 у вигляді суміші енантіомерів з 58.2 і 69.8 % е.н. відповідно (схема 5). Альтернативно, одержували хіральний діол 5, без рацемізації, з TBDMS- і THP-захищених гліцидних спиртів (9a і 9b, відповідно) і бутилциклопропансульфонат (2) при таких самих умовах, оптимізованих для одержання хлороспирту 3 з гарним виходом (див. схему 1, стадію E, вище). На щастя, TBDMS- і THP-захищені групи можуть бути легко видалені за допомогою кислотної обробки захищених проміжних продуктів 9a і 9b, надаючиенантіомерно чистий діол 5 (див. схему 1, стадію F, вище, і схему 6, нижче). Схема 6: хіральний синтез, виходячи з захищених гліцидних спиртів 6 UA 113850 C2 5 Реакції, проведені без добавок в результаті дали до 65 % утворення побічних продуктів, викликаного конкурувальним самоалкілуванням (див. схему 7, нижче). Внаслідок цього деякі добавки, такі як TMEDA, DMI, DMPU, CuI, LiI були профільтровані, але не показали суттєвого покращення (див. схему 7, нижче). Схема 7: утворення побічних продуктів S O OBu 1. n-BuLi, ТГФ, -78°C 2. добавка Bu S O O OBu O + S O OLi O 2 10 15 20 25 30 З реакцій, здійснених з бромідом магнію, виділяли 1-бром-3-хлор-пропан-2-ол у вигляді єдиного продукту, перетворення не спостерігали, коли як добавку застосовували тріетилбор. З усіх випробуваних добавок ефірат трифториду бору був визначений як найбільш перспективний. Гарні результати були одержані з 1.0 еквівалентом ефірату трифториду бору, тоді як більша кількість еквівалентів привела до утворення полімерів. Реакція ізопропіл циклопропансульфонату з (S)-2-(бензилоксиметил)оксираном у присутності 0.83 еквівалентів гексаметилфосфортріаміду (HMPT) була опублікована [див. 3]. Тому що HMPT проявляє канцерогенні й мутагенні властивості, перевага була віддана застосуванню ефірату трифториду бору замість HMPT як добавки для промислового одержання. Хіральний діол 5 одержували без рацемізації з TBDMS-, а також THP-захищених гліцидних спиртів (8a і 8b, відповідно) і бутил циклопропансульфонату 2. На щастя TBDMS- і THP-захищені групи можуть бути легко видалені за допомогою кислотної обробки, що надає енантіомерно чистий діол 5 (див. схему 1, стадію F, вище). Хіральний діол 5 потім перетворювали у цільовой діоксолан 6 з 2,2-диметоксипропаном, каталізованим п-толуолсульфонатом піридинію з гарним виходом (див. схему 1, стадія G, вище). II. Стосовно схеми 2, стадії H, J (і I), і K, вище: Синтез (S)-14 за допомогою сульфонілхлориду (S)-10 Як видно вище, утворення сульфонату натрію 7 було досягнуто з використанням метилату натрію замість суттєво більш дорогого тіоціанату калію [див. 1,2] (див. схему 1, стадію D, вище, і схему 8, нижче). Одержували чистий сульфонат натрію 7 з кристалізації з етанолом або ізопропанолом. Реакція 7 в піридині з фосфорилхлоридом [див. 4] виявилася більш економічним шляхом до сульфонілхлориду 10 у порівнянні з ціанурхлоридом [див. 5] як реагенту хлорування (див. схему 2, стадія H, вище, і схему 8, нижче). Після водної обробки, 7 UA 113850 C2 5 одержували 10 з гарним виходом без ушкодження захисної групи діоксолану. Реакції з оксалілхлоридом або трифенілфосфіномом/сульфурилхлоридом [див. 6] були менш ефективними. Енантіомерна чистота 10 була оцінена за допомогою хіральної ВЕРХ відповідних анілідів 11 (див. схему 2, стадія I, вище, і схему 8, нижче). Реакцію сульфонілхлориду 10 з аніліном прискорювали додаванням броміду літію. Схема 8: Синтез хіральних амідів DME, NaOMe, нагрів. в колбі зі звор. холодильн. O O S (S)-6 O O O OBu ONa S стадія D O (S)-7 O O піридин, POCl3 стадія H O H N O S (S)-11 O 10 анілін, LiBr, CH2Cl2 O O стадія I S O (S)-10 O Cl O Виходячи з сульфонілхлориду (S)-10 енантіомерно чистий (S)-14 готували з бромідом тетрабутиламонію як добавку при 70 °C в сульфолан/піридині 2:1 з наступним кислотним зняттям захисту (S)-13 під час водної обробки (див. схему 2, стадія K, вище, і схему 9, нижче). Амідне утворення прискорювали додаванням бромід тетрабутиламонію (див. схему 9, нижче). Сульфонілхлорид (R)-10 утворив енантіомер (R)-14 відповідно (див. схему 9, нижче). Енантіомерна чистота 14 була визначена за допомогою хіральної ВЕРХ. Схема 9: стереоселективний синтез (S)-14 O O S NH2 O H N Cl HO O (S)-10 O O F O сульфолан, піридин TBAB, 70°C O2S NH O F I H N OH O2S F HCl водн. стадія K стадія J F I F 12 F I F (S)-13 RDEA 119 (S)-14 Тому, в першому аспекті, даний винахід відноситься до способу одержання N-{3,4-дифтор-2[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонаміду формули (S)-14: HO OH SO2 F NH H N O F F 20 H N F F 15 NH O (S)-14, за допомогою наступних стадій, показаних на схемах 1 і 2, нижче: СХЕМА 1 8 I UA 113850 C2 O O Cl PGO ((S)-1) ((S)-8) Стадія A Стадія E O SO2 (2) OH O SO2 Cl ((S)-3) Стадія B O OH O PGO SO2 O SO2 ((S)-9) ((S)-4) Стадія C Стадія F O O HO O SO2 O SO2 ((S)-5) ((S)-6) Стадія D O O OH Стадія G O SO2 Na ((S)-7) СХЕМА 2 9 UA 113850 C2 O O O SO2 Na ((S)-7) Стадія H O O Стадія I O H N O Cl SO2 SO2 ((S)-11) ((S)-10) NH2 O Стадія J F H N I F F (12) O O SO2 F NH H N O I F ((S)-13) F Стадія K HO OH SO2 F NH H N O I F F ((S)-14) . У варіанті здійснення першого аспекту, даний винахід відноситься до способу одержання сполуки формули (S)-14: HO OH SO2 F NH H N O F F 5 (S)-14; що включає: 10 I UA 113850 C2 I) наступну стадію J: в якій сполуку формули (S)-10: O O Cl SO2 (S)-10 піддають взаємодії зі сполукою формули (12): NH2 O F H N I F F 5 (12) у присутності броміду, такого як бромід тетра-н-бутиламонію або бромід літію, наприклад, за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (S)13: O O SO2 F NH H N O I F 10 15 F ((S)-13) ; і, потім, II) наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до зазначеної реакційної суміші, що містить сполуку формули (S)-13, надаючи таким чином сполуку формули (S)-14. Альтернативно, у зазначеній вище стадії J, каталізатор, такий як 4-диметиламінопіридин, наприклад, може бути використаний замість зазначеного броміду. Альтернативно, на схемі 2, стадія J, сполуку формули (S)-10-Br: O O S O 20 Br O (S)-10-Br може бути використано замість сполуки (S)-10. Тому, у варіанті здійснення першого аспекту, даний винахід відноситься до способу одержання сполуки формули (S)-14: 11 UA 113850 C2 HO OH SO2 F NH H N O I F F 5 (S)-14; що включає: I) наступну стадію J: в якій сполуку формули (S)-10-Br: O O Br SO2 (S)-10-Br піддають взаємодії зі сполукою формули (12): NH2 H N O F I F F 10 (12) за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (S)-13: O O SO2 F NH H N O F ((S)-13) 15 I F ; і, потім, II) наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до зазначеної реакційної суміші, що містить сполуку формули (S)-13, надаючи таким чином сполуку формули (S)-14. У другом варіанті здійснення першого аспекту, даний винахід відноситься до способу одержання сполуки формули (S)-14: 12 UA 113850 C2 HO OH SO2 F NH H N O I F F 5 (S)-14; що включає наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до сполуки формули (S)-13: O O SO2 F NH H N O I F F ((S)-13) ; надаючи таким чином сполуку формули (S)-14. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-13: O O SO2 F NH H N O F 10 ((S)-13) одержують наступною стадією J: в якій сполуку формули (S)-10: F O O Cl SO2 (S)-10 піддають взаємодії зі сполукою формули (12): 13 I UA 113850 C2 NH2 O F H N I F F 5 (12) у присутності броміду, такого як бромід тетра-н-бутиламонію або бромід літію, наприклад, за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (S)13: O O SO2 F NH H N O I F 10 F ((S)-13) . Альтернативно, у зазначеній вище стадії J, каталізатор, такий як 4-диметиламінопіридин, наприклад, може бути використаний замість зазначеного броміду. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-13: O O SO2 F NH H N O F ((S)-13) одержують наступною стадією J: в якій сполуку формули (S)-10-Br: F O O 15 Br SO2 (S)-10-Br піддають взаємодії зі сполукою формули (12): 14 I UA 113850 C2 F NH2 H N O I F F (12) за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (S)-13: O O SO2 F NH H N O I F 5 F ((S)-13) . У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-10: O O Cl SO2 (S)-10 одержують тим, що сполуку формули (S)-7: O O 10 15 O SO2 Na (S)-7 , піддають взаємодії з хлорувальним агентом, таким як P(O)Cl 3, PCl3 або SOCl2, наприклад, за вибором у розчиннику, такому як піридин, наприклад, надаючи таким чином сполуку формули (S)-10. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-10-Br: O O S O (S)-10-Br одержують тим, що сполуку формули (S)-7: 15 Br O UA 113850 C2 O O 5 O SO2 Na (S)-7 , піддають взаємодії з бромувальним агентом, таким як P(O)Br 3 або PBr3, наприклад, за вибором у розчиннику, такому як піридин, наприклад, надаючи таким чином сполуку формули (S)-10-Br. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-7: O O O SO2 Na (S)-7 одержують тим, що сполуку формули (S)-6: O O 10 O SO2 (S)-6 піддають взаємодії з алкоголятом натрію, таким як метилат натрію, наприклад, за вибором у розчиннику, такому як метанол, наприклад, надаючи таким чином сполуку формули (S)-7. У додатковому варіанті здійснення першого аспекту, даний винахід відноситься до способу одержання сполуки формули (S)-10: O O Cl SO2 (S)-10 15 , в якій сполуку формули (S)-7": O O 20 O SO2 K (S)-7' , піддають взаємодії з хлорувальним агентом, таким як P(O)Cl3, PCl3 або SOCl2, наприклад, за вибором у розчиннику, такому як піридин, наприклад, надаючи таким чином сполуку формули (S)-10. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-7": O O O SO2 K (S)-7' 16 UA 113850 C2 одержують тим, що сполуку формули (S)-6: O O 5 O SO2 (S)-6 піддають взаємодії з алкоголятом калію, таким як метилат калію, наприклад, за вибором у розчиннику, такому як метанол, наприклад, надаючи таким чином сполуку формули (S)-7". Додатковий варіант здійснення першого аспекту даного винаходу відноситься до способу одержання N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонаміду формули (S)-14: HO OH SO2 F NH H N O F I F 10 (S)-14; що включає наступну стадію D: в якій сполуку формули (S)-6: O O 15 O SO2 (S)-6 піддають взаємодії з алкоголятом натрію, таким як метилат натрію, наприклад, за вибором у розчиннику, такому як метанол, наприклад, надаючи таким чином сполуку формули (S)-7: O O O SO2 Na (S)-7 . Додатковий варіант здійснення першого аспекту даного винаходу відноситься до способу одержання N-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонаміду формули (S)-14: 17 UA 113850 C2 HO OH SO2 F NH H N O F I F (S)-14; що включає наступну стадію D: в якій сполуку формули (S)-6: O O 5 O SO2 (S)-6 піддають взаємодії з алкоголятом калію, таким як метилат калію, наприклад, за вибором у розчиннику, такому як метанол, наприклад, надаючи таким чином сполуку формули (S)-7": O O O SO2 K (S)-7' 10 . У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-6: O O O SO2 (S)-6 одержують тим, що сполуку формули (S)-4: O O SO2 15 20 (S)-4 піддають взаємодії або с: a) трифторидом бору, за вибором у вигляді комплексу, такого як комплекс ефірату трифториду бору, наприклад, такого як комплекс трифторид бору-тетрагідрофуран, або комплекс трифторид бору-діетиловий ефір, наприклад, за вибором у розчиннику, такому як ацетон, наприклад, або з б) гідратом фосфорномолібденової кислоти, за вибором у розчиннику, такому як ацетон, наприклад, надаючи таким чином сполуку формули (S)-6. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-4: 18 UA 113850 C2 O O SO2 (S)-4 одержують тим, що сполуку формули (S)-3: OH Cl 5 O SO2 (S)-3; піддають взаємодії з основою, такою як гідроксид натрію, наприклад, за вибором у розчиннику, такому як, наприклад, вода, надаючи таким чином сполуку формули (S)-4. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-3: OH Cl 10 O SO2 (S)-3; одержують тим, що: a) сполуку формули 2: O SO2 15 20 (2) піддають взаємодії з основою, такою як н-бутиллітій, наприклад, за вибором у розчиннику, такому як тетрагідрофуран, наприклад, б) додають сполуку формули (S)-1 і трифторид бору, за вибором у вигляді комплексу, такого як комплекс ефірату трифториду бору, наприклад, такий як комплекс трифторид борутетрагідрофуран, або комплекс трифторид бору-діетиловий ефір, наприклад; і в) утворену таким чином депротоновану сполуку формули 2 піддають взаємодії зі сполукою формули (S)-1: O Cl 25 (S)-1; надаючи таким чином сполуку формули (S)-3. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-6: O O O SO2 (S)-6 одержують тим, що сполуку формули (S)-5: OH HO 30 35 O SO2 (S)-5 піддають взаємодії з 2,2-диметоксипропаном, за вибором у розчиннику, такому як тетрагідрофуран, наприклад і за вибором у присутності каталізатора, такого як нтолуолсульфонат піридинію наприклад, надаючи таким чином сполуку формули (S)-6. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-5: 19 UA 113850 C2 OH HO O SO2 (S)-5 одержують тим, що сполуку формули (S)-9: OH PGO 5 10 O SO2 (S)-9; в якій PG представляє собою захисну групу, таку як група м-бутилдиметилсилілу (сполука (S)-9a) або група тетрагідропіранілу (сполука (S)-9b), наприклад, піддають взаємодії з кислотою, такою як соляна кислота або н-толуолсульфонова кислота, наприклад, за вибором у розчиннику, такому як метанол, наприклад, надаючи таким чином сполуку формули (S)-5. У додатковому варіанті здійснення першого аспекту даного винаходу, зазначену вище сполуку формули (S)-9: OH PGO 15 O SO2 (S)-9; в якій PG представляє собою групу м-бутилдиметилсилілу (сполука (S)-9a) або групу тетрагідропіранілу (сполука (S)-9b), одержують тим, що: a) сполуку формули 2: O SO2 20 (2) піддають взаємодії з основою, такою як н-бутиллітій, наприклад, за вибором у розчиннику, такому як тетрагідрофуран, наприклад, б) додають сполуку формули (S)-8 і трифторид бору, за вибором у вигляді комплексу, такого як комплекс ефірату трифториду бору, наприклад, такий як комплекс трифторид борутетрагідрофуран, або комплекс трифторид бору-діетиловий ефір, наприклад; і в) утворену таким чином депротоновану сполуку формули 2 піддають взаємодії зі сполукою формули (S)-8: O PGO 25 30 35 (S)-8, в якій PG представляє собою групу т-бутилдиметилсилілу (сполука (S)-8a) або групу тетрагідропіранілу (сполука (S)-8b), відповідно, надаючи таким чином сполуку формули (S)-9. У додатковому варіанті здійснення першого аспекту, даний винахід відноситься до способу одержання сполуки формули (S)-14, в якій кожна з зазначених стадій від A до K, як показано на схемах 1 і 2, вище, описані відносно схем від 3 до 9, вище. Згідно з другим аспектом, даний винахід відноситься до проміжним сполук, які використовують при одержанні зазначеної вище сполуки формули (S)-14. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонілбромід (S)-10-Br: O O S O Br O (S)-10-Br. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до 20 UA 113850 C2 сполуки: 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонат калію (S)-7": O O 5 O SO2 K (S)-7' . В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонат (S)-6: O O 10 O SO2 (S)-6. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонат (S)-5: OH HO 15 O SO2 (S)-5. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-[(2S)-оксиран-2-ілметил]циклопропансульфонат (S)-4: O O SO2 20 (S)-4. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-[(2S)-3-хлор-2-гідроксипропіл]циклопропансульфонат (S)-3: OH Cl 25 O SO2 (S)-3. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-[(2S)-3-{[трет-бутил(диметил)силіл]окси}-2-гідроксипропіл] циклопропансульфонат (S)-9a: OH O O SO2 Si 30 (S)-9a. В одному варіанті здійснення зазначеного другого аспекту, даний винахід відноситься до сполуки: Бутил 1-[(2S)-2-гідрокси-3-(тетрагідро-2H-піран-2-ілокси)пропіл]циклопропансульфонат (S)9b: 21 UA 113850 C2 OH O 5 O O SO2 (S)-9b. У третьому аспекті, даний винахід відноситься до застосування проміжних сполук відповідно до другого аспекту, вище, для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонілброміду (S)-10-Br: O O S O 10 Br O (S)-10-Br для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонату калію (S)-7": O O 15 O SO2 K (S)-7' ; для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-{[(4S)-2,2-диметил-1,3-діоксолан-4-ил]метил}циклопропансульфонату (S)-6: O O 20 (S)-6; для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-[(2S)-2,3-дигідроксипропіл]циклопропансульфонату (S)-5: OH HO 25 30 O SO2 O SO2 (S)-5; для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-[(2S)-оксиран-2-ілметил]циклопропансульфонату (S)-4: O O SO2 (S)-4; для одержання сполуки формули (S)-14, вище. 22 UA 113850 C2 В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-[(2S)-3-хлор-2-гідроксипропіл]циклопропансульфонату (S)-3: OH Cl 5 10 O SO2 (S)-3; для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-[(2S)-3-{[трет-бутил(диметил)силіл]окси}-2-гідроксипропіл] циклопропансульфонату (S)-9a: OH O O SO2 Si 15 (S)-9a; для одержання сполуки формули (S)-14, вище. В одному варіанті здійснення зазначеного третього аспекту, даний винахід відноситься до застосування: Бутил 1-[(2S)-2-гідрокси-3-(тетрагідро-2H-піран-2-ілокси)пропіл]циклопропансульфонату (S)9b: OH O 20 O O SO2 (S)-9b; для одержання сполуки формули (S)-14, вище. У четвертому аспекті, даний винахід відноситься до способу одержання N-{3,4-дифтор-2-[(2фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[(2R)-2,3-дигідроксипропіл]циклопропансульфонаміду формули (R)-14: HO OH SO2 F NH H N O F 25 F (R)-14, за допомогою наступних стадій, показаних на схемах C і D, нижче: СХЕМА C 23 I UA 113850 C2 O O Cl PGO ((R)-1) ((R)-8) Стадія A Стадія E O SO2 (2) OH O SO2 Cl ((R)-3) Стадия B O OH O PGO SO2 O SO2 ((R)-9) ((R)-4) Стадія C Стадія F O O HO O SO2 O SO2 ((R)-5) ((R)-6) Стадія D O O OH Стадія G O SO2 Na ((R)-7) СХЕМА D 24 UA 113850 C2 O O O SO2 Na ((R)-7) Стадія H Стадія I O O O H N O Cl SO2 SO2 ((R)-11) ((R)-10) NH2 O Стадія J F H N F I F (12) O O SO2 F NH H N O I F ((R)-13) F Стадія K HO OH SO2 F NH H N O F I F ((R)-14) 5 . У додатковому варіанті здійснення четвертого аспекту, даний винахід відноситься до способу одержання сполуки формули (R)-14, в якій кожна з зазначених стадій від A до K як показано на схемах C і D, вище, описані аналогічно одержанню (S)-14 на схемах A і B, і схемах від 3 до 9, вище. В одному варіанті здійснення четвертого аспекту, даний винахід відноситься до способу одержання сполуки формули (R)-14: 25 UA 113850 C2 HO OH SO2 F NH H N O I F F 5 (R)-14; що включає: I) наступну стадію J: в якій сполуку формули (R)-10: O O Cl SO2 (R)-10 піддають взаємодії зі сполукою формули (12): NH2 O F H N I F F 10 (12) у присутності броміду, такого як тетра-н-бутиламонію бромід або бромід літію, наприклад, за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (R)-13: O O SO2 F NH H N O F ((R)-13) 15 20 I F ; і, потім, II) наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до зазначеної реакційної суміші, що містить сполуку формули (R)-13, надаючи таким чином сполуку формули (R)-14. Альтернативно, у зазначеній вище стадії J, каталізатор, такий як 4-диметиламінопіридин, наприклад, може бути використаний замість зазначеного броміду. Альтернативно, на схемі D, стадія J, сполука формули (R)-10-Br: 26 UA 113850 C2 O O S O 5 Br O (R)-10-Br може бути використана замість сполуки (R)-10. Тому, в варіанті здійснення четвертого аспекту, даний винахід відноситься до способу одержання сполуки формули (R)-14: HO OH SO2 F NH H N O I F F 10 (R)-14; що включає: I) наступну стадію J: в якій сполуку формули (R)-10-Br: O O Br SO2 (R)-10-Br піддають взаємодії зі сполукою формули (12): NH2 H N O F F I F 15 (12) за вибором у присутності основи, такої як піридин, наприклад, за вибором у розчиннику, такому як сульфолан, наприклад, надаючи таким чином реакційну суміш, що містить сполуку формули (R)-13: 27 UA 113850 C2 O O SO2 F NH H N O I F ((R)-13) 5 F ; і, потім, II) наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до зазначеної реакційної суміші, що містить сполуку формули (R)-13, надаючи таким чином сполуку формули (R)-14. В іншому варіанті здійснення четвертого аспекту, даний винахід відноситься до способу одержання сполуки формули (R)-14: HO OH SO2 F NH H N O I F 10 F (R)-14; що включає наступну стадію K: в якій водну мінеральну кислоту, таку як соляна кислота, наприклад, додають до сполуки формули (R)-13: O O SO2 F NH H N O F 15 I F ((R)-13) ; надаючи таким чином сполуку формули (R)-14. У додатковому варіанті здійснення четвертого аспекту даного винаходу, зазначену вище сполуку формули (R)-13: 28
ДивитисяДодаткова інформація
Назва патенту англійськоюChiral synthesis of n-{3,4-difluoro-2-[(2-fluoro-4-iodophenyl)amino]-6-methoxyphenyl}-1-[2,3-dihydroxy-propyl]cyclopropanesulfonamides
Автори англійськоюFey, Peter, Mayer, Agathe, Christine
Автори російськоюФей Петер, Майер Агате Кристине
МПК / Мітки
МПК: C07C 303/40, C07C 309/82, C07C 311/28, C07C 303/38
Мітки: n-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідроксипропіл]циклопропансульфонамідів, хіральний, синтез
Код посилання
<a href="https://ua.patents.su/56-113850-khiralnijj-sintez-n-34-diftor-2-2-ftor-4-jjodfenilamino-6-metoksifenil-1-23-digidroksipropilciklopropansulfonamidiv.html" target="_blank" rel="follow" title="База патентів України">Хіральний синтез n-{3,4-дифтор-2-[(2-фтор-4-йодфеніл)аміно]-6-метоксифеніл}-1-[2,3-дигідроксипропіл]циклопропансульфонамідів</a>
Попередній патент: Застосування сигма-лігандів при болю, пов’язаному з діабетом 2 типу
Наступний патент: Масляна дисперсія сульфоксімінів для боротьби з комахами
Випадковий патент: Дворядна ланцюгова передача