Кристали похідних 6,7-ненасиченого 7-карбамоїлморфінану і спосіб їх отримання
Номер патенту: 115028
Опубліковано: 11.09.2017
Автори: Ногуті Коуіті, Ода Сініті, Омура Сохеі, Інагакі Масанао, Хага Нобухіро, Тамура Йосінорі, Морімото Кендзі
Формула / Реферат
1. Сіль п-толуолсульфонової кислоти сполуки формули (ІА):
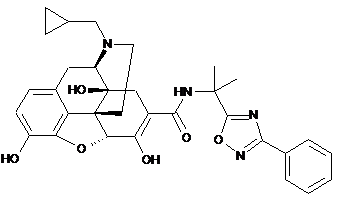 (ІА)
(ІА)
або її гідрат.
2. Кристалічна форма солі п-толуолсульфонової кислоти формули (ІC):
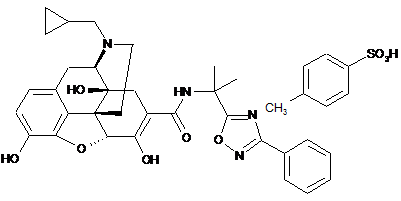 , (IC)
, (IC)
де в рентгенівському дифракційному спектрі порошку кристалів присутні піки, які відповідають дифракційним кутам (2q): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2°, 18,6°±0,2°, 20,4°±0,2°, 21,5°±0,2°, 21,9°±0,2°, 23,6°±0,2° і 25,5°±0,2°.
3. Кристалічна форма гідрату солі п-толуолсульфонової кислоти формули (ІС)
 , (IC)
, (IC)
яка містить воду, що відповідає від 1 до 2 молів води, де в рентгенівському дифракційному спектрі порошку кристалів присутні піки, які відповідають дифракційним кутам (2q): 6,6°±0,2°, 8,9°±0,2°, 11,4°±0,2°, 12,9°±0,2°, 14,0°±0,2°, 15,0°±0,2°, 17,6°±0,2°, 18,2°±0,2°, 22,4°±0,2°, 25,4°±0,2° і 28,7°±0,2°.
4. Форма II кристалічної форми гідрату солі п-толуолсульфонової кислоти формули (ІС)
 , (IC)
, (IC)
яка містить воду, що відповідає від 0,5 до 1 моля води, де в рентгенівському дифракційному спектрі порошку кристалів присутні піки, які відповідають дифракційним кутам (2q): 7,1°±0,2°, 8,8°±0,2°, 17,5°±0,2°, 19,2°±0,2°, 19,7°±0,2°, 21,2°±0,2°, 21,9°±0,2°, 23,7°±0,2°, 24,5°±0,2° і 26,1°±0,2°.
5. Фармацевтична композиція, яка включає терапевтично ефективну кількість кристалічної форми за будь-яким одним з пп. 2-4.
6. Спосіб отримання кристалічної форми солі п-толуолсульфонової кислоти формули (ІС)
 (IC)
(IC)
або кристалічної форми гідрату вказаної солі п-толуолсульфонової кислоти за будь-яким з пп. 2-4, що включає стадії:
додавання п-толуолсульфонової кислоти до сполуки формули (ІА)
 (ІА)
(ІА)
і кристалізації солі п-толуолсульфонової кислоти або її гідрату в розчиннику, за необхідності.
7. Спосіб отримання кристалічної форми або кристалічної форми гідрату вказаної солі п-толуолсульфонової кислоти за будь-яким з п. 2-4, який включає стадії:
1) обробляють основою сполуку формули (IID):
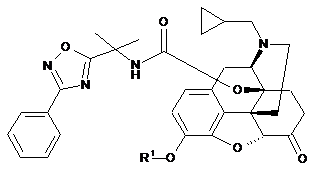 , (IID)
, (IID)
де R1 являє собою водень або захисну гідроксилгрупу, вибрану з групи, яка складається з бензилу, п-метоксифенілбензилу, ацетилу, формілу, бензоїлу, хлорацетилу, півалоїлу, метилкарбонату, ізобутилкарбонату, бензилкарбонату, вінілкарбонату, фенілкарбамату, мезилу, тозилу, триметилсилілу, триетилсилілу, трет-бутилдиметилсилілу, метоксиметилу, бензилоксиметилу, метоксіетоксиметилу, 2-(триметилсиліл)етоксиметилу, пропенілу, фенацилу і тетрагідропіранілу,
2) додають п-толуолсульфонову кислоту необов'язково після видалення захисної групи R1, і
3) необов'язково, кристалізують сіль п-толуолсульфонової кислоти з розчинника.
8. Спосіб за п. 7, який включає стадії
1) обробляють основою сполуку формули (ІІЕ):
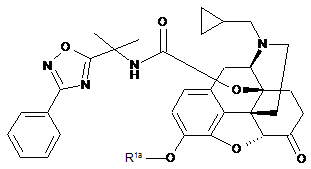 , (IIЕ)
, (IIЕ)
де R1a являє собою водень або захисну гідроксилгрупу, яку можна видалити основою, вибрану з групи, яка складається з ацетилу, формілу, бензоїлу, хлорацетилу, півалоїлу, метилкарбонату, ізобутилкарбонату, бензилкарбонату, вінілкарбонату, фенілкарбамату, мезилу і тозилу,
2) додають до цього п-толуолсульфонову кислоту, і
3) кристалізують сіль приєднання п-толуолсульфонової кислоти з розчинника.
Текст
Реферат: У даному винаході запропоновані стабільні кристалічні форми сполуки, представленої формулою (ІА): UA 115028 C2 (12) UA 115028 C2 N HO HN N HO O O OH O N , (ІА) її солі приєднання кислоти і/або їх сольвати. Вказані кристалічні форми надзвичайно корисні як матеріали для отримання лікарських засобів. У даному винаході запропоновані також нові способи отримання похідних 6,7-ненасиченого 7-карбамоїлморфінану. UA 115028 C2 5 10 15 20 25 30 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується кристалів похідних морфінану і способу їх отримання. Більш детально даний винахід стосується кристалів похідних 6,7-ненасиченого-7-карбамоїлморфінану, його солей приєднання кислоти і/або сольватів, і способу їх отримання. РІВЕНЬ ТЕХНІКИ Для доставки лікарських засобів бажані кристалічні форми, що мають чудові хімічні і/або фізичні властивості. У патентному документі 1 розкрито, що похідне 6,7-ненасиченого-7-карбамоїлморфінану, представлене наступною формулою: , можна використовувати як терапевтичний і/або профілактичний агент для лікування блювання і/або запору. Хоча наступна сполука (I-284): розкрита в безсольовій формі, в прикладах вказаного патенту конкретно не розкриті солі приєднання кислот і/або сольвати. До того ж, в патенті зовсім відсутній опис її кристалічної форми. Як спосіб отримання похідного 6,7-ненасиченого-7-карбамоїлморфінану, розкритий тільки спосіб синтезу відповідного похідного 7-карбамоїлу з 7-карбоксипохідного, як представлено наступною формулою: . ДОКУМЕНТ РІВНЯ ТЕХНІКИ Патентні документи [Патентний документ 1] Міжнародна патентна публікація заявки WO 2006/126637. [Патентний документ 2] Міжнародна патентна публікація заявки WO 2001/002375. Непатентні документи [Непатентний документ 1] Chemical Communications, 1998, vol. 23, 2575-2576. [Непатентний документ 2] Synthesis, 1989, vol. 2, 131-132. СУТЬ ВИНАХОДУ ПРОБЛЕМИ, ЯКІ ПОВИНЕН ВИРІШУВАТИ ВИНАХІД Активні інгредієнти лікарських засобів можуть мати фізичні властивості, які істотно відрізняються, що залежать від кожної твердої форми. Відмінності в таких фізичних властивостях у вказаних активних інгредієнтах можуть впливати, наприклад, на способи отримання або способи введення активних інгредієнтів лікарських засобів або фармацевтичних композицій, що включають вказані активні інгредієнти. 1 UA 115028 C2 5 10 15 20 25 Незважаючи на те, що самі похідні 6,7-ненасиченого-7-карбамоїлморфінану вже були описані, було бажано розкрити придатні солі і/або стабільні кристалічні форми і більш придатні способи їх отримання для використання в лікарських засобах або для промислового виробництва лікарських засобів. ЗАСОБИ ВИРІШЕННЯ ВКАЗАНИХ ПРОБЛЕМ Внаслідок інтенсивних досліджень автори даного винаходу виявили, що стабільні кристали отримують із сполук, представлених наступною формулою (IA): , їх солей приєднання кислот і/або сольватів, і здійснили наступний винахід. Далі автори виявили, що сполука наступної формули (I): , 2 3 де R являє собою необов'язково заміщений нижчий алкіл і R являє собою необов'язково заміщений нижчий алкіл, необов'язково заміщений циклоалкіл, необов'язково заміщений арил або необов'язково заміщений гетероарил, отримують, здійснюючи взаємодію карбаматного похідного наступної формули (II): , 1 2 3 де R являє собою водень або захисну групу для гідроксилу, і R і R мають вказані вище 1 значення; в присутності основи, і видаляючи захисну групу R , тим самим здійснюючи даний винахід відносно нового способу отримання похідного 6,7-ненасиченого-7-карбамоїлморфінану. У даному винаході запропоноване наступне. (1) Сіль п-толуолсульфонової кислоти, сіль оцтової кислоти або сіль хлористоводневої кислоти сполуки наступної формули (IA): або сольват вказаної сполуки, або її сіль приєднання кислоти. (2) Кристали солі п-толуолсульфонової кислоти сполуки наступної формули (IA): 2 UA 115028 C2 5 10 15 20 25 30 35 40 45 або кристали сольвату її солі приєднання кислоти. (3) Кристали солі п-толуолсульфонової кислоти за п. (2), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2° і 21,5°±0,2°. (4) Кристали солі п-толуолсульфонової кислоти за п. (2), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2°, 18,6°±0,2°, 20,4°±0,2°, 21,5°±0,2°, 21,9°±0,2°, 23,6°±0,2° і 25,5°±0,2°. (5) Кристали солі п-толуолсульфонової кислоти за п. (2), що відрізняються порошковим рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 1. (6) Форма I кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. 2, де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 12,9°±0,2°, 17,6°±0,2°, 22,4°±0,2°, 25,4°±0,2° і 28,7°±0,2°. (7) Форма I кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. (2), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 6,6°±0,2°, 8,9°±0,2°, 11,4°±0,2°, 12,9°±0,2°, 14,0°±0,2°, 15,0°±0,2°, 17,6°±0,2°, 18,2°±0,2°, 22,4°±0,2°, 25,4°±0,2° і 28,7°±0,2°. (8) Форма I кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. (2), що відрізняється порошковим рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 2. (9) Форма II кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. (2), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 8,8°±0,2°, 17,5°±0,2°, 21,9°±0,2°, 23,7°±0,2° і 26,1°±0,2°. (10) Форма II кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. (2), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 7,1°±0,2°, 8,8°±0,2°, 17,5°±0,2°, 19,2°±0,2°, 19,7°±0,2°, 21,2°±0,2°, 21,9°±0,2°, 23,7°±0,2°, 24,5°±0,2° і 26,1°±0,2°. (11) Форма II кристалічної форми гідрату солі п-толуолсульфонової кислоти за п. (2), що відрізняється порошковим рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 3. (12) Кристали солі оцтової кислоти сполуки формули (IA): або кристали сольвату її солі приєднання кислоти. (13) Кристали солі оцтової кислоти за п. (12), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 5,6°±0,2°, 10,3°±0,2°, 12,0°±0,2°, 14,6°±0,2° і 26,0°±0,2°. (14) Кристали солі оцтової кислоти за п. (12), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 5,6°±0,2°, 8,3°±0,2°, 9,1°±0,2°, 10,3°±0,2°, 12,0°±0,2°, 13,5°±0,2°, 14,6°±0,2°, 16,3°±0,2° і 26,0°±0,2°. (15) Кристали солі оцтової кислоти за п. (12), що відрізняються рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 4. (16) Кристали солі хлористоводневої кислоти сполуки формули (IA): 3 UA 115028 C2 5 10 15 20 25 30 35 40 або кристали сольвату солі приєднання кислоти. (17) Кристали солі хлористоводневої кислоти за п. (16), де вказані кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 8,5°±0,2°, 12,7°±0,2°, 15,6°±0,2°, 17,3°±0,2° і 23,9°±0,2°. (18) Кристали солі хлористоводневої кислоти за п. (16), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 8,5°±0,2°, 10,8°±0,2°, 11,3°±0,2°, 12,7°±0,2°, 13,9°±0,2°, 15,6°±0,2°, 17,3°±0,2°, 19,2°±0,2°, 20,1°±0,2° і 23,9°±0,2°. (19) Кристали солі хлористоводневої кислоти за п. (16), що відрізняються порошковим рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 5. (20) Кристали сполуки формули (IA): або кристали її сольвату. (21) Кристали сполуки формули (IA) за п. (20), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 13,5°±0,2°, 21,6°±0,2°, 22,1°±0,2°, 23,4°±0,2° і 26,7°±0,2°. (22) Кристали сполуки формули (IA) за п. (20), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 6,8°±0,2°, 11,7°±0,2°, 13,5°±0,2°, 15,6°±0,2°, 16,7°±0,2°, 21,6°±0,2°, 22,1°±0,2°, 23,4°±0,2°, 26,7°±0,2° і 30,1°±0,2°. (23) Кристали сполуки формули (IA) за п. (20), що відрізняються порошковим рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 7. (24) Кристали етанольного сольвату за п. (20), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 11,0°±0,2°, 16,5°±0,2°, 20,5°±0,2°, 21,8°±0,2° і 22,6°±0,2°. (25) Кристали етанольного сольвату за п. (20), де кристали характеризуються піками в порошковому рентгенівському дифракційному спектрі, відповідними дифракційним кутам (2θ): 6,9°±0,2°, 11,0°±0,2°, 12,9°±0,2°, 13,4°±0,2°, 16,5°±0,2°, 20,5°±0,2°, 21,3°±0,2°, 21,8°±0,2°, 22,6°±0,2° і 25,1°±0,2°. (26) Кристали етанольного сольвату за п. (20), що відрізняються рентгенівським дифракційним спектром, який практично ідентичний спектру, представленому на ФІГ. 6. (27) Фармацевтична композиція, що включає кристали за будь-яким одним з пп. (2)-(26). (27A) Антагоніст опіоїдного рецептора, що включає кристали за будь-яким одним з пп. (2)(26). (27B) Терапевтичний і/або профілактичний агент для лікування нудоти, блювання і/або запору, де вказаний агент включає кристали за будь-яким одним з пп. (2)-(26). (27C) Послаблюючий дію і/або профілактичний агент для лікування побічних ефектів, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора, де вказаний агент включає кристали за будь-яким одним з пп. (2)-(26). (27D) Терапевтичний і/або профілактичний агент за п. (27C), де побічними ефектами є нудота, блювота і/або запор. 4 UA 115028 C2 5 10 15 20 25 30 35 40 (27E) Терапевтичний і/або профілактичний агент за п. (27C) або (27D), де вказаною сполукою, що має агоністичну активність відносно опіоїдного рецептора, є морфін, оксикодон, гідрокодон, трамадол або їх фармацевтично прийнятні солі або сольвати. (27F) Використання кристалів за будь-яким одним з пп. (2)-(26) для отримання терапевтичного і/або профілактичного агента для лікування нудоти, блювання і/або запору. (27G) Використання кристалів за будь-яким одним з пп. (2)-(26) для отримання послаблюючої дії і/або профілактичного агента для лікування побічних ефектів, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора. (27H) Терапевтичний і/або профілактичний спосіб лікування нудоти, блювання і/або запору, який відрізняється введенням фармацевтичної композиції, що включає кристали за будь-яким одним з пп. (2)-(26). (27I) Спосіб, що послаблює дію і/або профілактичний, для лікування побічних ефектів, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора, який включає стадію введення кристалів за будь-яким одним з пп. (2)-(26). (27J) Фармацевтична композиція, що включає кристали за будь-яким одним з пп. (2)-(26), для лікування і/або профілактики нудоти, блювання і/або запору. (27K) Фармацевтична композиція, що включає кристали за будь-яким одним з пп. (2)-(26), для послаблення і/або профілактики побічних ефектів, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора. (27L) Анальгетики, що включають комбінацію сполук, що мають агоністичну активність відносно опіоїдного рецептора, з ефективною кількістю кристалів за будь-яким одним з пп. (2)(26) для послаблення і/або профілактики побічних ефектів, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора. (27M) Анальгетики, що включають комбінацію сполук, що мають агоністичну активність відносно опіоїдного рецептора, з ефективною кількістю кристалів за будь-яким одним з пп. (2)(26) для лікування і/або профілактики нудоти, блювання і/або запору, викликаних сполукою, що має агоністичну активність відносно опіоїдного рецептора. (27N) Анальгетики за п. (27L) або (27M), де сполукою, що має агоністичну активність відносно опіоїдного рецептора, є морфін, оксикодон, гідрокодон, трамадон або їх фармацевтично прийнятні солі або сольвати. (28) Спосіб отримання кристалів солі приєднання кислоти сполуки формули (IA): або кристалів сольвату вказаної солі приєднання кислоти за будь-яким одним з пп. (2)-(19), що відрізняється стадіями додавання кислоти до сполуки формули (IA), і подальшої кристалізації солі приєднання кислоти або її сольвату з розчинника, за необхідності. (29) Спосіб отримання кристалів за п. (2), що відрізняється стадіями: обробки основою сполуки формули (IID): , 1 де R являє собою водень або гідроксилзахисну групу, 1 додавання п-толуолсульфонової кислоти після видалення захисної групи R , необхідності, і кристалізації солі приєднання кислоти або її сольвату з розчинника, за необхідності. (30) Спосіб за п. (29), що відрізняється стадіями: обробки основою сполуки формули (IIE): 5 за UA 115028 C2 5 , 1a де R являє собою атом водню або гідроксизахисну групу, що видаляється основою, з подальшим додаванням до отриманого п-толуолсульфонової кислоти, і кристалізації солі приєднання кислоти або її сольвату з розчинника, за необхідності. (31) Спосіб отримання сполуки формули (II): 10 , 1b 2 де R являє собою гідроксизахисну групу, R являє собою необов'язково заміщений нижчий 3 алкіл, R являє собою необов'язково заміщений нижчий алкіл, необов'язково заміщений циклоалкіл, заміщений або незаміщений арил або заміщений або незаміщений гетероарил; що відрізняється здійсненням взаємодії сполуки формули (III): 15 , 1b 2 3 3 де R і R мають вказані вище значення; із сполукою формули: R -N=С=О, де R має вказані 3 3 вище значення; або із сполукою формули: R -NH-C(=О)-X, де R має вказані вище значення і X являє собою відхідну групу; в присутності або за відсутності кислоти. (32) Спосіб за п. (31), що відрізняється тим, що отримують сполуку формули (III): 1b , 2 де R і R мають вказані в п. (31) значення; здійснюючи захист гідроксигрупи сполуки формули (IV): 6 UA 115028 C2 , 2 де R має вказані в п. (31) значення. (33) Спосіб за п. (32), де послідовно здійснюють стадії отримання сполуки формули (III): 5 10 15 20 25 1b , 2 де R і R мають вказані в п. (31) значення; захисту гідроксильної групи сполуки формули (IV): , 2 де R має вказані в п. (31) значення; і здійснюють взаємодію сполуки формули (III) із сполукою формули: 3 R -N=С=О, 3 де R має вказані в п. (31) значення; або 3 3 із сполукою формули: R -NH-C(=О)-X, де R має вказані вище значення і X являє собою відхідну групу; в присутності або за відсутності кислоти. Де термін "послідовно здійснюють" означає той факт, що реакцію наступної стадії здійснюють без виділення сполуки, отриманої на попередній стадії. Наприклад, здійснюють дві стадії в одному реакторі. (34) Спосіб за будь-яким одним з пп. (31)-(33), де реакцію здійснюють за присутності кислоти. (35) Спосіб за п. (34), де кислота є кислотою Льюїса. (36) Спосіб за п. (35), де кислота Льюїса являє собою CuCl, CuCl2, CuBr, CuI, CuBr, CuSО4, Cu, Zn(OAc)2, ZnBr2 або ZnCl2. (37) Спосіб за будь-яким одним з пп. (31)-(36), що відрізняється тим, що реакцію здійснюють в присутності кислоти в кількості близько 0,00005-1,0 еквівалента відносно сполуки формули (III). 1b (38) Спосіб за будь-яким одним з пп. (31)-(37), де R являє собою гідроксилзахисну групу, що видаляється основою. (39) Спосіб отримання сполуки формули (I): 7 UA 115028 C2 , 2 3 де R і R мають вказані в п. (31) значення; шляхом обробки основою сполуки формули (IIA): 2 5 , 3 де R і R мають вказані вище значення. (40) Спосіб отримання сполуки формули (I): , 2 3 де R і R мають вказані в п. (31) значення; що відрізняється тим, що обробляють основою сполуки формули (IIC): 10 15 , 1с 2 3 де R являє собою гідроксизахисну групу, що видаляється основою, і R і R мають вказані вище значення. (41) Спосіб отримання сполуки формули (IB): , 1d 2 3 де R являє собою гідроксизахисну групу, що не видаляється основою, і R і R мають вказані в п. (31) значення; що відрізняється тим, що обробляють основою сполуки формули (IIB): 8 UA 115028 C2 5 10 , 1b 2 3 де R являє собою гідроксизахисну групу, і R і R мають вказані вище значення. (42) Спосіб за будь-яким одним з пп. (39)-(41), де основою є неорганічна основа. (43) Спосіб за будь-яким одним з пп. (39)-(41), де вказана основа являє собою гідроксид калію, гідроксид натрію, гідроксид літію або гідроксид цезію. (44) Спосіб за будь-яким одним з пп. (39)-(43), де температура реакції становить 30 °C100 °C. (45) Спосіб отримання сполуки формули (IX): шляхом здійснення реакції сполуки формули (VIIIa): , 5 де R являє собою нижчий алкіл; в присутності кислоти Льюїса і основи. (46) Спосіб за п. (45), що відрізняється тим, що здійснюють взаємодію сполуки формули (X): 15 , 5 де R являє собою нижчий алкіл; із сполукою формули (XI): 20 25 , отримуючи вказану сполуку формули (VIIIa). (47) Спосіб за будь-яким одним з пп. (45) або (46), де кислота Льюїса являє собою AlCl 3 або TiCl4. (48) Спосіб отримання солі приєднання кислоти сполуки формули (I), що включає стадії: здійснення взаємодії сполуки формули (IIIA): , 1c 2 де R являє собою гідроксизахисну групу, що видаляється основою, і R має вказані в п. (31) значення: 3 3 із сполукою формули: R -N=С=О, де R має вказані в п. (31) значення; або 9 UA 115028 C2 3 3 із сполукою формули: R -NH-C(=О)-X, де R має вказані вище значення, і X являє собою відхідну групу; в присутності або за відсутності каталізатора - кислоти Льюїса, до отримання сполуки формули (IIC): 5 10 15 20 25 , 1c 2 3 де R , R і R мають вказані вище значення; потім обробки сполуки формули (IIC) основою до отримання сполуки формули (I): , 2 3 де R і R мають вказані вище значення; і додавання кислоти до сполуки формули (I) до отримання солі приєднання кислоти. Солі приєднання кислоти також отримують, охолоджуючи реакційний розчин після того, як сіль приєднання кислоти утвориться внаслідок додавання кислоти. Де далі наводяться приклади варіантів даного винаходу отримання сполуки формули (IIC), що включають стадії: 3 3 здійснення взаємодії сполуки формули (IIIA) із сполукою формули: R -N=С=О, де R має вказані вище значення, за присутності каталізатора - кислоти Льюїса; 3 3 здійснення взаємодії сполуки формули (IIIA) із сполукою формули: R -N=С=О, де R має вказані вище значення, за відсутності каталізатора - кислоти Льюїса; або здійснення взаємодії 3 3 сполуки формули (IIIA) із сполукою формули: R -NH-C(=О)-X, де R і X мають вказані вище значення, за відсутності каталізатора - кислоти Льюїса. (49) Спосіб за п. (48), де сіль приєднання кислоти вказаного сполуки формули (I) являє собою сіль п-толуолсульфонової кислоти, сіль оцтової кислоти, сіль хлористоводневої кислоти або їх сольвати. (50) Спосіб за п. (49), де сіль п-толуолсульфонової кислоти, сіль оцтової кислоти або сіль хлористоводневої кислоти або їх сольвати являють собою кристали. (51) Сполука формули (IID): , 1 де R являє собою водень або гідроксилзахисну групу. (52) Сполука формули (VII): 30 , 6 де R являє собою групу, представлену -N=С=О або -NH-C(=О)-X, де X являє собою відхідну групу. У сполуках, представлених вищезгаданими формулою (II), формулою (IIA), формулою (IIB), формулою (IIC), формулою (IID) і формулою (IIE), водень в "-NH-" групі "-О-C(=О)-NH-", 10 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 60 приєднаній до бічного ланцюга в 7-положенні скелета морфінану, можна замінити амінозахисною групою. У описі, що розглядається, термін "галоген" включає фтор, хлор, бром і йод. Фрагменти, що містять термін галоген, такі як "заміщений галогеном нижчий алкіл", "заміщений галогеном нижчий алкокси" і "заміщений галогеном нижчий алкілтіо" також аналогічні. Термін "нижчий алкіл" включає нерозгалужений або розгалужений алкіл, що містить 1-10 атомів вуглецю, переважно 1-6 або більш переважно 1-3 і, наприклад, метил, етил, н-пропіл, ізопропіл, n-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, неопентил, гексил, ізогексил, н-гептил, ізогептил, н-октил, ізооктил, н-ноніл і н-децил. Переважні метил, етил, ізопропіл, н-бутил, втор-бутил, трет-бутил і 1-етилпропіл і т. д. Як приклади "необов'язково заміщеного нижчого алкілу", можна навести галоген, гідрокси, нижчий алкокси, заміщений галогеном нижчий алкокси, гідрокси нижчий алкокси, нижчий алкілтіо, нижчий алкіламіно, ациламіно, ацил, ацилокси, ціано, карбокси, нижчий алкоксикарбоніл, карбамоїл, нижчий алкілкарбамоїл, ціанокарбамоїл, нижчий алкілсульфонілкарбамоїл, арилсульфонілкарбамоїл, сульфамоїл, нижчий алкілсульфамоїл, нижчий алкілсульфоніл, циклоалкіл, необов'язково заміщений однією або більше групами, вибраними з групи замісників (група замісників включає галоген, гідроксил, нижчий алкіл, заміщений галогеном нижчий алкіл, гідрокси нижчий алкіл, нижчий алкокси нижчий алкіл, карбокси нижчий алкіл, нижчий алкоксикарбоніл нижчий алкіл, аміно нижчий алкіл, нижчий алкіламіно нижчий алкіл, ациламіно нижчий алкіл, ціано нижчий алкіл, нижчий алкокси, заміщений галогеном нижчий алкокси, гідрокси нижчий алкокси, нижчий алкілтіо, заміщений галогеном нижчий алкілтіо, ацил, ацилокси, аміно, нижчий алкіламіно, ациламіно, ціано, карбокси, нижчий алкоксикарбоніл, карбамоїл, нижчий алкілкарбамоїл, арилкарбамоїл, ціанокарбамоїл, нижчий алкілсульфонілкарбамоїл, сульфамоїл, нижчий алкілсульфамоїл, нижчий алкілсульфоніл, арил і гетероциклічна, група необов'язково заміщені нижчим алкілендіокси, циклоалкеніл, необов'язково заміщений однією або більше групами, вибраними з групи замісників α, арил, необов'язково заміщений однією або більше групами, вибраними з групи замісників α, арилокси, необов'язково заміщений однією або більше групами, вибраними з групи замісників α, арилтіо, необов'язково заміщений однією або більше групами, вибраними з групи замісників α, гетероциклічна група, необов'язково заміщена однією або більше групами, вибраними з групи замісників α, і гетероциклокси, необов'язково заміщений однією або більше групами, вибраними з групи замісників α. Нижчий алкільний фрагмент у виразі "заміщений галогеном нижчий алкіл", "гідрокси нижчий алкіл", "аміно нижчий алкіл", "ациламіно нижчий алкіл", "ацилокси нижчий алкіл", "циклоалкіл нижчий алкіл", "нижчий алкокси", "заміщений галогеном нижчий алкокси", "гідрокси нижчий алкокси", "нижчий алкокси нижчий алкіл", "нижчий алкоксикарбоніл", "карбокси нижчий алкіл", "нижчий алкоксикарбоніл нижчий алкіл", "нижчий алкілтіо", "заміщений галогеном нижчий алкілтіо", "нижчий алкіламіно", "нижчий алкіламіно нижчий алкіл", "нижчий алкілкарбамоїл", "нижчий алкілсульфамоїл", "нижчий алкілсульфоніл", "арил нижчий алкіл", "тринижчий алкілсиліл", "нижчий алкілдіарилсиліл", "триарил нижчий алкілсиліл", "нижчий алкокси нижчий алкокси нижчий алкіл", "нижчий алкілтіо нижчий алкіл", "арил нижчий алкокси нижчий алкіл", "нижчий алкілсульфоніл", "нижчий алкілсульфонілкарбамоїл", "нижчий алкілкарбоніл", "ціано нижчий алкіл", "нижчий алкоксикарбоніламіно", "нижчий алкілендіокси" і "заміщений гетероциклом нижчий алкіл" мають ті ж значення, що і наведені вище для виразу "нижчий алкіл". Замісники у висловлюваннях "необов'язково заміщений нижчий алкокси", "необов'язково заміщений нижчий алкілтіо" і "необов'язково заміщений нижчий алкілсульфоніл" мають ті ж значення, що і наведені вище для виразу "нижчий алкіл, необов'язково заміщений". Термін "нижчий алкеніл" включає нерозгалужений або розгалужений алкеніл, що містить 210 атомів вуглецю, переважно 2-8, більш переважно 3-6 атомів вуглецю, який містить один або більше з подвійних зв'язків в довільних положеннях. Більш конкретно, він включає вініл, аліл, пропеніл, ізопропеніл, бутеніл, ізобутеніл, преніл, бутадієніл, пентеніл, ізопентеніл, пентадієніл, гексеніл, ізогексеніл, гексадієніл, гептеніл, октеніл, ноненіл і деценіл і т. д. Замісники у виразі "необов'язково заміщений нижчий алкеніл" мають ті ж самі значення, що і для виразу "необов'язково заміщений нижчий алкіл". Термін "нижчий алкініл" включає нерозгалужений або розгалужений алкініл, що містить 2-10 атомів вуглецю, переважно 2-8, більш переважно 3-6, який містить один або більше з потрійних зв'язків в довільних положеннях. Більш конкретно, включені етиніл, пропініл, бутиніл, пентиніл, гексиніл, гептиніл, октиніл, нониніл, дециніл і т. д. Вони можуть містити подвійний зв'язок в ще більш довільних положеннях. 11 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 Замісники у виразі "необов'язково заміщений нижчий алкініл" мають ті ж значення, що і в наведеному вище виразі "необов'язково заміщений нижчий алкіл". Як приклади замісників "необов'язково заміщеного аміно" можна навести нижчий алкіл, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, циклоалкіл, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, ацил, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, аміно, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, арил, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, сульфамоїл, нижчий алкілсульфамоїл, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, арилсульфамоїл необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, нижчий алкілсульфоніл, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, арилсульфоніл, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, ариламіно, необов'язково заміщений однією або більше з груп, вибраних з групи замісників α, і гетероциклічна група, необов'язково заміщена однією або більше з груп, вибраних з групи замісників α. Замісники у виразі "необов'язково заміщений карбамоїл" мають ті ж самі значення, що і для наведеного вище виразу "необов'язково заміщений аміно". "Циклоалкіл" являє собою карбоциклічну групу, що містить 3-10 атомів вуглецю, переважно 3-8, більш переважно 4-8 атомів вуглецю, і включає, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононіл, циклодецил і т. д. Крім того, вони можуть бути конденсовані з вказаними далі "арильною" або "гетероцикліною групами" в довільних положеннях. Циклоалкільний фрагмент у виразах "циклоалкіл нижчий алкіл" і "циклоалкілкарбоніл" має ті ж самі значення, що і наведені вище для терміна "циклоалкіл". Одна або більше з груп, вибраних з розкритої вище групи замісників α, служать прикладами замісників у виразі "необов'язково заміщений циклоалкіл". Замісники можуть знаходитися в будь-якому положенні і можуть знаходитися у атома вуглецю з циклоалкільним зв'язком. Термін "циклоалкеніл" включає вищеперераховані значення для циклоалкілу, що містить один або більше з подвійних зв'язків в будь-якому положенні кільця, і конкретно включає циклопропеніл, циклобутеніл, циклопентеніл, циклогексеніл, циклогептеніл, циклооктеніл, циклогексадієніл і т. д. Циклоалкенільний фрагмент "циклоалкенілкарбонілу" має ті ж значення, що і вказані вище для "циклоалкенілу". Замісники у виразі "необов'язково заміщений циклоалкеніл" мають ті ж значення, що і вказані вище для виразу "циклоалкіл, необов'язково заміщений". Термін "арил" включає феніл, нафтил, антрил, фенантрил і особливо переважно феніл. Арильні фрагменти в "арилокси", "арилтіо", "арил нижчий алкіл", "нижчий алкілдіарилсиліл", "триарил нижчий алкілсиліл", "арил нижчий алкілокси нижчий алкіл", "арилсульфоніл", "арилсульфамоїл", "ариламіно", "арилкарбамоїл" і "арилсульфонілкарбамоїл" мають вказані вище значення для терміна "арил". Прикладами замісників для термінів "необов'язково заміщений арил", "необов'язково заміщений феніл" і "необов'язково заміщений арилсульфоніл" наведеної вище групи замісників α служать феніл, заміщений однією або більше з груп, вибраних із замісників групи α, фенокси, заміщений однією або більше з груп, вибраних з групи замісників α, або нижчий алкілендіокси і т. д. Термін "гетероциклічна група" включає гетероцикличні групи, що містять в кільці один або більше з гетероатомів, необов'язково вибраних з О, S і N, і конкретно включені гетероарили, що містять 5-6 членів, такі як піроліл, імідазоліл, піразоліл, піридил, піридазиніл, піримідиніл, піразиніл, триазорил, триадиніл, тетразоліл, ізоксазоліл, оксазоліл, оксадіазоліл, ізотіазоліл, тіазоліл, тіадіазоліл, фурил і тієніл і т. д.; біциклічні конденсовано-гетероциклічні групи, такі як індоліл, ізоіндоліл, індазоліл, індридиніл, індриніл, ізоіндриніл, хіноліл, ізохіноліл, цінолініл, фталазиніл, хіазолініл, нафтиридиніл, хіноксалініл, пуриніл, птеридиніл, бензопіраніл, бензімідазоліл, бензізоксазоліл, бензоксазоліл, бензоксадіазоліл, бензоізотіазоліл, бензотіазоліл, бензотіадіазоліл, бензофурил, ізобензофурил, бензотієніл, бензотриазорил, імідазопіридил, триазолопіридил, імідазотіазоліл, піразинопіридазиніл, хіназолініл, хіноліл, ізохіноліл, нафтиридиніл, дигідропіридил, тетрагідрохіноліл і тетрагідробензотієніл; трициклічні конденсовано-гетероциклічні групи, такі як карбазоліл, акридиніл, ксантеніл, фенотіазиніл, феноксатіїніл, феноксазиніл, дибензофурил; 12 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 60 неароматичні гетероциклічні групи, такі як діоксаніл, тіїраніл, тіоланіл, тієтаніл, оксиланіл, оксетаніл, оксатіоланіл, азетидиніл, тіаніл, піролідиніл, піролініл, імідазолідиніл, імідазолініл, піразолідиніл, піразолініл, піперидил, піперазиніл, морфолініл, морфоліно, тіоморфолініл, тіоморфоліно, дигідропіридил, дигідрофурил, тетрагідрофурил, тетрагідропіраніл, тетрагідротіазоліл і тетрагідроізотіазоліл. Переважні гетероарил або неароматичні гетероциклічні групи, що містять 5-6 членів. Гетероциклічний фрагмент термінів "гетероциклічний окси" і "гетероциклічний нижчий алкіл" має ті ж самі значення, що і вказані вище для "гетероциклічної групи". Одна або більше з груп, вибраних з групи, що складається з наведеної вище групи замісників α і оксо, є прикладами замісників в "необов'язково заміщеній гетероциклічній групі" і "необов'язково заміщений гетероциклокси". Замісники можуть знаходитися в будь-якому положенні і можуть бути замісниками біля атома вуглецю або атома азоту, що мають зв'язок гетероциклічної групи. Термін "ацил" включає нерозгалужений або розгалужений лінійний аліфатичний ацил, що містить 1-10 атомів вуглецю, переважно 1-6, більш переважно 1-4, і циклічний аліфатичний ацил, ароїл і гетероциклічний карбоніл, що містить 4-9 атомів вуглецю, переважно 4-7. Термін "лінійний аліфатичний" включає вищенаведені "нижчий алкіл", "нижчий алкеніл" і "нижчий алкініл". Термін "циклічний аліфатичний" включає вищенаведені "циклоалкіл" і "циклоалкеніл". Гетероциклічний фрагмент гетероциклічного карбонілу той же самий, що для вищезгаданої "гетероциклічної групи". Приклади включають ацил, форміл, ацетил, пропіоніл, бутирил, ізобутирил, валерил, півалоїл, гексаноїл, акрилоїл, пропіолоїл, метакрилоїл, кротоноїл, циклопропілкарбоніл, циклогексилкарбоніл, циклооктилкарбоніл, бензоїл, піридинкарбоніл, піперидинкарбоніл, піперазинкарбоніл, морфолінокарбоніл і т. д. Ацильні фрагменти "ацилокси", "ациламіно", "ациламіно нижчий алкіл" і "ацилокси нижчий алкіл" ті ж самі, що і для вищенаведеного "ацилу". Замісники для "необов'язково заміщеного ацилу" або "необов'язково заміщеного ацилокси" ті ж самі, що і замісники для вищезгаданого "необов'язково заміщеного нижчого алкілу", якщо "ацил" являє собою лінійний аліфатичний ацил, і якщо "ацил" являє собою циклічний аліфатичний ацил, ароїл і гетероциклічний карбоніл, замісником є одна або більше з груп, вибраних з вищенаведеної групи замісників α. Термін "сольват" включає сольвати з органічними розчинниками (етанолом, 2-пропанолом, метилацетатом, етилацетатом, н-пропілацетатом, 1,2-диметоксіетаном, метилізобутилкетоном, ацетонітрилом і т. д.) і, наприклад, гідрати. Якщо утворюється гідрат, сполука може бути координована з будь-якою кількістю молекул води. Прикладами "захисних гідроксилгруп" є бензил, п-метоксифенілбензил, ацетил, форміл, бензоїл, хлорацетил, півалоїл, метилкарбонат, ізобутилкарбонат, бензилкарбонат, вінілкарбонат, фенілкарбамат, мезил, тозил, триметилсиліл, триетилсиліл, третбутилдиметилсиліл, метоксиметил, бензилоксиметил, метоксіетоксиметил, 2(триметилсиліл)етоксиметил, пропеніл, фенацил і тетрагідропіраніл і т. д. Прикладами "захисних гідроксилгруп, що видаляються основою", є ацетил, форміл, бензоїл, хлорацетил, півалоїл, метилкарбонат, ізобутилкарбонат, бензилкарбонат, вінілкарбонат, фенілкарбамат, мезил, тозил і т. д. В одному аспекті прикладами служать ацетил, форміл, бензоїл, хлорацетил і півалоїл. У іншому аспекті прикладом служить ацетил. Прикладами "захисних гідроксил груп, що не видаляються основою", служать бензил, пметоксифенілбензил, триметилсиліл, триетилсиліл, трет-бутилдиметилсиліл, метоксиметил, бензилоксиметил, метоксіетоксиметил, 2-(триметилсиліл)етоксиметил, пропеніл, фенацил і тетрагідропіраніл і т. д. Прикладами "відхідних груп" є необов'язково заміщений фенокси (наприклад, фенокси, пнітрофенокси і о-нітрофенокси), гетероциклічні групи (наприклад, 1-імідазоліл і 1-піразоліл), необов'язково заміщений гетероциклокси (наприклад, піридилокси) і т. д. Прикладами "солей приєднання кислоти сполуки формули (I)" і "солей приєднання кислоти сполуки формули (IA)" є солі неорганічних основ (наприклад, хлористоводневої кислоти, сірчаної кислоти, азотної кислоти, карбонової кислоти, бромистоводневої кислоти, фосфорної кислоти, йодистоводневої кислоти і т. д.) або солі органічних кислот (наприклад, мурашиної кислоти, оцтової кислоти, пропіонової кислоти, трифтороцтової кислоти, лимонної кислоти, молочної кислоти, винної кислоти, щавлевої кислоти, малеїнової кислоти, фумарової кислоти, мигдалевої кислоти, глутарової кислоти, яблучної кислоти, бензойної кислоти, фталевої кислоти, аскорбінової кислоти, бензолсульфонової кислоти, п-толуолсульфонової кислоти, метансульфонової кислоти, етансульфонової кислоти і т. д.). Наприклад, як сіль приєднання кислоти "солі приєднання кислоти сполуки формули (I)" і солі приєднання кислоти "солі 13 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 приєднання кислоти сполуки формули (IA)", можна указати сіль п-толуолсульфонової кислоти, сіль оцтової кислоти і сіль хлористоводневої кислоти. Прикладами "амінозахисної групи" є трет-бутилдиметилсиліл, трет-бутоксикарбоніл, аліл, 9флуоренілметилоксикарбоніл, бензил, п-метоксибензил, метоксиметил, бензилоксиметил, бензгідрил і тритил. ЕФЕКТ ВИНАХОДУ У даному винаході запропоновані похідні 6,7-ненасиченого-7-карбамоїлморфінану, їх солі приєднання кислоти і/або кристали їх сольватів. Вказані кристали мають хорошу стабільність і їх можна використовувати як інгредієнти для отримання лікарських засобів. Новий спосіб отримання може додати внесок в скорочення стадій отримання, в підвищення виходів і т. д. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Фіг. 1 демонструє порошкову рентгенівську дифракційну картину кристалів (несольват) солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 2 демонструє порошкову рентгенівську дифракційну картину кристалів (форма I) гідрату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 3 демонструє порошкову рентгенівську дифракційну картину кристалів (форма II) гідрату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 4 демонструє порошкову рентгенівську дифракційну картину кристалів солі оцтової кислоти сполуки (IA) даного винаходу. Фіг. 5 демонструє порошкову рентгенівську дифракційну картину кристалів солі хлористоводневої кислоти вказаного сполуки (IA) даного винаходу. Фіг. 6 демонструє порошкову рентгенівську дифракційну картину кристалів етанольного сольвату сполуки (IA) даного винаходу. Фіг. 7 демонструє порошкову рентгенівську дифракційну картину кристалів вільної сполуки (IA) даного винаходу. Фіг. 8 демонструє порошкову рентгенівську дифракційну картину кристалів метилацетатного сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 9 демонструє порошкову рентгенівську дифракційну картину кристалів сольвату (етилацетат і 2-пропанол) солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 10 демонструє порошкову рентгенівську дифракційну картину кристалів сольвату (нпропілацетат/2-пропанол) солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 11 демонструє порошкову рентгенівську дифракційну картину кристалів ацетонітрильного сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 12 демонструє порошкову рентгенівську дифракційну картину кристалів 1,2діетоксіетанового сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 13 демонструє порошкову рентгенівську дифракційну картину кристалів метилізобутилкетонового сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 14 демонструє результати TG/DTA аналізів кристалів (несольват) солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 15 демонструє результати TG/DTA аналізів кристалів (форма I) гідрату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 16 демонструє результати TG/DTA аналізів кристалів (форма II) гідрату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 17 демонструє результати TG/DTA аналізів солі оцтової кислоти сполуки (IA) даного винаходу. Фіг. 18 демонструє результати TG/DTA аналізів солі хлористоводневої кислоти сполуки (IA) даного винаходу. Фіг. 19 демонструє результати TG/DTA аналізів етанольного сольвату сполуки (IA) даного винаходу. Фіг. 20 демонструє результати TG/DTA аналізів вільної форми сполуки (IA) даного винаходу. Фіг. 21 демонструє результати TG/DTA аналізів метилацетатного сольвату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 22 демонструє результати TG/DTA аналізів етилацетат/2-пропанольного сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 23 демонструє результати TG/DTA аналізів етилацетат/2-пропанольного сольвату солі п-толуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 24 демонструє результати TG/DTA аналізів ацетонітрильного сольвату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. 14 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 Фіг. 25 демонструє результати TG/DTA аналізів 1,2-диметоксіетанового сольвату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. Фіг. 26 демонструє результати TG/DTA аналізів метилізобутилкетонового сольвату солі птолуолсульфонової кислоти сполуки (IA) даного винаходу. ПЕРЕВАЖНИЙ СПОСІБ ЗДІЙСНЕННЯ ДАНОГО ВИНАХОДУ Кристали даного винаходу отримують у вигляді солі приєднання кислоти сполуки, представленої формулою (I), або сольвату вказаної солі приєднання кислоти. Прикладами кислот, що використовуються у винаході, служать п-толуолсульфонова кислота, оцтова кислота або хлористоводнева кислота. Вважають, що кристали п-толуолсульфонової кислоти не повинні бути гігроскопічними і повинні мати чудову стабільність. Як приклади розчинників для утворення сольватів використовують воду, етанол, 2-пропанол, метилацетат, етилацетат, н-пропілацетат, 1,2-диметоксіетан, метилізобутилкетон, ацетонітрил і т. д. Кристали солі приєднання кислоти кристалізуються після додавання 1,0-10,0 еквівалентів кислоти в розчин вказаного сполуки формули (I) при температурі від 0 °C до кімнатної температури або при нагріванні при температурі нижче за температуру кипіння розчинника, необов'язково охолоджуючи або конденсуючи вказаний розчинник. Отримання сольватованих кристалів здійснюють, розчиняючи сіль приєднання кислоти сполуки формули (I) в солюбілізуючому розчиннику, що містить розчинник, що підлягає сольватуванню, щонайменше при кімнатній температурі або при температурі нижче за температуру кипіння розчинника шляхом нагрівання, додаючи розчинник, що підлягає сольватуванню, і перемішуючи або залишаючи розчин вистоюється при температурі від 0 °C до кімнатної протягом від декількох годин до одного дня. Кристали можна відділити від розчинника, використовуючи звичайні способи виділення, такі як виділення фільтруванням або центрифугуванням, і виділити, використовуючи звичайні способи очищення, такі як промивання і сушіння. Сольвати сполук, представлених формулою (I), також включені в термін кристали даного винаходу. Прикладами розчинників служать вода, етанол і т. д. Сольват сполуки, представлений формулою (I), можна отримати тим же способом, що і сольват вищезгаданої солі приєднання кислоти. У разі сполуки (IA), як приклади кристалів даного винаходу можна навести сіль птолуолсульфонової кислоти (несольват), гідрат солі п-толуолсульфонової кислоти, метилацетатний сольват солі п-толуолсульфонової кислоти, етилацетат/2-пропанольний сольват солі п-толуолсульфонової кислоти, н-пропілацетат/2-пропанольний сольват солі птолуолсульфонової кислоти, ацетонітрильний сольват солі п-толуолсульфонової кислоти, 1,2диметоксіетановий сольват солі п-толуолсульфонової кислоти, метилізобутилкетоновий сольват солі п-толуолсульфонової кислоти, гідрохлоридний, ацетатний, етанольний сольват вільної форми і т. д. Наприклад, сіль п-толуолсульфонової кислоти (несольват) сполуки, представленої формулою (IA), отримують таким чином: 2-пропанол і н-пропілацетат додають до органічного шару, що містить сполуку (IA), і отриманий розчин конденсують. До концентрату по краплях додають 2-пропанольний розчин, що містить 1-10,0 еквівалентів п-толуолсульфонової кислоти при температурі 50-70 °C, і відбувається кристалізація. Отриману сиру тверду речовину розчиняють в метанолі і н-пропілацетаті знову шляхом нагрівання, нерозчинні матеріали відфільтровують, і кристалізацію здійснюють шляхом концентрування фільтрату у вакуумі. Отримані кристали сушать при температурі 50-70 °C протягом 2-5 годин у вакуумі, отримуючи цільову сіль п-толуолсульфонової кислоти (несольват). Конкретні способи отримання кристалів даного винаходу проілюстровані далі. Якщо немає конкретних вказівок, числові значення в описі і формулі винаходу являють собою майже найближчі значення. Числові відхилення відбуваються за рахунок неточностей калібрування приладів, приладових помилок, ступеня чистоти речовини, розмірів кристалів, розмірів зразків і інших чинників. Термін "кристали", використаний в описі, означає речовину, молекулярна структура якого має впорядкованість далекого порядку. Ступінь кристалічності кристалів можна визначити, використовуючи безліч методик, включаючи, наприклад, порошкову рентгенівську дифракцію, адсорбцію води, диференціальний або калориметричний аналізи, хромоскопію в розчині, і використовуючи характеристики розчинності. Звичайно кристалічні органічні сполуки складаються з великої кількості атомів, організованих періодично в тримірному просторі. Характер періодичності структури звичайно обумовлює фізичні властивості, які можна визначити, використовуючи більшість 15 UA 115028 C2 5 10 15 20 25 30 35 40 45 спектрофотометричних методів (наприклад, дифракцію рентгенівських променів, інфрачервону спектроскопію, Раман-спектроскопію і твердотільний ЯМР). Серед них найбільш високочутливий аналітичним способом для визначення кристалічності твердих речовин є метод порошкової дифракції рентгенівських променів (XRPD). Коли кристали опромінюють рентгенівськими променями, вони відбиваються від кристалічної решітки, інтерферують і посилюються тільки дифракційні піки, які відповідають умовам правила Брегга. Інші дифракційні піки не спостерігаються. З іншого боку, високоорганізовані дифракційні піки в широкому інтервалі не спостерігаються для аморфних твердих речовин. Звичайно далекий порядок, оснований на кристалічній решітці, що повторюються, відсутній в аморфних твердих тілах, і тоді спостерігається розмита XRPDкартина, звана ореолом. Кристалічні форми похідних 6,7-ненасиченого-7-карбамоїлморфінану, його солей приєднання кислоти і/або їх сольватів, розкритих в описі, що розглядається, мають, переважно, картини, що відрізняються порошковою рентгенівською дифракцією. У разі солей птолуолсульфонової кислоти сполуки (IA), можливо точно визначити кожні з кристалів по наявності характеристичних дифракційних піків і відрізнити одні кристали від інших. Характеристичні дифракційні піки, використані в описі, являють собою піки, вибрані з дифракційної картини, що спостерігається. Переважно, характеристичні піки можна вибрати з приблизно 20 піків, більш переважно з близько десяти піків, найбільш переважно, з близько п'яти піків відповідної дифракційної картини. Необхідно розуміти, що величина кута дифракції (2θ) включає помилку приблизно в ±0,2°, оскільки помилка може виникнути звичайно в межах ±0,2° у визначенні кута дифракції в XRPD. Тому не тільки кристали, що мають ідентичні значення кутів дифракції в XRPD, але також і кристали, що мають значення в інтервалі ±0,2°, включені в даний винахід. Добре відомо, що відносна інтенсивність піків, представлена далі в таблицях і на кресленнях, може мінятися під дією багатьох факторів, таких як, наприклад, орієнтаційний ефект кристалів по відношенню до пучка рентгенівських променів, ступінь чистоти речовини, що аналізується, або кристалічність зразка. Крім того, можуть спостерігатися зміщення піків через зміну висоти зразка. Крім того, можуть спостерігатися різні зсуви відповідно до рівняння Брегга (n А=2dsinθ), якщо зразок досліджують, використовуючи довжину хвилі, що відрізняється, але і інша картина XRPD, отримана при використанні такої іншої довжини хвилі, також включена в обсяг даного винаходу. Кристали солі п-толуолсульфонової кислоти (несольват), гідрату солі п-толуолсульфонової кислоти (форми I), і гідрату солі п-толуолсульфонової кислоти (форми II) сполуки (IA) в даному винаході демонструють порошковий рентгенівський дифракційний спектр, як представлено на фіг. 1-3. Всі кристали демонструють характеристичні піки, як представлено в таблиці 1. Кристали даного винаходу можна також охарактеризувати, використовуючи термічний аналіз. TG/DTA (термогравіметричний/диференціальний термічний аналіз) являє собою один з основних способів термічного аналізу і являє собою спосіб вимірювання маси і термічних характеристик речовини як агрегату атомів і молекул. TG/DTA являє собою вимірювання змін маси і кількості тепла в залежності від температури або часу для активного фармацевтичного інгредієнта, і отримують TG (термогравіметрія) і DTA (диференціальний термічний аналіз) криву, будуючи графік залежності отриманих результатів від температури або від часу. Із TG/DTA-кривої можна отримати інформацію про масу, про розкладання активного фармацевтичного інгредієнта, про дегідратації, про окислення, про відновлення, про сублімацію і випаровування і про кількість теплообміну. 16 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 У TG/DTA "точка плавлення" означає настання температури. Відомо, що спостережувані зміни температури і маси можуть залежати від швидкості нагрівання, способу отримання зразка, що досліджується, конкретного пристрою приладу TG/DTA. Для авторизації ідентичності кристалів важливі всі піки, і результати можуть змінюватися до деякого ступеня в залежності від умов вимірювання. Що стосується кристалів солі п-толуолсульфонової кислоти, гідрату (форми I) солі птолуолсульфонової кислоти, гідрату (форми II) солі п-толуолсульфонової кислоти, ацетату і гідрохлориду, то результати TG/DTA-аналізів представлені на фіг. 14-18. Кристали сполуки формули (IA), його солі приєднання кислоти і/або їх сольвати мають антагоністичну активність відносно опіоїдних рецепторів (особливо опіоїдних рецепторів δ і μ). Відповідно, вони можуть бути ефективні при лікуванні і/або для профілактики нудоти, блювання, запорів, також як гострих проблем травлення, гострого алкоголізму, харчових отруєнь, простуди, виразки шлунка, виразки дванадцятипалої кишки, раку шлунка, завороту кишок, апендициту, перитоніту, холециститу, гепатиту, запалення печінки, енцефаліту, менінгіту, мозкової гіпертензії, черепно-мозкових травм, морської хвороби, блювання вагітних, побічних ефектів хіміотерапії, побічних ефектів радіаційної терапії, побічних ефектів протиракових агентів, затримок шлунково-кишкового транзиту, викликаного тиском або стенозом шлунковокишкового тракту, або післяопераційних спайок кишок, нудоти або блювання, викликаних підвищенням мозкового тиску через пухлину мозку, мозкової кровотечі, менінгіту, наслідків опромінення пухлини мозку, гострого запору, викликаного ілеусом, виразки дванадцятипалої кишки або апендициту і т. д., нейропатії, нестачі харчування, слабості, авітаміноз, ішемії, атонічного запору, викликаного гіпочутливістю або недоліком механічного стимулу, спастичного запору, викликаного стресом і т. д., які викликані сполуками, що мають агоністичну активністю відносно опіоїдного рецептора. Кристали сполуки, представленої формулою (IA), її солі приєднання кислоти і/або їх сольвати в даному винаході відрізняються слабим транзитом в мозок і мають чудовий ефект відносно зниження побічних ефектів, таких як нудота, блювота і запор і т. д., викликаних агоністами опіоїдних рецепторів, без інгібування анальгезуючого ефекту агоністів, які вводять пацієнту із захворюваннями, пов'язаними з болем, таким як біль при раку (кісткові метастази; здавлювання нервів; при підвищеному внутрішньочерепному тиску; при пошкодженнях м'яких тканин; при запорі, або з болем при м'язових спазмах; з болем внутрішніх органів, м'язів і поясниці або суглобової сумки плеча; з післяопераційним хронічним болем і при AIDS і т. д. Крім того, кристали даного винаходу мають чисту антагоністичну активність відносно опіоїдних рецепторів, їх інгібуючу дію відносно hERG (ген-специфічні калієві канали серця) каналів слабке, і відсутній зв'язок з кардіотоксичністю. Все вищезгадане обумовлює переваги в аспекті безпеки. Крім того, кристали даного винаходу відрізняються вигідними характеристиками з точки зору способів введення, такими як прекрасна абсорбційна здатність при пероральному введенні, висока стабільність в плазмі людини і висока біодоступність, і тому вони дуже ефективні як лікарські засоби. Якщо прийом кристалів даного винаходу або їх фармацевтичних композицій прописаний пацієнтам проти нудоти, блювання і запору, які викликані сполукою, що має агоністичну активність відносно опіоїдного рецептора, їх можна вводити до введення, після введення або одночасно з введенням сполуки, що має агоністичну активність відносно опіоїдного рецептора. Інтервали між введенням вказаних двох типів лікарських засобів конкретно не обмежені. Наприклад, якщо фармацевтичну композицію, що включає кристали даного винаходу, вводять після введення сполуки, що має агоністичну активність відносно опіоїдного рецептора, ефективним буде введення вказаної композиції негайно після або з проміжком менше 3 днів після введення агоніста опіоїдного рецептора, або негайно після або з проміжком менше 1 дня після введення. Якщо вказану композицію вводять до введення агоніста опіоїдного рецептора, ефективним буде введення композиції безпосередньо перед або менше ніж за один день до введення агоніста опіоїдного рецептора, або безпосередньо перед або менше ніж за приблизно 12 годин до введення. Якщо фармацевтичну композицію, що включає кристали даного винаходу, або самі кристали прописують для лікування і/або профілактики нудоти, блювання або запору, інші агенти для лікування і/або профілактики нудоти, блювання або запору можна використовувати в комбінації. Наприклад, можливо введення сполуки даного винаходу з іншими агентами, такими як гідрохлорид ондансетрону, адренокортикостероїди (метилпреднізолон, преднізолон, дексаметазон і т. д.), прохлорперазин, галоперидол, тиміперон, перфеназин, метоклопрамід, домперидон, скополамін, гідрохлорид хлорпромазину, дроперидол, стимулюючі проносні 17 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 55 60 (сенозид, пікосульфат натрію і т. д.), осмотичні проносні (лактулоза), проносні солі (окисел магнію і т. д.) і т. д. Крім того, за необхідності, до кристалів або фармацевтичних композицій, що включають кристали даного винаходу, для отримання комбінованих агентів можуть бути додані сполуки, що мають агоністичну активністю відносно опіоїдного рецептора, і/або інші агенти для лікування і/або профілактики нудоти, блювання або запору, і також інші фармацевтичні добавки. Кристали даного винаходу можна вводити пацієнту безпосередньо або у вигляді фармацевтичної композиції, в якій кристали даного винаходу змішані з фармацевтичним носієм або ексципієнтом. Докладну інформацію відносно лікарських форм і способів введення можна знайти в "Remington's Pharmacological Sciences" Mack Publishing Co., Easton, and PA., останнє видання. Хоча придатний спосіб введення не обмежений, він може включати пероральне, інтраректальне, через слизову, ентеральне, внутрішньом'язове, підшкірне, інтраспінальне, інтратекальне, пряме інтравентрикулярне, внутрішньовенне, внутрішньоочеревинне, інтраназальне, інтраокулярне введення і ін'єкції. Переважні пероральний і парентеральний способи введення. Фармацевтичну композицію даного винаходу можна отримати способами, які добре відомі фахівцям, такими як звичайне змішування, розчинення, гранулювання, нанесення цукрової оболонки, подрібнення в порошок, емульгування, інкапсулювання, упаковування і ліофілізація. Фармацевтичні композиції, що використовуються в даному винаході, можна приготувати за допомогою відомих способів, використовуючи один або більше з фармацевтично прийнятних носіїв, включаючи ексципієнти і добавки, які полегшують приготування фармацевтично прийнятних лікарських композицій, що включають кристали даного винаходу. Конкретні форми лікарських композицій залежать від способів введення. Якщо введення здійснюють шляхом ін'єкцій, кристали даного винаходу можна вводити після їх розчинення у водному розчині, переважно, розчині Рінгера або в буферному розчині, такому як фізіологічний сольовий розчин, які фізіологічно прийнятні. У разі введення через слизову оболонку можна використовувати посилюючий проникність агент, придатний для відповідного цільового бар'єра. Можна використовувати посилюючі проникність агенти, які звичайно використовують у вказаній галузі техніки. Якщо використовується пероральний спосіб введення, кристали даного винаходу можна вводити в комбінації з фармацевтично прийнятними носіями, які добре відомі фахівцям. Для перорального введення пацієнту можна використовувати такі фармацевтичні форми, як таблетки, пілюлі, льодяники, таблетки з цукровою оболонкою, капсули, рідини, гелі, сиропи, зависі і суспензії. Фармацевтичні композиції для перорального введення можна отримати, змішуючи твердий ексципієнт і інші придатні добавки, за необхідності, гранулюючи суміш і обробляючи отримані гранули до отримання таблеток або ядер для нанесення цукрової оболонки. Приклади ексципієнтів включають збільшуючі об'єм агенти - цукри, такі як лактоза, сахароза, маніт або сорбіт; спеціально оброблену целюлозу, таку як кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль і картопляний крохмаль; і смолу трагаканту, метилцелюлозу, гідроксипропілметилцелюлозу і/або натрійкарбоксиметилцелюлозу і т. д. За необхідності можна додавати розпушуючі агенти, такі як агар і альгінова кислота. Можна використати солі, такі як альгінат натрію. Фармацевтичні композиції для перорального введення включають тверді капсули, отримані з желатину з пластифікаторами, такими як желатин, гліцерин або сорбіт. Тверді капсули можуть містити кристали даного винаходу разом із збільшуючими об'єм агентами, такими як лактоза, зв'язуючими, такими як крохмаль, мастильними агентами, такими як тальк або стеарат магнію, і стабілізуючими агентами, за необхідності. У разі м'яких капсул кристали даного винаходу можна розчинити або суспендувати у придатній рідині, такій як жирні масла, рідкий парафін або рідкий поліетиленгліколь. До лікарської композиції може бути доданий стабілізуючий агент. Фармацевтична композиція може також містити придатний носій або ексципієнт в твердій або в рідкій фазі. Приклади носіїв або ексципієнтів включають карбонат кальцію, фосфат кальцію, різні типи цукрів, крохмаль, похідні целюлози, желатин і полімери, такі як поліетиленгліколь і т. д. Ефективну кількість кристалів в фармацевтичних композиціях, що включають кристали даного винаходу, для лікування можна оцінити, використовуючи спочатку аналіз культури. Потім кількість, що вводиться можна збільшити для експериментів на тваринах таким чином, щоб діапазон концентрацій для циркуляції складав величину IC 50 (а саме концентрації кристалів або їх фармацевтичних композицій забезпечували б половину максимального інгібування PK 18 UA 115028 C2 5 10 15 20 25 30 35 активності), що визначено в аналізі клітинних культур. Потім ефективну кількість для людей можна більш точно визначити, використовуючи таку інформацію. Токсичність і терапевтичний ефект кристалів або фармацевтичних композицій, що включають кристали даного винаходу, можна виміряти, визначаючи значення IC 50 кристалів або фармацевтичних композицій, що включають вказані кристали, використовуючи стандартні медичні процедури в клітинній культурі або на лабораторних тваринах. Результати, отримані в аналізі клітинних культур і в експериментах на тваринах, можна використати для попереднього визначення інтервалу величин доз, що використовуються для людей. Величини доз для людей міняються в залежності від складу лікарського засобу і способу введення. З урахуванням стану пацієнтів, кожний практикуючий лікар може вибрати конкретні композиції лікарських засобів і дози (наприклад, з посиланням на Fingl et al., 1975, "in The Pharmacological Basis of Therapeutics", і Ch.1, р. 1). При пероральному введенні дорослим пацієнтам доза звичайно становить 0,1 мкг - 1 г/день, переважно, становить 0,01-200 мг/день, і у разі парентерального введення доза звичайно становить 1 мкг - 10 г/день, переважно 0,1-10 мг/день, хоч ця величина залежить від типу захворювання, способу введення і віку, і маси тіла пацієнта. Далі роз'яснюється спосіб отримання сполуки (I) даного винаходу. Спосіб отримання сполуки (I) в даному винаході проілюстрований на схемі 1: 1b 2 де R являє собою гідроксилзахисну групу; R являє собою необов'язково заміщений алкіл; R являє собою необов'язково заміщений алкіл, необов'язково заміщений циклоалкіл, 7 заміщений або незаміщений арил або заміщений або незаміщений гетероарил; і R являє собою необов'язково заміщений феніл. Відповідно до даного винаходу сполуку (I) можна отримати, додаючи основу до похідного карбамату (II) і здійснюючи їх взаємодію при температурі в інтервалі від кімнатної до температури нижче за температуру кипіння розчинника протягом від 1 до 10 годин. Як основи переважні неорганічні основи, такі як гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію, і, переважно, додавання водного розчину, що містить 1-10 еквівалентів лугу, до похідного карбамату (II). Здійснюють реакцію похідного карбамату, переважно, розчиняючи його в гідрофільному розчиннику, такому як метанол, етанол, 2-пропанол і ДМСО і т. д., і додаючи водний розчин вищезгаданого лугу. 1b Хоча гідроксилзахисна група в R в похідному карбамату (II) конкретно не обмежена, можливо безпосередньо отримати сполуку (I), якщо адаптувати захисну групу, яку можна видалити під дією основи, таку як ацетильна група. У разі захисної групи, яку не можна видалити основою, видалення захисної групи можна здійснити до або після обробки вищезгаданою основою. 3 19 UA 115028 C2 5 10 15 20 25 30 35 40 45 50 Похідне карбамату (II) отримують, здійснюючи взаємодію ізоціанатного похідного (V) із сполукою (III). Реакцію здійснюють, додаючи розчин, що містить від 0,5 до 5 еквівалентів, переважно від 1,0 до 1,2 еквівалентів, ізоціанатного похідного (IV) відносно сполуки (III), до розчину сполуки (III), і здійснюючи їх взаємодію при температурі від кімнатної до температури нижче за температуру кипіння розчинника протягом від 1 до10 годин. Переважно додавати каталізатор - кислоту Льюїса, таку як, наприклад, CuCl2, в кількості від 0,00005 до 1 еквівалента, переважно від 0,0001 до 0,1 еквівалента, більш переважно від 0,0001 до 0,01 еквівалента. Етилацетат, ацетонітрил, ацетон, толуол і т. д. можна використати як реакційний розчинник, хоч немає конкретних обмежень. Вищезгадане ізоціанатне похідне (V) можна отримати, здійснюючи взаємодію попередника 5 карбамату (VIII), де R являє собою нижчий алкіл, в присутності кислоти Льюїса і основи у відповідності з наступною схемою: . Похідне карбамату (II) можна також отримати, використовуючи активний ефір (VI) 7 карбамінової кислоти, де R являє собою необов'язково заміщений феніл, замість ізоціанатного похідного. Активний ефір можна отримати, здійснюючи взаємодію хлорформіату відповідного 3 фенолу з амінопохідним: R -NH2: . 7 7 У вказаній реакції переважний R , в якому OR група функціонує як відхідна група X, і особливо переважні фенільна група, п-нітрофенільна група, п-хлорфенільна група і т. д. ПРИКЛАДИ Далі даний винахід роз'яснюється більш детально із залученням прикладів, але вказані приклади не обмежують цей винахід. Хоч робилися спроби гарантувати точність, що наближається до числових значень (наприклад, кількості, температури і т. д.), потрібно брати до уваги деякі помилки і відхилення. Якщо конкретно не указано, % являє собою масовий % компонента, і масовий % являє собою масовий % від повної маси композиції. Тиск є атмосферним тиском або тиском, що наближається до нього. У описі, що розглядається прийняті наступні скорочення: г (g) являє собою грам, L являє собою літр, мг (mg) являє собою міліграм, мл (mL) являє собою мілілітр, Boc являє собою трет-бутоксикарбонільну групу, Ac являє собою ацетил, Me являє собою метильну групу, Et являє собою етильну групу і Pr являє собою пропільну групу. Отримання дифракційного спектра рентгенівських променів Рентгенівські дифракційні спектри кристалів, отриманих в кожному з прикладів, здійснюють в наступних умовах вимірювання відповідно до способів отримання дифракційних спектрів рентгенівських променів, розкритими в General Test Procedures of the Japanese pharmacopoeia (фармакопеї Японії). Прилад D-8 Discover (Bruker) Методика отримання Що стосується зразків, то застосовують наступні умови вимірювань: спосіб вимірювання: спосіб відображення; тип джерела випромінювання: Cu трубка; робоча довжина хвилі: CuK α випромінювання; струм в трубці: 40 мА; напруга на трубці: 40 кВ; підкладка для зразка: скло; інтервал кутів тестування: 3°-40°. Отримання результатів TG/DTA (TG/DTA=Комплекс диференціальнотермічного і термогравіметричного аналізу) Відмірюють близько 5 мг кожного з кристалів, отриманих в кожному прикладі, вміщують в алюмінієвий контейнер і вимірюють у відкритій системі. Умови вимірювань наступні. Умови вимірювань прилад: TG/DTA 6300 від SEIKO; 20 UA 115028 C2 5 10 15 20 25 30 інтервал температур при вимірюваннях: 25-300 °C; швидкість нагрівання: 10 °C/хв. Приклад 1-1 Отримання солі п-толуолсульфонової кислоти [сполука (IC)] сполуки (IA) (IC) Стадія 1: Синтез сполуки (3) Діізопропілетиламін (17,5 г, 135,4 ммоль) додають до розчину третбутоксикарбоніламіноізомасляної кислоти (1) (25,0 г, 123 ммоль) в н-пропілацетаті (150 мл) при 0 °C. До суміші по краплях додають ізобутилхлорформіат (17,6 г, 128,9 ммоль) при тій же температурі і перемішують протягом години. До отриманого додають розчин бензамідоксиму (2) (17,6 г, 129,3 ммоль) в н-пропілацетаті (100 мл) і перемішують при 0 °C протягом 1 години і потім при 95 °C протягом 5 годин. Додають кислотний водний розчин, і виділяють органічний шар, промивають гідрокарбонатом натрію і водою і концентрують у вакуумі. До реакційного розчину додають хлористоводневу кислоту, перемішують протягом 2,5 години, і кристали, що випали в осад, збирають фільтруванням, промивають і сушать, отримуючи сполуку (3) (27,34 г, 92,7 %). 1 H-ЯМР (300 МГц, ДМСО-d6) δ: 1,80 (6Н, с), 7,59-7,64 (3Н, м), 8,01-8,05 (2Н, м), 9,26 (3Н, уш.). Стадія 2: Синтез сполуки (4) До суспензії сполуки (3) (19,0 г, 79,2 ммоль) в толуолі (150 мл) при 25 °C додають лужну воду і перемішують. Додають метилхлорформіат (8,3 г, 88,0 ммоль) при 50 °C, перемішують протягом години, органічний шар виділяють, промивають послідовно водним розчином хлористоводневої кислоти, водним розчином бікарбонату натрію і водою і концентрують у вакуумі. До отриманого додають розчин трихлористого бору (1,0 моль/л, 7,3 мл) в толуолі, по краплях додають триетиламін при 50 °C і перемішують протягом 2 годин. Реакційний розчин концентрують, отримуючи розчин сполуки (4). Стадія 3: Синтез сполуки (6) Триетиламін (11,3 г, 111,7 ммоль) і оцтовий ангідрид (5,7 г, 55,8 ммоль) додають до розчину комерційного гідрохлориду налтрексону (5) (20,0 г, 52,9 ммоль) в етилацетаті (160 мл) і 21 UA 115028 C2 5 10 15 20 25 30 35 40 перемішують при 40 °C протягом 2 годин. Реакційний розчин охолоджують, промивають водою і концентрують, отримуючи розчин сполуки (6). 1 H-ЯМР (300 МГц, ДМСО-d6) δ: 0,14 (2H, д, J=4,8 Гц), 0,49 (2H, д, J=7,8 Гц), 0,88 (1H, м), 1,29 (1H, д, J=9,9 Гц), 1,46 (1H, тд, J=14,1, 3,3 Гц), 1,79 (1H, дт, J=12,0, 3,3 Гц), 1,90-2,00 (1H, м), 2,11 (1H, дт, J=14,4, 3,3 Гц), 2,26 (3H, с), 2,30-2,46 (3H, м), 2,52-2,72 (2H, м), 2,92 (1H, тд, J=14,1, 4,8 Гц), 3,07 (1H, д, J=18,9 Гц), 3,17 (1H, д, J=5,7 Гц), 4,91 (1H, с), 5,18 (1H, с), 6,71 (1H, д, J=8,1 Гц), 6,83 (1H, д, J=8,1 Гц). Стадія 4: Синтез сполуки (7) Реакційний розчин сполуки (4) і етилацетат додають до розчину сполуки (6), до отриманого додають водний розчин хлориду міді (II) і перемішують при 25 °C протягом 4 годин. До реакційного розчину додають гептан і здійснюють кристалізацію. Фільтрують, промивають і сушать, отримуючи в результаті сполуку (7) (89,2 %). 1 H-ЯМР (300 МГц, ДМСО-d6) δ: 0,20-0,40 (2H, м), 0,60-0,90 (1H, м), 1,20-1,50 (2H, м), 1,67 (3H, с), 1,74 (3H, с), 1,90-2,10 (2H, м), 2,10-2,20 (2H, м), 2,26 (3H, с), 2,30-2,55 (2H, м), 2,58-2,80 (4H, м), 3,03 (2H, м), 4,31 (1H, с), 4,81 (1H, с), 6,71 (1H, д, J=8,1 Гц), 6,85 (1H, д, J=7,8 Гц), 7,507,70 (3H, м), 7,92-8,01 (2H, м), 8,11 (1H, с). Стадія 5: Синтез сполуки (8) Водний розчин гідроксиду калію по краплях додають до суспензії сполуки (7) (5,5 г, 9,0 ммоль) в 2-пропанолі (22 мл) і перемішують при 80 °C протягом 5 годин. Реакційний розчин промивають толуолом, величину pH доводять до 7,0-8,0 і екстрагують н-пропілацетатом. Органічний шар промивають водою, додають 2-пропанол і н-пропілацетат і концентрують. Додають розчин п-толуолсульфонової кислоти (1,5 г, 8, l ммоль) в 2-пропанолі для здійснення кристалізації. Після охолоджування осад, що випав, збирають фільтруванням, отримуючи вологий продукт (8) (н-пропілацетат/2-пропанольний сольват солі п-толуолсульфонової кислоти). Результати рентгенівського дифракційного і TG/DTA-аналізів вологого продукту (8) (нпропілацетат/2-пропанольний сольват солі п-толуолсульфонової кислоти) представлені в наступному порівняльному прикладі 3. Стадія 6: Синтез сполуки (IC) Вологий продукт (8) розчиняють в метанолі і н-пропілацетаті шляхом нагрівання, і отриманий розчин фільтрують, промивають і концентрують у вакуумі. Осад, що випав, збирають фільтруванням, промивають, отримуючи сирий продукт, який сушать при температурі 60 °C протягом 3 годин у вакуумі, отримуючи кристали сполуки (IC) (несольват: 66,3 %). 1 H-ЯМР (300 МГц, ДМСО-d6) δ: 13,37 (1H, с), 9,44 (1H, с), 8,95 (1H, уш. с), 8,12 (1H, с), 7,997,96 (2H, м), 7,60-7,53 (3H, м), 7,49-7,45 (2H, м), 7,11 (2H, д, J=8,4 Гц), 6,69 (2H, ABq), 6,56 (1H, с), 4,94 (1H, с), 3,95 (1H, д, J=5,1 Гц), 3,50-3,25 (2H, м), 3,07 (2H, уш. д, J=12 Гц), 3,00-2,90 (1H, м), 2,75-2,60 (1H, м), 2,60-2,40 (2H, м), 2,29 (3H, с), 2,10 (1H, д, J=14,7 Гц), 1,70 (6H, с), 1,75-1,60 (1H, м), 1,15-0,95 (1H, м), 0,80-0,55 (2H, м), 0,55-0,35 (2H, м). Результати порошкового рентгеноструктурного дифракційного аналізу представлені на фіг. 1 і в таблиці 2. 22 UA 115028 C2 5 У порошковому рентгенівському дифракційному спектрі спостерігаються піки, відповідні дифракційним кутам (2θ): 7,8°±0,2°, 10,6°±0,2°, 15,6°±0,2°, 17,8°±0,2°, 18,6±0,2°, 20,4°±0,2°, 21,5°±0,2°, 21,9°±0,2°, 23,6°±0,2° і 25,5°±0,2°. Результати TG/DTA аналізу представлені на фіг. 14. Приклад 1-2 Отримання солі п-толуолсульфонової кислоти [сполука (IC)] сполуки (IA) (Альтернативний спосіб А) (IC) 23 UA 115028 C2 5 10 15 20 Стадія 1: Синтез сполуки (11) CDI (карбонілдіімідазол, 5,28 г, 31,1 ммоль) і ацетонітрил (5 мл) додають до суспензії метоксикарбоніл-2-метилаланіну (10) (5,00 г, 31,0 ммоль) в ацетонітрилі (25 мл) при 0 °C і перемішують протягом 1,5 години. Бензамідоксим (2) (4,65 г, 34,2 ммоль) і ацетонітрил (20 мл) додають при тій же температурі і перемішують протягом 2 годин. До отриманого відразу додають водний розчин карбонату калію [0,10 еквівалента відносно сполуки (10): 0,43 г] у воді (15 мл) і здійснюють реакцію при температурі нижче, ніж температура кипіння розчинника, протягом 1-5 годин. Після концентрування у вакуумі додають воду, і сирий продукт, що випав в осад, збирають фільтруванням і промивають. Вологий продукт сушать, отримуючи сполуку (11) (7,43 г, вихід 91,7 %). 1 H-ЯМР (300 МГц, CDCl3) δ: 1,81 (6H, с), 3,65 (3H, с), 5,46 (1H, с), 7,49-7,50 (3H, м), 8,05-8,08 (2H, м). Стадія 2: Синтез сполуки (4) Триетиламін (7,55 г, 74,63 ммоль) по краплях додають до розчину сполуки (11) (15,12 г, 57,41 ммоль) і трихлористого алюмінію (9,19 г, 68,89 ммоль) в толуолі при 50 °C і перемішують при тій же температурі протягом 2,5 годин. Органічний шар виділяють і концентрують, отримуючи реакційний розчин сполуки (4). 1 H-ЯМР (300 МГц, CDCl3) δ: 1,84 (6H, с), 7,31-7,55 (3H, м), 8,05-8,13 (2H, м). 13 C-ЯМР (75 МГц, CDCl3) δ: 29,85, 55,71, 126,16, 127,44, 128,78, 131,35, 168,23, 180,88. -1 ІЧ (см ): 1446, 1478, 1570, 1638, 2256, 2986, 3337. Стадія 3-6: Синтез сполуки (IC) Сполуку (IC) (несольват) синтезують із сполуки (5), використовуючи стадії прикладу 1-1. 24 UA 115028 C2 Приклад 1-3 Отримання солі п-толуолсульфонової кислоти [сполука (IC)] сполуки (IA) (Альтернативний спосіб В) 5 10 15 20 25 30 35 Стадія 1 Сполуку (3) (2,03 г, 10,0 ммоль), отриману тим же способом, що і спосіб стадії 1 прикладу 11, розчиняють в ацетонітрилі (20 мл), додають піридин (0,89 мл, 11,0 ммоль) і 4нитрофенілхлорформіат (2,22 г, 11,0 ммоль) при охолоджуванні льодом, і перемішують при кімнатній температурі протягом 1,5 години. Реакційний розчин виливають в льодяну воду, що містить 2 моль/л хлористоводневої кислоти, і двічі екстрагують етилацетатом. Отриманий екстракт промивають сольовим розчином, сушать над безводним сульфатом натрію, фільтрують і концентрують. Гексан (приблизно 20 мл) додають до отриманого масла блідожовтого кольору (4,88 г), яке твердне при охолоджуванні льодом. Отриманий твердий продукт збирають фільтруванням, промивають гексаном, отримуючи потрібну сполуку (16) (3,74 г) у вигляді твердої речовини білого кольору. 1 H-ЯМР (CDCl3) δ: 8,24 (2H, д, J=9,3 Гц), 8,09 (2H, м), 7,53-7,45 (3H, м), 7,33 (2H, уш. д, J=8,7 Гц), 5,99 (1H, уш. с), 1,92 (6H, с). Стадія 2 Сполуку (6) (3,28 г, 8,56 ммоль), синтезовану тим же способом, що і спосіб стадії 3 прикладу 1-1, і сполуку (16) (3,79 г, 10,3 ммоль) розчиняють в ацетонітрилі (10 мл) і кип'ятять із зворотним холодильником протягом 22 годин. Реакційний розчин охолоджують до кімнатної температури, виливають в льодяну воду і двічі екстрагують етилацетатом. Отриманий екстракт двічі промивають 0,1 моль/л водним розчином гідроксиду натрію і один раз сольовим розчином, сушать над безводним сульфатом магнію, фільтрують і концентрують. Отриману аморфну сполуку (7) (5,46 г) використовують на наступній стадії без додаткового очищення. 1 H-ЯМР (ДМСО-d6) δ: 8,0-7,9 (2H, м), 7,6-7,5 (3H, м), 6,9-6,7 (2H, AВq), 4,32 (1H, с), 3,2-1,2 (12H, м), 2,26 (3H, с), 1,71 (1Н, д, J=21,6 Гц), 1,61 (6H, с), 0,95-0,65 (1H, м), 0,55-0,2 (2H, м), 0,20,5 (2H, м). Стадія 3 Сполуку (7) (500 мг) розчиняють в диметилсульфоксиді (2 мл), додають 2 моль/л водний розчин гідроксиду калію (2 мл) і перемішують при 80 °C протягом 6 годин. Реакційний розчин охолоджують до кімнатної температури, нейтралізують, використовуючи 2 моль/л хлористоводневу кислоту, і екстрагують етилацетатом. Отриманий екстракт промивають послідовно 0,1 моль/л водним розчином гідроксиду натрію і сольовим розчином, сушать над безводним сульфатом натрію, фільтрують і концентрують. Отриману тверду аморфну речовину 25 UA 115028 C2 5 10 15 20 25 блідо-жовтого кольору (412 мг) розчиняють в метанолі (2 мл), додають гідрат птолуолсульфонової кислоти (165 мг) і залишають вистоюватися протягом 30 хвилин. Потім додають ацетонітрил (20 мл), і залишають вистоюватися при температурі 5 °C протягом ночі. Осад, що випав, збирають фільтруванням і сушать у вакуумі, отримуючи сіль птолуолсульфонової кислоти (IC) (несольват: 282 мг) у вигляді кристалів (вихід із сполуки (6): 48 %). 1 H-ЯМР (ДМСО-d6) δ: 13,37 (1H, с), 9,44 (1H, с), 8,95 (1H, уш. с), 8,12 (1H, с), 7,99-7,96 (2H, м), 7,60-7,53 (3H, м), 7,49-7,45 (2H, м), 7,11 (2H, д, J=8,4 Гц), 6,69 (2H, ABq, ), 6,56 (1H, с), 4,94 (1H, с), 3,95 (1H, d, J=5,1 Гц), 3,50-3,25 (2H, м), 3,07 (2H, уш. д, J=12 Гц), 3,00-2,90 (1H, м), 2,752,60 (1H, м), 2,60-2,40 (2H, м), 2,29 (3H, с), 2,10 (1H, д, J=14,7 Гц), 1,70 (6H, с), 1,75-1,60 (1H, м), 1,15-0,95 (1H, м), 0,80-0,55 (2H, м), 0,55-0,35 (2H, м). Приклад 1-4 Отримання солі п-толуолсульфонової кислоти [сполука (IC)] сполуки (IA) (Альтернативний спосіб С) Стадія 1: Синтез сполуки (4) Толуол додають до сполуки (11) (0,5 г, 1,91 ммоль), отриманої тим же способом, що і спосіб стадії 1 прикладу 1-2. До отриманого додають TiCl4 (2,30 ммоль), і суміш нагрівають до 50 °C. До реакційного розчину додають триетиламін (2,30 ммоль) і перемішують при тій же температурі протягом 2 годин, отримуючи реакційний розчин сполуки (4). Стадія 2-7: Синтез сполуки (IC) Сполуку (IC) (несольват) синтезують із сполуки (5), використовуючи ті ж стадії, що і стадії прикладу 1-1. Приклад 2 Синтез сполуки (20) 26 UA 115028 C2 5 10 15 20 25 30 35 Стадія 1 Сполуку (17) (4,51 г, 36 ммоль) розчиняють в ацетонітрилі (45 мл), і додають піридин (3,20 мл, 39,6 ммоль) і фенілхлорформіат (5,00 мл, 39,6 ммоль) при охолоджуванні льодом. Додають диметилформамід (9 мл) і ацетонітрил (30 мл) і перемішують при кімнатній температурі протягом 45 хвилин. Осад, що випав, з реакційного розчину збирають фільтруванням, промивають холодним метанолом і водою і сушать у вакуумі, отримуючи цільову сполуку (18) (7,02 г) у вигляді твердої речовини білого кольору. 1 H-ЯМР (CDCl3) δ: 8,61 (1H, с), 7,43 (2H, т, J=7,8 Гц), 7,41 (1H, с), 7,29 (1H, т, J=7,8 Гц), 7,21 (2H, д, J=7,8 Гц), 3,97 (3H, с). Стадія 2 Сполуку (6) (1,92 г, 5,00 ммоль), отриману тим же способом, що і спосіб стадії 3 прикладу 11, і сполуку (18) (1,84 г, 7,50 ммоль) розчиняють в диметилформаміді (10 мл) і перемішують при температурі 120 °C протягом 4 годин. Реакційний розчин охолоджують знов до кімнатної температури, додають ацетонітрил (50 мл) і осад, що випав, відфільтровують. Отриманий фільтрат концентрують при температурі 60 °C у вакуумі, і випаровують диметилформамід. До отриманого залишку додають ацетонітрил (100 мл) і перемішують при охолоджуванні льодом протягом 30 хвилин. Кристали, що випали в осад, збирають фільтруванням, промивають холодним ацетонітрилом і сушать у вакуумі, отримуючи першу порцію кристалів (1,66 г) сполуки (19). Далі маточний розчин концентрують, до залишку додають діетиловий ефір і перемішують при кімнатній температурі, отримуючи другу порцію кристалів (306 мг) і третю порцію кристалів (71 мг). 1 H-ЯМР (ДМСО-d6) δ: 10,58 (1H, уш. с), 8,52 (1H, с), 7,19 (1H, с), 6,83 (2H, AВq), 4,78 (1H, с), 4,44 (1H, д, J=5,4 Гц), 3,90 (3H, с), 3,12 (1H, д, J=18,6 Гц), 2,9-2,55 (4Н, м), 2,35 (1Н, дд, J=6,3 Гц, 12,6 Гц), 2,27 (3H, с), 2,25-2,12 (3H, м), 2,1-1,9 (1H, м), 1,62-1,48 (1H, м), 1,28-1,20 (1H, м), 0,750,62 (1H, м), 0,35 (2H, д, J=7,5 Гц), 0,1-0,5 (2H, м). Стадія 3 Сполуку (19) (2,02 мг, 3,78 ммоль) розчиняють в метанолі (9,5 мл), додають 2 моль/л водний розчин гідроксиду калію (9,5 мл) і перемішують при 60 °C протягом 2,5 годин. Реакційний розчин охолоджують знов до кімнатної температури, нейтралізують, використовуючи 2 моль/л хлористоводневу кислоту при охолоджуванні льодом, і випаровують метанол. Осад сирих кристалів, що випав, збирають фільтруванням, перекристалізовують з суміші етилацетату і метанолу (1:1), отримуючи цільову сполуку (20) (1,44 г, вихід 77 %) у вигляді кристалів. 1 H-ЯМР (ДМСО-d6) δ: 14,2 (1H, уш. с), 9,19 (1H, с), 8,8 (1H, уш. с), 8,32 (1H, с), 7,49 (1H, с), 6,56 (2H, ABq), 6,1 (1H, уш. с), 4,53 (1H, уш. с), 3,82 (3H, с), 3,5-2,3 (9H, м), 1,82 (1H, д, J=15,6 Гц), 1,53 (1H, уш. д, J=13,5 Гц), 1,15-0,95 (1H, м), 0,75-0,5 (2H, м), 0,5-0,3 (2H, м). Приклад 3-1 27 UA 115028 C2 Синтез сполуки (7) (спосіб 1) 5 10 15 Сполуку (6) (що відповідає гідрохлориду налтрексону 5,00 г), синтезовану за способом стадії 3 прикладу 1-1, розчиняють в етилацетаті, додають оцтову кислоту (0,1 еквівалента) і нагрівають до 50 °C. До отриманого додають розчин сполуки (4), синтезованої за способом стадій 1 і 2 прикладу 1-1, і перемішують при тій же температурі протягом 6,5 годин. До реакційного розчину додають гептан, що випав в осад твердий продукт збирають фільтруванням, промивають і сушать, отримуючи сполуку (7) (6,92 г, 85,3 %). Приклад 3-2 Синтез сполуки (7) (спосіб 2) Сполуку (6), синтезовану за способом стадії 3 прикладу 1-1, розчиняють в етилацетаті, до отриманого додають сполуку (4) (1,5 еквівалента) і толуол і перемішують при 70 °C протягом 8 годин, отримуючи сполуку (7). Приклад 4 Отримання гідрату кристалів солі п-толуолсульфонової кислоти (форма I) сполуки (IA) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline 6,7-unsaturated-7-carbamoyl morphinane derivative, and method for producing same
Автори англійськоюTamura, Yoshinori, Noguchi, Kouichi, Inagaki, Masanao, Morimoto, Kenji, Haga, Nobuhiro, Oda, Shinichi, Omura, Sohei
Автори російськоюТамура Йосинори, Ногути Коуити, Инагаки Масанао, Моримото Кендзи, Хага Нобухиро, Ода Синити, Омура Сохеи
МПК / Мітки
МПК: B01J 27/22, A61K 31/485, B01J 27/055, C07D 489/06, B01J 27/08, C07D 489/00, B01J 27/10, C07D 271/06
Мітки: кристали, отримання, похідних, 6,7-ненасиченого, 7-карбамоїлморфінану, спосіб
Код посилання
<a href="https://ua.patents.su/58-115028-kristali-pokhidnikh-67-nenasichenogo-7-karbamolmorfinanu-i-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Кристали похідних 6,7-ненасиченого 7-карбамоїлморфінану і спосіб їх отримання</a>
Попередній патент: Cxcr2-зв’язуючі поліпептиди
Наступний патент: Нові ад’ювантні композиції
Випадковий патент: Ортез для корекції деформацій опорно-рухового апарату