Застосування 1-[4-(1-адамантил)-фенокси]-3-(n-бензил,n-диметиламіно)-2-пропанолхлориду як інгібітору утворення патогенних біоплівок
Номер патенту: 113780
Опубліковано: 10.03.2017
Автори: Дудікова Дар'я Маратівна, Короткий Юрій Васильович, Вринчану Ніна Олексіївна, Смертенко Олена Аронівна, Суворова Зінаїда Сергіївна, Гриневич Світлана Вікторівна
Формула / Реферат
Застосування 1-[4-(1-адамантил)-фенокси]-3-(N-бензил,N-диметиламіно)-2-пропанолхлориду (1)
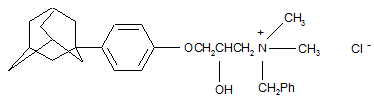 (1)
(1)
як інгібітору утворення патогенних біоплівок.
Текст
Реферат: Застосування 1-[4-(1-адамантил)-фенокси]-3-(N-бензил,N-диметиламіно)-2-пропанолхлориду як інгібітору утворення патогенних біоплівок, винахід належить до медицини, фармакології. Нами виявлено нові властивості 1-[4-(1-адамантил)-фенокси]-3-(N-бензил,N-диметиламіно)-2пропанолхлориду, які виражаються в пригніченні або порушенні плівкоутворення бактерій та грибів. Запропонована сполука інгібує плівкоутворення бактерій та грибів, має здатність до руйнування сформованих біоплівок, у т.ч. на поверхні засобів медичного призначення. Сполука може стати основою для розробки хіміотерапевтичного засобу широкого спектра дії, що може UA 113780 C2 (12) UA 113780 C2 застосовуватися для попередження утворення та/або інгібування росту мікроорганізмів у біоплівці, у т.ч. на поверхні, та/або руйнування сформованої біоплівки. + OCH2CHCH2 N OH CH3 CH2Ph CH3 Cl UA 113780 C2 Винахід належить до медицини, фармакології, зокрема, нами виявлено нові властивості 1[4-(1-адамантил)-фенокси]-3-(N-бензил, N-диметиламіно)-2-пропанолхлориду, формули: + OCH2CHCH2 N OH CH3 CH2Ph CH3 Cl , (1) 5 10 15 20 25 30 35 40 45 50 які виражаються в пригніченні або порушенні плівкоутворення бактерій та грибів. Винахід може стати основою для розробки антимікробних препаратів для профілактики гнійнозапальних процесів та для запобігання утворення біоплівки на засобах медичного призначення. Відомо, що сполука (1) проявляє протимікробну дію. Синтез, фізико-хімічні властивості та специфічна активність описані в патенті України № 89570 [1]. Біоплівка - це структурований комплекс мікроорганізмів, оточений позаклітинним полімерним матриксом та прикріплений до абіотичної або біотичної поверхні. В клінічній практиці біоплівки спричиняють близько 65-80 % усіх гнійно-запальних процесів, обумовлюють більшість хронічних інфекцій (верхніх дихальних шляхів, легень, серця, нирок, шкіри, кісток, системи травлення), контамінують практично усі штучні хірургічні імплантати, катетери тощо, що призводить до тяжких наслідків (генералізації, летальності), збільшення тривалості перебування хворих в стаціонарі та значних матеріальних витрат [2, 3]. Біоплівкові форми мікроорганізмів проявляють високу стійкість до антимікробних засобів. За таких умов стандартна антибіотикотерапія є неефективною, оскільки концентрація, необхідна для руйнування біоплівки, є токсичною для пацієнта. Незважаючи на активний пошук засобів та препаратів з антибіоплівковою активністю, в клінічній практиці досі найбільш ефективним вважається хірургічне видалення уражених тканин чи імплантату з наступною антибіотикотерапією. Тому існує необхідність в нових сполуках та композиціях для контролю розвитку біоплівок. Прототипом нами обрано патент на винахід № US 20120252820 ΑΙ, в якому представлено комбінацію 2-адамантанаміну (2) з препаратом азолового ряду (міконазолом), яка призводить до руйнування біоплівок, сформованих Candida albicans. Вона не проявляє достатньо широкого спектру дії, зокрема, не спричинює антибактеріального ефекту. Таким чином, сполука (2) не має сукупність ознак характерних для сполуки (1). В основу винаходу поставлено задачу пошуку сполук, які пригнічують або порушують плівкоутворення бактерій та грибів, серед похідних аміноадамантану. Рішення поставленої задачі досягається застосуванням сполуки 1-[4-(1-адамантил)фенокси]-3-(N-бензил, N-диметиламіно)-2-пропанолхлориду, яка має сукупність ознак: пригнічення утворення та руйнування біоплівок, сформованих бактеріями та/або грибами. Матеріали і обладнання: Тестована сполука: Субстанцію 1-[4-(1-адамантил)-фенокси]-3-(N-бензил, N-диметиламіно)-2-пропанолхлориду (1) розчиняли у 10,0 % ДМСО і використовували одразу після приготування. Тестована поверхня: У дослідженнях використовували наступні матеріали: - полістирол; - полівінілхлорид (наприклад, для виробництва катетерів). Тест-мікроорганізми: У дослідженнях застосовували штами Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus та Candida albicans, виділені від хворих з гнійно-запальними процесами. За добу до експериментального застосування бактерії пересівали на м'ясо-пептонний агар, гриби - на агар Сабуро, інкубували при 37 °C (бактерії) та 32 °C (гриби) впродовж 18-24 год. Мікроорганізми змивали 0,9 % розчином NaCl (фізіологічний розчин). Густину інокуляту визначали за оптичною щільністю на спектрофотометрі СФ-46 при довжині хвилі 590 нм 7 (бактерії) та 540 нм (гриби). Щільність робочого інокуляту становила 10 КУО/мл для бактерій та 6 10 грибних елементів на 1,0 мл поживного середовища. Приклад 1. Вплив сполуки (1) на процес формування біоплівки Дослідження впливу сполуки (1) на плівкоутворення здійснювали в концентраціях 1,0×ΜΙΚ; 2,5×ΜΙΚ та 5,0×ΜΙΚ. Значення мінімальної інгібуючої концентрації (МІК) наведені у табл. 1. 1 UA 113780 C2 Таблиця 1 Антибактеріальна дія сполуки (1) по відношенню до клінічних штамів бактерій та грибів (мкг/мл) Тест-штами мікроорганізмів Е. coli P. aeruginosa S. aureus С. albicans 5 10 15 20 МІК, мкг/мл 1,5 3,0 3,0 0,125 Здатність сполуки (1) впливати на процес формування біоплівки мікроорганізмами досліджували на 1-добових культурах, які культивували в лунках полістиролових мікротитрувальних планшет з наступним фарбуванням мікроорганізмів, які прикріпились до твердої фази (полістиролу) та сформували біоплівку. 7 Суспензії штамів мікроорганізмів в концентрації 10 КУО/мл вносили по 100 мкл в лунки, інкубували протягом 24 год. при 37 °C. Сполуку (1) в об'ємі 100 мкл вносили одночасно з мікроорганізмами. Як негативний контроль використовували полістиролові лунки, заповнені стерильним поживним середовищем. Після інкубування культуральну рідину видаляли, лунки промивали 3 рази фізіологічним розчином, вносили по 100 мкл барвника в кожну лунку і залишали на 45 хв при кімнатній температурі. Після цього лунки проминали 3 рази дистильованою водою і вносили по 100 мкл етилового спирту для екстрагування барвника. Позитивним контролем слугували лунки з інтактними мікроорганізмами, вирощені затих самих умов. Оцінка інтенсивності формування біоплівок проводилась на аналізаторі "Absorbance Microplate Reader EL×800" (BioTek, США) за оптичною щільністю спиртового екстракту барвника в кожній лунці при довжині хвилі поглинання 405 нм та хвилі порівняння 630 нм. Відсоток утвореної (сформованої) біоплівки, обчислювали як [(ODбп - ODc) / (ODp-ODпc)], де ODбп це оптична щільність розчинів, екстрагованих із біоплівок, оброблених сполукою (1), ODc - оптична щільність середовища з розчинами сполуки (1), ODp - оптична щільність позитивного контролю, ODпс - оптична щільність негативного контролю. Результати наведені в табл. 2. Таблиця 2 Вплив сполуки (1) на плівкоутворення бактерій та грибів Тест-штами мікроорганізмів Е. соlі P. aeruginosa S. aureus С. albiсarts Кількість МІК 1,0 2,5 5,0 1,0 2,5 5,0 1,0 2,5 5,0 1,0 2,5 5,0 Сформована біоплівка, % 55,0 47,2 44,4 100 75,5 36,2 95,4 52,8 12,4 65,3 25,8 7,7 25 Отримані результати свідчать, що досліджувана сполука (1) ефективно пригнічує плівкоутворення досліджуваних штамів мікроорганізмів. Приклад 2. Вплив сполуки (1) на сформовану біоплівку. 2 UA 113780 C2 5 10 15 20 Дослідження впливу сполуки (1) на сформовану біоплівку здійснювали в концентраціях 10,0×МІК, 25,0×МІК та 50,0×МІК. Здатність сполуки (1) порушувати сформовані біоплівки досліджували на 3-добових культурах мікроорганізмів, які культивували в лунках полістиролових мікротитрувальних планшет з наступним фарбуванням мікроорганізмів, які прикріпились до твердої фази (полістиролу) та сформували біоплівку. 7 Суспензії штамів мікроорганізмів в концентрації 10 КУО/мл вносили по 100 мкл в лунки, інкубували протягом 72 год. при 37 °C. До культурального середовища додавали сполуку (1) в об'ємі 100 мкл. Планшети інкубували 24 год. при 37 °C. Як негативний контроль використовували полістиролові лунки, заповнені стерильним поживним середовищем. Після інкубування культуральну рідину видаляли, лунки промивали 3 рази фізіологічним розчином, вносять по 100 мкл 0,1 % розчину генціанвіолета в кожну лунку і залишали на 45 хв. при кімнатній температурі. Після цього лунки промивали 3 рази дистильованою водою і вносили по 100 мкл етилового спирту для екстрагування барвника. Позитивним контролем слугували лунки з інтактними мікроорганізмами, вирощені за тих самих умов. Оцінка інтенсивності руйнування сформованих біоплівок проводилась на аналізаторі "Absorbance Microplate Reader EL×800" (BioTek, США) за оптичною щільністю спиртового екстракту барвника в кожній лунці при довжині хвилі поглинання 405 нм та хвилі порівняння 630 нм. Відсоток біоплівки, що залишилась, обчислювали як [(ODбп - ODc) / (ODp-ODп)], де ODбп це оптична щільність розчинів, екстрагованих із біоплівок, оброблених сполукою (1), ODc оптична щільність середовища з розчинами сполуки (1), ODp - оптична щільність позитивного контролю, ODпс - оптична щільність негативного контролю. Результати наведені в табл. 3. 25 Таблиця 3 Інгібуюча активність сполуки (1) на сформовані біоплівки мікроорганізмів Тест-штами мікроорганізмів Е. соlі P. aeruginosa S. aureus С. albicans 30 35 40 Кількість МІК Біоплівка, що залишилась, % 10,0 25,0 50,0 10,0 25,0 50,0 10,0 25,0 50,0 10,0 25,0 50,0 98,0 86,8 70,0 70,0 64,0 38,0 97,0 83,0 46,6 100 77,5 67,0 Згідно з отриманими даними, сполука (1) продемонструвала значне порушення сформованих біоплівок. Приклад 3. Вплив сполуки (1) на біоплівки, сформовані на урогенітальному катетері. Вплив сполуки (1) на біоплівки, сформовані на урогенітальному катетері досліджували в концентрації 5,0×МІК. Здатність сполуки (1) порушувати сформовані біоплівки досліджували на 3-добових культурах мікроорганізмів, які культивували в полівінілхлоридних урогенітальних катетерах (виробництва ТОВ "Допомога-1", Україна) з наступним фарбуванням мікроорганізмів, які прикріпились до твердої фази (полівінілхлориду) та сформували біоплівку. 7 Суспензії штамів мікроорганізмів в концентрації 10 КУО/мл вводили по 1,0 мл в просвіт катетера та інкубували впродовж 72 год. при 37 °C. Після закінчення терміну інкубації катетер промивали, заповнювали поживним середовищем зі сполукою в об'ємі 1,0 мл. Катетер закривали, інкубували в горизонтальному положенні 24 год. при 37 °C. Позитивним контролем слугували катетери з інтактними мікроорганізмами, вирощені за тих самих умов. Після закінчення терміну інкубації поверхню катетера обробляли 70 % етиловим спиртом. Рідину, яка знаходилась в катетері, переносили в пробірку з 2,0 мл поживного середовища. 3 UA 113780 C2 5 Катетер промивали 1,0 мл поживного середовища, промивну рідину поміщали в пробірку з 2,0 мл середовища. З центральної частини катетера стерильно вирізали сегмент ( 5 см), переносили в стерильну пробірку з 3,0 мл поживного середовища та механічно відділяли біоплівку від поверхні. З пробірок відбирали по 100 мкл рідини та переносили у полістироловий планшет. Оцінка формування біоплівок на моделі інфікованого катетера проводилась на аналізаторі "Absorbance Microplate Reader ELx800" (BioTek, США) за оптичною щільністю в кожній лунці при довжині хвилі поглинання 450 нм та хвилі порівняння 630 нм. Результати наведені в табл. 4. Таблиця 4 Інгібуюча активність сполуки (1) відносно біоплівок мікроорганізмів на поверхні урогенітального катетера Тест-штами мікроорганізмів S. aureus Контроль Кількість МІК Утворена біоплівка, % 5,0 0 60,0 100 10 15 20 25 Результати проведених експериментів показали (табл. 4), що сполука (1) інгібує ріст та розмноження асоційованих з абіотичною поверхнею клітин S. aureus на 40 %. Таким чином, сполука (1) проявляє широкий спектр активності та виразну дію для запобігання або порушення плівкоутворення та/або руйнування біоплівок мікроорганізмів. Виходячи з отриманих даних, 1-[4-(1-адамантил)-фенокси]-3-(N-бензил, N-диметиламіно)-2пропанолхлорид може застосовуватися для попередження утворення та/або інгібування росту мікроорганізмів у біоплівці, у т.ч. на поверхні, та/або руйнування сформованої біоплівки. Джерела інформації: 1. Пат. на винахід № 89570, Україна. 1-[4-(1-адамантил)-фенокси]-3-(N-бензил, Nдиметиламіно)-2-пропанол хлорид / Короткий Ю.В., Максимов Ю.М., Вринчану Н.О. та ін. № а200804978; заявл. 17.04.08; опубл. 10.02.10, Бюл. № 3. 2. Wolcott R.D. Biofilms and chronic infections / R.D. Wolcott, G.D. Ehrlich // JAMA. - 2008. V. 299. - № 22. - P. 2682-2684. 3. LewisK. Persister cells, dormancy and infectious disease / K. Lewis // Nat. Rev. Microbiol. 2007. - V. 5,№ 1.-P. 48-56. ФОРМУЛА ВИНАХОДУ Застосування 1-[4-(1-адамантил)-фенокси]-3-(N-бензил,N-диметиламіно)-2-пропанолхлориду (1) + OCH2CHCH2 N 30 OH CH3 CH3 CH2Ph Cl (1) як інгібітору утворення патогенних біоплівок. Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/14, C07C 211/63, C07C 215/20, C07C 13/615, C07C 217/44
Мітки: біоплівок, інгібітору, утворення, застосування, 1-[4-(1-адамантил)-фенокси]-3-(n-бензил,n-диметиламіно)-2-пропанолхлориду, патогенних
Код посилання
<a href="https://ua.patents.su/6-113780-zastosuvannya-1-4-1-adamantil-fenoksi-3-n-benziln-dimetilamino-2-propanolkhloridu-yak-ingibitoru-utvorennya-patogennikh-bioplivok.html" target="_blank" rel="follow" title="База патентів України">Застосування 1-[4-(1-адамантил)-фенокси]-3-(n-бензил,n-диметиламіно)-2-пропанолхлориду як інгібітору утворення патогенних біоплівок</a>
Попередній патент: Похідні арилетинілу
Наступний патент: Спосіб і пристрій вимірювання комплексного коефіцієнта відбиття
Випадковий патент: Спосіб управління процесом нейтралізації кислоти у виробництві аміачної селітри










