Спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини
Номер патенту: 119212
Опубліковано: 11.09.2017
Автори: Парницька Ольга Ігорівна, Будерацька Наталія Олексіївна, Капустін Едуард Вікторович, Гонтар Юлія Вікторівна, Ільїна Катерина Ігорівна, Лавриненко Сергій Вікторович, Ільїн Ігор Євгенович, Геревич Юрій Йосипович
Формула / Реферат
1. Спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини, який відрізняється тим, що за допомогою поляризаційної системи виявляють наявності мейотичного веретена поділу ооцитів, оцінку морфологічних варіантів мейотичного веретена поділу та його локалізацію відповідно до першого полярного тіла, за якими відбирають для вітрифікації найбільш життєздатні зрілі ооцити з веретеном поділу категорий А, В, С, F, G із зазначенням локалізації веретена поділу відповідно до першого полярного тіла, здійснюють вітрифікацію ооцитів, у яких після розморожування визначають локалізацію та морфологію мейотичного веретена поділу з наступною оцінкою впливу кріоконсервування на фертилізаційну спроможність ооцита людини при виявленні ооцитів з веретеном поділу (категорії Н) на границі другого полярного тіла і цитоплазми (телофаза II) та ооцитів категорії Е, в яких веретено поділу не візуалізується.
2. Спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини за п. 1, який відрізняється тим, що вітрифікацію ооцитів здійснюють шляхом проведення експозиції ооцитів в розчинах кріопротекторів, перенесенням ооцитів на носій, зануренням в рідкий азот та зберігання ооцитів в рідкому азоті до моменту їх розморожування.
Текст
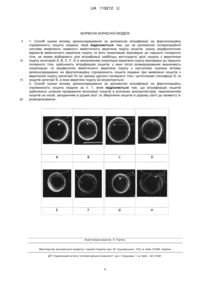
Реферат: Спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини, при якому за допомогою поляризаційної системи виявляють наявності мейотичного веретена поділу ооцитів, оцінку морфологічних варіантів мейотичного веретена поділу та його локалізацію відповідно до першого полярного тіла. Відбирають для вітрифікації найбільш життєздатні зрілі ооцити з веретеном поділу категорий А, В, С, F, G із зазначенням локалізації веретена поділу відповідно до першого полярного тіла. Здійснюють вітрифікацію ооцитів, у яких після розморожування визначають локалізацію та морфологію UA 119212 U мейотичного веретена поділу з наступною оцінкою впливу кріоконсервування на фертилізаційну спроможність ооцита людини. При виявленні ооцитів з веретеном поділу (категорії Н) на границі другого полярного тіла і цитоплазми (телофаза II) та ооцитів категорії Е, в яких веретено поділу не візуалізується. UA 119212 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі медицини, а саме до репродуктивної медицини, і може бути використана для відбору ооцитів та їх збереження в допоміжних репродуктивних технологіях, також може бути використана в галузі біології, зокрема в репродуктивній біології. Вітрифікація ооцитів - найбільш ефективна технологія збереження жіночих гамет, яка дозволяє уникнути багатьох юридичних, етичних та медичних проблем, на відміну від кріоконсервування ембріонів [1]. Успішна вітрифікація жіночих гамет відкриває нові перспективи у циклах лікування безпліддя методами допоміжних репродуктивних технологій (ДРТ) [2, 3, 4]. Облік тільки морфологічних параметрів ооцита є недостатнім, щоб спрогнозувати якість та імплантаційний потенціал ембріона. Наявність першого полярного тіла не завжди є критерієм зрілості яйцеклітини. За допомогою поляризаційного мікроскопу, візуалізуючи наявність веретена другого поділу мейозу, можна стверджувати, що ооцит знаходиться на стадїї метафази II [5, 6]. Класифікація морфологічних форм мейотичного веретена та його розташування відносно першого полярного тіла по категоріях вперше була розроблена і представлена в роботі [7]. В науковій літературі відсутні відомості щодо використання морфологічних характеристик та локалізації веретена поділу як предиктора кріорезистентності ооцитів та якості отриманих з них ембріонів. Адже порушення мейотичного веретена метафази II можуть привести до аномальної сегрегації хромосом після запліднення розморожених ооцитів, а це, в свою чергу, до анеуплоїдії ембріонів. В основу корисної моделі поставлена задача розробки способу оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини шляхом визначення морфологічних характеристик та локалізації мейотичного веретена поділу, виявлення при цьому порушення мейотичного веретена метафази II у розморожених після кріоконсервовання методом вітрифікації ооцитів людини. Технічний результат полягає в тому, що виявлення порушень мейотичного веретена поділу метафази II та його оцінка дозволить виявляти аномальні сегрегації хромосом після запліднення розморожених ооцитів та запобігти несприятливих наслідків для якості ембріона, у тому числі й анеуплоїдію ембріонів. Поставлена задача вирішується тим, що спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини, включає виявлення за допомогою поляризаційної системи наявності мейотичного веретена поділу ооцитів, оцінку морфологічних варіантів мейотичного веретена поділу та його локалізацію відповідно до першого полярного тіла, за якими відбирають для вітрифікації найбільш життєздатні зрілі ооцити з веретеном поділу категорий А, В, С, F, G із зазначенням локалізації веретена поділу відповідно до першого полярного тіла, здійснюють вітрифікацію ооцитів, у яких після розморожування визначають локалізацію та морфологію мейотичного веретена поділу з наступною оцінкою впливу кріоконсервування на фертилізаційну спроможність ооцита людини при виявленні ооцитів з веретеном поділу (категорії Н) на границі другого полярного тіла і цитоплазми (телофаза II) та ооцитів категорії Е, в яких веретено поділу не візуалізується. Вітрифікацію ооцитів здійснюють шляхом проведення експозиції ооцитів в розчинах кріопротекторів, перенесенням ооцитів на носій, зануренням в рідкий азот та зберігання ооцитів в рідкому азоті до моменту їх розморожування. Оцінювання мейотичного веретена поділу до кріоконсервування з наступною оцінкою впливу кріоконсервування на фертилізаційну спроможність ооцита людини є важливим критерієм як відбору ооцитів, так і прогнозу їх якості у подальшому. Це відкриває нові можливості для жінок репродуктивного віку зі збереженням своїх статевих клітин та використання їх для запліднення у найоптимальніший період свого життя. Представлений спосіб з оцінювання морфології та локалізації веретена поділу жіночих гамет є допоміжним методом відбору при створенні банку донорських ооцитів. Застосування оцінки веретена поділу ооцита перед вітрифікацією має перспективи не тільки для використання у програмах донації ооцитів, але й у новому перспективному напрямку допоміжних репродуктивних технологій, а саме при виконанні донації цитоплазми ооцита без синхронізації циклів "донор - реципієнт". Корисна модель пояснюється кресленням, де зображені отримані за допомогою поляризаційної системи, DIC контраст; 400, на яких представлені морфологічні варіанти A, B, C, D, E, F, G, H мейотичного веретена поділу ооцитів, де 1- мейотичне веретено, 2 перше полярне тіло, 3 - друге полярне тіло: А - компактне, ромбоподібне веретено, з чіткими краями; В - змінена форма, розмиті краї; С - слабка візуалізація; 1 UA 119212 U 5 10 15 20 25 30 35 40 45 50 55 D - візуалізація на межі першого полярного тіла і цитоплазми (телофаза І); Е - не візуалізується; F - зміна орієнтації осі веретена відповідно до полярного тіла; G - збільшене в розмірі; Н - візуалізація на межі другого полярного тіла і цитоплазми (телофаза II). Корисну модель виконують наступним чином. Дослідження за корисною моделлю було виконано на 88 донорських ооцитах. Середній вік донорів жіночих гамет склав 27,7±3,35 р. Ооцити отримували під час пункції фолікулів в циклах ДРТ. Ооцити культивували в чашках зі скляним дном (FluoroDish, World Precision Instruments, Китай), що містили 15 мкл культурального середовища Global (LifeGlobal, США) з додаванням 10 % людського альбуміну (LifeGlobal, США), вкритого мінеральною олією (LifeGlobal, США). Для попередження деполімеризації веретена в чашку розміщували не більше 3-х ооцитів. Після денудації ооцити перевіряли на наявність мейотичного веретена, візуалізацію якого проводили за допомогою поляризаційної системи Oosight (Hamilton Thome, США) під мікроскопом Nikon Eclipse Ti-U (Японія) з мікроманіпуляторами Narishige в чашках зі скляним дном (FluoroDish, World Precision Instruments, Китай). Візуалізацію мейотичного веретена проводили на термостолику (TokaiHit, Японія) з підігрівом 37 °C. Температура в ембріологічній лабораторії була не нижчою за 28 °C. Оцінювали наявність мейотичного веретена, його морфологію та локалізацію веретена відповідно до першого полярного тіла. Для попередження помилок, під час візуалізації за допомогою піпеток Holding К-НРІР-1035 та Micro-Injection K-MPIP-1035 (COOK, США) ооцит виставляли в ракурс найоптимальнішої візуалізації морфології мейотичного веретена з чіткою візуалізацією полярного тіла. Кут розміщення веретена відносно першого полярного тіла виміряли за допомогою інструментів програми Oosight Meta (Hamilton Thorne, США). Відносно морфології та локалізації веретена оцінювали кількість ембріонів на стадії дроблення, бластоцисти категорії А і кількість еуплоїдних і анеуплоїдних ембріонів. Біопсію ембріонів для проведення преімплантаційного дослідження виконували на третю або п'яту добу після запліднення, зразки фіксували і діагностували із застосуванням способу флуоресцентної in situ гібридизації (FISH) на хромосоми 13, 16, 18, 21, 22, X, Y. Статистичний аналіз здійснювали за допомогою тесту на нормальність Шапіро-Уілка, кореляції Спірмена і критерію χ-квадрат. За результатами досліджень та оцінки веретена поділу відбирали для вітрифікації найбільш життєздатні зрілі ооцити 3 веретеном поділу категорий А, В, С, F, G із зазначенням локалізації веретена поділу відповідно до першого полярного тіла. Незрілі ооцити категорій D - веретено на границі першого полярного тіла і цитоплазми (телофаза І), і ооцити, в яких веретено не візуалізується - категорії Е (це може бути або інтерфаза між першим і другим мейозом, або веретено в ооциті уже пошкоджене і такий ооцит нежиттєздатний, не дивлячись нормальну морфологію самого ооцита) не вітрифікували. Вітрифікацію відібраних ооцитів виконували через 2-3 год. після трансвагінальної пункції фолікулів. Для вітрифікації використовували кріотоп спосіб [7,8]. Експозицію ооцитів проводили в 300 мкл розчину 7,5 % етіленгліколю (ЕГ) + 7,5 % диметилсульфоксиду (ДМСО) у ТСМ199 середовищі з додаванням 20 % синтетичного замінювача сироватки (SSS) при кімнатній температурі протягом 12-15 хв. Тривалість експозиції ооцита в розчинах кріопротекторів залежала від його властивості відновлювати початкову форму. Після еквілібрації ооцити занурювали в розчин для вітрифікації, який вміщував 15 % ЕГ + 15 % ДМСО + 0,5М сахарози. Через 60 сек. ооцити переносили на носій Criotec (Cryotech, Японія) з мінімальною кількістю рідини і занурювали в рідкий азот та зберігання ооцитів в рідкому азоті до моменту їх розморожування. При розморожуванні носій з ооцитами переносили в попередньо нагрітий до 37 °C, розчин 1,0 М сахарози в ТСМ199 середовищі + 20 % SSS. Через 1 хв. ооцити опускали на дно лунки з розчином 0,5 М сахарози в середовищі ТСМ199 з 20 % SSS при кімнатній температурі протягом 3 хв. Після цього ооцити переносили в розчин ТСМ 199 з 20 % SSS на 5 хв. при кімнатній температурі з наступним культивуванням у культуральному середовищі до запліднення. Всі жіночі гамети розміщали у кількості по одному під відповідними номерами у чашках Oosafe діаметром 60 мм (SparMed, Denmark). Через 2 год. після культивування оцінювали та аналізували локалізацію та морфологію мейотичного веретена. 2 Статистичні гіпотези перевіряли за допомогою критеріїв t, χ при рівнях значимості р
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 5/075, C12N 5/073, G01N 33/48
Мітки: спроможність, фертилізаційну, допомогою, кріоконсервування, впливу, спосіб, ооцита, оцінки, вітрифікації, людини
Код посилання
<a href="https://ua.patents.su/6-119212-sposib-ocinki-vplivu-kriokonservuvannya-za-dopomogoyu-vitrifikaci-na-fertilizacijjnu-spromozhnist-oocita-lyudini.html" target="_blank" rel="follow" title="База патентів України">Спосіб оцінки впливу кріоконсервування за допомогою вітрифікації на фертилізаційну спроможність ооцита людини</a>
Попередній патент: Комплекс технічних засобів для керуючих систем безпеки та нормальної експлуатації атомної електростанції
Наступний патент: Спосіб підвищення стресостійкості та продуктивності сільськогосподарських культур
Випадковий патент: Ножовий блок головки кутера