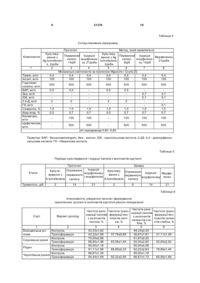
Спосіб генетичної трансформації для сортів картоплі вітчизняної селекції
Номер патенту: 21370
Опубліковано: 15.03.2007
Автори: Петюх Григорій Павлович, Карачинська Надія Василівна
Формула / Реферат
Спосіб генетичної трансформації для сортів картоплі вітчизняної селекції, що включає використання модифікованих поживних середовищ, які складаються з макро- та мікроелементів, вітамінів, фітогормонів - ауксину, цитотокініну і гібереліну, трансформацію клітин експлантів тканин картоплі з використанням кокультивування Agrobacterium tumefaciens з періодом культивування експлантів на етапі отримання первинного калюсу, який відрізняється тим, що вищезгаданий період культивування складає 8-10 діб і має другий і третій етапи, на яких поживне середовище доповнюють відповідно 0,1 мг/л індолілоцтової кислоти, 1 мг/л зеатину та 0,1 мг/л гіберелової кислоти.
Текст
Спосіб генетичної трансформації для сортів картоплі вітчизняної селекції, що включає використання модифікованих поживних середовищ, які складаються з макро- та мікроелементів, вітамінів, 3 21370 живному безгормональному середовищі для регенерації пагонів. Задачею корисної моделі, є розробка способу досягнення інтенсивної регенераційної здатності проростків експлантів тканин листків і сегментів стебел картоплі з використанням трансформації Agrobacterium tumefaciens в умовах in vitro. Технічний результат корисної моделі є отримання достатньої кількості трансгенних рослин сортів картоплі вітчизняної селекції для створення банків трансгенних рослин і проведення подальших наукових досліджень з ними. Суть корисної моделі, що заявляється полягає в наступному: У підготовлене рідке поживне середовище LB [2], при додаванні канаміцину і рефампіцину, переносять бактеріальну біомасу Agrobacterium tumefaciens pGV2260, відібрану з поверхні агару й культивують протягом доби в захищеному від світла місці на шейкері при температурі повітря 28°С. За допомогою бактеріальної петлі бактеріальну суспензію культури Ag. tumefaciens розсівають у вигляді штрихів на агаризоване поживне середовище АВ [2], збагаченого канаміцином і рефампіцином, і культивують у термостаті при температурі повітря-28°С. На третю добу культивування, з поверхні агару відбирають біомасу окремих бактеріальних колоній, після чого культивують на поживному середовищі LB, також збагаченого канаміцином і рефампіцином, протягом доби в захищеному від світла місці на шейкері при температурі повітря-28°С. Агробактеріальну культуру осаджують центрифугуванням, осад ресуспендують у рідкому поживному середовищі Мурашиге і Скуга (середовище не містить вуглеводів, вітамінів, регуляторів росту і амінокислот) [3] до отримання концентрації бактеріальної суспензії в 108кл/мл для інокуляції експлантів тканин картоплі. Далі проводять інокуляцію бактеріальною культурою Ag. tumefaciens експлантів тканин листків, сегментів стебла рослин картоплі, вирощених в умовах in vitro протягом 21 доби. Після інокуляції бактеріальною суспензією експланти звільняють від надлишку бактерій за допомогою стерильного фільтрувального паперу та переносять для кокультивації на агаризоване модифіковане середовище Мурашиге і Скуга [1], доповнене фітогормонами 2,4-дихлорфеноксиоцтовою кислотою (2,4-Д) і бензиламінопурином (БАП). Через 2 доби експланти тричі промивають стерильною водою і рідким середовищем Мурашиге і Скуга [3], яке збагачене цефотаксимом, з метою видалення з поверхні тканин експлантів картоплі бактерій Ag. tumefaciens. Для отримання первинного калюсу та рослин регенерантів, звільнені від Ag. tumefaciens екпланти переносять на модифіковане агаризоване середовище Мурашиге і Скуга [1], що містить фітогормони 2,4-Д, БАП і антибіотики - канаміцин, цефотаксим. Культивування на середовищі відбувається протягом 8 діб при 16-годинному світловому фотоперіоді, температурі повітря-22°С, відносній вологості повітря-80-85%, освітлені-4000лк. Через 8діб, після появи первинного калюсу, експланти переносять на поживне середовище, яке містить фітогормони зеатин (Зеа), індолілоц 4 тову кислоту (ІОК) та антибіотики - цефотаксим, канаміцин, далі знову культивують ще протягом 14 діб при 16-годинному світловому фотоперіоді, температурі повітря-22°С, відносній вологості повітря-80-85%, освітлені - 4000лк. В наступному пасажі експланти пасують на поживне середовище того ж складу, як попереднє, але з додаванням гіберелової кислоти (ГК). Проростки, які досягали розмірів 0,5-1,0см для укорінення переносять із чашок Петрі в пробірки з модифікованим безгормональним середовищем Мурашиге і Скуга [4], що містить 1% сахарози. Канаміцин-стійкі проростки укорінюють на безгормональному поживному середовищі Мурашиге і Скуга [4] з додаванням 100мг/л канаміцину. Приклад Рослинний матеріал. В процесі виконання досліджень використовували наступні занесені до Реєстру сортів рослин України сорти картоплі вітчизняної селекції (Solarium tuberosum L.): Бородянська рожева, Седнівська рання, Радич, Чернігівська рання. Билина, Загадка, Червона рута. Бактеріальна культура. Використовували штам pGV2260 Ag. tumefaciens, який містить вектор p35SGUSint [5]. 1. Отримання бактеріальної культури Agrobacterium tumefaciens GV2260 для інокуляції експлантів листків і міжвузль картоплі. Хід робіт: 1. У скляні посудини місткістю 250мл розливали по 5мл рідкого поживного середовища LB [2] (табл.2) доповненого канаміцином і рефампіцином у концентрації 100мг/л [5]. 2. Бактеріальну біомасу Ag. tumefaciens GV2260 відбирали з поверхні агару стерильною загостреною паличкою і переносили в 5мл рідкого середовища LB, потім у захищеному від світла місці культивували на шейкері (120об/хв.) при температурі повітря 28°С [6]. 3. У поживне агаризоване середовище АВ [2] (табл.3), після автоклавування (1ат., 20хв.) і охолодження до 40°С, додавали канаміцин і рефампіцин з розрахунку 100мг/л, потім розливали по 20мл у чашки ANUMBRA (100мм). 4. При використанні бактеріальної петлі розсівали бактеріальну суспензію у вигляді штрихів на агаризоване середовище АВ [2] і культивували 3 доби у термостаті при температурі повітря-28°С [6]. 5. Отриману біомасу окремих бактеріальних колоній Ag. tumefaciens GV2260 відбирали з поверхні агару стерильною загостреною паличкою і переносили в 5мл рідкого середовища LB, потім протягом доби культивувала в захи щеному від світла місці на шейкері (120об/хв) при температурі повітря-28°С [6]. 6. Бактеріальну культур у осаджували на центрифузі при 3000об/хв, осад ресуспендували в 10мл середовища Мурашиге і Скуга [3] (табл.1) (середовище не містить фітогормонів, вітамінів, амінокислот і вуглеводів) до отримання бактеріальної суспензії 108км/мл для інокуляції експлантів тканин картоплі [6]. 2. Інокуляція і кокультивація експлантів тканин картоплі з бактеріальною культурою Agrobacterium 5 21370 tumefaciens (у дослідженнях використовувалися експланти листків і міжвузль ізольованих із рослин картоплі та вирощених в умовах in vitro протягом 21доби). Хід робіт: 1. На ізольованих експлантах тканин картоплі робили скальпелем неглибокі надрізи. 2. Частину експлантів інокулювали протягом 15хв. суспензією нічної бактеріальної культури Ag. tumefaciens концентрацією 108кл/мл, яка була ресуспендованої в рідкому безгормональному поживному середовищі Мурашиге і Скуга [3]. Частину контрольних експлантів інкубували у безгормональному рідкому поживному середовищі Мураши ге і Скуга протягом 15хв. 3. Після інокуляції в бактеріальній суспензії експланти звільняли від надлишку бактерій за допомогою стерильного фільтрувального паперу і культивували спільно Ag. tumefaciens на агаризованому середовищі Мурашиге-Скуга [1] без антибіотиків. 4. Через 2доби експланти тричі промивали стерильною водою і тричі по 15хв ополіскували рідким середовищем Мурашиге і Скуга [3], що містить 500мг/л цефотаксиму [6]. 3. Отримання первинного калюсу та рослин регенерантів. Хід робіт: 1. Відмиті експланти переносили на модифіковане агаризоване середовище Мурашиге і Скуга [1] (табл.4), що містить 2мг/л 2,4-Д, 0,5мг/л БАП, 100мг/л канаміцину і 500мг/л цефотаксиму. Культивування на модифікованому середовищі проводили для отримання первинного калюсу протягом 8діб при 16-годинному світловому фотоперіоді, температурі повітря-22°С, відносній вологості повітря-80-85%, освітлені-4000лк. 2. На 8добу, після появи первинного калюсу, експланти переносили на поживне середовище, в склад якого входили Зеа-0,1мг/л, ІОК-10мг/л, цефотаксим-500мг/л, канаміцин-100мг/л. Період культивування – 14 діб при 16-годинному світловому фотоперіоді, температурі повітря-22°С, відносній вологості повітря-80-85%, освітлені 4000лк. 3. При наступному пасажі експланти пасували на поживне середовище того ж складу, як і попереднє, але з додаванням 0,1мг/л ГК (табл.5). 4. Проростки, які досягали розмірів 0,5-1,0см знімали з експлантів листків та міжвузль і перено 6 сили в скляні пробірки на модифіковане безгормональне середовище Мурашиге і Скуга (вміст цукрози в середовищі–1%) [4] для укорінення. Канаміцин-стійкі пагони укорінювали на безгормональному поживному середовищі Мурашиге-Скуга [4] з 100мг/л канаміцину. Встановлено, що регенераційна здатність експлантів залежить від генотипу, складу поживного середовища та умов культивування. Модифіковані умови культивування, середовища винаходу виявилися кращими за стандартні й забезпечили високу частоту регенерації і трансформації проростків з експлантів тканин картоплі сортів вітчизняної селекції (табл.6). При відтворенні досліду по прототипу, на вітчизняних сортах картоплі: Радич, Чернігівська рання, Червона рута, спостерігали некроз тканин і поодиноку регенерацію проростків експлантів тканин листків і сегментів стебла як на контролі - через 55-65 діб, так і у досліді після трансформації Ag. tumefaciens - на 45-50 добу. На превеликий жаль, за умов вирощування по прототипу високої частоти регенерації рослин-регенерантів не вдалося відтворити на сортах картоплі вітчизняної селекції. Розроблений нами спосіб дозволив досягти високої частоти регенерації і синхронності у проліферації рослин-регенерантів як на контролі, так і у досліді з трансформацією Ag. tumefaciens. Проліферація пагонів для сортів Радич, Чернігівська рання, Загадка, Червона рута після трансформації Ag. tumefaciens відбувалася набагато раніше, ніж на контролі. Після агробактеріальної трансформації з експлантів листків пагони регенерували на 2225 добу, з сегментів стебла - на 27-30 добу, а контролях, відповідно, - на 30-35 і 35-40 доби. У сортів Бородянська рожева, Билина, Седнівська рання проліферація пагонів із експлантів листків і сегментів стебла відбувалася майже одночасно як на контролі, так і у дослідах з трансформації Ag. tumefaciens розпочинаючи з 35-45 доби культивування. Отже, розроблений спосіб забезпечує високу частоту регенерації проростків із експлантів тканин листків і сегментів стебла сортів картоплі вітчизняної селекції; надає можливість отримувати трансгенні рослини картоплі через культур у in vitro з використанням агробактеріальних векторних систем. Таблиця 1 Склад поживного середовища Мурашиге і Скуга [3] Компоненти 1 Макроелементи Хімічна формула речовини 2 NH4NO3 KNO3 СаСl2 ´ 6Н2O MgSO4 ´ 7Н2O КН2РO4 Наважка, мг/л 3 1650 1900 656 370 170 7 21370 8 Продовження таблиці 1 1 Мікроелементи Вітаміни та амінокислоти Вуглеводи 2 MnSO4 ´ 5Н2O Н3ВO4 ZnSO4 ´ 7Н2O KJ Na2MoO4 ´ 2Н2O СоСl2 ´ 6Н2O CuSO4´ 5Н2O FeSO4 ´ 7Н2O Na2EДTA ´ 2Н2O Тіамін-НСl (В1) Пиридоксин-НСl (В6) Нікотинова кислота Міоінозит Гліцин Цукроза Агар-агар рН середовища 5,6-5,8 3 24,1 6,2 8,6 0,84 0,25 0,025 0,025 27,8 37,3 0,1 0,5 0,5 100 2,0 10000 7000 Таблиця 2 Середовища для росту бактеріальних культур LB (Лурія-Бертані) На 1л середовища: Речовина Триптон Дріжджовий екстракт Хлорид натрію Arap(Bacto), 1,5% Наважка, г/л 10 5 10 15 рН середовища 7,5 (NaOH) Таблиця 3 Середовища для росту бактерій і зберігання бактеріальних культур АВ Хімічна формула речовини K2HPO4 NaH2PO4 NH4Cl MgSO4 KCL СаСl2 FeSO4*7H2O Глюкоза, 0,5% Агар-агар, 1,5 рН середовища 7,5 (NaOH) Наважка, мг/л 150 50 50 7,3 7,5 7,5 0,125 5000 15000 9 21370 10 Таблиця 4 Склад поживних середовищ Прототип Метод, який заявляється КультивуКультивуПервинний Індукція Первинний Індукція Компоненти Морфогенез, вання з вання з Ag. калюс, морфогене- tumefaciens, калюс, морфогенеAg.tumefacien 21доба 14діб зу, 21доба 8діб зу, 14діб s, 2доби 2доби 1 2 3 4 5 6 7 8 Мінеральні компоненти за прописом Мурасіге і Скута [3] Тіамін, мг/л 0,4 0,4 0,4 0,4 0,4 0,4 0,4 Інозит, мг/л 100 100 100 100 100 100 100 Гідролізат 500 500 500 500 500 500 500 козеїна, мг/л БАП, мг/л 0,5 0,5 0,5 0,5 Зеа, мг/л 0,7 0,7 ІОК, мг/л 0,1 0,1 2,4-Д, мг/л 2 2 2 2 ГК, мг/л 0,1 Сахароза, % 1,0 1.0 1,0 1,0 1,0 1,0 1,0 Агар-агар, % 0,5 0,7 0,7 0,5 0,7 0,7 0,7 Канаміцин, 100 100 100 100 100 мг/л Цефотаксим, 500 500 500 500 500 мг/л рН середовища 5,60 -5,80 Примітки: БАП - бензиламінопурин; Зеа - зеатин; ІОК - індолілоцтова кислота; 2,4Д -2,4 - дихлорфеноксиоцтова кислота; ГК - гіберелова кислота Таблиця 5 Періоди культивування і індукції пагонів з експлантів картоплі Етапи Прототип Заявка Індукція Отримання КультиКультиву- Отримання Індукція Морфовування з первинного морфогенезу вання з первинного і морфогенез морфогенезу генез A.tumefaciens A.tumefaciens калюсу калюсу Тривалість, діб 2 14 21 2 8 14 21 Таблиця 6 Інтенсивність утворення пагонів і формування трансгенних рослин із експлантів картоплі різного походження Сорт 1 Бородянська рожева Варіант досліду 2 Контроль Трансформація Контроль Седнівська рання Трансформація Контроль Радич Трансформація Контроль Чернігівська рання Трансформація Частота регеЧастота реге- Частота транснерації пагонів нерації пагонів формації ексз експлантів з експлантів плантів листсегментів стелистків, % ків, % бла, % 3 4 5 53,33±1,92 48,33±2,25 42,22±1,99 37,78±0,99 36,67±1,б1 75,00±2,96 51,67±2,25 б8,90±1,98 65,56±1,45 50,00±2,92 95,00±1,18 90,00±4,08 91,11±1,98 88,89±2,33 82,22±2,63 96,67±1,36 95,00±1,18 94,44±1,89 92,22±2,56 86,67±1,72 Частота трансформації експлантів сегментів стебла, % 6 21,11±1,49 50,00±2,92 78,89±1,45 85,56±1,89 11 21370 12 Продовження таблиці 6 1 Билини Загадка Червона рута 2 Контроль Трансформація Контроль Трансформація Контроль Трансформація 3 81,67±2,26 78,89±2,24 90,00±3,04 87,78±1,44 93,33±1,92 90,00±2,01 4 78,89±2,24 87,78±1,44 90,00±2,01 5 76,67±3,04 73,33±1,22 90,00±3,04 76,67±2,02 95,00±1,18 88,89±2,33 6 73,33±1,22 76,67±2,02 88,89±2,33 Примітка. Середнє арифметичне ± стандартна помилка із 4-х дослідів з n=15 в кожному. 1-частота регенерації підраховувалася через 28діб після інокуляції Agrobacterium tumefasiens як співвідношення експлантів, що утворили бруньки або пагони до загальної кількості експлантів. 2-частота трансформації підраховувалася як співвідношення експлантів із трансгенними рослинами до загальної кількості експлантів. Список джерел: 1. Аветисов В.А., С тефанович А.М., Давыдова Ю.В., Мелик-Саркисов. Использование shooty мутанта Agrobacterium tumefaciens для повышения регенерационной активности эксплантов картофеля в культуре in vitro //Биотехн. теор. и научн.практ. журнал. 1991.- №6. -С.19-21. 2. Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир,1984. - 479с. 3. Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures //Phtsiol. Plant. - 1962.-Vol. 15. - P.473-497. 4. Маруненко И.М., Кучко А.А., Олейник Т.Н. Получение исходного селекционного материала Комп’ютерна в ерстка С.Литв иненко картофеля с помощью методов клеточной селекции (методические рекомендации)/Украинский НИИ картофельного хозяйства. К., 1991. -28с. 5. Vancanneyt G., Schmidt R., O'ConnorSanchez A., Willmitzer L., Rocha-Sosa M. Construction of an intron-containing marker gene: Splicing of the intron in transgenic plants and its use in monitoring early events in Agrobacterium mediated plant transformation. //Мої. Gen. Genet. -1990. -220. P.245-250. 6. Дрейпер Дж., Скот P., Армитидж Ф., Уолден Р. Генная инженерия растений. - М.: Мир, 1991. 270с. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of genetic transformation for potato varieties of domestic breeding
Назва патенту російськоюСпособ генетической трансформации для сортов картофеля отечественной селекции
МПК / Мітки
МПК: A01H 1/04
Мітки: трансформації, картоплі, сортів, генетично, селекції, вітчизняної, спосіб
Код посилання
<a href="https://ua.patents.su/6-21370-sposib-genetichno-transformaci-dlya-sortiv-kartopli-vitchiznyano-selekci.html" target="_blank" rel="follow" title="База патентів України">Спосіб генетичної трансформації для сортів картоплі вітчизняної селекції</a>
Попередній патент: Композиція хлібопекарського виробу на хмелю
Наступний патент: Спосіб магнітної дії на біологічний об’єкт
Випадковий патент: Пористий продукт, придатний до подрібнювання у крихту