Спосіб одержання асиметрично заміщених триазинів
Формула / Реферат
1. Способ получения асимметрично замещенных триазинов общей формулы (I)
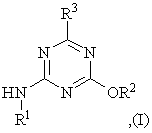
где R1 - водород, метил или этил;
R2 и R3 независимо друг от друга С1-С8-алкил, С3-С8-алкенил, С3-С8-алкинил, С3-С8-циклоалкил, фенил, бензил или фенетил, каждый из которых может иметь заместители, такие как фтор, хлор, фенил, С1-С4-алкил, С1-С4-галоидалкил или С1-С4-алкоксил,
путем взаимодействия производного гуанидина с производным карбоновой кислоты,
отличающийся тем, что в качестве производного гуанидина используют циангуанидин
общей формулы (II)
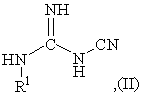
где R1 имеет заданные значения,
а в качестве производного карбоновой кислоты используют эфир карбоновой кислоты общей формулы (IV):
R3-CООR4 ,(IV)
где R3 имеет указанные значения;
R4 может принимать любые значения, указанные для R2,
и взаимодействие осуществляют в присутствии спирта общей формулы (III) R2-OH,
где R2 - имеет указанные значения, и основания или амида карбоновой кислоты,
выбранного из группы, включающей N,N-ди(С1-С4алкил)формамид,
N,N-ди(С1-С4алкил)ацетамид или N-метилпирролидон, и в присутствии соли либо солевидного соединения магния, кальция, алюминия, цинка, меди, железа, кобальта, никеля или хрома.
2. Способ по п. 1, отличающийся тем, что в качестве основания применяют алкоголят или третичный амин.
3. Способ по п. 1, отличающийся тем, что в качестве основания применяют алкоголят щелочного или щелочноземельного металла спирта общей формулы (III).
4. Способ по п. 1, отличающийся тем, что в качестве солей и солевидных соединений применяют галогениды, нитраты, сульфаты, алкоголяты или ацетаты элементов, указанных в п.1.
5. Способ по п. 1, отличающийся тем, что соли, соответственно солевидные соединения по п. 1, применяют в молярном количестве 0,001 - 2 на 1 моль циангуанидина формулы (II).
6. Способ по п. 1, отличающийся тем, что соли или солевидные соединения тяжелых металлов по п. 1 применяют в количествах меньше стехиометрических по отношению к циангуанидину формулы (II).
7. Способ по п. 1, отличающийся тем, что применяют соли или солевидные соединения щелочноземельных металлов кальция или магния.
8. Способ по п. 7, отличающийся тем, что соли кальция или магния используют в молярном количестве 0,01-2 на 1 моль циангуанидина формулы (II).
9. Способ по п. 1, отличающийся тем, что в качестве эфира карбоновой кислоты применяют C1-С6-алкиловый эфир перфторированной либо перхлорированной С1-С3-карбоновой кислоты.
10. Способ по п. 1, отличающийся тем, что в качестве эфира карбоновой кислоты используют метиловый эфир трифторуксусной кислоты, в качестве спирта формулы (III) -метанол и в качестве основания - метанолят щелочного металла.
11. Способ по п. 1, отличающийся тем, что метиловый эфир трифторуксусной кислоты подвергают взаимодействию с циангуанидином формулы (II) в присутствии метанолята щелочного металла и соли кальция.
12. Способ по п. 1, отличающийся тем, что метиловый эфир трифторуксусной кислоты подвергают взаимодействию с циангуанидином общей формулы (II) в присутствии N,N-диметилформамида и солей меди.
13. Способ по п. 1, отличающийся тем, что метиловый эфир трифторуксусной кислоты подвергают взаимодействию с циангуанидином формулы (II) в присутствии метанолята щелочного металла и соли цинка.
Текст
1 Способ получения асимметрично замещенных триазинов общей формулы (I) R3 N HN N' где R1 - водород, метил или этил, R2 и R3 независимо друг от друга Ci-Cs-алкил, СзCs-алкенил, Сз-Св-алкинил, Сз-Св-циклоалкил, фенил, бензил или фенетил, каждый из которых может иметь заместители, такие как фтор, хлор, фенил, Сі-С4-алкил, Сі-С4-галоидалкил или С1-С4алкоксил, путем взаимодействия производного гуанидина с производным карбоновой кислоты, отличающийся тем, что в качестве производного гуанидина используют циангуанидин общей формулы (II) NH HN N I1 H R ,(П) где R1 имеет заданные значения, а в качестве производного карбоновой кислоты используют эфир карбоновой кислоты общей формулы (IV) R3-COOR4,(IV) где R3 имеет указанные значения, R4 может принимать любые значения, указанные для R2, и взаимодействие осуществляют в присутствии спирта общей формулы (III) R2-OH, где R - имеет указанные значения, и основания или амида карбоновой кислоты, выбранного из группы, включающей N,N-flH(CiС4алкил)формамид, г\І,г\І-ди(Сі-С4алкил)ац;етамид или Nметилпирролидон, и в присутствии соли либо солевидного соединения магния, кальция, алюминия, цинка, меди, железа, кобальта, никеля или хрома 2 Способ по п 1, отличающийся тем, что в качестве основания применяют алкоголят или третичный амин 3 Способ по п 1, отличающийся тем, что в качестве основания применяют алкоголят щелочного или щелочноземельного металла спирта общей формулы (III) 4 Способ по п 1, отличающийся тем, что в качестве солей и солевидных соединений применяют галогениды, нитраты, сульфаты, алкоголяты или ацетаты элементов, указанных в п 1 5 Способ по п 1, отличающийся тем, что соли, соответственно солевидные соединения по п 1, применяют в молярном количестве 0,001 - 2 на 1 моль циангуанидина формулы (II) 6 Способ по п 1, отличающийся тем, что соли или солевидные соединения тяжелых металлов по п 1 применяют в количествах меньше стехиометрических по отношению к циангуанидину формулы (II) 7 Способ по п 1, отличающийся тем, что применяют соли или солевидные соединения щелочноземельных металлов кальция или магния 8 Способ по п 7, отличающийся тем, что соли кальция или магния используют в молярном количестве 0,01-2 на 1 моль циангуанидина формулы (II) 9 Способ по п 1, отличающийся тем, что в качестве эфира карбоновой кислоты применяют С-і-Сєалкиловый эфир перфторированной либо перхлорированной СгСз-карбоновой кислоты 10 Способ по п 1, отличающийся тем, что в качестве эфира карбоновой кислоты используют метиловый эфир трифторуксусной кислоты, в качестве спирта формулы (III) -метанол и в качестве основания - метанолят щелочного металла 11 Способ по п 1, отличающийся тем, что метиловый эфир трифторуксусной кислоты подвергают взаимодействию с циангуанидином формулы (II) в q (О 46719 присутствии метанолята щелочного металла и солеи меди соли кальция 13 Способ по п 1, отличающийся тем, что мети12 Способ по п 1, отличающийся тем, что метиловый эфир трифторуксусной кислоты подвергают ловый эфир трифторуксусной кислоты подвергают взаимодействию с циангуанидином формулы (II) в взаимодействию с циангуанидином общей форприсутствии метанолята щелочного металла и мулы (II) в присутствии N.N-диметилформамида и соли цинка Настоящее изобретение относится к способу получения асимметрично замещенных триазинов общей формулы (1) R3 H N 1/2 1 ANA0R2 где R1 - водород, метил или этил, R и R3 независимо друг от друга C-i-Cs -алкил, Сз-Cs -алкенил, Сз-Cs -алкинил, Сз-Св-циклоалкил, фенил, бензил или фенетил, каждый из которых может иметь заместители, такие как фтор, хлор, фенил, С1-С4 -алкил, С1-С4 -галоидалкил или С1-С4 -алкоксил Асимметрично замещенные триазины могут быть получены по самой различной методике, например, исходя из N-цианамидов, взаимодействием с комплексами Вильсмайера (см R L N Harries, Aust J Chem 34 (1981) 623), исходя из эфиров N-цианимидокислот (см заявку Германии DE-A 3411202, М А Рйгег, J L Soto, Heterocycles, 20 (1983) 463, К R Huffman, F С Schaefer, Journ Org Chem 28 (1963) 1816) или исходя их бигуанидинов (см S L Shapiro et al , Journ Org Chem 25 (1960) 379, патент США US-A 2535968) Из публикаций известно далее взаимодействие гуанилтиомочевины с диметилсульфатом и производными карбоновых кислот (см , например, Н Eilmgsfeld, Н Scheuermann, Chem Ber 100 (1967) 1874, заявку Германии DE-A 1670147, европейскую патентную заявку ЕР-А 545149), а также взаимодействие трихлорацетамидиногуанидинов с производными трифторуксусной кислоты (см заявку Германии DE-A 4034078) С помощью всех этих методов невозможно получать внутрикомплексные соединения (хелаты) в качестве промежуточных продуктов Другая возможность получения 6трифторметил-1,3,5-триазинов согласно способу, известному из публикации Jakugaku Zasshi 95, 499-511 (1975), состоит в том, что Nцианогуанидины переводят в медные комплексы N-амидино-О-алкилизомочевин, производные мочевины высвобождают с помощью сероводорода и затем подвергают взаимодействию с эфиром трифторуксусной кислоты согласи следующей схеме с с с NH; т ш + 1/2 н—О с N 1/2 Cue:г да. CMS R—о М СП К Из патента ГДР DD-A-252374 известен вариант этого способа, в котором вместо хлорида меди (II) применяют ацетат меди Для осуществления указанных способов требуются стехиометрические количества медных солей, при отсутствии медных солей вместо ISIами дино-О-ал кил изомочевины образуется преимущественно гуанилмочевина (см Kyushu Kogyo Daigaku Kenkyu Hokoku № 12, 69 - 78 (1962)) Взаимодействием гидрохлорида N-амидиноО-алкилизомочевины с этилхлорацетатом в смеси этанол / ІМаОСгНб можно получать соответствующий хлорметилтриазин только с очень низким выходом При этом исходный продукт необходимо предварительно выделить из медного комплекса Получение хелатных комплексов исходя из циангуанидина с помощью ацетата меди или хлорида цинка в метаноле описано у R I Dutta и А Syamal в Coord Chem Rev , том 2, 1967/ - С 441 457 Из публикации в Chemistry of Heterocychc Compounds, том 25, 1989 - С 547 - 550, известен способ выделения таких цинковых комплексов, после чего их подвергают взаимодействию с ангидридом трифторуксусной кислоты, получая в результате триазин Аналогичным путем сульфат цинка образует хелатный комплекс, который после обработки кипячением в воде разлагают на второй стадии до сульфата амидино-О-метилизомочевины (см патент США US - А 3360534, патент Индии IN - А 167500) и затем на третьей стадии его можно подвергать взаимодействию с ангидридом уксусной кислоты (см S Lotz, G Kiel, G Gattow, Zeitschnft anorg allgem Chemie 604 (1991), 53 - 62) или с метиловым эфиром трифторуксусной кислоты (см Т Tsujikawa, Jakugaku Zasshi 95, см выше), получая триазин с выходом 31%, соответственно 26% Указанные последними способы представляют собой очень дорогостоящие многостадийные способы, которые при использовании эфиров позволяют получать соответствующие триазины только с очень низким выходом, а при использовании ангидридов требуют приготовления стехиометрических количеств карбоновой кислоты, рециклизация которых в соответствующие ангидриды возможна лишь при очень высоких затратах При этом существует, как правило, необходимость выделять небезопасные в токсикологическом отношении, к тому же трудно фильтруемые комплексы тяжелых металлов, ко 46719 ные для R , и взаимодействие осуществляют в торые затем подвергаются взаимодействию в 2 присутствии спирта общей формулы 3 R -OH, где инертном растворителе с ангидридами, поскольку 2 R - имеет указанные значения, и основания или такое взаимодействие в спиртовом растворе в амида карбоновой кислоты, выбранного из группы, силу того, что ангидриды вступают в реакцию со включающей N, І\І-ди(Сі-С4-алкил)формамид, N, спиртами, исключается Кроме вышеназванных, г\І-ди(Сі-С4алкил) ацетамид или Nописанные способы имеют еще один существенный недостаток, а именно при их осуществлении метилпирролидон, и в присутствии соли либо сообязательно образуются большие количества солевидного соединения магния, кальция, алюмилей тяжелых металлов в виде органических шлания, цинка, меди, железа, кобальта, никеля или мов, удаление которых сопряжено с немалыми хрома трудностями Служащий в качестве исходного вещества заВ патенте США US-A 4886881 представлен мещенный циангуанидин общеизвестен N-метил-, одностадийный синтез 2-аминотриазинов, которые соответственно N-этил- замещенные производные получают исходя из циангуанидина и триметилормогут быть получены из циангуанидина и диалтоацетата в присутствии кислотного катализатора килсульфата, как это описано А Е Кретовым и А (кислота Льюиса), такого, как хлорид цинка В каС Беспаловым в Журнале прикладной химии, том честве растворителей рекомендуется использо34, (1961), стр 621 и далее Гуанидин может привать диметил-формамид и ацетонитрил меняться также в виде кислотно-аддитивной соли, причем в этом случае высвобождающуюся во В европейской патентной заявке ЕР 0482477 А время реакции кислоту целесообразно нейтралиописан способ получения асимметрично замезовать добавками соответствующего основания, щенных триазинов взаимодействием производнотакого, как метанолят натрия го гуанидина, например, N-замещенного производного N-трифторацетамидогуанилина с С учетом применения получаемых промежусоответствующим производным трифторуксусной точных продуктов 1 R2 может представлять собой, кислоты например, Сі-С4алкил, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил либо трет-бутил, Исходя из вышеизложенного, в основу изоСз-С4алкенил, как проп-2-ен-1-ил, 1-метилпроп-2бретения была положена задача найти способ, ен-1 -ил, бут-2-ен-1 -ил либо бут-З-ен-1 -ил, Сзкоторый обеспечивал бы получение триазинов со С4алкинил, как проп-2-ин-1-ил либо бут-2-ин-1-ил, структурой 1 взаимодействием циангуанидинов с Сз-СбЦиклоалкил, как циклопропил, циклобутил, эфирами карбоновых кислот, более доступных и в циклопентил либо циклогексил, особенно предто же время обладающих меньшей реакционной почтителен из них Сі-С4алкил, как метил способностью по сравнению с соответствующими ангидридами или ортоэфирами Этот способ долРадикал R2 может нести, кроме того, также жен был осуществляться по возможности без выдругие, инертные в соответствующих условиях деления продуктов, получаемых на промежуточреакции заместители, как, например, фтор либо ных стадиях, (так называемый способ получения в хлор, фенил, Сі-С4алкил, Сі-С4галогеналкил или одном аппарате) Поставленная задача решается Сі-С4алкокси способом получения асимметрично замещенных С учетом целевого применения триазинов триазинов общей формулы 1 формулы 1 R3 может представлять собой пред3 R почтительно СгС4галогеналкил, прежде всего фтор- либо хлорметил или фтор- либо хлорэтил, как ССІз, CF3, CF2CF3, CF2CI, CFCb, СН2С1, CHCI2, CH2F и CHF2 Особенно предпочтительны пергаHN логенированные алкильные радикалы ССІз, CF3 и 1 C2F5 где R - водород, метил или этил, Согласно изобретению взаимодействие цианR и R3 независимо друг от друга C-i-Cs -алкил, гуанидина формулы 2 со спиртом формулы 3 (соСз-Cs -алкенил, Сз-Cs -алкинил, Сз-Св-циклоалкил, ответственно R4OH, образованный путем гидрофенил, бензил или фенетил, каждый из которых лиза сложного эфира IV) проводят в присутствии может иметь заместители, такие как фтор, хлор, основания Неожиданным образом реакционную фенил, С1-С4 -алкил, С1-С4 -галоидалкил или С1-С4 активность металлохелатных комплексов удается -алкоксил повысить за счет возможности осуществления Путем взаимодействия производного гуанидиреакции со сложными эфирами формулы 4, хотя на с производным карбоновой кислоты, согласно эти эфиры обладают значительно меньшей реакизобретению в качестве производного гуанидина ционной активностью по сравнению с соответстиспользуют циангуанидин общей формулы 2 вующими ангидридами карбоновой кислоты или ортоэфирами (2) Для использования в качестве оснований пригодны как неорганические, так и органические основания В качестве неорганических оснований где R1 имеет заданные значения, а в качестве предпочтение отдают гидроксидам щелочных и производного карбоновой кислоты используют щелочноземельных металлов, а в качестве оргаэфир карбоновой кислоты общей формулы 4 нических оснований предпочтительно используют 3 4 R -COOR , третичные амины, такие, как СгС4триалкиламин, где R3 имеет указанные значения, например, триэтиламин, пиридин или NR4 может принимать любые значения, указанметилморфолин Целесообразно применять в каN І! U K 8 46719 честве основания алкоголят щелочного либо ще2,0, прежде всего от 0,005 до 1,0 на моль циангуалочноземельного металла трансформируемого нидина II 2 спирта R OH Этот алкоголят может образовыПри использовании тяжелых металлов их коваться in situ, например, из соответствующего щеличество должно быть минимальным и применять лочного металла или амида натрия либо гидрида следует лишь каталитические количества, напринатрия и спирта формулы 3 мер, менее 0,6 моля на моль циангуанидина При использовании солей магния и кальция особенно Количество основания составляет обычно предпочтительно такое количество составляет 0,1 - 2, прежде всего 0,8 - 1,2 мол эквивалента по 0,01 - 1,0, прежде всего 0,05 - 0,5 моля Естестотношению к циангуанидину формулы 2 Большие венно, возможны также количества, превышаюколичества также возможны, однако это, как пращие стехи о метр и чес кие по отношению к циангуавило, не дает каких-либо дополнительных пренидину формулы 2, например, 1 - 2 моля на моль имуществ циангуанидина II, однако соображения экономичВместо основания либо дополнительно может ности говорят в пользу применения количеств, применяться также амид карбоновой кислоты из меньше стехи о метрических группы, включающей N,N-flH(CiС4алкил)формамид, г\І,І\І-ди(Сі-С4алкил)ацетамид Исходное вещество формулы 3 либо может или N-метилпирролидон В качестве примеров быть образовано in situ из эфира карбоновой киможно назвать диметилформамид, диэтилформаслоты формулы 4 (R2 идентичен R4), либо его домид, диметилацетамид и диэтилацетамид Добавбавляют в реакционную смесь (предпочтительно в ки амидов карбоновой кислоты хорошо зарекокачестве растворителя) При одновременном исмендовали себя прежде всего при использовании пользовании эдукта III в качестве растворителя тяжелых металлов, в частности меди, в качестве рекомендуется выбирать соответственно спиртообразователей хелатных комплексов вой компонент в сложном эфире формулы 4 (т е R2 идентичен R4), чтобы избежать образования Количество амида карбоновой кислоты сопобочных продуктов ставляет, как правило, 1 - 30, прежде всего 5 - 1 0 мол эквивалентов по отношению к циангуанидину Молярное соотношение между циангуанидиформулы 2 Может оказаться также целесообразном формулы 2 и спиртом формулы 3 составляет, ным использовать амид карбоновой кислоты в как правило, 1 - 30, прежде всего 5-10 качестве растворителя Эфир карбоновой кислоты формулы 4 целесообразно применять в количестве от 0,5 до 10, В качестве солей или солевидных соединений прежде всего от 1 до 5 молей на моль циангуанищелочноземельных металлов, алюминия, соотдина 2 В качестве сложных эфиров формулы 4 ветственно тяжелых металлов могут рассматрисреди особенно предпочтительных следует наваться хорошо растворимые в реакционной среде звать следующие соединения эфиры СгС4алканпродукты, такие, как галогениды, например, фтолибо галогеналканкарбоновой кислоты, например, риды, хлориды или бромиды, нитраты, сульфаты СгСбалкиловые эфиры перфторированной либо или при необходимости фосфаты, алкоголяты или перфорированной СгС3карбоновой кислоты ацетаты Как показывает накопленный опыт, тип Примерами указанных эфиров являются метилосоединения щелочноземельных металлов, соотвый эфир уксусной кислоты, этиловый эфир укветственно других металлов, независимо от того, сусной кислоты, метиловый эфир пропионовой обладает ли оно хорошей растворимостью или кислоты, этиловый эфир пропионовой кислоты, нет, существенной роли не играет, так как реметиловый эфир трифторуксусной кислоты, метишающим фактором при его выборе являются маловый эфир дифторуксусной кислоты, метиловый териальные затраты В качестве примеров можно эфир фторуксусной кислоты, метиловый эфир привести следующие соединения МдСЬ, трихлоруксусной кислоты, метиловый эфир диМд(ОСН3)2, CaCI2, Zn(NO3)2, Cu(CH3COO)2, AICI3l хлоруксусной кислоты, метиловый эфир хлорукАІВгз, ZnCI2, ZnBr2, CuCI2, NiBr2, CrCI3, CaO, сусной кислоты, этиловый эфир трифторуксусной Ca(NO3)2, Mg(NO3)2, MgO, ZnO, FeCI2, FeCI3, кислоты, метиловый и этиловый эфир пентафторFe(NO3)2, Fe(NO3)3 Особенно предпочтительны из пропионовой кислоты, метиловый и этиловый них хлориды, прежде всего CaCI2 и ZnCI2 эфир пентахлорпропионовой кислоты С учетом Одно из преимуществ предлагаемого согласцелевого применения триазинов формулы 1 в кано изобретению способа состоит в том, что при честве промежуточных продуктов для средств его осуществлении в значительной степени или защиты растений наиболее предпочтительными даже полностью можно отказаться от присутствия исходными веществами формулы 4 являются метяжелых металлов и по соображениям экологии и тиловый эфир трифторуксусной кислоты и этилотоксикологии обойтись более безопасными в этом вый эфир трифторуксусной кислоты отношении элементами, такими, как магний и особенно кальций Исходя из этого, особенно предВзаимодействие соединений формулы 2 с сопочтительными являются растворимые соли этих единениями формул 3 и 4 может осуществляться элементов Очень хорошие результаты получают между самими этими веществами, т е без добатакже при использовании цинковых соединений вок инертных растворителей При этом спирт R2OH предпочтительно применяют одновременно Соли, соответственно солевидные соединев качестве растворителя Согласно одному из ния вышеназванных элементов могут применяться наиболее предпочтительных вариантов выполнев стехи о метрических количествах или предпочтиния в качестве основания в этих случаях выбирательно в меньших, чем стехиометричесюяе, колиют соответствующий алкоголят чествах по отношению к циангуанидину формулы 2, например, в молярных количествах от 0,001 до Температура реакции находится в пределах 46719 10 от 0 до 200°С, прежде всего в диапазоне от 20 до 250мл воды и 250мл разбавленной соляной ки150°С, особенно предпочтительна температура слоты и сушат при 60°С / 20 мбар Таким путем реакционной смеси при нагреве с обратным холополучают 43,2г (0,22 моля, 89%) 2-амино-4дильником трифторметил-6-метокси-1,3,5-триазина в виде бесцветного порошка (ЖХВД > 99 масс %) Т пл Особых условий проведения реакции каса161 -163,5°С тельно давления не требуется, ее осуществляют преимущественно при атмосферном давлении Пример 2 либо при собственном давлении соответствующей 2-амино-4-метокси-6-трифторметил-1,3,5реакционной среды триазин Реакцию можно проводить как в непрерывном 56,6г (0,5 моля) хлорида кальция (98%, порежиме, так и в прерывистом При непрерывном рошкообразный) и 21 Ог (2,5 моля) Nрежиме работы реагенты вводят предпочтительно циангуанидина загружают в 2л метанола При пес помощью трубчатого реактора либо каскада реремешивании нагревают с обратным холодильниакторов с мешалками ком и перемешивают при этом нагреве в течение 1 ч, после чего получают гомогенный раствор Согласно одному из особенно предпочтительЗатем смесь охлаждают до комнатной температуных вариантов осуществления способа по изобреры и добавляют 640г (5,0 молей) метилового эфитению получение триазинов формулы 1 проводят ра трифторуксусной кислоты, далее, в течение 25 без выделения промежуточных продуктов, напримин добавляют 450г (2,5 моля) раствора метаномер, следующим путем сначала приготавливают лята натрия (30 масс %-ный в метаноле), после смесь из циангуанидина формулы 1, сложного чего выпадает белый осадок После нагревания в эфира формулы 4 и соли щелочноземельного метечение 2ч с обратным холодильником смесь охталла либо солей других металлов (соответственлаждают до комнатной температуры и добавками но солевидных соединений) в количествах, меньконцентрированной соляной кислоты устанавлише стехиометрических, в спирте R2OH, служащем вают значение рН порядка 6 Затем метанол отгорастворителем, затем вводят добавки основания, няют, постепенно добавляют приблизительно 2л например алкоголят щелочного металла, такого, воды, отделяют выпавшие тонкокристаллические как NaOR или KOR2, после чего смесь нагревают белые кристаллы и сушат их под вакуумом с обратным холодильником Как правило, после того, как в реакционной Выход 402,4г (2,07 моля, 83% от теории) 1 смеси больше не остается циангуанидина, реакН-ЯМР-спектр (270МГц, CDCI3, TMC (внутцию по обычной методике заканчивают (например, ренний стандарт), а (част/млн)) 6,45 br (1H), 5,88 с помощью тонкослойной хроматографии, жидкоЬг(1Н), 4,03 s(3H) стной хроматографии высокого давления или же Пример 3 газовой хроматографии) 2-амино-4-метокси-6-трифторметил-1,3,5триазин Дальнейшую переработку с целью получения продукта формулы 1 способа осуществляют, как 84г (1 моль) циангуанидина и ЮОг (0,5 моля) правило, с помощью обычных методов, таких, как ацетата меди загружают в 600 мл метанола и в дистилляция, фильтрование, центрифугирование, течение 7 ч нагревают с обратным холодильниили добавками воды и последующим экстрагироком После охлаждения до 20°С загрузочную ванием смесь отсасывают, а твердый медный комплекс отделяют и сушат под вакуумом 41,4г (0,1 моля) Полученные неочищенные продукты при неэтого остатка загружают в 200мл метанола, в теобходимости могут подвергаться последующей чение 15 мин по каплям добавляют 45г (0,25 моля) очистке, например, путем кристаллизации, ректи30%-ного раствора метилата натрия Затем по фикации либо с помощью хроматографических каплям добавляют 76,8г (0,6 моля) метилового методов эфира трифторуксусной кислоты и нагревают в Триазины формулы 1, получаемые простым течение 2ч с обратным холодильником Смеси путем по способу согласно изобретению, преддают остыть до 40°С, отфильтровывают красноставляет собой ценные промежуточные продукты фиолетовое твердое вещество (28,6г) и концендля синтеза красителей, лекарственных средств и трируют маточный раствор Остаток промывают средств защиты растений, в частности гербициводой и сушат В результате получают 16,4г (84,5 дов, описанных, например, в следующих публикаммоля, 38%) вышеназванного триазина циях европейские патентные заявки ЕР-А 508348 и ЕР-А 111442 или в заявке Германии DE-A Пример 4 4038430 2-амино-4-метокси-6-трифторметил-1,3,5триазин Примеры синтеза Пример 1 41,4г (0,1 моля) медного комплекса из примера 3 загружают в 300мл ДМФ и при температуре 2-амино-4-метокси-6-трифторметил-1,3,520°С в течение 15 мин добавляют по каплям 51,2г триазин (0,4 моля) метилового эфира трифторуксусной 21 г (0,25 моля) N-циангуанидина, 3,4г (0,025 кислоты Затем нагревают сначала в течение 1 ч моля) безводного хлорида цинка и 160г (1,25 модо 50°С и продолжают нагревание еще в течение ля) метилового эфира трифторуксусной кислоты 5 ч до 90°С Реакционный раствор синего цвета загружают в 400мл метанола, нагревают до темконцентрируют и остаток смешивают со 100мл пературы 50°С и в течение 10ч добавляют с поводы и 100мл разбавленной соляной кислоты мощью насоса 50г (0,27 моля) 30%- ного раствора После отсасывания суспензии, промывки фильтметилата натрия Затем растворитель практичеровального осадка (коржа) и сушки остатка полуски полностью удаляют, остаток промывают 11 46719 12 чают 23,4г (0,12 моля, 60%) вышеназванного акционной смеси до 20 - 25°С в нее сначала бысттриазина в виде бесцветного порошка ро добавляют по каплям 5,0г (45 ммолей) метилового эфира дифторуксусной кислоты, а затем Пример 5 медленно 4,1 г (23 ммоля) раствора метанолята 2-амино-4-этокси-6-трифторметил-1,3,5натрия (30 масс %-ный в метаноле), после чего триазин выпадает белый осадок После перемешивания в 8,4 г (0,1 моля) циангуанидина и 35,5г (0,25 течение 2ч при одновременном нагревании с обмоля) этилового эфира трифторуксуснои кислоты ратным холодильником летучие компоненты удазагружают в 46г этанола и в течение 5 мин добавляют в водоструйном вакууме при температуре ляют суспензию из 8,5г (0,125 моля) метилата наванны 40°С, остаток распределяют между 100мл трия в 39,8г этанола После введения добавки воды и 100мл этилового эфира уксусной кислоты, 5,66г (0,05 моля) хлорида кальция реакционную органическую фазу отделяют и сушат ее над смесь в течение 7ч нагревают с обратным холоMgSO4 После удаления растворителя при 40°С в дильником Затем при температуре 20°С добавводоструйном вакууме получают указанное в заляют 0,5мл концентрированной соляной кислоты и головке соединение в виде масла с незначительудаляют этанол Далее добавляют ЮОг воды и ным количеством примесей (1,1 г, 6,3 ммоля, 28% суспензию отсасывают Остаток промывают 50 мл от теории), которое при необходимости можно воды и сушат при 50°С / 20 мбар Таким путем кристаллизовать растиранием с помощью смеси получают 18,6г (0,089 моля, 89%) 2-амино-4простой эфир / гексан (объем объем = 1 3) этокси-6-трифторметил-1,3,5-триазина в виде 1 бесцветного порошка (ЖХВД 99,8% поверхности, Н-ЯМР-спектр (400МГц, CDCI3, TMC (внутТ пл 124-125°С) ренний стандарт), а (част/млн)) 7,44 br (1H), 6,97 br (1Н), 6,27 t CJH F = 55Гц, 1Н), 3,96 s (ЗН) Пример 6 13 2-амино-4-дифторметил-6-метокси-1,3,5С-ЯМР-спектр (100МГц, CDCI 3 / CD3S(O)CD3, триазин TMC (внутренний стандарт), а (част/млн), протонный разрыв связи) 171,5 s (С-ОСН3), 169,8 t (CРаствор из 1,9г (23 ммоля) N-циангуанидина и CHF2, 2 JCF 25Гц), 168,8 s (C-NH2), 111,3 t (CHF2, 2,6г (23 ммоля) хлорида кальция в 50мл метанола 1 JCF243I~4), 5 4 , 7 S ( O C H 3 ) перемешивают в течение 90 мин при нагревании с обратным холодильником После охлаждения ре ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71
ДивитисяДодаткова інформація
Автори англійськоюMayer Horst
Автори російськоюМайер Хорст
МПК / Мітки
МПК: C07D 251/46, B01J 31/04, B01J 31/16, B01J 27/06, C07D 251/16
Мітки: асиметрично, спосіб, заміщених, триазинів, одержання
Код посилання
<a href="https://ua.patents.su/6-46719-sposib-oderzhannya-asimetrichno-zamishhenikh-triaziniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання асиметрично заміщених триазинів</a>










