4-метил-5-[2-(3-метил-1-адамантилкарбонілоксі)етил]-3-фенілкарбонілметил-1,3-тіазолій бромід, що викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля та не впливає на протонний градієнт секреторних гранул
Номер патенту: 60615
Опубліковано: 25.06.2011
Автори: Борисова Тетяна Олександрівна, Крисанова Наталія Валеріївна, Бабій Любов Володимирівна, Касаткіна Людмила Олександрівна, Романенко Олександр Вікторович, Вовк Андрій Іванович, Сівко Роман Віталійович
Формула / Реферат
4-Метил-5-[2-(3-метил-1-адамантилкарбонілоксі)етил]-3-енілкарбонілметил-1,3-тіазолій бромід, що викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля та не впливає на протонний градієнт секреторних гранул, загальної формули:
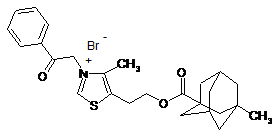 .
.
Текст
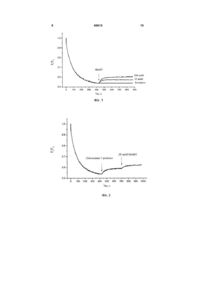
4-Метил-5-[2-(3-метил-1адамантилкарбонілоксі)етил]-3 фенілкарбонілметил-1,3-тіазолій бромід, що викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля та не впливає на протонний градієнт секреторних гранул, загальної формули: Корисна модель належить до галузі медицини, а саме до фармакології. Завданням корисної моделі є синтез сполуки 4-метил-5-[2-(3-метил-1адамантилкарбонілокси)етил]-3фенілкарбонілметил-1,3-тіазолій броміду (МАФТ) та дослідження дії цієї сполуки на мембранний потенціал та протонний градієнт секреторних гранул тромбоцитів крові кроля. Вивчення дії МАФТ на мембранний потенціал та протонний градієнт секреторних гранул тромбоцитів крові кроля проводилось у відділі нейрохімії Інституту біохімії ім. О.В. Палладіна НАН України і на кафедрі біології Національного медичного університету імені О.О. Богомольця. МАФТ синтезовано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії та нафтохімії НАН України. Тіамін (вітамін В1) є невід'ємним компонентом ряду біохімічних перетворень в організмі, виступаючи зокрема як кофермент у транскетолазних реакціях та реакціях декарбоксилування [1, 2], і може бути ефективним при лікуванні багатьох хвороб, особливо на стадіях їх виникнення [3]. Ще один важливий аспект, який останнім часом привертає увагу, пов'язаний з інгібуючим впливом тіаміну та інших солей тіазолію на накопичення продуктів глікозилювання білків [4], що порушує роботу клітини. Механізми цих процесів остаточно не з'ясовані, проте відомо, що тіазолієві сполуки можуть впливати на утворення основ Шифа з карбонільними групами цукрів та гальмувати накопичення продуктів Амадорі, що запобігає утворенню кінцевих продуктів глікозилювання [4]. Припускається також, що солі тіазолію здатні руйнувати поперечні зшивки, які включають дикетонні фрагменти, що виникають в результаті довготривалого функціонування білкової молекули [5, 6]. Вітамін В1 є незамінним компонентом процесів обміну речовин у центральній нервовій системі людини і тварин. Нестача вітаміну В1 в організмі супроводжуються порушенням рефлекторної діяльності, координації рухів, розвитком нейродегенеративних процесів [7]. У синапсах різних типів експериментально встановлено активуючий вплив вітаміну В1 на процеси квантової секреції нейромедіатора з нервових закінчень [8-10]. O Br + N S CH3 O O CH3 (19) UA (11) 60615 (13) U . 3 Молекула тіаміну містить у своєму складі тіазолієвий та піримідиновий цикли, які поєднані метиленовим містком. Наявність тіазолієвого циклу є характерною особливістю тіаміну та його похідних. Серед усіх ендогенних біологічно активних речовин в організмі лише тіамін та його похідні містять у своєму складі тіазолієвий цикл. Раніше було синтезовано тіазолієвий аналог вітаміну В1 - 3-децилоксикарбонілметил-4-метил-5(2-гідроксіетил)тіазолій хлорид (ДМГТ) [11-15]. У складі молекули ДМГТ присутній довгий вуглеводневий радикал, що, очевидно, сприяє вбудовуванню ДМГТ у біологічні мембрани. У рамках даної роботи була синтезована нова сполука, а саме 4-метил-5-[2-(3-метил-1адамантилкарбонілокси)етил]-3фенілкарбонілметил-1,3-тіазолій бромід (МАФТ) та досліджена дія цієї сполуки на мембранний потенціал та протонний градієнт секреторних гранул тромбоцитів крові кроля. Тромбоцити є форменими елементами крові, які беруть безпосередню участь у процесі її зсідання, що попереджає втрату крові при пошкоджені судин. Для забезпечення функціональної активності тромбоцитів важливе значення має підтримання певного рівня потенціалу їхньої плазматичної мембрани. Зміна його значення може обумовлювати модуляцію функціональної активності тромбоцитів. Зниження потенціалу плазматичної мембрани тромбоцитів призводить до змін у роботі іонних каналів, а саме потенціал-залежних калієвих каналів мембрани тромбоцитів, та натрійзалежних транспортерів глутамату [16]. Це може обумовлювати зміни у функціонуванні тромбоцитів та у системі гемостазу в цілому. Пошук та характеристика потенційного периферичного маркеру для аналізу порушень у функціонуванні глутаматних транспортерів мозку є надзвичайно актуальним завданням у галузі сучасної медицини. Тромбоцити крові здатні до активного + накопичення глутамату, містять високоафінні Nа залежні глутаматні транспортери та рецептори глутамату, тому тромбоцити можуть розглядатись як потенційний периферичний маркер порушень у функціонуванні глутаматних транспортерів мозку, а також приймати участь в підтримці гомеостазу позаклітинного глутамату в ЦНС [16-18]. Крім того,тромбоцити здатні до акумуляції глутамату в секреторних гранулах, та вивільнювати глутамат в процесі дегрануляції. Це може розглядатися як ауторегуляція процесів активації-агрегації тромбоцитів. Як і в нервових закінченнях головного мозку рівень акумуляції глутамату в кислих компартментах тромбоцитів визначається їх протонним граді+ єнтом (Н мембрани секреторних гранул тромбоцитів). Беручи до уваги дані, що наведені вище, доцільним є аналіз впливу МАФТ на потенціал плазматичної мембрани та протонний градієнт секреторних гранул тромбоцитів, як потенційного шляху модуляції цією сполукою функціональної активності тромбоцитів, що матиме значення для процесу зсідання крові та забезпечення гомеостазу позаклітинного глутамату в ЦНС. 60615 4 В основу корисної моделі покладено те, що було синтезовано сполуку МАФТ та показано, що вона викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля, не змінюючи при цьому протонний градієнт секреторних гранул. Додавання МАФТ (25-100 мкМ) до суспензії тромбоцитів крові кроля, які містили потенціалчутливий флуоресцентний зонд родамін 6G, призводить до вивільнення родаміну 6G з тромбоцитів. Ефект МАФТ є дозо-залежним. Додавання МАФТ (25-150 мкМ) до суспензії тромбоцитів крові кроля, з рН-чутливим флуоресцентним зондом акридиновим оранжевим, не призводить до вивільнення цього зонду з тромбоцитів. Ознаки способу. Методика одержання 4-метил-5-[2-(3-метил-1адамантилкарбанілокси)етил]-3фенілкарбонілметил-1,3-тіазолій броміду, виділення тромбоцитів з крові кроля, вимірювання потенціалу плазматичної мембрани тромбоцитів та визначення рівня закислення секреторних гранул тромбоцитів. Одержання 4-метил-5-[2-(3-метил-1адамантилкарбонілокси)етил]-3фенілкарбонілметил-1,3-тіазолій броміду Суміш 1 г (3,12 ммоль) 4-метил-5-[2-(3-метил1-адамантилкарбонілокси)етил] тіазолу та 0,62 г (3,12 ммоль) -бром-ацетофенону в 10 мл ацетону кип'ятили 2,5 год. Реакційну масу залишали на добу для кристалізації в холодильнику, після чого змішували з ацетоном. Сіль перекристалізували з суміші розчинників: метанол - ацетон - діетиловий етер (1:5:4). Отриманий продукт сушили над бензолом. Вихід 84%. Кристалічна сіль білого кольору з температурою топлення 193°С розчиняється при кімнатній температурі в етанолі, метанолі, диметилсульфоксиді, не розчиняється в бензолі, діетиловому етері та ацетоні. Будову 4-метил-5-[2-(3-метил-1адамантилкарбонілокси)етил]-3-фенілкарбонілметил-1,3-тіазолій броміду підтверджували 1 даними елементного аналізу та ЯМР Нспектроскопії. Знайдено, %: С 60,28; Н 6,26; N 2,98; S 6,14. C26H32BrNO3S. Обраховано, %: С 60,23; Н 6,22; N 2,70; S 6,18. 1 Спектри ЯМР Н зняті на імпульсному Фур'єспектрометрі Bruker WP-200 (200 МГц), внутрішній 1 стандарт ГМДС. Спектр ЯМР Н (DMSO), , м. д.: 0,76 с (3Н); 1,4-1,78 м (12Н); 2,04 с (2Н); 2,38 с (3Н); 3,35 т (2Н); 4,25 т (2Н); 6,48 с (2Н);7,63-8,08 м (5Н); 10,11 с (1Н). O Br + N S CH3 O O CH3 Виділення тромбоцитів з крові кроля Кров відбирали з вушної вени кроля у пластикові пробірки з антикоагулянтом ACD (85 мМ цитрату натрію, 70 мМ лимонної кислоти та 110 мМ 5 глюкози). Тромбоцити виділяли шляхом диференційного центрифугування, застосовуючи метод Мангано та Шварца [19]. Отриманий осад повільно ресуспендували у холодному середовищі, що містило (в мМ): NaCl - 126, KСl - 5, MgCl2 - 1,4, NaH2PO4 - 1,0, HEPES - 20, етиленглікольтетраоцтову кислоту (EGTA) - 2, D-глюкозу - 10 (рН 7,4). Одержання препарату тромбоцитів проводилось при 4°С. Тромбоцити використовували в експериментах упродовж 2 годин після отримання. Концентрацію білка визначали за методом Ларсона та співавторів [20]. Вимірювання потенціалу плазматичної мембрани тромбоцитів крові кроля Дослідження змін потенціалу плазматичної мембрани тромбоцитів проводили на спектрофлуориметрі Hitachi MPF-4 (Японія) з використанням потенціал-чутливого флуоресцентного зонду родаміну 6G (Molecular Probes, США). Він зв'язується з плазмалемою тромбоцитів та з внутрішньою мембраною мітохондрій, відповідно до їх мембранних потенціалів. Щоб виключити внесок мітохондрій у зміни загального рівня флуоресценції тромбоцитів, частину досліджень проводили у присутності блокатора дихального ланцюга мітохондрій - ротенону (4 мкМ) та інгібітору мітохонд+ ріальної Н -АТФ-синтетази - олігоміцину (4 мг/мл) у середовищі інкубації. Суспензію тромбоцитів (кінцева концентрація білка становила 0,2 мг/мл) преінкубували у безкальцієвому середовищі, що містило (в мМ): NaCl - 126, KСl - 5, MgCl2 - 1,4, NaH2PO4 - 1,0, HEPES - 20, EGTA - 2, D-глюкозу 10 (pH 7,4) упродовж 10 xв. при 37°С, а потім вносили в кварцову кювету з середовищем, що містило родамін 6G (0,5 мкМ). Потенціал плазматичної мембрани тромбоцитів оцінювали за інтенсивністю флуоресценції родаміну 6G згідно формули: F=Ft/F0 де F0 - інтенсивність флуоресценції родаміну 6G за відсутності тромбоцитів у кюветі, Ft - інтенсивність флуоресценції родаміну 6G у присутності тромбоцитів у кюветі. При цьому довжина хвилі збудження становила 528 нм, а довжина хвилі емісії – 551 нм (спектральна ширина щілин – 5 нм). Флуоресценцію реєстрували при постійному перемішуванні суспензії тромбоцитів при 37°С. Визначення рівня закислення секреторних гранул тромбоцитів крові кроля Для дослідження протонного градієнту секреторних гранул тромбоцитів був використаний рНчутливий флуоресцентний барвник акридиновий оранжевий (АО) (Molecular Probes, США), який селективно накопичується у компартментах з кислим рН (зокрема в секреторних гранулах тромбоцитів) [21]. АО - це ліпофільний амін; непротонована форма якого вільно проникає в мембрану. Він стає мембрано-непроникним після протонування в кислому середовищі органел, всередині яких є позитивний заряд. Розподіл АО в синаптосомах залежить від рН. Інтенсивність флуоресценції акумульованого АО, пропорційна протонному градієнту органели та ступеню наповнення секреторних гранул нейромедіатором. Зміни інтенсивності флуоресценції реєстрували на спектрофлуориметрі Hitachi MPF-4 (Японія). При цьому довжина 60615 6 хвилі збудження становила 490 нм, а емісії – 530 нм (спектральна ширина щілини – 5 нм). Суспензію тромбоцитів (кінцева концентрація білка 0,2 мг/мл) преінкубували 10 хв. при 37°С. Накопичення АО тромбоцитами реєстрували після додавання АО (кінцева концентрація 5 мкМ) до суспензії тромбоцитів при постійному перемішуванні. Ступінь закислення секреторних гранул в тромбоцитах визначали за інтенсивністю флуоресценції АО згідно формули: F=Ft/F0 де F0 - інтенсивність флуоресценції АО за відсутності тромбоцитів у кюветі, Ft - інтенсивність флуоресценції АО у присутності тромбоцитів у кюветі. В наших експериментах накопичення родаміну 6G тромбоцитами відбувалося упродовж 7 хвилин у безкальцієвому середовищі (Фіг.1, 2). Наступне додавання МАФТ у концентрації 25 мкМ або 100 мкМ до суспензії тромбоцитів призводило до швидкого вивільнення акумульованого родаміну 6G, що свідчило про деполяризацію мембранних структур тромбоцитів обумовлену дією МАФТ (Фіг.1). В наших дослідженнях мінімальна концентрація МАФТ при якій була зафіксована його дія на мембранний потенціал тромбоцитів становила 25 мкМ. Ступінь деполяризації мембрани тромбоцитів зростав при збільшенні концентрацій МАФТ в інкубаційному середовищі від 25 до 100 мкМ, що вказувало на дозо-залежність зазначеного ефекту МАФТ. Оскільки родамін 6G зв'язується з плазматичною мембраною тромбоцитів та з внутрішньою мембраною мітохондрій відповідно до їх потенціалів, для визначення впливу МАФТ саме на плазматичну мембрану, виключивши при цьому внесок мітохондрій у зміни загального рівня флуоресценції, було використано блокатор дихального ланцюга мітохондрій - ротенон (4 мкМ) та інгібітор мітохондріальної АТФ синтетази - олігоміцин (4 мг/мл). Як свідчать наведені на Фіг.2 дані, МАФТ в концентрації 25 мкМ викликає у присутності в середовищі інкубації ротенону та олігоміцину вивільнення попередньо акумульованого тромбоцитами родаміну 6G, внаслідок чого суттєво підвищується інтенсивність флуоресцентного сигналу. Це свідчить про обумовлену МАФТ деполяризацію безпосередньо плазматичної мембрани тромбоцитів. Додавання суспензії тромбоцитів до розчину АО супроводжується частковим зменшенням флюоресценції внаслідок акумуляції АО в кислих компартментах тромбоцитів, зокрема секреторних гранулах [21]. МАФТ в концентрації 25-150 мкМ не призводить до змін інтенсивності флюоресценції АО, що свідчить про відсутність впливу МАФТ на протонний градієнт секреторних гранул тромбоцитів (Фіг.3). Таким чином, слід підкреслити наступне: 1. МАФТ викликає вивільнення попередньо акумульованого тромбоцитами потенціалчутливого флуоресцентного зонду родаміну 6G, що свідчить про деполяризацію мембранних структур тромбоцитів. Ефект МАФТ є дозо-залежним. Мінімальна концентрація МАФТ, при якій був зафі 7 ксований його вплив на мембранний потенціал тромбоцитів, становила 25 мкМ. 2. У присутності в інкубаційному середовищі блокатора дихального ланцюга мітохондрій - ро+ тенону та інгібітору мітохондріальної Н -АТФ-азиолігоміцину (умов за яких виключено внесок мітохондрій у зміни загального рівня флуоресценції тромбоцитів), було виявлено суттєве зниження мембранного потенціалу плазматичної мембрани тромбоцитів при додаванні 25 мкМ МАФТ в середовище інкубації. 3. МАФТ (25-150 мкМ) не викликає вивільнення попередньо акумульованого тромбоцитами рНчутливого флуоресцентного зонду акридинового оранжевого, що свідчить про відсутність впливу МАФТ на протонний градієнт секреторних гранул тромбоцитів. Джерела інформації: 1. Kluger R., Rathgeber S. Catalyzing separation of carbon dioxide in thiamin diphosphate-promoted decarboxylation // FEBS J. - 2008. - Vol. 275, N 24. P. 6089-6100. 2. Kluger R., Tittmann K. Thiamin diphosphate catalysis: enzymic and nonenzymic covalent intermediates // Chem Rev. - 2008. - Vol.108, N 6. P. 1797 - 1833. 3. Depeint F., Bruce W. R., Shangari N., Mehta R., O'Brien P.J. Mitochondrial function and toxicity: Role of the В vitamin family on mitochondrial energy metabolism // Chem.-Biol. Interact. - 2006. - Vol. 163, N 1-2. - P. 94-112. 4. Booth A.A., Khalifah R.G., Todd P., Hudson B.G. In vitro kinetic studies of formation of antigenic advanced glycation end products (AGEs). Novel inhibition of post-Amadori glycation pathways // J. Biol. Chem. - 1997. - Vol. 272, N 9. - P. 5430-5437. 5. Пат. 6,790,859 B2 US, Int.Cl. A61K 31/425. Reversing advanced glycozilation cross-links using heterocyclic-substituted thiazolium compounds: Пат. 6,790,859 B2 USA, Int.Cl. A61K 31/425/ Wagle.D.R. (US); Alteon Inc. - №10,348/378; Заявл. 21.01.2003; Опубл. 14.09.2004; НКИ 514/365. - 2с. 6. Пат. ЕР 1327887 США, МКИ G01N33/68. Use of thiazolium compounds for preventing and reversing the formation of advanced glycosylation end products: Пат. ЕР 1327887 США, МКИ G01N33/58/A.Cerami; Alteon Inc (США); Picower Inst Med Res(США). № 03075955,9 - Заявл. 18.01.1996; Опубл. 16.07.2003. 7. Bettendorff L. Thiamine in excitable tissues: reflections on a non-cofactor role // Metab. Brain Dis. - 1994. - Vol. 9, N 3. - P. 183-209. 8. Романенко А.В. Действие тиамина на нервно-мышечную передачу у лягушки // Нейрофизиология. - 1985. - Т. 17, № 6. - С. 794-800. 8. Романенко А.В. Действие тиамина на различные типы синаптических соединений // Нейрофизиология. - 1986. - Т.18, №5. - С. 621-629. 9. Романенко А.В., Гнатенко В.М., Владимирова И.А.. Действие тиамина на нервно-мышечную передачу в гладких мышцах // Нейрофизиология. – 1994. - Т.26,№6. - С. 449-457. 10. Вовк А.И., Романенко А.В., Муравьева И.В., Зайцев Л.М. 3-децоксикарбонилметил-4метил-5--гидроксиэтилтиазолий хлорид или децоксикарбонилметил-4-метилтиазолий хлорид, 60615 8 угнетающие нервно-мышечную передачу и обладающие транквилизирующей активностью // Авто4 рское свидетельство 1547267 СССР, МКИ С 07 D 277/24, А 61 К 31/425. Заявлено 18.07.88. Зарегистрировано 01.11.89. 11. Романенко А.В., Вовк А.И., Шатурский О.Я. Действие тиазолевых аналогов витамина В1 на нервно-мышечную передачу и вызванную латротоксином секрецию медиатора в скелетной мышце // Нейрофизиология. - 1995. - Т.27, № 5/6. - С. 368-374. 12. Романенко А.В., Гнатенко В.М., Владимирова И.А., Вовк А.И. Пре- и постсинаптическая модуляция нервно-мышечной передачи в гладких мышцах тиазолевыми аналогами витамина В1 // Нейрофизиология. - 1995. - Т.27, №5/6. - С.375386. 13. Романенко О.В., Вовк А.І., Пммельрейх Н.Г., Шатурський О.Я. Сполука 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид, яка має блокувальний ефект на іонну провідність каналів, утворених амфотерицином В // Патент на корисну модель №22875 зареєстровано в Державному реєстрі патентів України на корисні моделі 25 квітня 2007р. 8с. 14. Борисова Т.О., Крисанова Н.В., Сівко Р.В., Романенко О.В., Вовк А.І. Сполука 3децилоксикарбоні лметил-4-метил-5-(2гідроксіетил)тіазолій хлорид, яка має інгібуючий ефект на процес натрій-залежного накопичення глутамату ізольованими нервовими закінченнями головного мозку щурів // Патент на корисну модель №38155 зареєстровано в Державному реєстрі патентів України на корисні моделі 25 грудня 2008р. - 8с. + 15. Kasatkina L., Borisova T. Impaired Na dependent glutamate uptake in platelets during depolarization of their plasma membrane // Neurochemistry International. - 2010. - Vol. 56, N 5. P. 711-719. 16. Borisova Т., Kasatkina L. Glutamate transporters of blood platelets as potential peripheral markers to analyze changes of glutamate transport activity in brain under altered gravity conditions // Journal of Gravitational Physiology. - 2007. - 14,N 1. P.81-82. 17. Борисова Т.А., Касаткина Л.А. Тромбоциты как потенциальный периферический маркер для анализа функционирования высокоаффинных + Nа -зависимых транспортеров глутамата в нервных окончаниях головного мезга // Космічна наука і технологія. - 2007. - Т. 13, №2. - С. 80-85. 18. Mangano R., Schwarcz R. The human platelets as a model for the glutamatergic neuron: platelet uptake of L-glutamate // J. Neurochem. 1981.-Vol.36,N3.-P. 1067-1076. 19.Larson E., Howlett В., Jagendorf A. Artificial reductant enhancement of the Lowry method for protein determination // Anal. Biochem. - 1986. Vol.155, N2. - P. 243-248. 20. Popov E.G., Gabbazov Z. A., Gavrilov I.Yu., Pozin E. Ya., Mejlumian A. G. Accumulation and release of acridine derivatives by intact platelets // Thomb. Res. - 1987. – Vol 47, N 6. - P. 639-645. 9 60615 10 11 Комп’ютерна верстка М. Ломалова 60615 Підписне 12 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-methyl-5-[2-(3-methyl-1-adamantylcarbonyloxy)ethyl]-3-enylcatbonylmethyl-1,3-thiazolium bromide inducing depolarization of platelet plasmamembrane of rabbit blood and having no effect on protonic gradient of secretory granules
Автори англійськоюKasatkina Liudmyla Oleksandrivna, Borysova Tetiana Oleksandrivna, Romanenko Oleksandr Viktorovych, Babii Liubov Voldymyrivna, Krysanova Natalia Valeriivna, Sivko Roman Vitaliovych, Vovk Andrii Ivanovych
Назва патенту російською4-метил-5-[2-(3-метил-1-адамантилкарбонилокси)этил]-3-фенилкарбонилметил-1,3-тиазолий бромид, который вызывает деполяризацию плазматической мембраны тромбоцитов крови кролика и не влияет на протонный градиент секреторных гранул
Автори російськоюКасаткина Людмила Александровна, Борисова Татьяна Александровна, Романенко Александр Викторович, Бабий Любовь Владимировна, Крысанова Наталия Валериевна, Сивко Роман Витальевич, Вовк Андрей Иванович
МПК / Мітки
МПК: C07D 277/00
Мітки: 4-метил-5-[2-(3-метил-1-адамантилкарбонілоксі)етил]-3-фенілкарбонілметил-1,3-тіазолій, плазматичної, крові, викликає, мембрани, протонний, бромід, впливає, кроля, гранул, градієнт, деполяризацію, секреторних, тромбоцитів
Код посилання
<a href="https://ua.patents.su/6-60615-4-metil-5-2-3-metil-1-adamantilkarboniloksietil-3-fenilkarbonilmetil-13-tiazolijj-bromid-shho-viklikaeh-depolyarizaciyu-plazmatichno-membrani-trombocitiv-krovi-krolya-ta-ne-vplivae.html" target="_blank" rel="follow" title="База патентів України">4-метил-5-[2-(3-метил-1-адамантилкарбонілоксі)етил]-3-фенілкарбонілметил-1,3-тіазолій бромід, що викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля та не впливає на протонний градієнт секреторних гранул</a>
Попередній патент: Спосіб виконання лампектомії з регіонарною лімфатичною дисекцією у хворих на рак молочної залози з локалізацією у верхніх квадрантах
Наступний патент: Спосіб ідентифікації папаверину гідрохлориду у лікарських формах аптечного виготовлення
Випадковий патент: Спосіб оптимізації системи розхолоджування гермооб'єму реакторного відділення