Застосування сполуки 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил)тіазолій хлорид як сполуки, яка викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля
Номер патенту: 48769
Опубліковано: 25.03.2010
Автори: Борисов Арсеній Андрійович, Вовк Андрій Іванович, Касаткіна Людмила Валеріївна, Романенко Олександр Вікторович, Борисова Тетяна Олександрівна
Формула / Реферат
Застосування сполуки 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил)тіазолій хлорид як сполуки, яка викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля, загальної формули:
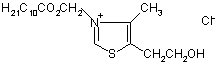 .
.
Текст
Застосування сполуки 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид як сполуки, яка викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля, загальної формули: Корисна модель належить до медицини, а саме до фармакології. Завданням корисної моделі є дослідження дії сполуки 3-децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид (ДМГТ) на мембранний потенціал тромбоцитів крові кроля. Вивчення дії ДМГТ на мембранний потенціал тромбоцитів крові кроля проводилось у відділі нейрохімії Інституту біохімії ім. О.В. Палладіна НАН України і на кафедрі біології Національного медичного університету імені О.О. Богомольця. ДМГТ синтезовано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії та нафтохімії НАН України. В центральній нервовій системі людини і тварин вітамін В1 (тіамін) є незамінним компонентом процесів обміну речовин. Нестача вітаміну В1 в організмі супроводжуються порушенням рефлекторної діяльності, координації рухів, розвитком нейродегенеративних процесів [1]. У синапсах різних типів експериментально встановлено активуючий вплив вітаміну В1 на процеси квантової секреції нейромедіатора з нервових закінчень [24]. Молекула тіаміну містить у своєму складі тіазолієвий та піримідиновий цикли, які поєднані метиленовим містком. Наявність тіазолієвого циклу є характерною особливістю тіаміну та його похідних. Серед усіх ендогенних біологічно активних речовин в організмі лише тіамін та його похідні містять у своєму складі тіазолієвий цикл. Раніше було синтезовано структурний аналог вітаміну В1 з непорушеним тіазолієвим циклом - ДМГТ [5]. У складі молекули ДМГТ присутній довгий вуглеводневий радикал, що, очевидно, сприяє вбудовуванню ДМГТ у біологічні мембрани. За багатьма властивостями ДМГТ може розглядатися як потенційний лікарський засіб [5-9]. Було показано, що уведений лабораторним тваринам ДМГТ чинить на них седативну, центральну міорелаксуючу, протисудомну, снодійну дію. При цьому у тварин також спостерігається зниження больової чутливості, пригнічення орієнтувальної пошукової поведінки. ДМГТ також здатен послаблювати нейротоксичний вплив на тварин білкового токсину -латротоксину, виділеного з отрути павука каракурта (Latrodectus mactans tradecimguttatus). В міоневральних синапсах ДМГТ викликає блокування квантової секреції медіатору, який вивільнюється з нервових закінчень у відповідь на подразнення нервових волокон або на додавання у оточуюче їх середовище латротоксину. У штучних фосфоліпідних мембранах ДМГТ зменшує провідність іонних каналів, сформованих -латротоксином, амфотерицином В або ністатином. Одним з розповсюджених нейромедіаторів у синапсах центральної нервової системи ссавців є глутамат, який зумовлює збудження нервових клітин, він бере участь у здійсненні таких важливих функцій головного мозку, як розпі (13) U . 48769 CH2CH2OH (11) S Cl UA CH3 + N (19) H21C10CO2CH2 3 знавання, пам'ять та навчання. В ізольованих нервових закінченнях головного мозку щурів ДМГТ викликає зменшення натрій-залежного накопичення глутамату та збільшення нестимульованого вивільнення глутамату [10, 11]. Також встановлені обумовлені дією ДМГТ зменшення протонного градієнту синаптичних везикул та деполяризація плазматичної мембрани ізольованих нервових закінчень головного мозку щурів [12, 13]. Усі попередні дослідження стосувались вивчення дії ДМГТ на нервову систему тварин та її складові елементи. До теперішнього часу не було досліджено дію ДМГТ на інші системи організму тварин, зокрема систему гемостазу. Тромбоцити є форменими елементами крові, які беруть безпосередню участь у процесі її зсідання, що попереджає втрату крові при пошкоджені судин. Для забезпечення функціональної активності тромбоцитів важливе значення має оптимальний рівень потенціалу їхньої плазматичної мембрани. Зміна його значення може обумовлювати модуляцію функціональної активності тромбоцитів. Зниження потенціалу плазматичної мембрани тромбоцитів призводить до змін у функціонуванні іонних каналів, а саме потенціал-залежних калієвих каналів мембрани тромбоцитів, та натрій-залежних транспортерів глутамату. Це може обумовлювати зміни у функціонуванні тромбоцитів та у процесі гемостазу в цілому [14, 15]. Беручи до уваги дані, що наведені вище, доцільним є аналіз впливу ДМГТ саме на потенціал плазматичної мембрани тромбоцитів крові кроля, як потенційного шляху модуляції цією сполукою процесу зсідання крові. В основу корисної моделі покладено те, що ДМГТ викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля. Додавання ДМГТ (25-100 мкМ) до суспензії тромбоцитів крові кроля, попередньо навантажених потенціал-чутливим флуоресцентним зондом родаміном 6G, призводить до вивільнення флуоресцентного зонду родаміну 6G з тромбоцитів. Повне вивільнення флуоресцентного зонду родаміну 6G з тромбоцитів відбувається упродовж 15 хв. при додаванні до тромбоцитів ДМГТ у концентрації 100 мкМ. Дія ДМГТ є дозо-залежною. Методика виділення тромбоцитів з крові кроля та вимірювання потенціалу плазматичної мембрани тромбоцитів Виділення тромбоцитів з крові кроля Кров кроля збирали у пластикові пробірки з антикоагулянтом ACD (2,5 г цитрату натрію, 1,5 г лимонної кислоти та 2,0 г глюкози в 100 мл двічі дистильованої води). Тромбоцити виділяли з крові кроля шляхом диференційного центрифугування, застосовуючи метод Мангано та Шварца [16]. Отриманий осад повільно ресуспендували у холодному середовищі, що містило (в мМ): NaCl - 126, КСl - 5, MgCl2 - 1,4, NaH2PO4 - 1,0, HEPES - 20, етиленглікольтетраоцтову кислоту (EGTA) - 2, Dглюкозу - 10 (рН 7,4). Усі операції проводилися при 4°С. Тромбоцити використовували в експериментах упродовж 2 годин після отримання. Концентрацію білка визначали за методом Ларсона та співавторів [17]. 48769 4 Вимірювання потенціалу плазматичної мембрани тромбоцитів крові кроля Дослідження змін потенціалу плазматичної мембрани тромбоцитів проводили з використанням потенціал-чутливого флуоресцентного зонду родаміну 6G (Molecular Probes, США). Він зв'язується з плазмалемою тромбоцитів та з мембраною мітохондрій, залежно від їх мембранних потенціалів. Щоб виключити внесок мітохондрій у зміни загального рівня флуоресценції тромбоцитів, частину досліджень проводили у присутності блокатора дихального ланцюга мітохондрій - ротенону (4 мкМ) та інгібітору мітохондріальної аденозинтрифосфатази (АТФ-ази) - олігоміцину (4 мг/мл) у середовищі інкубації. Суспензію тромбоцитів (кінцева концентрація білка становила 0,2 мг/мл) преінкубували у безкальцієвому середовищі, що містило (в мМ): NaCl - 126, КСl - 5, MgCl2 - 1,4, NaH2PO4 - 1,0, HEPES - 20, EGTA - 2, D-глюкозу 10 (pH 7,4) упродовж 10 хв. при 37°С, а потім вносили в спеціальну кварцову кювету для вимірювання флуоресценції, що містила родамін 6G (0,5 мкМ). Інтенсивність флуоресценції родаміну 6G визначалася на спектрофлуориметрі Hitachi MPF-4 (Японія). Потенціал плазматичної мембрани тромбоцитів оцінювали по інтенсивністі флуоресценції родаміну 6G згідно формули: F=Ft/F0 де F0 - інтенсивність флуоресценції родаміну 6G за відсутності тромбоцитів у кюветі, Ft - інтенсивність флуоресценції родаміну 6G у присутності тромбоцитів у кюветі. При цьому довжина хвилі збудження становила 528 нм, а довжина хвилі емісії - 551 нм (спектральна ширина щілин - 5 нм). Флуоресценцію реєстрували при постійному перемішуванні суспензії тромбоцитів при 37°С. В наших експериментах накопичення родаміну 6G тромбоцитами відбувалося упродовж 20 хвилин після додавання флуоресцентного зонду у безкальцієве середовище їх інкубації (Фіг.1, 2). Наступне додавання ДМГТ у концентрації 25 мкМ або 100 мкМ до цього середовища призводило до швидкого вивільнення з тромбоцитів акумульованого родаміну 6G, що свідчило про миттєву деполяризацію мембранних структур тромбоцитів обумовлену дією ДМГТ (Фіг.1). В наших дослідженнях мінімальна концентрація ДМГТ при якій була зафіксована його дія на мембранний потенціал тромбоцитів становила 25 мкМ. Ступінь впливу ДМГТ на нього зростав при збільшенні концентрацій ДМГТ в інкубаційному середовищі від 25 до 100 мкМ, що вказувало на дозо-залежність зазначеного ефекту ДМГТ. Оскільки родамін 6G зв'язується з плазматичною мембраною тромбоцитів та з мембраною мітохондрій відповідно до їх потенціалів, для визначення впливу ДМГТ саме на плазматичну мембрану, виключивши при цьому можливий внесок мітохондрій у реєструємі зміни загального рівня флуоресценції, було використано блокатор дихального ланцюга мітохондрій - ротенон (4 мкМ) та інгібітор мітохондріальної аденозинтрифосфатази (АТФ-ази) - олігоміцин (4 мг/мл). Як свідчать наведені на Фіг.2 дані, ДМГТ в концентрації 25 мкМ 5 викликає у присутності в середовищі інкубації ротенону та олігоміцину вивільнення попередньо акумульованого тромбоцитами родаміну 6G, внаслідок чого суттєво збільшується інтенсивність реєструємого флуоресцентного сигналу. Це свідчить про обумовлену ДМГТ деполяризацію безпосередньо плазматичної мембрани тромбоцитів. Таким чином, слід підкреслити наступне: 1. ДМГТ у концентрації 100 мкМ викликає повне вивільнення попередньо акумульованого тромбоцитами потенціал-чутливого флуоресцентного зонду родаміну 6G упродовж 15 хв, що свідчить про швидку деполяризацію мембранних структур тромбоцитів. Ефект ДМГТ є дозо-залежним. Мінімальна концентрація ДМГТ при якій була зафіксована його дія на мембранний потенціал тромбоцитів становила 25 мкМ. 2. У присутності в інкубаційному середовищі блокатора дихального ланцюга мітохондрій - ротенону та інгібітору мітохондріальної АТФ-ази олігоміцину (умов за яких виключено внесок мітохондрій у зміни загального рівня флуоресценції тромбоцитів), було виявлено суттєве зменшення мембранного потенціалу плазматичної мембрани тромбоцитів при додаванні 25 мкМ ДМГТ в середовище інкубації. Література: 1. Bettendorff L. Thiamine in excitable tissues: reflections on a non-cofactor role // Metab. Brain Dis. - 1994. - 9, № 3. - P. 183-209. 2. Романенко А.В. Действие тиамина на нервно-мышечную передачу у лягушки // Нейрофизиология. - 1985. - 17, № 6. - с. 794-800. 3. Романенко А.В. Действие тиамина на различные типы синаптических соединений // Нейрофизиология. - 1986. - 18, № 5. - с. 621-629. 4. Романенко А.В., Гнатенко В.М., Владимирова И.А.. Действие тиамина на нервно-мышечную передачу в гладких мышцах // Нейрофизиология. 1994. - 26, № 6. - с. 449-457. 5. Вовк А.И., Романенко А.В., Муравьева И.В., Зайцев Л.М. 3-децоксикарбонилметил-4-метил-5β-гидроксиэтилтиазолий хлорид или децоксикарбонилметил-4-метилтиазолий хлорид, угнетающие нервно-мышечную передачу и обладающие транквилизирующей активностью // Авторское свиде4 тельство 1547267 СССР, МКИ С07D277/24, А61К31/425. Заявлено 18.07.88. Зарегистрировано 01.11.89. 6. Романенко А.В., Вовк А.И., Шатурский О.Я. Действие тиазолевых аналогов витамина В1 на нервно-мышечную передачу и вызванную αлатротоксином секрецию медиатора в скелетной мышце // Нейрофизиология. - 1995. - 27, № 5/6. - с. 368-374. 7. Романенко А.В., Гнатенко В.М., Владимирова И.А., Вовк А.И. Пре- и постсинаптическая модуляция нервно-мышечной передачи в гладких мышцах тиазолевыми аналогами витамина В1 // Нейрофизиология. -1995.- 27, № 5/6. - с. 375-386. 8. Романенко О.В., Вовк А.І., Гіммельрейх Н.Г. Шатурський О.Я. Сполука 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид, яка має блокувальний ефект на іонну провідність каналів, утворених 48769 6 амфотерицином В. // Патент на корисну модель № 22875 зареєстровано в Державному реєстрі патентів України на корисні моделі 25 квітня 2007 р. - 8с. 9. Шатурський О.Я. Романенко О.В., Вовк А.І., Гіммельрейх Н.Г. Сполука 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил)тіазолій хлорид, яка має блокуючий ефект на іонну провідність каналів, утворених ністатином. // Патент на корисну модель № 27417 зареєстровано в Державному реєстрі патентів України на корисні моделі 25 жовтня 2007 р. - 8 с. 10. Борисова Т.О., Крисанова Н.В., Сівко Р.В., Романенко О.В., Вовк А.І. Сполука 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид, яка має інгібуючий ефект на процес натрій-залежного накопичення глутамату ізольованими нервовими закінченнями головного мозку щурів // Патент на корисну модель № 38155 зареєстровано в Державному реєстрі патентів України на корисні моделі 25 грудня 2008 р. - 8 с. 11. Борисова Т.О., Романенко О.В., Остапченко Л.І., Касаткіна Л.О., Крисанова Н.В., Борисов А.А., Вовк А.І. Застосування сполуки 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид як сполуки, яка викликає зменшення протонного градієнту синаптичних везикул в ізольованих нервових закінченнях головного мозку щурів, Патент України № 45943. 12. Борисова Т.О., Романенко О.В., Остапченко Л.І., Касаткіна Л.О., Борисов А.А., Крисанова Н.В., Вовк А.І. Застосування сполуки 3децилоксикарбонілметил-4-метил-5-(2гідроксіетил)тіазолій хлорид як сполуки, яка викликає деполяризацію плазматичної мембрани ізольованих нервових закінчень головного мозку щурів, Патент України № 45941. 13. Борисова Т.О., Романенко О.В., Крисанова Н.В., Сівко Р.В., Борисов А.А., Вовк А.І. Застосування сполуки 3-децилоксикарбонілметил-4метил-5-(2-гідроксіетил)тіазолій хлорид як сполуки, яка викликає збільшення нестимульованого вивільнення глутамату з нервових закінчень головного мозку щурів, Патент України № 45942. 14. Borisova Т., Kasatkina L. Glutamate transporters of blood platelets as potential peripheral markers to analyze changes of glutamate transport activity in brain under altered gravity conditions // Journal of Gravitational Physiology. - 2007. - 14, N 1. - P. 81-82. 15. Борисова Т.А., Касаткина Л.А. Тромбоциты как потенциальный периферический маркер для анализа функционирования высокоаффинных + Nа -зависимых транспортеров глутамата в нервных окончаниях головного мезга // Космічна наука і технологія. - 2007.- 13, № 2, с. 80-85. 16. Mangano R., Schwarcz R. The human platelets as a model for the glutamatergic neuron: platelet uptake of L-glutamate // J. Neurochem. 1981. - 36. - P. 1067-1076. 17. Larson E., Howlett В., Jagendorf A. Artificial reductant enhancement of the Lowry method for proteindetermination // Anal. Biochem. - 1986. - 155. - P. 243-248. 7 Комп’ютерна верстка Л.Литвиненко 48769 8 Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of 3-decyloxycarbonylmethyl-4-methyl-5-(2-hydroxyethyl)thiazolium chloride as a compound that causes depolarization of the plasmamembrane of rabbit blood platelets
Автори англійськоюBorysova Tetiana Oleksandrivna, Romanenko Oleksandr Viktorovych, Kasatkina Liudmyla Valeriivna, Borysov Arsenii Andriiovych, Vovk Andrii Ivanovych
Назва патенту російськоюПрименение соединения 3-децилоксикарбонилметил-4-метил-5-(2-гидроксиэтил)тиазолий хлорид как соединения, которое вызывает деполяризацию плазматической мембраны тромбоцитов крови кролика
Автори російськоюБорисова Татьяна Александровна, Романенко Александр Викторович, Касаткина Людмила Валерьевна, Борисов Арсений Андреевич, Вовк Андрей Иванович
МПК / Мітки
МПК: C07D 277/00
Мітки: плазматичної, 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил)тіазолій, деполяризацію, хлорид, сполуки, викликає, кроля, застосування, яка, крові, тромбоцитів, мембрани
Код посилання
<a href="https://ua.patents.su/4-48769-zastosuvannya-spoluki-3-deciloksikarbonilmetil-4-metil-5-2-gidroksietiltiazolijj-khlorid-yak-spoluki-yaka-viklikaeh-depolyarizaciyu-plazmatichno-membrani-trombocitiv-krovi-krolya.html" target="_blank" rel="follow" title="База патентів України">Застосування сполуки 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил)тіазолій хлорид як сполуки, яка викликає деполяризацію плазматичної мембрани тромбоцитів крові кроля</a>
Попередній патент: Сполука n-(n’-o-трифторметилфенілсукцинімідо-3)-n-фторанілін, яка має потенційну фізіологічну активність
Наступний патент: Пристрій формування оптичних завад засобам ураження, обладнаних оптико-електронними приладами
Випадковий патент: Спосіб ремонту обсадної колони








