Спосіб визначення вірулентності штамів холерних вібріонів
Номер патенту: 69753
Опубліковано: 15.09.2004
Автори: Стопчанська Алла Григорівна, Бощенко Юрій Анатолійович, Ковбасюк Олена Василівна, Костюченко Людмила Сергіївна, Пилипенко Наталія Василівна
Формула / Реферат
Спосіб визначення вірулентності штамів холерних вібріонів, що полягає у співкультивуванні бактерій та клітин-мішеней in vitro, який відрізняється тим, що бактерії та клітини співкультивують впродовж 6-7 годин при співвідношенні 10-105 бактерій і (1-5)105 клітин-мішеней та шляхом мікроскопії фарбованих препаратів установлюють вірулентність штаму за здатністю вібріонів розмножуватися у тісній асоціації з клітинами-мішенями, формування мікроколоній та нових осередків інфекції, наявність змін морфології клітин-мішеней.
Текст
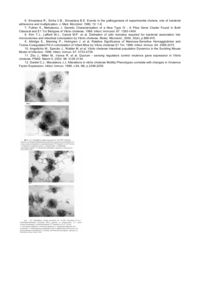
Винахід належить до медицини, а саме, до бактеріології і може використовуватися в практичних лабораторіях для визначення вірулентності виділених штамів холерних вібріонів, а також в наукових дослідженнях при вивченні біологічних властивостей збудників. В системі епідеміологічного нагляду за холерою і при визначенні об'єму протиепідемічних заходів вирішальною являється інформація про епідемічний потенціал (вірулентність) ізольованих штамів холерних вібріонів [1]. Не менш важливою є задача встановити біотип збудника холери в період епідемії. В останні роки доведено, що всі епідемічні штами V.cholerae, поряд з продукцією холерного токсину, мають властивість колонізувати тонкий кишечник людини [2, 3, 4, 5]. Колонізація епітеліальних клітин кишечнику є необхідною умовою продукції холерного токсину [5, 6], який зумовлює розвиток клінічних симптомів холери [5, 6]. Відомо, що основним фактором колонізації є токсин-корегулюючі пілі (англ. pile-ворсина) [5, 6, 7, 8]. Інші продукти епідемічних штамів V.cholerae, зокрема, гемаглютинин-протеаза, білки зовнішньої мембрани, ліпополісахариди, манозочутливий гемаглютинин і деякі інші, також беруть участь у взаємодії поверхневих структур холерних вібріонів і клітин-мішеней [4, 5, 9]. Виявлення факторів колонізації і їх ролі у взаємодії з клітинами-мішенями є дуже важливим не тільки для характеристики епідемічного потенціалу ізольованих штамів V.cholerae та для визначення біотипу ізолятів V.cholerae О1, але й для розуміння процесів природної еволюції збудника, що їх спостерігають в останні 30 років [5]. В зв'язку з цим інтенсивно досліджуються можливі молекули адгезії і колонізації штамів V.cholerae і розробляються моделі і способи їх виявлення [4, 10, 11]. Основною моделлю для оцінки колонізуючих властивостей штамів холерних вібріонів є миші-сосунки. Більшість авторів [9, 10, 11] використовує 4-7-денних мишенят-сосунків, яким під анестезією вводять внутрішньошлунково або per os 10-20LD20 або 5×105-10 6 бактерій в 0,1мл. Мишенят витримують при 26-30°С протягом 20-24 годин, добувають тонкий кишечник, який кладуть у флакони 3 ФБР-фосфатно-буферним розчином (або іншим середовищем) і гомогенізують для зруйнування клітин тонкого кишечнику. Далі готують розведення одержаної суспензії, висівають на поживний або селективний агар, підраховують число колоній, які виросли, і визначають середнє число колонієутворюючих одиниць (CFV). Основні недоліки цього способу: - трудомісткість, багатоетапність і небезпечність процесів дослідження; - необхідність використовування великовартісних приборів; - індивідуальні відмінності показників числа колонієутворюючих одиниць у експериментальних тварин. Спосіб вимагає значних економічних затрат в т.ч. великої кількості тварин, не дозволяє визначати характер взаємодії збудника з клітинами-мішенями і виявляти особливості етапів колонізації. В останні роки розроблені методи визначення колонізуючих властивостей штамів V.cholerae різного ступеню вірулентності in vitro на моделі культур клітин Нер-2, Т-84, NT29 [4, 5, 12]. Загальними рисами у більшості цих методів являється використання великих концентрації бактерій (100 і більше на 1 клітину-мішень) і короткочасність співкультивування бактерій і клітин - від 30 хвилин до 2 годин. Колонізуюча здатність штаму визначається візуально (світлова мікроскопія) числом бактерій, які зв'язались з однією клітиною-мішенню [12], або за кількістю життєздатних мікробів (CFV), зв'язаних з клітинами чи з тканинами [4, 7]. Запропоновані методи не дозволяють визначати тип взаємодії бактерій і клітин-мішеней, послідовні етапи колонізації, структуру мікроколоній, "мікроб-мікроб" взаємодію, характер, інтенсивність і швидкість заселення збудником клітинмішеней, порушення морфології останніх. Це заважає оцінці ключової ознаки вірулентності - фактора колонізації. Необхідно також підкреслити, що в зазначених способах досліджується переважно початковий етап колонізації (перші 30 хвилин контакту вібріонів з клітиною, рідко 1,5-2 години), отже, визначається експресія молекул адгезії на поверхні холерних вібріонів, які були вирощені на штучних поживних середовищах. Разом з тим, нещодавно одержані дані про експресію різного набору генів холерного вібріону in vitro і in vivo [7]. Відомий спосіб визначення колонізуючих властивостей штамів V.cholerae [4] за кількістю CFV, в якому використовують як модель диференційовані клітини кишечнику людини. Даний спосіб є найбільш близьким аналогом за суттю, і технічного рішення. Штами холерних вібріонів (різних біотипів і ступеня вірулентності) вирощують впродовж 16 годин на м'ясопептонному агарі і готують розведення на середовищі PFHM-11 - вільному від білку гібридомного середовища (англ. Protein Free Hibridoma Medium). В якості клітин-мішеней використовують клон диференційованих клітин НТ29-18 N2, одержаних з клітинної лінії НТ29-аденокарценоми товстого кишечнику людини. Моношар клітини НТ29-18 N(2) одержують шляхом культивування клітин на покривних скельцях спочатку протягом 24 годин на модифікованому середовищі. Ігла з високим вмістом глюкози, а потім 10-14 днів - на середовищі PFHM-11. На моношар клітин (106) вносять 106-10 9 бактерій і співкультивують їх від 30 хвилин до 2 годин. Потім покривні скельця переносять в нові лунки, що містять ФБР і 1% тритон-Х для лізісу клітин. Покривні скельця струшують 30 хвилин в, мікрошейкері. Титр зв'язаних з клітинами вібріонів визначають шляхом підрахунку колоній (CFV), які виросли на агарі при дослідженні серійних розведень одержаних суспензій. Невірулентні штами не зв'язуються з клітинами-мішенями або лише в незначній мірі. Недоліки відомого способу: - Складність і тривалість одержання клітин-мішеней, висока вартість середовища культивування клітин. - Багатоетапність. - Необхідність використання високовартістного обладнання. - Небезпечність. - Великі об'єми робіт із-за необхідності визначення титра вібріонів (CFV) в серійних розведеннях суспензій вібріонів і зруйнованих клітин. - Неможливість спостерігати послідовні етапи взаємодії бактерій і клітин і мішеней, способу колонізації і формування нових осередків, морфологічні зміни клітин-мішеней. - Неможливість виявляти тип взаємодії бактерій і клітин (біотип). Методологічні складності, тривалість дослідження і значні економічні витрати суттєво обмежують можливість оцінки in vivo та in vitro експресії другої ключової ознаки вірулентності - фактора колонізації, який характеризує епідемічний потенціал штамів V.cholerae. В зв'язку з цим удосконалення методичних заходів визначення вірулентності штамів V.cholerae, спрощення та здешевлення способа є важливими актуальними питаннями в проблемі холери. В основу винаходу поставлена задача підвищити інформативність та вірогідність способу визначення вірулентності V.cholerae О1 шляхом вивчення типу взаємодії холерного вібріона з клітинами-мішенями, який забезпечить підвищення інформативності і вірогідності визначення вірулентності, безпечність способу та економічний ефект. Поставлена задача досягається тим, що використовують однодобову культуру клітин HeLa (або МсСоу), вирощених на покривних скельцях у пеніцилінових флаконах без антибіотиків, вносять на моношар клітин 0,1мл суспензії холерних вібріонів у фізіологічному розчині в концентрації від 10 до 105 бактерій на 1-5×105 клітин. Клітини і бактерії співкультивують протягом 6-7 годин при 37°С, покривні скельця витягують, фіксують в суміші метилового спирту і льодяної оцтової кислоти (співвідношення 3:1), фарбують за Романовським-Гімза, монтують на предметних склах, досліджують в світловому мікроскопі та установлюють вірулентність штаму за здатністю вібріонів розмножуватися у тісній асоціації з клітинами-мішенями, формуванню мікроколоній та нових осередків інфекції, змінам морфології клітин-мішеней. Порівняння винаходу, що заявляється, з відомими рішеннями із джерел патентної та науково-технічної інформації, показало, що сукупність відмітних ознак способу та пристрою, є невідомою з рівня техніки, тобто не є частиною технічного рівня, бо в загальнодоступних джерелах не виявлено всієї сукупності ознак, характерних для винаходу, отже відповідає критерію "новизна". Спосіб відповідає винахідницькому рівню тому, що нами не виявлено рішень з використанням істотних ознак заявлених об'єктів винаходу для досягнення аналогічного технічного результату. Із порівняльної характеристики ознак прототипу і заявленого рішення (Табл.1) можна дійти наступних висновків. Істотними ознаками заявленого винаходу є ознаки, які характеризують умови співкультивування холерних вібріонів і клітин-мішеней (концентрація бактерій і клітин, строки співкультивування), що обумовлює можливість визначення: 1) етапів колонізації бактерій, які розмножилися в асоціації з клітинами; 2) морфологічних змін клітин; 3) диференціальних ознак колонізації клітин-мішеней вірулентними штамами V.cholerae класичного і El Tor біотипів. Табл. 1 Порівняльна характеристика ознак прототипу і заявленого рішення Ознака Вирощування бактерій, приготування розведень Строки одержання моношару клітин-мішеней Співвідношення числа бактерій с клітинами-мішенями Тривалість співкультивування бактерій і клітин-мішеней Визначення колонізуючих властивостей штаму Тривалість дослідження Прототип Заявлене рішення Відмінність 16 годин 18-20 годин 11-15 днів 1 день 5 106-109 вібріонів на 106 клітин 10-10 вібріонів на 1-5х10 клітин 30хв-2 години 6-7 годин лізис клітин, відділення від скла в мікрошейкері, приготовлення розведень, посівна поживні середовища, підрахунок числа CFU, визначення початкових етапів - адсорбції 13-17 днів фіксація, фарбування і мікроскопування препарату, визначення всіх етапів колонізації 2-3 дні + 5 + + + + Спосіб виконується наступним чином. Досліджуваний штам холерних вібріонів висівають в 5мл. 1% пептонної води і після 4 годин вирощування при 37°С пересівають на чашки Петрі з луговим агаром рН7,6, культивують протягом ночі при 37°С, готовлять суспензію бактерій в фізіологічному розчині з концентрацією від 10 до 103 мікробів в 0,1мл. для штамів V.cholerae El Tor і 103-105 мікробів - для штамів V.cholerae classica. В якості клітин-мішеней використовують однодобову культуру клітин HeLa або МсСоу, які вирощують на покривних скельцях в пеніцилінових флаконах без антибіотиків (1-5×105клітин). На кожне розведення бактеріальної суспензії використовують 2 флакони з культурою клітин, в які вносять по 0,1мл. досліджуваної концентрації вібріонів. Співкультивування вібріонів і клітин здійснюють при 37°С протягом 6-7 годин, потім покривні скельця переносять у флакони з фіксатором (метиловий спирт+льодяна оцтова кислота у відношенні 3:1), фіксують протягом години, фарбують за Романовським-Гімза, монтують на предметному склі, досліджують під світловим мікроскопом і визначають: 1) наявність зв'язаних з клітиною бактерій і мікроколоній; 2) заселення бактеріями сусідніх клітин; 3) набрякання або клазматоз клітин; 4) наявність чи відсутність скупчень бактерій у позаклітинному просторі. Виявлення зазначених ознак взаємодії холерних вібріонів і клітин-мішеней є основою для висновку про вірулентність штаму. Для оцінки колонізуючих властивостей штамів V.cholerae O1 in vitro на моделі культур клітин і встановлення типів взаємодій були використані еталонний високотоксигенний штам 569В V.cholerae classica і 19 штамів V.cholerae El Tor (12 токсигенних ctx+ і 7 нетоксигенних ctx- штамів), ізольованих від хворих та із об'єктів навколишнього середовища в період епідемічного підйому захворювання на холеру на півдні України в 19941995pp. Як зразок клітин-мішеней використані високочутливі до дії холерного токсину культури клітин HeLa і МсСоу, які вирощували на покривних скельцях. Адгезивні і колонізуючі властивості штамів V.cholerae вивчали при різних концентраціях холерних вібріонів (від 1 до 106 бактерій на 1-5×105клітин-мішеней) і тривалістю співкультивування бактерій і клітин від 2 до 24 годин. Фіксовані сумішшю метилового спирту з льодяною оцтовою кислотою і, пофарбовані за Романовським-Гімза препарати, досліджували під світловим мікроскопом. Встановлено, що найбільш чітко диференціювати типи взаємодії та досліджувати послідовні етапи колонізації вдається при співкультивуванні бактерій і клітин протягом 6-7 годин і при використанні низьких концентрацій бактерій, параметри, що були встановлені емпірично (табл.2). Вірулентні штами V.cholerae О1 неодмінно зв'язуються з клітинами, розмножуються в тісній асоціації з клітиною - на її поверхні у випадку V.cholerae classica або утворення ланцюжків із бактерій, чітко спрямованих до суміжних клітин з формуванням нового осередку інфекцій із кількох клітин (V.cholerae El Tor). В строки оптимального досліджування (6-7 годин), V.cholerae classica штам 569В утворює мікроколонії у вигляді конгломерату зруйнованої клітини з численними тісно асоційованими вібріонами. Цитоплазма клітин, що знаходяться поруч, збільшена в розмірах. Характерною особливістю вірулентних штамів V.cholerae El Tor є відокремлення від клітин численних ділянок цитоплазми за типом клазматозу. Весь комплекс згаданих вище ознак виявляють при концентрації 104-105 бактерій (для V.cholerae classica штам 569В) і 10-103 бактерій на 1-5×105клітин (для V.cholerae El Tor). При застосуванні менших концентрацій бактерій різко збільшується час, необхідний для виявлення згаданих вище ознак, а при більш високих, внаслідок швидкого розвитку етапів колонізації, неможливо чітко диференціювати їхню послідовність. Виявлено, що вібріони штаму 569В класичного біотипу зв'язуються з поверхнею переважно апікальною частиною. В процесі розмноження вони зберігають тісний зв'язок з клітиною і один з одним, утворюючи мікроколонії. Останні уявляють собою конгломерат компонентів зруйнованої клітини з численними тісно асоційованими вібріонами. На заключному етапі взаємодії частина вібріонів відокремлюється від мікроколонії і заселяє клітини, які розташовані поруч (фіг.1,2). Колонізуючий ефект у досліджувані строки спікультивування цього штаму з клітинами був з'ясований при концентрації 104-10 5 бактерій на 1-5×105клітин. Таблиця 2 Адгезивні і колонізуючі властивості штамів V.cholerae О1, модель in vitro - клітини HeLa та Me Coy Штами V.cholerae Кількість штамів Концентрація бактерій 104-105 бактерій на ctx+ штам V.cholerae classica, шт 569В 1 ctx+ штами V.cholerae E1 Tor, від хворих 12 сtx- штами V.cholerae E1 Tor, від хворих 7 1-103 сtx- штам V.cholerae E1l Tor, із зовнішнього середовища 1 10-102 1 - 5 × 10 5 клітин 10-103 бактерій на 1 - 5 × 10 5 клітин Тип взаємодії холерних вібріонів з клітинами Адгезія на поверхні клітин, мікроколонії навколо зруйнованих клітин, набрякання цитоплазми клітин. Адгезія бактерій по периферії клітин, розселення неперервними ланцюжками бактерій на суміжні клітини, клазматоз клітин Локальна адгезія до цитоплазми на межі сусідніх клітин, скупчення бактерій поза клітинами Ланцюжки поза клітинами Тип взаємодії ctx+ штамів V.cholerae El Tor суттєво відрізняється від описаного вище для токсигенного штаму класичного біотипу. Бактерії цих штамів, як правило прикріплюються до цитоплазматичної мембрани по периферії клітин, повторюючи її контури і дотикаються до неї багатьма ділянками. В процесі росту бактерії розміщуються по периметру клітини, утворюючи один чи більше ланцюжків, зв'язаних один з одним вібріонів, які асоціюються з суміжними клітинами і формують нові осередки інфекції (фіг.3). Характерною особливістю цих штамів є більш швидке відділення бактерій від клітин і менш тісний зв'язок їх один з одним вже на початкових етапах колонізації, а також суттєво більш низька, порівняно зі штамом 569В класичного біотипу, концентрація 5 вібріонів (101-102 бактерій на 1 - 5 × 10 клітин), необхідна для ініціації колонізуючого ефекту. Важливою + характеристикою ctx штамів V.cholerae El Tor являється відділення від багатьох клітин ділянок цитоплазми за типом клазматозу, що може свідчити про специфічну кластерізацію мембранних рецепторів клітин в результаті зв'язування значного числа бактеріальних молекул адгезії (фіг.4). Вібріони сtх+ штамів біотипу El Tor, ізольованих від хворих, частіше розташовуються поза клітинами або на межі сусідніх клітин без клазматозу останніх (фіг.5). Виділений із зовнішнього середовища штам 28 V.cholerae El Tor відрізняється чітким позаклітинним розміщенням і формуванням перекручених ланцюжків бактерій (фіг.6). Таким чином, виявлено чітко диференційовані типи взаємодії (адгезія і колонізація) токсигенних і нетоксигенних штамів холерних вібріонів і клітин-мішеней, що дозволяє визначати вірулентність ізольованих штамів холерних вібріонів, комплекс і об'єм протиепідемічних заходів, а також біотип штамів конкретної епідемії. Одержана інформація може використовуватися для прогнозування інтенсивності і поширення епідемії, тяжкості перебігу захворювань. Порівняння типів адгезії дозволяє вважати, що спорідненість молекул адгезії холерних вібріонів Е1 Тог біотипу до специфічних рецепторів клітин HeLa і Me Coy у досліджуваний період і здатність до росту і колонізації на 3 порядки вище, ніж у штаму 569В класичного біотипу. Тому при одночасному попаданні в організм людини штамів E1 Tor і класичного біотипу колонізувати кишечник будуть переважно вібріони штамів Е1 Тоr біотипу. Не виключено, що саме з цим пов'язана заміна класичного біотипу штамами El Tor в період VII пандемії. Зменшення розмірів цитоплазми в результаті клазматозу клітин в присутності ctx+ штамів V.cholerae E1 Tor в певній мірі пояснює часто менш важкий перебіг хвороби. Запропонований спосіб у порівнянні з прототипом, дозволяє диференціювати послідовні етапи колонізації вірулентними штамами клітин-мішеней і виявляти характерні структурні зміни останніх, визначати ознаки взаємодії бактерій і клітин, які характеризують біотип. Використання невеликих доз збудника дає можливість досліджувати експресію молекул адгезії і колонізації вібріонів, які виросли в тісній асоціації з клітинами-мішенями і, відповідно, наблизитись до умов їх експресії in vivo. Таким чином, спосіб підвищує рівень інформативності і достовірності установлення вірулентності штама V.cholerae О1. Скорочення кількості етапів способу (отже, контактів із збудником) сприяє підвищенню безпечності дослідження. Скорочення тривалості дослідження у 5-6 разів, порівняно із прототипом (табл.1), обумовлює також економічний ефект. Приклад 1. Штам V.cholerae classica 569В вирощують протягом 4 годин на 1% пептонній воді, засівають на чашки Петрі з лужним агаром рН7,6, культивують на протязі 18-20 годин при 37°С і готують суспензію бактерій в фізіологічному розчині. За допомогою стандарту мутності доводять концентрацію холерних вібріонів до 10 бактерій в 1мл. і готують розведення з концентрацією 103-105 бактерій в 0,1мл. Культуру клітин HeLa розсівають по 1,5мл. (10-15-104кл/мл) в пеніцилінові флакони з покривними скельцями розміром 1х2 см та вирощують протягом 24 годин в середовищі 199 з 10% телячої ембріональної сироватки без антибіотиків. На кожне розведення бактеріальної суспензії (103, 104, 10 5 бактерій в 0,1мл) використовують 2 флакони з культурою клітин, в які вносять по 0,1мл суспензії бактерій. Спікультивування вібріонів і клітин проводять протягом 6-7 годин при 37°С, потім покровні скельця переносять у флакони з фіксатором (метиловий спирт+льодяна оцтова кислота у відношенні 3:1), фіксують протягом години, висушують і фарбують за Романовським-Гімза, монтують на предметному склі, заключають у бальзам і досліджують в світловому мікроскопі при збільшені 10х90. Визначають наявність зв'язаних з клітиною-мішенню вібріонів і мікроколоній збудника у вигляді асоціації тісно зв'язаних вібріонів з компонентами зруйнованої клітини з різко конденсованим хроматином, заселення нових клітин і формування нових осередків інфекцій. Як правило, холерні вібріони локалізуються на поверхні клітин або поблизу них. Розташовані поруч з мікроколоніями клітини мають набрякшу вакуалізовану цитоплазму (фіг.1). Приклад 2. Ctx+ штам V.cholerae El Tor 481 культивують протягом 4 годин на 1% пептонній воді, потім засівають газоном на чашки Петрі з лужним агаром, рН7,6. Культуру вирощують протягом 18-20 годин при 37°С і готують суспензію бактерій в фізіологічному розчині. За допомогою стандарту мутності доводять концентрацію холерних вібріонів до 107 бактерій в 1мл фізіологічного розчину і готують розведення з концентраціями 10-103 бактерій в 0,1мл. Культуру клітин HeLa або МсСоу розсівають по 1,5мл (10-15×104кл/мл) в пеніцилінові флакони з покровними скельцями розміром 1х2см і вирощують протягом 24 годин в середовищі 199 з 10% телячої ембріональної сироватки без антибіотиків. На кожне розведення бактеріальної суспензії (10, 102, 103 бактерій в 0,1 мл) використовують 2 флакони з культурами клітин, в які вносять по 0,1 мл суспензії бактерій, співкультивування вібріонів і клітин проводять протягом 6-7 годин при 37°С, потім покривні скельця переносять у флакони з фіксатором, фіксують протягом години, висушують, фарбують за Романовським-Гімза, заключають у бальзам і досліджують при збільшенні 10х90. Визначають наявність зв'язаних з клітинами вібріонів, їх розташування по периферії клітин, утворення чітко направлених до суміжних клітин ланцюжків різної довжини, які складаються із окремих вібріонів, заселення нових клітин шляхом збільшення довжини ланцюжків, відсутність вібріонів і ланцюжків поза зв'язком з клітиною чи її фрагментами. Характерною особливістю є відділення від клітин-мішеней ділянок цитоплазми різної форми і розміру за типом клазматозу, тенденція до зв'язування вібріонів з клітинами, які діляться (фіг.3, 4). Наявність зазначених ознак свідчить про вірулентність досліджуваного штаму V.cholerae. Розроблений спосіб може бути використаним в практичних лабораторіях для встановлення вірулентності ізольованих штамів холерних вібріонів, визначення біотипу штаму V.cholerae О1 і оцінки їх епідемічного потенціалу при загрозі завозу холери, виділені штамів холерних вібріонів від хворих з симптомами діареї, в екстрених випадках при підозрі захворювання на холеру, а також наукових дослідженнях при вивченні біологічних властивостей збудника, варіацій адгезивних і колонізуючих властивостей в процесі природної еволюції збудника, комплементарності молекул адгезії рецепторам клітин-мішеней. Джерела інформації: 1. Мишанькин Б.Н., Ломов Ю.Н,, Бардых И.Д. Эволюция приемов оценки эпидемической значимости холерных вибрионов // Эпидемиол. и инфекецион. бол. - 2002.- №4. -С.57-61. 2. Смирнова Н.И., Кириллина О.А., Кутырев В.В. Генетические маркеры эпидемических штаммов V. cholerae // Журн. Микробиол. - 2000. - №5. - С.87-91. 3. Herrington D.A., Hall R.H., Losonsky J.J. rt al. Toxin, toxin-coregulated pili and Tox R regulon are essential for Vibrio cholerae pathogenesis in human. J. Exp. Med. 1988, 168: 1487-1492. 4. Benitez J., Spelbrink R., Silva A et al. Adherence of Vibrio cholerae to Cultured Differentiated Human Intestinal Cells: an in Vitro Colonization Model. 1997. Infect. Immun. 65: 3474-3477. 5. Faruque Sh.M., Albert M.J., Mekalanos J.J. Epidemiology, Genetics and Ecology of Toxigenic Vibrio cholerae. Microbiol. Моl. Biol. Rev., 1998, v.62, №4, p.1301-1314. 6. Srivastava R., Sinha V.B., Srivastava B.S. Events in the pathogenesis of experimental cholera, role of bacterial adherence and multiplication. J. Med. Microbiol. 1980, 13: 1-9. 7. Fullner К., Mekalanos J. Genetic Characterization of a New Type IV - A Pilus Gene Cluster Found in Both Classical and E1 Tor Biotypes of Vibrio cholerae. 1998. Infect. Immunol. 67: 1393-1404. 8. Kirn T.J., Lafferti M.J., Carola M.P. et al. Delination of pilin domains required for bacterial association into microcolonies and intestinal colonization by Vibrio cholerae. Molec. Microbiol., 2000, 35(4), p.896-910. 9. Attridge S., Manning P., Holmgren J. et al. Ralative Significance of Mannose-Sensitive Hemagglutinine and Toxine-Coregulated Pili in colonization of Infant Mice by Vibrio cholerae E1 Tor. 1996. Infect. Immun. 64: 3369-3373. 10. Angelichio M., Spector J., Walder M. et al. Vibrio cholerae Intestinal population Dynamics in the Suckling Mouse Model of Infection. 1999. Infect. Immun. 67: 3733-3739. 11. Zhu J., Miller M., Vance R. et al. Quorum - sensing regulators control virulence gene expression in Vibrio cholerae. PNAS. March 5, 2002. 99: 3129-3134. 12. Gardel C.J., Mecalanos J.J. Alterations in vibrio cholerae Motility Phenotypes correlate with changes in Virulence Factor Expression. Infect. Immun. 1996, v.64, N6, p.2246-2255.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for determination of virulence of cholera vibrios strains
Автори англійськоюStopchanska Alla Hryhorivna, Boshchenko Yurii Anatoliovych, Pylypenko Natalia Vasylivna, Kostiuchenko Liudmyla Serhiivna
Назва патенту російськоюСпособ определения вирулентности штаммов холерных вибрионов
Автори російськоюСтопчанская Алла Григорьевна, Бощенко Юрий Анатольевич, Пилипенко Наталия Васильевна, Костюченко Людмила Сергеевна
МПК / Мітки
МПК: C12N 1/20, C12R 1/63, C12N 5/16, C12Q 1/02
Мітки: вірулентності, штамів, холерних, визначення, вібріонів, спосіб
Код посилання
<a href="https://ua.patents.su/6-69753-sposib-viznachennya-virulentnosti-shtamiv-kholernikh-vibrioniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення вірулентності штамів холерних вібріонів</a>
Попередній патент: Спосіб одержання еритроцитарної маси для приготування діагностичних препаратів
Наступний патент: Лінійно-смугова ексимерно-галогенна лампа
Випадковий патент: Машина для очищення зерна