Спосіб визначення токсигенності холерних вібріонів
Номер патенту: 45930
Опубліковано: 15.04.2002
Автори: Стопчанська Алла Григорівна, Винник Валентина Дмитрівна, Пушкіна Валентина Олександрівна, Дронова Ірина Юріївна, Пилипенко Наталія Василівна
Формула / Реферат
1. Спосіб визначення токсигенності холерних вібріонів, що включає дослідження дії холерного екзотоксину на культуру перещеплюваних клітин, який відрізняється тим, що культуру перещеплюваних клітин, наприклад HeLa, вирощують на покривних скельцях в пеніцилінових флаконах протягом 24 годин, закріплюють ділянку лужного агару з 1-2-добовою бляшкою або колонією досліджуваного штаму холерного вібріона на верхньому краї покривного скельця і забезпечують контакт нижньої сторони агару з культуральною рідиною, співкультивують при 370 С протягом 8 та 24 годин зразки клітин з бактеріями без і з додаванням в середовище культивування холерної антитоксичної сироватки, витягають покривні скельця з клітинами, красять і шляхом мікроскопування встановлюють токсигенність штаму холерного вібріона за наявністю характерних патологічних змін ядра і цитоплазми клітин-мішеней в зразках без антитоксичної сироватки при відсутності таких в зразках з антитоксичною сироваткою.
2. Спосіб за п. 1, який відрізняється тим, що в покрашених препаратах порівнюють число гніздних однотипних пошкоджень та кількість пошкоджених клітин в осередку через 8 та 24 години і встановлюють рівень токсигенності штаму.
Текст
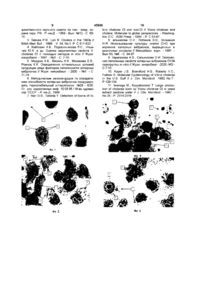
1 Спосіб визначення токсигенності холерних вібріонів, що включає дослідження дії холерного екзотоксину на культуру перещеплюваних клітин, який відрізняється тим, що культуру перещеплюваних клітин, наприклад НеІ_а, вирощують на покривних скельцях в пеніцилінових флаконах протягом 24 годин, закріплюють ділянку лужного агару з 1 -2-добовою бляшкою або колонією досліджуваного штаму холерного вібріона на верхньому краї покривного скельця і забезпечують контакт нижньої сторони агару з культуральною рідиною, співкультивують при 37° С протягом 8 та 24 годин зразки клітин з бактеріями без і з додаванням в середовище культивування холерної антитоксичної сироватки, витягають покривні скельця з клітинами, красять і шляхом мікроскопування встановлюють токсигенність штаму холерного вібріона за наявністю характерних патологічних змін ядра і цитоплазми клітинмішеней в зразках без антитоксичної сироватки при відсутності таких в зразках з антитоксичною сироваткою 2 Спосіб за п 1, який відрізняється тим, що в покрашених препаратах порівнюють число гніздних однотипних пошкоджень та КІЛЬКІСТЬ пошкоджених клітин в осередку через 8 та 24 години і встановлюють рівень токсигенності штаму Винахід відноситься до медицини, а саме, бактеріологи, і може бути використаний для визначення основної ознаки патогенності Vibrio cholerae (V cholerae) - здатності продукувати холерний екзотоксин Розроблений спосіб може бути використаний в практичних лабораторіях для встановлення токсигенності виділених штамів холерних вібріонів і оцінки їх епідемічного потенціалу, а також в наукових дослідженнях при вивченні біологічних властивостей циркулюючих штамів V cholerae, патогенезу холери, виявлення високотоксигенних штамів для одержання антитоксичної сироватки В системі епідеміологічного нагляду за холерою найважливіше значення має оцінка епідемічного потенціалу (вірулентності) виділених штамів холерних вібріонів [1, 2, 3] Однак, в зв'язку з особливостями біологи збудника холери, визначення його вірулентності продовжує залишатися досить складною проблемою [4] Найбільш важливою характеристикою патогенних властивостей штаму V cholerae є його ток сигенність [5, 6] In vivo здатність продукувати холерний екзотоксин (холероген) найбільш точно визначається на моделі кроликів-сосунків Однак, метод трудомісткий, дорогий і не дозволяє досліджувати велику КІЛЬКІСТЬ штамів [4] В зв'язку з цим виникла необхідність розробки ефективного та економічно вигідного способу визначення токсигенності in vitro Для цього використовують імуноферментний метод, метод латаксаглютинацп [7] Експресію гена ctx визначають також на моделі клітинних культур [7, 8, 9] Спільним етапом і недоліком способів in vivo є необхідність попереднього накопичення холерного екзотоксину в середовищі культивування холерного вібріона, де накопичуються також біологічно активні речовини з властивостями цитотоксинів, продукти метаболізму та руйнування мікробів Присутність цих компонентів затрудняв імунологічне та біологічне тестування холерогену [8, 10] Трудність розробки ефективних методів визначення in vitro продукції холерного екзотоксину обумовлена тим, що більшість природних штамів о со о> ю 45930 V cholerae eltor, особливо КЛІНІЧНИХ ІЗОЛЯТІВ, слабо секретує екзотоксин in vitro, a 20-30% вказаних штамів не продукує його в КІЛЬКОСТІ, яку можна визначити при тестуванні відомими методами [7] Недивлячись на розробку селективних середовищ та режимів культивування V cholerae (t, аерування та ш) проблема накопичення in vitro достатньої КІЛЬКОСТІ холеро гену повністю не вирішена, так як оптимальні умови його секреції істотно відрізняються як для штамів різних біотипів, так і одного біотипу [5, 7] Для визначення токсигенності штамів V cholerae використовують культури клітин різного походження [7], поверхнева мембрана яких має специфічні для холерогену рецептори (HeLa, Vero, Y-I, СНО, S49 та ш) Зв'язування останніми токсину забезпечує його транспорт усередину клітини та зміни її структурно-функціональних характеристик Висновок про холерогенність штаму ґрунтується на результатах реєстрації форми клітин після контакту з супернатантом [7] Вказані культури мають приблизно однакову чутливість для холерогену, при цьому клітини Y-1 внаслідок дії токсину округлюються, СНО - подовжуються, а у клітин Vero відмічається цитотоксичний ефект Варто підкреслити, що у випадку продукції штамом інших цитотоксинів маскується ефект дії холерогену [10] Як підкреслює О І Сальникова та ін [8], інтенсивність цих цитотоксинів багато в чому залежить від умов культивування штамів Відомий спосіб О І Сальникової та ш [8] визначення холерогену в безклітинних супернатантах бульйонних культур холерних вібріонів за характером його цитопатогенної дії на культуру оваріальних клітин китайського хом'ячка - СНО К1 Штами холерних вібріонів культивують при різних умовах (середовища різного складу, аерування, t) Для отримання супернатантів бульйонні культури центрифугують 40 хвилин при 7000 об/хв та обеззаражують гентаміцином (4 мкг/мл) РІЗНІ розведення супернатантів (1 256 і більше) вносять в об'ємі 0,05 мл в 96-луночні культуральні панелі і додають 0,05 мл суспензії клітин-мішеней СНО, суміш шкубують протягом ночі при 37С в 5% СО2Облік проводять під мікроскопом при малих збільшеннях за зміною форми 50% клітин в лунці Токсигенні штами викликають подовження клітин, а при деяких умовах культивування і цитодеструктивний ефект, що камуфлює реакцію клітин, характерну для холерогену Недоліки відомого способу 1 Неможливість виявлення структурних змін ядра і цитоплазми клітин-мішеней для холерогену, чітко диференціювати його пошкоджуючу дію при одночасній продукції досліджуваним штамом холерного вібріона інших цитотоксинів 2 Трудність визначення рівня токсинопродукцм із-за залежності синтезу холерогену від умов вирощування штаму холерного вібріона 3 Необхідність підбору режиму культивування (середовище, аерування) для вибіркової продукції токсинів індивідуальними штамами 4 Необхідність отримання супернатантів та використання їх численних розведень 5 Присутність в супернатантах продуктів розпаду та ЖИТТЄДІЯЛЬНОСТІ холерних вібріонів 6 Можливість реєстрації присутності холерогену лише при пошкоджені 50% и більше клітинмішеней в лунці В основу винаходу поставлена задача підвищити точність, інформативність і чутливість способу визначення токсигенності та рівня токсиноутворення штамів холерних вібріонів, котрий забезпечив би виявлення змін структури ядра та цитоплазми клітин-мішеней, характерних для дії холерогену і/або інших цитотоксинів, які продукує одна бляшка або колонія досліджуваного штаму холерних вібріонів Поставлене завдання досягається тим, що використовують однодобову культуру клітин HeLa, вирощених на покривних скельцях в пеніцилінових флаконах, ділянку лужного агару з двохдобовою культурою холерних вібріонів досліджуваного штаму поміщають в пеніциліновий флакон з клітинами і закріплюють на верхньому краї покривного скельця для дифузії холерогену і/або інших токсинів в культуральне середовище в умовах, які виключають безпосередній контакт вібріонів та клітин-мішеней, флакони розташовують під кутом 45° ставлять в термостат, через 8 та 24 години співкультивування при 37С клітини HeLa фіксують в розчині Буена, красять гематоксилін-еозином, препарати досліджують під світловим мікроскопом при збільшеннях 8 та 90 (окуляр 10), визначають наявність характерних для дії холерогену змін структури ядра (крупноглибчата агрегація хроматину) і цитоплазми (формування крупних вакуолей), гніздність однотипових пошкоджень Для підтвердження специфічності продукованого холерогену в ІНШІ флакони за ЗО хвилин до внесення ділянки агару з вібріонами вносять антитоксичну сироватку проти холерного екзотоксину в КІЛЬКОСТІ, здатній нейтралізувати весь токсин, який синтезує одна бляшка високотоксигенного штаму V cholerae 569В Наявність типових пошкоджень клітин HeLa тільки на препаратах без додавання сироватки в середовище співкультивування являється доказом продукції холерогену і підставою для висновку про токсигенність досліджуваного штаму холерних вібріонів У випадку необхідності визначення рівня токсиноутворення порівнюють гніздність пошкоджень (їх КІЛЬКІСТЬ на число типово пошкоджених клітин в осередках) через 8 та 24 години співкультивування клітин-мішеней та вібріонів Спосіб ефективний, високочутливий, підвищує точність та інформативність визначення токсигенності штамів холерних вібріонів, рівня їх токсиноутворення, дозволяє чітко диференціювати зміни структури ядер та цитоплазми клітин-мішеней, викликаних холерогеном та Іншими цитотоксинами холерних вібріонів, виключає необхідність підбору селективних середовищ та режимів культивування вібріонів, отримання супернатантів Спосіб пояснюють наступні фотографії фіг 1 - культура клітин HeLa після 48 годин культивування (контрольна культура), х 900 1) ядро, 2) ядерце, 3) цитоплазма, фіг 2 - морфологічні зміни клітин культури HeLa після співкультивування з vct+ штамом V cholerae classic 569B після 8 годин співкультивування, х 900 1) ядро, 2) ядерце, 3) цитоплазма, 4) конденсований хроматин, 5) цитоплазматичні тяжі, 45930 6) вакуолі, фіг 3 - морфологічні зміни клітин культури HeLa після співкультивування з vct+ штамом V cholerae classic 569B після 24 годин співкультивування, х 900 1) ядро, 3) цитоплазма, 4) конденсований хроматин, 6) вакуолі, фіг 4 - морфологічні зміни клітин культури HeLa після співкультивування з vct+ штамом V cholerae classic 569B після 24 годин співкультивування, х 900 1) ядро, 2) ядерце, 3) цитоплазма, 7) апоптотичні тільця, фіг 5 - морфологічні зміни клітин культури HeLa через 24 години після співкультивування з vet- штамом V cholerae не 01, х 900 1) ядро, 2) ядерце, 3) цитоплазма, 8) цитолізичний ефект, фіг 6 - морфологічні зміни клітин культури HeLa через 24 години після співкультивування з vet- штамом V cholerae 01, х 900 1) ядро, 2) ядерце, 3) цитоплазма, 4) конденсований хроматин, 9) примембранний хроматин, Фіг 7 Морфологічні зміни клітин культури HeLa через 24 години після співкультивування з vetштамом V cholerae не 01 в присутності антитоксичної сироватки до токсину штаму 569В (імунний цитоліз) , х 900 1) ядро, 2) цитоплазма, 6) вакуолі Спосіб виконують таким чином Використовують однодобову культуру клітин лінії HeLa (фіг 1), вирощену на покривних скельцях в пеніцилінових флаконах в ПОСІВНІЙ ДОЗІ 1,5x105 кл/мл На верхньому краї покривного скельця з клітинами закріплюють ділянку агару розміром 0,7x0,7 см, в центрі якої знаходиться бляшка або колонія досліджуваного штаму холерних вібріонів Відстань між краєм колонії та краєм вирізаної ділянки агару складає 1,5-2 мм Флакони розташовують під кутом 45° При цих умовах з культуральним середовищем стикується тільки нижній край агару, що забезпечує дифузію холерних токсинів в культуральне середовище та їх контакт з клітинами-мішенями, однак виключає безпосередній контакт вібріонів з останніми Для встановлення специфічності пошкодження клітин холерогеном в ІНШІ флакони з клітинами HeLa за ЗО хвилин до внесення ділянки агару з бляшкою або колонією холерних вібріонів додають 0,1 мл антитоксичної сироватки, здатної нейтралізувати холероген, продукований однією колонією V cholerae 569B Співкультивування вібріонів та клітин-мішеней проводять при 37°С протягом 8 та 24 годин Потім покривне скельце виймають з флакона, клітини фіксують, красять, досліджують під світловим мікроскопом послідовно при об'єктивах 8 та 90 (окуляр 10) та визначають наявність пошкоджених клітин з характерними структурними змінами цитоплазми і ядра в препаратах клітин, культивованих без специфічної антитоксичної сироватки і в и присутності Виявлення таких клітин тільки в відсутності антитоксичної сироватки є підставою для висновку про токсигенність штаму V cholerae Рівень токсиноутворення встановлюють за числом осередків пошкоджених клітин та КІЛЬКОСТІ останніх в осередку через 8 та 24 години Високотоксигенні штами викликають ГНІЗДНІ пошкодження, які включають 10 - 15 та більше характерно змінених клітин-мішеней через 24 години співкультиву вання і 3 - 5 таких клітин в осередку пошкодження через 8 годин Помірнотоксигенні штами через 24 години індукують ГНІЗДНІ пошкодження, які включають 3-5 змінених клітин-мішеней, а слаботоксигенні штами пошкоджують лиш окремі клітини Запропонованим способом були досліджені структурно-функціональні зміни культури HeLa при їх співкультивуванні з vct+ і vet- штамами V cholerae 01 Використані ЗО vct+ і 3 vet- штамів V cholerae eltor, ізольованих від людей в період епідемічних ускладнень в Миколаївській області в 1994 1995 рр , 12 vet- штамів V cholerae не ОІ, виділених від людей та із об'єктів зовнішнього середовища в період 1990 - 1994 рр та в 2000 р (колекція музею Українського протичумного інституту їм 1 1 Мечникова), а також високотоксигенний штам 569В V cholerae cholerae, люб'язно наданий д б н О Б Хайтовичем (Кримська протичумна станція) При вивчені пошкоджуючої дії токсигенних субстанцій, секретованих різними штамами V cholerae, виявлені та охарактеризовані раніш не ВІДОМІ ознаки пошкодження клітин HeLa холерним екзотоксином та іншими біологічно активними речовинами Встановлено, що холерний токсин штаму V cholerae 569B, а також 29 vct+ штамів V cholerae eltor викликають однотипні порушення морфології клітин, що специфічно нейтралізуються антитоксичною сироваткою Найбільш демонстративні структурні зміни ядер На початкових етапах патологічного процесу конденсований хроматин утворює не повні і повні кільця на периферії ядерця (фіг 2), потім формуються 1-2 ЩІЛЬНІ глибки хроматину, асоційовані з еозинофільним ядерцем (фігЗ) В цитоплазмі пошкоджених клітин виявляються крупні вакуолі (фіг 3) В окремих випадках пошкоджена клітина розпадається на фрагменти з утворенням апоптотичних тілець (фіг 4) Повна агрегація ядерного хроматину вказує на високий тропізм до нього холерного екзотоксину (фігЗ) В усіх вивчених зразках пошкоджені клітини розташовувались гніздно (від 3-5 до 10 -15 і більше клітин) Порівняльне вивчення інтенсивності продукції холерогену через 8 та 24 години співкультивування клітин та бактерій дозволило встановити, що штами V cholerae секретують різну КІЛЬКІСТЬ екзотоксину За цією ознакою вони можуть бути розділені на 3 групи інтенсивно, помірно та слабо продукуючи Активно секретуючі штами викликали пошкодження клітин уже через 8 годин На препаратах знаходили ГНІЗДНІ однотипні пошкодження клітин (2-3-5 клітин в осередку) Через 24 години КІЛЬКІСТЬ осередків збільшувалась, а число пошкоджених клітин в них досягало 5 -10 - 15 та більше Помірно продукуючи екзотоксин штами викликали пошкодження окремих клітин через 8 годин та ГНІЗДНІ з числом пошкоджених клітин в осередку 3 - 5 - 10 - через 24 години Слабо секретуючі штами індукували пошкодження окремих клітин (3, рідко 5) тільки через 24 години Із 10 досліджених токсигенних штамів V cholerae інтенсивно продукували екзотоксин 4 штами, помірно - 2 штами, слабо - 4 штами Принципово ІНШІ пошкодження були зареєстровані при співкультивуванні з клітинами HeLa З vet- штамів V cholerae 01 та 12 штамів V cholerae 45930 не 01 Виявлено 2 чітко диференційованих типи пошкодження клітин цитоліз (фіг) та зміни переважно ядерної мембрани і примембранного хроматину (фіг 6) В першому випадку спостерігали тотальну дегенерацію клітин без конденсації ядерного хроматину, а в другому - потовщення ядерної мембрани, и асоціацію з примембранним хроматином Співвідношення вказаних типів пошкоджень у різних штамів помітно варіювало з перевагою одного з них У випадку продукції токсинів, котрі викликають цитоліз, в процес деструкції втягуються всі клітини моношару, антитоксична сироватка не попереджує пошкоджень клітин продуктами vet- штамів V cholerae 01 та не 01 В и присутності розвивається особлива форма деструкції клітин - імунний цитоліз гіперхромне ядро розташовується в безструктурній цитоплазмі, її вміст виявляється в міжклітинному просторі в вигляді еозинофільної пористої маси (фіг 7) Отримані результати свідчать про наявність чіткої різниці між морфологічними проявами цитопатогенної дії екзотоксину і токсичних субстанцій, які секретують vct+ штами V cholerae 01 та vetштами V cholerae 01 і не 01, можливості визначення на цій основі токсигенності штамів V cholerae Запропонований спосіб визначення токсигенності штамів V cholerae має такі переваги 1 Виключається необхідність а) підбору селективних середовищ та аерування в процесі культивування холерних вібріонів, б) отримання супернатантів 2 Підвищується точність та чутливість визначення експресії гена ctx за рахунок виявлення характерних змін ядра та цитоплазми клітин, які рецептують холероген, специфічної нейтралізації цитопатогенної дії холерогену антитоксичною сироваткою 3 Підвищується інформативність способу за рахунок чіткої диференціації структурних змін клітин-мішеней, котрі викликає холероген та ІНШІ ЦИтотоксини холерних вібріонів 4 Дозволяє оцінити ефективність експресії гена ctx за рахунок визначення продукції холерогену однією бляшкою або колонією 5 Можливість популяційного відбору клонів з різним рівнем експресії холерогену Запропонований спосіб високочутливий, дозволяє визначити продукцію холерогену однією бляшкою або колонією холерних вібріонів, клональну однорідність штаму Метод технічно не складний, об'єктивний, може бути використаний для оцінки вірулентності штамів V cholerae в лабораторіях, де здійснюється культивування клітин Спосіб може бути високоефективним методом відбору високотоксигенних штамів ВІДОМОСТІ, ЩО підтверджують здійснення винаходу Приклад 1 Культуру клітин HeLa розсівають по 1,5 мл (10 - 15 х 10 кл/мл) в пеніцилінові флакони з покривними скельцями розміром 1x2 см і вирощують при 37°С протягом 24 годин За день до посіву або в день посіву клітин HeLa проводять посів досліджуваних штамів холерних вібріонів на чашки Петрі з лужним агаром Посів проводять петлею діаметром 1 мм легким дотиком до агару 8 на відстані 1 см один від одного Через 24 - 48 годин росту при 37°С очним пінцетом вирізають ділянку агару з бляшкою або колонією розміром 0,7x0,7 см таким чином, щоб відстань між краєм зони росту та краєм вирізаної ділянки агару складала 1,5-2 мм Вирізану ділянку очним пінцетом обережно поміщають в пеніцилінові флакони з однодобовою культурою HeLa і закріплюють його на верхньому краї покривного скла Флакони кладуть під кутом 45 ° При цьому з культуральною рідиною стикується тільки нижній край агару, що забезпечує дифузію токсину через агар в культуральну рідину, контакт токсину з клітинамимішенями і попереджує безпосередній контакт бактерій та клітин Для виявлення специфічності продукованого токсину в 2 ІНШІ флакони з клітинами HeLa за ЗО хвилин до внесення ділянки агару з бляшкою холерних вібріонів додають 0,1 мл антитоксичної холерної сироватки, здатної нейтралізувати екзотоксин, продукований однією колонією штаму V cholerae 569В Співкультивування клітинмішеней та вібріонів проводять при 37С протягом 8 та 24 годин Потім покривні скельця виймають із флаконів, клітини фіксують розчином Буена і красять гематоксилін-еозином Препарати досліджують під світловим мікроскопом послідовно при об'єктивах 8 та 90 (окуляр 10) Визначають наявність гніздних осередків клітин з характерними структурними змінами ядра і цитоплазми при співкультивуванні без і в присутності антитоксичної сироватки Виявлення осередків пошкодження клітин тільки на препаратах клітин, які співкультивувались в відсутності антитоксичної сироватки, вказує на продукцію холерним вібріоном холерогену і є підставою для висновку про токсигенність досліджуваного штаму Для визначення ефективності експресії гена ctx (рівня токсиноутворення) препарати досліджують через 8 та 24 години Співкультивування клітин-мішеней та вібріонів Високотоксигенні штами викликають ГНІЗДНІ пошкодження, які включають 10 -15 та більше характерно змінених клітин-мішеней через 24 години співкультивування і 3 -5 таких клітин в осередку пошкодження через 8 годин Помірнотоксигенні штами через 24 години індукують ГНІЗДНІ пошкодження, які включають 3-5 змінених клітин-мішеней, а слаботоксигенні штами пошкоджують лиш окремі клітини Нетоксигенні штами V cholerae 01 не викликають розвитку характерних для холерогену змін ядра та цитоплазми, їх цитотоксичний ефект не нейтралізується антитоксичною сироваткою проти холерного екзотоксину Література 1 Смирнова Н И , Кокушкин А М Эпидемически значимые штаммы холерного вибриона генетические особенности и возникновение // Мат засед Проблемной комиссии 46 04 «Холера и патогенные для человека вибрионы» Межведомственного научного совета по сан - эпид охране терр РФ , Р -на-Д -1999 - Вып №12 - С 45-46 2 Лобанов В В , Мазурхо Б Л , Сальникова О И , Алексеева Л П Разработка системы оценки токсинообразования у холерных вибрионов in vitro // Мат засед Проблемной комиссии 46 04 «Холера и патогенные для человека вибрионы» Межве 45930 домственного научного совета по сан -эпид охране терр РФ,Р-на-Д -1999-Вып №12-С 6870 3 Reeves Р R , Lan R Cholera in the 1990s // Brtsh Med Bull -1998 -V 54, No 3-P С 611-623 4 Хайтович А Б , Подосинникова Л С , Ильичев Ю А и др Оценка вирулентных свойств V cholerae 01 с помощью методов in vitro // Журн микробиол -1997 - №3 -С 7-Ю 5 Мазурхо А Б , Михась Н К , Монахова Е В , Рожков К К Определение оптимальных условий продукции ряда факторов патогенности холерных вибрионов // Журн микробиол - 2000 - №1 - С 21-24 6 Методические рекомендации по определению способности холерных вибрионов продуцировать термолабильный энтеротоксин №28 - 6/20 Гл упр карантинных инф 10 06 85 / М-во здравоохр СССР - Р -на-Д , 1986 7 Nair G В , Takeda Y Detection of toxins of Vi 10 brio cholerae Ol and non-OI // Vibrio cholerae and cholera Molecular to global perspectives - Washington, D С ASM Press -1994 - P С 53-67 8 альникова О И , Лобанов В В , Шиманюк Н Я Использование культуры клеток СНО при изучении холерных вибрионов, выращенных в различных условиях // Микробиол журн - 1991 Вып 53, №6 - С 94-97 9 Карагазова А В , Сальникова О И Экспрессия патогенных свойств холерных вибрионов 0139 серогруппы in vitro //Журн микробиол -2000-ЖЗС 7-Ю 10 Kaper J B , Brandford H B , Roberts N C , Falkow S Molecular Epidemiology of Vibrio cholerae in the U S Gulf // J d m Microbiol -1982-No 7 P 129-134 11 Iwanaga M , Kuyyakanond T Large production of cholerae toxin by Vibrio cholerae Ol in yeast extract peptone water // J Clm Microbiol - 1987 N o 2 5 - P 2314-2316 45930 >Ir, 7 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 12
ДивитисяДодаткова інформація
Автори англійськоюStopchanska Alla Hryhorivna, Pushkina Valentyna Olelsandrivna, Pylypenko Natalia Vasylivna
Автори російськоюСтопчанская Алла Григорьевна, Пушкина Валентина Александровна, Пилипенко Наталия Васильевна
МПК / Мітки
МПК: C12N 5/16, G01N 21/75, C12N 1/20, C12R 1/63, C12Q 1/02
Мітки: визначення, спосіб, токсигенності, холерних, вібріонів
Код посилання
<a href="https://ua.patents.su/6-45930-sposib-viznachennya-toksigennosti-kholernikh-vibrioniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення токсигенності холерних вібріонів</a>
Попередній патент: Спосіб діагностики карієсрезистентності зубів
Наступний патент: Газ для зварювання та різання металів
Випадковий патент: Спосіб отримання модифікованого алкідного зв'язуючого