Спосіб одержання поліфункціональних похідних 1,2,4-триазолу
Номер патенту: 70706
Опубліковано: 25.06.2012
Автори: Сливка Михайло Васильович, Усенко Руслан Миколайович, Лендєл Василь Георгійович
Формула / Реферат
Спосіб одержання поліфункціональних похідних 1,2,4-триазолу формули (I) 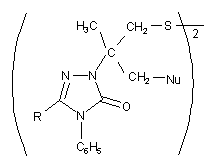 , який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що на першій стадії використовують металільні похідні формули (II)
, який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що на першій стадії використовують металільні похідні формули (II) 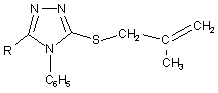 , які взаємодіють з галогенами (Вr2 або І2), після чого утворений конденсований органічний катіон (III)
, які взаємодіють з галогенами (Вr2 або І2), після чого утворений конденсований органічний катіон (III) 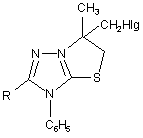 піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu = ОН, NAlk2; R = Ar, Alk; Hlg = Br, I.
піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu = ОН, NAlk2; R = Ar, Alk; Hlg = Br, I.
Текст
Реферат: Спосіб одержання поліфункціональних похідних 1,2,4-триазолу включає нуклеофільне розщеплення модельного конденсованого гетероциклу, причому на першій стадії використовують металільні похідні, які взаємодіють з галогенами (Вr2 або І2), після чого утворений конденсований органічний катіон піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk 2. UA 70706 U (12) UA 70706 U UA 70706 U 5 10 15 20 25 Корисна модель належить до органічної хімії, а саме до способів одержання поліфункціональних похідних 1,2,4-триазолу. Відомі кілька підходів при функціоналізації симетричних триазолів. Для введення функціональних груп широко використовується спосіб функціоналізації алкільних замісників трансмутацією наявних функціональних груп [1]. Цей прийом успішно використовується при відносній стабільності модельного гетероциклу та відсутності в його складі інших функціональних груп чи замісників, які здатні до перетворень в умовах реакції. Також використовують спосіб, який передбачає введення функціональної групи в складі нуклеофільного реагенту, яким діють на модельний триазол [2]. Цей метод є прийнятний лише у випадку наявності активного реакційного центру в складі вихідного гетероциклу і основним недоліком цього способу є важкодоступність реагентів, що містять необхідну для введення в гетероцикл функціональну групу. Найбільш близьким за технічною суттю до заявлюваного є спосіб одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів, який включає в себе нуклеофільне розщеплення модельного конденсованого гетероциклу [3]. Цей прийом характеризується введенням у вихідний гетероцикл вінільного фрагменту і меркаптогрупи. Основним обмеженням цього способу є присутність у вихідному конденсованому триазолтіоні метінового протону, що спричинює при дії нуклеофільних реагентів елімінування останнього з утворення виключно вінільного фрагменту. Задачею корисної моделі є розробка загального підходу одержання поліфункціональних похідних 1,2,4-триазолу, який характеризується універсальністю, простотою експерименту, доступністю реагентів та високими виходами, так як відомі методи функціоналізації гетероциклів є неприйнятними для їх синтезу. Поставлена задача вирішується таким чином, що в способі одержання поліфункціональних похідних 1,2,4-триазолу формули (І) CH2 H3C S CH2 Nu 2 C N N O N R C6H5 , який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що на першій стадії використовують металільні похідні формули (II) N N S N R CH2 C CH2 CH3 C6H5 30 , які взаємодіють з галогенами (Вr2 або І2), після чого утворений конденсований органічний катіон (ІІІ) CH3 CH2HIg N N S R N C6H5 35 піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=ОН, NAlk 2; R=Ar, Alk; Hlg=Br, I. Модельним об'єктом для досліджень було використано металільні тіоетери 4,5дизаміщеного-1,2,4-триазолу (2), які можна отримати реакцією алкілування триазол-3-тіону (1). Для штучного створення активного реакційного центру - позитивно зарядженого атому нітрогену 1 UA 70706 U 5 10 15 - було вибрано прийом електрофільної галогеногетероциклізації металільних похідних (2), який характеризується простотою виконання, доступністю реактивів та високими виходами. В результаті отримують поліконденсовані тіазолотриазоли (3) з позитивно зарядженим гетероатомом, що не містять атом гідрогену в α-положенні до позитивно зарядженого гетероатому і до галогенометильної групи. Суть розробленого способу функціоналізації системи 1,2,4-триазолу полягає в тому, що дія нуклеофільних реагентів різної природи призводить виключно до нуклеофільного заміщення атому галогену на фрагмент діючого нуклеофілу (чи конкурентного нуклеофілу середовища, в якому проводять синтез), яке супроводжується руйнуванням поліциклічної системи (3) з селективним формуванням поліфункціональних похідних 1,2,4-триазолу (4). Склад синтезованих поліфункціональних похідних 1,2,4-триазолу (4) підтверджено даними елементного аналізу; індивідуальність методом тонкошарової хроматографії (ТШХ); будову доведено методом спектроскопії ядерного магнітного резонансу на ядрах протону та ІЧ спектроскопією. Приклад 1 Схема функціоналізації на основі 3-металілтіо-4,5-дизаміщеного-1,2,4-триазолу (2) H N R 1) NaOH 2) ClCH2C(CH3)=CH2 N S N N CH2 S C R N CH2 O N Nu CH3 30 35 40 CH2HIg HIg N 1) H-Nu 2) H2O N S N R C6H5 3 4 25 CH2 HIg2 2 C6H5 20 C CH3 C6H5 2 H3C CH2 S N R C6H5 1 N N Nu=OH, NAlk2; R=Ar, Alk; Hlg=Br, I. 3-S-Металілтіо-4-феніл-1,2,4-триазол (2). Триазол (1) (0,054 моль) [4] розчиняють в розчині гідроксид калію (0,054 моль) в етанолі при нагріванні. Після охолодження до кімнатної температури, добавляють металілхлорид (0,092 моль) в 5 мл етанолу. Суміш нагрівають на водяній бані протягом 1 години. Кінцевий продукт, який випадає в осад після охолодження реакційної суміші, відфільтровують і перекристалізовують в етанолі. 3-S-Металілтіо-4,5-дифеніл-1,2,4-триазол (2a). Кристали білого кольору. Вихід 70 %, Ттопл 138-140 °C. Rf=0,88 (ізопропанол:гексан=5:1). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,70 с (3Н, СН3), 3,76 с (2Н, СН2), 4,87 д (2Н, =СН2), 7,35-7,55 м (10Н, 2С6Н5). Знайдено, %: N 13,74. C18H17N3S. Вирахувано, %: N 13,68. 5-Бензил-3-S-металілтіо-4-феніл-1,2,4-триазол (2б). Вихід 41 %. Ттопл 78-80 °C. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 1,65 с (3Н, СН3), 3,65 с (2Н, СН2), 3,99 с (2Н, CH2Ph), 4,79 д (2Н, =СН2, 13), 6,89-7,53 м (10Н, 2С6Н5). Знайдено, %: N 13,10. C19H19N3S. Вирахувано, %: N 13,08. 3-S-Металілтіо-5-n-нітрофеніл-4-феніл-1,2,4-триазол (2в). Вихід 57 %. Ттопл 172-173 °C. Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц): 1,72 с (3Н, СН3), 3,82 с (2Н, СН2), 4,85 с (1Н, =СН2), 4,94 с (1H, =СН2), 7,48, 7,61, 8,20 3 м (9Н, С6Н5, С6Н4). Знайдено, %: N 16,11. C18H16N4O2S. Вирахувано, %: N 15,90. 6-Бромометил-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло[3,2-b]-[1,2,4]триазол-7-ій броміди (3а-в). Розчиняють S-металіл-1,2,4-триазол (2) (0,0033 моль) в 15 мл льодяної оцтової кислоти. Бром (0,0066 моль) розчиняють в 5 мл СН3СООН. При постійному перемішуванні повільно прикопують розчин брому до розчину триазолу (2). Перемішують протягом 2 годин. Утворену смолу розтирають у ацетоні. Продукт перекристалізовують в льодяній оцтовій кислоті. 6-Бромометил-6-метил-2,3-дифеніл-5,6-дигідро-3H[1,3]тіазоло[3,2-b][1,2,41триазол-7-ій бромід (3а). Вихід 62 %. Ттопл 300-303 °C. Rf=0,52 (оцтова кислота:етанол:гексан=1:3:2). Спектр 2 UA 70706 U 5 10 15 20 25 30 35 40 45 50 55 60 ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 2.01 с (3Н, СН 3), 4,31 с (2Н, СН2 цикл), 4,43-4,54 к (2Н, СН2Вr, 13 7,7), 7,50-7,72 м (10Н, 2С6Н5). Спектр ЯМР С в ДМСО-Д6 (δ, м. ч.): 23,26, 37,89, 48,20, 69,11, 123,88, 126,85, 129,55, 129,91, 131,42, 132,43, 132,62, 132,96, 154,47, 160,05. Знайдено, %: N 9,05. C18H15Br2N3S. Вирахувано, %: N 8,99. 2-Бензил-6-бромометил-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло[3,2-b][1,2,4]триазол-7-ій бромід (36). Вихід 56 %. Ттопл 278-280 °C. Rf=0,75 (оцтова кислота:етанол:гексан=1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,89 с (3Н, СН3), 4,18 к (2Н, СН2 цикл, 12,3), 4,30 с (2Н, CH2Ph), 4,33-4,42 к (2Н, СН2Вr, 2,7), 7,09-7,77 м (10Н, 2С6Н5). Знайдено, %: N 8,71. C19H17Br2N3S. Вирахувано, %: N 8,77. 6-Бромометил-2-(4-нітрофеніл)-6-метил-3-феніл-5,6-дигідро-3H-[1,3]тіазоло[3,2b][1,2,4]триазол-7-ій бромід (3в). Вихід 46,2 %. Ттопл 259-261 °C. Rf=0,63 (оцтова кислота:етанол:гексан=1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,96 с (3Н, СН3), 4,24 м (2Н, СН2 цикл), 4,44 м (2Н, СН2Вr), 7,62, 8,34 2м (9Н, С6Н5, С6Н4). Знайдено, %: N 10,82. C18H16Br2N4O2S. Вирахувано, %: N 10,94. 6-(Йодометил)-6-метил-2,3-дифеніл-5,6-дигідро-3H-[1,31тіазоло[3,2-b][1,2,4]триазол-7-ій йодид (3г). Розчиняють тіоефір (2а) (0,0016 моль) в 15 мл етанолу або в 10 мл хлороформі. Йод (0,0033 моль) розчиняють в мінімальній кількості етанолу (55 мл) або хлороформу (45 мл). Прикопують розчин йоду при перемішуванні до розчину триазолу (2а). Суміш перемішують 7 діб. Випарують розчинник. Смолу, яка утворюється, розчиняють в ДМФА. Добавляють еквімолярну кількість калій йодиду (0,0016 моль). Перемішують 2 години. Фільтрують. Осад промивають водою. Продукт нагрівають в хлороформі протягом 5 годин. Вихід 58 % (етанол). Вихід 59 % (хлороформ). Ттопл 247-250 °C. Rf=0,67 (оцтова кислота:етанол:гексан=1:3:2). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,98 с (3Н, СН3), 3,98 с (2Н, СН2 цикл), 4,36-4,45 к (2Н, CH2 J, 3,7), 7,43-7,70 м (10Н, 2С6Н5). Знайдено, %: N 7,34. C18H15I2N3S. Вирахувано, %: N 7,49. 1-{2-Гідрокси-1-[3-гідрокси-2-метил-2-(5-оксо-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-1іл)пропілдисулфанілметил]-1-метилетил}-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-5-он (4а). Розчиняють монобромід (3) (0,00062 моль) в 5 мл ДМФА, гідроксид калію у 10 мл води. Розчин лугу доливають до розчину триазолу при перемішуванні. Перемішують протягом 2 годин. Вихід 95 %. Ттопл 165-167 °C. Rf=0,77 (ізопропанол:гексан=5:1). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,92 с (3Н, СН3), 3,12 с (2Н, CH2S), 4,16 с (2Н, СН2 цикл), 7,30-7,45 м (10Н, 2С6Н5). Знайдено, %: N 12,32. C36H36N6O4S2. Вирахувано, %: N 12,35. 1-(1-Метил-2-[2-метил-3-морфоліно-2-(5-оксо-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-1іл)пропілдисулфаніл1-1-морфолінометилетил}-3,4-дифеніл-4,5-дигідро-1Н-1,2,4-триазол-5-он (4б). Тіазолотриазолієву сіль (3) (0,0009 моль) розчиняють в 5 мл морфоліну, перемішують протягом 4 години. Розбавляють водою, фільтрують і перекристалізовують в ацетоні. Вихід 83 %. Ттопл 193-194 °C. Rf=0,15 (ізопропанол:гексан=1:5). Спектр ПМР в ДМСО-Д6 (δ, м. ч., J, Гц), 1,80 с (3Н, СН3), 2,21 с (4Н, 2СН2Nцикл), 2б87 с (2Н, CH2S), 3,35-3,48 м (6Н, 2СН2Оцикл, -1 CH2N), 7,36-7,56 м (10Н, 2С6Н5). ІЧ спектр (v, см ): 710 ср (CH2-S); 1590 с (С=О). Знайдено, %: N 13,72. C44H52N8O4S2. Вирахувано, %: N 13,69. Таким чином, було розроблено прийом взаємодії штучно створеного реакційного центру з нуклеофільними реагентами, що забезпечило проведення функціоналізації 1,2,4-триазолів при звичайних умовах чи помірному нагріванні без використання важкодоступних реагентів та складного апаратурного оформлення. Використання запропонованого способу нуклеофільного розщеплення отриманих електрофільною галогеноциклізацією металілтіотриазолів конденсованих тіазолотриазолів з позитивно зарядженим гетероатомом забезпечує селективність утворення поліфункціональних похідних, для синтезу яких відомі методи функціоналізації є неприйнятними. Спосіб однозначно діє як у випадку дії нуклеофільних реагентів різної природи, тому може бути використаний як загальний для функціоналізації 1,2,4-триазолів. Корисна модель може бути використана у науково-дослідних хімічних та хімікофармацевтичних лабораторіях. Джерела інформації: 1. Mazzone G., Bonina F., Blandino G. 3-Methylthio-, 3-(substituted-amino)ethylthio-, 3carboxymethylthio-, 3,3'-(dithiobis)-5-aryl-4H(R)-1,2,4-triazoles and N-substituted 2-aminomethyl derivatives of 5-агуl-4H(R)-1,2,4-triazoline-3-thiones: synthesis and biological activity // Farmaco Ed. Sci. - 1981. - V.36, №12. - P. 1004-1018. CA: (96) 122698m. 2. E.S.H.El Ashry, A.A. Kassem, H. Abdel-Hamid, F.F. Louis, Sh. A. Khattab, and M.R. Aouad. Synthesis and Alkylation of 5-(3-Chlorobenzo[b]thien-2-yl)-4H-1,2,4-triazole-3-thiol Under Classical and Microwave Conditions. // J. Heterocycl. Chem. - 2006. - V. 43. - №№11-12. - P. 1427-1430. 3 UA 70706 U 5 3. Патент (Україна), заявка №89300 C2 (Україна), МПК С07В 41/00, С07В 43/00, С07D 513/00, C07D 249/00. Спосіб одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів. / М.В. Сливка, Мар. В. Сливка, P.M. Усенко, В.Г. Лендєл / Заявл. 10.09.2008. Опубліковано 11.01.2010, Бюл. №17, 14 с. - Прототип. 4. С.М. Хрипак, В.И. Станинец, М.В. Сливка, Ю.Л. Зборовский. Окислительная гетероциклизация натриевых солей 3-меркапто-4-фенил-3Р-1,2,4-триазолов. // Укр. Хім. Журн. 2001. - т. 67, №4. - С. 110-113. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 Спосіб одержання поліфункціональних похідних 1,2,4-триазолу формули (I) CH2 S CH2 H3C Nu 2 C N N O N R C6H5 , який включає нуклеофільне розщеплення модельного конденсованого гетероциклу, який відрізняється тим, що на першій стадії використовують металільні похідні формули (II) N S N R 15 N CH2 C CH2 CH3 C6H5 , які взаємодіють з галогенами (Вr2 або І2), після чого утворений конденсований органічний катіон (III) CH3 CH2HIg N N S R N C6H5 20 піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, які являють собою NaOH, HNAlk2, причому фрагментами Nu, R, Hlg є: Nu=ОН, NAlk2; R=Ar, Alk; Hlg=Br, I. Комп’ютерна верстка А. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 1,2,4-triazole polyfunctional derivatives
Автори англійськоюSlyvka Mykhailo Vasyliovych, Usenko Ruslan Mykolaiovych, Lendiel Vasyl Heorhiiovych
Назва патенту російськоюСпособ получения полифункциональных производных 1,2,4-триазола
Автори російськоюСливка Михаил Васильевич, Усенко Руслан Николаевич, Лендел Василий Георгиевич
МПК / Мітки
МПК: C07B 41/00, C07B 43/00, C07D 249/00, C07B 45/00
Мітки: похідних, поліфункціональних, одержання, 1,2,4-триазолу, спосіб
Код посилання
<a href="https://ua.patents.su/6-70706-sposib-oderzhannya-polifunkcionalnikh-pokhidnikh-124-triazolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання поліфункціональних похідних 1,2,4-триазолу</a>










