Спосіб одержання n-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів
Номер патенту: 89300
Опубліковано: 11.01.2010
Автори: Сливка Михайло Васильович, Усенко Руслан Миколайович, Сливка Марина Василівна, Лендєл Василь Георгійович
Формула / Реферат
Спосіб одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів формули (І)
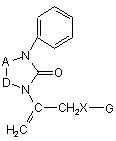 (І),
(І),
який включає взаємодію нуклеофільних реагентів із гетероциклічними системами, який відрізняється тим, що на першій стадії сполука формули (II)
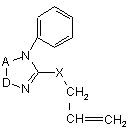 (ІІ)
(ІІ)
взаємодіє з Вr2, після чого утворену сполуку (III)
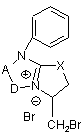 (ІІІ)
(ІІІ)
піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти (Nucl), якими є NaOH, Na2CO3, HNAlk2 (Н2О),
причому фрагментами A-D, X, G є:
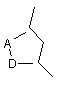 означає
означає 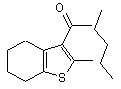 ,
,
Nucl являє собою NaOH, Na2CO3, X означає O, G означає H;
 означає
означає 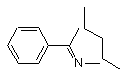 ,
,
Nucl означає NaOH, Na2CO3, HNAlk2 (Н2О), X означає S та
G означає 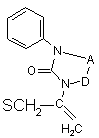 .
.
Текст
Спосіб одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів формули (І) 2 3 N O SCH2 G означає 89300 4 A N D C H2C . Винахід відноситься до органічної хімії, а саме до способів одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів. Відомі три підходи при функціоналізації гетероциклічних систем різної природи. Для введення різної природи алкільних, алкен(-ін)ільних та арільних (гетарільних) замісників в гетероциклічні системи широко використовують спосіб їх попереднього введення до стадії утворення відповідного гетероциклу [1]. Для вказаної природи замісників цей спосіб являється в цілому універсальним і характеризуються високими виходами. Однак, авторами відмічається, що при спробі введення таким чином функціональних груп, спостерігається зменшення виходу функціональних похідних гетероциклів (внаслідок втрати селективності процесу на стадії гетероциклізації). Також використовується спосіб функціоналізації алкільних замісників трансмутації функціональних груп гетероциклічних систем [2]. Цей прийом успішно використовується при відносній стабільності модельного гетероциклу та відсутності в його складі інших функціональних груп чи замісників, які здатні до перетворень в умовах реакції. Найбільш близьким за технічною сутністю до заявляємого є спосіб, який включає в себе взаємодію нуклеофільних реагентів із гетероциклічними системами [3]. Цей прийом характеризується введенням функціональної групи в складі реагенту, з яким вихідний гетероцикл взаємодіє, і є прийнятний лише у випадку наявності активного реакційного центру в складі вихідного гетероциклу (для забезпечення селективності процесу м'якими умовами проведення реакції). Основним недоліком цього способу є важкодоступність реагентів, що містять необхідну для введення в гетероцикл функціональну групу. Окрім цього, авторами відмічається зменшення виходів цільових функціональних похідних гетероциклів збільшенні числа реакційних центрів в їх складі та при ускладненні будови реагентів чи збільшенні в їх складі числа функціональних груп (фрагментів), що пояснюється втратою селективності процесу в цих випадках описаний спосіб оперує як правило використанням високоселективних реагентів чи спеціальних умов реакції, що призводить до ускладнення експерименту. Завданням винаходу є розробка загального підходу одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклічних систем різної природи, який характеризується простотою експерименту, доступністю реагентів та високими виходами, так як відомі методи функціоналізації гетероциклів є неприйнятними для їх синтезу. Поставлене завдання досягається таким чином, що в способі одержання N-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів формули (І) , який включає взаємодію нуклеофільних реагентів із гетероциклічними системами, який відрізняється тим, що на першій стадії сполука формули (II) взаємодіє з Br2, після чого утворену сполуку (III) піддають нуклеофільному розщепленню, використовуючи нуклеофільні реагенти, якими є NaOH, Na2CO3, HNAlk2 (Н2О), де фрагментами X, G, A-D є: 5 89300 6 Модельним об'єктами для досліджень було використано алільний етер тієно[2,3-d]піримідин2,4-діону (1) (представник -електронодефіцитних гетероциклічних систем) та похідні 3-алкілтіо-4аліл-1,2,4-триазолу (2), 3-алілтіо-4,5-дифеніл1,2,4-триазол (3) (представники електронодонорних гетероциклічних систем), які можна отримати майже з кількісними виходами методами, описаними в роботах [1-3]. Для штучного створення активного реакційного центру - позитивно заряджених атомів Нітрогену та Сульфуру було обрано прийом електрофільної галогеногетероциклізації алільних похідних (1-3), який характеризується простотою виконання, доступністю реактивів та високими (іноді кількісними) виходами [4]. В результаті отримують поліконденсовані гетероцикли з позитивно зарядженим гетероатомом, що містять атом Гідрогену в α-положенні як до позитивно зарядженого гетероатому, так і до галогенометильної групи. Суть розробленого способу функціоналізації гетероциклічних систем полягає в тому, що дія нуклеофільних реагентів різної природи призводить з одного боку до нуклеофільного заміщення атому галогену на фрагмент діючого нуклеофілу (чи конкурентного нуклеофілу середовища, в якому проводять синтез); а з іншого боку завдяки основності нуклеофілу відбувається елімінування атому Гідрогену в α-положенні до позитивно зарядженого гетероатому, яке супроводжується руйнуванням поліциклічної системи з формуванням вихідного гетероциклу (1-3) та утворенням подвійного зв'язку в α-положенні до фрагменту нуклеофілу та гетероциклу - тобто, відбувається утворення вінільних функціональних похідних тієно[2,3-d]піримідин-2,4-діону та 1,2,4триазолу. Причому, відмічається утворення вінільних функціональних похідних різного характеру, залежно від природи нуклеофільного реагенту, умов синтезу та природи штучно створеного активного реакційного центру. Склад синтезованих вінільних похідних гетероциклічних систем (1b,с, 2b,c,d', 3b) підтверджено даними елементного аналізу; індивідуальність методом тонкошарової хроматографії (ТШХ); будову доведено методом інфрачервоної спектроскопії (ІЧ) в таблетках калій броміду та методом спектроскопії протонного магнітного резонансу (ПМР) високого розрішення (300МГц). Приклад 1. Схема функціоналізації на основі алільного етеру тієно[2,3-d]-піримідин-2,4-діону (1). 1-(2H-3-Оксетеніл)-3-феніл-1,2,3,4,5,6,7,8октагідробензо[4,5]тієно-[2,3-d]піримідин-2,4-діон (1b). Α. 0.50г (0.001моль) моноброміду 1a розчиняють при нагріванні в 20мл диметилсульфоксиду (ДМСО); до отриманого розчину при постійному перемішуванні добавляють розчин 0.53г (0.005моль) натрій карбонату в 5мл води. Реакційну суміш перемішують при нагріванні до 70-80°С протягом 4 годин, після чого із реакційної суміші осаджують продукти гідролізу додаванням до останньої 100мл охолодженої води. Потім осад відфільтровують й промивають 50мл теплої води, підкисленої 1мл кислоти оцтової. Цільовий продукт 7 89300 8 реакції нагрівають до кипіння в етанолі; осад, який виділявся при охолодженні, кристалізують із етанолу чи диметилформаміду (ДМФА). Вихід 0.10г (29%). Б. 0.50г (0.001моль) моноброміду 1а розчиняють при нагріванні в 20мл ДМСО. До охолодженого до кімнатної температури розчину при постійному перемішуванні додають розчин 0.08г (0.002моль) натрій гідроксиду в 5мл води. Реакційну суміш перемішують при кімнатній температурі протягом 1 години, після чого із реакційної суміші осаджують продукти гідролізу додаванням до останньої 100мл охолодженої води. Потім осад відфільтровують й промивають 50мл теплої води. Твердий залишок нагрівають до кипіння в етанолі; осад, який виділявся при охолодженні, кристалізують із етанолу чи ДМФА. Вихід 0.09г (26%). В. Синтез і виділення цільового продукту реакції аналогічні прийому Б, тільки реакцію проводять при нагріванні до 70-80°С протягом 1 години. Вихід 0.11г (32%). Кристали без кольору, Ттопл. 219-220°С (А, Б, В, ДМФА), 215-216°С (А. В, этанол), Rf0.S5. ІЧ спектр, ν, см-1: 1680 с (С=О). Спектр ЯМР 1Н, δ, м.д.: 1.76 м (4Н, 2СН2), 2.71 м (2Н, СН2), 2.76 м (2Н, СН2), 5.89 с (2Н, СН2 цикл), 7.23-7.52 м (5Н, С6Н5, 1Н, =СНцикл). Знайдено, %: С 64.51; Η 4.51; N 8.02; S 9.00. C19H16N2O2S. Вирахувано, %: С 64.77; Η 4.55; Ν 7.95; S 9.09. 1-(1-Гідроксиметилвініл)-3-феніл1,2,3,4,5,6,7,8-октагідробензо-[4,5]-тієно[2,3d]піримідин-2,4-діон (1с). A. 0.50г (0.001моль) моноброміду 1а розчиняють при нагріванні в 20мл ДМСО; до отриманого розчину при постійному перемішуванні добавляють розчин 0.53г (0.005моль) натрій карбонату в 5мл води. Реакційну суміш перемішують при нагріванні до 70-80°С протягом 4 годин, після чого із реакційної суміші осаджували продукти гідролізу додаванням до останньої 100мл охолодженої води. Потім осад відфільтровують й промивають 50мл теплої води, підкисленої 1мл кислоти оцтової. Цільовий продукт реакції нагрівають до кипіння в етанолі, осад, який виділявся при охолодженні, відділяють, а із фільтрату водою виділяють осад, який кристалізують із 50%-ного водного розчину етанолу. Вихід 0.24г (69%). Б. 0.50г (0.001моль) моноброміду 1а розчиняють при нагріванні в 20мл ДМСО. До охолодженого до кімнатної температури розчину при постійному перемішуванні додають розчин 0.08г (0.002моль) натрій гідроксиду в 5мл води. Реакційну суміш перемішують при кімнатній температурі протягом 1 години, після чого із реакційної суміші осаджують продукти гідролізу додаванням до останньої 100мл охолодженої води. Потім осад відфільтровують й промивають 50мл теплої води; цільовий продукт реакції нагрівають до кипіння в етанолі, осад, який виділявся при охолодженні, відділяють, а фільтрат упарюють і твердий залишок кристалізують із системи розчинників ацетон гексан, 2:1. Вихід 0.11г (32%). B. Синтезу і виділення цільового продукту реакції аналогічні прийому Б, тільки реакцію проводять при нагріванні до 70-80°С протягом 1 години. Вихід 0.17г (49%). Кристали без кольору, Ттопл. 148-149°С (а), 141-143°С (б, в), Rf 0.78. ІЧ спектр, ν, см-1: 34003600 ш (О-Н), 1680 с (С=О). Спектр ЯМР 1Н, δ, м.ч.: 1.75 м (4Н, 2СН2), 2.69 м (2Н, СН2), 2.76 м (2Н, СН2), 4.81-4.83 м (2Н, СН2), 5.78 с (1Н, =СН2), 6.14 с (1Н, =СН2), 7.25-7.51 м (5Н, С6Н5). Знайдено,%: С 64.11;Н 5.11;N 7.97;S 9.09. C19H18N2O3S. Вирахуваного: С 64.41;Н 5.08;N 7.91;S 9.04. Приклад 2. Схема функціоналізації на основі 3-алкілтіо-4аліл-1,2,4-триазолів (2) 4-(3,3'-N,N'-R2,R3-Амінопропен-1-іл)-5-(4нітрофеніл)-3-R1-тіо-1,2,4-триазоли (2b1, 2b2, 2b3, 2b4). Сіль 2a (3ммоль) розчиняють при нагріванні в 15мл відповідного вторинного аміну і витримують 6-8 годин при температурі 20-25°С. Надлишок аміну відганяють у вакуумі (20мм рт.стовпч.); залишок промивають теплою водою; перекристалізацію проводять в ацетоні. 3-Метилтіо-5-(4-нітрофеніл)-4-(3-Nпіперидинілпропен-1-іл)-1,2,4-триазол (2b1). Кристали жовтого кольору. Вихід 57.0%, Ттопл. 132-1 s 133°С. ІЧ спектр (ν, см ): 765, 1355 ( NO2), 1530 (asNO2), 1610. Спектр ПМР в ДМСО-D6 (δ, м.д., J, Гц): 1.32-1.51 м (6Н, 3СН2); 2.34 м (4Н, 2СН2); 2.70 с (3Н, СН3); 3.06 д (2Н, СН2, 6.6); 6.01 м (1Н, СН); 6.80 д (1H, СН, 13.8); 7.99, 8.35 2д (4Н, 4-C6H4NO2, 9 8.7, 8.7). Знайдено, %: С 56.78; Η 5.84; Ν 19.65; S 8.94. C17H21N5O2S. Вирахувано, %: С 56.82; Η 5.85; Ν 19.50; S 8.91. 3-Метилтіо-4-(3-N-морфолінілпропен-1-іл)-5(4-нітрофеніл)-1,2,4-триазол (2b2). Кристали жовтого кольору. Вихід 61.0%, Ттопл. 163-164°С. ІЧ -1 s as спектр (ν, см ): 765, 1355 ( NO2), 1530 ( NO2), 1610. Спектр ПМР в ДМСО-D6 (δ, м.д., J, Гц): 2.39 т (4Н, 2СН2, 4.5); 2.70 с (3Н, СН3); 3.12 д (2Н, СН2, 6.9); 3.56 т (4Н, 2СН2, 4.8); 6.03 м (1Н, СН); 6.84 д (1H, СН, 14.1); 7.99, 8.35 2д (4Н, 4-C6H4NO2, 8.7, 8.7). Знайдено, %: С 53.22; Η 5.24; Ν 19.47; S 8.83. C16H19N5O3S. Вирахувано, %: С 53.19; Η 5.26; Ν 19.39; S 8.86. 5-(4-Нітрофеніл)-3-(-N,N'піперидинілкарбамоїлометилтіо)-4-(3-Nпіперидинілпропен-1-іл)-1,2,4-триазол (2b3). Кристали жовтого кольору. Вихід 61.0%, Ттопл. 158-1 s 159°С. ІЧ спектр (ν, см ): 760, 1350 ( NO2), 1530 as ( NO2), 1605, 1645. Спектр ПМР в ДМСО-D6 (δ, м.д, J, Гц): 1.32-1.61 м (12Н, 6СН2); 2.34 м (4Н, 2СН2); 3.08 д (2Н, СН2, 6.6); 3.47 м (4Н, 2СН2); 4.38 с (2Н, SCH2); 6.02 м (1H, СН); 6.85 д (1H, СН, 13.5); 8.00, 8.36 2д (4Н, 4-C6H4NO2, 8.7, 8.7). Знайдено, %: С 58.54; Η 6.33; Ν 18.02; S 6.67. C23H30N6O3S. Вирахувано, %: С 58.72; Η 6.38; Ν 17.87; S 6.81. 3-(N,N'-Морфолінілкарбамоїлометилтіо)-4-(3N-морфолінілпропен-1-іл)-5-(4-нітрофеніл)-1,2,4триазол (2b4). Кристали жовтого кольору. Вихід 59.0%, Ттопл. 141-142°С. ІЧ спектр (ν, см-1): 760, 1350 (sNO2), 1530 (asNO2), 1610, 1645. Спектр ПМР в ДМСО-D6 (δ, м.д., J, Гц): 2.40 т (4Η, 2СН2, 4.5); 3.13 д (2Н, СН2, 6.0); 3.45-3.68 м (12Н, 6СН2); 4.38 с (2Н, СН2); 6.05 м (1Н, СН); 6.89 д (1Н, СН, 13.5); 8.00, 8.36 2д (4Н, 4-C6H4NO2, 8.7, 8.7). Знайдено, %: С 53.01; Η 5.44; Ν 17.91; S 6.68. C21H26N6O5S. Вирахувано, %: С 53.16; Η 5.49; Ν 17.72; S 6.75. 3-Метилтіо-5-(4-ттрофеніл)-4-(3-N5 піролідинілпропен-1-іл)-1,2,4-триазол (2b ). Сіль 2а (3ммоль) розчиняли при нагріванні в 15мл піролідину і витримували 6 годин при температурі 2025°С. Надлишок аміну відганяли у вакуумі (20мм рт.стовпч.); залишок промивали теплою водою і кип'ятили в гексані протягом 2 годин - фільтрат відділяли декантацією і при охолодженні останнього викристалізовується цільовий продукт 2b5; перекристалізацію проводять в ацетоні. Кристали жовтого кольору. Вихід 12.0%, Ттопл. -1 s 118-120°С. ІЧ спектр (ν, см ): 765, 1355 ( NO2), 1530 (asNO2), 1610. Спектр ПМР в ДМСО-D6 (δ, м.д., J, Гц): 1.68 м (4Н, 2СН2); 2.48 м (4Н, 2СН2); 2.70 с (3Н, СН3); 3.20 д (2Н, СН2, 6.6); 6.08 м (1H, СН); 6.84 д (1Н, СН, 13.8); 8.01, 8.36 2д (4Н, 4C6H4NO2, 8.7, 8.7). Знайдено, %: С 55.63; Η 5.51; Ν 20.31; S 9.29. C16H19N5O2S. Вирахувано, %: С 55.65; Η 5.51; Ν 20.29; S 9.28. 89300 10 3-Метилтіо-5-(4-нітрофеніл)-4-(2-Nпіролідинілпропен-1-іл)-1,2,4-триазол (2с). Сіль 2а (3ммоль) розчиняли при нагріванні в 15мл відповідного вторинного аміну і витримували 6-8 годин при температурі 20-25°С. Надлишок аміну відганяли у вакуумі (20мм рт.стовпч.); залишок промивали теплою водою і кип'ятили в гексані протягом 2 годин - фільтрат відділяли декантацією; із залишка виділяли цільовий продукт 2с; перекристалізацію проводили в ацетоні. Кристали жовтого кольору. Вихід 63.0%, Tтопл. -1 s 144-145°С. ІЧ спектр (ν, см ): 760, 1350 ( NO2), as 1530 ( NO2), 1610. Спектр ПМР в ДМСО-D6 (δ, м.д., J, Гц): 1.45 с (3Н, СН3); 1.88 м (4Н, 2СН2); 2.64 с (3Н, СН3); 3.12-3.23 м (4Н, 2NCH2); 5.19 с (1Н, СН); 8.17, 8.32 2д (4Н, 4-C6H4NO2, 8.7, 8.7). Знайдено, %: С 55.61; Η 5.50; Ν 20.37; S 9.33. C16H19N5O2S. Вирахувано, %: С 55.65; Η 5.51; Ν 20.29; S 9.28. 4-(3-Етоксипропен-1-іл)-5-(4-нітрофеніл)-3-Rтіо-1,2,4-триазоли (2d1, 2d2). До розчину відповідної солі 2а (1.5ммоль) в абсолютному етанолі (18мл) добавляють 15% розчин етилату натрію (6мл); отриманий розчин через 2 години розбавляють трьохкратною кількістю води; потім проводять нейтралізацію оцтовою кислотою до рН=8. Цільові продукти екстрагують бензеном, бензеновий екстракт сушать сульфатом натрію, бензен відганяють у вакуумі (20мм рт.стовпч.), залишок перекристалізовують із метанолу і сушать в ексикаторі над хлоридом кальцію. 4-(3-Етоксипропен-1-іл)-3-метилтіо-5-(4нітрофеніл)-1,2,4-триазол (2d1). Кристали жовтого кольору. Вихід 52.1%, Ттопл. 74-76°С. ІЧ спектр (ν, см-1): 765, 1350 (sNO2), 1530 (asNO2), 1610, 1625, 2820. Спектр ПМР в метанолі-D4 (δ, м.д., J, Гц): 1.20 т (3Н, СН3, 7.4); 2.74 с (3Н, SCH3); 3.52 к (2Н, ОСН2, 7.4); 4.15 д (2Н, СН2, 6.2); 6.16 м (1H, СН); 6.78 д (1Н, СН, 16.0); 8.00, 8.38 2д (4Н, 4-C6H4NO2, 9.8, 9.8). Знайдено, %: С 52.74; Η 4.91; Ν 17.77; S 10.23. C14H16N4O3S. Вирахувано, %: С 52.50; Η 5.00; Ν 17.50; S 10.00. 3-Етилтіо-4-(3-етоксипропен-1-іл)-5-(42 нітрофеніл)-1,2,4-триазол (2d ). Кристали жовтого кольору. Вихід 47.9%, Ттопл. 58-59°С. ІЧ спектр (ν, см-1): 765, 1350 (sNO2), 1530 (asNO2), 1610, 1625, 2820. Спектр ПМР в метаноліD4 (δ, м.д., J, Гц): 1.20 т (3Н, СН3, 7.4); 1.43 т (3Н, СН3, 7.4); 3.28 к (2Н, SCH2, 7.4); 3.55 к (2Н, ОСН2, 7.4); 4.18 д (2Н, СН2, 6.2); 6.15 м (1H, СН); 6.79 д (1H, СН, 15.8); 7.99, 8.37 2д (4Н, 4-C6H4NO2, 9.8, 9.8). Знайдено, %: С 54.02; Η 5.33; Ν 16.94; S 9.73. C15H18N4O3S. Вирахувано, %: С 53.89; Η 5.39; Ν 16.77; S 9.58. Приклад 3. Схема функціоналізації на основі 3-алілтіо-4.5дифеніл-1,2,4-триазолу (3) 11 89300 4,5-дифеніл-2-(2-меркаптопропен-2-іл)-1,2,4триазол-3-ону дисульфід (3b). Сіль 3а (0.50г) перемішують в 5мл відповідного аміну при кімнатній температурі протягом двох годин. Перекристалізовують кінцевий продукт з ацетону. Кристали білого кольору. Вихід 76%, Ттопл.=152-153°С, Rf=0.87 (ізопропанол:гексан =5:1). Спектр ПМР в ДМСО-D6 (δ, м.ч., J, Гц): 4.24 с (2Н, СН2); 5.59 с, (1Н, =СН2 транс); 6.02 с (1H, =СН2 цис); 7.37- 7.57 м (10Н, 2С6Н5). Знайдено, %: N 13.82. C34H28N6S2O2. Вирахувано, %: N 13.64. Таким чином, було розроблено прийом взаємодії штучно створеного активного реакційного центру з нуклеофільними реагентами, що забезпечило проведення функціоналізації гетероциклічних систем при звичайних умовах чи помірному нагріванні без використання важкодоступних реагентів та складного апаратурного оформлення. Використання запропонованого способу нуклеофільного розщеплення отриманих електрофільною галогеноциклізацією поліконденсованих гетероциклів з позитивно зарядженим гетероатомом забезпечує селективність утворення Nвінільних функціональних похідних, для синтезу яких відомі методи функціоналізації гетероциклів є неприйнятними. Спосіб є простим, не потребує використання складного апаратурного оформлення та важкодоступних реактивів; спосіб однознач Комп’ютерна верстка Т. Чепелева 12 но діє як у випадку -електронодефіцитних, так і електронодонорних гетероциклічних систем, тому може бути використаний як загальний для функціоналізації 5,6-членних нітрогеновмісних гетероциклічних систем любої природи. Спосіб може бути використаний у науководослідних хімічних та хіміко-фармацевтичних лабораторіях. Джерела інформації: 1. S. Ernst, С. Richter, A. Hobert, G.G. Mariam, K. Schulze. Synthesis of new 1,2,4-triazolines and 1,3,4-thiadiazolines from bithioureas. // J.Heterocycl.Chem. - 1995. - V.32. - №№1-2. - P.275281. 2. Мелик-Оганджанян Р.Г., Хачатрян В.Э., Гапоян А.С. Фуро-, тиено- и пир-роло[2,3й]пиримидины. // Успехи химии. - 1985. - т.54, №3. - С.450-478. 3. E.S.H.E1 Ashry, A.A. Kassem, Η. AbdelHamid, F.F. Louis, Sh. A. Khattab, and M.R. Aouad. Synthesis and Alkylation of 5-(3-Chlorobenzo[b]thien2-yl)-4H-1,2,4-triazole-3-thiol Under Classical and Microwave Conditions. // J.Heterocycl.Chem. - 2006. V.43. - №№11-12. - P.1427-1430. - Прототип. 4. M.M. Цицика, Хрипак С.М., Смоланка И.В. Бром- и иодциклизация некоторых 4-аллил-1,2,4триазолинтионов-3. // Укр.Хим.Журн. - 1976. - т.42, №8. - С.841-842. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of n-vinyl functional derivatives of 5,6-membered nitrogen-containing heterocycles
Автори англійськоюSlyvka Mykhailo Vasyliovych, Slyvka Maryna Vasylivna, Usenko Ruslan Mykolaiovych, Lendiel Vasyl Heorhiiovych
Назва патенту російськоюСпособ получения n-винильных функциональных производных 5,6-членных нитрогеносодержащих гетероциклов
Автори російськоюСливка Михаил Васильевич, Сливка Марина Васильевна, Усенко Руслан Николаевич, Лендел Василий Георгиевич
МПК / Мітки
МПК: C07B 41/00, C07D 513/00, C07B 43/00, C07D 249/00
Мітки: гетероциклів, нітрогеновмісних, 5,6-членних, n-вінільних, одержання, функціональних, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/6-89300-sposib-oderzhannya-n-vinilnikh-funkcionalnikh-pokhidnikh-56-chlennikh-nitrogenovmisnikh-geterocikliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-вінільних функціональних похідних 5,6-членних нітрогеновмісних гетероциклів</a>
Попередній патент: Спосіб вилучення міді зі шламів гальванічного виробництва
Наступний патент: Вбудовуваний клапан, зокрема, для секційного радіатора і секційний радіатор
Випадковий патент: Трубне нарізне з'єднання










