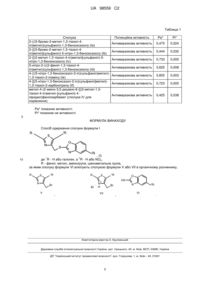
Спосіб одержання похідних 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу-2r
Номер патенту: 98559
Опубліковано: 25.05.2012
Автори: Коваленко Наталія Володимирівна, Цапко Магдаліна Дмитрівна, Воловенко Юліан Михайлович
Формула / Реферат
Спосіб одержання сполуки формули І
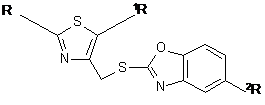 , (I)
, (I)
де 1R - Н або галоген, a 2R - Н або NO2,
R - феніл, метил, аміногрупа, ціанометильна група,
за яким сполуку формули VI алкілують сполукою формули V або VII в органічному розчиннику,
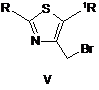 ,
,
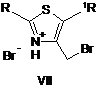 ,
,
 .
.
Текст
Реферат: 1 Винахід стосується способу одержання похідних 2-(((5- R-2-R-1,3-тіазол-4-іл)метил)сульфаніл)2 1,3-бензоксазолу- R формули (І) R 1R 2R , (I) 1 2 де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група. Сполуки можуть бути застосовані як сполуки для отримання фізіологічно активних речовин в медицині. UA 98559 C2 (12) UA 98559 C2 UA 98559 C2 Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а 2 саме способу одержання похідних (((1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу- R формули (І) 1R R 2R 5 10 15 , (I) 1 2 де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група. Тіазольне кільце зустрічається в сполуках розповсюджених у природі, які стоять в перших рядах важливості для живих систем, наприклад вітамін В1 і пеніцилін [1]. Похідними тіазолу є аналітичний засіб аміфеназол, феноклозинова кислота, яка є активним антиперетиком з анальгетичними характеристиками; препарат клометіазол має седативну, гіпнотичну і антиконвульсивну дії [2-4], а також лікарські препарати фамотидин [5], цефалоспорин [6] та інші [7]. Різноманітність біологічних активностей стимулює підвищений інтерес до розробки нових сполук цієї структури. В літературі [7] описано близький спосіб, за яким сполуку IV одержано взаємодією гідроброміду 4-(хлорметил)-2-метил-1,3-тіазолу II з метил-4-(2-аміно-3,5-диціано-6-сульфаніл-4піридил)фенілкарбаматом III в диметилформаміді у присутності натрію гідрогенкарбамату. Недоліком цього способу є: 1) низький вихід цільового продукту реакції, а саме 36 %; 2) трудомісткий спосіб очищення продукту хроматографічним методом NH2 S N S HS N NH S N + NH2 N N Cl N II N O N H III IV 20 25 O , В основу винаходу поставлено задачу - створення способу одержання похідних (((1,3-тіазол2 4-іл)метил)сульфаніл)-1,3-бензоксазолу- R (І), які можуть мати фізіологічну активність і можуть бути застосовані в медицині. 1 Поставлена задача вирішується при здійснені способу одержання похідних 2-(((5- R-2-R-1,32 тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу- R формули (І) взаємодією похідних 4бромометил-2-(R)-1,3-тіазолу формули V (схема І) або гідробромідів похідних 4-бромометил-21 2 (R)-1,3-тіазолу формули VII (схема II), де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група, в органічних розчинниках за схемами І і II: Схема І R S 1R R O + N S 1R HS N Br 2R O N S N 30 O N H O V 1 VI I(a-f) 2 де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група; Схема II 1 2R , UA 98559 C2 R S + - N Br H 1R 15 20 25 30 35 40 45 50 1R N Br O N 2R S N VI I(a-f) 2R , де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група. Одержані продукти мають достатню чистоту для подальшого використання як фізіологічно активних речовин. Винахід підтверджується наступними прикладами, які ілюструють, але не обмежують об'єм даного винаходу. Синтез 2-(((5-бромо-2-метил-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу (Іа) Приклад 1 До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу формули (Va) додають 0,001 2 моль 1,3-бензооксазол-2-тіолу формули (VI) (де R=H) у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 3,0 г (89 %) сполуки (Іа), т. пл. 78-79 °С. Спектр НЯМР (ДМСO-d6) , м.ч.: 7,58 д (1H, J=7,6 СН), 7,53 д (1Н, J=7,2 Гц, СН), 7,31-7,25 м (1Н, СН), 4,61 с (2Н, СН2), 2,63 с (3Н, СН3). Знайдено, %: С 42,74; Вr 23,82; N 8,71; S 19,01. C 12H9BrN2OS2. Вирахувано, %: С 42,24; Вr 23,42; N 8,21; S 18,79. Приклад 2 До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу формули (Va) додають 0,001 2 моль 1,3-бензооксазол-2-тіолу формули (VI) (де R=H) у 15 мл 20 мл спирту, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 3,0 г (89 %) сполуки (Іа), т. пл. 78-79 °С. Спектр НЯМР (ДМСО-d6) , м.ч.: 7,58 д (1Н, J=7,6 СН), 7,53 д (1Н, J=7,2 Гц, СН), 7,31-7,25 м (1Н, СН), 4,61 с (2Н, СН2), 2,63 с (3Н, СН3). Знайдено, %: С 42,81; Вr 23,90; N 8,79; S 19,12. C 12H9BrN2OS2. Вирахувано, %: С 42,24; Вr 23,42; N 8,21; S 18,79. Синтез 2-([(5-бромо-2-метил-1,3-тіазол-4-іл)метил]сульфаніл)-5-нітро-1,3-бензоксазолу(Іb) Приклад 1 До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу формули (Vb) додають 0,001 2 2 моль5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 3,4 г (87 %) сполуки (Іb), т. пл. 183-185 °С. Спектр 1 Н-ЯМР (ДМСО-d6) , м.ч.: 8,97 с (1Н, СН), 8,27 д (1Н, J=8,4 Гц,СН), 7,97 д (1Н, J=8,8 Гц, СН), 4,68 с (2Н, СН2), 2,62 с (3Н, СН3). Знайдено, %: С 37,32; Вr 20,48; N 10,71; S 16,46. C12H8BrN3O3S2. Вирахувано, %: С 37,32; Вr 20,69; N 10,88; S 16,60. Приклад 2 До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу формули (Vb) додають 0,001 2 2 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл етилацетату додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 3,1 г (67 %) сполуки (Іb), т. пл. 183-185 °С. Спектр 1 Н-ЯМР (ДМСO-d6) , м.ч.: 8,97 с (1Н, СН), 8,27 д (1Н, J=8,4 Гц,СН), 7,97 д (1Н, J=8,8 Гц, СН), 4,68 с (2Н, СН2), 2,62 с (3Н, СН3). Знайдено, %: С 37,32; Вr 20,48; N 10,71; S 16,46. C12H8BrN3O3S2. Вирахувано, %: С 37,32; Вr 20,69; N 10,88; S 16,60. Синтез 2-([(2-метил-1,3-тіазол-4-іл)метил]сульфаніл)-5-нітро-1,3-бензоксазолу (Іс) 1 10 S + HS VII 5 R O 2 2 UA 98559 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 1 2 До 0,001 моль 4-бромометил-2-метил-1,3-тіазолу формули (Vc) додають 0,002 моль 5- R2 1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) y 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,5 г (84 %) сполуки (Іа), т. пл. 137-138 °С. Спектр 1 Н-ЯМР (ДМСО-d6) , м.ч.: 8,49 с (1Н, СН), 8,26 д (1Н, J=8,4 Гц,СН), 7,78 д (1Н, J=8,4 Гц, СН), 7,45 с (1Н, СН), 4,68 с (2Н, СН2), 2,50 с (3Н, СН3). Знайдено, %: С 46,95; N 13,72; S 20,91. C12H9N3O3S2. Вирахувано, %: С 46,89; N 13,67; S 20,87. Приклад 2 До 0,001 моль гідроброміду 4-бромометил-2-метил-1,3-тіазолу формули (VIIc) додають 2 2 0,002 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) y 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,6 г (86 %) сполуки (Іс), т. пл. 1 137-138 °С. Спектр Н-ЯМР (ДМСО-d6) , м.ч.: 8,49 с (1Н, СН), 8,26 д (1Н, J=8,4 Гц,СН), 7,78 д (1Н, J=8,4 Гц, СН), 7,45 с (1Н, СН), 4,68 с (2Н, СН2), 2,50 с (3Н, СН3). Знайдено, %: С 46,95; N 13,72; S 20,91. C12H9N3O3S2. Вирахувано, %: С 46,89; N 13,67; S 20,87. Синтез 5-нітро-2-(((2-феніл-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу (Id) Приклад 1 2 До 0,001 моль 4-бромометил-2-феніл-1,3-тіазолу формули (Vd) додають 0,001 моль 5- R2 1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 3,21 г (87 %) сполуки (Id), т. пл. 133 °С. Спектр НЯМР (ДМСО-d6) , м.ч.: 8.50 с (1Н, СН), 8,27 д (1Н, J=8,8 Гц,СН), 7,76 д (1Н, J=4,0 Гц, СН), 7,80 д (2Н, J=8,8 Гц, протони фен.) 7,69 с. (1Н, СН), 7,44 уш. с (3Н, протони фен), 4,79 с (2Н, СН2). Знайдено, %: С 55,31; N 11,42; S 17,41. С17Н11N3О3S2. Вирахувано, %: С 55,27; N 11,37; S 17,36. Приклад 2 До 0,001 моль гідроброміду 4-бромометил-2-феніл-1,3-тіазолу формули (VIId) додають 0,001 2 2 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 3,25 г (88 %) сполуки (Id), т. пл. 133 °С. Спектр НЯМР (ДМСО-d6) , м.ч.: 8,50 с (1Н, СН), 8,27 д (1Н, J=8,8 Гц, СН), 7,76 д (1Н, J=4,0 Гц, СН), 7,80 д (2Н, J=8,8 Гц, протони фен.) 7,69 с (1Н, СН), 7,44 уш. с (3Н, протони фен.), 4,79 с (2Н, СН2). Знайдено, %: С 55,31; N 11,42; S 17,41. С17Н11N3O3S2. Вирахувано, %: С 55,27; N 11,37; S 17,36. Синтез 4-(((5-нітро-1,3-бензоксазол-2-іл)сульфаніл)метил)-1,3-тіазол-2-іламіну (Іе) Приклад 1 2 До 0,001 моль 4-бромометил-2-аміно-1,3-тіазолу формули (Ve) додають 0,001 моль 5- R-1,32 бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 2,7 г (87 %) сполуки (Іе). Спектр Н-ЯМР (ДМСОd6) , м.ч.: 8,46 с (1Н, СН), 8,51 д (1Н, J=8,8 Гц, СН), 7,76 д (1Н, J=8,8 Гц, СН), 6,88 уш. с (2Н, NH2), 6,46 с. (1Н, СН), 4,45 с (2Н, СН2). Знайдено, %: С 43,05; N 18,35; S 21,00. C11H8N4O3S2. Вирахувано, %: С 42,85; N 18,17; S 20,80. Приклад 2 До 0,001 моль гідроброміду 4-бромометил-2-аміно-1,3-тіазолу формули (Vb) додають 0,001 2 2 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 3 UA 98559 C2 5 10 15 20 25 30 35 40 45 50 55 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 2,76 г (89 %) сполуки (Іе), т. пл. 128 °С. Спектр НЯМР (ДМСО-d6) , м.ч.: 8,46 с (1Н, СН), 8,51 д (1Н, J=8,8 Гц, СН), 7,76 д (1Н, 7 8,8 Гц, СН), 6,88 уш. с. (2Н, NH2), 6,46 с (1Н, СН), 4,45 с (2Н, СН2). Знайдено, %: С 43,05; N 18,35; S 21,00. С11H8N4O3S2. Вирахувано, %: С 42,85; N 18,17; S 20,80. Синтез 4-{[(5-нітро-1,3-бензоксазол-2-іл)сульфаніл]метил}-1,3-тіазол-2-карбонітрилу (If) Приклад 1 До 0,001 моль 4-бромометил-2-карбонітрилу-1,3-тіазолу формули (Vf) [8] додають 0,001 2 2 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, 1 розчинник упарюють. В результаті виділяють 2,7 г (81 %) сполуки (If), т. пл. 103 °С. Спектр НЯМР (ДМСО-d6) , м.ч.: 8,48 с (1Н, СН), 8,26 д (1Н, J=6 Гц, СН), 7,77 д (1Н, J=6 Гц, СН), 7,70 с (1Н, СН), 4,74 с (2Н, СН2), 4,43 с (2Н, СН2). Знайдено, %: С 47,03; N 16,91; S 19,35. С13H8N4O3S2. Вирахувано, %: С 46,98; N 16,86; S 19,30. Приклад 2 До 0,001 моль гідроброміду 4-бромометил-2-карбонітрилу-1,3-тіазолу формули (VІІf) 2 2 додають 0,001 моль 5- R-1,3-бензооксазол-2-тіолу формули (VI) (де R=NO2) у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (325 мл) бензену або (340 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,76 г (83 %) сполуки (If), т. пл. 1 103 °С. Спектр Н-ЯМР (ДМСО-d6) , м.ч.: 8,48 с (1Н, СН), 8,26 д (1Н, J=6 Гц, СН), 7,77 д (1Н, J=6 Гц, СН), 7,70 с (1Н, СН), 4,74 с (2Н, СН2), 4,43 с (2Н, СН2). Знайдено, %: С 47,03; N 16,91; S 19,35. С13H8N4O3S2. Вирахувано, %: С 46,98; N 16,86; S 19,30. Комп’ютерне моделювання за програмою PASS показало потенційну можливість використання сполук, що заявляються, в широкому спектрі направленостей фізіологічної активності, зокрема в лікуванні виразкової хвороби шлунка. Слід зауважити, що сполука IV [7] (що вибрана для порівняння) за програмою PASS має наступні данні як потенційна сполука в лікуванні виразкової хвороби шлунка Ра* = 0,425, Рі* = 0,038, що менш за заявлені сполуки. У таблиці 1 представлена потенційна біоактивність заявлених похідних тіазолу з показниками активності. 1 Таким чином, одержано сполуки ряду похідних 2-(((5- R-2-R-1,3-тіазол-42 іл)метил)сульфаніл)-1,3-бензоксазолу- R формули (І), які, згідно з розрахунком за програмою PASS, можуть мати широкий спектр направленостей фізіологічної активності, зокрема в лікуванні виразкової хвороби шлунка. Потенційна можливість використання заявлених сполук дозволить розширити асортимент речовин, які можуть бути застосовані в медицині [7]. Джерела інформації: 1. Машковский М. Д. Лекарственные средства. Ч. 1, 2. - М.: Медицина, 1998. 2. Lyden P.; Jacoby M.; Schim J.; Albers G.; Mazzeo P.; Ashwood Т.; Nordlund A.; Odergren Т. The Clomethiazole Acute Stroke Study in tissue-type plasminogen activator-treated stroke (CLASS-T) final results. Neurology 2001, vol. 57, № 7, pp. 1199-1205. 3. Martin Bernard Keat, GB831873, 1960-04-06. 4. Shulman A. // A Possible Mode of Action of 2: // 4-Diamino-5-phenyl-thiazole Hydrochloride (Daptazole or Amiphenazole) // Nature 177, 703 (14 April 1956); doi:10.1038/177703a0. 5. Bod P., Harsanyi, // Austrian AT 389,510. Chem. Abstr, 113:59163 k. - 1984. 3. 649. 6. Mamsuo M.; Manabe R. //JP 01.79.178 Chem. Abstr. 111:153790 t. 1994. 29, 339. 7. EP 1 417 173 B1. 4 UA 98559 C2 Таблиця 1 Сполука 2-(((5-бромо-2-метил-1,3-тіазол-4іл)метил)сульфаніл)-1,3-бензоксазолу (Іа) 2-([(5-бромо-2-метил-1,3-тіазол-4іл)метил]сульфаніл)-5-нітро-1,3-бензоксазолу (Іb) 2-([(2-метил-1,3-тіазол-4-іл)метил]сульфаніл)-5нітро-1,3-бензоксазолу (Іс) 5-нітро-2-(((2-феніл-1,3-тіазол-4іл)метил)сульфаніл)-1,3-бензоксазолу (Id) 4-(((5-нітро-1,3-бензоксазол-2-іл)сульфаніл)метил)1,3-тіазол-2-іламіну (Іе) 4-{[(5-нітро-1,3-беноксазол-2-іл)сульфаніл]метил}1,3-тіазол-2-карбонітрилу (If) метил-4-(2-аміно-3,5-диціано-6-{[(2-метил-1,3тіазол-4-іл)метил-]сульфаніл}-4піридил)фенілкарбамат (сполука IV для порівняння) Потенційна активність Ра* Рі* Антивиразкова активність 0,475 0,024 Антивиразкова активність 0,444 0,032 Антивиразкова активність 0,733 0,005 Антивиразкова активність 0,625 0,008 Антивиразкова активність 0,855 0,003 Антивиразкова активність 0,723 0,005 Антивиразкова активність 0,425 0,038 Ра* показник активності. Рі* показник не активності. 5 ФОРМУЛА ВИНАХОДУ Спосіб одержання сполуки формули І 1R R 2R 10 , (I) 1 2 де R - Н або галоген, a R - Н або NO2, R - феніл, метил, аміногрупа, ціанометильна група, за яким сполуку формули VI алкілують сполукою формули V або VII в органічному розчиннику, R S N 1R R , O HS + - N Br H Br V 1R S N Br VII , 2R VI . Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-(((5-1r-2-r-1,3- thiazole-4-yl)methyl)sulfanyl)-1,3-benzoxazole-2r derivatives
Автори англійськоюKovalenko Natalia Volodymyrivna, Volovenko Yulian Mykchaylovich, Tsapko Mahdalina Dmytrivna
Назва патенту російськоюСпособ получения производных 2-(((5-1r-2-r-1,3-тиазол-4-ил)метил)сульфанил)-1,3-бензоксазола-2r
Автори російськоюКоваленко Наталия Владимировна, Воловенко Юлиан Михайлович, Цапко Магдалина Дмитриевна
МПК / Мітки
МПК: A61K 31/427, C07D 277/22, C07D 277/40, C07D 277/32, C07D 263/58
Мітки: одержання, спосіб, похідних, 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу-2r
Код посилання
<a href="https://ua.patents.su/7-98559-sposib-oderzhannya-pokhidnikh-2-5-1r-2-r-13-tiazol-4-ilmetilsulfanil-13-benzoksazolu-2r.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензоксазолу-2r</a>
Попередній патент: Порожнисте м’яке крило з повітрозбірником біля носка профілю і профільованою щілиною на верхній поверхні
Наступний патент: Спосіб одержання протиалкогольного та протинаркотичного засобу для ін’єкцій “налтетлонг”
Випадковий патент: Респіратор