Спосіб одержання похідних тіобарбітурової кислоти
Номер патенту: 71600
Опубліковано: 15.12.2004
Автори: Пассафаро Марко, Рапольд Томас, Урвілер Бернхард
Формула / Реферат
1. Спосіб одержання 4,6-диметокси-2-метилмеркаптопіримідину формули І
 I
I
гідрогенолізом сполуки формули II
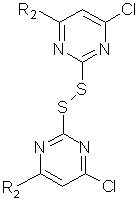 , ІІ
, ІІ
в якій R2 означає атом хлору або СН3О-, з використанням
агента гідрогенолізу в середовищі інертного розчинника в присутності метилюючого реагенту з наступною взаємодією з метилатом лужного металу в метанолі.
2. Спосіб за п. 1, у якому агент гідрогенолізу вибирають з групи, що включає боргідриди, диборан, алюмогідриди лужних металів і водень в присутності паладію або платини.
3. Спосіб за п. 2, у якому агент гідрогенолізу вибирають з групи, що включає боргідрид лужного металу, диборан, алюмогідрид літію і водень в присутності паладію або платини.
4. Спосіб за п. 3, у якому агентом гідрогенолізу є боргідрид лужного металу або водень у присутності паладію або платини.
5. Спосіб за п. 4, у якому агентом гідрогенолізу є боргідрид натрію або водень в присутності паладію або платини.
6. Спосіб за п. 1, у якому агент гідрогенолізу використовують у еквімолярних кількостях або у невеликому надлишку, від 5 до 15 мольних %, у перерахунку на сполуку формули II.
7. Спосіб за п. 1, у якому гідрогеноліз проводять при температурі реакції від 0 до 60° С.
8. Спосіб за п. 1, у якому гідрогеноліз проводять у середовищі кетонів, амідів, нітрилів, аліфатичних вуглеводнів, простих ефірів, спиртів, водно-спиртових сумішей або у сумішах цих розчинників.
9. Спосіб за п. 8, у якому як розчинник використовують ацетон, N,N-диметилформамід, 1-метил-2-піролідон, ацетонітрил, діоксан, тетрагідрофуран, метанол або водно-метанольну суміш.
10. Спосіб за п. 9, у якому використовують ацетон, N,N-диметилформамід, метанол, діоксан або тетрагідрофуран.
11. Спосіб за п. 1, у якому гідрогеноліз проводять безперервно в одному реакторі.
12. Спосіб за п. 1, у якому сполуку формули II у сухому метанолі, N,N-диметилформаміді або ацетонітрилі при температурі від 15 до 35° С змішують з боргідридом натрію, потім перемішують протягом від 0,5 до 3 год, після чого при тій же температурі реакції додають невеликий надлишок метилату натрію в метанолі та реакційну суміш обережно нагрівають до температури від 25 до 50° С при одночасному перемішуванні.
13. Спосіб за п. 1, у якому сполуку формули II у сухому метанолі, N,N-диметилформаміді або ацетонітрилі при температурі від 15 до 25° С змішують з одним молярним еквівалентом диметилсульфату в перерахунку на сполуку формули II, потім при температурі від 5 до 35° С з боргідридом натрію з наступним перемішуванням до завершення гідрогенолізу та метилювання дисульфіду формули II з утворенням сполуки формули III
 , III
, III
в якій R2 означає атом хлору або СН3О-, а потім при тій же температурі реакції додають надлишок метилату натрію в метанолі та цю реакційну суміш нагрівають при перемішуванні при температурі від 25 до 80° С.
14. Спосіб одержання 7-[(4,6-диметоксипіримідин-2-іл)тіо]-3-метилфталіду, який включає реакцію проміжного 4,6-диметокси-2-метилмеркаптопіримідину формули І
 , I
, I
одержаного гідрогенолізом сполуки формули ІІ
 , ІІ
, ІІ
в якій R2 означає атом хлору або СН3О-, з використанням агента гідрогенолізу в середовищі інертного розчинника в присутності метилюючого реагенту і наступну взаємодію з метилатом лужного металу в метанолі, з окислювачем та наступною взаємодією одержаного в такий спосіб 4,6-диметокси-2-(метилсульфоніл)піримідину з 7-меркапто-3-метилфталідом.
Текст
1. Спосіб одержання 4,6-диметокси-2метилмеркаптопіримідину формули І 2 3 71600 4 12. Спосіб за п.1, у якому сполуку формули II у 2-іл)тіо]-3-метилфталіду, який включає реакцію сухому метанолі, N,N-диметилформаміді або ацепроміжного 4,6-диметокси-2тонітрилі при температурі від 15 до 35° С змішують метилмеркаптопіримідину формули І CH 3O OCH 3 з боргідридом натрію, потім перемішують протягом від 0,5 до 3 год, після чого при тій же температурі N N реакції додають невеликий надлишок метилату натрію в метанолі та реакційну суміш обережно SCH3 ,I нагрівають до температури від 25 до 50° С при одночасному перемішуванні. одержаного гідрогенолізом сполуки формули ІІ R2 Cl 13. Спосіб за п.1, у якому сполуку формули II у сухому метанолі, N,N-диметилформаміді або ацеN N тонітрилі при температурі від 15 до 25° С змішують з одним молярним еквівалентом диметилсульфату S в перерахунку на сполуку формули II, потім при S температурі від 5 до 35° С з боргідридом натрію з N N наступним перемішуванням до завершення гідрогенолізу та метилювання дисульфіду формули II з Cl R2 утворенням сполуки формули III R2 Cl , ІІ в якій R2 означає атом хлору або СН 3О-, з викориN N станням агента гідрогенолізу в середовищі інертного розчинника в присутності метилюючого реаSCH 3 , III генту і наступну взаємодію з метилатом лужного в якій R2 означає атом хлору або СН 3О-, а потім металу в метанолі, з окислювачем та наступною при тій же температурі реакції додають надлишок взаємодією одержаного в такий спосіб 4,6метилату натрію в метанолі та цю реакційну суміш диметокси-2-(метилсульфоніл)піримідину з 7нагрівають при перемішуванні при температурі від меркапто-3-метилфталідом. 25 до 80° С. 14. Спосіб одержання 7-[(4,6-диметоксипіримідин Даний винахід відноситься до нового способу одержання специфічно заміщених похідних тіобарбітурової кислоти. В J.Org.Chem. 26, 792 (1961) описані можливі похідні піримідину, які у 2-му, 4-му і 6-му положеннях заміщені атомами водню, гідроксилами, амінота тіоловими групами. Описано можливість їхнього одержання синтетичним шляхом та можливість їхнього застосування при одержанні інших похідних. Так, наприклад, описано, з одного боку, синтез 4,6-дихлор-2-(метилтіо)піримідину з тіобарбітурової кислоти шляхом метилювання диметилсульфатом (ДМС) в основному середовищі з наступним хлоруванням одержаного як проміжного продукту 2-(метилтіо)-4,6-піримідиндіолу оксихлоридом фосфору, а з іншого боку, здатність атомів хлору в 4-му і 6-му положеннях піридинового кільця заміщуватися при застосуванні гідросульфіду натрію в етанолі з утворенням відповідного 4,6-піримідинтіолу. В ЕР-Α 0529631 описано одержання 2(метилтіо)динатрійбарбітурату з тіосечовини та диметилового ефіру малонової кислоти в присутності метилату натрію та метилювання одержаного як проміжного продукту динатрійтіобарбітурату метилбромідом. В J.Am.Chem.Soc. 76, 2899 (1954) описано, з однієї сторони, одержання біс(2,4-диметокси-6піримідиніл)дисульфіду з 2,4-диметокси-6піримідинтіолу з використанням пероксиду водню в діоксані, а з іншої сторони, його розщеплення шляхом відновлення алюмогідридом літію в абсолютному діетиловому ефірі та одержання відповідного 2,4-диметокси-6-піримідинтіолу з виходом 76%. В Helv.Chim.Acta 72, 744 (1989) описано одержання біс(4,6-дихлорпіримідин-2-іл)дисульфіду з 2-тіобарбітурової кислоти з оксихлоридом фосфору та Ν,Ν-діетиланіліном та одночасно з тим в журналі зазначено, що утворений дисульфід неможливо перетворити в мономерну урацилову похідну за допомогою або гідролізу, який каталізується кислотою або основою, або відновлювального гідролізу. В ЕР-А 0547411 описано одержання 4,6діалкокси-2-алкілмеркаптопіримідинів циклізацією ціанімідатів в присутності галогеніду водню з одержанням 4,6-діалкокси-2-галопіримідину та взаємодією цієї останньої сполуки з тіолатом натрію. У DE-A 2412854 описано одержання 2алкілтіо-4-метокси-6-гідроксипіримідину шляхом метилювання 2-алкілтіо-4,6-дигідроксипіримідину з використанням диметилсульфату. В Helv.Chim.Acta 72, 738 (1989) описано селективний основний гідроліз (в двостадійному способі) хлорного замісника в 2-му положенні 2,4,6трихлорпіримідину та наступне нуклеофільне заміщення інших хлорних замісників, в 4-му та 6-му положеннях, з використанням метанолу. Крім того, у DE А 4408404 та DE-A 2248747 описано перетворення 2-гідрокси-4,6діалкоксипіримідину із застосуванням оксихлориду 5 71600 6 фосфор у та каталітично ефективних кількостей розчинника та в присутності метилюючого реагенамінгідрохлориду або пентахлориду фосфору з ту, а потім з метилатом лужного металу в меодержанням 2-хлор-4,6-діалкоксипіримідину. танолі. Всі ці описані способи одержання специфічно Агентами гідрогенолізу, які прийнятні для гідзаміщених похідних (тіо-)барбітурової кислоти порогенолітичного розщеплення сполуки формули II, части складні в здійсненні через декілька реакційє, наприклад, гідриди бору, диборан, алюмогідриних стадії, оскільки, з однієї сторони, деякі замісди лужних металів та водень. Ті з них. які особлиники в певних положеннях піримідинового кільця во придатні, включають боргідриди лужних метамають практично однакову реакційну здатність, і лів, диборан, алюмогідрид літію та водень у не можуть бути заміщені селективно, а з іншої присутності каталізатора на основі благородного сторони, реакція з нуклеофільними реагентами металу. протікає повільно або ж вони навіть виявляють Як агенти гідрогенолізу особливо прийнятні помітну стабільність, тому вони вступають у взаєборгідриди лужних металів та водень у присутносмодію, якщо взаємодіють взагалі, в екстремальних ті каталізатора на основі благородного металу, реакційних умовах, зокрема в посудині під тиском особливо боргідрид натрію та водень у присутноста при підвищених температурах [див. J.Org.Chem. ті паладію або платини. 26, 794 (1961) та Helv.Chim.Acta 72, 745 (1989)]. Такі агенти гідрогенолізу звичайно використоОтже, при здійсненні таких способів одержання у вують у еквімолярних кількостях або у невеликому великих масштабах досягнуті ви хід продуктів та надлишку (від 5 до 15 мольних %) у перерахунку : ступінь їх чистоти часто виявляються незадовільна сполуку формули II. ними. Крім того, процеси виділення та очистки Реакцію гідрогенолізу сполуки формули II відекономічно неефективні та пов'язані з застосуванповідно до варіанту а) або б) проводять при темням складного обладнання. пературі реакції від 0 до 60°С. Було встановлено, що специфічно заміщена Розчинниками, які підходять для реакції гідро4,6-диметокси-2-тіобарбітурова кислота, 4,6генолізу сполуки формули II відповідно до варіанту диметокси-2-натрійтїобарбітурат та 4,6-диметоксиа) або б), служать, наприклад, кетони, аміди, ніт2-металтіопіримідин можуть бути легко одержані з рили, аліфатичні вуглеводні, прості ефіри, спирти, високими виходом продукту та ступенем його чисводно-спиртові суміші та суміші цих розчинників. тоти економічним та екологічним шляхом, а найПеревагу віддають ацетону, Ν,Νбільш переважно проведенням процесу в одному диметилформаміду (ДМФ), 1-метил-2-піролідону реакторі, з усуненням вищезгаданих недоліків (Ν-ΜΠ), ацетонітрилу, діоксану, тетрагідрофурану, описаних способів, безпосередньо з біс(4,6метанолу та водно-метанольній суміші. Особливо дизаміщених)-2-піримідиндисульфідів гідрогеноліпереважні ацетон, Ν,Ν-диметилформамід, метазом цих останніх сполук та безпосереднім метилнол, діоксан та тетрагідрофуран. юванням продуктів гідрогенолізу, без виділення Інша особливість способу відповідно до винаабо алкоголятом лужного металу, або метилююходу полягає в тому, що гідрогеноліз відповідно до чим реагентом та наступною взаємодією продукту варіанту а) або б) проводять безперервно, тобто у тіометилювання з алкоголятом лужного металу. вигляді реакції в одному реакторі, без виділення Таким чином, об'єктом даного винаходу є спопроміжних продуктів. сіб одержання похідних тіобарбітурової кислоти Продукт гідрогенолізу формули IV, який одерформули І жують безпосередньо відповідно до варіанту а) в якій R1 позначає SH, S-M+ або CH3S- a M+ позначає іон лужного металу, гідрогенолізом сполуки формули II в якій R2 позначає атом хлору або СН 3О-, з використанням а) агента гідрогенолізу в середовищі інертного розчинника та прямою реакцією продукту гідрогенолізу з метилатом лужного металу в метанолі або б) агента гідрогенолізу в середовищі інертного в якій R1 позначає SH або S-M+, де Μ+ позначає іон лужного металу, a R2 має значення, вказані в описі формули І, нестійкий, тому його не виділяють. Продукт гідрогенолізу формули III, який одержують безпосередньо відповідно до варіанту б) в якій R2 має значення, вказані в описі формули І, стійкий, тому, якщо необхідно, його можна виділяти. Ці реакції ілюструє схема реакцій 1. 7 71600 Якщо як агент гідрогенолізу використовують диборан або водень у присутності каталізатора на основі благородного металу, тоді відповідно до варіанту а) у вигляді продукту гідрогенолізу одержують насамперед нестійку сполуку формули IV, у якій R1 позначає SH. Якщо як агент гідрогенолізу використовують боргідрид лужного металу або алюмогідрид лужного металу, тоді відповідно до варіанту а) у вигляді продукту гідрогенолізу одержують насамперед нестійку сполуку формули IV, у якій R1 позначає S-M+, де Μ+ позначає іон лужного металу. В переважному варіанті а) проведення реакції гідрогенолізу відповідно до винаходу сполук у формули II в сухому метанолі, N.Nдиметилформаміді або ацетонітрилі при температурі від 15 до 35°С змішують з невеликим надлишком (від 5 до 10 мольних %) відносно необхідної кількості бор гідриду натрію, потім перемішують протягом від 0,5 до 3год., після чого при тій же температурі реакції додають невеликий надлишок (від 5 до 10 мольних %) відносно необхідної кількості метилату натрію в метанолі та реакційну суміш трохи нагрівають, до температури від 25 до 50° С, при одночасному перемішуванні. Після охолодження реакційної суміші одержаний сирий продукт або може бути використаний безпосередньо для проведення наступних реакцій, може або бути виділений концентруванням сирого продукту та його одержанням у чистому вигляді за допомогою звичайних методів очищення, таких, як перекристалізація. Вихід продукту звичайно знаходиться в інтервалі від 20 до >90% від теоретичного (залежно від використовуваного розчинника). В переважному варіанті б) проведення реакції гідрогенолізу відповідно до винаходу сполук у формули II у сухому метанолі, Ν,Νдиметилформаміді або ацетонітрилі при температурі від 15 до 25°С змішують з одним молярним еквівалентом диметилсульфату (ДМС) у перерахунку на сполуку формули II, потім при температурі від 5 до 35°С з невеликим надлишком (від 5 до 10 мольних %) відносно необхідної кількості боргі 8 дриду натрію з наступним перемішуванням (протягом приблизно від 1 до 3 год) до завершення гідрогенолізу та метилювання дисульфіду формули її з утворенням сполуки формули III в якій R2 позначає атом хлору або СН 3О-, а потім при тій лее температурі реакції додають надлишок (від 5 до 50 мольних %) метилату натрію в метанолі і цю реакційну суміш витримують при температурі від 25 до 80°С з одночасним перемішуванням до завершення реакції. Після охолодження реакційної суміші або одержаний сирий продукт може бути використаний безпосередньо для проведення наступних реакцій, або утворені солі можуть бути відфільтровані із наступним концентруванням фільтрату, а сирий продукт може бути виділений та одержаний у чистому вигляді за допомогою звичайних методів очищення, таких, як перекристалізація. Вихід продукту звичайно знаходиться в інтервалі від 80 до 90 % від теоретичного. Сполуками формули І, які в переважному варіанті одержують за способом відповідно до винаходу, є натріймеркаптид 4,6-диметокси-2піримідину та 4,6-диметокси-2метилмеркаптопіримідин. Вихідні сполуки формули II, а також використовувані агенти гідрогенолізу відомі або можуть бути одержані за допомогою відомих методів. Так, наприклад, у Helv.Chim.Acta 72, 744 (1989) описано одержання біс(4,6-дихлорпіримідин-2іл)дисульфіду (у сполуки формули II R2 позначає атом хлору) з 2-тіобарбітуровою кислотою з оксихлоридом фосфору та Ν,Ν-діетиланіліном. Метоксилювання біс(4,6-дихлоршримідин-2іл)дисульфіду надлишком метилату лужного металу легко приводить до заміщення кожного хлорного замісника в двох піримідинових кільцях та утворення сполуки формули II, у якій R2 позначає 9 71600 10 СН3О- [див. також J.Am.Chem.Soc. 76, 2899 (1954)] Запропонований відповідно до винаходу спосіб відрізняється від відомих способів тим, що 1) при його здійсненні одержують похідні 4,6диметоксипіримідин-2-тіолу з високими ступенем чистоти та виходом продукту в м'яких реакційних в якій R1 позначає CH3S-, вводять у взаємодію умовах, з окислювачем, таким, як пероксиди, наприклад з 2) при його здійсненні реакція протікає швидко, пероксидом водню, в оцтовій кислоті та у присут3) його можна здійснювати проведенням реакності вольфрамату лужного металу, зокрема воції в одному реакторі, льфрамату натрію, або газоподібний хлор, та оде4) його здійснення є легким, прямим та еконоржаний у такий спосіб 4,6-диметокси-2мічно і екологічно вигідним шляхом доступу до (метилсульфоніл)піримідин вводять у взаємодію з похідних 4,6-диметоксипіримідин-2-тіолу та 7-меркапто-3-метилфталідом проведенням реакції 5) його здійснення дає можливість проводити заміщення. in situ наступні реакції, такі, як окислення, з одерОтже, на першій реакційній стадії похідні 4,6жанням відповідних похідних 2диметоксипіримідин-2-тіолу формули І, які одер(метилсульфоніл)піримідину. жують відповідно до винаходу Переваги пропонованого способу перед відомими способами полягають, отже, в тому, що 1) він особливо прийнятний для великомасштабного застосування, 2) його здійснення дозволяє уникнути складв якій R1 позначає SH або S-M+, а М+ позначає них стадій розділення та очищення та іон лужного металу, вводять у взаємодію з метил3) можлива наступна обробка похідних 4,6юючим реагентом, таким, як диметилсульфат диметоксипіримідин-2-тіолу формули І проведен(ДМС), а потім з окислювачем, таким, як пероксиням процесу в одному реакторі без заміни розчинди, наприклад з пероксидом водню, в оцтовій кисників та, таким чином, зменшення кількості розлоті та у присутності вольфрамату лужного метачинників, що викидаються у відхід, та потреби в лу, зокрема вольфрамату натрію, або складному обладнанні. газоподібний хлор, та проводять реакцію одержаПохідні 4,6-диметоксипіримідин-2-тіолу форного в такий спосіб 4,6-диметокси-2мули І, які одержують відповідно до винаходу, ви(метилсульфоніл)піримідину з 7-меркапто-3 користовують, зокрема, як проміжні продукти при метилфталідом. одержанні 7-[(4,6-диметоксипіримідин-2-іл)тіо]-3Вищеописані варіанти способу одержання 7метилнафталіду, як викладено, наприклад, в ЕР-А [(4,6-диметоксипіримідин-2-іл)тіо]-30447506. метилнафталіду проілюстровані на наступній схеОтже, на першій реакційній стадії похідні 4,6мі реакції 2. диметоксипіримідин-2-тіолу формули І, які одержують відповідно до винаходу Відповідно до схеми реакцій 2 на першій реакційній стадії 4,6-диметокси-2-піримідинтіол або його тіолат лужного металу метилюють до проміжного 4,6-диметокси-2-піримідину. Таке метилювання диметилсульфатом (ДМС) звичайно проводять у водно-основному середовищі, необов'язково в середовищі полярного органічного розчинника, такого, як спирти, при температурі від 0 до 40°С Наступне окислення можна проводити, наприклад, пероксидом водню, або безпосередньо в тому ж розчиннику, або в органічних кислотах, таких, як алканкарбонові кислоти, наприклад в оцтовій кислоті, та у присутності вольфрамату лужного металу, наприклад вольфрамату натрію, або газоподібним хлором з одержанням 4,6-диметокси-2(метилсульфоніл)піримідину. За схемою реакцій 2 цільовий 4,6-диметокси2-(метилсульфоніл)піримідин можна одержувати з 11 71600 12 4,6-диметокси-2-метилмеркаптопіримідину безпоЗазначену в заголовку цільову сполуку молена або середньо окисленням, наприклад пероксидом возмішува ти з водою, охолоджувати та виділяти фідню в спиртах, додаючи органічні кислоти, та у льтруванням, або можна надалі використовувати присутності вольфрамату лужного металу. безпосередньо для наступної реакції. Реакції метилювання та окислення цього роду Приклад П2: одержання 4,6-диметокси-2описані, наприклад, у DE-А 2412854, DE-A (метилеульфоніл)піримідину 3324399, ЕР-А 0033195, Z.Chem. 17(392), 63 30г води додають у вищеописану реакційну (1977), Chem.Soc. 16(6), 489 (1995) та J.Org.Chem. суміш та оцтовою кислотою рН цієї реакційної су26,792 (1961). міші доводять до 3-4. Після додавання 0,01г тетНаступну реакцію одержаного 4,6-диметоксирабутиламонійброміду та 0,01г вольфрамату на2-(метилсульфоніл)піримідину з 7-меркапто-3трію протягом 30хв. при температурі від 60 до метилфталідом за схемою реакцій 2 звичайно 70°С доливають 3,4г 30%-ного пероксиду водню. проводять в інертному органічному розчиннику, Після перемішування протягом приблизно 1год. такому, як прості ефіри, кетони, нітрили та аміди, при температурі від 60 до 70°С окислення до віднаприклад у тетрагідрофурані, бутаноні, ацетонітповідного метилсульфонілу завершується. Реакрилі або Ν,Ν-диметилформаміді, при температурі ційну суміш прохолоджують до 0°С, змішують із від 0 до 160°С Реакцій заміщення такого типу опиприблизно 15г води та випавший в осад продукт сані, наприклад, в ЕР-А 0447506. виділяють фільтруванням. Цільову сполуку одерСпосіб відповідно до винаходу далі ілюстружують у чистому вигляді з виходом продукту від 80 ють наступні приклади. до 90%. Приклад П1: одержання 4,6-диметокси-2Приклад П3: одержання 4,6-дихлор-2метилтіобарбітурової кислоти метилтіобарбітурової кислоти 1,8г біс(4,6-дихлор-2-піримідин)дисульфіду В автоклаві з мішалкою розчин 2,5г 4,6при 22°С розчиняють у 30г Ν,Νдихлор-2-піримідиндисульфіду та 50мл метанолу диметилформаміду. Після додавання 1,26г димезмішують з 1,86г 2,6-лутидину та 2,2г диметилтилсульфа ту (ДМС) при температурі від 5 до 35°С сульфату. Після цього додають 0,25г сульфідоварозчин змішують з 0,19г боргідриду натрію та пеного Pd на вугіллі як каталізатор (фірми Engelhard) ремішують протягом приблизно 1год., до метилта при 22°С протягом 9год. проводять гідрогенізаювання всієї утвореної на цій стадії речовини до цію під тиском водню 20бар. Після охолодження та 4,6-дихлор-2-метилтіобарбітурової кислоти (за створення в автоклаві з мішалкою газоподібним даними тонкошарового хроматографічного аналіазотом інертної атмосфери каталізатор відфільтзу). Потім при 25°С додають 5,5г метаноровують та промивають метанолом. Після хромалу/метилату натрію (30%) та реакційну суміш натографічної обробки в колонці одержують 1,08г грівають до 50°С. При цій температурі зазначеної в заголовку цільової сполуки з 82%-ним перемішування продовжують до вступ у в реакцію виходом від теоретичного. 1Н-ЯМР (CDCl3, всієї 4,6-дихлор-2-метилтіобарбітурової кислоти. 400МГц): 7,08част./млн (s, 1H). Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of producing thiobarbituric acid derivatives
Назва патенту російськоюСпособ получения производных тиобарбитуровой кислоты
МПК / Мітки
МПК: C07D 239/60, C07D 239/66, C07B 61/00
Мітки: тіобарбітурової, кислоти, одержання, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/6-71600-sposib-oderzhannya-pokhidnikh-tiobarbiturovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних тіобарбітурової кислоти</a>
Попередній патент: Спосіб плівкового охолодження та пристрій для його здійснення
Наступний патент: Вставка в матрицю для виробництва коротких макаронів трубчастої форми
Випадковий патент: Конвеєр гвинтовий горизонтальний










