Спосіб стабілізації водно-сольового розчину тромбіну
Номер патенту: 73399
Опубліковано: 15.07.2005
Автори: Макогоненко Євген Митрофанович, Колодзейська Марія В'ячеславівна, Волков Георгій Леонідович
Формула / Реферат
Спосіб стабілізації водно-сольового розчину тромбіну, що включає застосування стабілізуючих реагентів, який відрізняється тим, що як стабілізуючий реагент використовують DL-лізин або L-глутамінову кислоту у концентрації 0,08-0,1 М, а стабілізацію здійснюють у 0,05 М трис-НСІ-буфері з оптимумом рН дії ферменту 7,6-8,0.
Текст
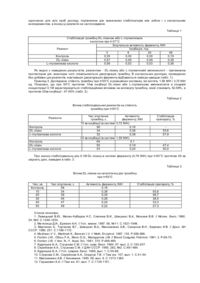
Винахід відноситься до біотехнології і являє собою стабілізацію водно-сольового розчину тромбіну. Дослідження стабільності і зберігання активності ферментів має фундаментальне значення для ензимології, біоорганічної хімії та медицини. Сучасна біотехнологія потребує детальної характеристики стабільності ферментів. Особливо важливою є різнобічна характеристика стабільності біополімерів в умовах їхнього практичного застосування, тобто у водному середовищі, за присутності органічних розчинників, детергентів, сполук, що денатурують білки, стабілізаторів, а також тих речовин, що знаходяться в іммобілізованій формі. Стабільність ферментів слід розуміти як функцію їхньої структури, яка здебільшого залежить від властивостей середовища. Одним із способів впливу на стабільність тромбіну є формування оптимального макросередовища. Підвищення резистентності макромолекулярної структури білка - одна з найважливіших проблем білкової хімії. Стабілізація тромбіну, як і всіх ферментів, можлива за допомогою різних факторів, і кожне нове повідомлення в цьому аспекті привертає увагу багатьох дослідників [1-4]. Дослідження захисної дії деяких амінокислот відкриває нові можливості для вивчення механізму стабілізації тромбіну продуктами розпаду білків в організмі. Слід зазначити, що тромбін може використовува тись у медицині, експериментальних дослідженнях, клінічній практиці. При цьому використання лабільних форм ферменту повністю виключається, передусім з діагностичною метою захворювання або як гемостатичного агента в хірургії. Як лікувальний засіб при патологіях серцево-судинної системи застосовують фактори, що стимулюють або пригнічують процес зсідання крові, або спричинюють лізис тромбу. Протеоліз фібриногену тромбіном, що зумовлює утворення фібринового згустка, найбільш досліджена біологічна функція тромбіну. Проте на сьогодні відомо, що тромбін є ферментом, який здійснює багато функцій [5-13]. Взаємодіючи з усіма ланками гемостазу - білками, клітинами крові і стінками судин - фермент бере участь у регуляції протилежно спрямованих процесів, пов'язаних як із зсіданням крові, так і зі збереженням її рідкого стану у кровоносному руслі [7-10]. У плазмі тромбін як активує, так і інактивує фактори V, VIII, XIII та білок С. На клітинному рівні тромбін функціонує як селективний протеолітичний фермент і гормон, дію якого опосередковано через специфічні рецептори. Він є потужним клітинним стимулятором індукції і секреції тромбоцитів, метаболізму арахідонової кислоти, мітогенезу [5, 10, 11, 14, 15]. Через те, що препарати тромбіну дуже лабільні у водно-сольовому середовищі, в багатьох дослідженнях рекомендують під час виділення їх ліофілізува ти кінцевий продукт. Однак водно-сольові розчини тромбіну мають переваги порівняно з ліофілізованими препаратами, особливо у разі використання їх у медицині, оскільки останні не потрібно додатково розбавляти, підбираючи розчинниками безпосередньо перед ін'єкціями, тобто виконувати ще додаткову функцію. Відомо декілька способів для приготування стабільної водно-сольової композиції тромбіна, в яких пропонується для стабілізації його використовувати альбумін, а також складну композицію буферних розчинів або композицію буфера, що містить 25-30% гліцеролу [16]. Однак, ці способи незадовільні, а стабільні водно-сольові препарати і досі виготовляються в недостатній кількості для практичного використання в медицині, насамперед для діагностики захворювання та аналітичних цілей. Відомо спосіб стабілізації водно-сольового розчину тромбіну, автори якого використовують суміш двох стабілізувальних агентів, а саме: різні полісахариди, наприклад цукор, ксиліт, сорбіт, маннітол, та амінокислоти аргинін (або гліцин) [17]. Проте, за присутності 4,6% аргініну у препараті виявлено лише 46% залишкової активності тромбіну у разі зберігання його при 5°С всього протягом одного місяця. Слід зазначити, що при дослідженні стабільності ферменту було використано досить високі концентрації полісахаридів (переважно 3-10%) і аргиніну (4,6-10%). При цьому, стійкість тромбіну визначали, переважно, при рН 6,5-6,7, що є додатковим фактором стабілізації ферменту. Крім того, в дослідженнях було використано різноманітні препарати, в тому числі й комерційні, недостатньо гомогенні і з низьким ступенем активності (100-1000 NIH/мг білка). Було використано також досить концентровані розчини тромбіну (переважно 300-500 NIH/мл), що помітно погіршує характеристику дійсної ефективності стабілізації тромбіну запропонованою сумішшю реагентів, оскільки в цих препаратах присутні досить небезпечні, так звані "баластні білки" - фактор Ха, плазмін і плазміноген, які зумовлюють додаткову лабільність тромбіну, спричинюючи обмежений протеоліз ферменту. В зазначеному патенті для дослідження стійкості ферменту використано, крім цитратного, фосфатний буфер, що не зовсім доцільно, тому що він призводить до помутніння ферментних розчинів внаслідок наявності в середовищі іонів Са++. При цьому утворюється осад комплексних сполук, що зовсім неприпустимо для практичного використання препаратів. Величина рН досліджуваних ферментних розчинів становить 6,5-6,7. Для того, щоб визначити біологічну активність тромбіну, необхідно підвищити зону рН до оптимуму, що-досягається у разі використання 0,5 чи 1,0Μ NaOH. Це досить кропітка і додаткова робота, яка значно подовжує тривалість експерименту. Нарешті, умови дослідження стабілізації ферменту також не оптимальні, вони досить м'які та короткотривалі. За прототип винаходу, як найбільш близький за технічною суттю, вибрано наступний спосіб [18]. Для підвищення стійкості ферменту автори використовують суміш трьох надто дорогих реагентів - білок сироваткового альбуміну, інгібітор протеїназ (найчастіше апротонін) та різних хелатних сполук (переважно EDTA). При цьому спостерігається синергізм їхнього впливу на каталіз тромбіну, що приводить до значної стабілізації ферменту. Було виявлено, що окремі досліджувальні стабілізувальні компоненти ефективно не підвищують стійкість препарату: сироватковий альбумін або апротонін, застосовані як окремо, так і сумісно і майже не впливають на стабільність препарата, хоча один хелатний реагент дещо стабілізує дію ферменту. До недоліків роботи слід віднести використання недоочищених препаратів тромбіну, а також характеристику дії ферменту тромбіну за амідолітичною активністю на синтетичному субстраті Tos-Gly-ProArg-pNa та суміші трьох надто дорогих реагентів. З даних літератури відомо, що в денатурованому ферменті амідолітична активність не завжди свідчить про структурні зміни в молекулі тромбіну. В несприятливому середовищі вона найчастіше становить 100%, тобто виявляється стабільнішою до денатурації, ніж біологічна активність ферменту (субстрат фібриноген), яка відображує дійсні зміни структури в денатурованому білку [19,5]. Цей факт пов'язаний зі специфічною структурою молекули тромбіну; його активного центру; наявності додаткового центру впізнавання, який забезпечує суперспецифічність ферменту; наявності великої кількості петель на зовнішній поверхні молекули тромбіну, які обумовлюють її високу рухливість і водночас значну лабільність. Ці питання досить добре висвітлено у працях, описаних в стаття х [5-15]. Отже, за амідолітичною активністю тромбіну ні в якому разі не можна охарактеризувати дійсну лабільність ферменту. Крім того, авторами використано м'які умови стабілізації препаратів, а дослідження найчастіше було проведено в зоні рН стабільності ферменту. Задачею нашого винаходу є розроблення нового простого способу довготривалої стабілізації тромбіну при температурі -20°С за зберігання препарату у формі розбавлених водно-сольових розчинів без додаткової концентрації їх на фільтрах «Amicon» (США) - використання дешевших реагентів; дослідження термоінактивації розчинів тромбіну в жорсткіших умовах, наприклад при 37 та 50°С, які досить часто реєструються на різних етапах виділення ферменту, особливо під час хроматографії, а також за термоінактивації тромбіну короткочасними високими температурами, необхідними для звільнення препарату від вірусів та небезпечних баластних білків. Очевидно також, що активність тромбіну знижується за дії детергентів, насамперед аніонних, та під час контакту препаратів зі стінками хімічного посуду або кровоносних судин. Крім того, нами запропоновано дослідження стабілізації тромбіну проводити в зоні рН-оптимуму його дії, щоб уникнути при визначенні активності ферменту додаткових процедур вводити в розчин слабку соляну кислоту або NaOH. При цьому слід використовувати 0,05Μ трис-НСІ-буфер, щоб уникнути мутності розчину, оскільки в системі завжди містяться іони Са ++. Для стабілізації тромбіну застосовували високоочищені препарати, а для одержання дійсної характеристики стабілізації тромбіну і уникнення побічних реакцій, дію ферменту визначали за згортальною активністю крові, а не амідазною активністю. Згортальну активність тромбіну визначали за тромбіновим часом - часом зсідання 0,5мл 0,1%-го розчину фібриногену під впливом 0,01мл розчину тромбіну при 29°С (рН 7,35) і виражали в одиницях ΝΙΗ. Для цього використовували калібровальну криву, яка віддзеркалює залежність часу зсідання фібриногену від концентрації тромбіну («Sigma», США), активність якого було раніше відкалібровано з використанням Міжнародного стандарту тромбіну (код Р4). Для визначення впливу стабілізувальних реагентів змішуємо розведені ферментні розчини, одержані після кінцевого етапу очищення хроматографічним методом (рН 7,6-8,0), з DL-лізином або L-глутаміновою кислотою до кінцевої концентрації 0,08-0,1Μ (1-1,5%). Використовували тромбін, який було виділено за методом, описаним в роботах [5,6]. Гомогенність препарату виявляли з використанням електрофорезу в ПААГ. Молекулярна маса його становила 36000, а питома активність 3000-3800 ΝlΗ/мг білка. Переваги запропонованого способу: - розбавлені водно-сольові розчини препарату зберігаються за присутності зазначених вище реагентів протягом одного року при t= -20°С без змін біологічної активності тромбіну, що свідчить про стабільність ферменту; - стабілізацію водно-сольового розчину тромбіну проведено за присутності індивідуальних DL-лізину або L-глутамінової кислоти при більш жорстких умовах. Показано, що при t=37°С зберігається 100% згортальної активності тромбіну протягом 48год. Значну стабілізувальну дію цих реагентів виявлено при термоінактивації препарату при 50°С. Оптимальні концентрації стабілізувальних агентів є 0,08-0,1М. Найкращим середовищем для дослідження стабілізації ферменту виявився 0,05Μ трис-НСІ-буфер (рН 7,6-8,0). Використані нами реагенти DL-лізин або L-глутамінова кислота стабілізують тромбін, утворюючи сполуки з реактивним центром їхніх молекул, які подібні сполукам фермент-субстрат. Стабільність всієї макроструктури ферментного білка у значній мірі залежить від стану його реактивного центру: молекули, які мають вільний реактивний центр, лабільніші за реактивний центр яких ввійшов у сполуку більш чи менш специфічного характеру. Другим фактором стабілізації тромбіну DL-лізином або L-глутаміновою кислотою може бути гальмування процесу автолізу. Висока стабільність виділеного нами гомогенного тромбіну дозволяє рекомендувати цей препарат для систематизованої характеристики ферменту, виділеними різними групами вчених, різними методами і з різного матеріалу та для характеристики препаратів, що містять протромбін, для визначення одиниць активності природних інгібіторів ферменту, зокрема антитромбіну III, гепарину то що. Можливість здійснення способу стабілізації тромбіну підтверджено прикладами. Приклад 1. Тромбін виділяли із пасти (ІІ+ІІІ), одержаної за фракціонування білків плазми за Коном [20]. Принципіальна схема виділення - це екстракція протромбіну та інших сполук, які залежать від вітаміну К, білкових факторів зсідання крові із її плазми, вибіркова адсорбція факторів протромбінового комплексу на хлористому барії, елюція протромбінового комплексу сірчанокислим амонієм; очищення протромбіну іонообмінною хроматографією на амберліті CG-50; активація протромбіну тромбопластином; очищення тромбіну від тромбопластину і активаційних фрагментів іонообмінною хроматографією на амберліті CG-50, з використанням елюції препарату 0,75Μ NaCl у 0,05Μ трис-НСІ-буфері (рН 7,6-8,0). За таких умов із 200мг вихідної пасти нами було одержано 60мг очищеного тромбіну з питомою активністю 3000-3800 NlН од/мг білка за зсіданням фібриногену. Вихід за активністю становив 89%. Для визначення впливу стабілізувальних агентів ми змішували розбавлені ферментні розчини, одержані після хроматографії (рН 7,6) з DL-лізином або Lглутаміновою кислотою до кінцевої концентрації 0,1М. Водно-сольові розчини зберігали при t=-20°С впродовж одного року. Ніяких змін згортальної активності не було виявлено, що свідчить про стабільність ферменту. Приклад 2. Досліджено термоінактивацію тромбіну при t= 37°С протягом 3, 6, 24 та 48год. Стабілізувальні агенти DL-лізин та L-глутамінову кислоту добавляли у водно-сольові розчини в еквімолярних кількостях до кінцевої концентрації 0,1М. В дослідах використовували 0,05Μ трис-НСІ-буфер (рН 7,6). Для визначення згортальної активності із суміші відбирали 0,01мл ферментного розчину. Біологічну активність визначали одночасно для всіх проб досліду, порівнюючи дію зазначених стабілізаторів між собою і з контрольним експериментом, в якому ці реагенти не застосовували. Таблиця 1 Стабілізація тромбіну DL-лізином або L-глутаміновою кислотою при t=37°С Згортальна активність ферменту, NlH Реагент Інкубація, год 3 6 24 48 Контроль 0,35 0,30 0,30 0,19 DL-лізин 0,57 0,49 0,49 0,38 L-глутамінова кислота 0,56 0,53 0,53 0,36 Як видно з наведених результатів, реагентам - DL-лізину або L-глутаміновій амінокислоті - притаманна протекторна дія, внаслідок чого сповільнюється денатурація тромбіну. В контрольних дослідах, проведених без добавки цих реагентів, інактивація (денатурація) ферменту відбувається завжди швидше (табл. 1). Приклад 3. Досліджено стійкість тромбіну при t=50°С в реакційних системах, які містять 1,59 ΝlΉ і 3,72 NIH од. Показано, що при 50°С протягом 10хв інкубації DL-лізин або L-глутамінова амінокислота в кінцевій концентрації 0,1Μ характеризується стабілізаційним впливом на молекулу тромбіну, який становить 52-58%, а протягом 20хв інкубації - 47-50% (табл. 2). Таблиця 2 Вплив стабілізувальних реагентів на стійкість тромбіну при t=50°С Час згортання Активність тромбіну, с ферменту, NIH 10 хв інкубації (в системі 3,72 NIH) 58 0,16 34 0,36 32 0,38 20 хв інкубації (в системі 1,59 NІH) 64 0,1 55 0,19 53 0,20 Реагенти Контроль DL-лізин L-глутамінова кислота Контроль DL-лізин L-глутамінова кислота Стабілізація препарату, % 55,6 57,9 47,4 50,0 Про значну стабілізувальну дію 0,1Μ DL-лізину в системі ферменту (4,76 ΝІΗ) при t=50°С протягом 50 хв свідчать дані, наведені в табл. 3. Таблиця 3 Вплив DL-лізина на каталітичну дію тромбіну при t=50°С Час, хв Контроль 10 20 30 40 50 Час згортання, с 58 34 39 45 47 49 Активність ферменту, NIH 0,16 0,36 0,30 0,26 0,24 0,22 Стабілізація препарату, % 55,6 46,7 38,5 33,3 27,3 Список посилань 1. Левицький В.Ю., Мелик-Нубаров Н.С, Слепнев В.И., Шикшнис В,Α., Можаев В.В. // Молек. биол. 1990. 24, №5. С.1246-1254. 2. Ме телица Д.И., Еремин Α.Η. // Усп. химии. 1987. 56, №11. С.1921-1948. 3. Мартинек К., Торчилин В.Г., Шикшнис В,Α., Максименко А.В., Смирнов В.Н., Березин И.В. // Докл. АН СССР. 1980. 251. С.1169-1172. 4. Mo zhaev V.V., Martinek K., Bere zin I.V. // Meth. En zymol. 1987. 135. P.586-596. 5. Fenton J.W., Ofosu F.Α., Moon D.G., Maraganore J.M. // Blood Coagulat. Febrinol. 1991. 2. P.69-75. 6. Fenton J.W. // Ann. N.-Y. Acad. Sci. 1981. 370. P.468-495. 7. Кудряшов Б.Α., Струкова С.Μ. // Усп. совр. биол. 1984. 97, вып. 2. С.193-207. 8. Серейская Α.Α., Струкова С.М. // ДАН СССР. 1985. 282, №2. С.481-484. 9. Кудряшов Б.А. // Усп. соврем, биол. 1989, вып. 1. С.55-68. 10. Струкова С.М., Серейская Α.Α., Осадчук Т.В. // Там же. 107, вып. 1. С.41-54. 11. Максименко А.В. // Биохимия. 1993. 58, вып. 9. С.1373-1384. 12. Гершкович А.А. // Там же. 61, вып. 7. С.1139-1151. 13. Кибирев В.К, Гершкович А.А. // Укр. биохим. журн. 1999. 71, №1. С.3-26. 14. Fenton J.W., Bing D.Μ. // Semin. Thromb. Hemost. 1986. 5. P.3-27. 15. Гершкович Α.Α., Кибирев В.К. // Биоорг. химия. 1988.14, №11. С.1461-1487. 16. Silbering S.В., Blythe R.P., Nesbitt R.U., Fawzi Μ.В. // Пат. 4965203. США. МКИ C12N 9/96. Опубл. 23.10.1990. 17. Nishimaki Hideo, Mi yano Kenmi, Kameyama Shouju, Takechi Kazuo // EP 0302754 A3. МКИ C12N 09/96, C12N 09/74, A61K 37:547. Опубл. 02.11.1989. 18. Helmut L, Knut B. // EP 0040799 A3. МКИ C12N 01/74; C12N 09:96, C12Q 01:56. Опубл. 13.01.1982. (прототип). 19. Gaffny P.J., Lord K., Brasher M., Kirkwood T.B.L. // Thromb. Res. 1977. 10, N 4. P.549-556. 20. Fenton J.W., Fasco M.J., Stackrow A.B. et al. "Human thrombins: Production, evaluation and properties of αthrombin" // J. Biol. Chem. 1977. 252, N11. P.3587-3598.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for stabilizing aqueous-salt thrombin solution
Автори англійськоюMakohonenko Yevhen Mytrofanovych, Volkov Heorhii Leonidovych
Назва патенту російськоюСпособ стабилизации водно-солевого раствора тромбина
Автори російськоюМакогоненко Евгений Митрофанович, Волков Георгий Леонидович
МПК / Мітки
МПК: C12N 9/74, A61K 35/16
Мітки: розчину, тромбіну, спосіб, водно-сольового, стабілізації
Код посилання
<a href="https://ua.patents.su/6-73399-sposib-stabilizaci-vodno-solovogo-rozchinu-trombinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб стабілізації водно-сольового розчину тромбіну</a>
Попередній патент: Пристрій для лазерного гравірування форм флексодруку
Наступний патент: Пристрій регулювання температури перегрітої пари при пускових режимах прямоструминного котла
Випадковий патент: Кондитерський виріб і спосіб його одержання