Комплекси платини ii з протипухлинною активністю, які містять хімічно модифіковані жовчні кислоти
Номер патенту: 78581
Опубліковано: 10.04.2007
Автори: Палм''єрі Бен''яміно, Медічі Алессандро, Бартолі Енцо
Формула / Реферат
1. Комплекс платини II формули:
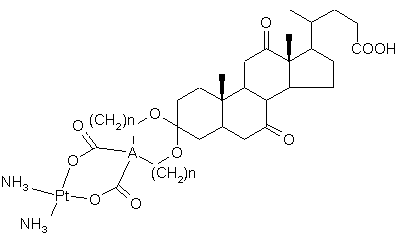 ,(I)
,(I)
в якій n є 0 або 1, а А представляє С або СН-СН-групу.
2. Комплекс за п. 1, який відрізняється тим, що n є 0, а А представляє СН-СН.
3. Комплекс за п. 1, який відрізняється тим, що n є 1, а А представляє С.
4. Комплекс за будь-яким з пунктів 1-3 для застосування як медикаменту.
5. Фармацевтична композиція, яка містить комплекс за будь-яким з пунктів 1-3 у суміші з прийнятними носіями і наповнювачами.
Текст
Винахід стосується комплексів платини (II), які мають антипухлинну активність, зокрема комплексів платини (II), в яких ліганди представлені аміаком і кеталєм у 3-позиції дигідрокси-дикарбоксильною кислотою. З аналізу досліджень антипухлинних властивостей цисплатини [див. публікацію В. Rosenberg et з!., Nature 205, 698, 1965; 222, 385 (1972)] відомо, що декілька досліджень було зосереджено на розробці комплексів платини, як; мають низьку токсичність і високу селективність відносно пухлинних клітин. Цuc-Платина фактично, незважаючи на її невротоксичність і ототоксичність, є особливо ефективною, коли використовується у комбінованій химіотерапії при лікуванні пухлин яєчок, яєчника, голови і шиї. Відомі комплекси платини, в яких два координаційних місця займають аміноліганди, а два інших координаційних місця займають функціональні групи стероїдних похідних. У [патенті ЕР 265 350], Кідані і інші, наведені комплекси, в яких стероїди, такі як холева і деоксихолева кислоти, координовані з металом через функціональні групи представлені на D кільці. З іншого боку, [Іспанський патент ES 2097085], описує комплекс металу, в якому координація жовчною кислотою відбувається через функціональні групи представлені на бокових ланцюгах у позиції 17. Винахід стосується комплексів платини (II) формули (1): в якій n є 0 або 1, а А є С або СН-СН група. Переважними втіленнями винаходу є комплекси, в яких: n є 0, а А є СН-СН група (сполука 1 а); n є 1, а А є С (сполука 1 b). Сполуку (1а) отримують починаючи з солі (2), в якій М є натрій або калій, і з аквакомплекса [(NH 3)2Pt(H20)2](NO3) 2. Сіль (2) отримують синтезом , який має наступні операції: 1) Суміш дегідрохолевої кислоти (3) і винної кислоти (4) естерифікують шляхом нагрівання під зворотним холодильником у спирті ROH з низькою молекулярною масою, який вибраний з метанолу, етанолу, пропанолу, ізопропанолу, переважно етанол, у присутності сульфонової кислоти R1SO3H, переважно, метансульфонової кислоти (схема 1), для отримання суміші естерів (5) і (6), в яких R є метил, етил, пропіл або Ізопропіл, переважно метил. 2) Продукт, отриманий у попередній операції, який складається з естерів (5) і (6), піддають нагріву у бензолі або толуолі, переважно у толуолі, для отримання кеталю карбонілу у 3- позиції дегідрохолевої кислоти формули (7), в якій R є такий, як визначено вище, разом з естерами (5) і (6), що не прорегували (схема 2). 3) Суміш естерів, отриманих у попередній операції омилюють шляхом обробки лужним гідроксидом BОН, де В є натрій або калій, переважно натрій, у водно-спиртовій суміші, в якій спирт є спиртом ROH з низькою молекулярною масою, вибраним з метанолу, етанолу, пропанолу, ізопропанолу, переважно етанолу, в якій співвідношення спирт-вода в межах від 3/1 до 1/1, переважно 2/1, згідно схеми 3. Динатрієву сіль (8) винної кислоти відфільтровують з реакційної суміші, а сіль (9) кетапю і мононатрієву сіль (10) дегідрохолевої кислоти, які отримані випаровуванням водно-спиртової фази, відокремлюють осадженням при різних рН, як це показано на схемі 4. Дегідрохолеву кислота (3) можна отримати доведенням рН до 5 кислотою, яка вибрана, наприклад, з гідрохлоридної кислоти, сульфатної кислоти, метасульфонової кислоти і паратолуолсульфонової кислоти, переважно, 20% сульфатної кислоти, з наступною екстракцією органічним розчинником, переважно етилацетатом; рН далі знижують приблизно до 3 для екстрагування триосновної кислоти (11а), а при доведенні рН до величини нижче 2 отримують суміш, яка складається з дикеталів (12) і (13). 4) Шляхом обробки триосновної кислоти (11а) 2 еквівалентами гідроксиду МОН, який визначено вище, переважно, натрій гідроксидом, отримують сіль (2), яку застосовують для приготування комплексу платини II (схема 5). Реакцію між аквакомплексом (14) і сіллю (2) проводять звичайними способами, які застосовують для отримання комплексів платини, а аквакомплекс (14) отримують з цис-платини у відповідності з тим, як описано у лі тературі. Сполуку (1b) отримують шляхом реакції солі (15), в якій М має значення, визначене вище, з аквакомплексом (14) (схема 6): Дегідрохолева кислота реагує з естером біс(гідроксиметил) малонової кислоти (16), в якому R має значення, визначене вище, у толуолі під зворотним холодильником в присутності сульфа тної кислоти, переважно паратолуолсульфонової кислоти , для отримання відповідного кеталю формули (17). Гідроліз гідроксидом натрію у метанолі і наступна обробка 20% соляною кислотою забезпечує вихід триосновноґ кислоти формули (11b). Сполуки (1), при введенні людині або тварині, які мають пухлини, що можуть лікуватися цисплатином або є резистентними до цисплатину, спроможні викликати регресію пухлин. Сполуки (1) можна застосовувати для лікування тих патологічних станів, для яких використовують цисплатин, зокрема для лікування пухлин [дивись публікацію Douple etal/ Cisplatin Current Status and Developments, Ed. A. W. Prestayk et ai., Academic Press, 125 (1880; Douple et si. Platinum Metais Res., 29; 118 (1985)]. Отже, винахід також стосується фармацевтичних композицій, які вміщують терапевтично ефективну кількість сполуки формули (1) у суміші із звичайними носіями і наповнювачами, Ефективну дозу сполук (1) визначатиме лікар за звичайними методиками. Співвідношення між дозами, які використовували для тварин різних видів і для людей (мг/м 2 площі тіла) описані у публікації [Freirech et al., Quantitative Comparison of Toxicity of Anticancer Agents in Mouse, Rat. Hamster, Dog, Monkey and Man Cancer Chemother, Rep, 50, n. 4, 219-244 (1986)]. Пацієнт отримуватиме дози комплексу на рівні від 0,1 до 200мг/кг ваги тіла, з режимом дозування, який буде дуже залежати від багатьох факторів, які добре відомі клініцистам, а режим лікування дуже залежить від типу пухлини, яку лікують, і від складності хвороби пацієнта. Сполуки (1) можна уводити перорально, парентерально, місцево або внутрішньопухлинно. Фармацевтичні композиції для парентерального введення охоплюють соляні стерильні розчини або суспензії, або стерильні порошки для незапланованого приготування розчинів або суспензій. Фармацевтичні композиції для парентерального введення також охоплюють олійні препарати для внутршньом'язового або внутрішньошлункового введення. Фармацевтичні композиції для перорального введення охоплюють, наприклад, сиропи або подібні рідинні форми, а також тверді форми, такі як таблетки, капсули і подібні. Фармацевтичні композиції за винаходом отримують такими відомими способами, як наведені у [публікації Remington's Pharmaceutical Sciences Handbook, XVII Ed.T Mack Pub., N.Y., США]. Сполуки (1) можна уводити разом з однією або більше речовинами, які підсилюють їх антипухлинну активність або які пом'якшують побічні ефекти, які супроводжують терапію комплексами платини, наприклад, разом із зменшеним глютатіоном, як описано у [патентах GB 2.174.905 і US 4,871,528]. Комплекси (1) також, переважно, можна уводити разом з іншими комплексами платини, які мають антипухлинну активність, тому додатковим об'єктом винаходу є фармацевтичні композиції, які містять сполуку (1) у комбінації з комплексом платини з антипухлинною активністю. Винахід додатково стосується застосування сполук (1) для приготування фармацевтичних композицій для лікування ссавців, які уражені пухлинами і які можуть лікуватися цис-платиною або є резистантними до цисплатини. Винахід ілюструється детально наступними прикладами. Приклади Матеріали і способи 1 Н-ЯМР- спектр реєстрували на спектрометрі типу "Varian Gemini 300 MHz" при частоті 300 МГц. Хімічні зсуви виражені у млн -1. 13 С-ЯМР-спектр триосновної кислоти (11а) реєстрували на спектрометрі типу "Varian Gemini 300 MHz" при частоті 75,1МГц. Хімічні зсуви виражені у млн -1. Інфрачервоні спектри реєстрували у КВr за допомогою спектрометра типу "N1COLET 51 ОР з перетворенням Фур'є". Приклад 1. Синтез холевої кислоти І L+)винної кислоти 3-кеталь Одержання сполуки формули 1а-Синтез дегідрохоево і L+)винної кислот етилового естеру 25г (1моль) дегідрохолєвої кислоти розчинюють у 200мл етанолу, у колбі на 250мл з круглим дном, яка обладнана магнітною мішалкою і холодильником, і додають 28г (3молі) L(+)винної кислоти і 0,4мл (0,1моль) метансульфонової кислоти. Суміш гріють під зворотним холодильником протягом приблизно 5-6 годин, відстежуючи хід реакції ТШХ (елюент; етилацетат/циклогексан/оцтова кислота; 50/50/1); спостерігають зникнення дегідрохолєвої кислоти і утворення двох нових продуктів, які мають величину Rf яка є вище, ніж у дегідрохолєвої кислоти. Після закінчення реакції суміш охолоджують і випаровують етанол під зменшеним тиском для отримання білої твердої речовини. Одержання сполуки формули 1b - Синтез Кеталю Білу тверду речовину, отриману у попередній операції, додають у 150мл толуолу, додають 0,4мл (0,1молі) метансульфонової кислоти, а потім гріють під зворотним холодильником у апараті Дина - Старка протягом 10 годин. Далі відстежуюють хід реакції з допомогою ТШХ (елюент: етилацетат/циклогексан/оцтова кислота; 50/50/1); спостерігають зникнення етилового естеру дегідрохолєвої кислоти. Після закінчення реакції суміш охолоджують і випаровують етанол під зменшеним тиском для отримання темно коричневої олії. Одержання сполуки формули 1с - Реакція омилення і підкислення Олійний залишок, отриманий від попередньої операції, обробляють 25г (0,63моль) NaOH, розчиненого у 100мл СН3ОН і 100мл води Одразу відбувається омилення з утворенням білого осаду який містить натрії тартрат і який фільтрують крізь пористу мембрану і промивають 60мл СН 3ОН Фільтрат концентрують у обертовому випарнику і отриману темну тверду речовину переносять у 200мл води 1100мл етилацетату Двофазну систему обробляють 20% H2SO4, органічну фазу відокремлюють при рН5, висушують і концентруюсь таким чином отримуючи назад депдрохолеву кислот/ що не прореагувала. До водної фази додають 100мл етилацетату і доводять до рН2,5-3 з допомогою 20% H2SO4 триосновна кислота осаджується і її одразу екстрагують у органічній фазі. Останню відокремлюють і висушують, після короткого відрізку часу спостерігають кристалізацію триосновної кислоти (звичайно у вигляді бліднокоричневих кристалів). Водну фазу обробляють 20% H2SO4 дo рН1 для отримання осаду, який в основному містить 3,7-дикеталь і 3,12-дикеталь дегідрохолевої кислоти. Одержання сполуки формули 1d- Кристалізація триосновної кислоти у етилацетаті 20г вихідної кислоти після першої кристалізації розчиняють у 200мл етилацетату і 15мл води у колбі на 250мл з круглим дном. Отриманий коричневий розчин містить залишок, кольору, який відфільтрують. Розчин висушують сульфатом натрію і випаровують під зниженим тиском, помітно зменшуючи його об'єм, потім охолоджують і залишають на декілька годин таким чином осаджуючи триосновну кислоту у вигляді білої твердої речовини, яку відфільтровують і промивають етилацетатом. Після сушки отримують 13,4г триосновної кислоти (вихід кристалізації 67%) 1 Н-ЯМР(піридин-d5+D20), 1,06-1,13 (6Н d-s, 2I/18-СН3), 1,36 (3H, s, 19-CH3), 1 4-2,6 (m, аліфатичний СН і СН2), 2 8 (1Н t, 11-СН), 2,98-3,1 (2Н m, 6/8СН), 5,4 (2Н m (d,d)s 25/26 СН) 1 H-ЯMP(CD3COOD + D20), 0,9 (3Н, d 21-СН3), 1,19 (3Н, s, 18-CH 3), 1,45 (3H, s, 19-СН3), 1,5-2,6 (m, аліфатичний СН , СН2), 2,9(1 Н, t, 11-СН), 31 (2Н, m, 6/8-СН), 4,95 (2Н, m (d,d), 25/26-CH) 13 С-ЯМР (піридин d5+D2О), 141,4 (С-І), 140,9 (С-8), 132,0 (С-4), 128,5-126,6 (С-ароматизатори), 81 9 (С-7), 62,9 (С-14), 55, 14 (С-15) 52.43 (С-16), 22,16 (С-17), 21,23 (С-18) ІЧ (см -1), 2980-2900 (розширення аліфатичної системи v-CH CH 2 СН3), 1750-1770 (некоординоване розширення vC=O) 1715-1700 (розширення депдрокарбонілів vC=O), 1400 (d-СН,СН2,СН3згин аліфатичної системи), 1250-1300 (vC=O розширення некоординованих карбоксилів). Елементний аналіз (підрахований для С 28Н38О10) Підрахована величина, С 62 90%, Н 7,16%, О 29,94% Виявлена величина С 62,81%, Н 7,64%, О 29,55% Одержання сполуки формули 1е - Синтез аквакомплексу [(NH3) 2 Рt (Н 2O)2 ](NO3) 2 0,75г (1,0молі) (NH2)3PtCI2 суспендують у колбі, яка захищена від світла і яка містить 20мл води, до спензії додають краплями при перемішуванні з розчином 0,84г (2,0молі) AgNO3 у 5мл води. Після закінчення додавання колбу розміщують на бані, яка термостатована при 60°С, і перемішують протягом 4 годин, після того суміш залишають для охолодження і аргентум хлорид відфільтровують. Отримують чистий блідо-жовтий фільтрат, який містить аквакомплекс [(NH 3)2Pt(H20)2](NO3)2 . Одержання сполуки формули 1f- Динатрієва сіль триосновної кислоти До 2,0молі 1 Н NaOH додають при перемішуванні до 1,33г (1,0молі) триосновної кислоти, додаючи декілька мл води для покращення перемішування. Розчин, який вміщує сіль, застосовують так, як це буде описано у наступній операції. Одержання сполуки формули Іg - Утворення цис-[діамін-(3-дегідрохоланоіліден-Lтартрат)платина (II)] До гарячого розчину динатрієвої солі триосновної кислоти додають розчин аквакомплексу, утворюється біло-жовтий пластівчастий осад. Реакційну суміш перемішують на бані, яка термостатована при 60°С, протягом 10 годин. Осад фільтр ують відсмоктуванням і залишають для сушки на повітрі або стаціонарному сушильному апараті при температурі 100°С. Отримують 1,56г комплексу (ви хід 84%). 1 Н-ЯМР (CD3COOD + D20 2:1) 0,9 )3Н, d, 21-CH3). 1,19 (3Н, s, 18-СН3), 1,45 (3Н, s, 19-СН3), 1,5-2,6 (m, аліфатичний СН, СН2), 2,9 (Н, t, 11-СН), 3,1 (2Н, m, 6/8-СН) 4,2 (6Н, s, NH 3), 4,8 (2Н, m, (d,d), 25/26-CH). ІЧ (см -1 1), 3285-3270 (vN-H розширення); 2980-2900 (розширення аліфатичної системи v-CH, -СН2, -СН3), 1715-1700 (vC=O розширення дегідро карбонілів); 1650-1600 (vC=O розширення координованих карбоксилів); 1350-1380 (vC=O розширення координованих карбоксилів). Елементний аналіз (підрахований для C28H42 О10PtN2) Підрахована величина: С 44,15%, Н 5,52%, N 3,68% Виявлена величина С 41,26%, Н 6,24%, N 4,00% Приклад 2. Триметиловий естер 3-кеталю Холевї кислоти і біс(гідроксиметил)-малонової кислоти 1 Н-ЯРМ (CD3OD); 0,8 93Н, d, 21-СН3); 1,1 (3Н, s, 18-CH 3); 1,25 (3Н, s, 19-CH 3); 1,5-2,5 (m, аліфатичний СН, СН2); 2,65 (H,t, 1,1-СНО; 2,8 (2Н, m, 6/8-СН); 3,6-3/8 (9Н, 3s, 29/30/31-СН3); 4,3 (4Н, m (d,d), 25/26-CH 2).
ДивитисяДодаткова інформація
Назва патенту англійськоюPlatinum complexes containing bile acids derivatives having antitumor activity
Назва патенту російськоюКомплексы платины ii с противоопухолевой активностью, которые содержат химически модифицированные желчные кислоты
МПК / Мітки
МПК: C07J 51/00, A61P 35/00
Мітки: хімічної, модифіковані, жовчні, активністю, протипухлинною, платини, комплекси, кислоти, містять
Код посилання
<a href="https://ua.patents.su/6-78581-kompleksi-platini-ii-z-protipukhlinnoyu-aktivnistyu-yaki-mistyat-khimichno-modifikovani-zhovchni-kisloti.html" target="_blank" rel="follow" title="База патентів України">Комплекси платини ii з протипухлинною активністю, які містять хімічно модифіковані жовчні кислоти</a>
Попередній патент: Спосіб одержання 1,2,4-триазол-1-ілметилоксиранів та проміжна сполука
Наступний патент: Пристрій для вимірювання товщини прозорої плівки
Випадковий патент: Система стабілізації тиску коксового газу в його мережі під час кантувальних пауз на коксових батареях










