Спосіб одержання 1,2,4-триазол-1-ілметилоксиранів та проміжна сполука
Номер патенту: 78580
Опубліковано: 10.04.2007
Автори: Хеннінгзен Міхаель, Ноак Райнер, Зандер Міхаель
Формула / Реферат
1. Спосіб регіоспецифічного одержання 1,2,4-триазол-1-ілметилоксиранів формули І,
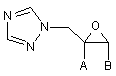 ,(I)
,(I)
у якій А і В однакові або різні і незалежно один від одного означають С1-С4-алкіл, феніл-С1-С2-алкіл, С3-С6-циклоалкіл, С3-С6-циклоалкеніл, тетрагідропіраніл, тетрагідрофураніл, діоксаніл або феніл, причому фенільний залишок може мати від одного до трьох замісників, вибраних із групи, яка включає галоген, нітро, С1-С4-алкіл, С1-С4-алкілокси, феноксі, аміно, С1-С2-галогеналкіл або фенілсульфоніл, причому
а) оксиран формули II,
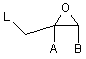 ,(II)
,(II)
у якій А і В мають вищенаведені значення і L означає нуклефільно заміщувану групу, що відходить, піддають взаємодії з 4-аміно-1,2,4-триазолом формули III
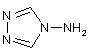 ,(III)
,(III)
з одержанням 4-аміно-1,2,4-триазолієвих солей формули IV
 ,(IV)
,(IV)
b) 4-аміно-1,2,4-триазолієві солі формули IV деамінують нітритами лужних металів й кислотою або органічними нітритами з одержанням 1,2,4-триазол-1-ілметилоксиранів загальної формули І.
2. Спосіб за п. 1, який відрізняється тим, що реакцію взаємодії на стадії а) проводять у присутності органічного розчинника.
3. Спосіб за п. 2, який відрізняється тим, що як органічний розчинник використовують спирти, кетони, нітрили, складні ефіри, органічні карбонати, неароматичні й ароматичні вуглеводні, прості ефіри, аміди, диметилсульфоксид, сульфолан або їх суміші.
4. Спосіб за будь-яким з пп. 2 або 3, який відрізняється тим, що як органічний розчинник використовують метанол, етанол, бутанол, ізопропанол, пентанол, гексанол, октанол, деканол, метилгліколь, етилгліколь, н-бутилгліколь, ацетон, метилетилкетон, циклогексанон, ацетонітрил, пропіонітрил, етилацетат, бутилацетат, тетрагідрофуран, диметоксіетан, діоксан, диметилформамід, диметилацетамід, N-метилпіролідон, тетраметилсечовину, диметилсульфоксид, сульфолан або їх суміші.
5. Спосіб за п. 4, який відрізняється тим, що як органічний розчинник використосовують н-бутилгліколь, 2-етилгексанол або їх суміші з толуолом.
6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що реакцію взаємодії на стадії а) здійснюють при температурі від 50 до 150°С.
7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що реакцію взаємодії на стадії а) здійснюють у присутності 0,01-5 мол.% каталізатора або 5-300 мол.% допоміжної речовини.
8. Спосіб за п. 7, який відрізняється тим, що як каталізатор використовують четвертинну амонієву сіль, четвертинну фосфонієву сіль, бетаїни і/або як допоміжну речовину використовують нуклеофільні аніони і аміни.
9. Спосіб за будь-яким з пп. 7 або 8, який відрізняється тим, що як каталізатор використовують тетрабутиламонійхлорид, 4-диметилсульфонійфенолат і/або як допоміжну речовину використовують ціаніди, йодиди, фториди, діазобіциклооктан, диметиламінопіридин, диметилциклогексиламін, трибутиламін, триетиламін або діазабіциклоундекан (ундецен).
10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що одержані на стадії а) 4-амінотриазолієві солі формули IV виділяють із реакційної суміші осадженням і/або кристалізацією.
11. Спосіб за п. 10, який відрізняється тим, що осадження і/або кристалізацію 4-амінотриазолієвих солей формули IV здійснюють при температурі нижче 10°С.
12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що одержані на стадії а) 4-амінотриазолієві солі формули IV екстрагують із реакційної суміші безперервною і/або перериваною екстракцією.
13. Спосіб за п. 12, який відрізняється тим, що безперервну і/або переривану екстракцію проводять водою, у випадку необхідності, в присутності органічного розчинника, що не змішується з водою.
14. Спосіб за будь-яким з пп. 1-13, який відрізняється тим, що деамінування на стадії b) проводять у водному розчині, в суміші води/тетрагідрофурану, води/спиртів або води/N-метилпіролідону.
15. Спосіб за будь-яким з пп. 1-14, який відрізняється тим, що деамінування на стадії b) проводять органічними нітритами у водному або органічному розчиннику або в сумішах водних/органічних розчинників, таких як вода/тетрагідрофуран, вода/спирти, вода/N-метилпіролідон.
16. Спосіб за будь-яким з пп. 14 або 15, який відрізняється тим, що деамінування на стадії b) здійснюють при температурі від -10 до 60°С.
17. 4-Аміно-1,2,4-триазолієві солі формули IV,
 (IV)
(IV)
де А, В і L- мають зазначені в п. 1 значення.
18. 4-Аміно-1,2,4-триазолієві солі формули IV за п. 17, у якій А і В однакові або різні і означають заміщений галогеном, С1-С4-алкілом або С1-С4-алкокси фенільний залишок.
19. 4-Аміно-1,2,4-триазолієві солі формули IV за п. 17, у якій А означає 4-фторфеніл і В означає 2-хлорфеніл.
Текст
Даний винахід відноситься до способу регіоспецифічного одержання 1,2,4-триазол-1-ілметилоксиранів формули І, у якій А і В однакові або різні і незалежно один від одного означають С 1-С4-алкіл, феніл-С 1-С2-алкіл, С3-С6циклоалкіл, С3-С6-циклоалкеніл, тетрагідропіраніл, тетрагідрофураніл, діоксаніл або феніл, причому фенільний залишок може мати від одного до трьох замісників, вибраних із групи, яка включає галоген, нітро, С1-С4-алкіл, С1-С4-алкілокси, феноксі, аміно, С1-С2-галогеналкіл або фенілсульфоніл, причому а) оксиран формули II, у якій А і В мають вищенаведені значення і L означає нуклефільно заміщувану гр уп у, що відходить, піддають взаємодії з 4-аміно-1,2,4-триазолом формули III з одержанням 4-аміно-1,2,4-триазолієвих солей формули IV і b) 4-аміно-1,2,4-триазолієві солі формули IV деамінують нітритами лужних металів і кислотою або органічними нітритами з одержанням 1,2,4-триазол-1-ілметилоксиранів загальної формули І. 4-Амінотриазолієві солі формули IV є проміжними продуктами для одержання азолілметилоксиранів. Азолілметилоксирани служать для одержання фунгіцидних засобів, зокрема, засобів проти хвороб зернових культур. З [ЕР-А 94 564, US 4,906,652, ЕР-А 330 132 і ЕР-А 334 035] відомі способи одержання триазолілметилоксиранів, виходячи з оксирану формули II і 1,2,4-триазоліну в присутності основи. Усі ці способи проводять при кімнатній температурі. Час реакції складає близько 8-18 годин. [DE-A 39 36 823] описує реакцію взаємодії оксирану формули II з 1,2,4-триазолідоном натрію протягом 5 годин при 75°С. Як розчинник застосовують диметилформамід і N-метилпіролідон. Обробка одержаного продукту триазолування здійснюється осадженням у воді і/або екстракцією. Відомі з рівня техніки способи мають ряд недоліків. При триазолуванні сполук формули II утворюються поряд з бажаними 1- також і 4-заміщені триазоли в кількостях 10-35%. Далі при сольволізі і реакції розкриття циклу утворюється ряд побічних продуктів, що знижують ви хід і значно ускладнюють виділення й очищення цільових триазолілметилоксиранів. Для очищення одержаних сумішей ізомерів використовуються наступні методи: Екстракція (відома, наприклад, з [DE-A 3218130, DE-A 3536529, DE-A 3805376, DE-A 3737888, ЕР-А 330132, US 4,906,652]), осадження (наприклад, з [DE-A 3936823]), хроматографія (наприклад, з [DE-A 3806089]), рекристалізація з простого діізопропілового ефіру [DE-A 3936823, US 4,906,652], метил-третбутилового ефір у/н-гексану [DE-А 3805376, ЕР-А 330132], метил-трет-бутилового ефіру [DE-A 3737888]. В усіх випадках повинні комбінуватися різні методи. Чистота біологічно активних ізомерів складає в більшості випадків нижче ніж 92%, тільки після вищеописаних складних методів обробки можна одержати чистоту більш ніж 94%. З літератури також відомо, що при алкілуванні 4-амінотриазолів утворюються четвертинні триазолієві солі IV, ациклічні аміногрупи яких можуть бути деаміновані аналогічно хімії 1,1-заміщених відповідним чином похідних гідразину нітритом натрію і НСІ. Утворюються регіоселективно заміщені похідні триазолу [див. публікацію Houben-Weyl, E 14,479 і далі]. Цю реакцію можна також переносити на алкілування галометилкетонами [див. публікацію Astleford і ін. J. Org. Chem. 54,731 (1989)] і вона описана для одержання фунгіцидних діючих речовин, наприклад, у [Can. Pat 2.051.281]. Оксирани реагують відповідно до європейської [заявки ЕР 618.198] при розкритті оксиранового циклу з одержанням 2-гідроксіалкіл-4-амінотриазолієвих солей, які, щоправда, можуть бути деаміновані, однак потім приводять до утворення 2-гідроксіалкілтриазолів. При врахуванні згаданого рівня техніки не можна було очікувати, що сполуки формули II можуть взаємодіяти з 4-амінотриазолами з одержанням 4-амінотриазолієвих солей, у яких зберігається оксирановий цикл. Несподівано був розроблений такий спосіб одержання 1-заміщених триазолметилоксиранів, у якому використовують стерично утруднені оксирани II, що піддають взаємодії з 4-амінотриазолами без, відповідно, присутності каталізаторів або допоміжних речовин з одержанням четвертинної амонієвої солі IV і після цього неалкіловані 4-аміногрупи піддають деамінуванню нітритами лужних металів і кислотою або органічними нітритами. При цьому утворюються бажані 1-заміщені триазолілметилоксирани без домішок або 4-заміщених триазолілметилоксиранів. Бездоганне утворення продуктів відповідно до винаходу є несподіваним, тому що, по-перше потрібно було очікувати реакцію амінотриазолу з оксирановим циклом з одержанням гідроксіалкілтриазолів і, по-друге, потрібно було побоюватися розкриття оксиранового циклу в присутності сильної кислоти. Нижче більш докладно пояснюється спосіб відповідно до винаходу. Для способу відповідно до винаходу придатні азолметилоксирани, що одержані з наступних вихідних продуктів: а) оксирани формули II, у якій А і В однакові або різні і незалежно один від одного означають С 1-С4-алкіл, феніл-С 1-С2-алкіл, С3-С6-циклоалкіл, С3-С6-циклоалкеніл, тетрагідропіраніл, тетрагідрофураніл, діоксаніл або феніл, причому фенільний залишок може мати від одного до трьох замісників, вибраних із групи, яка включає галоген, нітро, С1-С4-алкіл, С1-С4-алкілокси, феноксі, аміно, С1-С2-галогеналкіл або фенілсульфоніл і L означає нуклефільно заміщувану гр упу, що відходить. Оксирани можуть бути одержані способами, описаними в [ЕР-А 94564, US 4,906,652, ЕР-А 330132, ЕР-А 334035 і DE 3936823]. Кращі вихідні сполуки мають наступні замісники, причому перевага має силу як для окремих сполук, так і для їх комбінації: А і В переважно означають заміщений галогеном, С1-С4-алкілом або С1-С4-алкілокси фенільний залишок. Особливо краще А означає 4-фторфеніл і В означає 2-хлорфеніл. L означає нуклефільно заміщувану гр упу, що відходить, як наприклад, галогенід, алкілсульфонат, арилсульфонат або алкілсульфат. Кра ще L означає хлорид, бромід, тозилат і мезилат. Особливо краще L означає мезилат. b) 4-аміно-1,2,4-триазоли формули III або аналогічні похідні. Застосовуваний відповідно до винаходу 4-амінотриазол можна легко одержати з гідразину і формаміду [див. п ублікацію Houben-Weyl E 14,525]. Одержання 4-амінотриазолієвих солей формули IV відповідно до винаходу здійснюють звичайно в присутності органічного розчинника і, у випадку необхідності, при використанні каталізатора або допоміжної речовини при температурі від 0 до 150°С, краще від 50 до 150°С. До кращих органічних розчинників відносяться спирти, такі, як метанол, етанол, бутанол, ізопропанол, пентанол, гексанол, октанол, деканол, метилгліколь, етилгліколь, н-бутилгліколь, кетони, такі, як ацетон, метилетилкетон або циклогексанон, нітрили, такі, як ацетонітрил або пропіонітрил, складні ефіри, такі, як етилацетат, бутилацетат, органічні карбонати, такі, як диметилкарбонат або диетилкарбонат, неароматичні або ароматичні вуглеводні, такі, як циклогексан, толуол, хлорбензол або 1,2-дихлорбензол, прості ефіри, такі, як тетрагідрофуран, диметоксіетан, діоксан, аміди, такі, як диметилформамід, диметилацетамід, Nметилпіролідон, тетраметилсечовина, далі диметилсульфоксид, сульфолан і відповідні суміші. Як кращі розчинники придатні спирти, такі, як метанол, етанол, ізомерні бутаноли і пентаноли, 2етилгексанол, метилгліколь, етилгліколь, н-бутилгліколь, а також їх суміші з толуолом. Особливо кращі н-бутилгліколь, 2-етилгексанол, а також їх суміші з толуолом. Як каталізатори придатні четвертинні амонієві і фосфонієві солі, такі, як тетрабутиламонійхлорид, бетаїни, такі, як 4-диметилсульфонійфеналат. Як допоміжні речовини придатні спеціальні нуклеофільні аніони, наприклад, ціанід, йодид, фторид, аміни, такі, як діазобіциклооктан, диметиламінопіридин, диметилцикпогексиламін, трибутиламін, триетиламін або діазобіциклоундекан (ундецен). Каталізатори використовують у кількості 0,01-5мол.% у перерахунку на оксиран II, допоміжні речовини в кількості 5-300мол.%. 4-амінотриазолієві солі формули IV можуть бути одержані в чистій формі з реакційних сумішей кристалізацією і/або осадженням, у випадку необхідності, при низьких температурах - нижче 10°С. 4-амінотриазолієві солі формули IV розчиняють у воді й обробляють нітритами лужних металів, такими, як нітрит калію або нітрит натрію і сильними кислотами, такими, як соляна або сірчана кислота при температурі від -10 до 60°С. Можуть також використовуватися органічні нітрити, такі, як наприклад, н-бутилнітрит або третбутилнітрит. Поряд з водними розчинами деамінування можна здійснювати також і в сумішах водних/органічних розчинників, таких, як вода/тетрагідрофуран, вода/спирти або вода/N-метилпіролідон. Далі можливо видаляти використаний розчинник випаровуванням і залишок піддавати деамінуванню після відділення водонерозчинних компонентів. Особливим варіантом є проведення амінотриазолування, в розчиннику, що змішується в малому ступені з водою, такому, як н-бутанол, і-пентанол, 2-етилгексанол або тетрабутилсечовина при одночасній або наступній екстракції четвертинної солі водою. Триазолілметилоксирани, що утворюються, як правило, осаджуються з водного розчину вже при деамінуванні. Осадження може комплетуватися нейтралізацією. У способі відповідно до винаходу співвідношення 1-заміщених до 4-заміщених триазолів (регіоселективність) підвищується до значення 50. Часто 4-заміщені похідні триазолу більше не виявляються. Одержаний продукт більше не потрібно піддавати складному очищенню. Вміст 1-заміщеного триазолу, як правило, складає більш ніж 98%. Частка неактивних ізомерів і побічних продуктів значно знижена і разом з цим значно підвищена екологічна ефективність агрохімічної діючої речовини. Ще одним об'єктом даного винаходу є 4-аміно-1,2,4-триазолієві солі формули IV, у якій А і В однакові або різні і незалежно один від одного означають С 1-С4-алкіл, феніл-С 1-С2-алкіл, С3-С6циклоалкіл, С3-С6-циклоалкеніл, тетрагідропіраніл, тетрагідрофураніл, діоксаніл або феніл, причому фенільний залишок може мати від одного до трьох замісників, вибраних із групи, яка включає галоген, нітро, С1-С4-алкіл, С1-С4-алкілокси, феноксі, аміно, С1-С2-галогеналкіл або фенілсульфоніл, і L- означає аніон нуклефільно заміщуваної групи, що відходить такий, як, наприклад, галогенід, алкілсульфонат, арилсульфонат або алкілсульфат. А і В переважно означають заміщений галогеном, С1-С4-алкілом або С1-С4-алкілокси фенільний залишок. Краще А означає 4-фторфеніл і В означає 2-хлорфеніл. Краще L- означає хлорид, бромід, тозилат і мезилат. Особливо краще L- означає мезилат. Наведені для замісників А, В і L органічні частини молекули являють собою збірні поняття для індивідуального перерахунку окремих членів груп. Всі вуглеводневі ланцюги, тобто такі, як алкіл, алкокси, галогеналкіл, фенілалкіл, циклоалкіл, циклоалкеніл можуть бути нерозгалуженими або розгалуженими. Якщо не зазначено по-іншому, галогеновані замісники мають переважно від одного до п'яти однакових або різних атомів галогену. Значення галоген включає хлор, фтор, бром або йод. Далі наведені наступні значення: - С1-С4-алкіл означає, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2-метилпропіл або 1,1-диметилетил; - С1-С2-галогеналкіл означає С 1-С2-алкільний залишок, наведений вище, що частково або повністю заміщений фтором, хлором, бромом і/або йодом, тобто, наприклад, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорметил, дихлорфторметил, хлордифторметил, 2-фторетил, 2хлоретил, 2-брометил, 2-йодетил, 2,2-дифторетил, 2,2,2-трифторетил, 2-хлор-2-фторетил, 2-хлор-2,2дифторетил, 2,2-дихлор-2-фторетил, 2,2,2-трихлоретил, пентафторетил. - С1-С4-алкоксі означає, наприклад, метоксі, етокси, пропокси, 1-метилетокси, бутокси, 1-метилпропокси, 2метилпропокси або 1,1-диметилетокси; феніл-С 1-С2-алкіл означає заміщений фенільним залишком С 1-С2-алкіл, такий, як бензил, 1-фенілетил і 2фенілетил; - С3-С6-циклоалкіл означає, наприклад, циклопропіл, циклобутил, циклопентил або циклогексил; С3-С6-циклоалкеніл означає С 3-С6-циклоалкіл з подвійним зв'язком, такий, як циклопропеніл, циклобутеніл, циклопентеніл або циклогексеніл. Спосіб відповідно до винаходу пояснюється наступними прикладами виконання. Як оксиран II використовують у всі х випадках сполуку формули II з наступними замісниками: L=CH3SO2O-, В=4-фторфеніл і А=2-хлор феніл. Приклад 1: 142,8г сполуки формули II (L=MeSO2 O-, цис/транс 5:95) нагрівають разом з 33,6г 4-аміно-1,2,4-триазолу і 400мл н-бутанолу протягом 8 годин до 100°С. Амінотриазолієва сіль, що утворилася, випадає з реакційної суміші у твердій формі. Конверсія мезилату складає більш ніж 90% (визначеного за методом ВЕРХ). Після охолодження суміші можна було відділити 110г 4-амінотриазолієвої солі формули IV (62% вихід). Маточний розчин може використовуватися із амінотриазолієвою сіллю, що залишилася в розчині (біля 45г) для наступної реакції. 4-Амінотриазолієва сіль має Тпл.=192°С. Приклад 2: 142,8г сполуки формули II (L=MeSO 2O-, цис/транс 5:95) розчиняють в 500мл ізопропанолу і потім нагрівають протягом 8 годин при 80°С разом з 33,6г 4-амінотриазолу. Досягають конверсії сполуки ІI в 51% і можуть відокремлювати з охолодженого розчину прибл. 72г 4-амінотриазолієвої солі формули IV (80% непрореагованої сполуки II). Тпл. становить 193°С. Аналогічний тест у присутності 0,2г йодиду калію досягає через 8 годин конверсії в 67%. Приклад 3: 454мл розчину мезилату в диметилформаміді, що містить 143г мезилату II (цис/транс 5:95) нагрівають разом з 33,6г 4-аміно-1,2,4-триазолу й 400мл N-метилпіролідону протягом 2 годин до 130°С. Амінотриазолієву сіль формули IV, що утворилася після видалення розчинника вакуумом можна очищати обережним промиванням залишку ацетоном/МеОН. Конверсія мезилату становить більш ніж 97% (за методом ВЕРХ). Виділяють 140г 4-амінотриазолієвої солі формули IV (81% ви хід). 4-Амінотриазолієва сіль формули IV має Тпл.=190°С. Приклад 4: Суміш із 5г (14ммоль) мезилату і 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (153ммоль) 2-етилгексанолу перемішують протягом 16 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 85%. Приклад 5: Суміш із 5г (14ммоль) мезилату й 1,1г (13ммоль) 4-аміно-1,2,4-триазолу в 20г (148ммоль) дигліму перемішують протягом 7 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 25%. Приклад 6: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (202ммоль) Nметилпіролідону перемішують протягом 7 годин при 100°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 72%. Приклад 7: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (149ммоль) простого діетиленглікольдиметилового ефіру перемішують протягом 7 годин при 100°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 51%. Приклад 8: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (203ммоль) циклогексанону перемішують протягом 6 годин при 90°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 2%. Приклад 9: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (153ммоль) 1-октанолу перемішують протягом 6 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 65%. Приклад 10: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (227ммоль) етиленкарбонату перемішують протягом 6 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 27%. Приклад 11: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20 г (194ммоль) бензонітрилу перемішують протягом 6 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 49%. Приклад 12: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (200ммоль) циклогексанону перемішують протягом 17 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 29%. Приклад 13: Суміш із 5г (14ммоль) мезилату й 1,4г (17ммоль) 4-аміно-1,2,4-триазолу в 20г (136ммоль) 1,2дихлорбензолу перемішують протягом 16 годин при 80°С. Після цього до реакційної суміші додають 50г повністю знесоленої води й через 5 хвилин при 65°С розділяють фази. Вихід (визначений за методом ВЕРХ) становить 21% Приклад 14: До розчину із 252,2г (3,0моль) 4-аміно-1,2,4-триазолу в 1070,4г (8,4моль) н-бутил-гліколю додають при 90°С і 130мбар 356,8г (1,0моль) мезилату в 2020г толуолу. Подачу й дистиляцію закінчують мінімально через 6 годин і потім реакційну суміш охолоджують до 85°С. Після цього роблять рівномірну зміну температури на 3 К/годину до 65°С. Після охолодження одержаної реакційної суміші до 25°С суспензію фільтрують над всмоктувальної фритою. Вихід (визначений за методом ВЕРХ) становить 98%. Приклад 15: До розчину з 86,4г (1,03моль) 4-аміно-1,2,4-триазолу й 128,3г три-н-бутиламіну (0,69моль) в 600г (4,7моль) н-бутилгліколю дозують при 90°С і 130мбар 121г (0,34моль) мезилату в 679г толуолу. Дозування й дистиляцію 556г закінчують мінімально через 6 годин і після цього реакційній суміші дають остудитися до 85°С. Після цього роблять рівномірну зміну температури на 3 К/годину до 65°С. Після охолодження одержаної реакційної суміші до 25°С суспензію фільтрують над всмоктувальною фритою. Вихід (визначений за методом ВЕРХ) становить 77%. Приклад 16: До розчину із 86,4г (1,03моль) 4-аміно-1,2,4-триазолу й 43,2г три-н-бутиламіну (0,34моль) в 600г (4,7моль) н-бутилгліколю дозують при 90°С і 130мбар 121г (0,34моль) мезилату в 679г толуолу. Дозування й дистиляцію 556г толуолу закінчують мінімально через 6 годин і після цього реакційній суміші дають остудитися до 85°С. Після цього роблять рівномірну зміну температури на 3 К/годину до 65°С. Після охолодження одержаної реакційної суміші до 25°С суспензію фільтрують над всмоктувальною фритою. Вихід (визначений за методом ВЕРХ) становить 52%. Приклад 17: До розчину з 84,8г (1,01моль) 4-аміно-1,2,4-триазолу в 600г (4,7моль) н-бутилгліколю дозують при 90°С і 130мбар 128,2г (0,36моль) мезилату в 725г толуолу. Дозування й дистиляцію 631г толуолу закінчують мінімально через 6 годин і після цього дають реакційній суміші остудитися до 85°С. Після цього роблять рівномірну зміну температури на 3 К/годину до 65°С. Після охолодження одержаної реакційної суміші до 25°С суспензію фільтрують над всмоктувальною фритою. Вихід (визначений за методом ВЕРХ) становить 99%. Деамінування: Приклад 18: Проведення 50ммоль твердої 4-амінотриазолієвої солі формули IV (22г, причому А=4-фтор феніл і В=2-хлорфеніл) завантажують в 150мл води й змішують з 110ммоль концентрованої соляної кислоти (11мл). Потім реакційну суміш охолоджують до 0°С. При цій температурі повільно прикраплюють розчин 3,6г (52ммоль) нітриту натрію в 50мл води, при цьому починає виділятися газ. Після закінчення подачі реакційній суміші дають нагрітися до кімнатної температури й потім нейтралізують розведеним розчином карбонату калію (~ 50мл 15%-го водного розчину). Продукт, що випав, відсмоктують, промивають водою й сушать. Вихід становить 95%, Тпл. 136°С, вміст: 98,5% транс-епоксиконазолу (транс, відн. А і В). Приклад 19: Під азотом подають 1162,5г (0,5моль) 18,9%-вого водного розчину триазолієвої солі і за допомогою 18%вої соляної кислоти встановлюють рН на
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for the preparation of 1,2,4-triazol-1-yl-methyl-oxiranes and an intermediary compound
Автори англійськоюNoack Rainer, Sander, Michael
Назва патенту російськоюСпособ получения 1,2,4-триазол-1-илметилоксиранов и промежуточное соединение
Автори російськоюНоак Райнер
МПК / Мітки
МПК: C07D 521/00, C07D 405/06, A01P 3/00
Мітки: проміжна, спосіб, сполука, одержання, 1,2,4-триазол-1-ілметилоксиранів
Код посилання
<a href="https://ua.patents.su/6-78580-sposib-oderzhannya-124-triazol-1-ilmetiloksiraniv-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1,2,4-триазол-1-ілметилоксиранів та проміжна сполука</a>
Попередній патент: Композиція для одержання жорсткого пінополіуретану
Наступний патент: Комплекси платини ii з протипухлинною активністю, які містять хімічно модифіковані жовчні кислоти
Випадковий патент: Редуктор










