Спосіб отримання 3-ціано-6-алкокси-7-нітро-4-хінолінів
Номер патенту: 80607
Опубліковано: 10.10.2007
Автори: Флойд Міддлтон Броунер, мол., Паган Мігель Анхель, Дункан Скотт Мейсон
Формула / Реферат
1. Спосіб отримання 3-ціано-6-алкокси-7-нітро-4-хінолону, при якому проводять стадії:
а) взаємодії заміщеного антранілату формули (І) з диметилацеталем диметилформаміду:
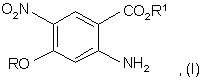
де R означає алкіл,
з отриманням сполуки формули (II):
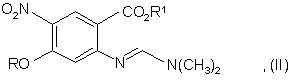
b) конденсації сполуки формули (II) з трет-бутилціаноацетатом з отриманням сполуки формули (III):
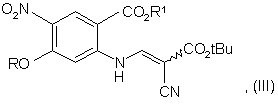
с) гідролізу сполуки формули (III) з отриманням сполуки формули (IV):
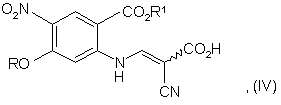
d) декарбоксилювання сполуки формули (IV) до сполуки формули (V):
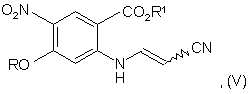
е) циклізації сполуки формули (V) з отриманням 3-ціано-6-алкокси-7-нітро-4-хінолону формули:
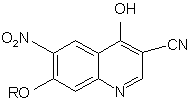 .
.
2. Спосіб за п. 1, в якому стадія взаємодії передбачає об'єднання сполуки формули (І) і диметилацеталю диметилформаміду зі спиртовим розчинником при температурі приблизно від 50 до 80 °С.
3. Спосіб за п. 2, в якому як спиртовий розчинник використовують трет-бутанол.
4. Спосіб за будь-яким з пп. 1-3, в якому взаємодію здійснюють приблизно при 80 °С.
5. Спосіб за будь-яким з пп. 1-4, в якому на стадії а) реакційну суміш охолоджують до осадження сполуки формули (II).
6. Спосіб за будь-яким з пп. 1-4, в якому диметилацеталь диметилформаміду і антранілат об'єднують без спиртового розчинника і нагрівають приблизно до 110 °С, отримуючи сполуку формули (II).
7. Спосіб за п. 6, в якому реакційну суміш розбавляють, фільтрують і сушать, отримуючи сполуку формули (II).
8. Спосіб за будь-яким з пп. 1-7, в якому диметилацеталь диметилформаміду використовують при концентрації від 1 до 5 еквівалентів.
9. Спосіб за п. 8, в якому диметилацеталь диметилформаміду використовують при концентрації від 1 до 2 еквівалентів.
10. Спосіб за п. 9, в якому диметилацеталь диметилформаміду використовують при концентрації 1,2 еквівалента.
11. Спосіб за будь-яким з пп. 1-10, в якому стадія конденсації передбачає об'єднання сполуки формули (II), ацетонітрилу, кислоти, толуолу або спиртового розчинника з отриманням сполуки формули (III) при температурі приблизно від 20 до 110 °С.
12. Спосіб за п. 11, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту.
13. Спосіб за п. 12, в якому як кислоту використовують оцтову кислоту.
14. Спосіб за будь-яким з пп. 1-10, в якому стадія конденсації включає додавання спиртового розчинника в комбінації з трет-бутилціаноацетатом при температурі приблизно від 25 до 35 °С.
15. Спосіб за п. 14, в якому спиртовий розчинник являє собою трет-бутанол.
16. Спосіб за п. 14 або 15, в якому трет-бутилціаноацетат використовують у кількості приблизно від 1,5 до 2,0 еквівалентів.
17. Спосіб за будь-яким з пп. 1-16, в якому стадія гідролізу включає додавання кислоти в розчинник до сполуки формули (III) при температурі приблизно від 20 до 110 °С.
18. Спосіб за п. 17, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту.
19. Спосіб за п. 17 або 18, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід.
20. Спосіб за п. 17, в якому кислота і розчинник являють собою оцтову кислоту.
21. Спосіб за п. 17, в якому стадія гідролізу включає додавання до сполуки формули (III) трифторметансульфокислоти в ацетонітрилі при температурі приблизно від 20 до 30 °С.
22. Спосіб за будь-яким з пп. 1-21, в якому стадія декарбоксилювання включає додавання кислоти або основи до сполуки формули (IV) в розчиннику при температурі приблизно від 80 до 140 °С.
23. Спосіб за п. 22, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід, простий дифеніловий ефір, орто-дихлорбензол, суміш ТГФ/ксилол, диметилпропіонітрил і ізопропанол.
24. Спосіб за п. 22 або 23, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту.
25. Спосіб за будь-яким з пп. 22-24, в якому як основу використовують діізопропілетиламін, піридин, діазобіцикло[2.2.3]ундецен (DBU), гідроксид натрію, піперидин, диметилформамід, пропіонітрил або ізопропанол.
26. Спосіб за п. 22, що включає додавання діазобіцикло[2.2.3]ундецену і ацетонітрилу до сполуки формули (IV) при температурі приблизно 80 °С.
27. Спосіб за будь-яким з пп. 1-26, в якому стадія циклізації включає додавання основи в розчиннику до сполуки формули (V) при температурі приблизно від 60 до 140 °С протягом приблизно 4-5 годин.
28. Спосіб за п. 27, в якому як основу використовують діізопропілетиламін, піридин і діазобіцикло[2.2.3]ундецен, гідроксид натрію, піперидин, диметилформамід, пропіонітрил або ізопропанол.
29. Спосіб за п. 27 або 28, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід, простий дифеніловий ефір, орто-дихлорбензол, суміш ТГФ/ксилол, диметилпропіонітрил і ізопропанол.
30. Спосіб за п. 27, в якому стадія циклізації включає додавання діазобіцикло[2.2.3]ундецену в ацетонітрилі приблизно при 80 °С протягом приблизно 4-5 годин з отриманням 3-ціано-6-алкокси-7-нітро-4-хінолону.
31. Спосіб за п. 30, в якому діазобіцикло[2.2.3]ундецен складає від 3 до 5 еквівалентів.
32. Спосіб за п. 30 або 31, в якому 3-ціано-6-алкокси-7-нітро-4-хінолон виділяють гасінням водною НСl.
33. Спосіб за будь-яким з пп. 1-32, в якому стадії гідролізу, декарбоксилювання і циклізації проводять послідовно без виділення.
34. Спосіб за п. 33, що включає гідроліз сполуки формули (III) трифторметансульфокислотою в ацетонітрилі при температурі приблизно від 20 до 30 °С протягом максимум 60 хв., додавання DBU і кип'ятіння протягом періоду до 5 годин.
Текст
1. Спосіб отримання 3-ціано-6-алкокси-7нітро-4-хінолону, при якому проводять стадії: а) взаємодії заміщеного антранілату формули (І) з диметилацеталем диметилформаміду: O2N CO2R1 3 80607 4 8. Спосіб за будь-яким з пп. 1-7, в якому диметилацеталь диметилформаміду використовують при концентрації від 1 до 5 еквівалентів. 22. Спосіб за будь-яким з пп. 1-21, в якому стадія декарбоксилювання включає додавання кислоти або основи до сполуки формули (IV) в розчиннику при температурі приблизно від 80 до 140 °С. 9. Спосіб за п. 8, в якому диметилацеталь диметилформаміду використовують при концентрації від 1 до 2 еквівалентів. 23. Спосіб за п. 22, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід, простий дифеніловий ефір, орто-дихлорбензол, суміш ТГФ/ксилол, диметилпропіонітрил і ізопропанол. 10. Спосіб за п. 9, в якому диметилацеталь диметилформаміду використовують при концентрації 1,2 еквівалента. 11. Спосіб за будь-яким з пп. 1-10, в якому стадія конденсації передбачає об'єднання сполуки формули (II), ацетонітрилу, кислоти, толуолу або спиртового розчинника з отриманням сполуки формули (III) при температурі приблизно від 20 до 110 °С. 12. Спосіб за п. 11, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту. 13. Спосіб за п. 12, в якому використовують оцтову кислоту. як кислоту 14. Спосіб за будь-яким з пп. 1-10, в якому стадія конденсації включає додавання спиртового розчинника в комбінації з третбутилціаноацетатом при температурі приблизно від 25 до 35 °С. 15. Спосіб за п. 14, в якому спиртовий розчинник являє собою трет-бутанол. 16. Спосіб за п. 14 або 15, в якому третбутилціаноацетат використовують у кількості приблизно від 1,5 до 2,0 еквівалентів. 17. Спосіб за будь-яким з пп. 1-16, в якому стадія гідролізу включає додавання кислоти в розчинник до сполуки формули (III) при температурі приблизно від 20 до 110 °С. 18. Спосіб за п. 17, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту. 19. Спосіб за п. 17 або 18, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід. 20. Спосіб за п. 17, в якому кислота і розчинник являють собою оцтову кислоту. 21. Спосіб за п. 17, в якому стадія гідролізу включає додавання до сполуки формули (III) трифторметансульфокислоти в ацетонітрилі при температурі приблизно від 20 до 30 °С. 24. Спосіб за п. 22 або 23, в якому як кислоту використовують оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту або трифторметансульфокислоту. 25. Спосіб за будь-яким з пп. 22-24, в якому як основу використовують діізопропілетиламін, піридин, діазобіцикло[2.2.3]ундецен (DBU), гідроксид натрію, піперидин, диметилформамід, пропіонітрил або ізопропанол. 26. Спосіб за п. 22, що включає додавання діазобіцикло[2.2.3]ундецену і ацетонітрилу до сполуки формули (IV) при температурі приблизно 80 °С. 27. Спосіб за будь-яким з пп. 1-26, в якому стадія циклізації включає додавання основи в розчиннику до сполуки формули (V) при температурі приблизно від 60 до 140 °С протягом приблизно 45 годин. 28. Спосіб за п. 27, в якому як основу використовують діізопропілетиламін, піридин і діазобіцикло[2.2.3]ундецен, гідроксид натрію, піперидин, диметилформамід, пропіонітрил або ізопропанол. 29. Спосіб за п. 27 або 28, в якому як розчинник використовують толуол, ацетонітрил, тетрагідрофуран, диметилацетамід, простий дифеніловий ефір, орто-дихлорбензол, суміш ТГФ/ксилол, диметилпропіонітрил і ізопропанол. 30. Спосіб за п. 27, в якому стадія циклізації включає додавання діазобіцикло[2.2.3]ундецену в ацетонітрилі приблизно при 80 °С протягом приблизно 4-5 годин з отриманням 3-ціано-6алкокси-7-нітро-4-хінолону. 31. Спосіб за п. 30, в якому діазобіцикло[2.2.3]ундецен складає від 3 до 5 еквівалентів. 32. Спосіб за п. 30 або 31, в якому 3-ціано-6алкокси-7-нітро-4-хінолон виділяють гасінням водною НСl. 33. Спосіб за будь-яким з пп. 1-32, в якому стадії гідролізу, декарбоксилювання і циклізації проводять послідовно без виділення. 5 80607 6 34. Спосіб за п. 33, що включає гідроліз сполуки формули (III) трифторметансульфокислотою в ацетонітрилі при температурі приблизно від 20 до 30 °С протягом максимум 60 хв., додавання DBU і кип'ятіння протягом періоду до 5 годин. Даний винахід стосується способу великомасштабного отримання 3-ціано-6-алкокси7-нітро-4-хінолонів, які є проміжними продуктами отримання інгібіторів протеїнтирозинкінази (РТК), корисних при лікуванні раку. Двома синтетичними способами отримання 3ціано-4-хінолонів або 3-карбоалкілоксихінолонів, що найчастіше застосовуються, є внутрішньомолекулярна реакція Фріделя-Крафтса і електроциклічне замикання кільця N(2карбоксивініл)анілінових похідних. Умови реакції Фриделя-Крафтса добре працюють для багатих електронами анілінів, помірно для незаміщених анілінів, погано або зовсім не працюють для анілінів з дефіцитом електронів і абсолютно некорисні для великомасштабного отримання 3ціано-4-хінолонів, що використовує аніліни з дефіцитом електронів. До речі, електроноакцепторні групи аніліну знижують нуклеофільність ароматичного кільця таким чином, що побічні взаємодії конкурують (якщо не переважають) з бажаною внутрішньомолекулярною конденсацією. Термічні умови електроциклічного замикання кільця N-(2карбоксивініл)анілінових похідних звичайно вимагають температур вищих за 240°С. Однак структуру 3-ціано-4-хінолонів отримують за допомогою реакцій електроциклічного замикання кільця №(2-карбоксивініл)анілінових похідних при нагріванні до 260°С в дифеніловому ефірі [патент США №6002008; WO 98/43960]. Зокрема, існує декілька недоліків, пов'язаних з електроциклічним замиканням кільця, для отримання кількостей матеріалу в технологічному масштабі. Звичайно взаємодії протікають при великому розбавленні (66:1), даючи в результаті неефективний великомасштабний спосіб внаслідок низької продуктивності. Крім того, термічне розкладання кінцевого продукту і/або вихідного матеріалу піддає ризику чистоту кінцевого продукту внаслідок високотемпературних умов взаємодії. До того ж обладнання, необхідне для безпечного проведення високотемпературних взаємодій у великому масштабі, є дорогим і недоступно в звичайній лабораторії або заводських умовах. Виробництво 3-ціано-4-хінолонів за допомогою електроциклічного замикання кільця страждає від всіх згаданих вище проблем, особливо від термічного розкладання необхідного кінцевого продукту або вихідного матеріалу. Наприклад, відомо, що 7-етокси-4-гідрокси-6-нітрохінолін-3карбонітрил розкладається при 240°С, тоді як мінімальна необхідна для циклізації температура становить 256°. Таким чином, в даній галузі існує потреба в способі, який направлений на і переважно долає високотемпературну циклізацію, яка приводить до термічного розкладання. Наступні експериментальні подробиці приведені для полегшення розуміння даного винаходу і жодним чином не призначені і не повинні тлумачитися як обмеження даного винаходу, викладеного в приведеній далі формулі винаходу. Даний винахід стосується способу отримання 3-ціано-6-алкокси-7-нітро-4-хінолону, який включає a) взаємодію заміщеного антранілату формули (І) з диметилацеталем диметилформаміду: де R і R1 означають алкіл; з отриманням сполуки формули (II): b) конденсацію сполуки стадії а) з третбутилціаноацетатом з отриманням сполуки формули (III): c) гідроліз сполуки стадії b) з отриманням сполуки формули (IV): d) декарбоксилювання сполуки стадії с) до сполуки формули (V): e) циклізацію сполуки стадії d) в присутності основи з отриманням 3-ціано-6-алкокси-7-нітро-4хінолону формули: 7 Термін «алкіл», що використовується тут, означає лінійну або розгалужену алкільну групу, наприклад, С1-С6 алкільну групу, переважно С1С4 алкільну групу, більш переважно Me, Et, н-Pr, ізо-Pr, н-Bu, найбільш переважно Me або Et. R і R1 можуть бути однаковими або різними. Даний винахід включає всі таутомерні форми сполук, а також суміші даних таутомерних форм. Описаний тут винахід для отримання 3-ціано6-алкокси-7-нітро-4-хінолонів не вимагає описаних вище високої температури (256°С) і низьковиробничого сильного розбавлення (66:1). Дані умови взаємодії дозволяють проводити реакцію циклізації в стандартному технологічному обладнанні. Спосіб даного винаходу показаний на схемі І. Як описано на схемі І, заміщений антранілат 1, в якому R означає алкіл, взаємодіє з диметилацеталем диметилформаміду (ДМФАДМА) або приблизно з 1-5 еквівалентами диметилацеталю диметилформаміду в спиртовому розчиннику з отриманням Ν,Νдиметиламідину 2. У переважному варіанті концентрація (ДМФА-ДМА) складає від 1 до 2 еквівалентів. Переважні умови для даної взаємодії використовують приблизно 1,2 еквіваленти диметилацеталю диметилформаміду в третбутанолі при температурі приблизно від 50 до 120°С з переважною температурою 80°С. У переважному варіанті дана взаємодія допускає просте виділення Ν,Ν-диметиламідину 2 при охолоджуванні реакційної суміші з осадженням продукту і збором осаду фільтруванням. Дана методика забезпечує майже кількісний вихід Ν,Νдиметиламідину 2 достатньої міри чистоти для використання його на наступній стадії без додаткового очищення. В іншій переважній методиці здійснюють взаємодію заміщеного антранілату 1 з диметилацеталем диметилформаміду при кипінні (приблизно 110°С) і після розбавлення водою виділяють Ν,Ν 80607 8 диметиламідин 2 фільтруванням і сушінням зібраного продукту. Реакцію конденсації Ν,Ν-диметиламідину 2 з трет-бутилціаноацетатом можна проводити, застосовуючи ацетонітрил, кислоту, толуол або спиртовий розчинник при температурі приблизно від 20°С до 110°С, отримуючи N-(2-ціано-2-третбутоксикарбонілвініл)антранілат 3. В переважному варіанті конденсацію проводять, додаючи третбутанол при температурі приблизно від 25°С до 35°С приблизно з 1,5-2,0 екв. третбутилціаноацетату, що забезпечує речовину високої якості (>98%, рідинна хроматографія при високому тиску (область ВТРХ)) з високим виходом (90-99%). Гідроліз N-(2-ціано-2-третбутоксикарбонілвініл)антранілату 3 можна провести, застосовуючи кислоту в розчиннику або безпосередньо оцтову кислоту як розчинник при температурі приблизно від 20 до 110°С. У переважному варіанті гідроліз включає обробку N(2-ціано-2-трет-бутоксикарбонілвініл)антранілату З каталітичною кількістю трифторметансульфокислоти в ацетонітрилі при температурі приблизно від 20 до 30°С з отриманням N-(2-ціано-2карбоксивініл)антранілату 4, як охарактеризовано з допомогою ЯМР. N-(2-ціано-2-третбутоксикарбонілвініл)антранілат 3 можна необов'язково нагріти до 180°С в ортодихлорбензолі (ОДХБ) для видалення третбутилового складного ефіру і отримання N-(2ціано-2-карбоксивініл)антранілату 4. Декарбоксилювання N-(2-цiaнo-2кapбoкcивiнiл)aнтpaнiлaтy 4 можна провести в кислотних або основних умовах, отримуючи N-(2ціановініл)антранілат 5. В переважному варіанті кислоти включають оцтову кислоту і паратолуолсульфонову кислоту, основи включають діізопропілетиламін, піридин або діазобіцикло[2.2.3]ундецен (DBU) у відповідних розчинниках, які включають ацетонітрил, оцтову кислоту, піридин і диметилацетамід, при температурі приблизно від 80 до 140°С. Якщо термічно індукований гідроліз N-(2-ціано-2-третбутоксикарбонілвініл)антранілату 3 до N-(2ціановініл)антранілату 5 в орто-дихлорбензолі (ОДХБ) проводять в присутності каталітичної кількості відповідної основи, яка включає діізопропілетиламін (ДІЕА), то N-(2-ціано-2-третбутоксикарбонілвініл)антранілат 3 перетворюється безпосередньо в N-(2-ціановініл)антранілат 5. В переважному варіанті застосовують DBU в ацетонітрилі при температурі близько 80°С. Внутрішньомолекулярну аніонну циклізацію N(2-ціановініл)антранілату 5 до 3-ціано-6-алкокси-7нітро-4-хінолону 6 можна провести приблизно з 213екв. основи в розчиннику. У переважному варіанті основа включає DBU, NaH, піперидин, диметиламінопіридин (DMAP) або трет-бутилат калію (KOtBu). У переважному варіанті розчинники включають ацетонітрил, простий дифеніловий ефір, ОДХБ, суміші ТГФ/ксилол, толуол, Ν,Νдиметилформамід (ДМФА), пропіонітрил або ізопропанол. У переважному варіанті коефіцієнти 9 розбавлення розчинникхубстрат складають приблизно від 15 до 30:1 при температурі приблизно від 60°С до 140°С. Переважною методикою отримання 3-ціано-6-алкокси-7-нітро-4хінолону 6 є обробка N-(2-ціановініл)антранілату 5 приблизно 3-5екв. DBU в ацетонітрилі при температурі близько 80°С протягом приблизно 4-5 годин і гасіння водною НСl. Більш переважною методикою отримання 3ціано-6-алкокси-7-нітро-4-хінолону 6 з N-(2-ціано-2трет-бутоксикарбонілвініл)антранілату 3 є послідовне проведення гідролізу, декарбоксилювання і внутрішньомолекулярної циклізації в одній і тій же посудині без виділення N-(2-ціано-2-карбоксивініл)антранілату 4 або №(2ціановініл)антранілату 5. Більш переважний спосіб отримання 3-ціано-6-алкокси-7-нітро-4-хінолону 6 включає гідроліз М-(2-ціано-2-третбутоксикарбонілвініл)антранілату 3 приблизно 0,20,3екв. трифторметансульфокислоти в ацетонітрилі при температурі приблизно від 20 до 30°С протягом приблизно 5-60хв. з подальшим доданням приблизно 3-5екв. DBU і кип'ятінням реакційної суміші протягом приблизно 4-5 годин. 3Ціано-6-алкокси-7-нітро-4-хінолон 6 виділяють, розбавляючи реакційну суміш водою і збираючи отриманий осад фільтруванням. Зібраний осад розтирають з етилацетатом, отримуючи 3-ціано-6-алкокси-7-нітро-4-хінолон 6 у вигляді бежево-коричневої твердої речовини (вихід 70-80%, >98% за даними 1Н ЯМР). Заявлений тут винахід забезпечує 3-ціано-7алкокси-6-нітро-4-хінолони при об'єднанні стадій і без необхідності високотемпературної циклізації. 3-Ціано-6-алкокси-7-нітро-4-хінолон 6 отримують з хорошим загальним виходом (70% для 5 перетворень, що проводяться за дві операції в окремих реакторах, при чистоті >98% за даними ВЕРХ і 1H ЯМР). Для цілей даного винаходу кислота являє собою молекулярний об'єкт або хімічну речовину, здатну передавати протон або утворювати ковалентний зв'язок з електронною парою. Переважні кислоти включають оцтову кислоту, трифтороцтову кислоту, пара-толуолсульфонову кислоту, метансульфонову кислоту і трифторметансульфокислоту. Для цілей даного винаходу «розчинник» є терміном, що застосовується до вихідної рідкої фази в цілому, що містить екстрагент. Розчинник може містити тільки один екстрагент або може являти собою складову гомогенну суміш екстрагента(ів) з розріджувачем(ами). У переважному варіанті розчинник включає толуол, ацетонітрил, тетрагідрофуран (ТГФ), диметилацетамід, оцтову кислоту, піридин, простий дифеніловий ефір, ОДХБ, суміші ТГФ/ксилол, толуол, Ν,Ν-диметилформамід (ДМФА), пропіонітрил або ізопропанол. Для цілей даного винаходу основа являє собою хімічну речовину або молекулярний об'єкт, що має доступну пару електронів, здатну утворювати ковалентний зв'язок з протоном або вакантною орбіталлю деякої іншої речовини. У переважному варіанті основа включає 80607 10 діізопропілетиламін, піридин або діазобіцикло[2.2.3]ундецен (DBU), NaH, піперидин, диметиламінопіридин (DMAP) або трет-бутилат калію(КОtВи). Для цілей даного винаходу термін "алкіл" включає лінійні і розгалужені алкільні фрагменти, переважно з 1-6 атомів вуглецю. Для сприяння подальшому розумінню даного винаходу, спосіб даного винаходу ілюструють наступні необмежувальні приклади. Приклад 1 Метиловий ефір 2[[диметиламіно)метилен1аміно]-4-етокси-5нітробензойної кислоти У 3-літрову круглодонну колбу, забезпечену верхньою мішалкою, холодильником і термопарою, під N2 завантажують метиловий ефір 2-аміно-4-етокси-5-нітробензойної кислоти (80г, 333ммоль) і диметилацеталь Ν,Νдиметилформаміду (500мл). Реакційну суміш нагрівають до кипіння із зворотним холодильником (100°С). Як тільки густа суспензія стає гомогенною і завершується взаємодія, реакційну суміш охолоджують до 25-30°С. Реакційну суміш розбавляють водою (3л) і фільтрують отриману суспензію. Осад на фільтрі промивають водою (3x500 мл) і сушать у вакуумі (50мм рт. ст.) при 55°С, отримуючи вказану в заголовку сполуку у вигляді майже білої твердої речовини (89,6г, вихід 91%, чистота >90% за даними інтегрування ЯМРспектрів). 1Н ЯМР (300 МГц, ДМСО-d6): 8,23 (с, 1Н), 7,81 (с, Ш), 6,71 (с, 1Н), 4,22 (кв., J=7 Гц), 3,68 (с, ЗН), 3,09 (с, 3Н), 2,97 (с, 3Н), 1,40 (т, J=7 Гц, 3Н). Приклад 2 Трет-бутиловий ефір 2-ціано-3-(5'етокси-2'-метоксикарбоніл-4'-нітрофеніл) аміно-2акрилової кислоти У 3-літрову круглодонну колбу, забезпечену верхньою мішалкою, холодильником і термопарою, під N2 завантажують метиловий ефір 2-[[(диметиламіно)метилен]аміно]-4-етокси-5нітробензойної кислоти (68г, 230ммоль), третбутанол (500мл), а потім трет-бутилціаноацетат (65г, 460ммоль). Реакційну суміш нагрівають до кипіння із зворотним холодильником. Через 4 години реакційну суміш охолоджують до кімнатної температури і фільтрують суспензію. Осад на фільтрі промивають гептаном (2x100мл) і сушать у вакуумі (50мм рт. ст.) при 40°С, отримуючи вказану в заголовку сполуку у вигляді бежевої твердої речовини (83г, вихід 91%, чистота >98% за даними ЯМР). 1Н ЯМР (300МГц, ДМСО-d6): 12,7 (д, J=12,9 Гц, 1Н), 8,77 (д, J=12,9 Гц, 1Н), 8,50 (с, 1H), 7,47 (с, 1H), 4,37 (кв., J=7 Гц, 2Н), 3,91 (с, 3Н), 1,52 (с, 9Н), 1,40 (т, J=7 Гц, 3Н). Приклад 3 Трет-бутиловий ефір 2-ціано-3-(5'етокси-2'-метоксикарбоніл-4'-нітрофеніл) аміно-2акрилової кислоти У 3-літрову круглодонну колбу, забезпечену верхньою мішалкою, холодильником і термопарою, під N2 завантажують метиловий ефір 2-аміно-4-етокси-5-нітробензойної кислоти (100г, 0,416моль), диметилацеталь Ν,Νдиметилформаміду (59,5г, 0,499моль) і третбутанол (800мл). Реакційну суміш нагрівають при 11 кипінні із зворотним холодильником протягом 1,5 годин. Реакційну суміш охолоджують до 22-35°С і додають трет-бутилціаноацетат (117г, 0,832моль). Реакційну суміш перемішують при температурі від 20 до 30°С протягом 2 годин. Осад збирають фільтруванням з відсмоктуванням, промивають гептаном (500мл), потім сушать до постійної ваги при зниженому тиску (50мм рт. ст.)) і 45°С протягом ночі, отримуючи вказану в заголовку сполуку у вигляді не зовсім білої твердої речовини (162,9 г, вихід 95%, чистота >95% за даними ВЕРХ). 1Н ЯМР (300 МГц, ДМСО-d6): 12,7 (д, J=12,9 Гц, 1Р), 8,77 (д, J=12,9 Гц, 1Н), 8,50 (с, 1Н), 7,47 (с, 1Р), 4,37 (кв., J=7 Гц, 2Н), 3,91 (с, 3Н), 1,52 (с, 9Н), 1,40 (т, J=7 Гц, 3Н). Приклад 4 N-(2-ціановініл)-2-аміно-4-етокси-5нітробензойна кислота В круглодонну колбу на 500мл, забезпечену мішалкою, холодильником і термопарою, під N2 завантажують трет-бутиловий ефір (2)-2-ціано-3-(5'-етокси-2'-метоксикарбоніл-4'нітрофеніл)аміно-2-акрилової кислоти (20г, 51,1ммоль), Ν,Ν-діізопропілетиламін (1мл, 5,72ммоль) і орто-дихлорбензол (200мл). Реакційну суміш нагрівають до кипіння із зворотним холодильником (180°С). Через 7,5 годин взаємодія завершується, що підтверджують тонкошаровою хроматографією. Реакційну суміш охолоджують до кімнатної температури і розбавляють гексаном (500мл), викликаючи осадження сирого продукту. Тверду речовину виділяють фільтруванням, отримуючи вказану в заголовку сполуку у вигляді бежевого порошку (11,7 г, вихід 79% стереоізомерів 65:35, чистота 94% за даними ЯМР). 1Н ЯМР (300 МГц, ДМСОd6): 11,1 (д, J=12,7 Гц, 0,65 Η), 10,6 (д, J=12,9 Гц, 0,35 Η), 8,47 (с, 0,65 Η), 8,37 (с, 0,35 Η), 8,29 (дд, J=13,4, 12,9 Гц, 0,35 Η), 8,16 (дд, J=12,7,8,5 Гц, 0,65 Η), 7,13 (с, 1Н), 5,49 (д, J=13,4 Гц, 0,35Н), 4,97 (д, J=8,4 Гц, 0,65 Н), 4,38-4,28 (м, 2Н), 3,90 (с, 1,95 Н), 3,88 (с, 1,05 Н), 1,39 (т, J=7 Гц, 3Н). Приклад 5 7-етокси-4-гідрокси-6-нітрохінолін-3карбонітрил В круглодонну колбу на 100мл, забезпечену верхньою мішалкою, холодильником і термопарою, завантажують трет-бутиловий ефір (2)-2-ціано-3-(5'-етокси-2'-метоксикарбоніл-4'нітрофеніл)аміно-2-акрилової кислоти (2,5г, 6,3ммоль) і ацетонітрил (50 мл). До даного гетерогенного реакційного середовища додають трифторметансульфокислоту (0,12мл, 0,21ммоль). Після зникнення вихідного матеріалу, що підтверджують ТШХ (20% EtOAc/гексан), додають до реакційної суміші DBU (4,0мл, 4,25ммоль). Потім реакційну суміш нагрівають до кипіння із зворотним холодильником і контролюють на завершення процесу (>95% за даними ВЕРХ колонка Phenoraenex 3мкм феніл-гексил (150x4,6мм)). Потім реакційну суміш гасять 10% НСl (100мл) і розбавляють водою (400мл). Після перемішування протягом 15хв. при кімнатній температурі суспензію фільтрують і зібрану тверду речовину залишають сушитися на повітрі. Зібрану тверду речовину суспендують в етилацетаті 80607 12 (25мл) при кімнатній температурі і знов фільтрують і залишають сушитися на повітрі. Дана методика дає 1,15г (70%) вказаної в заголовку сполуки у вигляді бежевої твердої речовини, яка являє собою >95% продукту за даними інтегрування спектрів ЯМР. 1Н ЯМР (300 МГц, ДМСО-d6): 12,9 (с, 1H), 8,79 (с, 1H), 8,51 (с, 1H), 7,24 (с, 1H), 4,27 (кв., J=7 Гц, 2Н), 1,41 (τ, J=7 Гц, 3Н).
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 3-cyano-6-alkoxy-7-nitro-4-quinolines
Автори англійськоюDUNCAN, Scott, Mason, PAGAN, Miguel, Angel, FLOYD, Middleton, Brawner, Jr.
Назва патенту російськоюСпособ получения 3-циано-6-алкокси-7-нитро-4-хинолинов
Автори російськоюДункан Скотт Мейсон, Паган Мигель Анхель, Флойд Миддлтон Броунер, мол.
МПК / Мітки
МПК: C07D 215/56
Мітки: 3-ціано-6-алкокси-7-нітро-4-хінолінів, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/6-80607-sposib-otrimannya-3-ciano-6-alkoksi-7-nitro-4-khinoliniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 3-ціано-6-алкокси-7-нітро-4-хінолінів</a>










