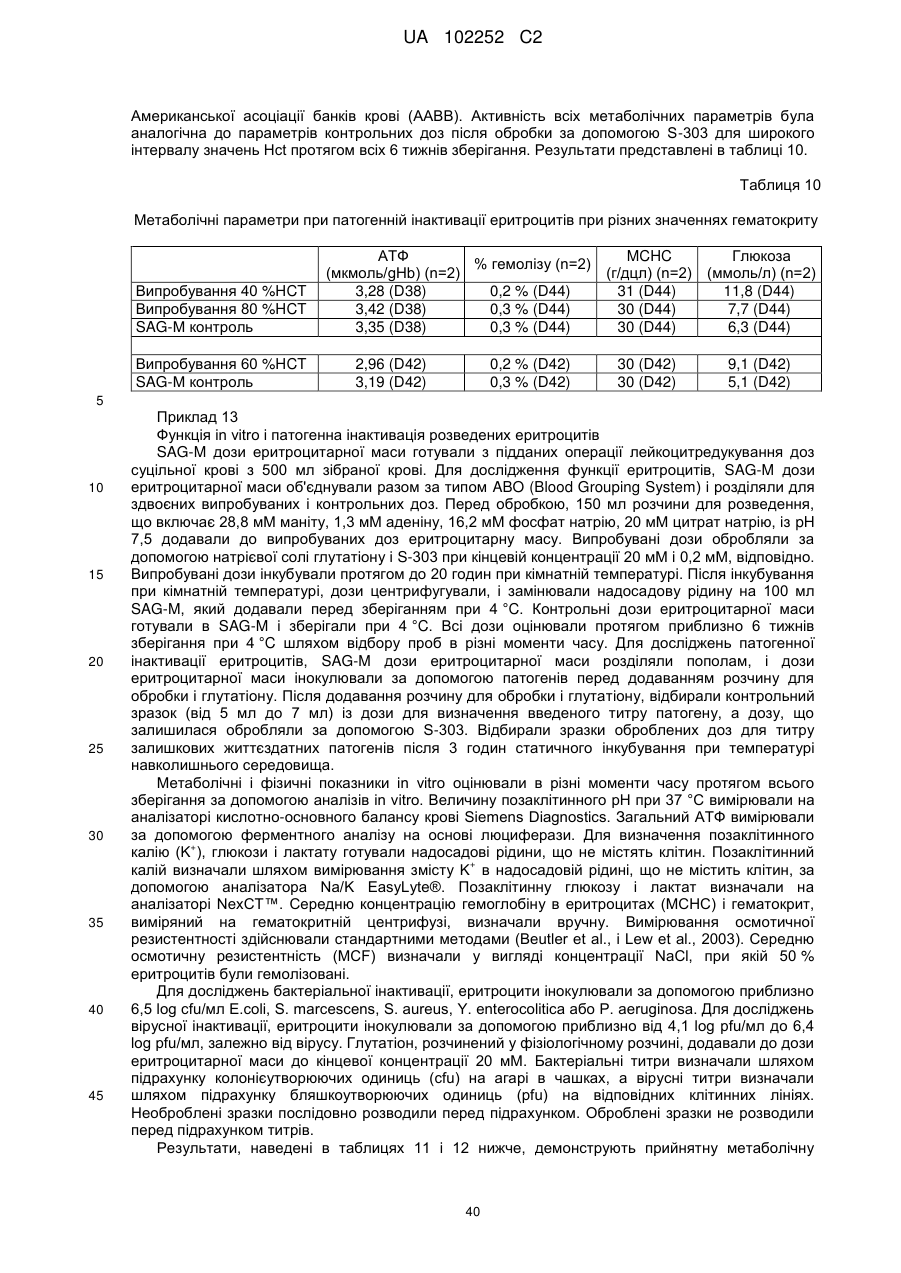
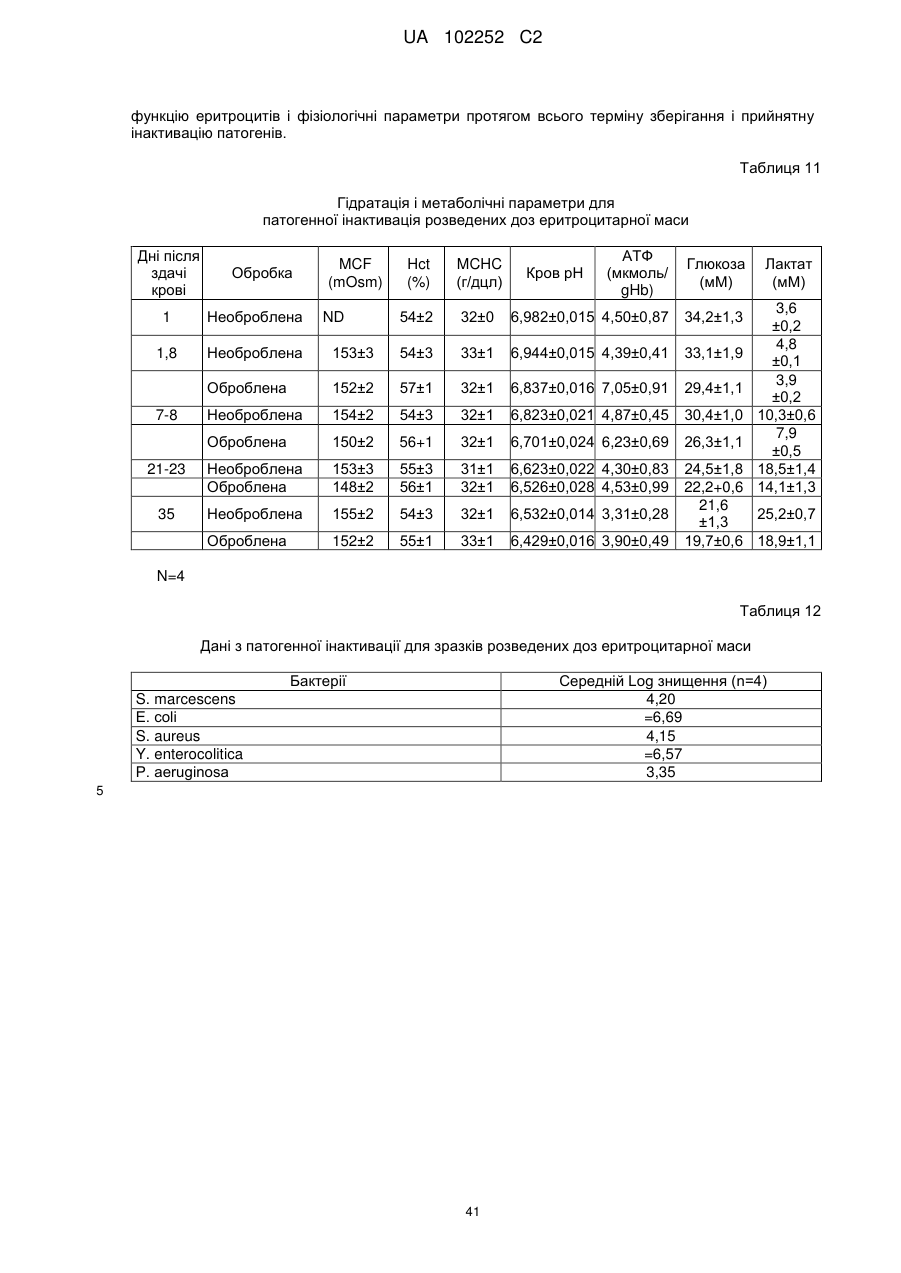
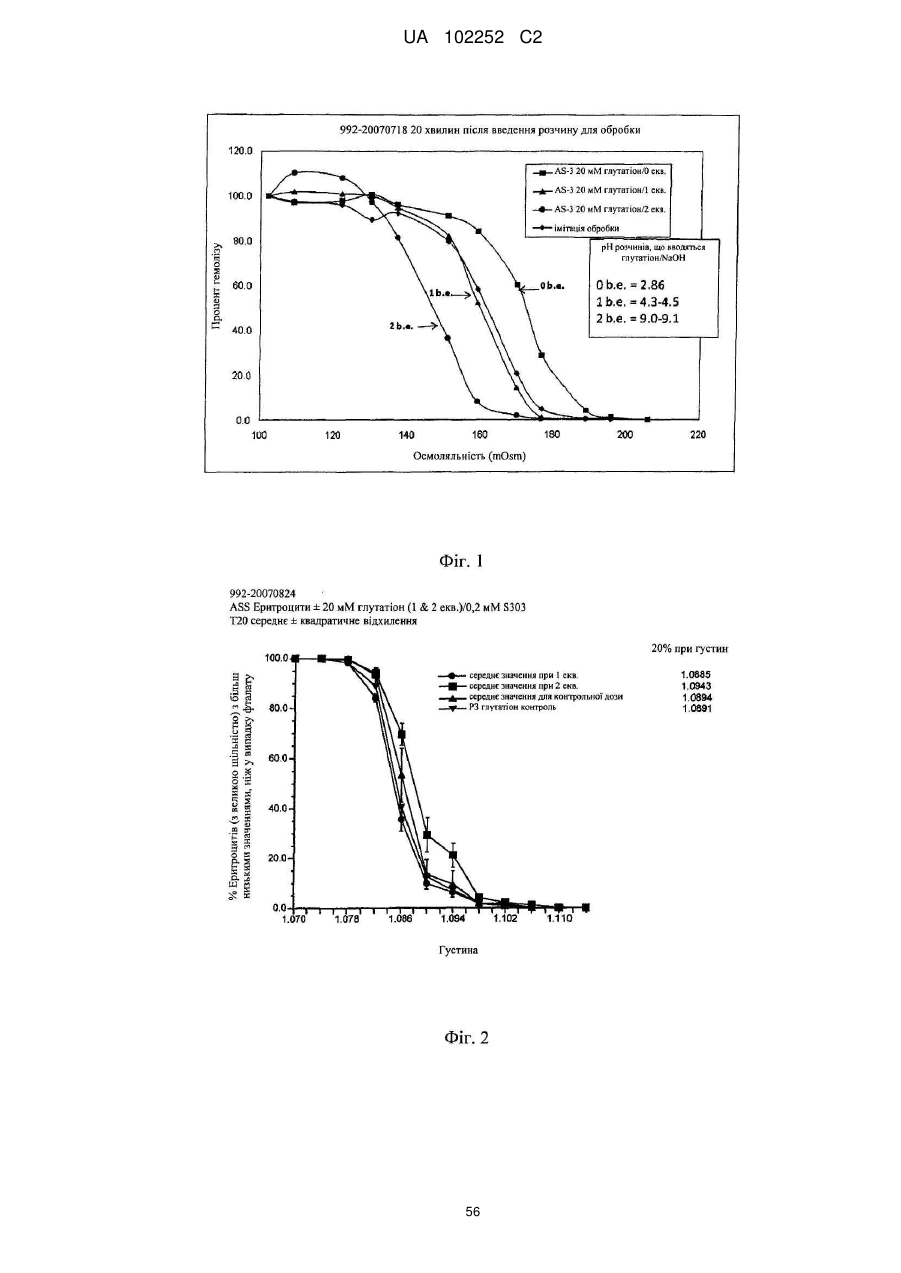
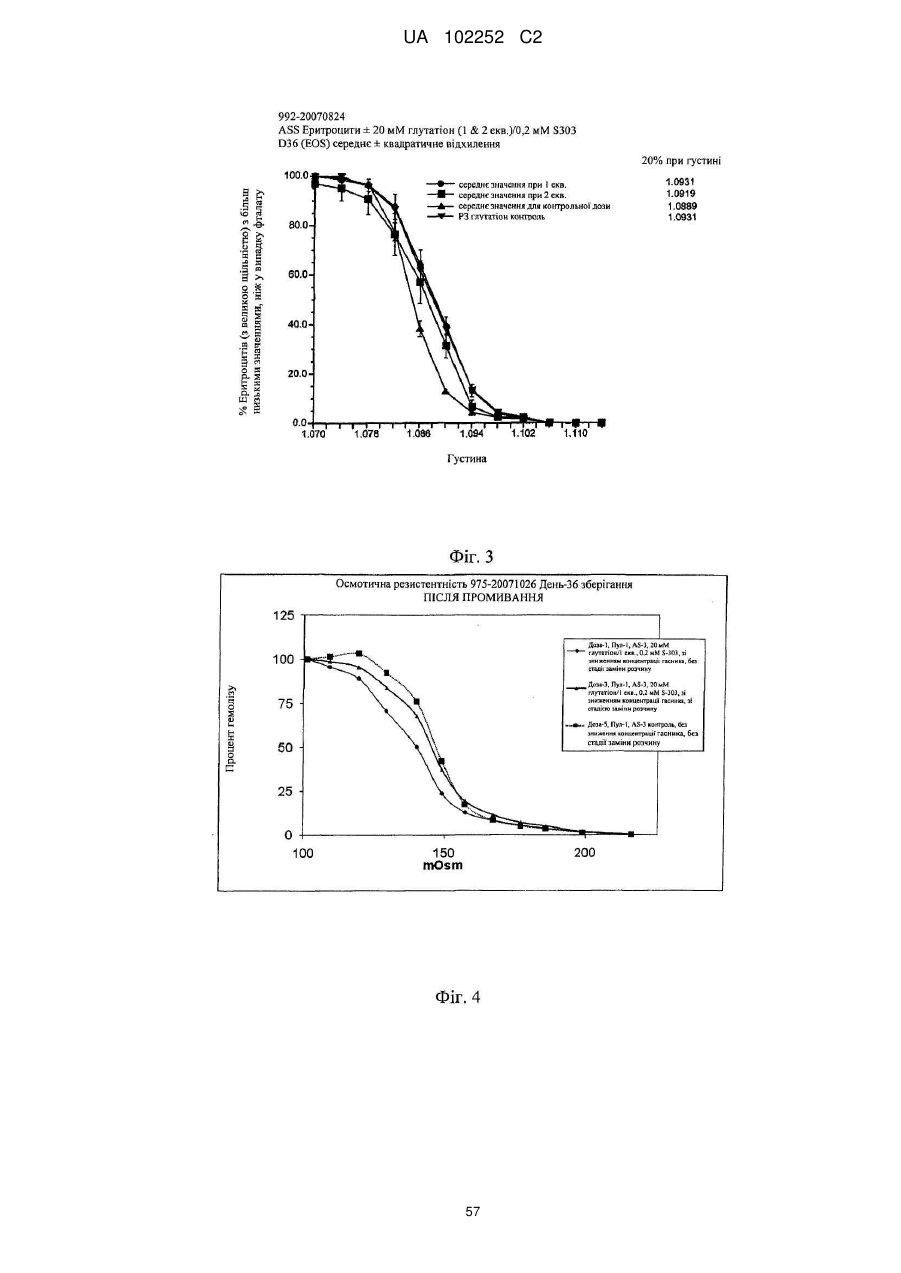
Вдосконалений спосіб гасіння небажаних побічних реакцій при патогенній інактивації еритроцитів
Формула / Реферат
1.Спосіб обробки композиції еритроцитів, що включає:
(a) змішування
(і) ефективної кількості патоген-інактивуючої сполуки, що включає функціональну групу, яка є реакційноздатною електрофільною групою або яка утворює реакційноздатну електрофільну групу;
(іі) ефективної кількості гасника, що включає тіольну групу, де тіол здатний реагувати з реакційноздатною електрофільною групою патоген-інактивуючої сполуки;
(iii) композиції, що включає еритроцити; і
(iv) приблизно від 0,5 до 1,5 еквівалентів основи, де еквівалент означає мольну кількість, яка є еквівалентною мольній кількості гасника в суміші;
в розчині для обробки або в розчині для розведення;
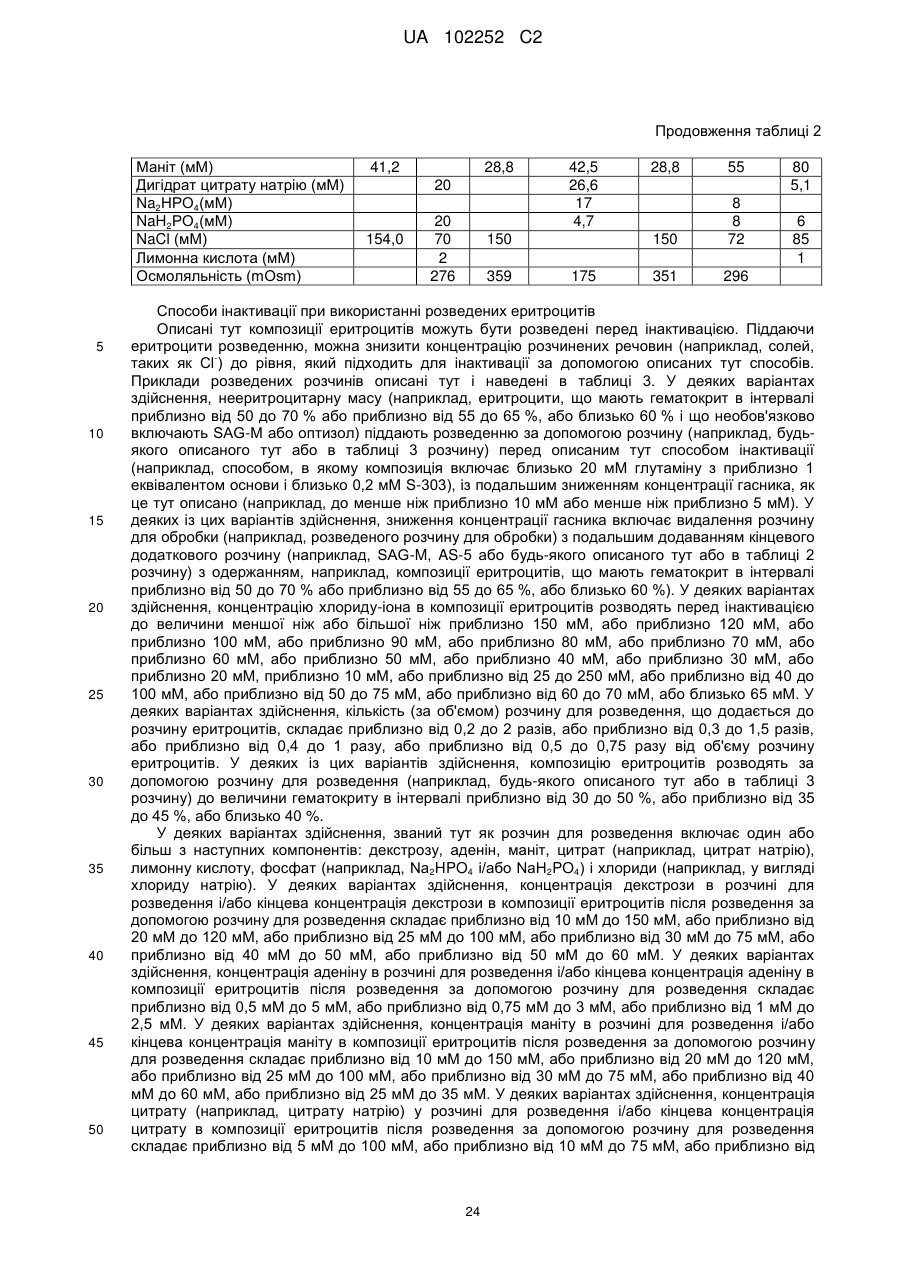
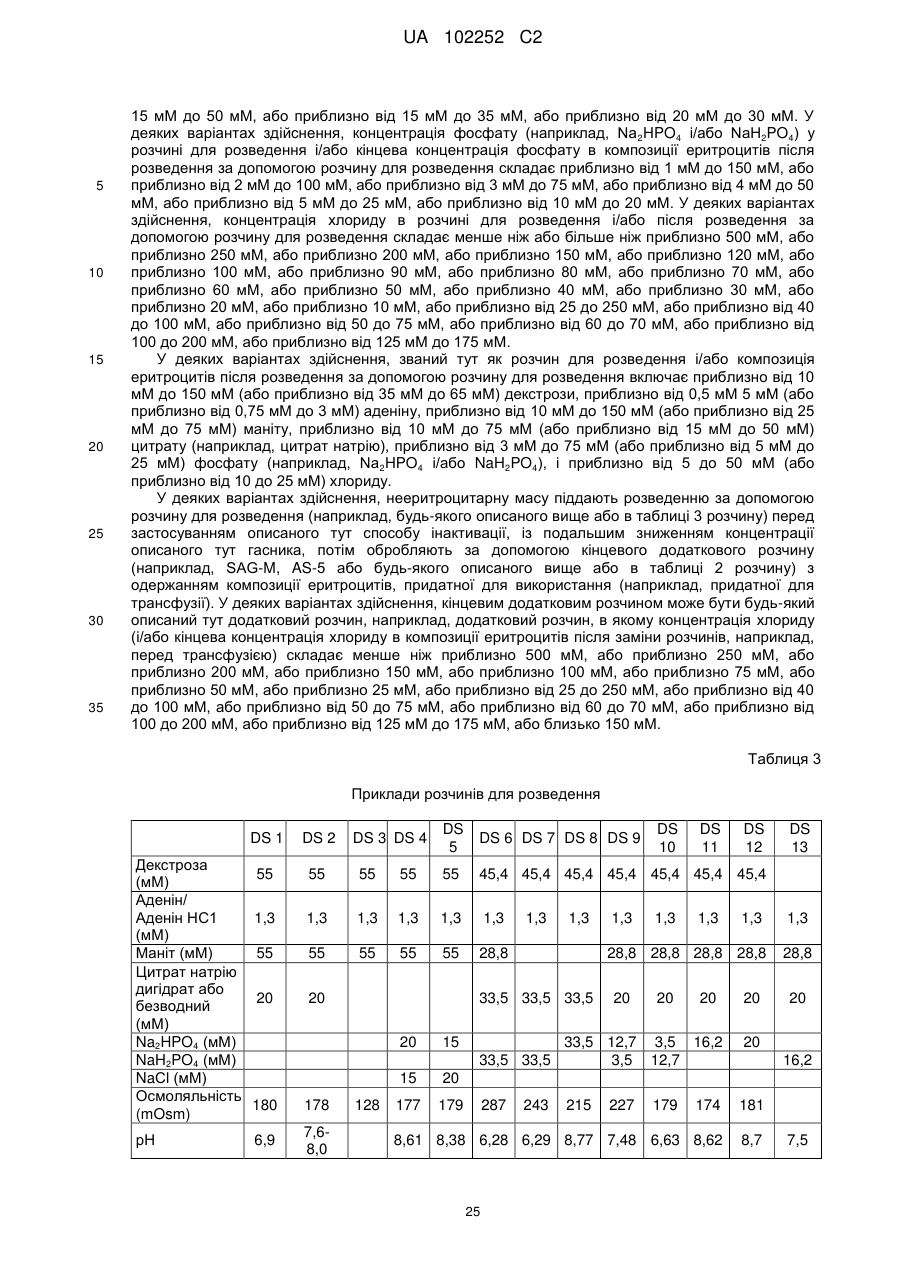
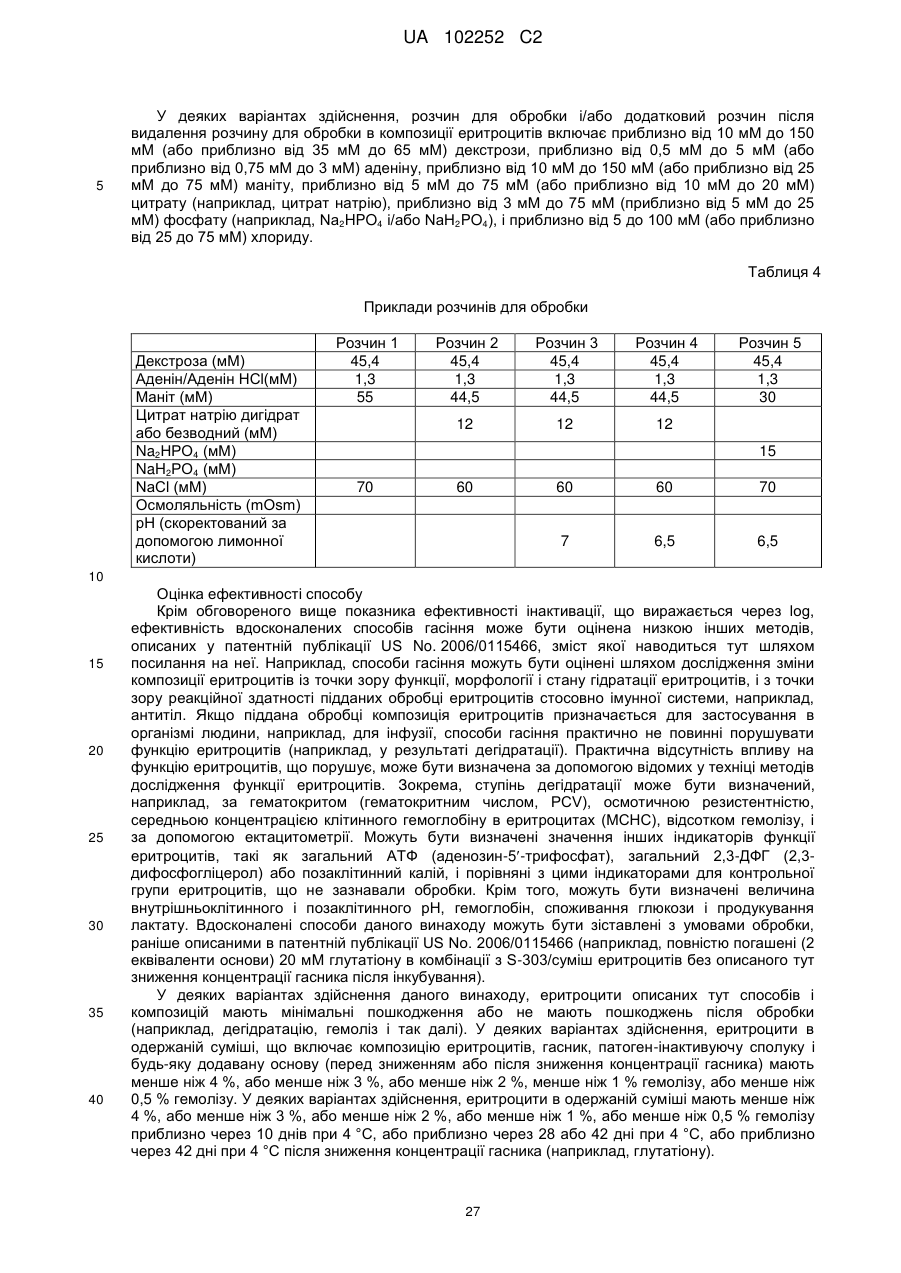
де розчин для обробки або розчин для розведення включає один або більше з таких компонентів: декстрозу, аденін, маніт, цитрат і лимонну кислоту;
і де концентрація іонів хлориду в суміші на стадії (а) після додавання розчину для обробки або розчину для розведення становить приблизно від 40 мМ до 100 мМ;
(b) заміна розчину, використовуваного при обробці композиції еритроцитів на стадії (а), кінцевим додатковим розчином таким чином, щоб концентрація гасника в суміші знизилася
до менше ніж приблизно 10 мМ.
2. Спосіб за п. 1, де розчин для обробки включає один або більше з наступних компонентів: декстрозу, аденін, маніт, цитрат, лимонну кислоту, фосфат і хлорид.
3. Спосіб за п. 1, де розчин для розведення включає аденін, маніт, цитрат і фосфат.
4. Спосіб за будь-яким із пп. 1-3, де композиція, яка містить еритроцити (iii), також містить додатковий розчин.
5. Спосіб за будь-яким із пп. 1-4, де основа включає приблизно від 0,75 до 1,25 еквівалентів основи, де еквівалент означає мольну кількість, яка є еквівалентною мольній кількості гасника в суміші.
6. Спосіб за будь-яким із пп. 1-4, де основа включає близько 1 еквівалента основи, де еквівалент означає мольну кількість, яка є еквівалентною мольній кількості гасника в суміші.
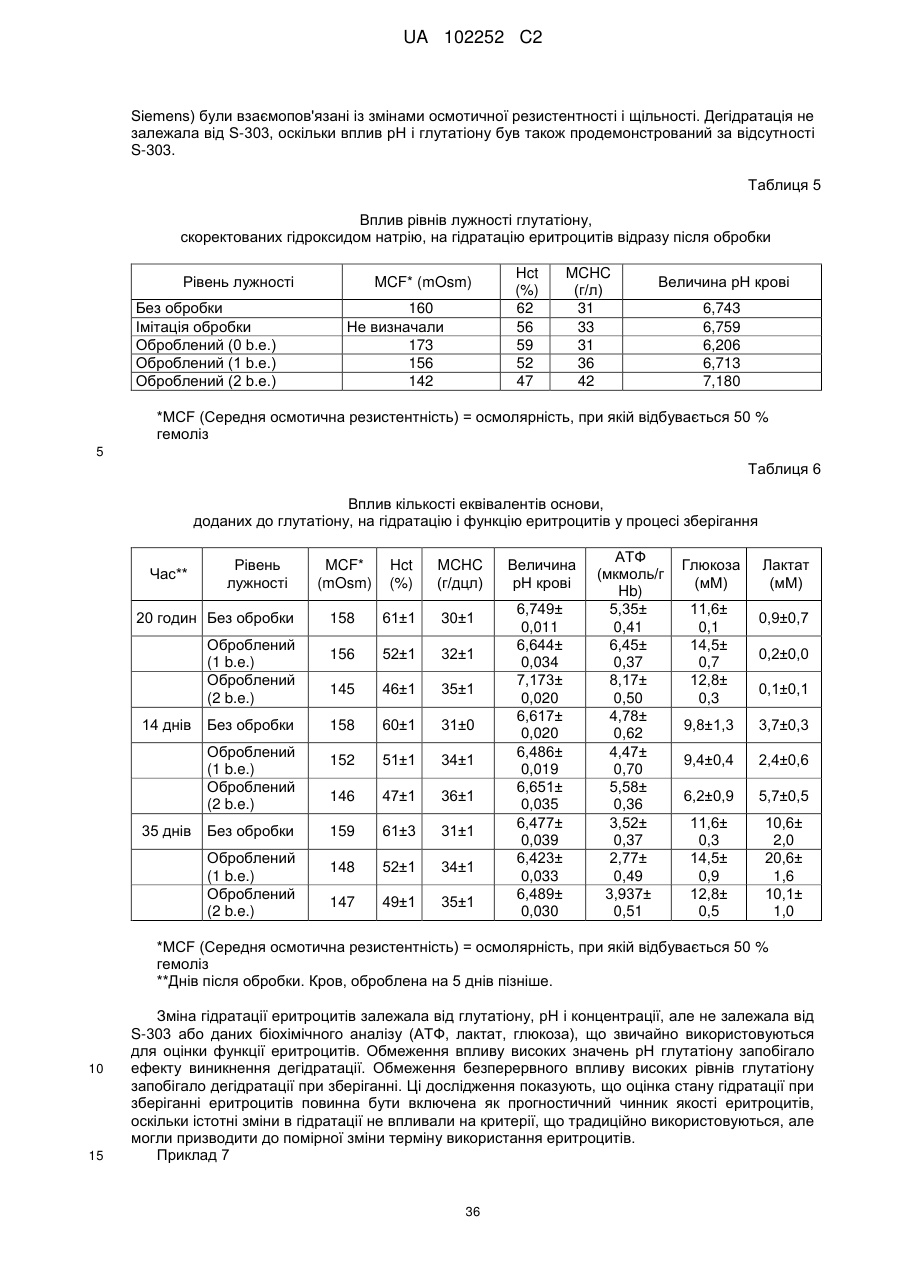
7. Спосіб за будь-яким із попередніх пунктів, де одержана на стадії (а) суміш має величину рН при 37 °С приблизно від 6,0 до 7,5.
8. Спосіб за п. 7, де одержана на стадії (а) суміш має величину рН при 37 °С приблизно від 6,5 до 7,1.
9. Спосіб за п. 7, де одержана на стадії (а) суміш має величину рН при 37 °С близько 6,8.
10. Спосіб за будь-яким із попередніх пунктів, де гасник включає цистеїн або похідне цистеїну.
11. Спосіб за п. 8, де гасником є глутатіон або його фармацевтично прийнятна сіль.
12. Спосіб за п. 9, де гасником є мононатрієва сіль глутатіону.
13. Спосіб за будь-яким із попередніх пунктів, де концентрація гасника в одержаній на стадії (а) суміші складає більше ніж 2 мМ.
14. Спосіб за п. 13, де гасник в одержаній на стадії (а) суміші присутній в концентрації приблизно від 5 мМ до 30 мМ.
15. Спосіб за п. 13, де гасник в одержаній на стадії (а) суміші присутній в концентрації приблизно від 15 мМ до 25 мМ.
16. Спосіб за п. 13, де гасник в одержаній на стадії (а) суміші присутній в концентрації близько 20 мМ.
17. Спосіб за будь-яким із попередніх пунктів, де час між стадією (а) і стадією (b) складає приблизно від 1 до 48 годин.
18. Спосіб за п. 17, де час між стадією (а) і стадією (b) складає приблизно від 4 до 30 годин.
19. Спосіб за будь-яким із попередніх пунктів, де стадія (b) включає центрифугування суміші з подальшим видаленням надосадової рідини з суміші.
20. Спосіб за будь-яким із пп. 1-16, де стадія (b) включає ексклюзійне розділення за розміром частинок.
21. Спосіб за будь-яким з пп. 1-16, де стадія (b) передбачає використання пристроїв для видавлювання.
22. Спосіб за будь-яким із попередніх пунктів, де гасник в одержаній на стадії (b) суміші присутній в концентрації менше ніж приблизно 8 мМ.
23. Спосіб за будь-яким із попередніх пунктів, де гасник в одержаній на стадії (b) суміші присутній в концентрації менше ніж приблизно 6 мМ.
24. Спосіб за будь-яким із попередніх пунктів, де функціональну групу вибирають із групи,
яка складається з іприту, проміжної сполуки іприту та еквівалента іприту.
25. Спосіб за будь-яким із попередніх пунктів, де функціональна група є іоном азиридинію або здатна утворювати іон азиридинію.
26. Спосіб за будь-яким із попередніх пунктів, де реакційноздатна електрофільна група здатна реагувати з нуклеїновими кислотами.
27. Спосіб за будь-яким із попередніх пунктів, де патоген-інактивуюча сполука додатково включає ліганд, що зв'язує нуклеїнову кислоту.
28. Спосіб за п. 27, де лігандом, що зв'язує нуклеїнову кислоту, є інтеркалятор.
29. Спосіб за п. 28, де інтеркалятором є акридин.
30. Спосіб за будь-яким із пп. 27-29, де патоген-інактивуюча сполука включає неміцний лінкер, що зв'язує функціональну групу, і ліганд, що зв'язує нуклеїнову кислоту.
31. Спосіб за п. 30, де патоген-інактивуючою сполукою є β-аланін, N-(акридин-9-іл), 2-[біс(2-хлоретил)аміно]-етиловий ефір.
32. Спосіб за будь-яким із попередніх пунктів, де концентрація петоген-інактивуючої сполуки в одержаній на стадії (а) суміші складає приблизно від 0,1 мкМ до 5 мМ.
33. Спосіб за будь-яким із попередніх пунктів, де основа являє собою NaOH або лужний буфер.
34. Спосіб за будь-яким із попередніх пунктів, де концентрація патоген-інактивуючої сполуки в одержаній на стадії (а) суміші є достатньою для інактивації щонайменше 1 log патогену в композиції еритроцитів, у випадку, якщо він присутній.
35. Спосіб за будь-яким із попередніх пунктів, де концентрація патоген-інактивуючої сполуки в одержаній на стадії (а) суміші є достатньою для інактивації щонайменше 3 log патогену в композиції еритроцитів, у випадку, якщо він присутній.
36. Спосіб за будь-яким із попередніх пунктів, де обробка інактивує шонайменше 1 log патогенного контамінанту в композиції еритроцитів, у випадку, якщо він присутній.
37. Спосіб за п. 36, де обробка інактивує щонайменше 3 log патогенного контамінанту в композиції еритроцитів, у випадку, якщо він присутній.
38. Спосіб за будь-яким із попередніх пунктів, де еритроцити в одержаній суміші мають менше ніж 1 % гемолізу через 42 дні при 4 °С після стадії (b).
39. Спосіб за будь-яким із попередніх пунктів, де після стадії (а) еритроцити в одержаній суміші мають величину зв'язувальної здатності з антитілами (ABC), меншу ніж 55 %, у порівнянні зі значенням ABC для еритроцитів, підданих такому способу обробки і за таких самих умов, але без використання основи.
40. Спосіб за будь-яким із попередніх пунктів, де еритроцити в одержаній суміші мають величину середньої зв'язувальної здатності з антитілами (ABC), меншу ніж приблизно 50000.
41. Спосіб за п. 40, де еритроцити в одержаній суміші мають величину середньої зв'язувальної здатності з антитілами (ABC), меншу ніж приблизно 40000.
42. Спосіб за будь-яким із пп. 1-39, де еритроцити в одержаній суміші мають величину середньої зв'язувальної здатності з антитілами (ABC) приблизно від 25000 до 70000.
43. Спосіб за п. 42, де еритроцити в одержаній суміші мають величину середньої зв'язувальної здатності з антитілами (ABC) приблизно від 35000 до 45000.
44. Спосіб за будь-яким із попередніх пунктів, де еритроцити в одержаній суміші мають величину гематокритного числа, більшу ніж 50 %, через 42 дні при 4 °С після стадії (b).
45. Спосіб за будь-яким із попередніх пунктів, де еритроцити в одержаній суміші мають величину середньої осмотичної резистентності, більшу ніж 140 мОсм, через 42 дні при 4 °С після стадії (b).
46. Композиція еритроцитів, одержана за допомогою способу за будь-яким з пп. 1-40, для
застосування в способі інфузії еритроцитів пацієнту.
47. Спосіб зниження ступеня дегідратації в композиції еритроцитів, де композицією є суміш, що включає гасник, здатний реагувати з патоген-інактивуючою сполукою, приблизно від 0,5
до 1,5 еквівалентів основи, де еквівалент означає мольну кількість, яка є еквівалентною мольній кількості гасника в суміші, еритроцити і розчин для обробки або розчин для розведення; де розчин для обробки або розчин для розведення включає один або більше з
наступних компонентів: декстрозу, аденін, маніт, цитрат і лимонну кислоту; і де концентрація іонів хлориду в композиції еритроцитів становить приблизно від 40 мМ до 100 мМ; де спосіб включає заміну розчину в суміші кінцевим додатковим розчином таким чином, щоб концетрація гасника в суміші знизилася до кількості, меншої ніж приблизно 10 мМ.
48. Спосіб за п. 47, де гасник включає цистеїн або похідне цистеїну.
49. Спосіб за п. 48, де гасником є глутатіон або його фармацевтично прийнятна сіль.
50. Композиція, що включає еритроцити, яка одержана способом за будь-яким із пп. 1-45.
51. Спосіб за будь-яким із пп. 1-45, 47-49, де кінцевий додатковий розчин включає один
або більше з наступних компонентів: декстрозу, хлорид натрію, аденін, гуанозин, глюкозу, цитрат, лимонну кислоту, фосфат і маніт.
Текст
Реферат: Винахід пропонує вдосконалений спосіб обробки композицій еритроцитів за допомогою патогенінактивуючої сполуки за умов, які забезпечують відповідну інактивацію патогену при збереженні життєздатності клітин. Крім того, пропонується спосіб зниження ступеня дегідратації еритроцитів, а також піддана обробці композиція еритроцитів. UA 102252 C2 (12) UA 102252 C2 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки Ця заявка вимагає пріоритет попередньої заявки на патент США No. 61/043666, озаглавленої "Способи гасіння при патогенній інактивації еритроцитів", поданої 9 квітня 2008 року, і попередньої заявки на патент США No. 61/087034, озаглавленої "Способи гасіння при патогенній інактивації еритроцитів", поданої 7 серпня 2008 року. Зміст цих обох заявок включений у даний опис шляхом посилання на них, як ніби вони повністю цитувалися нижче. Галузь техніки, якої стосується винахід Цей винахід стосується вдосконалених способів гасіння реакційноздатних електрофільних сполук, що використовуються при обробці препаратів крові з метою інактивації можливих патогенів. Зокрема, нуклеофільні сполуки, такі як тіоли, використовують при підвищеній концентрації для гасіння реакційноздатних електрофільних сполук у композиціях еритроцитів із подальшим зниженням їхньої концентрації для зменшення ступеня дегідратації еритроцитів (RBC). Рівень техніки Перенесення захворювання продуктами крові та іншими біологічними матеріалами залишається серйозною проблемою охорони здоров'я. Незважаючи на те, що були досягнуті значні успіхи при масовому контролі донорської крові і в дослідженні крові, проте, у продуктах крові під час її дослідження можуть бути не виявлені такі віруси, як гепатит В (HBV), гепатит С (HCV), і вірус імунодефіциту людини (HIV) внаслідок низьких рівнів вмісту вірусу або вірусних антитіл. Крім вірусної небезпеки, у цей час існує проблема відсутності відповідних сертифікаційних випробувань для проведення скринінгу крові, призначеної для використання при трансфузії, на присутність невірусних мікробів, таких як бактерії або представники найпростіших організмів. Існує також ризик, що невідомий до цього часу патоген може стати переважаючим у призначених для трансфузії продуктах крові, і виникне небезпека перенесення захворювання, як це, наприклад, відбувалося до виявлення ризику передачі ВІЛ внаслідок переливання крові. Для інактивації патогенів перед клінічним застосуванням продукту крові, у кров або в плазму крові вводять хімічні реагенти. Звичайно, для продуктів крові, що містять невелику кількість еритроцитів або що не містять еритроцити, таких як тромбоцити і плазма, використовують фотохімічні сполуки, що активуються, такі як псоралени. Для продуктів крові, що містять еритроцити, були розроблені сполуки для патогенної інактивації, які не вимагають фотоактивації. Ці сполуки звичайно мають електрофільні групи, які реагують із патогенами, і більш конкретно, із нуклеїновою кислотою патогену. Наприклад, у патентному документі U.S. 5055485 описана інактивація вірусів у клітинних композиціях і композиціях, що містять білок, за допомогою епоксидів арилдіолів. Можуть бути використані й інші сполуки, які генерують електрофіли in situ. У публікації LoGrippo et al., Proceedings of the Sixth Congress of the International Society of Blood Transfusion, Bibliotheca Haematologica (Hollander, ed.), 1958, pp. 225230 наведені результати досліджень із застосування для вірусної інактивації азотистого іприту, CH3-N(CH2CH2Cl)2. Ще більш важливими є патентні документи U.S. 5691132, 6177441, 6410219, 6143490 і 6093725, зміст яких наводиться тут шляхом посилання на них, в яких описане застосування сполук, що мають компонент, який забезпечує спрямованість дії тільки за нуклеїновою кислотою, так само як і електрофільний компонент, який реагує з нуклеїновою кислотою з метою інактивації патогену. У патентних документах U.S. 6093725 і 6514987, зміст яких наводиться тут шляхом посилання на них, описані аналогічні сполуки, в яких компонент сполуки, що забезпечує спрямованість дії тільки за нуклеїновою кислотою, сполучений із реакційноздатним електрофільним компонентом через гідролізовану ланку. У патентних документах U.S. 6136586 і 6617157, зміст яких наводиться тут шляхом посилання на них, описане використання етиленімінних олігомерів і споріднених сполук для патогенної інактивації. Ці сполуки етиленімінних похідних звичайно мають азиридинову групу, яка забезпечує наявність реакційноздатного електрофільного компонента, і поліамінний компонент, який забезпечує спрямований вплив сполуки за нуклеїновою кислотою. Загальний клас сполук із спрямованим впливом за нуклеїновою кислотою, маючі електрофільну або аналогічну групу, реагуючу з нуклеїновою кислотою, використовують для інактивації патогенів у крові, продуктах крові, і в різних зразках біологічного походження. Існує деяка небезпека, що хоч ці сполуки і спеціально призначені для спрямованого впливу за нуклеїновою кислотою, проте, вони можуть реагувати з іншими компонентами крові, такими як білки або клітинні мембрани. Ці побічні реакції є несприятливими і можуть викликати побічні небажані ефекти, такі як зміни білків і клітинних мембран, які можуть розпізнаватися імунною системою. Коли такі піддані обробці продукти крові використовують повторно, вони можуть викликати імунну реакцію реципієнта на оброблений продукт крові. У патентних документах U.S. 1 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 6270952, 6709810 і 7293985, зміст яких наводиться тут шляхом посилання на них, описані способи гасіння таких патоген-інактивуючих сполук для зниження ступеня протікання будь-яких таких небажаних побічних реакцій. У патентній публікації U.S. No. 2006/0115466, зміст якої наводиться тут шляхом посилання на неї, описані удосконалення для цих умов гасіння, які спрямовані на імунну реакцію, що розвивається у відповідь на присутність патоген-інактивуючої сполуки. Однак, незважаючи на підвищення ефективності гасіння, було виявлено, що в деяких випадках піддані обробці еритроцити мали знижений термін використання внаслідок підвищеного ступеня дегідратації клітин, що вимірюється по зниженій величині осмотичної резистентності еритроцитів і зниженій величині гематокриту. Таким чином, існує потреба в способах зниження небажаних електрофільних побічних реакцій патоген-інактивуючих сполук при збереженні здатності патоген-інактивуючої сполуки інактивувати небезпечні патогени без шкідливого впливу на життєздатність і термін використання обробленого продукту крові. Зокрема, існує потреба у вдосконалених способах гасіння патоген-інактивуючих сполук в еритроцитах. Суть винаходу Даний винахід пропонує способи обробки композицій еритроцитів за допомогою патогенінактивуючої сполуки і гасника за умов, які забезпечують відповідну патогенну інактивацію і зниження ступеня протікання небажаних побічних реакцій (таких як зміна еритроцитів) при зниженні або мінімізації несприятливих ефектів, такому як дегідратація клітин. У деяких варіантах здійснення, гасником є глутатіон, який нейтралізований за допомогою придатної кількості основи. У деяких варіантах здійснення, спосіб включає зниження концентрації глутатіону відразу після патогенної інактивації. В одному аспекті, даний винахід пропонує спосіб обробки композиції еритроцитів, що включає: a) наявність i) ефективної кількості патоген-інактивуючої сполуки для інактивації патогену, у випадку, якщо він присутній, де патоген-інактивуюча сполука включає функціональну групу, яка є або яка утворює реакційноздатну електрофільну групу, ii) ефективної кількості гасника, що включає тіольну групу, де тіол здатний реагувати з реакційноздатною електрофільною групою патоген-інактивуючої сполуки і iii) композиції, що включає еритроцити; b) змішування патоген-інактивуючої сполуки і гасника з композицією, що включає еритроцити; і с) відповідне зниження концентрації гасника в суміші до кількості, яка знижує степінь дегідратації еритроцитів, що відбувається при зберіганні суміші, стосовно ступеня дегідратації еритроцитів, що відбувається при зберіганні суміші при початковій концентрації гасника. У деяких із цих варіантів здійснення, зниження концентрації гасника включає видалення розчину, що використовується під час інактивації, і додавання кінцевого додаткового розчину (наприклад, будь-якого описаного тут розчину, такого як SAG-M, AS-5, або будь-якого розчину з таблиць 2, 3 або 4). У деяких варіантах здійснення, стадія (a) додатково включає наявність придатної основи, стадія (b) додатково включає змішування основи з композицією, що включає еритроцити, де основа присутня в достатній кількості для зниження ступеня протікання небажаної реакції патоген-інактивуючої сполуки з еритроцитами в суміші, стосовно суміші без основи. У деяких варіантах здійснення, небажаною реакцією патоген-інактивуючої сполуки з еритроцитами є зміна поверхні еритроцитів патоген-інактивуючою сполукою. У деяких варіантах здійснення, стадія (a) додатково включає наявність придатної основи, стадія (b) додатково включає змішування основи з композицією, що включає еритроцити, де основа присутня в достатній кількості для зниження рівня зв'язування антитіла з анти-патоген-інактивуючою сполукою підданої обробці композиції еритроцитів в одержаній суміші, принаймні, приблизно на 5 % (або, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 %, або, принаймні, приблизно на 90 %) відносно суміші, що не містить основи. У деяких варіантах здійснення, основа і гасник змішують із композицією еритроцитів перед змішуванням патоген-інактивуючої сполуки з композицією еритроцитів, у той же самий час, або не пізніше ніж через 30 хвилин після змішування патоген-інактивуючої сполуки з композицією еритроцитів. У деяких варіантах здійснення, основа і гасник змішують разом перед змішуванням або основи, або гасника, з композицією еритроцитів. У деяких варіантах здійснення, основою є NaOH. У деяких варіантах здійснення, основою є лужною буфер. У деяких варіантах здійснення, основа включає приблизно від 0,5 до 1,5 еквівалентів основи, де еквівалент означає мольну кількість, яка є еквівалентною мольній кількості гасника в суміші. У деяких варіантах здійснення, основа включає приблизно від 0,75 до 1,25 еквівалентів основи. У деяких варіантах здійснення, основа включає близько 1 еквівалента основи. У деяких варіантах здійснення, одержана суміш на стадії (b) має величину pH при 37 °C приблизно від 6,0 до 7,5. У деяких варіантах здійснення, величина pH складає приблизно від 6,5 до 7,1. У деяких 2 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантах здійснення, величина pH складає близько 6,8 або 6,9. У деяких варіантах здійснення, гасник включає цистеїн або похідне цистеїну. У деяких варіантах здійснення, гасником є глутатіон або його фармацевтично прийнятна сіль. У деяких варіантах здійснення, концентрація гасника в одержаній суміші на стадії (b) є більшою, ніж 2 мM. У деяких варіантах здійснення, концентрація гасника складає приблизно від 5 мM до 30 мM. У деяких варіантах здійснення, концентрація гасника складає приблизно від 15 мM до 25 мM. У деяких варіантах здійснення, концентрація гасника складає близько 20 мМ. У деяких варіантах здійснення, зниження концентрації гасника на стадії (с) включає центрифугування суміші з подальшим видаленням надосадової рідини. У деяких варіантах здійснення, стадія (с) включає ексклюзивне розділення. У деяких варіантах здійснення, гасник в одержаній суміші на стадії (с) присутній при концентрації меншій, ніж приблизно 10 мM. У деяких варіантах здійснення, концентрація гасника складає менше, ніж приблизно 8 мM. У деяких варіантах здійснення, концентрація гасника складає менше, ніж приблизно 6 мM (або менше, ніж приблизно 4 мМ, або менше, ніж приблизно 2 мM). У деяких варіантах здійснення, зберіганням суміші є зберігання суміші протягом більш ніж 10 днів при 4 °C. У деяких варіантах здійснення, зберіганням суміші є зберігання суміші протягом більш ніж 42 днів (або 28 днів) при 4 °C. У деяких варіантах здійснення, спосіб включає додавання додаткового розчину (наприклад, будь-якого додаткового розчину, описаного в таблиці 2, і/або додаткового розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, суміш зберігають у додатковому розчині (наприклад, будь-якому додатковому розчині, описаному в таблиці 2, і/або додатковому розчині, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, спосіб додатково включає заміну розчину для обробки (наприклад, будь-якого розчину, описаного в таблицях 2, 3 або 4, і/або розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат, і/або маніт) на додатковий розчин (наприклад, будь-який додатковий розчин, описаний у таблиці 2, і/або додатковий розчин, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, концентрація хлориду в композиції перед зниженням концентрації гасника складає менше, ніж приблизно 100 мM (або близько 75 мM). У деяких варіантах здійснення, концентрація хлориду в композиції після зниження концентрації гасника і/або додавання додаткового розчину складає більше, ніж 100 мM (або близько 125 мM). У деяких варіантах здійснення кожного зі згаданих вище способів, так само як й інших описаних тут способів, функціональною групою є іприт, проміжна сполука іприту або еквівалент іприту. У деяких варіантах здійснення, функціональна група є, або вона здатна до утворення іона азиридинію. У деяких варіантах здійснення, реакційноздатна електрофільна група здатна реагувати з нуклеїновими кислотами. У деяких варіантах здійснення, патоген-інактивуюча сполука додатково включає ліганд, що зв'язує нуклеїнову кислоту. У деяких варіантах здійснення, лігандом, що зв'язує нуклеїнову кислоту, є інтеркалятор. У деяких варіантах здійснення, інтеркалятором є акридин. У деяких варіантах здійснення, патоген-інактивуюча сполука включає неміцну ланку, що з'єднує функціональну групу і ліганд, що зв'язує нуклеїнову кислоту. У деяких варіантах здійснення, патоген-інактивуючою сполукою є β-аланін, N-(акридин9-іл), 2-[біс(2-хлоретил)аміно]етиловий ефір. У деяких варіантах здійснення, концентрація патоген-інактивуючої сполуки в одержаній суміші на стадії (b) складає приблизно від 0,1 мкM до 5 мM. У деяких варіантах здійснення, концентрація повинна бути достатньою для інактивації, принаймні, 1 log патогену в композиції еритроцитів, у випадку, якщо він присутній. У деяких варіантах здійснення, концентрація повинна бути достатньою для інактивації, принаймні, 3 log патогену. У деяких варіантах здійснення, час між стадією (b) і стадією (с) складає приблизно від 1 до 48 годин. У деяких варіантах здійснення, час складає приблизно від 10 до 30 годин. У деяких варіантах здійснення, час складає приблизно від 15 до 25 годин. У деяких варіантах здійснення, обробка призводить до інактивації, принаймні, 1 log патогенних контамінації композиції еритроцитів, у випадку, якщо вона присутня. У деяких варіантах здійснення, обробка призводить до інактивації, принаймні, 3 logs. У деяких варіантах здійснення, спосіб додатково включає стадію зниження концентрації патоген-інактивуючої сполуки в суміші. У деяких варіантах здійснення, стадії зниження концентрації гасника в суміші і зниження концентрації патоген-інактивуючої сполуки в суміші відбуваються в один і той же час. У деяких варіантах здійснення кожного зі згаданих вище способів, так само як й інших описаних тут способів, еритроцити (RBCs) одержаної суміші через 20 годин після стадії (b) мають величину зв'язувальної здатності анти-патоген-інактивуючої сполуки з антитілом (ABC) менш ніж 65 %, у порівнянні з величиною ABC еритроцитів для того ж самого способу і за тих самих умов, але без використання основи. У деяких варіантах здійснення, еритроцити мають 3 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 середнє значення ABC менше, ніж приблизно 50000. У деяких варіантах здійснення, еритроцити мають середнє значення ABC менше, ніж приблизно 40000. У деяких варіантах здійснення, еритроцити мають середнє значення ABC приблизно від 25000 до 70000. У деяких варіантах здійснення, еритроцити мають середнє значення ABC приблизно від 35000 до 45000. У деяких варіантах здійснення, еритроцити одержаної суміші мають після стадії (с) менш ніж 1 % гемолізу. У деяких варіантах здійснення, еритроцити мають після стадії (с) менш ніж 1 % гемолізу через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, еритроцити одержаної суміші мають після стадії (с) гематокритне число (PCV) більше ніж 50 %. У деяких варіантах здійснення, еритроцити мають після стадії (с) PCV більше ніж 50 % через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, еритроцити одержаної суміші мають після стадії (с) величину середньої осмотичної резистентності еритроцитів більше ніж 140 (або 150) через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, кількість патогенінактивуючої сполуки не знижують, і/або патоген-інактивуюча сполука не контактує з пристроєм для адсорбції сполуки (CAD). У додатковому аспекті, винахід пропонує спосіб зниження ступеня дегідратації еритроцитів, що включає: a) наявність композиції еритроцитів, що включає суміш i) гасника, де гасник здатний реагувати з патоген-інактивуючою сполукою, і ii) еритроцитів; і b) відповідне зниження концентрації гасника (і, необов'язково, концентрації патоген-інактивуючої сполуки і/або її побічних продуктів) у суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, щодо ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника. У деяких варіантах здійснення, гасник включає цистеїн або похідне цистеїну. У деяких варіантах здійснення, гасником є глутатіон або його фармацевтично прийнятна сіль. У деяких варіантах здійснення, гасник в одержаній на стадії (b) суміші присутній у концентрації менше ніж приблизно 10 мM. У деяких варіантах здійснення, концентрація гасника складає менше ніж приблизно 8 мM. У деяких варіантах здійснення, концентрація гасника складає менше ніж приблизно 6 мM, або менше ніж приблизно 2 мM. У деяких варіантах здійснення, еритроцити (RBCs) в одержаній суміші після стадії (b) мають менше ніж 1 % гемолізу. У деяких варіантах здійснення, еритроцити після стадії (b) мають менше ніж 1 % гемолізу через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, еритроцити одержаної суміші після стадії (b) мають гематокритне число (PCV) більше, ніж 50 %. У деяких варіантах здійснення, еритроцити одержаної суміші після стадії (b) мають PCV більше, ніж 50 % через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, еритроцити одержаної суміші мають після стадії (b) величину середньої осмотичної резистентності більшу, ніж 140 (або 150) через 42 дні (або 28 днів) при 4 °C. У деяких варіантах здійснення, зберіганням суміші є зберігання суміші протягом більше ніж 10 днів при 4 °C. У деяких варіантах здійснення, зберіганням суміші є зберігання суміші протягом більш ніж 42 днів (або 28 днів) при 4 °C. У деяких варіантах здійснення, кількість патоген-інактивуючої сполуки не знижують і/або патоген-інактивуюча сполука не контактує з пристроєм адсорбції сполуки (CAD). Пропонуються композиції еритроцитів, одержані за допомогою кожного із згаданих вище способів. Також пропонуються композиції еритроцитів, які можуть бути одержані за допомогою кожного зі згаданих вище способів. У додатковому аспекті, винахід пропонує композицію, що включає a) еритроцити, де еритроцити ковалентно прореагували з електрофільною групою патоген-інактивуючої сполуки; і b) гасник, що включає тіольну групу, яка здатна реагувати з патоген-інактивуючою сполукою; де композиція використовується для інфузії людям після зберігання до 42 днів (або 28 днів) при 4 °C. У деяких варіантах здійснення, інактивується, принаймні, 1 log патогену, у випадку, якщо він присутній. У деяких варіантах здійснення, інактивуються, принаймні, 3 logs. У деяких варіантах здійснення, електрофільною групою є іприт, проміжна сполука іприту або еквівалент іприту. У деяких варіантах здійснення, електрофільна група є іоном азиридинію, або вона здатна утворювати іон азиридинію. У деяких варіантах здійснення, електрофільна група здатна реагувати з нуклеїновими кислотами. У деяких варіантах здійснення, електрофільна група ковалентно реагує з клітинною поверхнею еритроцитів. У деяких варіантах здійснення, патогенінактивуюча сполука додатково включає ліганд, що зв'язує нуклеїнову кислоту. У деяких варіантах здійснення, лігандом, що зв'язує нуклеїнову кислоту, є інтеркалятор. У деяких варіантах здійснення, інтеркалятором є акридин. У деяких варіантах здійснення, патогенінактивуюча сполука включає неміцну ланку, що з'єднує електрофільну групу і ліганд, що зв'язує нуклеїнову кислоту. У деяких варіантах здійснення, патоген-інактивуючою сполукою є β-аланін, N-(акридин-9-іл), 2-[біс(2-хлоретил)аміно]етиловий ефір. У деяких варіантах здійснення, гасник включає цистеїн або похідне цистеїну. У деяких варіантах здійснення, гасником є глутатіон або його фармацевтично прийнятна сіль. У деяких варіантах здійснення, гасник присутній при 4 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрації, яка є досить низькою, для того щоб виключити або мінімізувати дегідратацію еритроцитів під час зберігання. У деяких варіантах здійснення, концентрація гасника складає приблизно менш ніж 10 мM. У деяких варіантах здійснення, концентрація гасника складає приблизно менш ніж 8 мM. У деяких варіантах здійснення, концентрація гасника складає приблизно менш ніж 6 мM, або приблизно менш ніж 2 мM. У деяких варіантах здійснення, еритроцити (RBCs) мають гематокритне число (PCV) більше, ніж 55 %. У деяких варіантах здійснення, еритроцити мають значення PCV більше, ніж 60 %. У деяких варіантах здійснення, еритроцити мають середню величину зв'язувальної здатності з антитілами (ABC) приблизно меншу, ніж 50000. У деяких варіантах здійснення, еритроцити мають середню величину ABC приблизно меншу, ніж 40000. У деяких варіантах здійснення, еритроцити мають середню величину ABC приблизно від 25000 до 60000. У деяких варіантах здійснення, еритроцити мають середню величину ABC приблизно від 25000 до 70000. У деяких варіантах здійснення, еритроцити мають середню величину ABC приблизно від 35000 до 45000. У деяких варіантах здійснення, композиція додатково включає додатковий розчин (наприклад, будь-який додатковий розчин, описаний у таблиці 2, і/або додатковий розчин, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, концентрація хлориду в додатковому розчині і/або в композиції складає приблизно більше ніж 100 мM (або близько 125 мM). У додатковому аспекті, винахід пропонує способи інфузії еритроцитів людині, що включають: a) наявність будь-якої однієї із згаданих вище композицій еритроцитів або композиції еритроцитів, одержаної будь-яким одним з описаних тут способів, і b) інфузію композиції еритроцитів людині. В одному аспекті, винахід пропонує спосіб обробки композиції еритроцитів, що включає: (a) змішування (i) патоген-інактивуючої сполуки, що включає функціональну групу, яка є реакційноздатною електрофільною групою, або яка утворює реакційноздатну електрофільну групу (наприклад, ефективна кількість патоген-інактивуючої сполуки для інактивації патогену у випадку, якщо він присутній); (ii) гасника (наприклад, ефективної кількості гасника), що включає тіольну групу, де тіол здатний реагувати з реакційноздатною електрофільною групою патогенінактивуючої сполуки; і (iii) композиції, що включає еритроцити; і (b) відповідне зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючий внаслідок зберігання суміші, відносно ступеня дегідратації еритроцитів, виникаючий внаслідок зберігання суміші при початковій концентрації гасника. У деяких з цих варіантів здійснення, зниження концентрації гасника включає видалення розчину, що використовується під час інактивації, і додавання кінцевого додаткового розчину (наприклад, будь-якого описаного тут розчину, такого як SAG-M, AS-5 або будь-якого розчину з таблиць 2, 3 або 4). Спосіб може включати будь-який один або більш з варіантів здійснень, перерахованих тут або вище. У деяких варіантах здійснення, спосіб додатково включає змішування придатної основи з композицією, що включає еритроцити, де основа присутня в достатній кількості, щоб знизити ступінь протікання небажаної реакції патоген-інактивуючої сполуки з еритроцитами в суміші, стосовно суміші, що не містить основи. У деяких варіантах здійснення, небажаною реакцією патоген-інактивуючої сполуки з еритроцитами є зміна поверхні еритроцитів патогенінактивуючою сполукою. У деяких варіантах здійснення, спосіб додатково включає змішування придатної основи з композицією, що включає еритроцити, де основа присутня в достатній кількості, щоб знизити величину зв'язування анти-патоген-інактивуючої сполуки з антитілом для підданій обробці композиції еритроцитів в одержаній суміші, принаймні, приблизно на 5 % (або, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 %, або, принаймні, приблизно на 90 %) стосовно суміші без основи. В одному аспекті, винахід пропонує спосіб зниження ступеня дегідратації в композиції еритроцитів, де композиція є сумішшю, що включає гасник, здатний реагувати з патогенінактивуючою сполукою, і еритроцити; де спосіб включає достатнє зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, стосовно рівня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника. В іншому аспекті, винахід пропонує спосіб інфузії еритроцитів, що включає інфузію описаної тут композиції еритроцитів людині. Стислий опис фігур На фігурі 1 наведена осмотична резистентність еритроцитів при різних вмістах основи після початкового введення гасника, як це описано в прикладі 6. На фігурі 2 наведена густина еритроцитів при різних вмістах основи при інкубації протягом 20 годин. 5 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фігурі 3 наведена густина еритроцитів при різних вмістах основи після інкубації і зберігання протягом 36 днів. На фігурі 4 наведена осмотична резистентність еритроцитів після інкубації і зберігання протягом 36 днів при зниженні і без зниження концентрації гасника (тобто з проведенням і без проведення стадії заміни). На фігурі 5 наведена осмотична резистентність еритроцитів після інкубації і зберігання протягом 42 днів зі зміною початкової концентрації гасника (зі стадією заміни) у порівнянні із середньою початковою концентрацією гасника (без стадії заміни). На фігурі 6 наведена осмотична резистентність еритроцитів після інкубації і зберігання протягом 36 днів у присутності і за відсутності патоген-інактивуючої сполуки. На фігурі 7 наведені значення зв'язувальної здатності з антитілами (ABC) для різних препаратів еритроцитів, одержаних за допомогою способів даного винаходу. Детальний опис винаходу Даний винахід пропонує способи обробки композицій еритроцитів для інактивації можливо присутніх у них патогенів, що забезпечують при цьому зниження або мінімізацію протікання небажаних побічних реакцій (таких як зміна еритроцитів, що призводить до небажаної імунної реакції у відповідь) і зниження або мінімізацію несприятливих впливів на життєздатність клітин (наприклад, зниженої осмотичної резистентності і/або підвищеного ступеня дегідратації) і/або на термін використання під час обробки і після обробки. Ми виявили, що відповідний контроль величини pH у поєднанні з використанням придатних кількостей гасника під час процесу патогенної інактивації дозволяє знизити початкову ступінь дегідратації еритроцитів, підданих обробці патоген-інактивуючою сполукою. За цим процесом може слідувати зниження початкової концентрації гасника для одержання здорових патоген-інактивованих еритроцитів, що дозволяє здійснювати зберігання клітин без значних змін осмотичної резистентності. Ці способи особливо підходять для одержання композицій еритроцитів, в яких патогени вже були інактивовані для клінічного застосування, особливо, коли композиції планується зберігати протягом деякого періоду часу перед їх клінічним застосуванням. Відповідно, даний винахід, в одному аспекті, пропонує спосіб обробки композиції еритроцитів, що включає патоген-інактивуючу сполуку і гасник, шляхом (1) змішування патогенінактивуючої сполуки і гасника з композицією, що включає еритроцити; і (2) відповідного зниження концентрації гасника для зниження ступеня дегідратації еритроцитів, що виникає внаслідок зберігання суміші, стосовно ступеня дегідратації еритроцитів, що виникає внаслідок зберігання суміші при початковій концентрації гасника. В інших аспектах, даний винахід пропонує способи зниження ступеня дегідратації і/або підвищення осмотичної резистентності еритроцитів, так само як і способи інфузії еритроцитів людям. Крім того, пропонуються піддані обробці композиції еритроцитів. Еритроцити Композиції еритроцитів винаходу включають, але цим не обмежуючи, будь-який продукт крові, що включає еритроцити (наприклад, людську кров), де продукт крові забезпечує або здатний забезпечити еритроцити, придатні для застосування у людей, ссавців і/або хребетних, наприклад, для інфузії. Композиції еритроцитів включають, наприклад, суцільну кров і концентрати еритроцитів, таку як еритроцитарна маса (наприклад, еритроцити з підвищеним гематокритом і/або що не містять додатковий розчин). Композиції еритроцитів можуть бути охарактеризовані за допомогою їх гематокриту або гематокритного числа (PCV), величини концентрації еритроцитів у композиції. Композиції еритроцитів можуть мати гематокрит в інтервалі приблизно від 1 до 100 %, більш ймовірно, приблизно від 10 до 90 %, а також приблизно від 35 до 80 %, або приблизно від 40 до 70 %. Такі композиції еритроцитів можуть включати хімічні реагенти, такі як патоген-інактивуючі сполуки і гасники. Вони можуть також включати буфери та інші розчини, такі як додаткові розчини еритроцитів (наприклад, будь-який описаний тут розчин, такий як SAG-M, AS-5 або будь-який розчин із таблиць 2, 3 або 4), що включають солі або буферні розчини. У деяких варіантах здійснення, описані тут композиції еритроцитів перед застосуванням в описаних тут способах обробки є еритроцитарними масами, що мають гематокрит в інтервалі приблизно від 70 до 90 %, або приблизно від 75 до 85 %, або близько 80 %. У деяких варіантах здійснення, композиції еритроцитів перед використанням і/або під час використання в описаних тут способах обробки не є еритроцитарними масами, що мають гематокрит в інтервалі приблизно від 50 до 70 %, або приблизно від 55 до 65 %, або близько 60 %. У деяких варіантах здійснення, композиції еритроцитів перед використанням і/або під час використання в описаних тут способах обробки розводять за допомогою розчину для розведення, і вони мають гематокрит в інтервалі приблизно від 30 до 50 %, або приблизно від 35 до 45 %, або близько 40 %. У деяких варіантах здійснення, описані тут композиції 6 UA 102252 C2 5 10 15 еритроцитів піддавали лейкоцитредукуванню перед застосуванням в описаних тут способах обробки. У деяких варіантах здійснення, композиції еритроцитів не піддавали лейкоцитредукуванню. Будь-яка композиція еритроцитів, яка буде приведена в контакт або буде введена живій людині, ссавцеві або хребетному, коли такий контакт несе ризик перенесення захворювання внаслідок зараження патогенами, може бути піддана описаній тут обробці. Патогени крові Патогенне контамінування, якщо воно присутнє, яке інактивують способами винаходу, включає будь-який збудник, що містить нуклеїнову кислоту, здатний спричинити захворювання у людини, інших ссавців або хребетних. Патогенний збудник може бути одноклітинним або багатоклітинним. Прикладами патогенів є бактерії, віруси, найпростіші, гриби, дріжджові гриби, плісняви і мікоплазми, які викликають захворювання у людей, інших ссавців або хребетних. Генетичним матеріалом патогену може бути ДНК або РНК, і генетичний матеріал може бути присутнім у вигляді односпіральної або двоспіральної нуклеїнової кислоти. У таблиці 1 наведений список прикладів вірусів, який, як передбачається, ні в якій мірі не є обмеженням для винаходу. Таблиця 1 Необмежуючі приклади вірусів Сімейство: Adeno Arena Bunya Herpes Orothomyxo Papova Paramyxo Picorna Pox Reo Retro Rhabdo Toga Hepadna Bacteriophage (Rickettsia) Вірус: Adenovirus 2 (Аденовірус 2) Canine hepatitis (Собачий гепатит) Pichinde (Пічінде) Lassa (Ласа) Turlock (Турлок) California encephalitis (Каліфорнійський енцефаліт) Herpes simplex 1 (Простий герпес 1) Herpes simplex 2 (Простий герпес 2) Cytomegalovirus (Цитомегаловірус) Pseudorabies (Інфекційний бульбарний параліч) Influenza (Грип) SV-40 Measles (Кір) Mumps (Інфекційний паротит) Parainfluenza 2 and 3 (Парагрип 2 і 3) Poliovirus 1 and 2 (Вірус поліомієліту 1 и 2) Coxsackie A-9 (Вірус коксакі А-9) Echo 11 Vaccinia (Коров'яча віспа) Fowl Pox (Віспа птахів) Blue tongue (Африканська катаральна лихоманка) Colorado tick fever (Колорадська кліщова лихоманка) HIV (Вірус імунодефіциту людини) Avian sarcoma (Саркома птахів) Murine sarcoma (Саркома мишей) Murine leukemia (Лейкемія мишей) Vesicular stomatitis virus (Вірус везикулярного стоматиту) Western equine encephalitis (Західний енцефаліт коней) Dengue 2 (Лихоманка Денге 2) Dengue 4 (Лихоманка Денге 4) St. Louis encephalitis (Енцефаліт Сент-Луїс) hepatitis B (Гепатит В) Lambda (Лямбда-фаг) R17 T2 R. akari (rickettsialpox) (Віспоподібний рикетсіоз) На додаток до інактивації можливих контамінуючих патогенів, способи даного винаходу 7 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть також інактивувати лейкоцити, які можуть бути присутніми в композиції еритроцитів. Переважно, щоб способи зниження вмісту лейкоцитів використали для видалення основної маси лейкоцитів із композицій еритроцитів, призначених для інфузії, оскільки вони можуть викликати небажані імунні реакції у відповідь у реципієнта. Однак не всю кров піддають обробці для зниження вмісту лейкоцитів, або за допомогою способів зниження вмісту лейкоцитів можуть видаляти не всі лейкоцити. Тому, інактивація будь-яких залишкових лейкоцитів описаними тут способами винаходу може додатково знижувати ризик прояву таких імунних реакцій у відповідь. Патоген-інактивуючі сполуки Інактивацію патогену в композиції еритроцитів здійснюють шляхом контактування патогену в композиції еритроцитів з патоген-інактивуючою сполукою. У будь-якому з описаних тут варіантів здійснення, патоген-інактивуюча сполуки (наприклад, описана тут S-303) може бути присутньою в ефективній кількості (наприклад, ефективній кількості для інактивації патогену, наприклад, у кількості, достатній для інактивації, наприклад, принаймні, 1 log, 2 log, або 3 log патогену в композиції еритроцитів, у випадку, якщо він присутній). Патоген-інактивуючі сполуки, які можуть бути використані в способах винаходу, включають сполуки, що містять функціональну групу, яка є, або яка здатна утворювати, і утворила, наприклад, in situ, реакційноздатну групу, таку як електрофільна група. У ряді випадків, патоген-інактивуючі сполуки даного винаходу не вимагають фотоактивації, для того щоб ставати реакційноздатними. Наприклад, функціональною групою може бути іпритна група, група з проміжної сполуки іприту, група з еквівалента іприту, епоксид, формальдегід або синтон, що одержується з формальдегіду. Такі функціональні групи здатні утворювати in situ реакційноздатну групу, таку як електрофільні азиридин, іон азиридинію, тііран або іон тііранію. Іпритна група може бути моно- або біс(галогенетил)амінною групою або моно(галогенетил)сульфідною групою. Еквівалентом іприту є група, яка реагує за таким самим механізмом, як іприт, наприклад, шляхом утворення реакційноздатних проміжних сполук, таких як групи азиридинію і азиридину або групи тіірану і тііранію. Приклади включають похідні азиридину, моно або біс(мезилетил)амінні групи, моно(мезилетил)сульфідні групи, моноабо біс(тозилетил)амінні групи і моно(тозилетил)сульфідні групи. Синтон, що одержується з формальдегіду, є будь-яким сполукою, яке розпадається до формальдегіду, і який включає гідроксиламін, такий як гідроксиметилгліцин. Реакційноздатна група патоген-інактивуючої сполуки здатна реагувати з нуклеїновими кислотами патогенів, наприклад, із нуклеофільними групами нуклеїнової кислоти. Реакційноздатна група також здатна реагувати з нуклеофільною групою гасника. Патогенінактивуючі сполуки можуть також включати компонент, який націлює сполуки на нуклеїнові кислоти, такий як якірна ділянка. Якірна ділянка включає фрагмент, який здатний нековалентно зв'язуватися з біополімером нуклеїнової кислоти, таким як ДНК або РНК, і його також називають лігандом, що зв'язує нуклеїнову кислоту, групою, що зв'язує нуклеїнову кислоту, або фрагментом, що зв'язує нуклеїнову кислоту. Приклади таких сполук описані в патентних документах U.S. 5691132, 6410219, 6136586, 6617157 і 6709810, зміст кожного з яких наводиться тут шляхом посилання на нього. Інший клас патоген-інактивуючих сполук, які можуть бути погашені за допомогою способів винаходу, включає згадані вище реакційноздатні групи, сполучені з групою, що зв'язує нуклеїнову кислоту, за допомогою гідролізованої ланки, описаний у патентному документі U.S. 6514987, зміст якого наводиться тут шляхом посилання на нього. Якірна ділянка патоген-інактивуючих сполук має спорідненість до нуклеїнових кислот. Ця спорідненість може бути зумовлена будь-яким із декількох способів нековалентного зв'язування з нуклеїновою кислотою, включаючи, але цим не обмежуючи, інтеркаляцію, зв'язування з малою борозенкою, зв'язування з великою борозенкою, і електростатичне зв'язування (наприклад, зв'язування з фосфатним остовом). Спорідненість може бути також зумовлена змішаними способами зв'язування (наприклад, інтеркаляцією і зв'язуванням із малою борозенкою). Зв'язування може бути послідовно-специфічним (тобто, підвищена спорідненість до зв'язування для однієї або більш конкретних послідовностей нуклеїнових кислот у порівнянні з іншими послідовностями нуклеїнових кислот) або не є послідовно-специфічним. Детальні приклади таких фрагментів, що зв'язують нуклеїнову кислоту, можуть бути знайдені в згаданих вище патентних документах. У деяких варіантах здійснення кожного з описаних тут способів, композицій і наборів, патоген-інактивуючі сполуки можуть включати функціональну групу, яка є або яка утворює реакційноздатну електрофільну групу, яка може реагувати з нуклеофілом вибраного гасника. У деяких варіантах здійснення, патоген-інактивуюча група включає ліганд, що зв'язує нуклеїнову кислоту, і функціональну групу, яка є або яка утворює електрофільну групу. Конкретним прикладом відповідного патоген-інактивуючої сполуки для використання в даному винаході є β-аланін, N-(акридин-9-іл), 2-[біс(2-хлоретил)аміно]етиловий ефір (який також 8 UA 102252 C2 тут інакше називають як "S-303"), структура якого наведена нижче, включаючи його солі. 5 10 15 20 25 30 35 40 45 50 У деяких варіантах здійснення, концентрація патоген-інактивуючої сполуки, такої як S-303, у суміші з композицією еритроцитів і гасником знаходиться в інтервалі приблизно від 0,05 мM до 4 мM, приблизно від 0,05 мM до 2 мM, приблизно від 0,05 мМ до 0,5 мМ, приблизно від 0,1 мМ до 0,3 мМ, або близько 0,2 мМ. У деяких варіантах здійснення, мольне співвідношення гасника до патоген-інактивуючої сполуки у разі змішування обох компонентів із композицією еритроцитів складає приблизно від 10:1 до 400:1, також приблизно від 10:1 до 200:1, також приблизно від 20:1 до 200:1, також приблизно від 50:1 до 200:1, також близько 100:1. Гасники Гасники для використання в способах даного винаходу призначені для зниження ступеня протікання небажаних побічних реакцій реакційноздатних електрофільних сполук, що використовуються для інактивації патогенів (наприклад, зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів, яке може призводити до небажаної імунної реакції у відповідь). У будь-якому з описаних тут варіантів здійснення, гасник (наприклад, описаний тут глутатіон) може бути присутнім в ефективній кількості (наприклад, ефективній кількості для зниження ступеня протікання небажаних побічних реакцій, такій як описані тут кількості). Придатні гасники включають нуклеофільну групу, яка здатна реагувати з електрофільною групою патоген-інактивуючої сполуки. Необмежуючі приклади детально описані в патентному документі U.S. 6709810, зміст якого наводиться тут шляхом посилання на нього. У деяких варіантах здійснення, гасники здатні значно знижувати ступінь протікання небажаних побічних реакцій у композиції еритроцитів, дозволяючи при цьому патоген-інактивуючій сполуці в достатньому ступені інактивувати патоген, яким може бути контамінована композиція еритроцитів. У деяких варіантах здійснення, у вдосконалених способах даного винаходу використовують ефективну кількість гасника в комбінації з ефективною кількістю патогенінактивуючої сполуки за умов, які забезпечують оптимальне зниження ступеня протіканнянебажаних побічних реакцій (наприклад, зв'язування патоген-інактивуючої сполуки) у поєднанні з достатньою інактивацією патогенів без значної зміни (наприклад, без зниження) осмотичної резистентності клітини і без значної зміни (наприклад, без підвищення) ступеня дегідратації. Може бути знижений ступінь протікання цілого ряду небажаних побічних реакцій, таких як реакція патоген-інактивуючої сполуки з білками і/або компонентами еритроцитів. У деяких варіантах здійснення, гасник забезпечує оптимальне зниження ступеня зміни еритроцитів, такої як зв'язування IgG з еритроцитами або зв'язування патоген-інактивуючої сполуки з еритроцитами. Незважаючи на те, що способи винаходу включають обробку композиції еритроцитів ex vivo, деякі гасники можуть залишатися в композиції при введенні людині. У зв'язку з цим, у деяких варіантах здійснення, гасники винаходу є придатними для інфузії. Придатні гасники включають, але цим не обмежуючи, сполуки, що включають тіольну групу, такі як гасники, що включають амінокислоту цистеїн або придатне похідне цистеїну, таке як Nацетилцистеїн. Приклади таких гасників включають цистеїн і пептиди, що включають, принаймні, один цистеїн, такий як глутатіон. У деяких варіантах здійснення, придатні гасники включають похідне цистеїну, яке може утворювати тіольну групу in situ із використанням або без використання додаткових хімічних реагентів або ферментів, що додаються, таких як Sацетилцистеїн або інші придатні одержані з тіолу проліків цистеїну, або пептидів, що включають S-ацетилцистеїн або інші придатні одержані з тіолу проліків цистеїну. Придатними похідними цистеїну є ті похідні, які приємно включають, або здатні утворювати in situ, цистеїнілтіол, який здатний реагувати з електрофільною групою патоген-інактивуючої сполуки. У деяких варіантах здійснення, гасником є пептид, що містить від 2 до 10 амінокислот, де, принаймні, однією з амінокислот є цистеїн, N-ацетилцистеїн, S-ацетилцистеїн, або інша придатна похідна цистеїну. У деяких варіантах здійснення, гасником є пептид, що містить, принаймні, 3 амінокислоти, наприклад, приблизно 3-10 амінокислот, наприклад, приблизно 3-6 9 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислот, де, принаймні, однією з амінокислот є цистеїн, N-ацетилцистеїн, S-ацетилцистеїн або інше придатне похідне цистеїну. У деяких варіантах здійснення, гасником є пептид, що містить, принаймні, 3 амінокислоти, наприклад, приблизно 3-10 амінокислот, наприклад, приблизно 3-6 амінокислот, де, принаймні, однією з амінокислот є цистеїн, N-ацетилцистеїн, Sацетилцистеїн або інше придатне похідне цистеїну, і також де, принаймні, 2 або, принаймні, 3 з амінокислот є цистеїном, N-ацетилцистеїном, S-ацетилцистеїном або іншим придатним похідним цистеїну. У переважному варіанті здійснення, гасником є нейтралізований глутатіон (також відомий як L-глутатіон і γ-L-глутаміл-L-цистеїніл-гліцин). Глутатіон має багато властивостей, які роблять його особливо придатним у ролі гасника. Він звичайно присутній у всіх типах клітин. Мабуть, він не здатний пасивно проникати в патоген, наприклад, шляхом проходження через клітинні мембрани або ліпідні плівки бактерій і вірусів у ліпідній оболонці, або шляхом проходження через вірусну капсулу вірусів без ліпідної оболонки. При приблизно нейтральному значенні pH, глутатіон несе на собі заряд і за відсутності активного транспорту не проникає через ліпідні бішари в будь-якому помітному ступені. Це підтверджується у разі інактивації вірусів в ліпідній оболонці, таких як ВІЛ і вірус везикулярного стоматиту, на які глутатіон не чинить істотної дії, включаючи використання концентрацій нейтралізованого глутатіону більші, ніж 2 мМ. Застосування глутатіону дійсно дає деякий ефект при інактивації, наприклад, Yersinia enterocolitica (ієрсинії ентероколітики), Staphylococcus epidermidis (епідермальних стафілококів) і Serratia marcescens (сератії). Однак це може досягатися тільки шляхом використання ефективних кількостей нейтралізованого глутатіону і патоген-інактивуючої сполуки. Внаслідок цього, пропонуються переважні способи гасіння, при яких контамінація композиції еритроцитів вірусним або бактеріальним патогеном інактивується, принаймні, на 2 log, переважно, принаймні, на 3 log. У деяких варіантах здійснення, Staphylococcus epidermidis (епідермальні стафілококи) можуть бути інактивовані, принаймні, на 3 log, також приблизно на 4 log, або приблизно на 5 log, і вірус везикулярного стоматиту може бути інактивований, принаймні, на 4 log, також приблизно на 5 log, або приблизно на 6 log. У деяких варіантах здійснення, інактивація Staphylococcus epidermidis (епідермальних стафілококів) за допомогою S-303 складає близько 3 log, також близько 2 log, або близько 1 log, що аналогічно до композиції, інактивованої за допомогою 2 мМ кислого глутатіону і 0,2 мМ S-303. У деяких варіантах здійснення, інактивація везикулярного стоматиту за допомогою S-303 складає близько 2 log, або близько 1 log, або є практично ідентичною інактивації аналогічної композиції, інактивованої за допомогою 2 мМ кислого глутатіону і 0,2 мМ S-303. За відповідних умов, описаних у даному винаході, глутатіон також є придатним для зберігання еритроцитів in vitro, і одержана композиція еритроцитів є придатною для введення in vivo. У деяких варіантах здійснення, гасником є глутатіон в його відновленій формі. Може також бути використаний глутатіондисульфід, окислена форма глутатіону, за умови, що в достатньому ступені відбувається відновлення глутатіондисульфіду в розчині перед додаванням розчину в суміш, що включає композицію еритроцитів, або в достатньому ступені відбувається відновлення глутатіондисульфіду після додавання до суміші, що включає композицію еритроцитів. У деяких варіантах здійснення, гасником є похідне глутатіону, таке як моноалкіловий ефір або діалкіловий ефір глутатіону, де алкильною групою є лінійна або розгалужена група, що має від 1 до 10 вуглецевих атомів. Конкретні приклади алкільних груп включають, але цим не обмежуючи, метильну групу, етильну групу, пропільну групу, ізопропільну групу, бутильну групу, ізобутильну групу, третбутильну групу, пентильну групу, ізопентильну групу, неопентильну групу, третпентильну групу, 1-метилбутильну групу, гексильну групу, ізогексильну групу, 2метилпентильну групу, 1-етилбутильну групу, гептильну групу, октильну групу, нонільну групу, ідецильну групу. Наприклад, необмежуючі приклади похідних глутатіону включають метиловий ефір глутатіону, моноетиловий ефір глутатіону, і моноізопропіловий ефір глутатіону. У деяких варіантах здійснення, використовують окислений діетиловий ефір глутатіону (GSSG-(гліцил)діетил-ефір). У деяких варіантах здійснення, тіоефір глутатіону після додавання до композиції еритроцитів піддають гідролізу з утворенням тіолу. Потрібно мати на увазі, що в деяких варіантах здійснення, гасник може застосовуватися у формі вільної кислоти або основи, у той час як в інших варіантах здійснення, гасник може застосовуватися у формі солі. Якщо гасник знаходиться у формі солі, переважно, щоб сіллю була фармацевтично прийнятна сіль. Фармацевтично прийнятні солі сполук (у формі водорозчинних, маслорозчинних або диспергованих продуктів) включають звичайні нетоксичні солі або солі четвертинного амонію, які утворюються, наприклад, із неорганічних або органічних кислот або основ. Приклади таких солей приєднання кислоти включають ацетат, адипат, 10 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, лактат, малеат, метансульфонат, 2нафталінсульфонат, нікотинат, оксалат, памоат, пектинат, персульфат, 3-фенілпропіонат, фосфат, пікрат, півалат, пропіонат, сукцинат, тартрат, тіоціанат, тозилат і ундеканоат. Солі основи включають солі амонію, солі лужних металів, такі як солі натрію і калію, солі лужноземельних металів, такі як солі кальцію і магнію, солі з органічними основами, такі як солі дициклогексиламіну, N-метил-D-глюкаміну, і солі з амінокислотами, такими як аргінін, лізин і так далі. Крім того, основні азотовмісні групи можуть кватернізовані за допомогою таких реагентів як нижчі алкілгалогеніди, такі як метил-, етил-, пропіл- і бутилхлорид; броміди і йодиди; діалкілсульфати, такі як диметил, діетил, дибутил і діамілсульфати, довголанцюгові галогеніди, такі як децил-, лаурил-, міристил- і стеарилхлориди, броміди і йодиди, аралкілгалогеніди, такі як бензил- і фенетилброміди та інші. Інші фармацевтично прийнятні солі включають сульфатну сіль етанолату і сульфатні солі. Наприклад, у деяких варіантах здійснення, гасник знаходиться у формі фармацевтично прийнятної солі, утвореній із глутатіону. У деяких варіантах здійснення, гасник знаходиться у формі фармацевтично прийнятної солі, утвореної з глутатіону і одного або більше катіонів, таких як натрій, алюміній, кальцій, літій, магній, цинк або тетраметиламоній. У деяких варіантах здійснення, гасником є глутатіон (відновлений), і його вводять у формі мононатрієвої солі глутатіону (що випускається, наприклад, фірмою Biomedica Foscama, Italy). У деяких інших варіантах здійснення, глутатіон (відновлений) вводять у формі гідрохлоридної солі глутатіону. У деяких інших варіантах здійснення, глутатіон вводять у формі динатрієвої солі глутатіону (відновленого). У додаткових варіантах здійснення, використовують сульфат моноалкілового ефіру глутатіону. У деяких варіантах здійснення, глутатіон вводять у формі динатрієвої солі окисленого глутатіону. Способи інактивації і гасіння Способи даного винаходу включають комбінацію композиції еритроцитів із патогенінактивуючою сполукою і гасником за умов, коли при змішуванні композиції з патогенінактивуючою сполукою і гасником величина pH одержаної композиції знаходиться у придатній області для забезпечення придатної патогенної інактивації і зменшення ступеня протікання небажаних побічних реакцій (таких як зміна еритроцитів) при обмеженому впливі або при відсутності впливу на життєздатність (наприклад, на осмотичну резистентність і дегідратацію) і/або на термін використання продукту крові, підданого обробці. Крім того, даний винахід описує зниження концентрації гасника в композиції еритроцитів після проведення патогенної інактивації для збереження життєздатності і терміну використання еритроцитів під час їхнього зберігання. Описаний тут додатковий розчин також може бути застосований до еритроцитів під час їх зберігання, і він може бути використаний для заміни розчинів для обробки і/або розчинів для розведення, що застосовується у час патогенної інактивації. Вдосконалені способи включають декілька характерних рис, які можуть бути важливими при гасінні. Першою характерною рисою є тіольна група або інша придатна нуклеофільна група. Другою характерною рисою є коректування величини pH розчину. Можна забезпечити певний рівень гасіння просто шляхом коректування величини pH розчину. Внаслідок цього, гасники винаходу забезпечують композиції, що включають еритроцити, деяку буферну місткість, де буферна місткість сама по собі забезпечує поліпшене гасіння. Наприклад, використання аналога цистеїну, такого як метіонін, у ролі гасника, при його придатній модифікації для забезпечення придатної зміни величини pH в композиції еритроцитів, може призводити до певного рівня гасіння зв'язування патоген-інактивуючої сполуки з еритроцитами. Оскільки атом сірки в метіоніні не є нуклеофільним, метіонін не забезпечує ніякого гасіння, крім як забезпечення необхідної величини pH розчину. Таким чином, комбінація коректування pH і тіольної групи забезпечує поліпшене гасіння. Ретельне коректування величини pH і еквівалентна кількість основи може також знизити ступінь дегідратації еритроцитів у процесі інактивації. Третьою характерною рисою, яка може бути важливою для досягнення поліпшеного гасіння в деяких варіантах здійснення, є вибір переважних гасників, які практично не проникають всередину патогенів, таких як віруси і бактерії. Такі гасники забезпечують достатнє гасіння у позаклітинному середовищі, де відбуваються реакції, що шкідливо впливають, такі як зв'язування з поверхнями еритроцитів, але без додаткового гасіння патоген-інактивуючої сполуки, після того як вона проникла всередину патогену. І нарешті, вдосконалені способи гасіння даного винаходу включають зниження концентрації гасника після інактивації і, у ряді випадків, додавання додаткового розчину для зберігання. Було показано, що еритроцити мають 11 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 підвищений термін використання і знижені ступені дегідратації під час зберігання при зниженні загальної концентрації гасника до відповідних меж. В одному аспекті, даний винахід пропонує спосіб обробки композиції еритроцитів, що включає: a) наявність i) патоген-інактивуючої сполуки, що включає функціональну групу, яка є реакційноздатною електрофільною групою, або яка утворює реакційноздатну електрофільну групу (наприклад, ефективної кількості патоген-інактивуючої сполуки для інактивації патогену, у випадку, якщо він присутній), ii) гасника (наприклад, ефективної кількості описаного тут гасника), що включає тіольну групу, де тіол здатний реагувати з реакційноздатною електрофільною групою патоген-інактивуючої сполуки, і iii) композиції, що включає еритроцити; b) змішування патоген-інактивуючої сполуки і гасника з композицією, що включає еритроцити; і с) відповідне зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, відносно ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника. У деяких варіантах здійснення, стадія (a) додатково включає введення придатної основи, стадія (b) додатково включає змішування основи з композицією, що включає еритроцити, і основа присутня в достатній кількості для зниження ступеня протікання небажаної реакції патоген-інактивуючої сполуки з еритроцитами в суміші, стосовно суміші, що не містить основи. У деяких варіантах здійснення, небажаною реакцією патоген-інактивуючої сполуки з еритроцитами є зміна поверхні еритроцитів внаслідок впливу патоген-інактивуючої сполуки. У деяких варіантах здійснення, стадія (a) додатково включає введення придатної основи, стадія (b) додатково включає змішування основи з композицією, що включає еритроцити, і основа присутня в достатній кількості для зниження рівня зв'язування анти-патоген-інактивуючої сполуки з антитілом для підданої обробці композиції еритроцитів в одержаній суміші, принаймні, приблизно на 5 % (або, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 %, або, принаймні, приблизно на 90 %) стосовно суміші, що не містить основи. У деяких варіантах здійснення, терміни зберігання суміші складають величину більшу ніж, яка дорівнює або меншу ніж 7, 10, 14, 21, 28, 35 або 42 дні зберігання при 4 °C або при кімнатній температурі. У деяких варіантах здійснення, суміш зберігають у додатковому розчині (наприклад, у будь-якому додатковому розчині, описаному в таблиці 2, і/або в додатковому розчині, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, спосіб додатково включає заміну розчину, що використовується в процесі обробки, на додатковий розчин (наприклад, будь-який додатковий розчин, описаний у таблиці 2, і/або додатковий розчин, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У додатковому аспекті, винахід пропонує спосіб зниження дегідратації еритроцитів, що включає: a) одержання композиції еритроцитів, що включає i) гасник, де гасник здатний реагувати з патоген-інактивуючою сполукою, і ii) еритроцити; і b) відповідне зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, стосовно ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника. У деяких варіантах здійснення, терміни зберігання суміші складають величину більшу ніж, яка дорівнює або меншу ніж 7, 10, 14, 21, 28, 35 або 42 дні зберігання при 4 °C або при кімнатній температурі. У деяких варіантах здійснення, спосіб додатково включає додавання додаткового розчину (наприклад, будь-якого додаткового розчину, описаного в таблиці 2, і/або додаткового розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт), наприклад, перед зберіганням. Гасник і/або додавана основа (або нейтралізований гасник), що використовується в описаних тут способах, може бути змішаний із композицією еритроцитів перед додаванням патоген-інактивуючої сполуки до композиції еритроцитів, у той же самий час, або після додавання патоген-інактивуючої сполуки до композиції еритроцитів. Якщо гасник і основу (або нейтралізований гасник) змішують із композицією еритроцитів після того, як патогенінактивуючий розчин змішують із композицією еритроцитів, то переважно, щоб гасник і/або основу (або нейтралізований гасник) додавали до композиції еритроцитів перед тим, як відбудеться більша частина побічної реакції патоген-інактивуючої сполуки з еритроцитами, внаслідок чого може бути досягнуте відповідне гасіння небажаної побічної реакції. У деяких варіантах здійснення, гасник і/або основу (або нейтралізований гасник) змішують із композицією еритроцитів приблизно через одну годину, приблизно через 30 хвилин, приблизно через 20 хвилин, приблизно через 10 хвилин, приблизно через 5 хвилин, приблизно через 2 хвилини, або приблизно через 1 хвилину після змішування патоген-інактивуючої сполуки з композицією еритроцитів. У деяких варіантах здійснення, гасник і основу змішують із композицією еритроцитів одночасно з патоген-інактивуючою сполукою. 12 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення кожного з описаних тут способів, гасник і основу (або нейтралізований гасник), що додається попередньо обробляють за допомогою композиції еритроцитів протягом придатного часу перед додаванням патоген-інактивуючої сполуки (наприклад, S-303), наприклад, приблизно менше ніж одна година, приблизно менше ніж 30 хвилин, приблизно менше ніж 20 хвилин, приблизно менше ніж 10 хвилин, приблизно менше ніж 5 хвилин, приблизно менше ніж 2 хвилини, або приблизно менше ніж 1 хвилина, до змішування патоген-інактивуючої сполуки з композицією еритроцитів. У деяких додаткових варіантах здійснення, попередню обробку проводять при температурі приблизно від 1 °C до 30 °C, також приблизно від 18 °C до 25 °C, або близько 37 °C, або близько кімнатної температури. У деяких варіантах здійснення кожного з описаних тут способів, патоген-інактивуючу сполуку (наприклад, S-303) інкубують із композицією еритроцитів в присутності гасника і додаваної основи (або нейтралізованого гасника) протягом придатного часу, наприклад, протягом приблизно від 30 хвилин до 48 годин, також приблизно від 2 до 36 годин, також приблизно від 8 до 24 годин, також близько 20 годин. У деяких додаткових варіантах здійснення, інкубування проводять в інтервалі температур приблизно від 1 °C до 30 °C, також приблизно від 18 °C до 25 °C, або близько 37 °C, або близько кімнатної температури. Що стосується характерної риси, пов'язаної з коректуванням величини pH композиції еритроцитів, то в раніше відомих способах гасіння таких патоген-інактивуючих сполук не надавали значення важливості придатної величини рН одержаної суміші, як з точки зору ефективності гасіння, так і з точки зору життєздатності клітин в процесі інактивації. Незважаючи на те, що в раніше відомих способах була показана необхідність у достатній кількості основи і придатному значенні pH для відповідного гасіння небажаних побічних реакцій патогенінактивуючої сполуки (наприклад, шляхом підвищення вмістів непротонованого глутатіону для зниження зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів), у цих способах не було виявлено і не був описаний вплив підвищеної кількості основи на дегідратацію клітин у процесі інактивації. Таким чином, один аспект даного винаходу включає коректування величини pH композиції еритроцитів до придатного значення для інкубування патоген-інактивуючої сполуки і гасника (наприклад, відповідного значення, при якому виключається шкідливий вплив на дегідратацію). У деяких варіантах здійснення, при змішуванні патоген-інактивуючих сполук і гасника з композицією еритроцитів встановлюють до відповідного значення pH суміші, при якому знижується ступінь протікання небажаних побічних реакцій патоген-інактивуючої сполуки (наприклад, зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів, яке може призводити до небажаної імунної реакції у відповідь) і достатньо знижується ступінь дегідратації клітин у процесі інактивації. У деяких варіантах здійснення, небажаною побічною реакцією є зміна поверхні еритроцитів внаслідок впливу патоген-інактивуючої сполуки. У деяких варіантах здійснення, зміною є ковалентне зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів. В інших варіантах здійснення, зміною є нековалентне зв'язування патогенінактивуючої сполуки з поверхнею еритроцитів. Як вже тут було описано, в деяких варіантах здійснення кожного зі способів, знижується ступінь протікання небажаної (що також тут називають "несприятливої") побічної реакції патоген-інактивуючої сполуки з еритроцитами. У деяких варіантах здійснення, небажаною побічною реакцією, ступінь протікання якої знижують, є зміна поверхні еритроцитів внаслідок впливу патоген-інактивуючої сполуки. У деяких варіантах здійснення, ступінь протікання побічної реакції знижують, принаймні, приблизно на 5 %, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 %, або, принаймні, приблизно на 90 %. Зниження ступеня протікання побічної реакції може бути підтверджене, наприклад, шляхом вимірювання кількості зв'язування антитіл із підданими обробці еритроцитами, які є специфічними до патоген-інактивуючої сполуки, і/або шляхом визначення терміну використання підданих обробці еритроцитів in vivo, і порівняння цих даних із даними для еритроцитів, підданих обробці другим способом, що відрізняється (наприклад, способом без достатньої кількості гасника і/або додаваної основи до реакційної суміші, способом, в якому не додається гасник і/або основа до реакційної суміші, і/або обробки при більш низькому значенні pH). Наприклад, у деяких варіантах здійснення описаних тут способів, ступінь зв'язування анти-патоген-інактивуючої сполуки з антитілом для підданих обробці еритроцитів знижується, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 %, або, принаймні, приблизно на 90 %, стосовно другого способу (наприклад, способу без достатньої кількості гасника і/або додаваної основи до реакційної суміші, способу, в якому не додається гасник і/або основа до реакційної суміші, і/або обробки при більш низькому значенні pH). 13 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення, при змішуванні патоген-інактивуючої сполуки і гасника з композицією еритроцитів, величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,1, приблизно від 6,5 до 7,0, приблизно від 6,6 до 6,8 або близько 6,6, 6,7, 6,8 або 6,9. Хоча величина pH композиції еритроцитів може і змінюватися у часі, бажано, щоб величина pH знаходилася в необхідному інтервалі при додаванні гасника до композиції еритроцитів, незалежно від того, містить вона вже або не містить патоген-інактивуючу сполуку. Способи даного винаходу включають додавання патогенінактивуючої сполуки і гасника до композиції еритроцитів. Підтримка необхідного інтервалу значень pH є необхідною при додаванні як патоген-інактивуючої сполуки, так і гасника, незалежно від порядку додавання патоген-інактивуючої сполуки і/або гасника до композиції еритроцитів. Іншими словами, як тільки всі три компоненти змішані, значення pH повинно знаходитися в необхідному інтервалі. У деяких варіантах здійснення, гасник додають раніше, ніж патоген-інактивуючу сполуку. У деяких варіантах здійснення, патоген-інактивуючу сполуку додають раніше, ніж гасник. У деяких варіантах здійснення, гасник і патоген-інактивуючу сполуку додають практично одночасно. Таким чином, після додавання патоген-інактивуючої сполуки і гасника досягається момент, коли і гасник, і патоген-інактивуюча сполука змішані з композицією еритроцитів. Необхідне значення pH може бути одержане різними способами, і немає обмежень на те, яким способом здійснюється коректування величини pH композиції еритроцитів, або в деяких варіантах здійснення, величину рН істотно не змінюють від природного значення pH продукту крові. Наприклад, необхідне значення pH композиції еритроцитів може бути досягнуте шляхом коректування величини pH. Коректування величини pH може бути здійснене, наприклад, шляхом додавання відповідного додаткового розчину, такого як буферний розчин, перед додаванням патоген-інактивуючої сполуки і гасника. У деяких варіантах здійснення, композиція еритроцитів може бути промита один або більше разів за допомогою придатного буфера перед суспендуванням в ньому або іншому придатному буфері. Як варіант, величина pH композиції еритроцитів може бути скоректована одночасно з додаванням або патоген-інактивуючої сполуки, або гасника, або їх обох. У деяких варіантах здійснення, величину pH коректують одночасно з додаванням гасника. У деяких варіантах здійснення, гасник нейтралізують, так що додавання нейтралізованого гасника забезпечує необхідний інтервал значень pH у композиції еритроцитів. Як приклад, нейтралізація глутатіону може бути використана для здійснення необхідних коректувань величини pH. У деяких варіантах здійснення, може бути використана відповідний ступінь нейтралізації глутатіону, наприклад, шляхом додавання 1 еквівалента основи, для одержання гасника, який при додаванні до композиції еритроцитів буде забезпечувати необхідне коректування величини pH композиції. Відповідна нейтралізація буде залежати від гасника, що використовується. Наприклад, коли використовують пептид, вона може залежати від компонентів амінокислот пептиду. У деяких варіантах здійснення, може бути використаний гасник, який практично не впливає на величину pH композиції еритроцитів. Наприклад, використання пептиду, що включає цистеїн, який може додатково включати одну або більше амінокислот, дає в результаті більш нейтральне значення pH для розчину виділеного природного пептиду. У деяких варіантах здійснення, пептид додатково включає, принаймні, одну основну амінокислоту, таку як аргінін або лізин. У деяких варіантах здійснення описаних тут способів, де основу змішують із композицією еритроцитів разом із патоген-інактивуючою сполукою і гасником для збільшення pH суміші до бажаного значення і/або для поліпшення гасіння небажаних побічних реакцій, основою є основна сіль. Основна сіль може спочатку бути розчинена у водному розчині перед змішуванням з композицією еритроцитів. В інших варіантах здійснення, сіль може бути додана безпосередньо в композицію еритроцитів у твердому вигляді. У деяких варіантах здійснення, основна сіль включає гасник і в результаті забезпечує дію, як гасника, так і основи для суміші. У деяких варіантах здійснення, основою, що використовується в способі є сильна основа, така як NaOH. Звичайно, сильну основу, таку як NaOH, спочатку розчиняють у водному розчині перед змішуванням із композицією еритроцитів. У деяких варіантах здійснення, сильну основу (наприклад, у розчині або в твердому вигляді) змішують із гасником перед змішуванням із композицією еритроцитів. У деяких варіантах здійснення, основою є лужною буфер (що додається в достатніх кількостях і що має прийнятне значення pKa, для того щоб встановити в суміші необхідний інтервал значень pH). Якщо використовують лужний буфер, у деяких варіантах здійснення, буфером буде бути фармацевтично прийнятний буфер. У деяких варіантах здійснення, буфер буде мати титрований протон зі значенням pKa в інтервалі приблизно від 7 до 8. Приклади буферів, які можуть бути використані як лужні буфери, включають, але цим не обмежуючи, N-(2-гідроксіетил)піперазин-N-2-етансульфонову кислоту 14 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 (HEPES), забуферений фосфатом фізіологічний розчин (PBS), і буфер із фосфату натрію. Інші придатні лужні буфери можуть бути легко вибрані будь-яким фахівцем у цій галузі. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, величина pH суміші еритроцитів, гасника, патоген-інактивуючої сполуки, і будь-якої доданої основи складає величину приблизно більшу, ніж 5,5, приблизно більшу, ніж 5,7, приблизно більшу, ніж 6,0, приблизно більшу, ніж 6,3, приблизно більшу, ніж 6,5, приблизно більшу, ніж 6,7, приблизно більшу, ніж 7,0, або приблизно більшу ніж 7,2. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, величина pH суміші еритроцитів, гасника, патоген-інактивуючої сполуки, і основи (якщо його додають) знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,1, приблизно від 6,5 до 7,0 або приблизно від 6,6 до 6,8, або близько 6,6, 6,7, 6,8 або 6,9. У деяких варіантах здійснення, зазначене значення pH є значенням pH при кімнатній температурі. У деяких варіантах здійснення, зазначене значення pH є значенням pH при 37 °C. Наприклад, у деяких варіантах здійснення композицію, що включає еритроцити, піддають обробці за допомогою патоген-інактивуючої сполуки в присутності гасника і будь-якої додаваної основи де величина pH суміші знаходиться в інтервалі приблизно від 6,5 до 7,0 (або 7,1) при 37 °C. У деяких варіантах здійснення, величина pH суміші еритроцитів, гасника та основи (якщо додавання основи є частиною способу) знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,1, приблизно від 6,5 до 7,0 або приблизно від 6,6 до 6,8, або близько 6,5, 6,7, 6,8 або 6,9, перед змішуванням патоген-інактивуючої сполуки з композицією еритроцитів. У деяких інших варіантах здійснення, величину pH коректують під час змішування патоген-інактивуючої сполуки з композицією, що містить еритроцити, або приблизно через 1 годину, приблизно через 30 хвилин, приблизно через 20 хвилин, приблизно через 10 хвилин, приблизно через 5 хвилин, або приблизно через 2 хвилини після змішування патогенінактивуючої сполуки з композицією, що містить еритроцити. У деяких варіантах здійснення цих способів, в яких коректують величину pH, величину pH коректують до бажаного інтервалу значень перед змішуванням патоген-інактивуючої сполуки з композицією, що містить еритроцити, одночасно зі змішуванням патоген-інактивуючої сполуки з композицією, що містить еритроцити, приблизно через 1 годину, приблизно через 30 хвилин, приблизно через 20 хвилин, приблизно через 10 хвилин, приблизно через 5 хвилин, або приблизно через 2 хвилини після змішування патоген-інактивуючої сполуки з композицією, що містить еритроцити. У тих варіантах здійснення, в яких гасником є глутатіон, патоген-інактивуючою сполукою є S-303, переважно, щоб величина pH суміші, що включає композицію еритроцитів і гасник, коректували до необхідного інтервалу pH (наприклад, від pH 6,5 до 7,0) перед змішуванням S-303 із композицією еритроцитів. У деяких варіантах здійснення, одержана після змішування еритроцитів, гасника та основи величина pH композиції не потребує коректування величини pH початкової композиції еритроцитів. Наприклад, композиція еритроцитів може мати величину pH у необхідному інтервалі 6,0-7,5, і величинаpH композиції істотно не змінюється при додаванні гасника і потім патоген-інактивуючої сполуки. У таких варіантах здійснення, гасник або природним чином забезпечує необхідне значення pH, або його нейтралізують для забезпечення необхідного значення pH. Це є комбінацією додавання високих початкових кількостей гасника, таких як, приблизно від 5 мМ до 40 мМ, з одержаною величиною pH у необхідному інтервалі, яка є важливою. У відомих способах, не застосовували таких концентрацій глутатіону, наприклад, із необхідним інтервалом значення pH в поєднанні з іншими аспектами даного винаходу. Таким чином, у разі пептидів, незалежно від пептидного гасника, за необхідності він може бути ефективно нейтралізований для забезпечення придатного інтервалу значень pH при додаванні до композиції еритроцитів, і крім того він може бути вибраний для забезпечення придатної кількості буферної дії в необхідному інтервалі значень pH. Внаслідок цього, нейтралізований гасник означає, що за необхідності гасник відповідним чином був відтитрований за допомогою кислоти або основи, так що при додаванні до композиції еритроцитів, одержана суміш має величину pH, при якому забезпечується більш ефективне гасіння протікання небажаних побічних реакцій (наприклад, зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів, яке може призводити до небажаної імунної реакції у відповідь) при запобіганні дегідратації клітинам в процесі інактивації, наприклад, величину pH в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,0, приблизно від 6,5 до 7,1, приблизно від 6,6 до 6,8 або близько 6,6, 6,7, 6,8 або 6,9. У деяких варіантах здійснення, виділений природним чином пептид є у придатному ступені нейтралізованим, тобто він не вимагає додавання кислоти або основи для забезпечення необхідного значення pH в кінцевій суміші. Крім того, переважні гасники будуть забезпечувати буферну місткість для підтримки 15 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 значення pH в необхідному інтервалі протягом часу, необхідного для гасіння протікання небажаних побічних реакцій. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, гасник є нейтралізованим. Гасник називають "нейтралізованим" за допомогою основи, якщо достатня кількість основи була об'єднана з гасником, внаслідок чого в суміші, що включає композицію, яка містить еритроцити, патоген-інактивуючу сполуку і гасник, поліпшується гасіння протікання небажаної побічної реакції між патоген-інактивуючою сполукою та еритроцитами. "Нейтралізований гасник" не повинен обов'язково мати нейтральне значення pH, і не повинен бути обов'язково незарядженим. У деяких варіантах здійснення, нейтралізований гасник знаходиться ні в його найбільш протонованій формі, ні в його найбільш депротонованій формі. У деяких варіантах здійснення, коли гасник є дуже кислим, величина pH нейтралізованого гасника може бути все ж нижчою, ніж 7,0 (наприклад, близько 6,6, 6,7, 6,8 або 6,9). У деяких варіантах здійснення, величина pH розчину нейтралізованого гасника може бути більшою ніж 7,0. У деяких варіантах здійснення, величина pH розчину нейтралізованого гасника буде помітно вищою, ніж величина рН гасника перед додаванням основи. У деяких варіантах здійснення, гасник нейтралізують за допомогою, принаймні, приблизно 0,25 еквівалентів, принаймні, приблизно 0,5 еквівалентів, принаймні, приблизно 0,75 еквівалентів, принаймні, приблизно 1 еквіваленти, принаймні, приблизно 1,25 еквівалентів, принаймні, приблизно 1,5 еквівалентів, або, принаймні, приблизно 2 еквівалентів основи. У деяких варіантах здійснення, гасник нейтралізують за допомогою приблизно менше ніж 2 еквівалентів, приблизно менше ніж 1,5 еквівалентів, приблизно менше ніж 1,25 еквівалентів, приблизно менше ніж 1 еквіваленти, або приблизно менше ніж 0,75 еквівалентів основи. У деяких варіантах здійснення, гасник нейтралізують за допомогою приблизно від 0,25 до 2 еквівалентів, приблизно від 0,5 до 1,5 еквівалентів, або приблизно від 0,75 до 1,25 еквівалентів основи. У деяких варіантах здійснення, гасник нейтралізують за допомогою близько 0,75 еквівалентів основи. В інших варіантах здійснення, гасник нейтралізують за допомогою близько 1 еквівалента основи. В інших варіантах здійснення, гасник нейтралізують за допомогою близько 1,25 еквівалентів основи. Наприклад, у деяких варіантах здійснення винаходу, глутатіон нейтралізують за допомогою близько 1 еквівалента придатної основи, такої як гідроксид натрію. У цьому випадку, розчин протонованого глутатіону має величину pH близько 3, нейтралізований розчин за допомогою 1 еквівалента гідроксиду натрію має величину pH близько 4,5 і розчин, нейтралізований за допомогою 2 еквівалентів гідроксиду натрію, має величину pH близько 9,5. Будь-який відповідний пептидний гасник, що включає, принаймні, один цистеїн, може бути підданий відповідному коректуванню для забезпечення необхідного значення pH при додаванні до композиції еритроцитів. Придатні способи нейтралізації глутатіону та інші гасники є очевидними для звичайних фахівців у цій галузі. У деяких варіантах здійснення, для нейтралізації або часткової нейтралізації гасника використовують гідроксид натрію. У деяких варіантах здійснення, тверді гранули NaOH спочатку розчиняють у воді для одержання концентрованого розчину основи, наприклад, 1N, 5N, 10N або 20N розчину NaOH. У деяких варіантах здійснення, відповідну кількість такого розчину NaOH потім додають до гасника або перед додаванням гасника до суміші, або в той же самий час, або після додавання гасника до суміші. Як варіант, NaOH додають до композиції еритроцитів або патоген-інактивуючої сполуки, або до їх комбінації, перед додаванням гасника до суміші. У доповнення до одержання гасника, величина pH якого відповідно скоректована або який є нейтралізованим, у деяких варіантах здійснення, переважні гасники не здатні значно проникати в патогени, так що вони оптимально гасять небажані реакції у позаклітинному середовищі, але не перешкоджають патогенній інактивації, як тільки патоген-інактивуюча сполука проникла всередину патогену. У деяких варіантах здійснення кожного з описаних тут способів, гасником є кисла сполука. У деяких варіантах здійснення, гасник одержують у формі вільної кислоти. У деяких варіантах здійснення, гасник є кислим, і для нейтралізації гасника додають, принаймні, близько 1 еквівалента основи. Розчин, що включає такий нейтралізований гасник, може бути, у ряді випадків, лужним, нейтральним або навіть кислим. У деяких варіантах здійснення, для нейтралізації або часткової нейтралізації гасника додають близько 1 еквівалента основи. У деяких варіантах здійснення, додають близько 2 еквівалентів основи. У деяких варіантах здійснення, гасник є кислим і для нейтралізації гасника використовують приблизно від 0,5 до 1,5 еквівалентів основи. У деяких варіантах здійснення, використовують приблизно від 0,75 до 1,25 еквівалентів основи. У деяких варіантах здійснення, використовують близько 1 еквівалента основи. 16 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення, гасник нейтралізують перед додаванням до композиції еритроцитів і/або до патоген-інактивуючої сполуки. В інших варіантах здійснення, гасник нейтралізують після об'єднання гасника з композицією еритроцитів і/або патоген-інактивуючою сполукою. У деяких варіантах здійснення, величина pH нейтралізованого гасника перед додаванням до композиції еритроцитів і/або патоген-інактивуючої сполуки знаходиться в інтервалі приблизно від 2,5 до 7,5, приблизно від 3,0 до 6,5, приблизно від 3,5 до 5,5, приблизно від 4,0 до 5,0 або приблизно від 4,3 до 4,5 або близько 4,4. У деяких варіантах здійснення, гасником є глутатіон, і його одержують у формі мононатрієвої солі глутатіону, і його нейтралізують за допомогою близько 1 еквівалента основи або не нейтралізують за допомогою основи. У деяких інших варіантах здійснення, гасником є глутатіон, і його одержують у формі гідрохлоридної солі глутатіону і нейтралізують за допомогою приблизно 1 еквівалента основи. У деяких варіантах здійснення кожного з описаних тут способів, початкова концентрація гасника в суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку, і будь-яку додану основу, є підвищеною під час процесу інактивації, і потім знижується до зниженої концентрації після процесу інактивації. У деяких варіантах здійснення, початкова концентрація гасника є достатньою для зниження ступеня протікання небажаних побічних реакцій патоген-інактивуючої сполуки (наприклад, зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів), і потім її знижують до зниженої концентрації, достатньої для зниження негативного впливу на життєздатність (наприклад, осмотичну резистентність і дегідратацію) і/або на термін використання під час зберігання клітин. Винахід охоплює будь-яку кількість способів, що використовуються для зниження концентрації гасника після процесу патогенної інактивації. У деяких варіантах здійснення, концентрацію гасника (наприклад, глутатіону) знижують шляхом центрифугування суміші, що включає композицію еритроцитів, гасник і патоген-інактивуючу сполуку, із подальшим видаленням надосадової рідини суміші і потім додавання свіжого розчину, такого як додатковий розчин (наприклад, будь-який додатковий розчин, описаний у таблиці 2, і/або додатковий розчин, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт), для ресуспендування клітин (наприклад, за допомогою промивання клітин). Процес центрифугування, видалення надосадової рідини і додавання свіжого розчину (наприклад, будьякого додаткового розчину, описаного в таблиці 2, і/або додаткового розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт) може бути повторюваний, у деяких варіантах здійснення, ще 1, 2, 3, 4 або 5 або більше разів. У деяких варіантах здійснення, спосіб, що використовується для зниження концентрації гасника, є автоматизованим. У деяких варіантах здійснення, свіжий розчин не включає гасник або включає знижену концентрацію гасника. У деяких варіантах здійснення, концентрацію гасника (наприклад, глутатіону) знижують шляхом хімічної деактивації гасника. У деяких варіантах здійснення, концентрацію гасника (наприклад, глутатіону) знижують шляхом адсорбції в періодичному або безперервному процесі видалення або шляхом ексклюзивного розділення за розміром у безперервному процесі за допомогою мембран (наприклад, мембран із порожнистих волокон або мембран для діалізу), або гранул для ексклюзивного розділення за розміром. У деяких варіантах здійснення, кількість гасника не зменшують і/або він не контактує з пристроєм для адсорбції сполук (CAD). У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкова концентрація гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу складає приблизно більше ніж 2 мМ, приблизно більше ніж 4 мМ, приблизно більше ніж 6 мМ, приблизно більше ніж 8 мМ, приблизно більше ніж 10 мМ, приблизно більше ніж 15 мМ або приблизно більше ніж 20 мМ. У деяких варіантах здійснення, початкова концентрація гасника в суміші знаходиться в інтервалі приблизно від 2 мМ до 100 мМ, приблизно від 2 мМ до 40 мМ, приблизно від 4 мМ до 40 мМ, приблизно від 5 мМ до 40 мМ, приблизно від 5 мМ до 30 мМ, або приблизно від 10 мМ до 30 мМ, або до 2 мМ, 5 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ або 100 мМ. У деяких варіантах здійснення, початкова концентрація гасника в суміші складає близько 20 мМ. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкова концентрація гасника (наприклад, глутатіону) у суміші еритроцитів, гасника і патоген-інактивуючої сполуки складає приблизно більше ніж 2 мМ, приблизно більше ніж 4 мМ, приблизно більше ніж 6 мМ, приблизно більше ніж 8 мМ або приблизно більше ніж 10 мМ, і величина pH суміші складає приблизно більше ніж 5,5, приблизно більше ніж 5,7, приблизно більше ніж 6,0, приблизно більше ніж 6,3, приблизно більше ніж 6,5, приблизно 17 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше ніж 6,7, приблизно більше ніж 7,0 або приблизно більше ніж 7,2. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкова концентрація гасника в суміші знаходиться в інтервалі приблизно від 2 мМ до 40 мМ, приблизно від 4 мМ до 40 мМ, приблизно від 5 мМ до 40 мМ, приблизно від 5 мМ до 30 мМ або приблизно від 10 мМ до 30 мМ або близько 20 мМ, і величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,1, приблизно від 6,5 до 7,0 або приблизно від 6,6 до 6,8 або близько 6,6, 6,7, 6,8 або 6,9. У деяких варіантах здійснення, початкова концентрація гасника в суміші складає приблизно більше ніж 2 мМ, приблизно більше ніж 4 мМ, приблизно більше ніж 6 мМ, приблизно більше ніж 8 мМ або приблизно більше ніж 10 мМ, і величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,1, приблизно від 6,5 до 7,0 або приблизно від 6,6 до 6,8 або близько 6,6, 6,7, 6,8 або 6,9. У деяких варіантах здійснення, концентрація гасника (наприклад, глутатіону) у суміші знаходиться в інтервалі приблизно від 10 мМ до 30 мМ, і величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 7,5. У деяких варіантах здійснення, концентрація гасника (наприклад, глутатіону) у суміші знаходиться в інтервалі близько 20 мМ, і величина pH суміші знаходиться в інтервалі приблизно від 6,5 до 7,0 (або 7,1). У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкову концентрацію гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку основу, що додається після процесу інактивації знижують більш ніж у 2 рази або 3 рази, або 4 рази, або 5 разів, або 6 разів, або 7 разів, або 8 разів, або 9 разів, або 10 разів, або 15 разів, або 20 разів, або 25 разів, або 30 разів, або 35 разів, або 40 разів, або 50 разів, або 100 разів, або 500 разів, або 1000 разів стосовно початкової концентрації гасника (наприклад, глутатіону) у суміші. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, знижена концентрація гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу після процесу інактивації складає приблизно менше ніж 15 мМ, приблизно менше ніж 10 мМ, приблизно менше ніж 8 мМ, приблизно менше ніж 6 мМ, приблизно менше ніж 5 мМ, приблизно менше ніж 4 мМ, приблизно менше ніж 3 мМ, приблизно менше ніж 2 мМ, приблизно менше ніж 1 мМ, приблизно менше ніж 0,75 мМ, приблизно менше ніж 0,5 мМ або приблизно менше ніж 0,25 мМ. У деяких варіантах здійснення, знижена концентрація гасника в суміші після періоду інактивації знаходиться в інтервалі приблизно від 1 мМ до 20 мМ, приблизно від 2 мМ до 15 мМ, приблизно від 3 мМ до 10 мМ, приблизно від 4 мМ до 8 мМ, або приблизно від 5 мМ до 6 мМ. У деяких варіантах здійснення, знижена концентрація гасника в суміші після періоду інактивація складає приблизно до 0,25 мМ або 0,5 мМ, або 0,75 мМ, або 1 мМ, або 1,5 мМ, або 2 мМ, або 3 мМ, або 4 мМ, або 5 мМ, або 6 мМ, або 7 мМ, або 8 мМ, або 9 мМ, або 10 мМ, або 12,5 мМ, або 15 мМ, або 20 мМ. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкова концентрація гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу складає приблизно більше ніж 2 мМ, приблизно більше ніж 4 мМ, приблизно більше ніж 6 мМ, приблизно більше ніж 8 мМ або приблизно більше ніж 10 мМ, і знижена концентрація гасника в суміші після процесу інактивації складає приблизно менше ніж 15 мМ, приблизно менше ніж 10 мМ, приблизно менше ніж 8 мМ, приблизно менше ніж 6 мМ, приблизно менше ніж 5 мМ, приблизно менше ніж 4 мМ, приблизно менше ніж 3 мМ, приблизно менше ніж 2 мМ, приблизно менше ніж 1,5 мМ, приблизно менше ніж 1 мМ, приблизно менше ніж 0,75 мМ, приблизно менше ніж 0,5 мМ або приблизно менше ніж 0,25 мМ. У деяких варіантах здійснення, початкова концентрація гасника знаходиться в інтервалі приблизно від 2 мМ до 100 мМ, приблизно від 2 мМ до 40 мМ, приблизно від 4 мМ до 40 мМ, приблизно від 5 мМ до 40 мМ, приблизно від 5 мМ до 30 мМ, або приблизно від 10 мМ до 30 мМ або близько 20 мМ, і знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 1 мМ до 20 мМ, приблизно від 2 мМ до 15 мМ, приблизно від 3 мМ до 10 мМ, приблизно від 4 мМ до 8 мМ або приблизно від 5 мМ до 6 мМ. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) знаходиться в інтервалі приблизно від 10 мМ до 30 мМ, і знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 2 мМ до 15 мМ. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) складає близько 20 мМ, і знижена концентрація гасника в суміші після періоду інактивації знаходиться в інтервалі приблизно від 4 мМ до 8 мМ. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник (наприклад, глутатіон), патоген-інактивуючу 18 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуку і будь-яку додавану основу складає більше ніж 2 мМ, більше ніж приблизно 4 мМ, більше ніж приблизно 6 мМ, більше ніж приблизно 8 мМ або більше ніж приблизно 10 мМ; величина pH суміші складає більше ніж приблизно 5,5, більше ніж приблизно 5,7, більше ніж приблизно 6,0, більше ніж приблизно 6,3, більше ніж приблизно 6,5, більше ніж приблизно 6,7, більше ніж приблизно 7,0 або більше ніж приблизно 7,2; і знижена концентрація гасника в суміші після процесу інактивації складає менше ніж приблизно 15 мМ, менше ніж приблизно 10 мМ, менше ніж приблизно 8 мМ, менше ніж приблизно 6 мМ, менше ніж приблизно 5 мМ, менше ніж приблизно 4 мМ, менше ніж приблизно 3 мМ, менше ніж приблизно 2 мМ, менше ніж приблизно 1,5 мМ, менше ніж приблизно 1 мМ, менше ніж приблизно 0,75 мМ, менше ніж приблизно 0,5 мМ або менше ніж приблизно 0,25 мМ. У деяких варіантах здійснення, початкова концентрація гасника знаходитьсяв інтервалі приблизно від 2 мМ до 100 мМ, приблизно від 2 мМ до 40 мМ, приблизно від 4 мМ до 40 мМ, приблизно від 5 мМ до 40 мМ, приблизно від 5 мМ до 30 мМ, або приблизно від 10 мМ до 30 мМ або близько 20 мМ; величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 8,5, приблизно від 6,0 до 7,5, приблизно від 6,5 до 7,0, приблизно від 6,5 до 7,1 або приблизно від 6,6 до 6,8, або близько 6,6, 6,7, 6,8 або 6,9; і знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 1 мМ до 20 мМ, приблизно від 2 мМ до 15 мМ, приблизно від 3 мМ до 10 мМ, приблизно від 4 мМ до 8 мМ або приблизно від 5 мМ до 6 мМ. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) знаходиться в інтервалі приблизно від 10 мМ до 30 мМ; величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 7,5; і знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 2 мМ до 15 мМ. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) складає близько 20 мМ; величина pH суміші знаходиться в інтервалі приблизно від 6,5 до 7,0 (або 7,1); і знижена концентрація гасника в суміші після періоду інактивації знаходиться в інтервалі приблизно від 4 мМ до 8 мМ. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, період часу між моментом початку додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації в суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу є достатнім для зниження протікання небажаних побічних реакцій патоген-інактивуючої сполуки (наприклад, зв'язування патоген-інактивуючої сполуки з поверхнею еритроцитів, яке може призводити до небажаної імунної реакції у відповідь). У деяких варіантах здійснення, період часу є достатнім для зниження протікання небажаних побічних реакцій патоген-інактивуючої сполуки і для запобігання дегідратації або зниженню ступеня дегідратації клітин в процесі інактивації. У деяких варіантах здійснення, період часу між моментом початку додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації в суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу складає більше ніж, приблизно дорівнює або складає менше ніж 5 годин, 10 годин, 15 годин, 20 годин, 25 годин, 30 годин, 35 годин, 40 годин або 50 годин. У деяких варіантах здійснення, період часу складає приблизно від 1 до 96 годин або приблизно від 1 до 72 годин, або приблизно від 1 до 48 годин, або приблизно від 10 до 30 годин, або приблизно від 15 до 25 годин, або близько 20 годин. У деяких варіантах здійснення кожного з описаних тут способів і кожної з описаних тут композицій, початкова концентрація гасника (наприклад, глутатіону) у суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу складає більше ніж 2 мМ, більше ніж приблизно 4 мМ, більше ніж приблизно 6 мМ, більше ніж приблизно 8 мМ, більше ніж приблизно 10 мМ, або більше ніж приблизно 15 мМ; знижена концентрація гасника в суміші після періоду інактивації складає менше ніж приблизно 25 мМ, менше ніж приблизно 20 мМ, менше ніж приблизно 15 мМ, менше ніж приблизно 10 мМ, менше ніж приблизно 8 мМ, менше ніж приблизно 6 мМ, менше ніж приблизно 5 мМ, менше ніж приблизно 4 мМ, менше ніж приблизно 3 мМ, менше ніж приблизно 2 мМ, менше ніж приблизно 1,5 мМ, менше ніж приблизно 1 мМ, менше ніж приблизно 0,75 мМ, менше ніж приблизно 0,5 мМ або менше ніж приблизно 0,25 мМ; і період часу між моментом додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації складає більше ніж, приблизно дорівнює або складає менше ніж 5 годин, 10 годин, 15 годин, 20 годин, 25 годин, 30 годин, 35 годин, 40 годин, або 50 годин. У деяких варіантах здійснення, початкова концентрація гасника знаходиться в інтервалі приблизно від 2 мМ до 100 мМ, приблизно від 2 мМ до 40 мМ, приблизно від 4 мМ до 40 мМ, приблизно від 5 мМ до 40 мМ, приблизно від 5 мМ до 30 мМ, або приблизно від 10 мМ до 30 мМ 19 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 або близько 20 мМ; знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 1 мМ до 20 мМ, приблизно від 2 мМ до 15 мМ, приблизно від 3 мМ до 10 мМ, приблизно від 4 мМ до 8 мМ або приблизно від 5 мМ до 6 мМ; і період часу між моментом додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації складає приблизно від 1 до 96 годин або приблизно від 1 до 72 годин, або приблизно від 1 до 48 годин, або приблизно від 10 до 30 годин, або приблизно від 4 до 30 годин, або приблизно від 10 до 25 годин, або приблизно від 15 до 25 годин, або близько 20 годин. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) знаходиться в інтервалі приблизно від 10 мМ до 30 мМ; знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 2 мМ до 15 мМ; і період часу між моментом додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації складає приблизно від 10 до 30 годин. У деяких варіантах здійснення, початкова концентрація гасника (наприклад, глутатіону) становить приблизно 20 мМ; і знижена концентрація гасника в суміші після процесу інактивації знаходиться в інтервалі приблизно від 4 мМ до 8 мМ; і період часу між моментом додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації складає приблизно від 15 до 25 годин. У деяких із цих варіантів здійснення, величина pH суміші знаходиться в інтервалі приблизно від 6,5 до 7,0 (або 7,1). В інших варіантах цих здійснень, величина pH суміші знаходиться в інтервалі приблизно від 6,0 до 7,5. У будь-кому з цих варіантів здійснень, температура суміші, що включає композицію еритроцитів і гасник у період часу між моментом додавання гасника при початковій концентрації і моментом зниження концентрації гасника до зниженої концентрації знаходиться в інтервалі температур приблизно від 1 °C до 30 °C, також приблизно від 18 °C до 25 °C або близько 37 °C, або близько кімнатної температури. У деяких варіантах здійснення, даний винахід пропонує спосіб обробки композиції еритроцитів, що включає: a) наявність i) патоген-інактивуючої сполуки (наприклад, ефективної кількості патоген-інактивуючої сполуки для інактивації патогену, у випадку, якщо він присутній), що включає неміцну ланку, що з'єднує іпритну групу з лігандом, що зв'язує нуклеїнову кислоту (наприклад, S-303), ii) гасника (наприклад, ефективної кількості гасника), що включає тіольну групу, де тіол здатний реагувати з реакційноздатною електрофільною групою патогенінактивуючої сполуки (наприклад, глутатіону), iii) композиції, що включає еритроцити, і iv) придатної основи (наприклад, NaOH); b) змішування патоген-інактивуючої сполуки, гасника і придатної основи з композицією, що включає еритроцити; і с) достатнє зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші (наприклад, після 10, 28 або 42 днів при 4 °C), стосовно ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника. У деяких варіантах здійснення, суміш включає приблизно від 0,5 до 1,5 еквівалентів основи (або приблизно від 0,75 до 1,25 еквівалентів), де еквівалент означає мольну кількість, яка еквівалентна мольній кількості гасника в суміші, і/або одержана суміш на стадії (b) має величину pH при 37 °C приблизно від 6,0 до 7,5 (або приблизно від 6,5 до 7,0, або 7,1). У деяких варіантах здійснення, основа на стадії (a) присутня в достатній кількості, щоб знизити ступінь зв'язування анти-патоген-інактивуючої сполуки з антитілом для підданій обробці композиції еритроцитів в одержаній суміші, принаймні, приблизно на 5 % (або, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 % або, принаймні, приблизно на 90 %) стосовно суміші, що не містить основи. У деяких варіантах здійснення, концентрація гасника складає приблизно від 5 мМ до 30 мМ (або приблизно від 15 мМ до 25 мМ), і/або гасник в одержаній суміші на стадії (с) присутній при концентрації менше ніж приблизно 10 мМ (або менше ніж приблизно 6 мМ, або менше ніж приблизно 2 мМ). У деяких варіантах здійснення, концентрація патоген-інактивуючої сполуки в одержаній суміші на стадії (b) складає приблизно від 0,1 мкM до 5 мМ і/або є достатньою для інактивації, принаймні, 1 log (або 3 log) патогену в композиції еритроцитів, у випадку, якщо він присутній. У деяких варіантах здійснення, час між стадією (b) і стадією (с) складає приблизно від 1 до 48 годин (або від 15 до 25 годин). У деяких варіантах здійснення, через 20 годин після стадії (b), еритроцити (RBCs) одержаної суміші мають величину зв'язувальної здатності з антитілами (ABC) меншу, ніж 65 %, у порівнянні з величиною ABC для еритроцитів, підданих обробці цим же способом і за таких самих умов, але без використання основи,і/або мають середнє значення ABC менше, ніж приблизно 50000 (або приблизно від 25000 до 70000), і/або мають менше ніж 1 % гемолізу після стадії (с) (або після зберігання протягом 28 або 42 днів при 4 °C), і/або мають гематокритне число (PCV) більше ніж 50 % після стадії (с) (або після зберігання протягом 28 або 42 днів при 20 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 4 °C), і/або мають величину середньої осмотичної резистентності еритроцитів меншу ніж 140 (або 150) через 28 (або 42) днів при 4 °C після стадії (с). У деяких із цих варіантів здійснення, зниження концентрації гасника на стадії (с) включає видалення розчину, що використовується в процесі інактивації, і додавання кінцевого додаткового розчину (наприклад, будь-якого описаного тут розчину, такого як SAG-M, AS-5, будь-якого розчину з таблиць 2, 3 або 4, або додаткового розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, даний винахід пропонує спосіб обробки композиції еритроцитів, що включає (a) змішування (i) патоген-інактивуючої сполуки (наприклад, ефективної кількості патоген-інактивуючої сполуки для інактивації патогену, у випадку, якщо він присутній), що включає функціональну групу, яка є або яка утворює реакційноздатну електрофільну групу (наприклад, S-303); (ii) гасника (наприклад, ефективної кількості гасника), що включає тіольну групу (наприклад, глутатіон), де тіол здатний реагувати з реакційноздатною електрофільною групою патоген-інактивуючої сполуки; (iii) композиції, що включає еритроцити; і (iv) придатної основи (наприклад, NaOH); і (b) достатнє зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, відносно ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші (наприклад, через 10, 28, або 42 дні при 4 °C) при початковій концентрації гасника. У деяких варіантах здійснення, суміш включає приблизно від 0,5 до 1,5 еквівалентів основи (або приблизно від 0,75 до 1,25 еквівалентів), де еквівалент означає мольну кількість основи, яка еквівалентна мольній кількості гасника в суміші, і/або одержана суміш на стадії (a) має величину pH при 37 °C приблизно від 6,0 до 7,5 (або приблизно від 6,5 до 7,0 або 7,1). У деяких варіантах здійснення, основа на стадії (a) присутня в достатній кількості для зниження ступеня зв'язування анти-патоген-інактивуючої сполуки з антитілом для підданій обробці композиції еритроцитів в одержаній суміші, принаймні, приблизно на 5 % (або, принаймні, приблизно на 10 %, принаймні, приблизно на 25 %, принаймні, приблизно на 50 %, принаймні, приблизно на 75 % або, принаймні, приблизно на 90 %) відносно суміші без основи. У деяких варіантах здійснення, концентрація гасника складає приблизно від 5 мМ до 30 мМ (або приблизно від 15 мМ до 25 мМ), і/або гасник у одержаній суміші на стадії (b) має концентрацію менше ніж приблизно 10 мМ (або менше ніж приблизно 6 мМ, або менше ніж приблизно 2 мМ). У деяких варіантах здійснення, концентрація патоген-інактивуючої сполуки в одержаній суміші на стадії (a) складає приблизно від 0,1 мкM до 5 мМ і/або є достатньою для інактивації, принаймні, 1 log (або 3 log) патогену в композиції еритроцитів, у випадку, якщо він присутній. У деяких варіантах здійснення, час між стадією (a) і стадією (b) складає приблизно від 1 до 48 годин (або від 15 до 25 годин). У деяких варіантах здійснення, через 20 годин після стадії (a) еритроцити (RBCs) одержаної суміші мають зв'язувальну здатність з антитілами (ABC) меншу, ніж 65 %, у порівнянні зі значенням ABC для еритроцитів з цього ж самого способу і за цих же самих умов, але без використання основи, і/або має середнє значення ABC менше, ніж приблизно 50000 (або приблизно від 25000 і 70000), і/або має менше ніж 1 % гемолізу після стадії (b) (або після зберігання протягом 28 або 42 днів при 4 °C) і/або мають гематокритне число (PCV) більше ніж 50 % після стадії (b) (або після зберігання протягом 28 або 42 днів при 4 °C), і/або мають величину середньої осмотичної резистентності еритроцитів більшу, ніж 140 (або 150), через 28 (або 42) днів при 4 °C після стадії (b). У деяких із цих варіантів здійснення, зниження концентрації гасника на стадії (b) включає видалення розчину, що використовується в процесі інактивації, і додавання кінцевого додаткового розчину (наприклад, будь-якого описаного тут розчину, такого як SAG-M, AS-5, будь-якого розчину з таблиць 2, 3 або 4, або додаткового розчину, що включає хлорид натрію, аденін, глюкозу, фосфат, гуанозин, цитрат і/або маніт). У деяких варіантах здійснення, даний винахід пропонує спосіб зниження дегідратації еритроцитів, що включає: a) одержання композиції еритроцитів, що включає i) гасник (наприклад, глутатіон), де гасник здатний реагувати з патоген-інактивуючою сполукою, і ii) еритроцити; і b) достатнє зниження концентрації гасника в суміші до кількості, яка знижує ступінь дегідратації еритроцитів, виникаючої внаслідок зберігання суміші, відносно ступеня дегідратації еритроцитів, виникаючої внаслідок зберігання суміші при початковій концентрації гасника (наприклад, через 10, 28 або 42 днів при 4 °C). У деяких варіантах здійснення, гасник в одержаній суміші на стадії (b) присутній при концентрації меншій, ніж приблизно 10 мМ (або меншій ніж приблизно 6 мМ, або меншій ніж приблизно 2 мМ). У деяких варіантах здійснення, еритроцити (RBCs) одержаної суміші мають менше ніж 1 % гемолізу після стадії (b) (або після зберігання протягом 28 або 42 днів при 4 °C), і/або має гематокритне число (PCV) більше, ніж 50 % після стадії (b) (або після зберігання протягом 28 або 42 днів при 4 °C), і/або мають величину середньої осмотичної резистентності еритроцитів більшу ніж 140 (або 150) через 28 21 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 (або 42) днів при 4 °C після стадії (b). Способи винаходу включають використання патоген-інактивуючої сполуки і гасника ex vivo. Застосування ex vivo включає використання сполук для обробки композиції еритроцитів поза організмом живої людини, ссавця або хребетного, де підданий обробці біологічний матеріал призначається для використання всередині живої людини, ссавця або хребетного. Наприклад, відбір крові з людини і введення сполуки в кров для інактивації патогенів визначають як застосування сполуки ex vivo, якщо кров призначена для повторного введення цій людині або іншій людині. Повторне введення людської крові цій людині або іншій людині могло б бути застосуванням крові in vivo, на протилежність застосуванню сполуки ex vivo. Якщо сполука все ще присутня в крові, коли її повторно вводять людині, тоді сполуку на додаток до його застосування ex vivo також вводять in vivo. Деякі варіанти здійснення даного винаходу включають застосування гасника ex vivo, де композиція еритроцитів призначається для використання in vivo. У деяких випадках, певний вміст гасника залишається в композиції еритроцитів, так що гасник також вводиться in vivo. Застосування матеріалу або сполуки in vitro включає використання матеріалу або сполуки поза організмом живої людини, ссавця або хребетного, де матеріал або сполука не призначена для повторного введення в організм живої людини, ссавця або хребетного. Прикладом застосування in vitro може бути діагностичний аналіз компонентів препарату еритроцитів. Способи винаходу можуть застосовуватися при використанні композиції еритроцитів in vitro, оскільки зміна еритроцитів або інших складових може впливати на аналіз компонентів препарату крові in vitro. Таким чином, способи винаходу можуть забезпечувати безпеку при роботі з такими препаратами in vitro з відповідним гасінням змін препарату, які можуть, в іншому випадку, заважати діагностичному випробуванню препарату. З описаними тут способами і композиціями еритроцитів можуть бути використані додаткові розчини, що включають солі і/або буферні розчини. Наприклад, вибраний буфер (наприклад, SAG-M, AS-5 або будь-який розчин, описаний у таблицях 2, 3 і/або 4) може бути доданий до композиції еритроцитів перед інактивацією, під час інактивації і/або після процесу інактивації і/або під час зниження концентрації гасника. Способи інактивації при використанні еритроцитарної маси У деяких варіантах здійснення, еритроцитарну масу (еритроцитарні маси) (наприклад, еритроцити без додаткового розчину і/або що мають гематокрит в інтервалі приблизно від 70 до 90 %, або приблизно від 75 до 85 %, або близько 80 %) піддають описаному тут способу інактивації (наприклад, способу, в якому композиція включає зміст близько 20 мМ глутатіону з приблизно 1 еквівалентом основи і близько 0,2 мМ S-303), потім піддають обробці (у ряді випадків, зберігають за допомогою) за допомогою додаткового розчину (наприклад, SAG-M, AS5 або будь-якого описаного тут або в таблиці 2 розчину). Приклади додаткових розчинів описані тут і наведені в таблиці 2. У деяких із цих варіантів здійснення, додатковий розчин (наприклад, будь-який описаний тут або в таблиці 2 розчин) додають до композиції еритроцитів, що включає гасник, патоген-інактивуючу сполуку, і будь-яку додавану основу через приблизно від 5 хвилин до 20 годин після додавання патоген-інактивуючої сполуки (наприклад, S-303) і/або гасника (наприклад, глутаміну). У деяких варіантах здійснення, додатковий розчин додають до композиції еритроцитів через приблизно від 5 хвилин до10 годин, або через приблизно від 5 хвилин до 5 годин, або через приблизно від 5 хвилин до 60 хвилин, або через приблизно від 5 хвилин до 30 хвилин, або через приблизно від 10 хвилин до 20 хвилин, або через приблизно 15 хвилин після додавання патоген-інактивуючої сполуки (наприклад, S-303) і/або гасника (наприклад, глутаміну). У деяких варіантах здійснення, концентрацію гасника знижують, як тут описано, після додавання додаткового розчину (наприклад, SAG-M, AS-5 або будь-якого описаного тут або в таблиці 2 розчину). Наприклад, еритроцитарна маса може бути піддана описаному тут способу інактивації (наприклад, обробці, де композиція включає близько 20 мМ глутаміну, близько 1 еквівалента основи, і близько 0,2 мМ S-303), потім обробці за допомогою додаткового розчину (наприклад, SAG-M, AS-5 або будь-яким описаним тут або в таблиці 2 розчином) у конкретний момент часу після додавання патоген-інактивуючої сполуки і/або гасника (наприклад, через приблизно від 5 хвилин до 5 годин або через приблизно від 10 хвилин до 20 хвилин, або через приблизно 15 хвилин), із подальшим зниженням концентрації гасника, як це тут описано (наприклад, до концентрації менше ніж приблизно 10 мМ, або менше ніж приблизно 5 мМ). У деяких із цих варіантів здійснення, зниження концентрації гасника включає видалення розчину для обробки і/або додаткового розчину з подальшим додаванням кінцевого додаткового розчину (наприклад, SAG-M, AS-5 або будь-якого описаного тут або в таблиці 2 розчину) з одержанням композиції еритроцитів, що має, наприклад, гематокрит в інтервалі приблизно від 50 до 70 % або приблизно від 55 до 65 %, або близько 60 %. У деяких 22 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 варіантах здійснення, концентрація хлориду-іона в композиції еритроцитів перед і/або в процесі інактивації складає менше ніж або більше ніж приблизно 150 мМ, або приблизно 120 мМ, або приблизно 100 мМ, або приблизно 90 мМ, або приблизно 80 мМ, або приблизно 70 мМ, або приблизно 60 мМ, або приблизно 50 мМ, або приблизно 40 мМ, або приблизно 30 мМ, або приблизно 20 мМ, або приблизно 10 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або близько 70 мМ, або близько 65 мМ. У деяких варіантах здійснення, званий тут як додатковий розчин (наприклад, додатковий розчин, що вводиться перед зниженням і/або після зниження концентрації гасника) включає один або більше з наступних компонентів: декстрозу, аденін, гуанозин, маніт, цитрат (наприклад, цитрат натрію), лимонну кислоту, фосфат (наприклад, Na 2HPO4 і/або NaH2PO4) і хлориди (наприклад, у вигляді хлориду натрію). У деяких варіантах здійснення, концентрація декстрози в додатковому розчині і/або кінцева концентрація декстрози в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 50 мМ. У деяких варіантах здійснення, концентрація аденіну в додатковому розчині і/або кінцева концентрація аденіну в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 0,5 мМ до 5 мМ, або приблизно від 0,75 мМ до 3 мМ, або приблизно від 1 мМ до 2,5 мМ. У деяких варіантах здійснення, концентрація гуанозину в додатковому розчині і/або кінцева концентрація гуанозину в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 0,5 мМ до 5 мМ, або приблизно від 0,75 мМ до 3 мМ, або приблизно від 1 мМ до 2,5 мМ, або приблизно від 1,5 мМ до 2 мМ. У деяких варіантах здійснення, концентрація маніту в додатковому розчині і/або кінцева концентрація маніту в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно від 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 50 мМ, або приблизно від 35 мМ до 45 мМ. У деяких варіантах здійснення, концентрація цитрату (наприклад, цитрату натрію) у додатковому розчині і/або кінцева концентрація цитрату в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 5 мМ до 100 мМ, або приблизно від 10 мМ до 75 мМ, або приблизно від 15 мМ до 50 мМ, або приблизно від 15 мМ до 35 мМ, або приблизно від 20 мМ до 30 мМ. У деяких варіантах здійснення, концентрація фосфату (наприклад, Na 2HPO4 і/або NaH2PO4) у додатковому розчині і/або кінцева концентрація фосфату в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає приблизно від 1 мМ до 150 мМ, або приблизно від 2 мМ до 100 мМ, або приблизно від 3 мМ до 75 мМ, або приблизно від 4 мМ до 50 мМ, або приблизно від 5 мМ до 25 мМ, або приблизно від 10 мМ до 20 мМ. У деяких варіантах здійснення, концентрація хлориду в додатковому розчині і/або кінцева концентрація хлориду в композиції еритроцитів після заміни розчинів (наприклад, перед трансфузією) складає менше ніж або більше ніж приблизно 500 мМ, або приблизно 250 мМ, або приблизно 200 мМ, або приблизно 150 мМ, або приблизно 100 мМ, або приблизно 75 мМ, або приблизно 50 мМ, або приблизно 25 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або приблизно від 60 до 70 мМ, або приблизно від 100 до 200 мМ, або приблизно від 125 мМ до 175 мМ, або близько 150 мМ. У деяких варіантах здійснення, розчин, що називають тут як додатковий (наприклад, додатковий розчин, що вводиться перед зниженням і/або після зниження концентрації гасника), і/або кінцева композиція еритроцитів після заміни розчинів (наприклад, перед трансфузією) включає приблизно від 10 мМ до 150 мМ (або приблизно від 50 мМ до 90 мМ) декстрози, приблизно від 0,5 мМ до 5 мМ (приблизно від 0,75 мМ до 3 мМ) аденіну, приблизно від 10 мМ до 150 мМ (або приблизно від 25 мМ до 100 мМ) маніту, приблизно від 10 мМ до 75 мМ (або приблизно від 15 мМ до 50 мМ) цитрату (наприклад, цитрату натрію), приблизно від 3 мМ до 75 мМ (або приблизно від 5 мМ до 25 мМ) фосфату (наприклад, Na 2HPO4 і/або NaH2PO4), і приблизно від 50 до 250 мМ (або приблизно від 100 до 175 мМ) хлориду. Таблиця 2 Приклади додаткових розчинів Декстроза (мМ) Аденін (мМ) Гуанозин (мМ) AS-1 111,0 2,0 AS-3 SAG-M 55,5 45,4 2,2 1,3 23 Erythro-sol 81,1 1,6 AS-5 45,4 2,2 PAGGS-M MAP 47,5 36,4 1,4 1 1,44 UA 102252 C2 Продовження таблиці 2 Маніт (мМ) Дигідрат цитрату натрію (мМ) Na2HPО4(мМ) NaH2PО4(мМ) NaCl (мМ) Лимонна кислота (мМ) Осмоляльність (mOsm) 5 10 15 20 25 30 35 40 45 50 41,2 28,8 20 154,0 20 70 2 276 42,5 26,6 17 4,7 359 175 55 150 150 28,8 8 8 72 351 80 5,1 296 6 85 1 Способи інактивації при використанні розведених еритроцитів Описані тут композиції еритроцитів можуть бути розведені перед інактивацією. Піддаючи еритроцити розведенню, можна знизити концентрацію розчинених речовин (наприклад, солей, таких як Cl ) до рівня, який підходить для інактивації за допомогою описаних тут способів. Приклади розведених розчинів описані тут і наведені в таблиці 3. У деяких варіантах здійснення, нееритроцитарну масу (наприклад, еритроцити, що мають гематокрит в інтервалі приблизно від 50 до 70 % або приблизно від 55 до 65 %, або близько 60 % і що необов'язково включають SAG-M або оптизол) піддають розведенню за допомогою розчину (наприклад, будьякого описаного тут або в таблиці 3 розчину) перед описаним тут способом інактивації (наприклад, способом, в якому композиція включає близько 20 мМ глутаміну з приблизно 1 еквівалентом основи і близько 0,2 мМ S-303), із подальшим зниженням концентрації гасника, як це тут описано (наприклад, до менше ніж приблизно 10 мМ або менше ніж приблизно 5 мМ). У деяких із цих варіантів здійснення, зниження концентрації гасника включає видалення розчину для обробки (наприклад, розведеного розчину для обробки) з подальшим додаванням кінцевого додаткового розчину (наприклад, SAG-M, AS-5 або будь-якого описаного тут або в таблиці 2 розчину) з одержанням, наприклад, композиції еритроцитів, що мають гематокрит в інтервалі приблизно від 50 до 70 % або приблизно від 55 до 65 %, або близько 60 %). У деяких варіантах здійснення, концентрацію хлориду-іона в композиції еритроцитів розводять перед інактивацією до величини меншої ніж або більшої ніж приблизно 150 мМ, або приблизно 120 мМ, або приблизно 100 мМ, або приблизно 90 мМ, або приблизно 80 мМ, або приблизно 70 мМ, або приблизно 60 мМ, або приблизно 50 мМ, або приблизно 40 мМ, або приблизно 30 мМ, або приблизно 20 мМ, приблизно 10 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або приблизно від 60 до 70 мМ, або близько 65 мМ. У деяких варіантах здійснення, кількість (за об'ємом) розчину для розведення, що додається до розчину еритроцитів, складає приблизно від 0,2 до 2 разів, або приблизно від 0,3 до 1,5 разів, або приблизно від 0,4 до 1 разу, або приблизно від 0,5 до 0,75 разу від об'єму розчину еритроцитів. У деяких із цих варіантів здійснення, композицію еритроцитів розводять за допомогою розчину для розведення (наприклад, будь-якого описаного тут або в таблиці 3 розчину) до величини гематокриту в інтервалі приблизно від 30 до 50 %, або приблизно від 35 до 45 %, або близько 40 %. У деяких варіантах здійснення, званий тут як розчин для розведення включає один або більш з наступних компонентів: декстрозу, аденін, маніт, цитрат (наприклад, цитрат натрію), лимонну кислоту, фосфат (наприклад, Na2HPO4 і/або NaH2PO4) і хлориди (наприклад, у вигляді хлориду натрію). У деяких варіантах здійснення, концентрація декстрози в розчині для розведення і/або кінцева концентрація декстрози в композиції еритроцитів після розведення за допомогою розчину для розведення складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно від 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 50 мМ, або приблизно від 50 мМ до 60 мМ. У деяких варіантах здійснення, концентрація аденіну в розчині для розведення і/або кінцева концентрація аденіну в композиції еритроцитів після розведення за допомогою розчину для розведення складає приблизно від 0,5 мМ до 5 мМ, або приблизно від 0,75 мМ до 3 мМ, або приблизно від 1 мМ до 2,5 мМ. У деяких варіантах здійснення, концентрація маніту в розчині для розведення і/або кінцева концентрація маніту в композиції еритроцитів після розведення за допомогою розчину для розведення складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно від 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 60 мМ, або приблизно від 25 мМ до 35 мМ. У деяких варіантах здійснення, концентрація цитрату (наприклад, цитрату натрію) у розчині для розведення і/або кінцева концентрація цитрату в композиції еритроцитів після розведення за допомогою розчину для розведення складає приблизно від 5 мМ до 100 мМ, або приблизно від 10 мМ до 75 мМ, або приблизно від 24 UA 102252 C2 5 10 15 20 25 30 35 15 мМ до 50 мМ, або приблизно від 15 мМ до 35 мМ, або приблизно від 20 мМ до 30 мМ. У деяких варіантах здійснення, концентрація фосфату (наприклад, Na 2HPO4 і/або NaH2PO4) у розчині для розведення і/або кінцева концентрація фосфату в композиції еритроцитів після розведення за допомогою розчину для розведення складає приблизно від 1 мМ до 150 мМ, або приблизно від 2 мМ до 100 мМ, або приблизно від 3 мМ до 75 мМ, або приблизно від 4 мМ до 50 мМ, або приблизно від 5 мМ до 25 мМ, або приблизно від 10 мМ до 20 мМ. У деяких варіантах здійснення, концентрація хлориду в розчині для розведення і/або після розведення за допомогою розчину для розведення складає менше ніж або більше ніж приблизно 500 мМ, або приблизно 250 мМ, або приблизно 200 мМ, або приблизно 150 мМ, або приблизно 120 мМ, або приблизно 100 мМ, або приблизно 90 мМ, або приблизно 80 мМ, або приблизно 70 мМ, або приблизно 60 мМ, або приблизно 50 мМ, або приблизно 40 мМ, або приблизно 30 мМ, або приблизно 20 мМ, або приблизно 10 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або приблизно від 60 до 70 мМ, або приблизно від 100 до 200 мМ, або приблизно від 125 мМ до 175 мМ. У деяких варіантах здійснення, званий тут як розчин для розведення і/або композиція еритроцитів після розведення за допомогою розчину для розведення включає приблизно від 10 мМ до 150 мМ (або приблизно від 35 мМ до 65 мМ) декстрози, приблизно від 0,5 мМ 5 мМ (або приблизно від 0,75 мМ до 3 мМ) аденіну, приблизно від 10 мМ до 150 мМ (або приблизно від 25 мМ до 75 мМ) маніту, приблизно від 10 мМ до 75 мМ (або приблизно від 15 мМ до 50 мМ) цитрату (наприклад, цитрат натрію), приблизно від 3 мМ до 75 мМ (або приблизно від 5 мМ до 25 мМ) фосфату (наприклад, Na2HPO4 і/або NaH2PO4), і приблизно від 5 до 50 мМ (або приблизно від 10 до 25 мМ) хлориду. У деяких варіантах здійснення, нееритроцитарну масу піддають розведенню за допомогою розчину для розведення (наприклад, будь-якого описаного вище або в таблиці 3 розчину) перед застосуванням описаного тут способу інактивації, із подальшим зниженням концентрації описаного тут гасника, потім обробляють за допомогою кінцевого додаткового розчину (наприклад, SAG-M, AS-5 або будь-якого описаного вище або в таблиці 2 розчину) з одержанням композиції еритроцитів, придатної для використання (наприклад, придатної для трансфузії). У деяких варіантах здійснення, кінцевим додатковим розчином може бути будь-який описаний тут додатковий розчин, наприклад, додатковий розчин, в якому концентрація хлориду (і/або кінцева концентрація хлориду в композиції еритроцитів після заміни розчинів, наприклад, перед трансфузією) складає менше ніж приблизно 500 мМ, або приблизно 250 мМ, або приблизно 200 мМ, або приблизно 150 мМ, або приблизно 100 мМ, або приблизно 75 мМ, або приблизно 50 мМ, або приблизно 25 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або приблизно від 60 до 70 мМ, або приблизно від 100 до 200 мМ, або приблизно від 125 мМ до 175 мМ, або близько 150 мМ. Таблиця 3 Приклади розчинів для розведення DS 5 DS 6 DS 7 DS 8 DS 9 55 55 45,4 45,4 45,4 45,4 45,4 45,4 45,4 1,3 1,3 1,3 1,3 55 55 55 28,8 DS 1 Декстроза (мМ) Аденін/ Аденін HC1 (мМ) Маніт (мМ) Цитрат натрію дигідрат або безводний (мМ) Na2HPO4 (мМ) NaH2PO4 (мМ) NaCl (мМ) Осмоляльність (mOsm) рН DS 2 DS 3 DS 4 55 55 55 1,3 1,3 55 55 20 20 1,3 1,3 20 15 28,8 20 20 33,5 12,7 3,5 16,2 3,5 12,7 287 215 174 181 8,61 8,38 6,28 6,29 8,77 7,48 6,63 8,62 8,7 15 178 6,9 7,68,0 128 20 20 33,5 33,5 180 DS 13 1,3 20 1,3 DS 12 1,3 20 1,3 DS 11 28,8 28,8 28,8 28,8 33,5 33,5 33,5 1,3 DS 10 177 179 16,2 20 25 243 227 179 7,5 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 Способи інактивації при використанні ресуспендованої еритроцитарної маси У деяких варіантах здійснення, еритроцитарну масу (еритроцитарні маси) (наприклад, еритроцити, що мають гематокрит в інтервалі приблизно від 70 до 90 % або приблизно від 75 до 85 %, або близько 80 %) піддають обробці розчином перед проведенням описаного тут способу інактивації (наприклад, способу, в якому композиція включає близько 20 мМ глутатіону приблизно з 1 еквівалентом основи і близько 0,2 мМ S-303). Приклади розчинів для обробки наведені в таблиці 4. У деяких варіантів здійснення, розчин для обробки (наприклад, будь-який описаний у таблиці 4 розчин) додають до еритроцитарної маси перед додаванням гасника, патоген-інактивуючої сполуки, і будь-якої основи, що додається. У деяких із цих варіантів здійснення, композицію еритроцитарної маси обробляють за допомогою розчину для обробки, що призводить до одержання не-еритроцитарної маси (наприклад, еритроцитів, що мають гематокрит в інтервалі приблизно від 50 до 70 % або приблизно від 55 до 65 %, або близько 60 %). У деяких варіантах здійснення, (a) додають до еритроцитарної маси розчин для обробки, (b) проводять описаний тут спосіб інактивації (наприклад, спосіб, в якому композиція включає близько 20 мМ глутатіону з приблизно 1 еквівалентом основи і близько 0,2 мМ S-303), і (с) знижують, як це тут описано, концентрацію гасника, (наприклад, до менше ніж приблизно 10 мМ, або менше ніж приблизно 5 мМ). У деяких із цих варіантів здійснення, стадія (с) включає видалення розчину для обробки і додавання кінцевого додаткового розчину (наприклад, будьякого описаного тут розчину, такого як SAG-M, AS-5 або будь-якого розчину з таблиць 2, 3 або 4) з одержанням, наприклад, композиції еритроцитів, що мають гематокрит в інтервалі приблизно від 50 до 70 %, або приблизно від 55 до 65 %, або близько 60 %. У деяких з цих варіантів здійснення, концентрація хлориду-іона в композиції еритроцитів перед і/або в процесі інактивації складає менше ніж або більше ніж приблизно 150 мМ, або приблизно 120 мМ, або приблизно 100 мМ, або приблизно 90 мМ, або приблизно 80 мМ, або приблизно 70 мМ, або приблизно 60 мМ, або приблизно 50 мМ, або приблизно 40 мМ, або приблизно 30 мМ, або приблизно 20 мМ, приблизно 10 мМ, або від приблизно 25 до 250 мМ, або від приблизно 40 до 100 мМ, або від приблизно 50 до 75 мМ, або від приблизно 60 до 70 мМ, або близько 65 мМ. У деяких варіантах здійснення, званий тут як розчин для обробки включає один або більше з наступних компонентів: декстрозу, аденін, маніт, цитрат (наприклад, цитрат натрію), лимонну кислоту, фосфат (наприклад, Na2HPO4 і/або NaH2PO4) і хлориди (наприклад, у вигляді хлориду натрію). У деяких варіантах здійснення, концентрація декстрози в розчині для обробки і/або концентрація декстрози в додатковому розчині після видалення розчину для обробки в композиції еритроцитів складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно від 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 50 мМ, або приблизно від 50 мМ до 60 мМ. У деяких варіантах здійснення, концентрація аденіну в розчині для обробки і/або концентрація аденіну в додатковому розчині після видалення розчину для обробки в композиції еритроцитів складає приблизно від 0,5 мМ до 5 мМ, або приблизно від 0,75 мМ до 3 мМ, приблизно від 1 мМ до 2,5 мМ. У деяких варіантах здійснення, концентрація маніту в розчині для обробки і/або концентрація маніту в додатковому розчині після видалення розчину для обробки в композиції еритроцитів складає приблизно від 10 мМ до 150 мМ, або приблизно від 20 мМ до 120 мМ, або приблизно від 25 мМ до 100 мМ, або приблизно від 30 мМ до 75 мМ, або приблизно від 40 мМ до 60 мМ. У деяких варіантах здійснення, концентрація цитрату (наприклад, цитрату натрію) у розчині для обробки і/або концентрація цитрату в додатковому розчині після видалення розчину для обробки в композиції еритроцитів складає приблизно від 1 мМ до 100 мМ, або приблизно від 2 мМ до 75 мМ, або приблизно від 5 мМ до 50 мМ, або приблизно від 7,5 мМ до 25 мМ, або приблизно від 10 мМ до 15 мМ. У деяких варіантах здійснення, концентрація фосфату (наприклад, Na2HPO4 і/або NaH2PO4) у розчині для обробки і/або концентрація фосфату в додатковому розчині після видалення розчину для обробки в композиції еритроцитів складає приблизно від 1 мМ до 150 мМ, або приблизно від 2 мМ до 100 мМ, або приблизно від 3 мМ до 75 мМ, або приблизно від 4 мМ до 50 мМ, або приблизно від 5 мМ до 25 мМ, або приблизно від 10 мМ до 20 мМ. У деяких варіантах здійснення, концентрація хлориду в розчині для обробки і/або концентрація хлориду в додатковому розчині після видалення розчину для обробки в композиції еритроцитів становить приблизно 250 мМ, або приблизно 200 мМ, або приблизно 150 мМ, або приблизно 120 мМ, або приблизно 100 мМ, або приблизно 90 мМ, або приблизно 80 мМ, або приблизно 70 мМ, або приблизно 60 мМ, або приблизно 50 мМ, або приблизно 40 мМ, або приблизно 30 мМ, або приблизно 20 мМ, приблизно 10 мМ, або приблизно від 25 до 250 мМ, або приблизно від 40 до 100 мМ, або приблизно від 50 до 75 мМ, або приблизно від 60 до 70 мМ, або приблизно від 100 до 200 мМ, або приблизно від 125 мМ до 175 мМ. 26 UA 102252 C2 5 У деяких варіантах здійснення, розчин для обробки і/або додатковий розчин після видалення розчину для обробки в композиції еритроцитів включає приблизно від 10 мМ до 150 мМ (або приблизно від 35 мМ до 65 мМ) декстрози, приблизно від 0,5 мМ до 5 мМ (або приблизно від 0,75 мМ до 3 мМ) аденіну, приблизно від 10 мМ до 150 мМ (або приблизно від 25 мМ до 75 мМ) маніту, приблизно від 5 мМ до 75 мМ (або приблизно від 10 мМ до 20 мМ) цитрату (наприклад, цитрат натрію), приблизно від 3 мМ до 75 мМ (приблизно від 5 мМ до 25 мМ) фосфату (наприклад, Na2HPO4 і/або NaH2PO4), і приблизно від 5 до 100 мМ (або приблизно від 25 до 75 мМ) хлориду. Таблиця 4 Приклади розчинів для обробки Декстроза (мМ) Аденін/Аденін HCl(мМ) Маніт (мМ) Цитрат натрію дигідрат або безводний (мМ) Na2HPО4 (мМ) NaH2PО4 (мМ) NaCl (мМ) Осмоляльність (mOsm) pH (скоректований за допомогою лимонної кислоти) Розчин 1 45,4 1,3 55 Розчин 2 45,4 1,3 44,5 Розчин 3 45,4 1,3 44,5 Розчин 4 45,4 1,3 44,5 12 12 Розчин 5 45,4 1,3 30 12 15 70 60 60 60 70 7 6,5 6,5 10 15 20 25 30 35 40 Оцінка ефективності способу Крім обговореного вище показника ефективності інактивації, що виражається через log, ефективність вдосконалених способів гасіння може бути оцінена низкою інших методів, описаних у патентній публікації US No. 2006/0115466, зміст якої наводиться тут шляхом посилання на неї. Наприклад, способи гасіння можуть бути оцінені шляхом дослідження зміни композиції еритроцитів із точки зору функції, морфології і стану гідратації еритроцитів, і з точки зору реакційної здатності підданих обробці еритроцитів стосовно імунної системи, наприклад, антитіл. Якщо піддана обробці композиція еритроцитів призначається для застосування в організмі людини, наприклад, для інфузії, способи гасіння практично не повинні порушувати функцію еритроцитів (наприклад, у результаті дегідратації). Практична відсутність впливу на функцію еритроцитів, що порушує, може бути визначена за допомогою відомих у техніці методів дослідження функції еритроцитів. Зокрема, ступінь дегідратації може бути визначений, наприклад, за гематокритом (гематокритним числом, PCV), осмотичною резистентністю, середньою концентрацією клітинного гемоглобіну в еритроцитах (MCHC), відсотком гемолізу, і за допомогою ектацитометрії. Можуть бути визначені значення інших індикаторів функції еритроцитів, такі як загальний АТФ (аденозин-5-трифосфат), загальний 2,3-ДФГ (2,3дифосфогліцерол) або позаклітинний калій, і порівняні з цими індикаторами для контрольної групи еритроцитів, що не зазнавали обробки. Крім того, можуть бути визначені величина внутрішньоклітинного і позаклітинного pH, гемоглобін, споживання глюкози і продукування лактату. Вдосконалені способи даного винаходу можуть бути зіставлені з умовами обробки, раніше описаними в патентній публікації US No. 2006/0115466 (наприклад, повністю погашені (2 еквіваленти основи) 20 мМ глутатіону в комбінації з S-303/суміш еритроцитів без описаного тут зниження концентрації гасника після інкубування). У деяких варіантах здійснення даного винаходу, еритроцити описаних тут способів і композицій мають мінімальні пошкодження або не мають пошкоджень після обробки (наприклад, дегідратацію, гемоліз і так далі). У деяких варіантах здійснення, еритроцити в одержаній суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу (перед зниженням або після зниження концентрації гасника) мають менше ніж 4 %, або менше ніж 3 %, або менше ніж 2 %, менше ніж 1 % гемолізу, або менше ніж 0,5 % гемолізу. У деяких варіантах здійснення, еритроцити в одержаній суміші мають менше ніж 4 %, або менше ніж 3 %, або менше ніж 2 %, або менше ніж 1 %, або менше ніж 0,5 % гемолізу приблизно через 10 днів при 4 °C, або приблизно через 28 або 42 дні при 4 °C, або приблизно через 42 дні при 4 °C після зниження концентрації гасника (наприклад, глутатіону). 27 UA 102252 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення, еритроцити в одержаній суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу (перед зниженням або після зниження концентрації гасника) мають більше, ніж 50 %, або більше ніж 55 %, або більше ніж 60 %, або більше ніж 65 % гематокритне число (PCV). У деяких варіантах здійснення, еритроцити в одержаній суміші мають більше, ніж 50 %, або більше, ніж 55 %, або більше, ніж 60 %, або більше, ніж 65 % гематокритне число (PCV) приблизно через 10 днів при 4 °C, або приблизно через 28 або 42 дні при 4 °C, або приблизно через 42 дні при 4 °C після зниження концентрації гасника (наприклад, глутатіону). У деяких варіантах здійснення, еритроцити в одержаній суміші, що включає композицію еритроцитів, гасник, патоген-інактивуючу сполуку і будь-яку додавану основу (перед зниженням або після зниження концентрації гасника) мають середню осмотичну резистентність (MCF; осмолярність, при якій відбувається 50 % гемоліз) більше ніж 130, або більше ніж 135, або більше ніж 140, або більше ніж 145, або більше ніж 150, або більше ніж 155. У деяких варіантах здійснення, еритроцити в одержаній суміші мають середню осмотичну резистентність (MCF) більше ніж 130, або більше ніж 135, більше ніж 140, або більше ніж 145, або більше ніж 150, або більше ніж 155 приблизно через 10 днів при 4 °C, або приблизно через 28 або 42 дні при 4 °C, або приблизно через 42 дні при 4 °C після зниження концентрації гасника (наприклад, глутатіону). Способи визначення АТФ, 2,3-дифосфогліцерату, глюкози, гемоглобіну, гемолізу і калію є відомими в техніці, і вони тут описані в експериментальному розділі. Дивіться, наприклад, публікацію Davey et al, Transfusion, 32:525-528 (1992), зміст якої наводиться тут шляхом посилання на неї. Способи визначення функції еритроцитів також описані в публікаціях Greenwalt et al, Vox Sang, 58:94-99 (1990); Hogman et al, Vox Sang, 65:271-278 (1993); і Beutler et al, Blood, Vol. 59 (1982), зміст яких наводиться тут шляхом посилання на них. Наприклад, загальний АТФ і загальний 2,3-дифосфогліцерат можуть бути визначені за допомогою набору Sigma ATP або набору 2,3-DPG (фірми Sigma, St. Louis, Mo.). Набір ATP може бути використаний відповідно до методики фірми Sigma № 366-UV, зміст якої наводиться тут шляхом посилання на неї. Загальний АТФ може також бути визначений за допомогою ферментного аналізу на основі люциферази або протоколу, описаного Беутлером (Beutler) у 1984 році. Вмісти + + позаклітинного калію можуть бути визначені за допомогою аналізатора для K /Na (Ciba Corning Model 614 (фірми Ciba Corning Diagnostics Corp., Medford, MA). Величина позаклітинного pH може бути виміряна шляхом центрифугування клітин при 4 °C протягом 15 хвилин при 12000 х g і видалення надосадової рідини, величина pH якої може бути виміряна за допомогою стандартного рН-метра при кімнатній температурі (наприклад, фірми Beckman, із каломельним електродом порівняння з епоксидної смоли). Для визначення величини внутрішньоклітинного pH осад, що залишився після центрифугування, може бути закритий пробкою в пробірці для центрифугування і підданий зберіганню при температурі близько -80 °C протягом, принаймні, 2 годин. Потім осад може бути підданий лізуванню шляхом додавання деіонізованої води. Лізований зразок може бути ретельно змішаний із водою, і величина pH розчину може бути виміряна або при кімнатній температурі за допомогою стандартного рН-метра, або при кімнатній температурі за допомогою аналізатора кислотно-основного балансу крові Ciba Corning Model 238 (фірми Ciba Corning Diagnostics Corp., Medford, MA). Вимірювання можуть бути зроблені відразу після проведення обробки і залежно від часу зберігання, що пройшов після обробки, наприклад, після зберігання протягом до 42 днів. Способи даного винаходу дозволяють одержувати композицію еритроцитів, в якій гемоліз підданих обробці еритроцитів складає величину меншу, ніж 3 % після 28 днів зберігання, більш переважно, меншу, ніж 2 % поле 42 днів зберігання, і найбільш переважно, меншу, ніж або яка дорівнює приблизно 1 % після 42 днів зберігання при 4 °C. У деяких варіантах здійснення пропонується композиція еритроцитів (наприклад, композиція еритроцитів, одержаних будь-яким з описаних тут способів), в якій величина загального АТФ може бути вищою в порівнянні з величиною загального АТФ для композиції еритроцитів, підданих обробці за допомогою 2 мМ кислого глутатіону і 0,2 мМ S-303. В деяких варіантах здійснення), описані тут способи гасіння дозволяють одержати композиції еритроцитів, що мають значення АТФ, які приблизно на 20 %, також 30 %, також 40 % або приблизно на 50 % вищі в порівнянні з композиціями, що піддані обробці способами з використанням 2 мМ кислого глутатіону і 0,2 мМ S-303. У деяких варіантах здійснення, більш високе значення АТФ зберігається через 7, 14, 21, 28, 35 або 42 дні зберігання. У деяких варіантах здійснення, більш високе значення АТФ знижується в процесі зберігання. У деяких варіантах здійснення даного винаходу, описані тут способи і композиції включають композиції еритроцитів, в яких еритроцити характеризуються зниженим ступенем впливу небажаних побічних реакцій внаслідок дії патоген-інактивуючої сполуки (наприклад, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюImproved method for extincting undesired side reactions at pathogen inactivation of red blood cells
Автори англійськоюMufti, Maheed, Erickson, Anna, North, Anne
Назва патенту російськоюУсовершенствованный способ гашения нежелательных побочных реакций при патогенной инактивации эритроцитов
Автори російськоюМуфти Нахид, Эриксон Анна, Норт Анне
МПК / Мітки
МПК: A01N 43/42, A61L 2/00, A61P 7/00, A01N 1/02, A61K 35/14
Мітки: гасіння, еритроцитів, небажаних, вдосконалений, інактивації, спосіб, реакцій, патогенний, побічних
Код посилання
<a href="https://ua.patents.su/61-102252-vdoskonalenijj-sposib-gasinnya-nebazhanikh-pobichnikh-reakcijj-pri-patogennijj-inaktivaci-eritrocitiv.html" target="_blank" rel="follow" title="База патентів України">Вдосконалений спосіб гасіння небажаних побічних реакцій при патогенній інактивації еритроцитів</a>