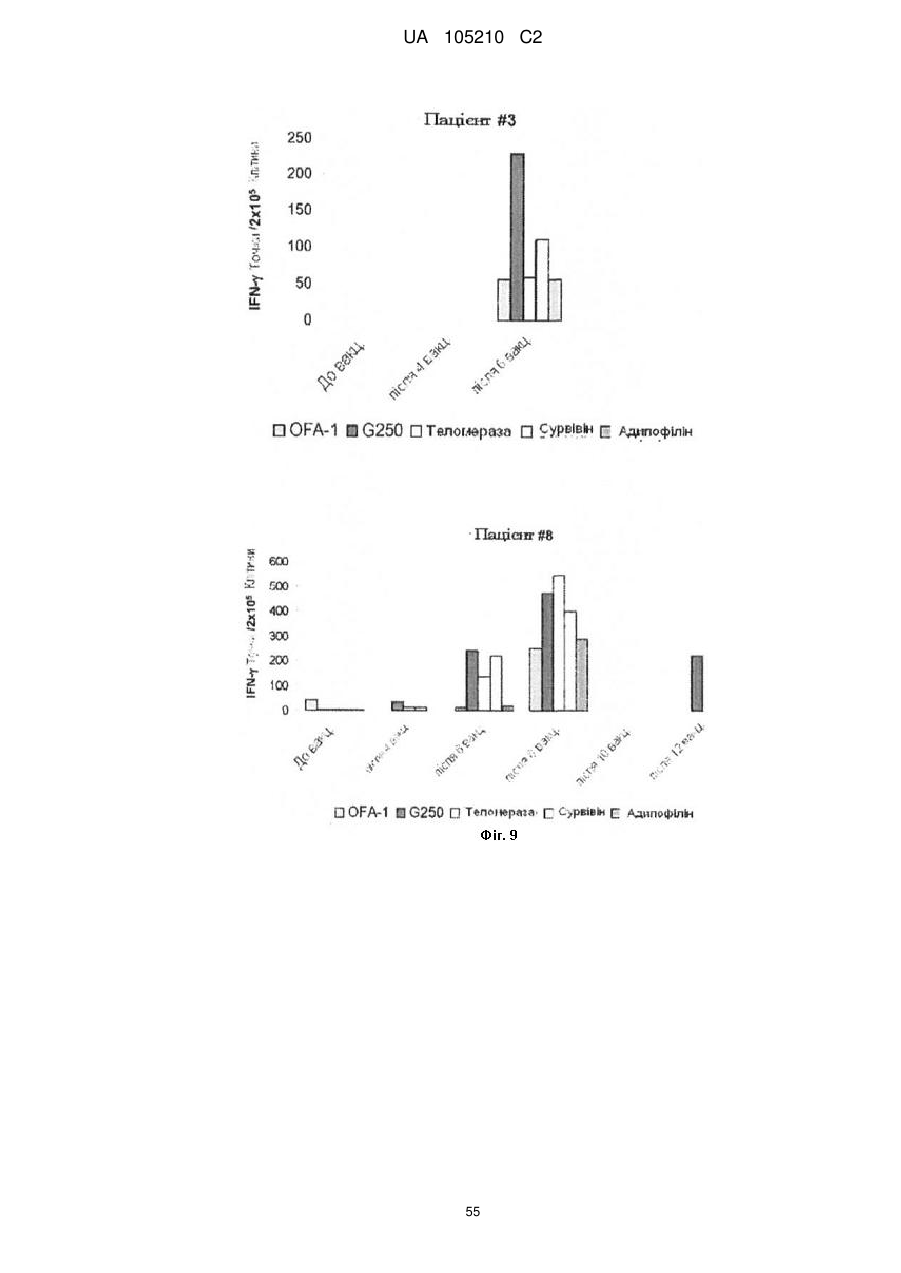
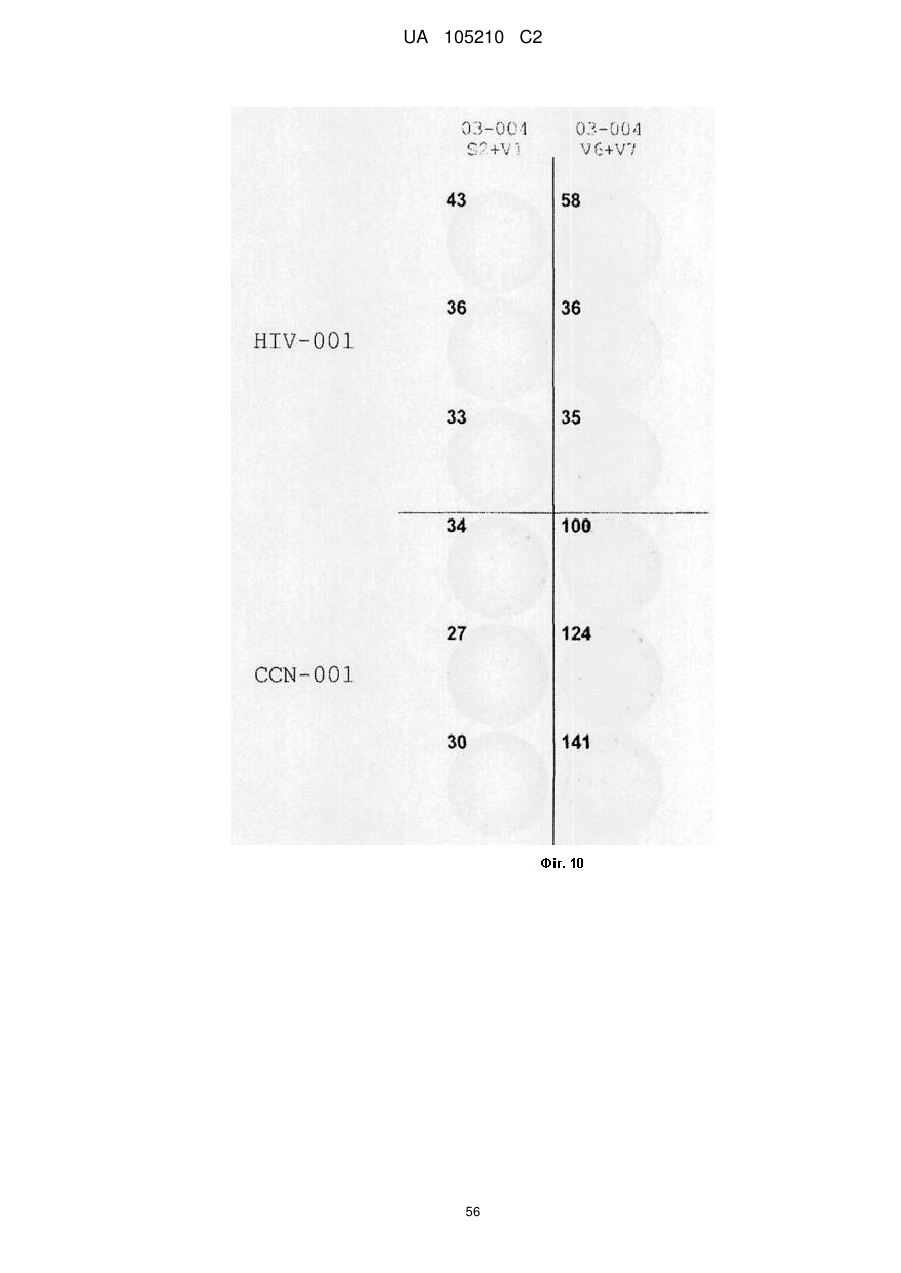
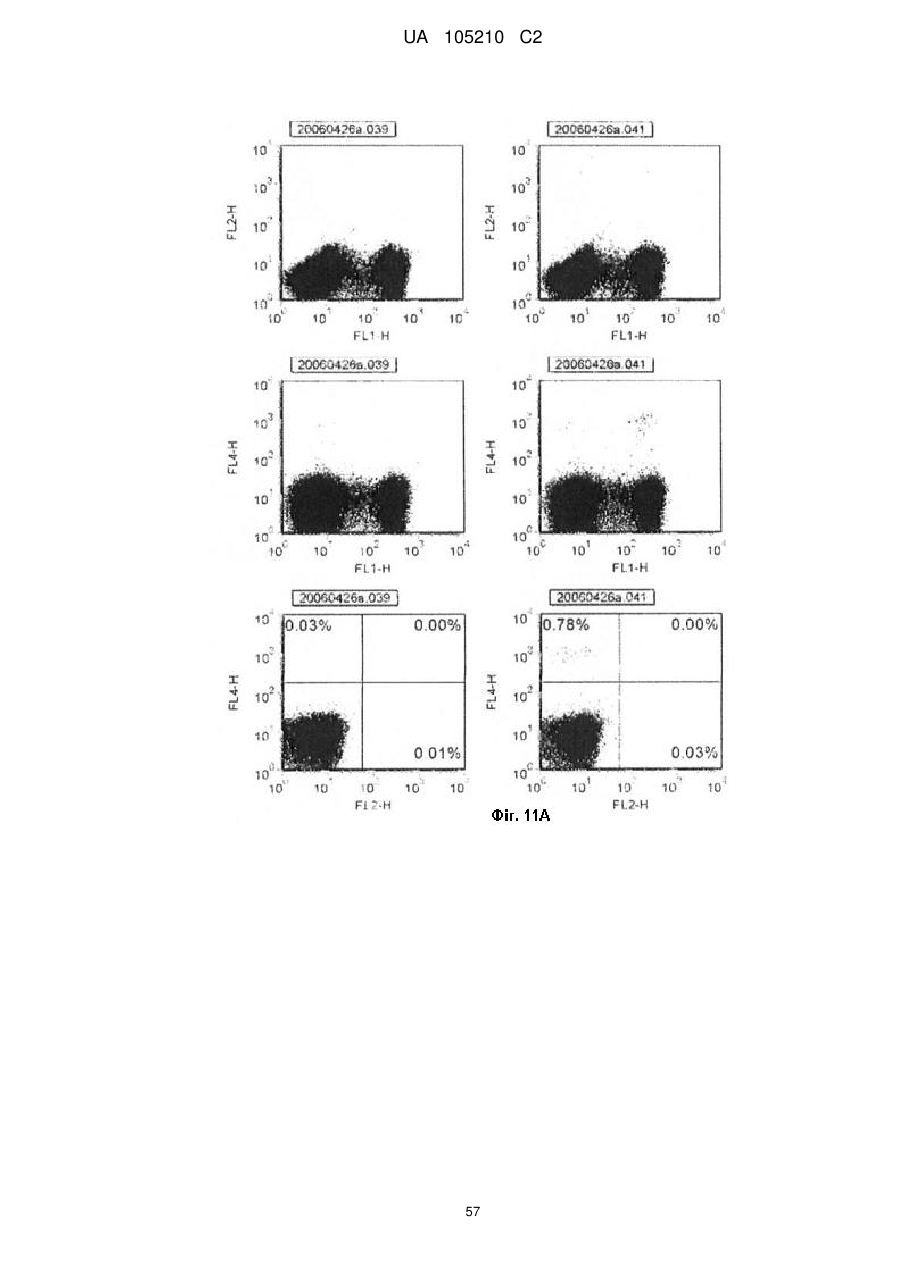
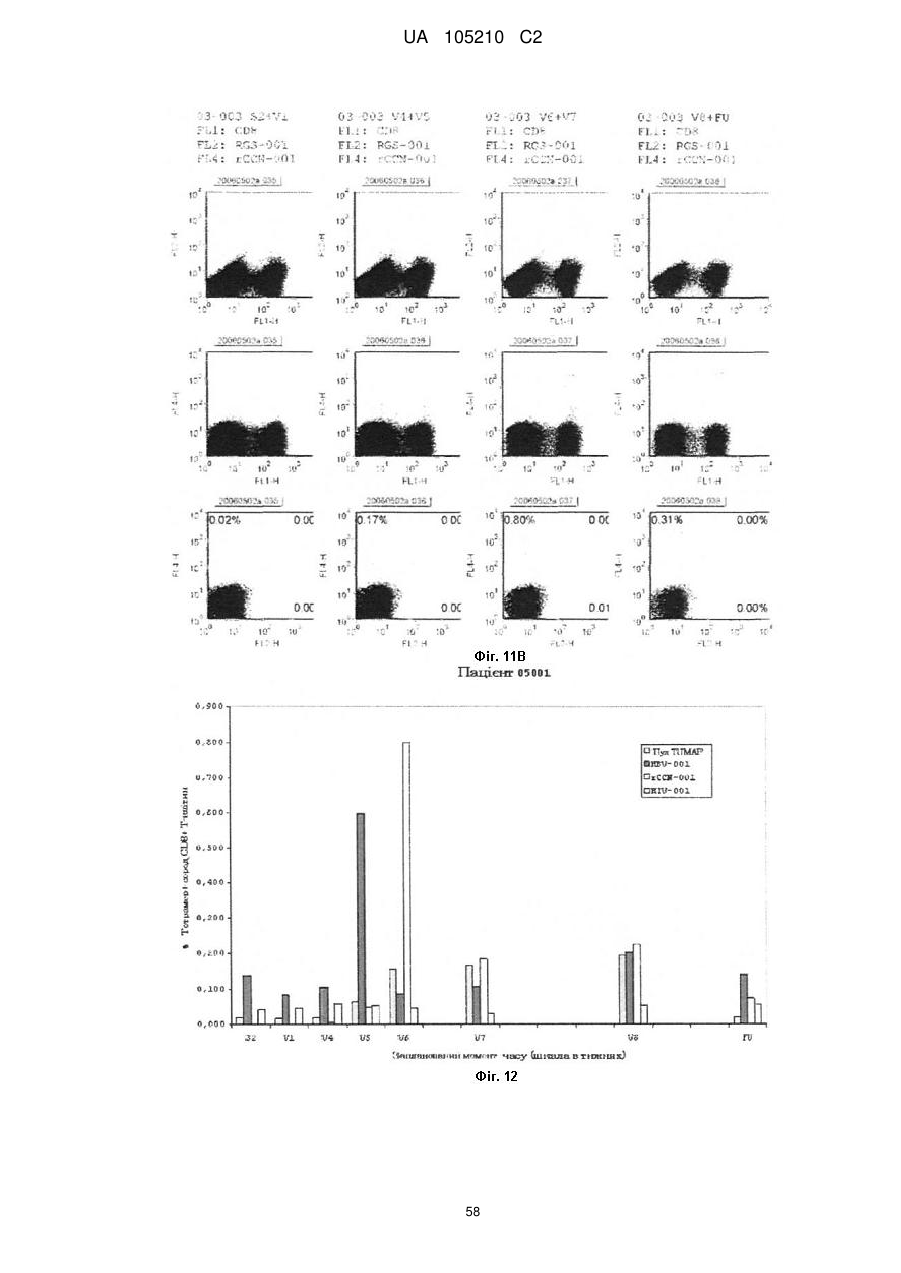
Протиракова вакцина та її застосування
Номер патенту: 105210
Опубліковано: 25.04.2014
Автори: Штеффен Вальтер, Нільс Еммеріх, Харпреет Зінгх, Тоні Вейншенк
Формула / Реферат
1. Протиракова вакцина, що містить пухлино-асоційований пептид, який включає послідовність відповідно до SEQ ID NO: 2, що має загальну довжину від 9 до 30 амінокислот.
2. Протиракова вакцина за п. 1, у якій пептид складається з амінокислотної послідовності відповідно до SEQ ID NO: 2.
3. Протиракова вакцина за п. 1 або п. 2, у якій пептид включає непептидні зв'язки.
4. Протиракова вакцина за будь-яким з пп. 1-3, яка додатково включає принаймні один додатковий пептид, що включає послідовність відповідно до будь-якої з SEQ ID NO: 1 та/або від SEQ ID NO: 3 до SEQ ID NO: 11, де зазначені пептиди мають загальну довжину від 9 до 30 амінокислот.
5. Протиракова вакцина за п. 4, яка включає пептиди, які складаються з амінокислотних послідовностей відповідно до SEQ ID NO: 2, що мають загальну довжину від 9 до 30 амінокислот, та SEQ ID NO: 1 та/або від SEQ ID NO: 3 до SEQ ID NO: 11, що мають загальну довжину від 9 до 16 амінокислот.
6. Протиракова вакцина за будь-яким з пп. 1-5, яка додатково містить принаймні один прийнятний ад'ювант.
7. Протиракова вакцина за п. 6, в якій ад'ювант вибраний з групи факторів стимулювання росту колоній, такий як фактор стимулювання росту колоній гранулоцитів-макрофагів (GM- CSF).
8. Застосування протиракової вакцини відповідно до будь-якого з пп. 1-7 у виробництві лікарського засобу для знищення ракових клітин в пацієнта.
9. Застосування за п. 8, у якому ракові клітини є клітинами гіпернефроми.
Текст
Реферат: Винахід належить до протиракової вакцини, що містить пухлино-асоційований пептид, та до застосування протиракової вакцини у виробництві лікарського засобу для знищення ракових клітин у пацієнта. UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід належить до методів імунотерапії, а також до молекул і клітин, що застосовуються в імунотерапевтичних методах. Зокрема, цей винахід належить до імунотерапії раку, в особливості, раку нирки. Крім того, цей винахід належить до пухлино-асоційованих пептидних епітопів Т-хелперів, окремо або в поєднанні з іншими пухлино-асоційованими пептидами, які виступають активними фармацевтичними інгредієнтами композицій вакцин, стимулюючих протипухлинні імунні реакції. Зокрема, цей винахід належить до двох нових пептидних послідовностей, одержаних з молекул HLA І та II класу ліній пухлинних клітин людини, що можуть використовуватися у вакцинних композиціях для викликання протипухлинних імунних реакцій. В цілях даного винаходу, усі довідкові матеріали, що згадані тут, включені шляхом посилань в усій повноті. Стимулювання імунної реакції залежить від наявності антигенів, що визнані імунною системою хазяїна як чужорідні. Виявлення існування антигенів, асоційованих з пухлинами, надало можливість використовувати імунну систему хазяїна для впливу на ріст пухлини. Зараз досліджуються різні механізми використання як гуморальних, так і клітинних компонентів імунної системи для імунотерапії раку. Окремі елементи клітинної імунної реакції мають здатність безпосередньо розпізнавати та руйнувати клітини пухлин. Ізоляція цитотоксичних Т-лімфоцитів (ЦТЛ) з популяцій пухлинних клітин або з периферичної крові наводить на думку, що такі клітини відіграють значну роль в природних імунних захистах проти раку (Cheever et al., Annals N.Y. Acad. Sci. 1993 690:101-112). + + Зокрема, Т-клітини CD8 (TCD8 ), котрі розпізнають молекули головного комплексу гістосумісності (МНС) Класу І, що презентують пептиди зазвичай в 8-10 залишків, одержані з білків, які розташовані у ядрі чи цитозолі, відіграють важливу роль в цій реакції. МНС-молекули людини також мають назву лейкоцитарних антигенів людини (HLA). Є два класи МНС-молекул: МНС-І-молекули - їх можна знайти на більшості клітин, що мають ядро, котрі представляють пептиди, утворені в результаті протеолітичного розпаду ендогенних білків та більш крупних пептидів. МНС-молекули класу II можна знайти тільки в професійних антиген-презентуючих клітинах (АПК), та вони презентують пептиди екзогенних протеїнів, поглинених клітинами АПК в ході ендоцитозу, і проходять подальшу обробку. Комплекси пептиду та МНС-І розпізнаються СD8-позитивними цитотоксичними Т-лімфоцитами, а комплекси пептиду та МНС-ІІ розпізнаються СD4-позитивними Т-клітинами- хелперами. СD4-позитивні Т-клітини- хелпери грають важливу роль в регуляції ефекторних функцій протипухлинних реакцій Т-клітин, та з цієї причини ідентифікація CD4-позитивних епітопів Тклітин, одержаних з пухлино-асоційованих антигенів (ПАА) може мати велике значення для розробки фармацевтичних продуктів для викликання протипухлинних імунних реакцій (Kobayashi, H., R. Omiya, M. Ruiz, E. Huarte, P. Sarobe, J.J. Lasarte, M. Herraiz, B. Sangro, J. Prieto, F. Borras-Cuesta, and E. Celis. 2002. Identification of an antigenic epitope for helper T lymphocytes from carcinoembryonic antigen. Clin. Cancer Res. 8:3219-3225., Gnjatic, S., D. Atanackovic, E. Jager, M. Matsuo, A. Selvakumar, N.K. Altorki, R.G. Maki, B. Dupont, G. Ritter, Y.T. Chen, A. Knuth, and L.J. Old. 2003. Survey of naturally occurring CD4+T-cell responses against NYESO-1 in cancer patients: Correlation with antibody responses. Proc. Natl. Acad. Sci. U.S.A. 100(15):8862-7). На моделях ссавців, наприклад, мишей, було продемонстровано, що навіть за відсутністю ефекторних клітин цитотоксичних Т-лімфоцитарних (ЦТЛ) ефекторних клітин (тобто, СD8нозитивних Т-лімфоцитів), СD4-позитивні Т-клітини є достатніми для візуалізації інгібування пухлин шляхом інгібування ангіогенезу завдяки секреції гамма-інтерферону (IFNγ) (Qin, Z. and T. Blankenstein. 2000. CD4+T-cell-mediated tumor rejection involves inhibition of angiogenesis that is dependent on IFN gamma receptor expression by nonhematopoietic cells. Immunity. 12:677-686). Крім того, було продемонстровано, що СD4-позитивні Т-клітини, які розпізнають пептиди з пухлино-асоційованих антигенів, представлених молекулами HLA класу II, можуть протидіяти розвитку пухлини шляхом індукування Антитіл (Ab) (Kennedy, R.C., М.Н. Shearer, A.M. Watts, and + R.K. Bright. 2003. CD4 T lymphocytes play a critical role in antibody production and tumor immunity against simian virus 40 large tumor antigen. Cancer Res. 63:1040-1045). На відміну від пухлиноасоційованих пептидів, які зв'язуються з молекулами HLA класу І, лише невелика кількість лігандів класу II ПАА була описана до цього часу (www.cancerimmunity.org, www.syfpeithi.de). Оскільки визначальна експресія молекул HLA класу II зазвичай притаманна лише клітинам імунної системи (Mach, В., V. Steimle, E. Martinez-Soria, and W. Reith. 1996. Regulation of MHC class II genes: lessons from a disease. Annu. Rev. Immunol. 14:301-331), можливість виділення пептидів класу II безпосередньо з первинних пухлин не вважалася ймовірною. Отже, описувались різноманітні стратегії щодо включення відповідних антигенів у шлях перетворення 1 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 класу II антиген-презентуючими клітинами (АПК), наприклад, інкубування АПК з антигеном, що представляє інтерес, для забезпечення можливості його захвату, обробки та презентування (Chaux, P., V. Vantomme, V. Stroobant, К. Thielemans, J. Corthals, R. Luiten, A.M. Eggermont, T. Boon, and B.P. van der Bruggen. 1999. Identification of MAGE-3 epitopes presented by HLA-DR molecules to CD4(+) T lymphocytes. J. Exp. Med. 189:767-778), або трансфекція клітин генами чи міні-генами, що кодують відповідний антиген та включені в інваріантний ланцюжок, який сприяє транслокації антигенів до лізосомного компартменту обробки та компонування МНС класу II (МIIС). Для того, щоб пептид індукував (викликав) клітинну імунну реакцію, він повинен бути зв'язаним з МНС-молекулою. Цей процес залежить від алелі МНС-молекули та специфічного поліморфізму амінокислотної послідовності пептиду. Зв'язані з МНС класу І пептиди зазвичай мають довжину 8-10 залишків, яка вміщує два консервативні залишки ("домени") в своїй первинній амінокислотній послідовності, що взаємодіють з відповідною порожниною зв'язування МНС-молекули. За відсутності запалення, експресія МНС-молекул класу II, переважно, зводиться до клітин імунної системи, зокрема, професійних антиген-презентуючих клітин (АПК), наприклад, моноцитів, клітин, що походять з моноцитів, макрофагів, дендритних клітин. Антигени, котрі розпізнаються пухлиноспецифічними Т-лімфоцитами, тобто, їхні епітопи, можуть бути молекулами, одержаними з будь-яких класів білків, таких як ферменти, рецептори, транскрипційні фактори, та ін. Крім того, пухлиноасоційовані антигени, можуть, наприклад, бути присутні тільки в клітинах пухлин як продукти генів, що мутували. Іншим важливим класом пухлино-асоційованих антигенів є тканино-специфічні структури, такі як СТ-антигени (антигени раку сім'яників), які експресуються в різних видах пухлин та в здоровій тканині сім'яників. Були ідентифіковані різноманітні антигени, асоційовані з пухлинами. Крім того, проведена значна дослідницька робота по ідентифікації додаткових антигенів, асоційованих з пухлинами. Деякі групи асоційованих з пухлинами антигенів, також згадуваних в літературі як пухлиноспецифічні антигени, є тканиноспецифічними. Приклади включають тирозиназу для меланоми, PSA та PSMA для раку простати та хромосомні кросовери (транслокації), такі як bcr/abl в лімфомі, але не обмежуються ними. Однак, ряд ідентифікованих пухлинних антигенів зустрічається в багатьох видах пухлин, а деякі з них, такі як онкогенні білки та/або генисупресори пухлин (огляд генів-супресорів пухлин для раку нирок наведено, наприклад, в роботі Linehan WM, Walther MM, Zbar В. The genetic basis of cancer of the kidney. J Urol. 2003 Dec; 170(6 Pt 1):2163-72), котрі фактично викликають трансформаційну дію, зустрічаються практично в усіх видах пухлин. Наприклад, звичайні білки клітин, контролюючі ріст та диференціацію клітин, такі як р53 (що є прикладом гена-супресора пухлин), ras, c-met, myc, pRB, VHL та HER-2/neu, можуть накопичувати мутації, що призводить до посилення експресії цих генних продуктів, таким чином роблячи їх онкогенними (McCartey et al. Cancer Research 1998 15:58 2601-5; Disis et al. Ciba Found. Symp. 1994 187:198-211). Муцин-1 (MUC1) є високо глікозильованим трансмембранним глікопротеїном типу І, який в надлишку надмірно експресований на клітинний поверхні багатьох аденкарцином людини, таких як рак грудей та рак яєчників. Аберантне деглікозилювання у злоякісних новоутвореннях є типовим та виявляє епітопи в пухлинних клітинах, котрі не могли б бути присутніми на нормальних клітинах. Крім того, експресія MUC1 була продемонстрована в множинній мієломі та деяких В-клітинних лімфомах, інших ніж лімфома Ходжкіна (Gendler S, Taylor-Papadimitriou J, Duhig T, Rothbard J, and Burchell J. A highly immunogenic region of a human polymorphic epithelial mucin expressed by carcinomas is made up of tandem repeats. J. Biol. Chem. 263:12820-12823 (1988); Siddiqui 1988; Girling A, Bartkova J, Burchell J, Gendler S, Gillett C, and Taylor-Papadimitriou J. A core protein epitope of the polymorphic epithelial mucin detected by the monoclonal antibody SM3 is selectively exposed in a range of primary carcinomas. Int. J. Cancer 43:1072-1076 (1989); Brossart 1999; Duperray 1989; Mark 1989; Delsol 1988; Apostolopoulos V and McKenzie IF. Cellular mucins: targets for immunotherapy. Crit Rev. Immunol. 14:293-309 (1994); Firm OJ, Jerome KR, Henderson RA, Pecher G, Domenech N, Magarian-Blander J, and Barratt-Boyes SM. MUC-1 epithelial tumor mucin-based immunity and cancer vaccines. Immunol. Rev. 145:61-89 (1995)). Кілька недавніх наукових робіт (Apostolopoulos V and McKenzie IF. Cellular mucins: targets for immunotherapy. Crit Rev. Immunol. 14:293-309 (1994); Finn OJ, Jerome KR, Henderson RA, Pecher G, Domenech N, Magarian-Blander J, and Barratt-Boyes SM. MUC-1 epithelial tumor mucin-based immunity and cancer vaccines. Immunol. Rev. 145:61-89 (1995); Barnd 1989; Takahashi 1994; Noto 1997) продемонстрували, що цитотоксичні МНС-необмежені Т-клітини з пухлин яєчників, грудей, підшлункової залози та множинної мієломи можуть розпізнавати епітопи корового білка MUC1, локалізовані в тандемному повторі. Були ідентифіковані два НЬА-А2-обмежених епітопи Т 2 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітин, одержані з білка MUC1 (Brossart 1999, ЕР 1484397). Один пептид одержується з ділянки тандемного повтору білка MUC1. Другий пептид локалізується в межах сигнальної послідовності MUC1. Індукування реакцій цитотоксичних Т-лімфоцитів in vivo після вакцинацій пацієнтів з запущеним раком грудей чи яєчників дендритними клітинами, в які імпульсним шляхом введені ці пептиди, було успішним (Brossart 2000) (Wierecky 2005). Що стосується гіпернефроми, експресія MUC1 є спільною в умовних пухлинах, та були наведені дані про її зв'язок зі ступенем та стадією пухлини (Fujita 1999; Kraus 2002; Leroy 2002; Bamias 2003; Cao 2000). Щодо MUC1, надмірна експресія білка не співвідноситься з надмірною експресією мРНК. Адипофілін є маркером для спеціалізованих диференційованих клітин, які вміщують ліпідні краплини, та для хвороб, що асоціюються з клітинами, акумулюючими жири (Heid 1998). Адипофілін зустрічається в широкому діапазоні культивованих клітинних ліній, включаючи фібробласти, клітини ендотелія та епітелія. Однак, в тканинах експресія адипофіліна обмежується окремими типами клітин, такими як клітини епітелію грудей під час годування, клітин кори надниркових залоз, клітин Sertoli та Leydig чоловічої репродуктивної системи, та стеатозом чи гепатоцитами з жировим переродженням при алкогольному цирозі печінки (Heid 1998). С дані про те, що адипофілін надмірно експресований в колоректальному раку (Saha 2001), гепато-клітинній карциномі (Kurokawa 2004) та в гіпернефромі (Young 2001). c-Met кодує гетеродимерічний трансмембранний рецептор з тирозин-кіназною активністю, що складається з α-ланцюга, котрий за допомогою дисульфіду зв'язується з β-субодиницею (Bottaro 1991; Rubin 1993). Обидві субодиниці експресуються на поверхні, важка β-субодиниця відповідає за зв'язування ліганду, фактора росту гепатоцитів (HGF); α-субодиниця вміщує внутрішньоклітинний домен, який сприяє активації різних шляхів сигнальної трансдукції. Передача сигналів c-Met бере участь в регенерації органів, як було показано для печінки та нирки, ембріогенезі, гематопоезі, розвитку м'язів та в регуляції міграції та зцеплення нормально активованих В-клітин та моноцитів (Zarnegar 1995; Naldini 1991; Montesano 1998; Schmidt 1995; Uehara 1995; Bladt 1995; Takayama 1996; Mizuno 1993; van, V 1997; Beilmann 2000). Крім того, різні дослідження вказують на участь надмірної експресії c-Met в злоякісній трансформації та інвазивності ракових клітин. c-Met виступає посередником в багатофункціональній та потенційно онкогенній активності HGF-фактора/коефіцієнта розсіювання, включаючи сприяння росту клітин, рухомості, виживаності, позаклітинному матричному розпаду та ангіогенезу (Bottaro 1991; Rubin 1993; Zarnegar 1995). Зв'язування HGF з рецептором індукує аутофосфорилювання c-Met та активує передачу сигналів по низхідній, включаючи ras, фосфатидилінозітол 3'-кіназу, фосфоліпазу Сγ та мітоген-активовані білкові кіназо-зв'язані шляхи (Naldini 1991; Montesano 1998; Furge 2000; Ponzetto 1993; Dong 2001; Furge 2001). Ген c-Met експресується, переважно, в епітеліальних клітинах та надмірно експресується в кількох злоякісних тканинах та клітинних лініях (Di Renzo 1995; Ferracini 1995; Tuck 1996; Koochekpour 1997; Li 2001; Fischer 1998; Maulik 2002; Qian 2002; Ramirez 2000). Все більша кількість наукових робіт демонструє, що не епітеліальні клітини, такі як гематопоетичні, невральні та скелетні клітини реагують на HGF, та гематологічні злоякісні новоутворення, такі як множинна мієлома, хвороба Ходжкіна, лейкемія, експресують c-Met-білок (Gherardi 1991; Teofili 2001; Borset 1999; Jucker 1994; Pons 1998). Дерегульований контроль фенотипу інвазивного росту онкогенно активованим c-Met, що викликаний c-Met-активуючими мутаціями, посилення/ надмірна експресія c-Met та здобуття аутокрінних петель HGF/c-Met надає інвазивні та метастатичні властивості раковим клітинам. В особливості, значна активація c-Met у трансгенних мишей, надмірно експресуючих HGF, сприяє поширеному пухлиногенезу (Wang 2001; Takayama 1997). Регулятор передачі сигналів G-білка 5 (RGS5) є негативним регулятором шляхів передачі сигналів гетеротриметричного G-білка, хоча його функція in vivo залишається неясною. RGSбілки утворюють сімейство молекул з унифікованою каталітичною функцією, але з різним розповсюдженням у тканинах. Вони стимулюють внутрішню гуанозин-трифосфатазну (GTPase) активність активованих субодиниць Got і таким чином прискорюють інактивацію G-білка. Отже, RGS-молекули інгібують передачу сигналів рецепторів, зв'язанихз G-білком, по низхідній (De 2000). За останній час було продемонстровано, що індукування Регулятора передачі сигналів О-білка-5 в перицитах співпадає з активною реконструкцією судин протягом неоваскуляризації пухлини. У моделі клітинного канцерогенезу панкреатичного острівка у мишей, а також у високоангіогенних астроцитомах, надмірна експресія RGS5 була продемонстрована в періцитах протягом ангіогенного переключення, що супроводжує активну реконструкцію судин. Надмірна експресія була обмежена судинною системою пухлини, у порівнянні з нормальним островком Лангерганса. Однак, RGS5 також демонструє підвищуючу регуляцію при заживленні ран та овуляції (Berger 2005). 3 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 Експресія RGS5 збільшується в RCC (Rae 2000). Ще в одному дослідженні RT-PCR (полімеразна ланцюгова реакція в режимі реального часу) демонструвала сильну експресію RGS5 в усіх досліджених RCC, та експресія була дуже слабкою чи не визначальною в нормальних нирках (6.6:1 при PCR в режимі реального часу). Ендотеліальні клітини пухлини були основним місцем локалізації RGS5 в RCC (Furuya 2004). Крім того, як повідомлялося, RGS5 є синусоїдальним маркером ендотеліальних клітин в гепато-клітинній карциномі (Chen 2004). Аполіпопротеїн LI (APOL1) є виділеним ліпопротеїном високої щільності, який зв'язується з аліпопротеїном А-І. Аполіпопротеїн А-1 - відносно розповсюджений плазмовий білок та є основним апопротеїном HDL (ліпопротеїну високої щільності). Він бере участь у формуванні більшості холестерилових ефірів у плазмі і також сприяє видаленню холестерину з клітин. Аполіпопротеїн L1 може відігравати роль в обміні і транспортуванні ліпідів по тілу, а також у реверсивному транспортуванні холестерину з периферійних клітин до печінки. Плазмовий білок - єдиний ланцюговий поліпептид з приєднаною молекулярною масою в 40 kDa (Duchateau 1997; Duchateau 2001). АРОЫ кДНК була виділена з бібліотеки кДНК активованих ендотеліальних клітин, та була показана її підвищена регуляція TNF-α, котрий є потенційно ирозапалювальним цитокіном. (Monajemi 2002). КІАА0367 був ідентифікований в Проекті Kazusa кДНК, націленому на ідентифікацію невідомих довгих транскриптів людини, які кодують перспективні білки (Ohara 1997). Хоча функція передбачуваного 820-амінокислотного довгого продукту КІАА0367 невідома, він вміщує ліпіднозв'язуючий доменний профіль CRAL-TRIO на С-кінці, котрий зв'язує малі гідрофобні молекули, і що є присутнім в декількох нуклеотидообмінних факторах та в ВCL2/аденовірусЕ1В 19-kDa білково-взаємодіючому білку 2 (BNIP-2). BNIP-2 бере участь в контролі різноманітних функцій клітин, включаючи клітинну морфологію, міграцію, ендоцитоз та прогресію клітинного циклу (Zhou 2005). КІАА0367 знаходиться на хромосомній ділянці 9q21. Ця ділянка описується як спільна мішень гомозіготного видалення в багатьох пухлинах (Gursky 2001; Weber 2001) чи втрата гетерозіготності (Louhelainen 2000; Tripathi 2003). Розчинна гуанілат-циклаза (sGC), гетеродимерний білок, що складається з альфа- та бетасубодиниць (1 гемова група), каталізує перетворення GTP в другий месенджер cGMP та функціонує як основний рецептор для оксиду азоту та нітровазодиляторних ліків (Zabel 1998). GUCYa3 та b3 надмірно експресовані у гліомах людини. Трансфекція антисенсних GUCY1A3 чи GUCY1B3 зменшувала васкуляризацію та ріст пухлини у "голих" мишей. Це може бути обумовлено тим фактом, що VEGF індукується cGMP (Saino 2004). GUCY1A3 сприяє міграції пухлинних клітин клітинної лінії пухлин молочної залози у мишей (Jadeski 2003). Циклін D1 належить до сімейства висококонсервативних циклінів, зокрема до підсімейства цикліну D (Xiong 1991; Lew 1991). Цикліни функціонують як регулятори CDK (цикліно-залежні кінази). Різні цикліни демонструють визначені моделі експресії та розпаду, що робить свій внесок у тимчасову координацію кожної мітотичної події (Deshpande 2005). Циклін D1 формує комплекс з CDK4 або CDK6 та функціонує як регуляторна підгрупа CDK4 чи CDK6, активність яких вимагається для переходу G1/S клітинного циклу. CCND1 формує з CDK4 та CDK6 серин/треонін-кіназний повноферментний комплекс та надає йому субстратну специфічність (Bates 1994). Як було продемонстровано, білок взаємодіє з білком-супресором пухлин Rb (Loden 2002), та експресія цього гена позитивно регулюється Rb (Halaban 1999). Мутації, ампліфікація та надмірна експресія цього гена, що змінює розвиток клітинного циклу, часто спостерігається в різноманітних пухлинах та може сприяти пухлиногенезу (Hedberg 1999; Vasef 1999; Troussard 2000). Білки сімейства матричної металопротеїнази (ММР) беруть участь у руйнуванні позаклітинної матриці в нормальних фізіологічних процесах, таких як розвиток ембріону, репродукція, ремоделювання тканин, а також у патологічних процесах, таких як артрит та метастазування (Molt 2004). Матрична металопротеїназа 7 (ММР7) виділяється як пасивний пропротеїн 29.6 kDa, що активується при розщепленні позаклітинними протеїназами. Активний фермент має молекулярну масу 19,1 kDa та зв'язує два іони цинку та два іони кальцію на підгрупу (Miyazaki 1990; Browner 1995). ММР7 розпадається на желатини, фібронектин та казеїн (Miyazaki 1990; Quantin 1989) і відрізняється від більшості членів сімейства ММР тим, що не вміщує консервативного С-термінального білкового домену (Gaire 1994). ММР7 часто виявляється надмірно експресованою в злоякісній тканині (Lin 2004; Bramhall 1997; Denys 2004), та існують думки, що вона сприяє інвазії пухлинних клітин in vivo (Wang 2005). Ці білки можуть бути мішенню пухлиноспецифічної імунної реакції при багатьох видах ракових захворювань. 4 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пептид HBV-001 внутрішнього антигену вірусу Гепатиту В не має походження з ендогенного пухлино-асоційованого антигену людини, а одержується з внутрішнього антигену вірусу Гепатиту В. По-перше, він дозволяє кількісно порівняти величину Т-клітинних реакцій, індукованих TUMAP, і таким чином, зробити важливі висновки щодо здатності викликати протипухлинні реакції. По-друге, вій функціонує як важливий позитивний контроль у випадку відсутності будь-яких Т-клітинних реакцій у пацієнта. По-третє, він також дозволяє визначити статус імунокомпетентності пацієнта. Інфекція, викликана вірусом Гепатиту В (HBV), є одною з основних причин захворювання печінки, від якого страждають приблизно 350 мільйонів людей в усьому світі (Rehermann 2005). Внаслідок легкості передачі горизонтальним та вертикальним шляхом та потенціалу переходу у хронічну форму, що може призвести до цирозу печінки та гепато-клітинної карциноми, HBV завдає серйозного впливу системі охорони здоров'я в багатьох країнах світу. Геном HBV (Previsani 2002) складається з частково двониткової кільцевої ДНК. У віріонах HBV, він компонується разом із капсидним білком НВс та іншими білками для формування нуклео-капсиду, що знаходиться в зовнішній оболонці, яка вміщує ліпіди та HBs сімейства поверхневих білків (також називається "оболонковий білок"). Антигенні детермінанти, що асоціюються з НВс та HBs, відомі як HBcAg та HBsAg, відповідно. Ці антигени зв'язані з серологічними реакціями, тобто, реакціями антитіл, що визначаються у крові пацієнтів та є одними з найбільш клінічно прийнятних систем антигенів-антитіл для діагностування HBVінфекції. НВс буде представляти новий чужорідний антиген для усіх осіб, які не мають попередньої історії HBV-інфекції. Оскільки імуногенні пептиди добре відомі для цього антигену (Bertoletti 1993; Livingston 1997), один пептид з десяти амінокислот з HBcAg був вибраний як позитивний контроль антигену в ІМА. Індукування НВс-пентидо-специфічних ЦТЛ буде згодом використовуватись як маркер імунокомпетентності пацієнта та успішної вакцинації. Імунотерапія у пацієнтів, хворих на рак, націлена на активацію, зокрема клітин імунної системи, в особливості, так званих цитотоксичних Т-клітин (CTL, відомих як "клітини-кілери", також називаються СD8-позитивними Т-клітинами), проти пухлинних клітин, але не проти здорових тканин. Пухлинні клітини відрізняються від здорових клітин експресією пухлиноасоційованих білків. HLA-молекули на клітинній поверхні презентують клітинний вміст назовні, таким чином дозволяючи цитотоксичній Т-клітині проводити диференціацію між здоровою та пухлинною клітиною. Це реалізується за допомогою розбивки усіх білків всередині клітини на короткі пептиди, котрі потім додаються до молекул HLA та презентуються на клітинній поверхні (Rammensee 1993). Пептиди, що презентовані на пухлинних клітинах, але не презентовані (або в незначній мірі презентовані) на здорових клітинах тіла, називаються пухлино-асоційованими пептидами (TUMAP). Перші клінічні випробування з використанням пухлино-асоційованих пептидів розпочали в середині 90-х років минулого століття Бун (Boon) та його колеги, в основному, для індикації меланоми. Клінічні реакції в найбільш вдалих випробуваннях варіювалися від 10 % до 30 %. Тяжкі побічні ефекти чи серйозна аутоімунність не повідомлялися в будь-яких клінічних випробуваннях із використанням монотерапії вакциною на основі пептидів. Є дані про вітиліго у слабкій формі, що спостерігалася у деяких пацієнтів, які проходили лікування пептидами, асоційованими з меланомою. Однак, примування одного виду ЦТЛ зазвичай є недостатнім для знищення усіх пухлинних клітин. Пухлини дуже мутагенні і, таким чином, здатні швидко реагувати на атаки ЦТЛ, змінюючи свою білкову модель для уникнення розпізнавання цитотоксичними Т-лімфоцитами. З метою протидії пухлинним механізмам уникнення, для вакцинації використовується широкий діапазон специфічних пептидів. Таким способом, проти клітини може бути розпочата широка одночасна атака відразу кількома ЦТЛ-клонами. Це може зменшити шанси того, що пухлина уникатиме імунної реакції. Ця гіпотеза недавно була підтверджена клінічним дослідженням лікування пацієнтів, хворих на меланому в останній стадії… Лише з кількома винятками, пацієнти, що мали якнайменш 3 визначені Т-клітинні реакції, продемонстрували об'єктивні клінічні реакції чи стабілізацію захворювання (Banchereau 2001), а також збільшену виживаність (інформація одержана при особистому спілкуванні з J. Banchereau), в той час як широкій більшості пацієнтів з менш ніж 3 Т-клітинними реакціями діагностувалося прогресуюче захворювання. До цього часу, були описані різноманітні стратегії щодо включення антигенів до шляхів перетворення класу II або І. Можна інкубувати антигенпрезентуючі клітини (АПК) з відповідним антигеном, що представляє інтерес, для його прийняття та обробки (Chaux, P., Vantomme, V., Stroobant, V., Thielemans, К., Corthals, J., Luiten, R., Eggermont, A.M., Boon, T. & van der, B. P. (1999) J. Exp Med 189, 767-778. Dengjel J, Schoor O, Fischer R, Reich M, Kraus M, Muller M, Kreymborg K, Altenberend F, Brandenburg J, Kalbacher H, Brock R, Driessen C, Rammensee HG, Stevanovic S. Autophagy promotes MHC class II presentation of peptides from intracellular source 5 UA 105210 C2 5 10 15 20 25 30 proteins. Proc Natl Acad Sci USA. 2005 May 31;102(22):7922-7.). Інші стратегії використовують гібридні білки, які вміщують цільові послідовності для лізосом. Такі гібридні білки, експресовані в АПК, направляють антигени до ділянки обробки класу II (Marks, M. S., Roche, P. A., van Donselaar, E., Woodruff, L., Peters, P.J. & Bonifacino, J.S. (1995). J Cell Biol 131, 351-369, Rodriguez, F., Harkins, S., Redwine, J.M., de Pereda, J.M. & Whitton, J. L. (2001)7. Virol. 75, 1042110430). Для того, щоб білки розпізнавалися цитотоксичними Т-лімфоцитами (ЦТЛ) як пухлиноспецифічні антигени, та з метою використання в лікуванні, треба дотримуватися деяких попередніх умов. Антиген має бути синтезований, головним чином, клітинами пухлин, а не нормальними здоровими тканинами, чи він має бути присутній в здорових клітинах в достатньо невеликих кількостях. Крім того, бажано, щоб відповідний антиген був не тільки присутній в одному виді пухлин, але також знаходився у високих концентраціях (наприклад, кількість копій на клітину). Істотною є присутність епітопів в амінокислотній послідовності антигену, оскільки такий пептид ("імуногенний пептид"), котрий одержується з асоційованого з пухлиною антигену, повинен призводити до Т-клітинної реакції in vitro чи in vivo. Приблизно 30 % пацієнтів страждають від метастазування, коли описується картина захворювання, та ще 25 % пацієнтів мають локально запущені пухлини. У 40 % осіб, які пройшли хірургічне втручання, з часом розвиваються метастази. Серед осіб з метастазуванням, приблизно 75 % мають метастази в легенях, 36 % - ураження лімфатичних вузлів та/або м'яких тканин, 20 % - ураження кісток та 18 % мають ураження печінки. Виживаність протягом 5 років варіюється в залежності від класифікації стадій захворювання за Робсоном. Усі разом, RCC залишаються смертельними приблизно у 80 % пацієнтів (Senn HJ, Drings P, Glaus A, Jungi WF, Pralle НВ, Sauer R, and Schlag PM. Checkliste Onkologie, 5th edition. Georg Thieme Verlag, Stuttgart/New York (2001), Vokes ЕЕ, and Golomb HM. Oncologic Therapies, 2nd edition. SpringerVerlag, Berlin/Heidelberg (2003). Класифікація гіпернефроми виконується відповідно до класифікації TNM (розмір пухлини, стан лімфовузлів та наявність метастаз) (Guinan P. TNM Staging of Renal Cell carcinoma. Presented at 'Diagnosis and prognosis of Renal Cell Carcinoma: 1997 Workshop', Rochester, Minnesota, March21-22, Communication of the UICC-Union Internationale Contre le Cancer, and AJCC-American Joint Committee on Cancer, published by ASC-American Society Cancer (1997), Communication of the UICC), див. таблиці А та В нижче. Таблиця А: TNM-класифікація гіпернефроми Т1 7,0 см, обмежується ниркою N2 Т3 Т4 інвазія в основні вени, надниркові залози чи периренальну область інвазія за межі Gerota fascia Стадії по AJCC TNМ-класифікація Стадія І Стадія II Стадія III Стадія IV Т1 Т2 Т1 Т2 Т3 Т4 АnуТ АnуТ N0 N0 N1 N1 N0, N1 N0, N1 N2 Any N М0 М0 М0 М0 М0 М0 М0 M1 35 6 один регіонарний лімфовузол більш ніж один регіонарний лімфовузол М0 ніяких віддалених метастаз M1 віддалені метастази UA 105210 C2 Таблиця В: Класифікація стадій гіпернефроми за Робсоном та 5-річна виживаність Класифікація стадій за Робсоном Стадія І/II Стадія III Стадія IV (Т4) Стадія IV (МІ) 5-річна виживаність* 75 % - 86 % 41 %-64 % 15 %- 18 % 0%-3% * Американська Фундація Урологічних Захворювань 5 10 15 20 25 30 35 40 45 Стандартне лікування RCC - це радикальна нефректомія (для усіх стадій). Радіаційна терапія може використовуватись для зменшення поширення раку, але гіпернефроми часто стійкі до опромінювання. Гормональна терапія може зменшити зростання пухлини в деяких випадках (менш, ніжна 10 %). На даний час хіміотерапія не показала якоїсь значної активності в цьому захворюванні. Вінбластин, 5-FU (5-фторурацил) та флоксуридан (FUDR) є хіміотерапевтичними ліками, котрі найбільш вивчені, але тільки 5-FU та його метаболіт FUDR продемонстрували ступінь активності в 10-12 % (Vokes ЕЕ, and Golomb HM. Oncologic Therapies, 2nd edition. Springer-Verlag, Berlin/Heidelberg (2003)). Комбінація гемцитабіну та 5-FU дала ефективність в 17 %. Імунологічним лікам, наприклад, альфа-інтерферону (IFNα) або Інтерлейкіну-2 (IL-2), в останні роки дали оцінку регуляторні органи в США та в Європі, відносно лікування запущеної RCC. На цей час призначення IL-2 у великих дозах являє собою єдиний імунологічний режим, ухвалений FDA. Спочатку були наведені дані, що монотерапія IFNα має ефективність 25-30 %, але ряд додаткових випробувань показав, що істинна дієвість становить лише 10 % (Vokes ЕЕ, and Golomb HM. Oncologic Therapies, 2nd edition. Springer-Verlag, Berlin/Heidelberg (2003)). IL-2, як виявилось, має подібну загальну ефективність, в порівнянні з IFNα, з приблизно 5 % пацієнтів, що досягли тривалої повної ремісії (Rosenberg 1987). Недавній мета-аналіз більш, ніж 6000 пацієнтів з запущеними випадками RCC дозволив зробити висновок, що в середньому лише 12,9 % клінічних реакцій можна досягти цитокіновою терапією (наприклад, альфа-IFN, бюлюсним введенням великих доз IL-2, або інгаляціями IL-2). Той самий аналіз показав 4,3 %реакцію на плацебо та 2,5 %-реакцію на неімунотерапевтичні засоби контролю хвороби (Cochrane Database Syst Rev. 2000; (3):CD001425. Immunotherapy for advanced renal cell cancer. Coppin C, Porzsolt F, Awa A, Kumpf J, Coldman A, Wilt T). Хоча нові методи лікування показали клінічну ефективність в багатьох випадках пухлин та були ухвалені в останні роки, виживаність у випадках гіпернефроми не зазнала якихось значних змін за останнє десятиріччя. Наявні на цей час варіанти системного лікування, хіміотерапія, а також імунологічне лікування, показали досить слабку ефективність та, що більш важливо, вони обмежуються значною системною токсичністю. Отже, є незадоволена медична потреба в нових варіантах лікування гіпернефроми. Т-хелпери відіграють важливу роль в регуляції ефекторної функції ЦТЛ в протипухлинному імунітеті. Епігони Т-хелперів, що запускають реакцію цих клітин типу ТН1, підтримують + ефекторні функції CD8 Т-клітин- кілерів, котрі включають цитотоксичні функції, спрямовані проти клітин пухлин, що експресують комплекси пухлино-асоційованого пептиду/МИС на своїх клітинних поверхнях. Таким способом, пептидні епітопи Т-хелперів, самостійно чи в комбінації з іншими пухлино-асоційованими, можуть служити активними фармацевтичними інгредієнтами композицій вакцин, які стимулюють протипухлинні імунні реакції. Основна задача розробки протипухлинної вакцини полягає, таким чином, в ідентифікації та характеристиці нових асоційованих з пухлинами антигенів та епітопів імуногенних Т-хелперів, які походять з них, що можуть розпізнаватися CD8-позитивними Т-клітинами або СD4позитивними Т-клітинами, зокрема, CD4-позитивними Т-клітинами ТH1-типу. Отже, задача цього винаходу полягає в знаходженні нових амінокислотних послідовностей для таких пептидів, що мають здатність зв'язуватися з молекулою головного комплексу гістосумісності людини (МНС) классу І (HLA класу І) або II (HLA класу II). Додаткова задача цього винаходу полягає в наданні ефективної протиракової вакцини, котра принаймні частково базується на цих нових пептидах. Відповідно до цього винаходу, перша задача вирішується визначенням пухлиноасоційованого пептиду, що вибирається з групи пептидів, яка вміщує принаймні послідовність відповідно до будь-якої послідовності SEQ ID NО: 1 або SEQ ID NО: 2 доданого переліку, де 7 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 пептид має здатність зв'язуватися з молекулою головного комплексу гістосумісності людини (МHС) класу II (HLA класу II), а також може зв'язуватися з молекулою головного комплексу гістосумісності людини (МНС) класу І (HLA класу І), за умови, що пептид не є неушкодженим пухлино-асоційованим поліпептидом людини. В цьому винаході автори демонструють, що є можливість виділити та характеризувати пептиди, що зв'язуються з молекулами HLA класу І чи II, безпосередньо з пухлин ссавців, переважно, пухлин людини, зокрема гіпернефром. Цей винахід надає пептиди, що походять з антигенів, які асоціюються з пухлиногенезом, та мають здатність зв'язуватися в достатній мірі з HLA-молекулами класу II для запуску імунної реакції лейкоцитів людини, зокрема, лімфоцитів, в особливості, Т-лімфоцитів, головним чином, СD4-позитивних Т-лімфоцитів, а конкретніше, СО4-позитивних Т-лімфоцитів, що виступають посередниками в імунних реакціях ТH1-типу. Цей винахід також надає пептиди, котрі походять з антигенів, асоційованих з пухлиногенезом, та мають здатність зв'язуватися в достатній мірі з HLA-молекулами класу І для запуску імунної реакції лейкоцитів людини, зокрема, лімфоцитів, в особливості, Т-лімфоцитів, головним чином, СD8-позитивних цитотоксичних Т-лімфоцитів. Пептиди мають походження з пухлиноасоційованих антигенів, зокрема пухлиноасоційованих антигенів з функціями, наприклад, в протеолізі, ангіогенезі, рості клітин, регуляції клітинного циклу, діленні клітин, регуляції транскрипції, регуляції трансляції, інвазії тканин, включаючи, наприклад, пухлиноасоційовані пептиди з матричної металопротеїнази 7 (ММР7; SEQ ID №.1) та Аполіпопротеїну LI (APOL1; SEQ ID No. 4). В цьому винаході автори надають незаперечний доказ того, що пухлиноасоційовані пептиди, які в достатній мірі неспецифічно зв'язуються з молекулами HLA класу II, зокрема ті алелі HLA класу II, що генетично кодуються локусами HLA DR геному людини, мають здатність викликати імунні реакції, в яких посередниками виступають СD4-позитивні Т-клітини людини. СD4позитивні Т-клітини були виділені з периферичної крові людини, демонструючи те, що заявлені пептиди є прийнятними для запуску Т-клітинних реакцій імунної системи людини проти вибраних пептидів в пептидомі пухлинної клітини. Як показано нижче на прикладі пептиду з ММР7 (SEQ ID No. 1), було виявлено, що цей неспецифічно зв'язуваний з HLA-DR пухлиноасоційований пептид розпізнається СП4-позитивними Т-клітинами. Подібним чином, було виявлено, що пухлиноасоційовані пептиди, які достатньою мірою зв'язуються з HLA-молекулами класу І, здатні викликати імунні реакції, де посередниками виступають СD8-позитивні цитотоксичні Т-лімфоциги людини, і також продемонстровано, що заявлені пептиди є прийнятними для запуску реакцій імунної системи людини проти обраних пептидів пептидому пухлинної клітини. Оскільки пептиди можуть синтезуватись хімічним способом та використовуватись як активні фармацевтичні інгредієнти фармацевтичних препаратів, пептиди, запропоновані в цьому винаході, можна використовувати для імунотерапії, переважно імунотерапії раку. Щоб ідентифікувати ліганди HLA класу І чи II з ПАА для розробки імунотерапії на основі пептидів, автори винаходу зробили спробу виділити пептиди безпосередньо з солідних пухлин, зокрема, гіпернефром (RCC) (див. приклади нижче). Причини того, що RCC була вибрана для демонстрації технічних доказів концепції, викладені нижче: Близько 150 000 людям в усьому світі кожного року ставиться діагноз "гіпернефрома" (RCC), хвороба, що асоціюється з високим рівнем смертності та призводить приблизно до 78000 смертей на рік (Pavlovich, СР. and L.S. Schmidt. 2004. Searching for the hereditary causes of renal-cell carcinoma. Nat. Rev. Cancer 4:381-393). Якщо діагностуються метастази, виживаність протягом одного року зменшується приблизно до 60 % (Jemal, A., R.C. Tiwari, Т. Murray, A. Ghafoor, A. Samuels, E. Ward, E.J. Feuer, and M.J. Thun. 2004. Cancer statistics, 2004. CA Cancer J. Clin. 54:8-29), що підкреслює високу незадоволену потребу в цій індикації. Оскільки RCC вважається імуногенною пухлиною (Oliver RTD, Mehta A, Barnett MJ. A phase 2 study of surveillance in patients with metastatic renal cell carcinoma and assessment of response of such patients to therapy on progression. Моl Biother. 1988; 1:14-20. Gleave M, Elhilali M, Frodet Y, et al. Interferon gamma-lb compared with placebo in metastatic renal cell carcinoma. N Engl J Med. 1998;338:1265), про що свідчить існування пухлинореагуючих та пухлиноінфільтруючих ЦТЛ (Finke, J.H., P. Rayman, J. Alexander, M. Edinger, R.R. Tubbs, R. Connelly, E. Pontes, and R. Bukowski. 1990. Characterization of the cytolytic activity of CD4+and CD8+tumor-infiltrating lymphocytes in human renal cell carcinoma. Cancer Res. 50:2363-2370), були розпочаті клінічні дослідження по розробці протипухлинних вакцинацій на пептидній основі (Wierecky J, Mueller M, Brossart P. Dendritic cell-based cancer immunotherapy targeting MUC-1. Cancer Immunol Immunother. 2005 Apr 28). Однак, внаслідок відсутності епітопів Т-клітин-хелперів з ПАА, 8 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулярно визначені вакцини зазвичай вміщують пептиди, функціонуючі тільки як ліганди класу І. Друга задача цього винаходу вирішується тим, що пропонується фармацевтичний препарат, переважно, у формі вакцини, котрий є ефективним проти ракових клітин, зокрема клітин солідних пухлин, що вміщує ефективну кількість пептиду, відповідно до винаходу, чи нуклеїнову кислоту, яка кодує такий пептид. Вакцина може, крім того, вміщувати додаткові пептиди та/або наповнювачі для більшої ефективності, як пояснюється нижче. Пептид або нуклеїнова кислота, що кодує пептид, може також вміщувати протипухлинну чи протиракову вакцину. Вона може вводитись безпосередньо пацієнту в уражений орган, або системно, чи застосовуватись ex vivo до клітин, виділених з пацієнта чи клітинної лінії людини, котрі згодом вводяться пацієнту, чи використовуватись in vitro для вибирання субпопуляції з імунних клітин, які виділяються з пацієнта і потім знов вводяться йому. Перший аспект винаходу пропонує пептид, який вміщує амінокислотну послідовність, згідно із послідовністю SEQ ID NО. 1 (SQDDIKGIQKLYGKRS) або SEQ ID NО: 2 (VMAGDIYSV), чи її варіант, за умови, що пептид не є неушкодженим поліпептидом людини, з якого одержується амінокислотна послідовність (тобто, одна з повних послідовностей, зазначених в ідентифікаційних даних ділянки локуса (номер за каталогом див. в доданій таблиці 1 нижче). Як описується нижче, усі пептиди, що утворюють базис цього винаходу, представлені клітинами, що несуть МHС классу I або II (RCC). Отже, усі конкретні пептиди, а також інші пептиди, які вміщують таку ж послідовність (наприклад, похідні пептиди), викликають специфічну Т-клітинну реакцію, хоча та міра, в якій ця реакція буде індукуватися, може варіюватися в залежності від конкретного пептиду. Різниця, наприклад, може бути викликана мутаціями в зазначених пептидах (див. нижче). Фахівцю, який має значний досвід в цій галузі, добре відомі методи, що можуть бути застосовані для визначення міри індукування реакції окремим пептидом, зокрема, із посиланням на наведені тут приклади та відповідні літературні джерела. По суті, пептид за цим винаходом переважно складається з амінокислотної послідовності, відповідно до ідентифікаційного номеру 1 чи 2 (SEQ ID NО: 1 або SEQ ID NО: 2), чи її варіанту. Вираз "складається, по суті, з" буде означати, що пептид, згідно із цим винаходом, на додаток до послідовності за номерами від SEQ ID NО: 1 до SEQ ID NО: 11, чи її варіанта, вміщує додаткові N- та/або С-термінальні ділянки амінокислот, які не обов'язково формують частину пептиду, що функціонує як ключова послідовність пептиду, вміщуючи модель зв'язку, та як епітоп імуногенного Т-хелпера. Однак, ці ділянки можуть бути важливими для забезпечення ефективного введення пептиду, відповідно до цього винаходу, в клітини. В одному з втілень цього винаходу, пептид цього винаходу вміщує 80 N-термінальних амінокислот HLA-DR- антиген-асоційованого інваріантного ланцюгу (р33, надалі "Іі"), одержаного з NCBI, інвентарний номер в генному банку (GenBank) X00497 (Strubin, M., Mach, В. and Long, Е.О. The complete sequence of the mRNA for the HLA-DRassociated invariant chain reveals a polypeptide with an unusual transmembrane polarity EMBO J. 3 (4), 869-872 (1984)). Під терміном "варіант" даної амінокислотної послідовності ми маємо на увазі, що бокові ланцюжки, наприклад, одного чи двох амінокислотних залишків змінюються (наприклад, шляхом заміни їх боковим ланцюжком іншого природно існуючого амінокислотного залишку чи якимось іншим боковим ланцюжком) таким чином, що пептид все ще здатний зв'язуватися з молекулою HLA, по суті, в такий же спосіб, як і пептид, що складається з даної амінокислотної послідовності. Наприклад, пептид може бути модифікований так, що він буде якнайменше утримувати, чи навіть поліпшувати, здатність взаємодіяти та зв'язуватися з прийнятною молекулою МНС, такою як HLA-DRB1 у випадку HLA-молекул класу II, або HLA-A2 у випадку молекул класу І, та якнайменше утримувати, чи навіть поліпшувати, здатність утворювати активований ЦТЛ, який може розпізнавати та знищувати клітини, котрі аберантно експресують поліпептид, що вміщує амінокислотну послідовність, як визначено в аспектах винаходу чи здатність стимулювати Т-клітини-хелпери, котрі можуть надати допомогу CD8-позитивним Тклітинам чи прямо атакувати клітини-мішені, шляхом секреції цитокінів. Як можна дізнатися з бази даних, описаної далі, окремі позиції HLA-DR-зв'язуючих пептидів є, як правило, доменними залишками, формуючими ключову послідовність, що відповідає за зв'язок у порожнини зв'язування IILA. Модифікації цих та інших залишків, які беруть участь в зв'язуванні HLA-DR, можуть посилити зв'язування без зміни розпізнавання ЦТЛ. Ті амінокислотні залишки, що не суттєвими для взаємодії з Т-клітинним рецептором, можуть бути модифіковані шляхом заміни іншою амінокислотою, введення якої не має суттєвого впливу на реактивність Т-клітин та не виключає зв'язування із відповідним МНС. Отже, за винятком 9 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначеної умови, пептид винаходу може бути будь-яким пептидом (до цього терміну ми відносимо олігопептид чи поліпептид), котрий включає амінокислотні послідовності або їхню частину чи варіант, що надається. Стосовно МНС-презентуючих пептидів (класу II) відомо, що ці пептиди складаються з "ключової послідовності", яка має певний HLA-специфічний амінокислотний фрагмент та додаткові N- та/або С-термінальні подовження, які не втручаються у функцію ключової послідовності (тобто, вважаються нерелевантними до взаємодії пептиду і Т-клітини). N- та/або С-термінальні подовження можуть мати довжину від 1 до 10 амінокислот, відповідно. Тобто, переважний пептид цього винаходу демонструє загальну довжину від 9 до 100 амінокислот, переважно, від 9 до 30 амінокислот та більш переважно від 9 до 16 амінокислот. Цей пептид може використовуватись безпосередньо для завантаження МНС-молекул класу II, або послідовність може клонуватись у вектори, згідно із наведеним нижче описанням. Оскільки ці пептиди формують кінцевий продукт обробки більш крупних пептидів в межах клітини, також можуть використовуватися довші пептиди. (Пептиди винаходу можуть маги будь-який розмір, але як правило, вони можуть бути менше ніж 100000 Da за молекулярною масою, переважно, менше 50000 Da, ще більш переважно - менше 10000 Da та, зазвичай, близько 5000 Da.) Пептиди винаходу можуть мати будь-який розмір, але як правило вони можуть бути меншими ніж 100000 за молекулярною вагою, переважно меншими 50000, ще більш переважно меншими 10000 та, зазвичай, приблизно 5000. Що стосується кількості амінокислотних залишків, пептиди винаходу можуть мати менше 1000 залишків, переважно менше, ніж 500 залишків, та ще більш переважно - менше 100 залишків. В іншому аспекті цього винаходу, подібно до ситуації, роз'ясненої вище для МНС-молекул класу II, пептиди цього винаходу можуть використовуватись для викликання специфічної реакції МНС класу І, оскільки пептиди можуть демонструвати одночасні ключові або часткові послідовності HLA-молекул класу І. Тобто, переважний пептид цього винаходу демонструє загальну довжину від 9 до 16 амінокислот, переважно від 9 до 12 амінокислот. Мається на увазі, що такі пептиди можуть використовуватись (наприклад, у вакцині) як довші пептиди, подібні пептидам МНС класу II. Методи ідентифікації специфічних для МНС класу І "Ключових послідовностей", які мають визначений HLA-специфічний амінокислотний мотив для молекул HLA класу І, відомі спеціалістам та можуть бути спрогнозовані, наприклад, комп'ютерними програмами РАРrоС (http://www.uni-tuebingen.de/uni/kxi/) та SYFPEITHI (http://www.syfpeithi.de) (див. нижче). Пептиди винаходу, зокрема, є прийнятними для імунотерапевтичних методів для надання змоги Т-клітинам розпізнавати клітини, котрі аберантно експресують поліпептиди, що формують основу для пептидів цього винаходу. Оскільки ці специфічні пептиди, які складаються з певних амінокислотних послідовностей, зв'язуються з HLA-молекулами класу І чи II, переважно, щоб пептиди винаходу були такими, що зв'язуються з HLA-молекулами класу І чи II, та зв'язаний таким чином HLA-пептидний комплекс, коли він присутній на поверхні належної антигенпрезентуючої клітини, був здатний викликати стимуляцію Т-клітин, що розпізнають клітини, аберантно експресуючі поліпептид, вміщуючий певну амінокислотну послідовність. Якщо пептид, що є більшим, ніж близько 12 амінокислотних залишків, використовується безпосередньо для зв'язування МНС-молекули, бажано, щоб залишки, розташовані по краях основної ділянки зв'язування HLA, не завдавали значного впливу здатності пептиду специфічно зв'язуватися з порожниною зв'язування МНС-молекули чи представляти пептид в Т-клітини. Однак, як вже зазначалося вище, перевага надасться використанню більш крупних пептидів, особливо, коли вони кодуються полінуклеотидом, оскільки ці більш крупні пептиди можуть розділятися на частини відповідними антиген-презеитуючими клітинами. Приклади пептидів МНС-лігандів, мотиви, варіанти, а також окремі приклади N- та/або Стермінальних подовжень можна, наприклад, одержати в базі даних SYFPEITH1 (Rammensee Н, Bachmann J, Emmerich NP, Bachor OA, Stevanovic S. SYFPEITHI: database for MHC ligands and peptide motifs. Immunogenetics. 1999 Nov; 50(3-4):213-9. Review.) на сайті http://syfpeithi.bmiheidelberg.com/ та у посиланнях, наведених на ньому. Як необмежені приклади, окремі пептиди для HLA-DR в базі даних - це K Н K V YACEVTHQG L S S, одержаний з ланцюга Ig kappa 188-203 (Kovats et al. Eur J Immunol. 1997 Apr; 27(4):1014-21); K V Q WKVDNALQS G N S, одержаний з ланцюгу Ig kappa 145-159 (Kovats et al. Eur J Immunol. 1997 Apr; 27(4):1014-21), L P R L I AFTSEHSHF, одержаний з GAD65 270-283 (Endl et al. J Clin Invest. 1997 May 15; 99(10):2405-15) або F FRMVISNPA A T H Q D I D F L I, одержаний з GAD65 556-575 (Endl et al. J Clin Invest. 1997 May 15; 99(10):2405-15). Крім того, пептиди також можуть походити з мутованих послідовностей антигенів, наприклад, у випадку А Т G F К Q S S K A L Q R Р V A S, що одержується з гібридного білку bcr-abl 210 kD (ten Bosch et 10 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 al. Blood. 1996 Nov 1; 88(9):3522-7), G YKVLVLNPS V A A T, одержаної з HCV-1 NS3 28-41 Diepolder et al. J Virol. 1997 Aug; 71(8):6011-9), або FRKQNPDIV I Q Y M D D L Y V G, одержаної з HIV-1 (HXB2) RT 326-345 (van der Burg et al. J Immunol. 1999 Jan 1; 162 (1): 152-60). Усі "доменні" амінокислоти (див. Friede et al., Biochim Biophys Acta. 1996 Jun 7; 1316(2):85-l01; Sette et al. J Immunol. 1993 Sep 15; 151(6):3163-70.; Hammer et al. Cell. 1993 Jul 16; 74(l):197-203., and Hammer et al. J Exp Med. 1995 May 1; 181 (5): 1847-55. As examples for HLA-DR4) позначаються жирним шрифтом, а передбачувані ключові послідовності підкреслюються. Усі описані вище пептиди підпадають під термін "варіанти" даної амінокислотної послідовності. Термін "пептид" трактується авторами винаходу як такий, що включає не тільки молекули, в яких амінокислотні залишки з'єднуються пептидними зв'язками (-CO-NH-), але також молекули, де пептидний зв'язок реверсується. Такі ретро-інверсивні пептидні міметики можуть вироблятися за методами, відомими в даній галузі, наприклад, описаними в роботі Meziere et al (1997) J. Immunol. 159, 3230-3237, яка включена в даний документ шляхом посилання. Цей підхід включає формування псевдопептидів, які включають зміни із залученням основи, а не орієнтації бокових ланцюгів. Автори Meziere et al (1997) показали, що, якнайменш, для реакцій клітин МНС класу II і Т-хелперів такі псевдопептиди є корисними. Ретро-інверсивні пептиди, які вміщують зв'язки NH-CO замість пептидних зв'язків CO-NH, набагато більш стійкі до протеолізу. Як правило, пептид винаходу - це пептид, котрий при експресії антиген-презентуючою клітиною може бути оброблений так, що створюється фрагмент, який здатний зв'язатися з відповідною молекулою МНС та може бути представлений відповідною клітиною і викликати належну Т-клітинну реакцію. Буде братися до уваги той факт, що фрагмент, який створюється з пептиду, також може бути пептидом винаходу. Прийнятним є те, що пептид винаходу вміщує частину, котра включає дану амінокислотну послідовність або її частину чи варіант, та додаткову частину, яка надає якусь бажану властивість. Наприклад, додаткова частина може включати інший епітоп Т-клітини (незалежно від того, чи походить він з того ж поліпептиду, що й перша частина епітопа Т-клітини), або вона може включати білок-носій чи пептид. Отже, в одному з втілень винаходу пептид являє собою укорочений білок людини чи гібридний білок або фрагмент білка та іншої поліпептидної частини, за умови, що частина, яка включає білок людини, вміщує одну чи декілька амінокислотних послідовностей винаходу. В особливо переважному втіленні винаходу, пептиди включають амінокислотні послідовністі винаходу та якнайменш один додатковий епітоп Т-клітини, причому додатковий епітоп Т-клітини здатний полегшувати викликання Т-клітинної реакції, спрямованої на тип пухлини, що аберантно експресує пухлино-асоційований антиген. Таким чином, пептиди винаходу включають так звані "нанизані" поліпептиди, котрі також можуть використовуватися як вакцини. Такі пептиди можуть бути розділені хімічними лінкерами, котрі можуть вміщувати амінокислоти (такі як G-ділянки), але які можуть - додатково чи альтернативно - включати групи хімічних зв'язків (тобто, без якихось функцій, крім надання певного інтервалу). Під терміном "аберантно експресовані" ми маємо на увазі, що поліпептид надмірно експресований, в порівнянні з нормальними рівнями експресії, або що ген є мовчазним у тканині, з якої походить пухлина, але він експресується в пухлині. Термін "надмірно експресований" трактується авторами винаходу таким чином: поліпептид присутній на рівні, що принаймні в 1,2 разу перевищує рівень, який спостерігається в нормальній тканині; та переважно, принаймні, в 2 рази та ще більш переважно, принаймні, в 5 або 10 разів більше рівня, присутнього в нормальній тканині. Пептиди (принаймні ті, що вміщують пептидні зв'язки між амінокислотними залишками) можуть бути синтезовані за допомогою Fmoc-поліамідного способу синтезу пептидів твердої фази, як розкривається в роботі Lu et al (1981) J. Org. Chem. 46, 3433-3436, та посиланнях на літературні джерела, наведених в ній. Тимчасовий захист N-аміногрупи забезпечується 9фторенілметилоксикарбонільною (Fmoc) групою. Повторне розщеплювання цієї високолабільної основної захисної групи виконується із використанням 20 % піперидину в N, Nдіметилформаміді. Функціональність бокових ланцюгів може захищатися у виді їхніх простих бутилових ефірів (у випадку серинового треоніну і тирозину), складних бутилових ефірів (у випадку глютамінової кислоти та аспарагінової кислоти), бутилоксикарбонільних похідних (у випадку лізину та гістидину), тритилового похідного (у випадку цистеїну) та 4-метокси-2,3,6триметилбензолсульфонільного похідного (у випадку аргініну). Коли глютамін чи аспарагін є Стермінальними залишками, використовується 4,4'-діметоксибензогідрильна група для захисту функціональних амідних груп бокових ланцюгів. Як твердофазні підкладки використовують полідиметил-акриламідний полімер, що складається з трьох мономерів, диметилакриламіду (основний мономер), бісакрилоїлетилендіаміну (крос-лінкер) та метилового ефіру 11 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 акрилоїлсаркозину (функціональна речовина). Використовувана речовина пептиднополімерного зв'язку, що розщеплюється, - це кислотно-лабільна похідна 4-гідроксиметилфеноксіоцтової кислоти. Усі амінокислотні похідні додаються у виді їхніх сформованих симетричних ангідридних похідних, за винятком аспарагіну та глютаміну, що додаються за допомогою реверсованої процедури зв'язку, де посередником виступає N, N-дициклогексилкарбодіімід/1гідроксибензотриазол. Контроль усіх реакцій зв'язування та зняття захисту ведеться із використанням нінгідринового, тринітробензол-сульфоново-кислотного чи ізотинового тестів. Після завершення синтезу пептиди звільняються від полімерної підкладки з одночасним видаленням захисних груп бокових ланцюгів шляхом обробки 95 % трифтороцтовою кислотою, яка вміщує 50 % суміші поглиначів. Поглиначі, які зазвичай використовуються, - це стандитіол, фенол, анізол та вода; точний вибір залежить від амінокислот-складників пептиду, який синтезується. Трифтороцтова кислота (ТФК) видаляється шляхом випарювання у вакуумі, з подальшим розтиранням в порошок з діетиловим ефіром, з одержанням первинного пептиду. Будь-які присутні поглиначі видаляються простою процедурою екстракції, яка після ліофілізації водної фази дає первинний пептид, вільний від поглиначів. Реактиви для пептидного синтезу, взагалі, можна одержати в компанії Calbiochem-Novabiochem (UK) Ltd, Nottingham NG7 2QJ, UK. Очищення може виконуватися із використанням будь-кого одного чи кількох методів, таких як, гель-хроматографія, іонообмінна хроматографія та (зазвичай) зворотнофазна високоефективна рідинна. Аналіз пептидів може виконуватися за допомогою тонкошарової хроматографії, зворотнофазної високоефективної рідинної хроматографії, амінокислотного аналізу після гідролізу кислот та мас-спектрометричного аналізу із бомбардуванням прискореними атомами (БПА), а також мас-спектрометричного аналізу MALDI та ESI-Q-TOF. Ще один аспект винаходу дає нуклеїнову кислоту (наприклад, полінуклеотид), що кодує пептид винаходу. Нуклеїновою кислотою, відповідно до цього винаходу, може бути ДНК, кДНК, ПНК, СНК, РНК чи їхні комбінації, та вони можуть вміщувати або не вміщувати інтрони, за умови, що полінуклеотид кодує пептид. Без сумніву, тільки ті пептиди, що вміщують природно існуючі амінокислотні залишки, з'єднані природними пептидними зв'язками, кодуються полінуклеотидом. Інший аспект винаходу пропонує вектор експресії, здатний експресувати поліпептид, відповідно до винаходу. Були розроблені різноманітні методи для оперативного зв'язку полінуклеотидів, зокрема, ДНК, з векторами, наприклад, за допомогою комплементарних когезійних сайтів термінації. Наприклад, комплементарні гомополімерні ділянки можуть додаватися до ДІІК-сегмента для введення у векторну ДНК. Вектор та ДНК-сегмент потім з'єднуються шляхом водневого зв'язку між комплементарними гомополімерними кінцями для формування рекомбінантних молекул ДНК. Синтетичні лінкери, які вміщують один чи кілька рестрикційних сайтів, забезпечують альтернативний метод з'єднання ДНК-сегмента з векторами. ДНК-сегмент, сформований рестрикційним гідролізом ендонуклеази, як описувалось раніше, обробляється ДНКполімеразою бактеріофага Т4 або ДНК-полімеразою І зі штаму Е.соlі, ферментів, ідо видаляють виступаючі, 3'-однониткові сайти за допомогою своїх 3'-5'-екзонуклеотичних функцій та заповнюють заглиблені 3'-кінці, завдяки процесам полімеризації. Комбінація цих функцій, таким чином, генерує ДНК-сегменти з тупими кінцями. Сегменти з тупими кінцями потім інкубуються з великим молярним надлишком молекул лінкерів в присутності ферменту, що здатний каталізувати зшивання ДНК-молекул з тупими кінцями, таких як ДНК-лігаза бактеріофагу Т4. Таким чином, продуктами реакції є ДНК-сегменти з послідовностями полімерних лінкерів на кінцях. Ці ДНК-сегменти потім розщеплюються відповідним рестрикційним ферментом та зшиваються з вектором експресії, що був гідролізований ферментом, який утворює сайти термінації, сумісні з сайтами ДНК- сегмента. Синтетичні лінкери, які вміщують ряд рестрикційних сайтів ендонуклеази, доступні для придбання в ряді компаній, включаючи International Biotechnologies Inc, Нью Хейвен, Цинцинаті, США. Бажаним способом модифікації ДНК, що кодує поліпептид винаходу, є використання ланцюгової полімеразної реакції, яка розкривається в роботі Saiki et al (1988) Science 239,487491. Цей метод може застосовуватись для введення ДНК у відповідний вектор, наприклад, шляхом створення належних рестрикційних сайтів, чи для модифікації ДНК іншими прийнятними шляхами, які відомі в цій галузі. В цьому методі до ферментативно примноженої ДНК з обох сторін примикають два праймери, котрі самі по собі включаються у примножену ДНК. Зазначені праймери можуть вміщувати сайти розпізнавання рестрикційних ендонуклеаз, 12 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 що можна використовувати для клонування векторів експресії за методами, відомими в цій галузі. ДНК (або у випадку ретровірусних векторів, РНК) потім експресується в належному організмі хазяїна для утворення поліпептиду, що становить сполуку цього винаходу. Таким чином, ДНК, що кодує поліпептид, який є сполукою винаходу, може використовуватися за відомими методами, відповідним чином модифікованими згідно із доктринами, вміщеними тут, для створення вектора експресії, що згодом використовується для трансформації відповідної клітини хазяїна з метою експресії та формування поліпептиду винаходу. Такі методи розкриті в патентах США: № 4,440,859, виданий 3 квітня 1984 р. авторам Rutter et al, № 4,530,901, виданий 23 липня 1985 p. автору Weissman, № 4,582,800, виданий 15 квітня 1986 р. автору Crowl, № 4,677,063, виданий 30 червня 1987 р. авторам Mark et al, № 4,678,751, виданий 7 липня 1987 p. автору Goeddel, № 4,704,362, виданий 3 листопада 1987 р. авторам Itakura et al, № 4,710,463, виданий 1 грудня 1987 p. автору Murray, № 4,757,006, виданий 12 липня 1988 р. авторам Toole, Jr. et al, № 4,766,075, виданий 23 серпня 1988 p. авторам Goeddel et al та № 4,810,648, виданий 7 березня 1989 p. автору Stalker, всі з яких включені в цей документ шляхом посилань. ДНК (або у випадку ретровірусних векторів, РНК), що кодує поліпептид, який є сполукою винаходу, може з'єднуватись з різними іншими ДНК-послідовностями для введення в належний організм хазяїна. Супутня ДНК буде залежати від характеру хазяїна, способу введення ДНК до хазяїна та від того факту, чи бажане епісомне утримання або інтеграція. В цілому, ДНК вводиться у вектор експресії, такий як плазміда, в належній орієнтації та з відповідною рамкою зчитування для експресії. При необхідності, ДНК може зв'язуватися з належними нуклеотидними послідовностями транскрипційного і трансляційного регуляторного контролю, що розпізнаються бажаним хазяїном, хоча такі контрольні елементи взагалі є доступними у векторі експресії. Потім вектор вводиться хазяїну із використанням стандартних методик. В цілому, не всі організми-хазяїни будуть трансформуватися вектором. Таким чином, виникає необхідність обрати трансформовані клітини хазяїна. Одна з методик вибору включає введення у вектор експресії ДНК-послідовності з будь-якими необхідними контрольними елементами, що кодує специфічну рису у трансформованій клітині, наприклад, резистентність до антибіотиків. Як альтернативний варіант, ген для такої специфічної риси може бути на іншому векторі, котрий використовується для ко-трансформації бажаної клітини хазяїна. Клітини хазяїна, трансформовані рекомбінантною ДНК винаходу, потім культивуються протягом достатнього часу в належних умовах, які відомі досвідченим фахівцям, з урахуванням розкритих в цьому документі доктрин, щоб дозволити експресію поліпептиду, котрий згодом може бути виділений. Існує багато систем експресії, включаючи бактерії (наприклад, Е.соlі та Bacillus subtilis), дріжджі (наприклад, Saccharomyces cerevisiae), нитковидні грибки (наприклад, Aspergillus), клітини рослин, тварин і комах. Переважною системою можуть бути RCC або клітини Awells. Промотором є елемент контролю експресії, що сформований ДНК-послідовністю, яка забезпечує зв'язування РНК-полімерази і транскрипцію. Промоторні послідовності, порівнювані із зразковими бактеріальними хазяїнами, як правило, знаходяться у векторах плазмід, які вміщують зручні сайти рестрикції для введення ДНК-сегмента цього винаходу. Типовими векторними плазмідами прокаріотів є pUC18, pUC19, pBR322 та pBR329, які можна придбати в Biorad Laboratories, (Річмонд, Каліфорнія, США) та рТrс99А і рKK223-3, які продає компанія Pharmacia, Piscataway, Нью-Джерсі, США. Типовою векторною плазмідою клітин ссавців є pSVL, що є в наявності в компанії Pharmacia, Piscataway, Нью-Джерсі, США. Цей вектор використовує останній промотор SV40, для викликання експресії клонованих генів, і найвищий рівень експресії спостерігається в Т-антигенутворюючих клітинах, таких як клітини COS-1. Прикладом індукованого вектора експресії у ссавців є pMSG, який також можна придбати в Pharmacia. Цей вектор використовує індукований глюкокортикоїдом промотор вірусу пухлини грудей у мишей з довгим термінальним повтором для викликання експресії клонованого гена. Прийнятними плазмідними векторами дріжджів є pRS403-406 та pRS413-416, які доступні для придбання в Stratagene Cloning Systems, La Jolla, Каліфорнія 92037, США. Плазміди pRS403, pRS404, pRS405 та pRS406 - це дріжджові інтегровані плазміди (YIp), що включають специфічні маркери дріжджів H1S3, TRP1, LEU2 та URA3. Плазміди pRS413-416 - це дріжджові центромерні плазміди (Ycps). Існують також інші вектори та системи експресії, для використання з клітинами різних хазяїв. Цей винахід також належить до клітини хазяїна, що трансформується полінуклеотидним вектором даного винаходу. Клітина хазяїна може бути прокаріотом чи еукаріотом. Бактеріальні 13 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 клітини можуть бути переважно прокаріотичними клітинами хазяїна, в деяких обставинах це типові штами Е.соlі, такі як, наприклад, штами DH5 Е.соlі, які можна придбати в Bethesda Research Laboratories Inc., Бетесда, Меріленд, США, та RR1, які доступні для придбання в American Type Culture Collection (АТСС) of Rockville, Меріленд, США (№ АТСС 31343). Переважні еукаріотичні клітини хазяїна включають клітини дріжджів, комах та ссавців, переважно клітини хребетних, такі як клітини мишей, пацюків, мавп чи фібробластичні та ниркові клітинні лінії людини. Дріжджові клітини хазяїна включають YPH499, YPH500 та YPH501, які доступні для придбання в Stratagene Cloning Systems, Ла Джолла, Каліфорнія 92037, США. Переважні клітини хазяїна у ссавців включають клітини яєчника китайського хом'ячка (СНО), що можна придбати в АТСС як CCL61; клітини ембріона NIH швейцарської миші (NIH/3T3), які можна придбати в АТСС як CRL 1658; клітини COS-1, виділені з нирок мавпи, що є в наявності для продажу в АТСС як CRL 1650, та клітини 293, які представляють клітини нирок ембріону людини. Переважними клітинами комах є клітини Sf9, в які можуть вводитись вектори експресії бакуловірусу. Трансформація клітин хазяїна ДНК-конструкцією цього винаходу виконується за допомогою добре відомих методів, що, як правило, залежать від типу використовуваного вектору. Трансформація прокаріотичних клітин хазяїна описана, наприклад, в роботах Cohen et al (1972) Proc. Natl. Acad. Sci. USA 69,2110 та Sambrook et al (1989) Molecular Cloning, A Laboratory Manual, Cold Spring Flarbor Laboratory, Cold Spring Harbor, NY. Трансформація дріжджових клітин описана в роботі Sherman et al (1986) Methods In Yeast Genetics, A Laboratory Manual, Cold Spring Harbor, NY. Метод Бегса - Beggs (1978) Nature 275,104-109 - також є прийнятним. Стосовно клітин хребетних, реактиви, які використовуються для трансфекції таких клітин, наприклад, фосфат кальцію та DEAE-декстран чи ліпосомні композиції, можна придбати в компаніях Stratagene Cloning Systems або Life Technologies Inc., Gaithersburg, Меріленд, 20877, США. Електропорація також прийнятна для трансформації та/або трансфекції клітин і є добре відомим методом трансформації дріжджових клітин, бактеріальних клітин, клітин комах та хребетних. Успішно трансформовані клітини, тобто, клітини, які вміщують ДНК-конструкцію цього винаходу, можна ідентифікувати за допомогою добре відомих методик. Наприклад, клітини, одержані в результаті введення конструкції експресії цього винаходу, можуть вирощуватись з утворенням поліпептиду винаходу. Клітини можуть збиратись та лізуватися із дослідженням вмісту ДНК на присутність ДНК за методом, описаним в роботі Southern (1975) J. Моl. Віоl. 98,503 чи Berent et al (1985) Biotech. 3,208. Альтернативно, присутність білка в надосадовій рідині може визначатися із використанням антитіл, як описано нижче. На додаток до прямого визначення присутності рекомбінантної ДНК, успішна трансформація може підтверджуватися добре відомими імунологічними методами, коли рекомбінантна ДНК здатна спрямовувати експресію білка. Наприклад, клітини, успішно трансформовані вектором експресії, утворюють білки, які демонструють належну антигенність. Зразки клітин з вірогідною трансформацією збираються та досліджуються на білок за допомогою належних антитіл. Отже, на додаток до самих трансформованих клітин хазяїна, цей винахід також передбачає культуру таких клітин, переважно моноклональну (клонально гомогенну) культуру, чи культуру, яка виділяється з моноклональної культури у живильному середовищі. Далі роз'яснюється, що певні клітини хазяїна, згідно із винаходом, можуть застосовуватись у синтезі пептидів винаходу, наприклад бактеріальні, дріжджові клітини та клітини комах. Однак, в ряді терапевтичних методів можуть бути прийнятними інші клітини хазяїна. Наприклад, антигенпрезентуючі клітини, такі як дендритні клітини, можуть з успіхом використовуватись для експресування пептидів винаходу, за умови, що ці пептиди можуть надходити у відповідні МНСмолекули. Переважними клітинами хазяїна є рекомбінантні клітини RCC чи клітини Awells. Переважним є метод формування пухлино-асоційованогопептиду, згідно із цим винаходом, і цей метод включає культивування клітини хазяїна, відповідно цього винаходу, та виділення пептиду з клітини хазяїна чи її культурного середовища, відповідно до стандартних методів. Інший аспект винаходу пропонує метод створення пептиду для перорального, ректального, інтраназального чи під'язикового введення, внутрішньовенного (i.v.) введення, підшкірного (s.c.) введення, інтрадермального (i.d.) введення, внутрішньочеревного (і.р.) введення, внутрішньо м'язового (і.m.) введення. Переважні способи введення пептиду - це s.c, i.d., і.р., і.m. та i.v. Переважними способами введення ДНК є i.d., i.m., s.c, і.р. та i.v. Можуть вводитись дози від 0,1 до 500 мг пептиду чи ДНК, як також зазначається нижче. 14 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ще один аспект винаходу належить до використання пухлино-асоційованого пептиду, відповідно до винаходу, нуклеїнової кислоти, відповідно до винаходу, чи вектору експресії, відповідно до винаходу, в медицині. Задача цього винаходу, в його додатковому аспекті, вирішується фармацевтичною композицією, яка вміщує принаймні один пухлино-асоційований пептид, згідно із послідовністю SEQ ID NО: 1 або SEQ ID NО: 2, згідно із винаходом, нуклеїнову кислоту, згідно із винаходом, чи вектор експресії, згідно із винаходом, а також фармацевтично прийнятний носій. Ця композиція використовується для парентерального введення, наприклад, підшкірного, інтрадермального, внутрішньочеревного, внутрішньовенного, внутрішньо м'язового чи перорального введення. Для цього пептиди розчиняються або суспендуються у фармацевтично прийнятному, переважно водному, носії. Крім того, композиція може вміщувати наповнювачі, такі як буферні елементи, зв'язувальні речовини, очисники, розчинники, ароматизатори, мастильні речовини та ін. Пептиди також можуть вводитись разом з імунно-стимулюючими речовинами, такими як цитокіни. Вичерпний перелік наповнювачів, які можуть використовуватись у такій композиції, наведений, наприклад, в книзі A. Kibbe, Handbook of Pharmaceutical Excipients, 3. Ed., 2000, American Pharmaceutical Association and pharmaceutical press. Композиція може використовуватись для попередження, профілактики та/або лікування аденомних чи ракових захворювань. Фармацевтичний препарат, який вміщує принаймні один з пептидів цього винаходу, що включає будь-яку з послідовностей SEQ ID NО: 1 та/або SEQ ID NО: 2, нуклеїнову кислоту, згідно із винаходом, чи вектор експресії, згідно із винаходом, вводиться пацієнту, який страждає на аденомне чи ракове захворювання, асоційоване з відповідним пептидом чи антигеном. Таким чином, можна викликати ЦТЛ-опосередковану імунну реакцію. Фармацевтична композиція, відповідно до цього винаходу, переважно, додатково вміщує якнайменш один додатковий пухлино-асоційований пептид, який включає послідовність, згідно із будь-якою послідовністю від SEQ ID NО: 3 до SEQ ID NО: 10, відповідну нуклеїнову кислоту чи відповідний вектор експресії. В цілому, пептиди, які присутні у фармацевтичній композиції, згідно із винаходом, мають ті самі властивості, як описано вище, для пептидів цього винаходу, що вміщують SEQ ID NО: 1 та/або SEQ ID NО: 2. Тобто, вони можуть мати загальну довжину від 9 до 100, переважно від 9 до 30, та ще більш переважно від 9 до 16 амінокислот. Крім того, якнайменш один пептид, згідно із будь-якою послідовністю SEQ ID NО: 1-SEQ ID NО: 11, може включати непептидні зв'язки. Крім того, відповідні нуклеїнові кислоти можуть кодувати від 9 до 100, переважно, від 9 до 30 та ще більш переважно, від 9 до 16 амінокислот. Переважною є фармацевтична композиція, відповідно до винаходу, котра вміщує пептиди (зокрема, пухлино-асоційовані), які складаються з амінокислотних послідовностей, відповідно до SEQ ID NО: 1 та/або SEQ ID NО: 2 та від SEQ ID NО: 3 до SEQ ID NО: 11. Переважною є фармацевтична композиція, відповідно до винаходу, в якій кількість пептиду(пептидів) (зокрема, пухлино-асоційованих), нуклеїнової кислоти(кислот), згідно із винаходом, чи вектору(векторів) експресії, згідно із винаходом, присутня в такій композиції, залежить від виду тканини, раку та/або пацієнта. Пептид також може бути міченим або бути гібридним білком чи гібридною молекулою. Пептид може бути, по суті, чистим або поєднаним з імуностимулюючим ад'ювантом, чи використовуватись в комбінації з імуностимулюючими цитокінами, чи вводитись з належною системою доставки, наприклад ліпосомами. Інші прийнятні ад'юванти включають стимулон Aquila's QS21 (Aquila Biotech, Ворчестер, Масачусетс, США), який виділяється з сапоніну, мікробактеріальні екстракти та синтетичні імітатори стінок бактеріальних клітин, а також патентовані ад'юванти, наприклад Ribi's Detox. Інший ад'ювант, похідний з сапоніну, Quil А, також може використовуватись (Superfos, Данія). Крім того, можуть використовуватись інші ад'юванти, такі як ад'ювант Фрейнда. Пептид також може з'єднуватись з належним носієм, таким як гемоціанін лімфи равлика (KLH) або манан (див. WO 95/18145 та Longenecker et al (1993) Ann. NY Acad. Sci. 690, 276-291). Оскільки ад'ювант визначається як субстанція, яка посилює імунну реакцію на антиген (MedlinePlus® Medical Dictionary, N1H), можуть використовуватись інші субстанції з цією функцією, включаючи, без обмежень, агоністів tollподібних рецепторів (TLR-агоністи), переважно, субстанції, які агоністично взаємодіють з TLR 3, 7, 8 та 9, більш переважно, TLR 9, такі як протамін-стабілізуюча РНК, CpG-олігонуклеотиди, CpR-олігонуклеотиди, бактеріальна ДІЖ, імідазокіноліни та ін. Інші субстанції, відомі в даній галузі, котрі є прийнятними для посилення імунної реакції, включають, без обмежень, інгібітори індуцибельної синтази окису азоту (iNOS), аргінази (ARG1), індолеамін-2,3-діоксігенази (IDO), рецептора 1 фактора судинного ендотеліального росту 15 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 (VEGFR-1), фактора судинного ендотеліального росту (VEGF), циклооксигенази-2 (СОХ-2), TGFбета рецептору І (TGF-beta-RI). Такі інгібітори можуть бути, наприклад, моноклональними антитілами проти таких молекул чи малих молекул. Малі молекули та моноклональні антитіла, відомі в даній галузі як такі, що мають інгібіторну функцію відносно до факторів, згаданих вище, і, таким чином, ефект посилення імунної реакції, - це, наприклад, 1-МТ, NCX-4016, рофекоксіб (rofecoxib), селебрекс (celebrex), ВЕС, ABH, nor-NOHA, SB-505124, SD-208, LY580276, AMD3100, аксітініб (axitinib), бевакізумаб (bevacizumab), JSI-124, CPA-7, XL-999, ZD2171, пазопаніб (pazopanib), CP-547632 та VEGF Trap. Крім того, субстанції, які зменшують кількість регуляторних Т-клітин (CD4+, CD25+, FoxP3+), є прийнятними як ад'юванти. Вони включають, наприклад, циклофосфамід (Cytoxan), ONTAK (денілейкін діфтітокс), Sunitinib, анти-СТЬА-4 (MDX-010, СР-675206), анти-СD25, анти-ССL22 та анти-GITR, але не обмежуються ними. В іншому переважному втіленні винаходу вакцина є вакциною з нуклеїновою кислотою. Відомо, що щеплення вакциною з нуклеїновою кислотою, такою як ДНК-вакцина, що кодує поліпептид, призводить до Т-клітинної реакції. Вона може вводитись безпосередньо пацієнту в уражений орган, або системно, чи застосовуватись ex vivo до клітин, виділених з пацієнта чи клітинної лінії людини, котрі згодом вводяться пацієнту, чи використовуватись in vitro для обирання субпопуляції з імунних клітин, які виділяються з пацієнта і потім знов вводяться йому. Якщо нуклеїнова кислота вводиться в клітини in vitro, вона може бути корисною для клітин, що трансфекуються, щоб спільно експресувати імуностимулюючі цитокіни, наприклад, інтерлейкін 2 чи GM-CSF. Вакцина з нуклеїновою кислотою може вводитись з ад'ювантом, таким як BCG чи галун. Однак, бажано, щоб вакцина з нуклеїновою кислотою вводилася без ад'юванта. Полінуклеотид може бути, по суті, чистим, або включеним в належний вектор чи в систему доставки. Відповідні вектори та системи доставки включають вірусні системи, основані на аденовірусі, вірусі коров'ячої віспи, ретровірусах, вірусі герпесу, адено-асоційованому вірусі чи гібридах, які включають елементи більш, ніж одного вірусу. Невірусні системи доставки включають катіонні ліпіди та катіонні полімери, добре відомі як засоби доставки ДНК. Також може використовуватись фізична доставка, наприклад, за допомогою "генної пушки". Пептид чи пептид, кодований нуклеїновою кислотою, може бути гібридним білком, наприклад, епітопом з правцевого анатоксину, що стимулює С£)4-позитивні Т-клітини. Відповідно, будь-яка нуклеїнова кислота, яка вводиться пацієнту, є стерильною і такою, що не вміщує пірогену. Чиста ДНК може вводитися внутрішньо м’язовим, інтрадермальним чи підшкірним шляхом. Пептиди можуть вводитися внутрішньо м'язовим, інтрадермальним чи підшкірним шляхом. Зручним є те, що вакцина з нуклеїновою кислотою може включати будь-який прийнятний засіб доставки нуклеїнової кислоти. Нуклеїнова кислота, переважно ДНК, може бути чистою (тобто, по суті, без інших компонентів для введення) або може доставлятись з ліпосомами чи як частина вірусної векторної системи доставки. Існує думка, що поглинання нуклеїнової кислоти та експресія поліпептиду, кодованого професійними антиген-презентуючими клітинами, такими як дендритні клітини, може бути механізмом ініціації імунної реакції, однак, дендритні клітини не можуть бути трансфековані, але є все ж таки важливими, оскільки вони можуть забирати експресований пептид з трансфекованих клітин в тканині ("крос-примування", наприклад, в роботі Thomas AM, Santarsiero LM, Lutz ER, Armstrong TD, Chen YC, Huang LQ, Laheru DA, Goggins M, Hruban RH, Jaffee EM. Mesothelin-specific CD8(+) T-cell responses provide evidence of in vivo cross-priming by antigen-presenting cells in vaccinated pancreatic cancer patients. J Exp Med. 2004 Aug 2; 200(3):297-306). Переважно, якщо нуклеїново-кислотна вакцина, така як ДНК-вакцина, вводиться в м'язи, в той час як пептидні вакцини переважно повинні вводитися s.c. чи i.d. Також переважно, якщо вакцина вводиться в шкіру. Вакцина з нуклеїновою кислотою може вводитись без ад'юванта. Вакцина з нуклеїновою кислотою може вводитись з ад'ювантом, таким як BCG чи галун. Інші прийнятні ад'юванти включають стимулон Aquila's QS21 (Aquila Biotech, Ворчестер, Масачусетс, США), який виділяється з сапоніну, мікробактеріальні екстракти та синтетичні імітатори стінок бактеріальних клітин, а також патентовані ад'юванти, наприклад Ribi's Detox. Інший ад'ювант, похідний з сапоніну, Quil А, також може використовуватись (Superfos, Данія). Бажано, щоб вакцина з нуклеїновою кислотою вводилася без ад'юванта. Крім того, можуть використовуватись інші ад'юванти, такі як ад'ювант Фрейнда. Також може бути зручним введення пептиду, зв'язаного з гемоцианіном лімфи равлика, переважно також з ад'ювантом. 16 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Імунізаційна терапія раку, в якій посередником виступає полінуклеотид, описана в роботах Conry et al (1996) Seminars in Oncology 23,135-147; Condon et al (1996) Nature Medicine 2,11221127; Gong et al (1997) Nature Medicine 3,558-561; Zhai et al (1996) J. Immunol. 156,700-710; Graham et al (1996) Int J. Cancer 65,664-670; та Burchell et al (1996) pp 309-313 In: Breast Cancer, Advances in biology and therapeutics, Calvo et al (eds), John Libbey Eurotext, всі з яких включені в цей документ шляхом посилань в усій повноті. Також може бути корисним спрямовування вакцини в конкретні клітинні популяції, наприклад, антиген-презентуючі клітини, по місцю введення, використання цільових векторів та систем доставки чи селективна очистка такої клітинної популяції у пацієнта та введення пептиду чи нуклеїнової кислоти ex vivo (наприклад, дендритні клітини можуть сортуватись, як описано авторами Zhou et al (1995) Blood 86,3295-3301; Roth et al (1996) Scand. J. Immunology 43,646651). Наприклад, цільові вектори можуть вміщувати тканино- чи пухлиноспецифічний промотор, який спрямовує експресію антигену в належне місце. Винахід в своєму іншому аспекті належить до фармацевтичної композиції, яка вміщує один чи кілька зазначених пептидів, згідно із винаходом. Ця композиція використовується для парентерального введення, наприклад, підшкірного, інтрадермального, внутрішньо м'язового чи перорального введення. Для цього пептиди розчиняються або суспендуються у фармацевтично прийнятному, переважно водному, носії. Крім того, композиція може вміщувати наповнювачі, такі як буферні елементи, зв'язувальні речовини, очисники, розчинники, ароматизатори, мастильні речовини та ін. Пептиди також можуть вводитись разом з імуностимулюючими речовинами, такими як цитокіни. Вичерпний перелік наповнювачів, які можуть використовуватись у такій композиції, наведений, наприклад, в книзі A. Kibbe, Handbook of Pharmaceutical Excipients, 3. Ed., 2000, American Pharmaceutical Association and pharmaceutical press. Композиція може використовуватись для попередження, профілактики та/або терапії аденомних чи ракових захворювань. Фармацевтичний препарат, який вміщує принаймні один з пептидів цього винаходу, що включає SEQ ID No. 1 та/або SEQ ID No. 2, вводиться пацієнту, який страждає на аденомне чи ракове захворювання, асоційоване з відповідним пептидом чи антигеном. Таким чином, можна викликати ЦТЛ-специфічну імунну реакцію. В іншому аспекті цього винаходу, комбінація з двох чи декількох пептидів, згідно із винаходом, може використовуватись як вакцина, в прямому поєднанні чи в межах однієї схеми лікування. Крім того, можуть використовуватись комбінації з іншими пептидами, наприклад, МНС- клас І чи II- специфічними пептидами. Досвідчений фахівець зможе вибрати бажані комбінації імуногенних пептидів шляхом тестування, наприклад, генерації Т-клітин in vitro, а також їхньої ефективності та загальної присутності, проліферації, спорідненості та розширення окремих Т-клітин для певних пептидів, та функціональності Т-клітин, наприклад, аналізуючи утворення IFN-γ (див. також приклади нижче). Зазвичай, найбільш ефективні пептиди згодом комбінуються як вакцина в цілях, описаних вище. Належна вакцина буде переважно вміщувати від 1 до 20 пептидів, найбільш переважно 2, 3, 4, 5, 6, 7, 8, 9, 10 або 11 різних пептидів, ще більш переважно, 6, 7, 8, 9, 10 або 11 різних пептидів, і, найбільш переважно, 11 різних пептидів. Довжина пептиду для використання в протираковій вакцині може бути будь-яким прийнятним пептидом. Зокрема, це може бути прийнятний 9-мерний пептид чи 7-, 8-, 10-, 11- або 12-мерний пептид. Пептиди більшої довжини також можуть використовуватись, але 9-мерні або 10-мерні пептиди, описані в доданій таблиці 1, с переважними пептидів МНС класу І. Пептид(и) становлять протипухлинну чи протиракову вакцину. Вона може вводитись безпосередньо пацієнту в уражений орган або системно, чи застосовуватись ex vivo до клітин, виділених з пацієнта, чи клітинної лінії людини, котрі згодом вводяться пацієнту, чи використовуватись in vitro для обирання субпопуляції з імунних клітин, які виділяються з пацієнта і потім знов вводяться йому. Пептид також може з'єднуватись з належним носієм, таким як гемоцианін лімфи равлика (KLH) або маннан (див. WO 95/18145 та Longenecker et al (1993) Ann. NY Acad. Sci. 690, 276-291). Пептидна вакцина може вводитися без ад'юванта. Вакцина з нуклеїновою кислотою може також вводитись з ад'ювантом, таким як BCG чи галун. Інші прийнятні ад'юванти включають стимулон Aquila's QS21 (Aquila Biotech, Ворчестер, Масачусетс, США), який виділяється з сапоніну, мікробактеріальні екстракти та синтетичні імітатори стінок бактеріальних клітин, а також патентовані ад'юванти, наприклад Ribi's Detox. Інший ад'ювант, похідний з сапоніну, Quil А, також може використовуватись (Superfos, Данія). Крім того, можуть використовуватись інші ад'юванти, такі як ад'ювант Фрейнда. Також може бути зручним введення пептиду, зв'язаного з гемоціаніном лімфи равлика, переважно також з ад'ювантом. Крім того, можуть використовуватись інші ад'юванти, такі, як зазначені вище. 17 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пептид також може бути міченим, або бути гібридним білком чи гібридною молекулою. + Очікується, що пептиди, послідовність яких дається в цьому винаходу, стимулюють CD8 ЦТЛ. + Однак, стимуляція більш ефективна у присутності підтримки, яка надається CD4 Т-клітинами. Отже, гібридний партнер або частини гібридної молекули належним чином утворюють епітопи, + + які стимулюють CD4 T-клітини. СО4 -стимулюючі епітопи добре відомі в цій галузі та включають епітопи, ідентифіковані в анатоксині правця. В особливо переважному втіленні пептидної вакцини, відповідно до винаходу, така вакцина є протипухлинною вакциною з кількох пептидів, для лікування гіпернефроми. Переважно, така вакцина вміщує ряд пухлино-асоційованих пептидів, згідно із послідовностями від SEQ ID NО: 1 до 10. котрі розташовані та ідентифіковані на первинних гіпернефромах. Цей ряд включає пептиди HLA класу І і класу II. Ряд пептидів може також вміщувати принаймні один пептид, такий як з внутрішнього антигену HBV, використовуваний як пептид позитивного контролю, що служить як імунний маркер для тестування ефективності інтрадермального введення. В одному з конкретних втілень винаходу, вакцина складається з 11 індивідуальних пептидів (згідно з послідовностями від SEQ ID NО: 1 до 11) від приблизно 1500мкг до приблизно 75 мкг, переважно від 1000 мкг до близько 750 мкг та більш переважно від приблизно 500 мкг до приблизно 600 мкг, і найбільш переважно - приблизно 578 мкг кожного пептиду, всі з яких можуть очищатися за допомогою HPLC та іонообмінної хроматографії та мають форму білого чи жовтуватого порошку. Ліофілізат переважно розчиняється в гідрокарбонаті натрію та використовується для інтрадермальних ін'єкцій протягом 30 хвилин після відновлення при кімнатній температурі. Відповідно до цього винаходу, переважні кількості пептидів можуть варіюватися від приблизно 0,1 до 100 мг, переважно, від приблизно 0,1 до 1 мг, та найбільш переважно - від приблизно 300 мкг до 800 мкг на 500 мкл розчину. Термін "приблизно" тут означає +/-10 процентів від даного значення, якщо не зазначено інше. Спеціаліст у цій галузі здатний відкорегувати фактичну кількість пептиду, який використовується, на основі кількох факторів, наприклад, імунного статусу індивідуального пацієнта та/або кількості TUMАР, що є присутньою в конкретному виді раку. Пептиди цього винаходу можуть бути надані в інших прийнятних формах (стерильні розчині та ін.) замість ліофілізату. Очікується, що деякі пептиди, послідовність яких дається в цьому винаходу, стимулюють + + CD8 ЦТЛ. Однак, стимуляція більш ефективна у присутності підтримки, яка надається CD4 Тклітинами. Отже, гібридний партнер або частини гібридної молекули належним чином + + утворюють епітопи, які стимулюють CD4 Т-клітини. CD4 -стимулюючі епітопи добре відомі в цій галузі та включають ті, що були ідентифіковані в анатоксині правця чи пептид з ММР7, які передбачені цим винаходом. Нарешті, вакцина, згідно із винаходом, може залежати від специфічного виду раку, яким хворіє пацієнт, що проходить лікування, а також стану захворювання, попередньої схеми лікування, імунного статусу пацієнта та, звичайно, від HLA-гаплотипу пацієнта. Крім того, вакцина, згідно із винаходом, може вміщувати індивідуалізовані компоненти, відповідно до особистих потреб конкретного пацієнта. Прикладами є різні кількості пептидів, згідно із експресією відповідних ПАА у зазначених конкретних пацієнтів, небажані побічні ефекти внаслідок алергії чи інших режимів лікування, а також корегування для другого курсу після проходження першого циклу чи курсу лікування. Ще один аспект цього винаходу належить до використання пептиду, згідно із винаходом, чи полінуклеотиду або вектора експресії, що кодує такий пептид, у виготовленні медикаменту для знищення клітин-мішеней у пацієнта, коли клітини-мішені аберантно експресують поліпептид, який вміщує амінокислотну послідовність винаходу. Переважним є використання фармацевтичної композиції, що є протираковою вакциною. Додатковий аспект цього винаходу забезпечує використання пептиду, згідно із винаходом, або полінуклеотиду чи вектора експресії, що кодує такий пептид, для виготовлення медикаменту для індукування імунної реакції, зокрема, клітинної імунної реакції, в особливості, імунної реакції з посередництвом Т-клітин, проти клітин солідних пухлин, коли такі клітини експресують МНС-молекулу класу І чи II людини на своїй поверхні та презентують поліпептид, який вміщує амінокислотну послідовність винаходу. В контексті цього винаходу було несподівано виявлено, що пухлинні клітини солідних пухлин, на відміну від здорових клітин тієї ж самої тканини, експресують молекулу HLA класу II людини на своїй поверхні. Цей факт був описаний тільки один раз в роботі Brasanac et al (Brasanac D, Markovic-Lipkovski J, Hadzi-Djokic J, Muller GA, Muller CA. Immunohistochemical analysis of HLA class II antigens and tumor infiltrating mononuclear cells in renal cell carcinoma: correlation with clinical and histopathological data. Neoplasma. 1999;46(3): 173-8.), де вивчалися заморожені в кріостаті шматочки 37 гіпернефром (RCC) - 25 клітин мононуклеарного типу, 10 18 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 гранулярних та 2 хромофобних - за непрямим імунопероксидазним методом, що використовує моноклональні антитіла (МоАЬ) до HLA-DR, -DP and-DQ- антигенів для аналізу антигенів HLA класу II, та анті-СВ14, -CD3, -CD4 та -CD8 МоАb до пухлиноінфільтруючих мононуклеарів (ТІМ). Кількість позитивних клітин оцінювалась напівкількісно, а результати імуногістохімічних досліджень були співвіднесені з клінічними (рік та стать пацієнта, розмір пухлини та TNM-стадія - за класифікацією TNM (розмір пухлини, стан лімфовузлів та наявність метастаз)) та гістопатологічними (цитологія, гістологія, ступінь) характеристиками RCC. Усі RCC експресували HLA-DR, 92 % -DQ та 73 % -DP-антигени з рівнем експресії в ієрархії - DR>-DQ>-DP, але ніяке статистично важливе співвідношення не могло бути встановлене з якимись проаналізованими гістопатологічними чи клінічними параметрами. Моноцити були в більшій кількості, ніж Тлімфоцити, а Т-клітини CD4+ - в більшій кількості, ніж CD8+, в той час як пухлини з перевагою Тлімфоцитів та приблизно рівною кількістю CD4+ та CD8+ Т-клітин мали найбільший середній діаметр. Неадекватна активація Т-лімфоцитів пухлинними клітинами (незважаючи на здатність антиген-презентування) могла бути причиною зв'язку параметрів, що означає більш агресивну поведінку пухлини, з аберантною експресією HLA-антигену класу II на RCC. Ще один аспект цього винаходу пропонує використання пептиду, згідно із винаходом, чи полінуклеотиду або вектора експресії, що кодує такий пептид, у виготовленні медикаменту для знищення клітин-мішеней у пацієнта, коли клітини-мішені аберантно експресують поліпептид, який вміщує амінокислотну послідовність, яка дасться в будь-якій з послідовностей з SEQ ID NО: 1 до 10. Інший аспект винаходу пропонує метод (методи) утворення активованих Т-лімфоцитів (ЦТЛ) in vivo або in vitro, причому перший метод включає контакт Т-клітин in vitro з антигензавантаженими МНС-молекулами класу І або II людини, експресованими на поверхні відповідної антиген-презентуючої клітини протягом періоду часу, достатнього для активації даних Т-клітин антиген-специфічним способом, коли антиген являє собою пептид, згідно із винаходом. Другий метод, який є більш переважним, описується в роботі Walter et al. (Walter S, Herrgen L, Schoor O, Jung G, Wernet D, Buhring HJ, Rammensee HG, Stevanovic S. Cutting edge: predetermined avidity of human CDS T-cells expanded on calibrated MHC/anti-CD28-coated microspheres. J Immunol. 2003 Nov 15; 171(10):4974-8). МНС-молекули класу II можуть експресуватися на поверхні будь-якої прийнятної клітини, та переважно, якщо клітина є такою, що природно не експресує МНС-молекули класу II (в цьому випадку виконується трансфекція клітини для експресії такої молекули) або, якщо експресує, вона є дефектною в шляхах процесингу чи презентації антигену. Таким чином,для клітини, що експресує МНС-молекулу класу II, можливо примування, по суті, повністю, обраним пептидним антигеном до активації ЦТЛ. Антиген-презентуюча клітина (чи клітина-стимулятор), як правило, має на своїй поверхні МНС-молекулу класу І або II та переважно не здатна, сама по собі, завантажувати зазначену МНС-молекулу класу І або II обраним антигеном. Як описується більш детально нижче, МНСмолекула класу І або II може легко завантажуватись вибраним антигеном in vitro. Переважно, клітина ссавців не має пептидного транспортера ТАР, чи має його знижений рівень або зменшену функцію. Відповідні клітини, в яких немає пептидного транспортера ТАР, включають Т2, RMA-S та клітини дрозофіли. ТАР - це Транспортер, асоційований з процесингом антигенів. Клітинна лінія Т2, яка не здатна завантажувати пептиди людини, є доступною для придбання в American Type Culture Collection, 12301 Parklawn Drive, Rockville, Меріленд 20852, США, номер за каталогом CRL 1992; лінія клітин дрозофіли, лінія Schneider 2, доступна для придбання в АТСС, номер за каталогом CRL 19863; клітинна лінія миші RMA-S описана авторами Кагге та Ljunggren (1985) J. Exp. Med. 162,1745. Простіше кажучи, клітина хазяїна перед трансфекцією практично не експресує МНС-молекул класу І. Також бажано, щоб клітина-стимулятор експресувала молекулу, важливу для костимуляції Т-клітини, наприклад, будь-яку з В7.1, В7.2, ІСАМ-1 та LFA 3. Ще в одному втіленні винаходу також можуть використовуватись комбінації HLA-молекул. + Використання рекомбінантних поліепітопних вакцин для доставки ряду CD8 ЦТЛ-епітопів описано в роботах Thomson et al (1996) J. Immunol. 157, 822-826 та WO 96/03144, посилання на які включені в цей документ. Відносно цього винаходу, бажано (та переважно) включити в єдину вакцину пептид (чи нуклеїнову кислоту, що кодує пептид), причому пептид включає в будьякому порядку амінокислотну послідовність цього винаходу та CD4-позитивний епітоп, який стимулює Т-клітину (таку як одержана з ММР-7). Ця вакцина була б особливо корисна для лікування ракових захворювань. 19 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для генерації ЦТЛ in vitro може використовуватись ряд інших методів. Наприклад, методи, описані в роботах Peoples et al (1995) Proc. Natl. Acad. Sci. USA 92,432-436 та Kawakami et al (1992) J. Immunol. 148, 638643 використовують аутологічні лімфоцити з популяцій пухлинних клітин в генерації ЦТЛ. В роботі Plebanski et al (1995) Eur. J. Immunol. 25, 1783-1787 описується використання аутологічних лімфоцитів периферичної крові (ЛПК) для отримання ЦТЛ. Робота Jochmus et al (1997) J. Gen. Virol. 78,1689-1695 стосується створення аутологічних ЦТЛ шляхом імпульсного введення пептиду чи поліпептиду до дендритних клітин або інфікування рекомбінантним вірусом. Автори роботи Hill et al (1995) J. Exp. Med. 181, 2221-2228 та Jerome et al (1993) J. Immunol. 151,1654-1662 використовують В-клітини у формуванні аутологічних ЦТЛ. Крім того, макрофаги, завантажені пептидом чи поліпептидом імпульсним методом або інфіковані рекомбінантним вірусом, можуть використовуватись для отримання аутологічних ЦТЛ. Алогенні клітини також можуть використовуватись у підготовці ЦТЛ, і цей спосіб детально описаний в патенті WO 97/26328, який включено в цей документ шляхом посилання. Наприклад, на додаток до клітин дрозофіли та клітин Т2, можуть застосовуватись інші клітини для представлення антигенів, такі як клітини СНО, клітини комах, інфіковані бакуловірусом, клітини бактерій, дріжджів та клітини-мішені, інфіковані коров'ячою віспою. Крім того, можуть використовуватись віруси рослин (див., наприклад, роботу Porta et al (1994) Virology 202, 449955, в якій описується розробка мозаїчного вірусу вігни як високопродуктивної системи для презентації чужорідних пептидів). Переважно, у методі, згідно із цим винаходом, антиген-презентуюча клітина вміщує вектор експресії, як описано вище. Активовані Т-клітини, коли вони спрямовуються проти пептидів винаходу, є корисними в терапії. Отже, ще один аспект винаходу пропонує активовані Т-клітини, що одержуються за допомогою згаданих вище методів винаходу. Ще один аспект винаходу пропонує активовані Т-клітини, котрі селективно розпізнають клітину, що аберантно експресує поліпептид, вміщуючий амінокислотну послідовність винаходу. Переважно, Т-клітини розпізнають цю клітину шляхом взаємодії з комплексом HLA/пептид (наприклад, зв'язування). Т-клітини є корисними у методі знищення клітин-мішеней у пацієнта, клітини-мішені якого аберантно експресують поліпептид, що вміщує амінокислотну послідовність винаходу, причому пацієнту вводиться ефективна кількість активованих Т-клітин. Ті Т-клітини, які вводяться пацієнту, можуть виділятися з пацієнта та активуватись, як описано вище (тобто, вони є аутологічними Т-клітинами). Альтернативно, Т-клітини одержуються не від пацієнта, а від іншої людини. Безумовно, переважно, якщо людина є здоровою людиною. Під терміном "здорова людина" автори винаходу мають на увазі, що людина взагалі має добре здоров'я, переважно має адекватну імунну систему та, ще більш переважно, не страждає від якогось захворювання, що може бути легко перевірено та виявлено. Активовані Т-клітини експресують рецептор Т-клітини (РТК), що включається в розпізнавання клітин, які експресують аберантний поліпептид. Корисно, якщо кДНК, що кодує РТК, клонується з активованих Т-клітин та передається в подальші Т-клітини для експресії. In vivo, клітини-мішені для CD4-позитивних Т-клітин, відповідно до одного з втілень цього винаходу, можуть бути клітинами пухлини (що іноді експресують МНС класу II) та/або клітинами строми, що оточують пухлину (клітинами пухлини) (які іноді також експресують МНС класу II). РТК клонів Т-клітин винаходу, специфічні для пептидів винаходу, є клонованими. Використання РТК в клонах Т-клітин визначається із використанням (і) РТК-варійованих моноклональних антитіл, які є регіонально специфічними, та (іі) RT PCR з праймерами, специфічними для генних сімейств Va та Vp. Бібліотека кДНК формується з полі-А- мРНК, що екстрагується з клонів Т-клітин. Використовуються праймери, специфічні для С-термінальної частини ланцюгів а та Р РТК та для N-термінальної частини ідентифікованих сегментів Va та Р. Повна кДНК для ланцюга а та Р РТК примножується ДНК-полімеразою високої точності, та примножені продукти клонуються в належний вектор клонування. Клоновані гени ланцюгу а та II можуть бути зібрані в РТК з одним ланцюгом за методом, описаним в роботі Chung et al (1994) Proc. Natl. Acad. Sci. USA 91, 12654-12658. В цій одноланцюговій конструкції за сегментом VaJ йде сегмент V DJ, після чого слідує сегмент Ср, за яким йде трансмембранний і цитоплазматичний сегмент ланцюга CD3. Цей одноланцюговий РТК потім вводиться у ретровірусний вектор експресії (може використовуватись панель векторів, на основі їхньої + здатності інфікувати зрілі CD8 Т-лімфоцити людини та бути посередником в генній експресії: ретровірусна векторна система Kat є одною з переважних можливостей (див. Finer et al (1994) Blood 83, 43). Амфотропний ретровірус високого титру використовується для інфікування + + очищених CD8 або CD4 Т-лімфоцитів, виділених з периферичної крові у пацієнтів з пухлинами 20 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 (за протоколом, опублікованим в роботі Roberts et al (1994) Blood 84,2878-2889, яка включена в цей документ шляхом посилання). Антитіла проти CD3 використовуються для ініціації + проліферації очищених CD8 Т-клітин, що полегшує ретровірусну інтеграцію та стабільну експресію одноланцюгових РТК. Ефективність ретровірусної трансдукції визначається шляхом 1 викрашування інфікованих CD8 Т-клітин антитілами, специфічними для РТК з одним ланцюгом. + Аналіз трансдукованих CD8 Т-клітин in vitro підтверджує, що вони демонструють те ж саме пухлиноспецифічне знищення, що спостерігається алло-рестрикційним Т-клітинним клоном, з + якого первісно були клоновані ланцюги РТК. Популяції трансдукованих CD8 Т-клітин з очікуваною специфічністю можуть використовуватись для адоптивної імунотерапії пацієнтів з пухлинами. Пацієнти можуть одержувати від 10 до 10 аутологічних трансдукованих Т-клітин. Аналогічно CD8-позитивним, можуть бути генеровані трансдуковані CD4-позитивні Т-клітинихелпери, які несуть відповідні конструкції. Інші прийнятні системи для введення генів у Т-клітини описані в роботі Moritz et al (1994) Proc. Natl. Acad. Sci. USA 91, 4318-4322, яка включена в цей документ шляхом посилання. В роботах Eshhar et al (1993) Proc. Natl. Acad. Sci. USA 90, 720-724 та Hwu et al (1993) J. Exp. Med. 178, 361-366 також описується трансфекція Т-клітин. Отже, інший аспект винаходу пропонує РТК, який розпізнає клітину, що аберантно експресує поліпептид, вміщуючий амінокислотну послідовність винаходу, причому РТК одержується з активованих Т-клітин. Як і РТК, у винахід включені молекули, функціонально еквівалентні РТК. Вони включають будь-яку молекулу, яка функціонально еквівалентна РТК, котра може виконувати ту ж функцію, що й РТК. Зокрема, такі молекули включають генетично розроблені тридоменні одноланцюгові РТК, які створюються за методом, описаним в роботі Chung et al (1994) Proc. Natl. Acad. Sci. USA 91, 12654-12658, яка включена в цей документ шляхом посилання та згадана вище. Винахід також включає полінуклеотид, що кодує РТК чи функціонально еквівалентну молекулу, та вектор експресії, який кодує РТК чи його функціонально еквівалентну молекулу. Вектори експресії, які є прийнятними для експресування РТК винаходу, включають описані вище, стосовно експресування пептидів винаходу. Однак, бажано, щоб вектори експресії були векторами, які здатні експресувати РТК в Тклітини після трансфекції. Ще один аспект винаходу пропонує метод знищення клітин-мішеней у пацієнта, коли клітини-мішені аберантно експресують поліпептид, який вміщує амінокислотну послідовність винаходу, і цей метод передбачає введення пацієнту ефективної кількості пептиду, згідно із винаходом, чи ефективної кількості полінуклеотиду або вектора експресії, що кодує даний пептид, або ефективної кількості Т-лімфоцитів, як визначено вище, причому кількість цього пептиду або полінуклеотиду чи вектора експресії або Т-клітин є ефективною для стимуляції імунної реакції проти клітини-мішені у зазначеного пацієнта. Клітина-мішень - це, як правило, пухлинна чи ракова клітина, зокрема, клітини солідних пухлин, що експресують МНС-молекулу класу І чи II людини на своїй поверхні та презентують поліпептид, який вміщує амінокислотну послідовність, котра надається вище. Ще один аспект винаходу пропонує метод знищення клітин-мішеней у пацієнта, коли ці клітини-мішені аберантно експресують поліпептид, що вміщує амінокислотну послідовність винаходу, і цей метод включає етапи (1) одержання Т-клітин від пацієнта; (2) введення в зазначені клітини полінуклеотиду, який кодує РТК, або функціонально еквівалентної молекули, як зазначено вище; та (3) введення клітин, утворених в етапі (2), пацієнту. Інший аспект винаходу пропонує метод знищення клітин-мішеней у пацієнта, коли ці клітинимішені аберантно експресують поліпептид, який вміщує амінокислотну послідовність, як визначено вище, і цей метод включає етапи (1) отримання антиген-презентуючих клітин, таких як дендритні клітини, від зазначеного пацієнта; (2) контакту антиген-презентуючих клітин з пептидом, як визначено в першому чи другому або третьому аспектах винаходу, або з полінуклеотидом, що кодує такий пептид, ex vivo; та (3) повторного введення таким чином оброблених антиген-презентуючих клітин пацієнту. Переважно, антиген-презентуючі клітини є дендритними клітинами. Відповідно, дендритні клітини є аутологічними дендритними клітинами, які імпульсним методом завантажуються антигенним пептидом. Антигенний пептид може бути належним антигенним пептидом, який викликає відповідну Т-клітинну реакцію. Т-клітинна терапія із використанням аутологічних дендритних клітин, в які імпульсним методом завантажуються пептиди з пухлино-асоційованого антигену, розкривається в роботі Murphy et al (1996) The Prostate 29,371-380 and Tjua et al (1997) The Prostate 32, 272-278. В іншому втіленні винаходу антиген-презентуючі клітини, такі як дендритні клітини, контактують з полінуклеотидом, котрий кодує пептид винаходу. Полінуклеотид може бути будь 21 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 яким відповідним полінуклеотидом, та переважно, щоб він був здатний трансдукувати дендритні клітини, таким чином забезпечуючи презентування пептиду та стимуляцію імунітету. Зручним є те, що полінуклеотид може включати в себе вірусний полінуклеотид чи вірус. Наприклад, показано, що дендритні клітини, трансдуковані аденовірусом, стимулюють антигенспецифічний протипухлинний імунітет відносно MUC1 (див. Gong et al (1997) Gene Ther. 4,10231028) Подібним чином, можуть використовуватись системи на основі аденовірусів (див., наприклад, роботу Wan et al (1997) Hum. Gene Ther. 8, 1355-1363); ретровірусні системи (Specht etal (1997) J. Exp. Med. 186, 1213-1221 та Szabolcs et al (1997). Крім того, можна використовувати перенос в дендритні клітини за допомогою кров'яних часток (Tuting et al (1997) Eur. J. Immunol. 27, 2702-2707); та можна використовувати РНК (Ashley et al (1997) J. Exp. Med. 186, 1177-1182). Роз'яснюється, що відносно методів знищення клітин-мішеней у пацієнта особливо бажано, щоб клітинами-мішенями були ракові клітини, ще більш переважно клітини злоякісних новоутворень нирки чи товстої кишки. В переважному втіленні винаходу перед лікуванням визначається HLA-гаплотип пацієнта. Визначення HLA-гаплотипу може проводитись із використанням будь-якого прийнятного методу; такі методи добре відомі фахівцям. Винахід включає, зокрема, використання пептидів винаходу (чи полінуклеотидів, що кодують їх) для активної вакцинації in vivo; для обробки аутологічних дендритних клітин in vitro із подальшим введенням таким чином оброблених дендритних клітин in vivo для активації Тклітинних реакцій; для активації аутологічних Т-клітин in vitro із подальшою адоптивною терапією (тобто, оброблені Т-клітини вводяться пацієнту); та для активації Т-клітин від здорових донорів (з відповідними чи невідповідними МНС) in vitro із подальшою адоптивною терапією. Вакцини цього винаходу, в його переважному втіленні, вводяться в організм-хазяїн окремо чи разом із іншими засобами протиракової терапії для сповільнення чи припинення формування пухлин. Пептидна вакцина може вводитися без ад'юванта. Вакцина з нуклеїновою кислотою може також вводитись з ад'ювантом, таким як BCG чи галун. Інші прийнятні ад'юванти також описані вище. Пептиди, відповідно до винаходу, також можуть використовуватись як діагностичні реактиви. Використовуючи пептиди, можна проаналізувати, чи присутні в Т-клітинній популяції ті Тклітини, які специфічно направлені проти пептиду або індукуються терапією. Крім того, збільшення прекурсорних Т-клітин може бути перевірено з тими пептидами, які демонструють реактивність проти визначеного пептиду. Пептид також може використовуватись як маркер для моніторингу розвитку пухлини, що експресує зазначений антиген, з якого виділяється пептид. В доданій Таблиці 1 перелічені пептиди в тому виді, як вони ідентифікуються. Крім того, в Таблиці визначені білки, з яких походить пептид, та відповідне положення пептиду в належному білку. Також даються відповідні інвентарні номери, котрі відносяться до генного банку (Genbank) "Національного Центру Інформації з Біотехнології" Національного Інституту Здоров'я (див. http://www.ncbi.nlm.nih.gov). В іншому переважному втіленні пептиди використовуються для викрашування лейкоцитів, зокрема, Т-лімфоцитів. Це використання має особливу перевагу, якщо доказується, чи присутні в ЦТЛ-популяції специфічні ЦТЛ, які спрямовані проти пептиду. Крім того, пептид можна використовувати як маркер для визначення ходу лікування аденомних чи ракових захворювань, пухлинної хвороби чи розладу. В іншому переважному втіленні пептиди використовуються для виробництва антитіла. Поліклональні антитіла можна одержати стандартним шляхом, за допомогою імунізації тварин, вводячи їм пептид, та подальшої очистки імунного глобуліну. Моноклональні антитіла можуть бути одержані за стандартними протоколами, такими як описані, наприклад, в роботі Methods Enzymol. (1986), 121, Hybridoma technology and monoclonal antibodies. Ідентифікація епітопів Т-хелперів пухлино-асоційованих антигенів залишається важливою задачею в протипухлинній імунотерапії. До цього часу, були описані різноманітні стратегії щодо ідентифікації пептидів класу І чи II з ПАА, починаючи від інкубування АПК з антигеном, що представляє інтерес, для забезпечення можливості його захвату, обробки та презентування (Chaux, P., V. Vantomme, V. Stroobant, К. Thielemans, J. Corthals, R. Luiten, A.M. Eggermont, T. Boon, and B.P. van der Bruggen. 1999. Identification of MAGE-3 epitopes presented by HLA-DR molecules to CD4(+) T lymphocytes. J. Exp. Med. 189:767-778), to various transfection strategies with fusion proteins (Dengjel, J., P.Decker, O. Schoor, F. Altenberend, T. Weinschenk, H.G. Rammensee, and S. Stevanovic. 2004. Identification of a naturally processed cyclin Dl T-helper epitope by a novel combination of HLA class II targeting and differential mass spectrometry. Eur. J. Immunol. 34:3644 22 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 55 60 3651). Усі ці методи є дуже трудомісткими та часто залишаються неясними, якщо ідентифіковані HLA-ліганди фактично представлені ги vivo тканиною людини. Автори винаходу ідентифікували ліганд, що є причиною одної ключової послідовності з ММР7. Автори винаходу виявили, що цей білок надмірно експресується в гіпернефромі; до того ж, він був описаний як пухлино-асоційований (Miyamoto, S., К. Yano, S. Sugimoto, G. Ishii, T. Hasebe, Y. Endoh, K. Kodama, M. Goya, T. Chiba, and A. Ochiai. 2004. Matrix metalloproteinase-7 facilitates insulin-like growth factor bioavailability through its proteinase activity on insulin-like growth factor binding protein 3. Cancer Res. 64:665-671; Sumi, Т., Т. Nakatani, H. Yoshida, Y. Hyun, T. Yasui, Y. Matsumoto, E. Nakagawa, K. Sugimura, H. Kawashima, and O. Ishiko. 2003. Expression of matrix metalloproteinases 7 and 2 in human renal cell carcinoma. Oncol. Rep. 10:567-570). Цей пептид неспецифічно зв'язувався з молекулами HLA класу II та був здатний активувати СD4позитивпі Т-клітиии від різних здорових донорів. Таким чином, підхід авторів винаходу буде корисним для ідентифікації нових перспективних варіантів пептидів класу II з ПАА для використання в клінічних протоколах вакцинацій. Слід взяти до уваги, що ознаки винаходу, які розкриваються та описуються в цьому документі, можна використовувати тільки у відповідній комбінації, як зазначається, та за єдиною формою, не відходячи від обсягу цього винаходу. Тепер винахід буде описуватися більш детально, із посиланням на наступні креслення, перелік послідовності та приклади. Наступні приклади даються в ілюстративних цілях та не мають наміру обмежувати винахід. Послідовності SEQ ID NО: 1 та SEQ ID NО: 2 показують пептидні послідовності Т-клітинного епітопа, що вміщує пептиди, які представлені МНС класу І або II, згідно із цим винаходом. SKQ ID NО: 3-SEQ ID NО: 11 показують пептидні послідовності тих пептидів, що використовуються у вакцині цього винаходу, яка далі іменується "ІМА". Фіг. 1 показує презентацію пептиду ІМА-МЕТ-001, одержаного з c-Met-протоонкогену, на зразку первинної пухлини RCC013. Нано-капілярна високоефективна рідинна хроматографія ESI MS була проведена на пептидах, елюйованих з RCC013. Мас-хроматограма для 1006,54±0,5 Da показує пікове значення при часі витримування 47.8 хвилин. Мас-спектр індукованого зіткненнями розпаду з m/z 1006.54, зареєстрований в другому циклі LC-MS при заданому часі витримування та показаний у вставці, підтвердив наявність ІМА-МЕТ-001 (Weinschenk 2002). Фіг. 2 показує експресію тканинами c-Met-протоонкогену (MET). Експресія була проаналізована із використанням олігонуклеотидних мікро-чіпів. Номери копій відносяться до нирки, що встановлена на 1.0. "Р" означає, що ген присутній, "А" - що він відсутній, а "М" - ген присутній в незначній кількості, відповідно до статистичних абсолютних call-алгоритмів. "І" означає, що експресія гену значно збільшилася, по відношенню до нирки, "D" - зменшена експресія, a "NC" означає, що в експресії не відбулося змін. Значення експресії стосовно нирки розраховується за відношенням реєстрації сигналу та відображається в верхній частині смуг. Пунктирна горизонтальна лінія показує найвищу експресію в нормальних тканинах (в цьому випадку - легенів). Фіг. 3 показує знищення завантажених пептидом клітин-мішеней цитотоксичними Тлімфоцитами (ЦТЛ), примованими ІМА-МЕТ-001. Фіг. 4 показує знищення ракових клітин ЦТЛ, примованими ІМА-МЕТ-001. Малюнок 5 показує аналіз інгібування із використанням "холодних" клітин-мішеней. Малюнок 6 показує тетрамерний аналіз подовжень, керованих мікросферами. Фіг. 7 показує in vitro- імуногенність ІМА-ММР-001 - Представницькі значення внутрішньоклітинних гамма-IFN/CD4- викрашувань чотирьох здорових донорів. Донори 1, 2 і 3 продемонстрували СD4-позитивш Т-клітини, реактивні проти ІМА-ММР-001 після третьої та четвертої стимуляції. Донор 4 був також негативним. Фіг. 8 показує диференційну пептидну презентацію на тканині пухлини і здоровій тканині - (А) Мас-спектр двох пептидних видів m/z 739.96 та 741.95, одержаний з тканини нормальної нирки і тканини гіпернефроми пацієнта RCC100, відповідно. Мас-спектр демонструє приблизно 4кратну надмірну презентацію пептиду Адипофіліну на тканині гіпернефроми, в порівнянні з відповідною аутологічною нормальною тканиною (В). Mac-спектрометричний аналіз індукованого зіткненнями розпаду m/z 741.95 (пухлина) виявив пептидну послідовність IMAADF-003, - пептидну послідовність, одержану з Адипофіліну. Фіг. 9 показує імунітет in vivo проти IMA-ADF-001 - Т-клітинний імунітет у 2 пацієнтів, хворих на RCC, проти кількох не-вакцинованих пептидів у пацієнтів, котрим було зроблено щеплення аутологічними дендритними клітинами, в які імпульсним шляхом введені TUMAP, одержані з MUC. Т-клітини, специфічні для IMA-ADF-001 ("Адипофілін"), не були присутні до вакцинації та 23 UA 105210 C2 5 10 15 20 25 30 були визначені у пацієнта № 3 (верхня панель) після 6 вакцинацій та у пацієнта № 8 (нижня панель) після 8 вакцинацій. Фіг. 10 показує представницькі зразки ІМА-індукованої Т-клітинної реакції, ідентифіковані із використанням амнліфікаційного аналізу ELISPOT для того ж пацієнта і антигену. Верхня та нижня колонка представляють негативний контроль антигену HIV-001 та окремий TUMAP IMACCN-001, що використовується для зчитування, відповідно. Ліва колонка показує ELISPOT пулу зразків, взятих до вакцинації на день відсіву 2 (S2) та безпосередньо до першої ін'єкції (VI). Права колонка показує ELISPOT пулу зразків, взятих протягом протоколу вакцинації на 22-й день (V6) та 36-й день (V7). Кількість позитивних клітин дається для кожного експерименту. Фіг. 11. Представницькі приклади ІМА-індукованих Т-клітинних реакцій, що ідентифіковані за допомогою ампліфікаційного тетрамерного аналізу за методом викрашування. Верхня та середня панелі представляють двомірні дот-ділянки, обмежені CD3+ лімфоцитами; нижні панелі обмежені CD3+CD8+ лімфоцитами. Пацієнти, моменти часу та викрашування є такими, що зазначені для кожної колонки. S1+V1: зразки, взяті до вакцинації; V4+V5: зразки, взяті на 8-й та на 15-й день; V6+V7: зразки, взяті на 22-й та 36-й день; V8+FU: зразки, взяті на 64-й день (остання вакцинація) та після 85-го до 92-го дня (кінець дослідження). А: Дані для пацієнта 03-004, що підтверджують імунологічну реакцію на IMA-CCN-001, показані на Фіг. 10. Клітинна популяція, позитивна на CD3+ т IMA-CCN-001-тетрамер, може бути ідентифікована після четвертої та п'ятої ін'єкції IMA (V6+V7; середня панель), що була причиною 0,78 % лімфоцитів (V6+V7; нижня панель). Ніяка позитивна популяція не була виявлена для К67-001-тетрамеру (верхня панель). В: Дані для пацієнта 03-003 не показали ніякої імунологічноїреакції проти пептиду ІMA-RGS-001 (верхня панель), але показали виникнення IMA-CCN-001-тетрамер-позитивної реакції протягом часового курсу протоколу вакцинації (середня панель, колонка 3 і 4), що обумовлює до 0,8 % лімфоцитів (нижня панель; колонка 3). Фіг. 12: Кінетика величин Т-клітин, що спостерігалася в ампліфікаційних тетрамерних аналізах визначених моментів часу. Результати показані для зчитувань у визначені моменти часу для пацієнта 05-001, у якого індукована вакциною Т-клітинна реакція була визначена за допомогою стандартного ампліфікаційного тетрамерного аналізу зі змішаними зразками. Результати даються для всіх пухлино-асоційованих антигенів, присутніх в ІМ А (пул TUMAP) та, зокрема, для пептиду IMA-CCN-001. Крім того, показані контролі HІV-001 та IMA-HBV-001 в межах одного аналізу у визначений момент часу. Приклади Глосарій Терміни чи скорочення АЕ AJCC BfArM CTL DC GM-CSF rhuGM-CSF HBV HLA IARC IMP INF MAA мне RCC SAE SmPC TUMAP Опис Небажане явище Американський Об'єднаний Комітет по Раку Bundesinstitut fur Arzneimittel und Medizinprodukte Цитотоксичні Т-клітини Дендритна клітина rhuGM-CSF (Рекомбінантний фактор стимулювання колоній гранулоцитів-макрофагів у людини) Вірус гепатиту В Антиген на поверхні лейкоцитів людини Міжнародна Агенція по Вивченню Раку Досліджуваний медичний продукт Інтерферон Заявка на видачу реєстраційного посвідчення Головний комплекс гістосумісності Гіпернефрома Серйозне небажане явище Стисле викладення характеристик продукту Пухлиноасоційований пептид 35 1. Характеристика пептидів цього винаходу Дані відносно експресії генних продуктів, з яких одержуються ІМА-пептиди Пептиди, що були ідентифіковані з тканини первинної RCC, були вибрані до включення у вакцину ІМА (див. нижче), відповідно до внутрішньої системи класифікації, переважно, на основі 24 UA 105210 C2 5 10 15 20 25 30 35 40 45 50 аналізу генної експресії, наукової літератури та пошуку у базі даних відомих властивостей антигену, з якого ідентифіковано одержаний пептид. Усі природно існуючі пептиди мають високу надмірну експресію в тканині гіпернефроми, в порівнянні з тканиною нормальної нирки, а також рядом інших здорових органів і тканин. Такий відбір необхідний для того, щоб (1) підібрати пептиди, котрі здатні індукувати Т-клітини з високою специфічністю для розпізнавання пухлини, а не інших тканин, для зведення до мінімуму шансу аутоімунності, викликаної вакцинацією ІМА, та (2) забезпечити, щоб більшість пухлин в популяції пацієнтів розпізнавалася індукованою Тклітиною. Середня розповсюдженість антигенів, з яких одержані пептиди, вміщені в ІМА, становить 68 % (надмірна експресія в RCC в порівнянні із здоровими органами і тканинами в n=24 зразках RCC) та варіюється в діапазоні від 54 % до 96 % для окремих антигенів. Це значно вище, ніж в стандартних пухлинних антигенах, таких як Her-2/neu (розповсюдженість: 25-30 %). Профілі глобальної генної експресії були побудовані із використанням системи мікро-чипів високої щільності (Affymetrix), що є в продажу. РНК була виділена з тканин, оброблена та гібридизована з олігонуклеотидними мікро-чипами високої щільності. Після викрашування і промивання, чипи були проскановані, та інтенсивність флуоресценції кожної точки на чипі представляла вид рівня експресії гену, що відповідав ДНК-послідовності олігонуклеотиду. Кілька олігонуклеотидів на чипах охоплюють послідовність кожного гена. Після статистичного комп'ютерного аналізу відповідні парні значення експресії між двома зразками можна одержати для кожного гену. Стандартизація усіх даних з різних зразків із використанням одного постійного зразку як базису дозволяє кількісно оцінити рівні експресії між усіма зразками. Джерела РНК - Усі РНК з тканин людини були одержані комерційним шляхом (Ambion, Хантінгтон, Великобританія; Clontech, Гейдельберг, Німеччина; Stratagene, Амстердам, Нідерланди, BioChain, Гейдельберг, Німеччина). Усі РНК від кількох осіб були змішані таким чином, щоб РНК від кожної особи була однаково зважена. Якість та кількість була підтверджена на приладі Agilent 2100 Bioanalyzer (Agilent, Вальбронн, Німеччина) із використанням лабораторного комплекту RNA 6000 Nano LabChip Kit (Agilent). Аналіз із використанням олігонуклеотидних мікро-чипів високої щільності - Двониткова ДНК була синтезована з 5-8 мгк усієї РНК за допомогою Superscript RTII (Life Technologies, Inc., Карлсруе, Німеччина) та праймеру (Eurogentec, Серенг, Бельгія), як зазначено в посібнику Affymetrix. In vitro-транскрипція із використанням приладу маркування РНК-транскриитів BioArray™ High Yield™ RNA Transcript Labelling Kit (ENZO Diagnostics, Inc., Фармінгейл, штат Нью-Йорк), фрагментація, гібридизація на Affymetrix U133A чи U133 Plus 2.0 GeneChips (Affymetrix, Санта Клара, Каліфорнія) та викрашування стрептавідін-фікоерітріновим та біотінільованим анти-стрептавідиновим антитілом (Molecular Probes, Лейден, Нідерланди) виконувалось згідно із протоклоами виробника (Affymetrix). Був використаний сканер Affymetrix GeneArray Scanner, і дані були проаналізовані за допомогою програмного забезпечення Microarray Analysis Suite 5.0 або системної програми GeneChipt® Operating Software (GCOS). Для стандартизації були використані 100 службових генів, наданих Affymetrix. Парні порівняння були розраховані із використанням значень експресії в нирці, як базису. Відповідно, усі значення експресії, розраховані відносно реєстрації сигналу, даються застосовно до нирки, що визначена як 1. Про значимість диференційної експресії можна судити по значенням "змін", наданим статистичними алгоритмами, які впроваджені в комп'ютерній програмі. Для абсолютного визначення експресії, дані були проаналізовані знову, із використанням статистичних алгоритмів. Наявність чи відсутність генної експресії була визначена абсолютними call-алгоритмами. Панель експресії зразкової тканини для генної експресії протоонкогену c-Met (MET) показана на Малюнку 2. MET був надмірно експресований в 96 % проаналізованих гіпернефром (n=24, права сторона), але така експресія не спостерігалася чи спостерігалася в набагато меншій мірі в декількох вибраних здорових тканинах та органах, а також імунологічно важливих тканинах і клітинах (ліва сторона на ФІГ. 2): В Таблиці 1 підсумовані пептиди, які вміщені у вакцині винаходу 1МА, що включає також пептиди, відповідно до винаходу. 25 UA 105210 C2 Таблиця 1 Пептиди, згідно із цим винаходом Внутрішній Ід. номер послідовності ІМА-ММР-001 IMA-ADF-002 IMA-ADF-001 ІМА-АРО-001 IMA-CCN-001 IMA-GUC-001 ІМА-К67-001 IМА-МЕТ-001 IMA-MUC-001 IMA-RGS-001 ІМЛ-HBV-001 Антиген Матрична металопротеїназа 7 Адипофілін Адипофілін Аполіпопротеїн L1 Циклін D1 GUCY1A3 КІАА0367 протоонкоген c-met MUC1 RGS-5 HBV № послідовності SEQ ID-No. Послідовність SQDDIKGIQKLYGKRS 1 VMAGDIYSV SVASTITGV ALADGVQKV LLGATCMFV SVFAGVVGV ALFDGDPHL YVDPVITSI STAPPVHNV LAALPHSCL FLPSDFFPSV 2 3 4 5 6 7 8 9 10 11 В Таблиці 2 підсумовуються результати експресії для усіх антигенів, що кодують пептиди, вміщені у вакцині винаходу ІМА, а також пептиди, відповідно до винаходу. 5 Таблиця 2 Частоти надмірної експресії антигенів в RCC (n=24) Внутрішній Ід.номер послідовності IMA-ADF-001 & 002 ІМА-АРО-001 IMA-CCN-001 IMA-GUC-001 ІМА-К67-001 ІМА-МЕТ-001 IMA-MUC-001 IMA-RGS-001 ІМА-ММР-001 Значна надмірна експресія RCC в 1 порівнянні з почкою Антиген Адипофілін Анголіпонротеїн L1 Циклін D1 GUCY1A3 КІАА0367 протоонкоген c-met 83 % 67 % 58 % 88 % 54 % 96 % Ніякої надмірної MUC1 експресії на рівні мРНК RGS-5 96 % Матрична металопротеїназа 7 58 % Надмірна експресія RCC в порівнянні з усіма нормальними 2 тканинами 75 % 58 % 63 % 71 % J 54 % 96 % Ніякої надмірної експресії на рівні мРНК 58 % 67 % 1 Відповідно до значень "змін", наданих статистичними алгоритмами, впровадженими в комп'ютерній програмі (номер "1") 2 Кількість RCC зі збільшеною експресією, в порівнянні з нормальною тканиною з найвищою експресією між усіма нормальними тканинами 3 Мозок є імуно-привілейованим та не враховується з цієї причини 10 Мінімальна надмірна експресія в RCC в порівнянні з усіма нормальними тканинами становить 54 %, максимальна - 96 %. Це значно вище, ніж в стандартних пухлинних антигенах, таких як Her-2/neu (розповсюдженість: 25-30 %). Виняток становить MUC, де ніяка надмірна експресія не визначається для мРНК MUC. Однак, треба взяти до уваги наступні опубліковані звіти: 1. Аберантне дегликозилювання в злоякісних новоутвореннях є типовим та викриває епітопи в пухлинних тканинах, котрі не могли б бути присутні на нормальних клітинах. Існує висока ймовірність того, що такий механізм також працює в RCC. Це може пояснити специфічне 26 UA 105210 C2 5 10 15 20 25 30 35 знищення ліній пухлинних клітин, що експресують MUC (Brossart 1999). Будь ласка, див. також главу 4.1.5 щодо властивостей MUC. 2. IMA-MUC-001 вводився в комбінації з аутологічними дендритними клітинами у випробуванні, ініційованому дослідником, в Універсітеті Тюбінгену (Tubingen). В цьому випробуванні, представленому недавно на засіданні ASCO 2003 (Mueller 2003) та в наступних даних на ASCO 2005 (Wierecky 2005), не були описані ніякі ауто-імунні ефекти. 3. Інші звіти про клінічні дослідження демонструють, що цитотоксичні Т-клітини, специфічні для IMA-MUC-001, існують природно (без імунізації) у пацієнтів з карциномою молочної залози (Rentzsch 2003) та колоректальною карциномою (Dittmann 2004). Ніякі дані про аутоімунні ефекти не наводяться щодо цих пацієнтів. Це підкреслює природну роль IMA-MUC-001 специфічних Т-клітин. На основі цих підтверджуючих даних, застосування IMA-MUC-001 може вважатися безпечним, хоча ніяка надмірна експресія не може бути визначена для MUC-антигену на одному лише рівні мРНК. Неспецифічне зв'язування ІМА-ММР-001 з кількома HLA-DR-алелями. ІМА-ММР-001 - це пептид, який зв'язується з HLA-DR, HLA-молекулою класу II. TUMAP класу II активують Т-клітини-хелпери, котрі відіграють важливу роль у сприянні функції цитотоксичних Т-клітин, активованих TUMAP класу II. Неспецифічне зв'язування пептиду HLA-DR є важливим для забезпечення того, щоб більшість (>50 %) НLА-А*02-позитивних пацієнтів, що проходять лікування ІМА, були також здатні проявляти Т-клітинну реакцію на ІМА-ММР-001. In silico аналіз зв'язування ІМА-ММР-001 вказує на те, що ІМА-ММР-001 неспецифічно зв'язується з кількома HLA-DR-алелями (DRB1*0101, *0301, *0401, *1101 та *1501), що охоплює в сукупності якнайменше 69,6 % НLА-А2-позитивної білої раси. Неспецифічне зв'язування ІМА-ММР-001 підтверджується експериментально даними імуногенності in vitro. Принцип тесту Із використанням алгоритму SYFPEITHI, розробленого Університетом Тюбінгену (Rammensee 1997; Rammensee 1999), було класифіковане зв'язування ІМА-ММР-001 з кількома типовими алелями HLA-DR (див. таблицю нижче). Алгоритм був успішно використаний для ідентифікації епітопів класу І та класу її з широкого ряду антигенів, наприклад, з антигенів людини ТАА TRP2 (клас І) (Sun 2000) та SSX2 (клас II) (Neumann 2004). Проаналізовані HLADR-алелі охоплюють принаймні 69,6 % HLA-А2-позитивної білої раси (Моrі 1997). Порогове значення для зв'язування було визначене на показнику 18, на основі аналізу показників зв'язування відомих опублікованих неспецифічних HLA-DR лігандів. Неспецифічне зв'язування визначається як зв'язування пептиду HLA-DR з кількома HLA-DR-алелями, експресованими принаймні у 50 % білої раси. Локуси HLA-A та HLA-DR знаходяться у стані неврівноваженості зв'язків, що дає комбінації HLA-A2 та специфічних HLA-DR, котрі мають перевагу в порівнянні з іншими (Таблиця 3). Таблиця 3 Гаплотип HLA-A HLA-DR 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 2 9 2 10 2 11 2 12 2 n.а. 40 Частота [%] 8,8 14,9 6,1 21,3 1,2 15,2 13,0 4,2 1,2 1,4 8,7 2,6 1,4 Таблиця 3: Частоти галотипів Північно-американської білої раси - Показані серологічні гаплотипи. N.a. означає "не присвоєний" (Mori 1997). Ліганди окремих МНС-молекул несуть відповідні хімічні амінокислоти у визначених позиціях їхньої первинної послідовності, що дозволяє визначити пептидний мотив для кожного МНС-алеля (Falk 1991). SYFPE1THI використовує матриці мотивів, виведені з уточнених мотивів, що виключно основані на аналізі 27 UA 105210 C2 природних лігандів за методом розщеплення по Кдману чи тандемної мас-спектрометрії (Schirle 2001). Ці матриці дозволяють точно спрогнозувати пептиди з даної білкової послідовності, презентовані на МНС-молекулах класу І чи класу II (Rotzschke 1991). 5 Таблиця 4 Антиген DRB1*-алель ІМА-ММР-001 10 15 20 25 30 35 40 45 50 0101 (8,8 %) 35 0301 (6,1 %) 18 0401 (21,3 %) 20 0701 (13,0 %) 14 1101 (8,7 %) 26 1501 (п.а. %) 20 Таблиця 4: Показники зв'язування ІМА-ММР-001 з типовими HLA-DR-алелями Наведені показники SYFPEITHI щодо зв'язування ІМА-ММР-001 з найбільш типовими алелями HLA-DRB1 в білій расі. Частоти відповідних серологічних гаплотипів HLA-А2-позитивних представників білої раси надані в дужках. Пептид вважався таким, що зв'язується з HLA-молекулою, коли показник дорівнював чи перевищував 18. Но основі прогнозу алгоритму SYFPEITHI. ІМА-ММР-001, ймовірно, зв'язується з кількома HLA-DR-алелями (DRB1*0101, *0301, *0401, * 1101 та * 1501), що охоплюють, принаймні, 69.6 % НLА-А2-нозитивної білої раси. Оскільки немає в наявності частотних даних HLA-DR15, цей алель не включається у розрахунок. Отже, є велика вірогідність, що обхват популяції навіть вище, ніж 69.9 %. Експериментальне підтвердження неспецифічного зв'язування ІМА-ММР-001 одержане завдяки даним імуногенності in vitro (див.нижче). Порівняння експресії антигену та презентування одержаного пептиду на пухлині та аутологічній нормальній тканині. Передбачається, що надмірно експресовані антигени будуть надмірно презентуватися на клітинній поверхні HLA-молекул. Як приклад, було показано, що пептид HLA-A*03, який походить з Адипофіліну, надмірно експресованого антигену, з якого одержані НLА-А*02-пептиди IMA-ADF-001 та IMA-ADF-002, включені в ІМА, надмірно презентується на тканині гіпернефроми, в порівнянні з аутологічною нормальною тканиною від пацієнта RCC100, із застосуванням стратегії QUALITEA. Це демонструє, в даному ілюстративному випадку, що надмірна експресія антигену (в цьому випадку, Адипофілін) співвідноситься з надмірним презентуванням одержаних з того ж антигену пептидів. Метод детально описаний в роботі (Lemmel 2004). QUALITEA представляє стратегію диференційного кількісного аналізу HLA-елюйованих пептидів з пухлини та нормальної тканини. 1 2 HLA-ліганди, одержані з двох різних джерел, - це N-термінально дериватизовані Нх- або DX реагентом і комбіновані ліганди. Після виправлення складу пептиду за методом високоефективної рідинної хроматографії, пептиди кількісно оцінюються із використанням 1 аналізу RSI-MS, відповідно до їхніх пікових ділянок. Пара дериватизованих пептидів ( Нх2 дериватизація та Dх-дериватизація) є фізично та хімічно ідентичною та легко визначається, оскільки вона, по суті, коелююється в хроматографічних системах. Крім того, існує різниця у масах, вимірювана в ході циклів мас-спектрометричного сканування. Ця різниця залежить від кількості стабільних ізотопів у похідній сполуці. Ідентифікація послідовності ліганду виконується за допомогою аналізу ESI-MSMS та пошуку в комп'ютерній базі даних зареєстрованого спектру. Отже, цей аналіз надає інформацію про якісні та кількісні аспекти пептидної презентації на пухлині та нормальній тканині. Приклад диференційної презентації HLA-пептиду на пухлині та нормальній тканині надмірно експресованого антигену показаний на Фіг. 8. Пептид IMA-ADF-003, котрий був в 4-кратній мірі надмірно експресований на тканині пухлини, в порівнянні з тканиною здорової нирки від пацієнта RCC100, був ідентифікований за допомогою мас-спектрометричного аналізу індукованого зіткненнями розпаду серед багатьох однаково презентованих пептидів. Цей пептид, надмірно презентований на клітині пухлини, був одержаний з Адипофіліну. Аналіз генної експресії того ж пацієнту RCC100 виявив також 2.64-кратну надмірну експресію Адипофіліну в тканині цієї пухлини, в порівнянні із здоровою ниркою (дані не показані). Ці дані підтверджують, в даному конкретному випадку, що надмірна експресія в тканині пухлини на генному рівні призводить до надмірної презентації пептиду на поверхні пухлинної клітини. Імуногенність in vivo проти IMA-ADF-001 В аутологічні дендритні клітини (DC), отримані у пацієнтів з RCC, були імпульсним шляхом введені два TUMAP, одержані з MUC, серед яких був IMA-MUC-001. IMA-ADF-001 не був 28
ДивитисяДодаткова інформація
Автори російськоюHarpreet Singh, Niels Emmerich, Steffen Walter, Toni Weinschenk
МПК / Мітки
МПК: A61K 39/00, A61K 38/00, C12N 15/00, C07K 14/47
Мітки: вакцина, застосування, протиракова
Код посилання
<a href="https://ua.patents.su/61-105210-protirakova-vakcina-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Протиракова вакцина та її застосування</a>
Попередній патент: Установка для керамічного наплавлення промислових печей
Наступний патент: Хіноксалінові похідні і їх застосування для лікування доброякісних і злоякісних пухлинних захворювань
Випадковий патент: 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили та спосіб їх отримання