2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили та спосіб їх отримання
Номер патенту: 109029
Опубліковано: 10.07.2015
Автори: Воловенко Юліан Михайлович, Хиля Ольга Володимирівна, Кулай Ігор Володимирович, Воловненко Тетяна Анатоліївна
Формула / Реферат
1. 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили загальної формули (І):
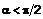 ,
,
де
X = O або CH2, причому кількість атомів Оксигену лише один;
Y = N або CR3, причому кількість атомів Нітрогену від 0 до 1;
R1 = (C1-C6)поліфторалкіл, Ar;
R3 = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2;
R4 = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2;
замісники R4 або R3 та R4, розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
Z = S, N, NR2; R2 = H, Alk, (C1-C6)поліфторалкіл, Bn;
у випадку Z = NR2: замісники R1, R2, розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
Alk = (C1-C6)алкіл; Bn = Ph-(C1-C6)алкіл;
Hal = F, Cl, Br, I;
n = 1-2; m = 0-2;
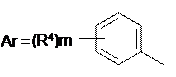 ;
;
за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal.
2. Спосіб отримання 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (І):
 ,
,
де
X = O або CH2, причому кількість атомів Оксигену лише один;
Y = N або CR3, причому кількість атомів Нітрогену від 0 до 1;
R1 = (C1-C6)поліфторалкіл, Ar;
R3 = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2;
R4 = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2;
замісники R4 або R3 та R4, розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
Z = S, N, NR2; R2 = H, Alk, (C1-C6)поліфторалкіл, Bn;
у випадку Z = NR2: замісники R1, R2, розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
Alk = (C1-C6)алкіл; Bn = Ph-(C1-C6)алкіл;
Hal = F, Cl, Br, I;
n = 1-2; m = 0-2;
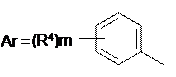 ;
;
за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal,
при якому здійснюють такі етапи:
отримують похідні 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили загальної формули (І) шляхом ацилювання гетарилацетонітрилів загальної формули (ІІ) 4-хлоробутаноїлхлоридом (IV) в присутності основи і послідовної циклізації утворених 2-гетариліден-3-оксо-6-хлорогексаннітрилів загальної формули (ІІІ) при нагріванні в присутності основи.
Текст
Реферат: Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме 2гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (І) та способу їх отримання X Het X CN . (І) 2-Гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили можуть бути використані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. UA 109029 C2 Даний винахід стосується галузі органічної хімії, зокрема хімії гетероциклічних сполук, а саме 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (І) та способу їх отримання (I) (R4)m (R1)n 1 2 Het= , , 5 10 15 20 де X=O або CH2, причому кількість атомів Оксигену лише один; 3 Y=N або CR , причому кількість атомів Нітрогену від 0 до 1; 1 R = (C1-C6)поліфторалкіл, Ar; 3 R =H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 R =H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 3 4 замісники R або R та R розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; 2 2 Z=S, N, NR ; R =H, Alk, (C1-C6)поліфторалкіл, Bn; 2 1 2 у випадку Z=NR : замісники R , R розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; Alk = (C1-C6)алкіл; Bn=Ph-(C1-C6)алкіл; Hal=F, Cl, Br, I; n=1-2; m=0-2; Ar = (R4)m ; 25 30 35 за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal. 2-Гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили можуть бути використані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. Сполуки, що заявляються, їх властивості та спосіб отримання в літературі не описані. Відомі такі способи отримання похідних 2-тетрагідро-2-фураніліденацетонітрилів. Конденсація діетилацеталю бутиролактону з метиленактивними сполуками. Ацеталь бутиролактону вступав в реакції лише з відносно сильними СН-кислотами [Соловьева Н.П., Марченко Η.Б., Граник В.Г., Шейнкер Ю.Н. // Хим. гетероцикл. соед. - 1982. - № 7. - С. 914-918; Марченко Η. Б., Граник В. Г. // Хим. гетероцикл. соед. - 1982. - № 1. - С. 68-71; Ершов Л. В., Граник В. Г. // Хим. гетероцикл. соед. - 1985. - № 7. - С. 929-932], як зображено на схемі 1. Схема 1 O O EtOH/F3B. Et2O O O O Et R Et CN O R CN R=COOC2H5;CN;CONH2;COOCH3. 40 Недоліками цього способу є необхідність в використанні токсичних речовин, проведення реакції при високих температурах, а також невисокі виходи реакції. 1 UA 109029 C2 5 Синтез 2-(тетрагідро-2-фураніліден)-4-(метиламіно)бутиронітрилу на основі реакції циклоприєднання між ацетатом N-[2-тетрагідро-2-фураніліден]-Nметил(триметилсиліл)метанамінію та акрилонітрилом [Alex I.D., et al. // Tetrahedron Lett.-1989. Vol. 30, №47. - P. 6573-6576], як зображено на схемі 2. Схема 2 CF3COO+ Si N CN + CsF,CH2Cl2 N NC + O O 10 H N NC O Основні недоліки цього способу - низький вихід (58 %) цільового і утворення побічного продукту. Отримання тетрагідрофураніліденацетонітрилів на основі реакції метатезису 6-алкоксигекс2-инонітрилу з платиновим каталізатором в толуені [Furstner A. // J. Am. Chem. Soc.-2001. - Vol. 123. - P. 11863-11869], як зображено на схемі 3. Схема 3 15 R 20 CN O PtCl2 CN O toluene R Недоліком цього способу є використання комерційно вартісних платинових реагентів та важкодоступних субстратів. Синтез 2-(2-оксифеніл)-2-(тетрагідро-2-фураніліден)ацетонітрилу дією LDA та 1-бромо-2хлоретану на 3-оксо-2-(2-метоксифеніл)бутанонітрил [Rasool Nasir, Rashid M.A., Reinke H., Fischer С, Langer P. // Tetrahedron.-2007. - Vol. 63, № 47. - P. 11626-11635], як зображено на схемі 4 Схема 4 25 CN O + Cl Br O LDA + O 30 35 CN CN O HO HO Суттєвий недолік цього методу - використання високореакційноздатного LDA, що може викликати небажані побічні реакції. Синтез N-ціано(тетрагідрофуран-2-іліден)метилбензаміду з N-ціанметилбензаміду шляхом ацилювання останнього хлорангідридом γ-бромомасляної кислоти у тетрагідрофурані за низької температури при використанні одного еквіваленту бутиллітію як основи і подальша обробка ще одним еквівалентом основи дозволяє отримати цільовий продукт [Papageorgiou С, et. al. // Helv. Chim. Acta. - 1998. - Vol. 81. - P. 1319-1328; Papageorgiou C, et. al. // Bioorganic Chemistry.-1997. Vol. 25, № 4. - P. 233-238], як показано на схемі 5 Схема 5 O O O + Ph N H CN BuLi Br Cl Br O O O BuLi THF,-78oC Ph 40 2 N H CN Ph N H CN UA 109029 C2 5 При дії основ на 2-(4-оксо-3,4-дигідрохіназолін-2-іліден)-3-оксо-6-хлорогексаннітрили з високими виходами утворюються продукти регіоселективного внутрішньомолекулярного алкілювання - 2-(4-оксо-3,4-дигідрохіназолін-2-іл)-2-(тетрагідро-2-фураніліден)ацетонітрили [Воловенко Ю.М., Хиля О.В., Воловненко Т.А. // Хим. гетероцикл. соед. - 2003. - № 39. - С. 439440.; Воловенко Ю.М., Хиля О.В., Воловненко Т.А., Туров А.В. // Доповіді НАН України. - 2003. № 4. - С. 128-133; 2. Khilya O.V., Volovnenko T.A., Turov A.V., Zubatyuk R.I., Shishkin O.V., Volovenko Yu.M. // Chem. Heterocycl. Compd.-2011. - Vol 47. - P. 1141-1154.], як зображено на схемі 6 Схема 6 10 O R1 O NH R1 NEt3 O NH Cl R2 N H R3 R2 R CN O N R4CN R3 R1,R2,R3=H,Alk,Cl,R4=H,Me 15 20 Недоліком цього способу є неможливість препаративного отримання обох стереоізомерів, а також неприйнятність щодо високоосновних гетероциклічних систем, в зв'язку з гідролітичною нестабільністю деяких представників даних сполук. В основу винаходу поставлено задачу розробити спосіб отримання обох стереоізомерів, а також створити зручніший спосіб синтезу 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів з високоосновними гетероциклами. Поставлена задача вирішується при взаємодії 2-гетарилацетонітрилів загальної формули (II) з 4-хлоробутаноїлхлоридом (IV) в присутності основи з утворенням 2-гетариліден-3-оксо-6хлорогексаннітрилів загальної формули (III), які в присутності основ зазнають подальшої циклізації з утворенням 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (І), як показано на схемі 7. Схема 7 25 (II) (III) (IV) (III) (I) (R4)m (R1)n 1 2 Het= , (R4)m (R1)n 1 2 HetH= , , де 3 UA 109029 C2 5 10 X=O або CH2, причому кількість атомів Оксигену лише один; 3 Y=N або CR , причому кількість атомів Нітрогену від 0 до 1; 1 R = (C1-C6)поліфторалкіл, Ar; 3 R =H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 R =H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 3 4 замісники R або R та R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; 2 2 Z=S, N, NR ; R =H, Alk, (C1-C6)поліфторалкіл, Bn; 2 1 2 у випадку Z=NR : замісники R , R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; Alk = (C1-C6)алкіл; Bn=Ph-(C1-C6)алкіл; Hal=F, Cl, Br, I; n=1-2; m=0-2; Ar = (R4)m 15 20 25 30 35 40 45 50 . за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal. Структура синтезованих сполук доведена фізико-хімічними методами, зокрема, ЯМРспектроскопії, ІЧ-спектроскопії, елементного аналізу та для деяких сполук за допомогою рентгеноструктурних досліджень. Винахід підтверджується нижченаведеними прикладами: Загальна методика синтезу 2-гетариліден-3-оксо-6-хлорогексаннітрилів (IIІ) До 4 ммоль 2-гетарилацетонітрилу в 10 мл абсолютного діоксану, при перемішуванні на магнітній мішалці, додають 5 ммоль основи (триетиламін, піридин, діізопропілетиламін) та 5 ммоль 4-хлоробутаноїлхлориду. Перемішують 3-4 год. при кімнатній температурі, залишають на ніч. Реакційну суміш упарюють у вакуумі, до сухого залишку додають 10-15 мл води. Осад відфільтровують, промивають водою. Методики синтезу 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів (І) Методика А До суспензії 3 ммоль гетариліден-3-оксо-6-хлоргексаннітрилу в 5 мл діоксану, при перемішуванні на магнітній мішалці, додають 4 ммоль основи (триетиламін, піридин, диізопропілетиламін). Перемішують 2-3 год. при кімнатній температурі (контроль за допомогою тонкошарової хроматографії), залишають на ніч. Реакційну суміш упарюють у вакуумі, до сухого залишку додають 15 мл холодної води і залишають в холодильнику на 12 год. для кристалізації. Осад відфільтровують, промивають водою. В разі потреби розділення ізомерів проводять хроматографічно на силікагелі, елюент - хлороформ / метанол (98:2). Методика Б В 10 мл абсолютного N, N-диметилформаміду розчиняють 3 ммоль одного з ізомерів гетариліден-2-(тетрагідро-2-фураніліден)ацетонітрилу. Кип'ятять протягом 10-30 хвилин. Розчин упарюють у вакуумі, до сухого залишку додають 15 мл холодної води і залишають в холодильнику на 12 год. для кристалізації. Осад відфільтровують, промивають водою. Розділення ізомерів проводять хроматографічно на силікагелі, елюент - хлороформ / метанол (98:2). Методика В Розчиняють 4 ммоль гетарилацетонітрилу та 10 ммоль основи (триетиламін, піридин) в 10 мл абсолютного ацетонітрилу або діоксану, поступово додають 5 ммоль 4хлоробутаноїлхлориду при охолодженні та інтенсивному перемішуванні. Реакційну суміш витримують протягом 1-3 год. при кімнатній температурі, залишають на ніч. Після закінчення реакції розчинник упарюють у вакуумі, до сухого залишку додають 50 мл води. Осад відфільтровують, промивають водою та перекристалізовують з відповідного розчинника. Приклад 1 4 UA 109029 C2 F3C NH O Cl CN Cl 5 2-[3-Хлоро-5-(трифлуорометил)піридин-2(1H)-іліден]-3-оксо-6-хлоргексаннітрил. 1 Жовті кристали, вихід - 76 %, Тпл. 144-145 °C. Н ЯМР (DMSO-d6, 400 MHz), δ, м. ч: 2,13 (2Н, м), 2,91 (2Н, т, J=7,0 Гц), 3,68 (2Н, т, J=7,0 Гц), 8,31 (1H, д, J=1,6 Гц), 8,72 (1H, с), 16,84 (1Н, уш. -1 с). ІЧ (KBr):2196 (CN); 1648 (CO) см . Елементний аналіз (%): обчислено для С12Н9Сl2F3N2O: С 44,33; Η - 2,79; Ν - 8,62; знайдено: С - 45,07; Η - 3,21; Ν - 8,61. Приклад 2 CH3 NH O Cl H3C N CN 10 15 2-(4,6-Диметилпіримідин-2(1H)-іліден)-3-оксо-6-хлоргексаннітрил. 1 Безбарвні кристали, вихід - 95 %, Тпл. 102-104 °C. Н ЯМР (DMSO-d6, 400 MHz), , м. ч: 2,10 (2Н, м),2,42 (6Н, с), 2,80 (2Н, т, J=6,5 Гц), 3,66 (2Н, τ, J=6,5 Гц), 6,98 (1Н, с), 16,21 (1H, с). ІЧ -1 (KBr):2202 (CN); 1608 (CO) см . Елементний аналіз (%): обчислено для С12Н14СlN3O: С - 57,26; Η - 5,61; Ν - 16,69; СІ (14,08); знайдено: С - 56,47; Η - 5,49; Ν - 16,9; СІ (14,39). Приклад 3 Cl F3C O N CN 20 25 (2E)-[3-Хлоро-5-(трифлуорометил)піридин-2-іл]-2-(тетрагідро-2-фураніліден)ацетонітрил. 1 Методика А, Б. Безбарвні кристали, вихід - 92 %, Тпл. 89-90 °C. Н ЯМР (DMSO-d6, 400 MHz), , м. ч.: 2,26 (2Н, м, J=7,3 Гц), 3,18 (2Н, т, J=7.3 Гц), 4.53 (2Н, т, J=7,3 Гц), 6,28 (1H, д, J=1,2 Гц), -1 8,85 (1H, с). ІЧ (KBr): 2208 (CN) см . Елементний аналіз (%): обчислено для С12Н8СlF3N2O: С 49,93; Η - 2,79; Ν - 9,7; СІ (12.28); знайдено: С - 49,77; Η - 3,04; Ν - 9,69; СІ - (12,37). Будову також доведено за даними рентгеноструктурних досліджень (Фіг. 1). Приклад 4 Cl F3C O N CN 30 35 (2Z)-[3-Хлоро-5-(трифлуорометил)піридин-2-іл]-2-(тетрагідро-2-фураніліден)ацетонітрил. 1 Методика А, Б. Безбарвні кристали, вихід - 92 %, Тпл. 99-101 °C. Н ЯМР (DMSO-d6, 400 MHz), , м. ч.: 2.19 (2Н, м, J=7,4 Гц), 3,00 (2Н, т, J=7,4 Гц), 4,59 (2Н, т, J=7,4 Гц), 6,29 (1H, с), 8.81 -1 (1H, с). ІЧ (KBr):2208 (CN) см . Елементний аналіз (%): обчислено для C12H8ClF3N2O: С, 49,93; Η, 2,79; Ν, 9,7; СІ (12,28); знайдено: С - 49,77; Η - 3,04; Ν - 9,69; СІ (12,37). Будову також доведено за даними рентгеноструктурних досліджень (Фіг. 2). Приклад 5 5 UA 109029 C2 CH3 N H3C O N CN 5 (2Z)-(4,6-Диметилпіримідин-2-іл)-2-(тетрагідро-2-фураніліден)ацетонітрил. 1 Методика Б. Безбарвні кристали, вихід - 95 %, Тпл. 135-136 °C. Н ЯМР (DMSO-d6, 400 MHz), , м. ч.: 2,22 (2Н, м, J=7,4 Гц), 2,42 (6Н, с), 3,44 (2Н, τ, J=7,4 Гц), 4,52 (2Н, τ, J=7,4 Гц), 6,89 (1H, -1 с). ІЧ (KBr): 2218 (CN) см . Елементний аналіз (%): обчислено для C 12H13N3O: С - 66,96; Н - 6,09; N-19,52. Знайдено: С - 66,55; Н - 6,07; N-19,38. Приклад 6 10 O N N N CN 15 (2Z)-[(6,7,8,9-Тетрагідро-5H-[1,2,4]триазоло[4,3-a]азепін-3-іл)]-2-(тетрагідро-2фураніліден)ацетонітрил. 1 Методика В. Безбарвні кристали, вихід - 82 %. Н ЯМР (DMSO-d6, 400 МГц), , м. ч.: 1,691,71 (4Н, м), 1,87 (2Н, м), 2,25 (2Н, м), 2,91 (2Н, м), 3,14 (2Н, т, J=7,8 Гц), 3,85 (2Н, м), 4,50 (2Н, т, J=7,1 Гц). ФОРМУЛА ВИНАХОДУ 20 1. 2-Гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили загальної формули (І): (I) (R4)m 1 (R1)n 2 Het= , 25 30 , де X = O або CH2, причому кількість атомів Оксигену лише один; 3 Y = N або CR , причому кількість атомів Нітрогену від 0 до 1; 1 R = (C1-C6)поліфторалкіл, Ar; 3 R = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 R = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 3 4 замісники R або R та R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; 6 UA 109029 C2 2 5 2 Z = S, N, NR ; R = H, Alk, (C1-C6)поліфторалкіл, Bn; 2 1 2 у випадку Z = NR : замісники R , R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; Alk = (C1-C6)алкіл; Bn = Ph-(C1-C6)алкіл; Hal = F, Cl, Br, I; n = 1-2; m = 0-2; Ar = (R4)m 10 ; за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal. 2. Спосіб отримання 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (І): O Cl Het Cl + Cl HetH O CN (II) CN (IV) O X Cl HetH CN (III) Het X CN (III) (I) O Het Het O (R4)m Het= (R1)n 11 R Y Y z Y , N , (R4)m R1 (R1)n 1 HetH= Y N H 15 20 O 2 2 N N Y , CN CN z Y N H , , N O 2 2 N , R N H R , де X = O або CH2, причому кількість атомів Оксигену лише один; 3 Y = N або CR , причому кількість атомів Нітрогену від 0 до 1; 1 R = (C1-C6)поліфторалкіл, Ar; 3 R = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 R = H, Alk, (C1-C6)поліфторалкіл, Ar, OH, OAlk, Hal, NO2, NH2; 4 3 4 замісники R або R та R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; 2 2 Z = S, N, NR ; R = H, Alk, (C1-C6)поліфторалкіл, Bn; 7 UA 109029 C2 2 5 1 2 у випадку Z = NR : замісники R , R , розташовані в сусідніх положеннях, можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; Alk = (C1-C6)алкіл; Bn = Ph-(C1-C6)алкіл; Hal = F, Cl, Br, I; n = 1-2; m = 0-2; Ar = (R4)m 10 ; за умови, коли Het = хіноліл-, ізохіноліл-, піридил-, то вони містять одночасно мінімум два замісники: (C1-C6)поліфторалкіл та Hal, при якому здійснюють такі етапи: отримують похідні 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили загальної формули (І) шляхом ацилювання гетарилацетонітрилів загальної формули (ІІ) 4-хлоробутаноїлхлоридом (IV) в присутності основи і послідовної циклізації утворених 2-гетариліден-3-оксо-6хлорогексаннітрилів загальної формули (ІІІ) при нагріванні в присутності основи. 8 UA 109029 C2 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Автори англійськоюVolovenko Yulian Mykhailovych
Автори російськоюВоловенко Юлиан Михайлович
МПК / Мітки
МПК: C07D 411/00, C07D 405/06, C07D 403/06, C07D 407/06, C07D 401/06
Мітки: 2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/11-109029-2-getaril-2-tetragidro-2-furanilidenacetonitrili-ta-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">2-гетарил-2-(тетрагідро-2-фураніліден)ацетонітрили та спосіб їх отримання</a>
Попередній патент: 2-гетарил-2-(1,3-дигідро-1-ізобензофураніліден)ацетонітрили та спосіб їх отримання
Наступний патент: Переробка біомаси
Випадковий патент: Вузол з'єднання секцій жолоба скребкового конвеєра












