Заміщені алкіламідопіперидини
Номер патенту: 79659
Опубліковано: 10.07.2007
Автори: Марзабаді Мохамед Р., Джианг Ю, Ветзель Джон М., Лу Кай, Чен Чіен-Ан
Формула / Реферат
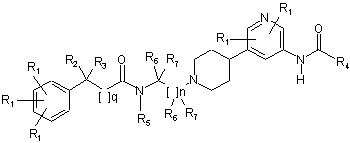
1. Сполуки, що мають структуру:
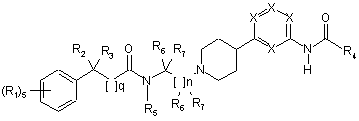 ,
,
де кожний R1 - це незалежно водень; -F; -Сl; -Br; -I; -CN; -NO2; С1-С7 алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; С2-С7 алкеніл з прямим або розгалуженим ланцюгом; С3-С7 циклоалкіл або C5-C7 циклоалкеніл; арил; гетероарил; -N(R5)2; -(СН2)mOR5; -COR5; -CO2R5; -OCOR5; -CON(R5)2; -N(R5)COR5; -N(R5)CON(R5)2; -OCON(R5)2 або -N(R5)CO2R5;
де R2 - це водень; -F; -Сl; -Br; -I; -CN; -(CH2)mOR5; -(CH2)mSR5; -NH2; С1-С7 алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1;
де R3 - це водень; -F; -Сl; -Br; -I; -CN; -(CH2)mOR5; -(CH2)mSR5; C1-C7 алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)р-;
де R4 - це C1-C7 алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом, С3-С6 циклоалкіл, C1-C7 алкіл-С3-С6 циклоалкіл; -N(R5)2 або -(CH2)mOR5;
де кожний R5 - це незалежно водень; арил; гетероарил або C1-C7 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений арилом або гетероарилом;
де кожний R6 - це незалежно водень; C1-C7 алкіл з прямим або розгалуженим ланцюгом;
де кожний R7 - це незалежно водень; феніл або C1-C7 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом;
де кожний m - це незалежно ціле число від 0 до 5 включно;
де n - це ціле число від 1 до 5 включно;
де р - це ціле число від 2 до 7 включно;
де q - це ціле число від 0 до 2 включно; і
де кожний Х - це незалежно CR1 або N, за умови, що якщо один Х - це N, тоді решта X - це CR1;
або їх фармацевтично прийнятні солі.
2. Сполука за п. 1, де сполука має структуру:
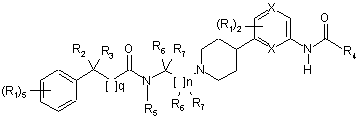 .
.
3. Сполука за п. 2, де сполука має структуру:
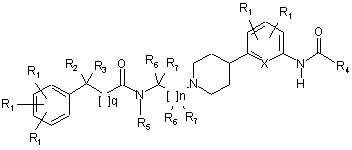 ,
,
де R2 та R3 - це незалежно водень; -F; -Сl; -Br; -I; -CN; -(CH2)mOR5; -(CH2)mSR5; С1-С7 алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)p-;
де R4 - це С1-С7 алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом, С3-С6 циклоалкіл, -N(R5)2 або -(CH2)mOR5; та де Х - це СН або N.
4. Сполука за п. 3, де кожний R1 - це незалежно водень; -F; -Сl; -Br; -І; -CN; -NO2; С1-С7 алкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; -(CH2)mOR5; -COR5; -CO2R5; -OCOR5; -CON(R5)2; -N(R5)COR5 або -N(R5)CON(R5)2;
де R2 та R3 - це незалежно водень; -F; -Сl; -Br; -I; -CN; -(CH2)mSR5; С1-С7 алкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)р-;
де R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом, С3-С6 циклоалкіл, -N(R5)2 aбo -(CH2)mOR5;
де кожний R5 - це незалежно водень або С1-С3 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом;
де m - це ціле число від 0 до 3 включно;
де n - це ціле число від 1 до 3 включно;
де р - це ціле число від 2 до 5 включно;
де q - це 0; і
Х - це СН.
5. Сполука за п. 4, де сполука має структуру:
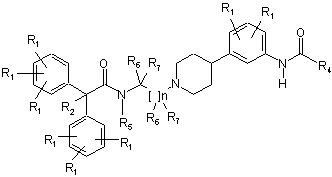 .
.
6. Сполука за п. 5, де R7 - це незалежно водень або С1-C7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом.
7. Сполука за п. 6, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С1-C7 алкіл з прямим або розгалуженим ланцюгом; та R2 - це водень або С1-С-7 алкіл з прямим або розгалуженим ланцюгом.
8. Сполука за п. 7, де n - це 2.
9. Сполука за п. 8, де сполука вибрана з групи, яка складається з:
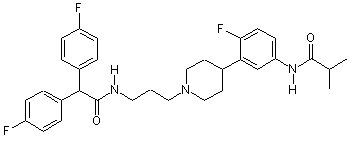 ;
; 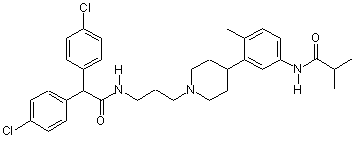 та
та 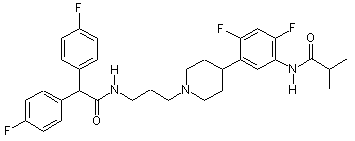 .
.
10. Сполука за п. 4, де R2 та R3 - це незалежно водень або С1-С7 алкіл з прямим або розгалуженим ланцюгом.
11. Сполука за п. 10, де кожний R5 - це незалежно водень або С1-С3 алкіл з прямим або розгалуженим ланцюгом; R7 - це незалежно водень або С1-С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом.
12. Сполука за п. 11, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С1-С7 алкіл з прямим або розгалуженим ланцюгом.
13. Сполука за п. 12, де n - це 2.
14. Сполука за п. 13, де сполука вибрана групи, що складається з:
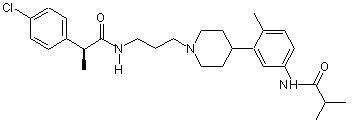 ;
; 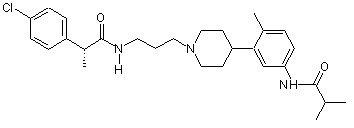 ;
; 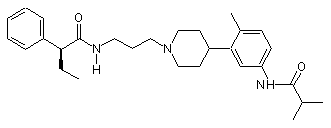 ;
; 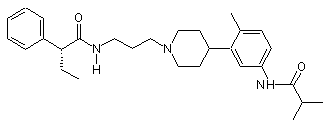 ;
; 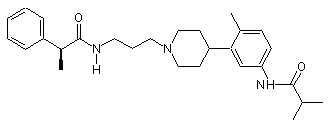 та
та 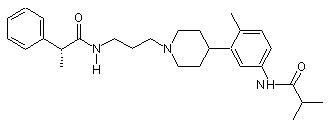 .
.
15. Сполука за п. 3, де сполука має структуру:
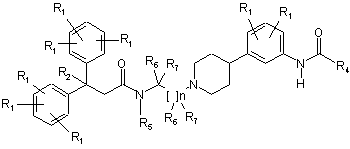 .
.
16. Сполука за п. 4, де R2 і R3 разом - це -(СН2)р-.
17. Сполука за п. 2, де сполука має структуру:
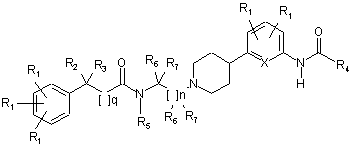
та де R2 - це водень або -ОН.
18. Сполука за п. 17, де R3 - це феніл, заміщений одною або декількома складовими R1; тa q=0.
19. Сполука за п. 18, де кожний R5 - це незалежно водень або С1-С3 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; R7 - це незалежно водень або С1-С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом.
20. Сполука за п. 19, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С1-С7 алкіл з прямим або розгалуженим ланцюгом.
21. Сполука за п. 20, де n - це 2.
22. Сполука за п. 21, де Х - це N.
23. Сполука за п. 21, де Х - це CR1.
24. Сполука за п. 23, де R2 - це ОН.
25. Сполука за п. 24, де сполука вибрана з групи, що складається з:
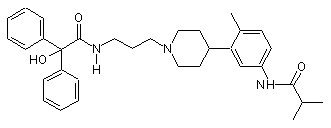 ;
; 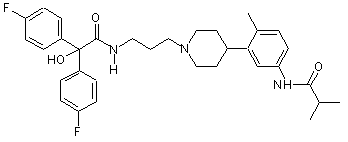 ;
; 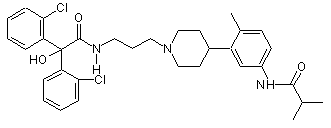 .
.
26. Сполука за п. 2, де сполука має структуру:
 .
.
27. Сполука за п. 26, де R3 - це феніл, заміщений одною або декількома складовими R1; тa q=0.
28. Сполука за п. 27, де R5 та R7 - це незалежно водень або С1-С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом.
29. Сполука за п. 28, де R2 - це водень або -ОН.
30. Сполука за п. 29, де сполука має структуру:
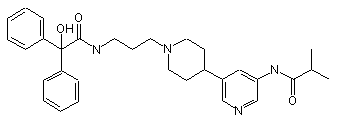 ;
; 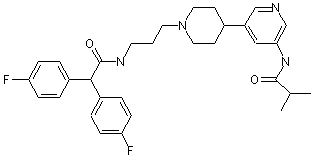 ;
; 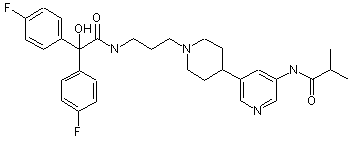 та
та 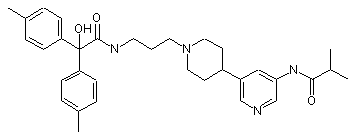 .
.
31. Сполука за п. 1, де сполука є енантіомерно чистою.
32. Сполука за п. 1, де сполука є діастереомерно чистою.
33. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за п. 1 та фармацевтично прийнятний носій.
34. Фармацевтична композиція, що виготовлена шляхом змішування сполуки за п. 1 та фармацевтично прийнятного носія.
35. Спосіб виготовлення фармацевтичної композиції, який включає змішування сполуки за п. 1 та фармацевтично прийнятного носія.
36. Спосіб лікування суб'єкта, що страждає на афективний розлад, вибраний з групи, яка складається з депресії, великої депресії, біполярного розладу, агорафобії, специфічної фобії, соціальної фобії, обсесивно-компульсивного розладу, посттравматичного стресового розладу, гострого стресового розладу та тривожного розладу, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п.1.
37. Спосіб лікування суб'єкта, що страждає на сечовий розлад, вибраний з групи, яка складається з нетримання сечі, непереборного позиву до сечовипускання, частого сечовипускання, настирливості щодо сечовипускання, ніктурії або енурезу, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п. 1.
38. Спосіб лікування суб'єкта, що страждає на розлад харчування, вибраний з групи, яка складається з ожиріння, булімії, нервової булімії або нервової анорексії, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п. 1.
Текст
1. Сполуки, що мають структур у: 3 79659 де R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом, С3-С6 циклоалкіл, -N(R5)2 aбo (CH2)mOR5; де кожний R5 - це незалежно водень або С1-С3 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; де m - це ціле число від 0 до 3 включно; де n - це ціле число від 1 до 3 включно; де р - це ціле число від 2 до 5 включно; де q - це 0; і Х - це СН. 5. Сполука за п.4, де сполука має структур у: R1 4 Cl O N ; Cl O N R6 R 7 R1 N R1 [ ]n R5 R2 O NH ; O N N N N H N O H O O O NH R1 R1 R1 N H NH R4 ; H R6 R7 O N R1 N O H NH R1 . 6. Сполука за п.5, де R7 - це незалежно водень або С1-C7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом. 7. Сполука за п.6, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С 1-C7 алкіл з прямим або розгалуженим ланцюгом; та R2 - це водень або С1С-7 алкіл з прямим або розгалуженим ланцюгом. 8. Сполука за п.7, де n - це 2. 9. Сполука за п.8, де сполука вибрана з групи, яка складається з: F F H N N та O N N O H NH R1 R1 H ; R1 H N H N O та N N N [ ]n R5 R1 N O R6 R 7 O R2 R1 O H N F . 16. Сполука за п.4, де R2 і R3 разом - це -(СН2)р-. 17. Сполука за п.2, де сполука має структуру: R1 R1 O O R1 N N R4 H R6 R7 F F R1 R1 R1 Cl Cl O NH N N N H . 15. Сполука за п.3, де сполука має структуру: O O F ; O H R3 O [ ]q R1 O F . 10. Сполука за п.4, де R2 та R3 - це незалежно водень або С1-С7 алкіл з прямим або розгалуженим ланцюгом. 11. Сполука за п.10, де кожний R5 - це незалежно водень або С 1-С3 алкіл з прямим або розгалуженим ланцюгом; R7 - це незалежно водень або С 1С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом. 12. Сполука за п.11, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С 1-С7 алкіл з прямим або розгалуженим ланцюгом. 13. Сполука за п.12, де n - це 2. 14. Сполука за п.13, де сполука вибрана групи, що складається з: R2 R1 R6 R 7 X N N [ ]n R5 N R4 H R6 R 7 та де R2 - це водень або -ОН. 18. Сполука за п.17, де R3 - це феніл, заміщений одною або декількома складовими R1; тa q=0. 19. Сполука за п.18, де кожний R5 - це незалежно водень або С 1-С3 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; R7 - це незалежно водень або С 1-С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом. 20. Сполука за п.19, де кожний R1 - це незалежно водень, -F; -Сl; -Вr; -І або С 1-С7 алкіл з прямим або розгалуженим ланцюгом. 21. Сполука за п.20, де n - це 2. 22. Сполука за п.21, де Х - це N. 23. Сполука за п.21, де Х - це CR1. 5 79659 24. Сполука за п.23, де R2 - це ОН. 25. Сполука за п.24, де сполука вибрана з групи, що складається з: 6 F OH O N N N O O N N HO N O H NH OH O N ; F та F N N O N HO N N O H NH ; F Cl O N HO N O H Cl NH . 26. Сполука за п.2, де сполука має структуру: N R1 O R1 R1 R2 R6 R 7 R3 O N N N [ ]n R5 [ ]q R1 R4 H R6 R7 R1 . 27. Сполука за п.26, де R3 - це феніл, заміщений одною або декількома складовими R1; тa q=0. 28. Сполука за п.27, де R5 та R7 - це незалежно водень або С 1-С7 алкіл з прямим або розгалуженим ланцюгом; та R4 - це С1-С7 алкіл з прямим або розгалуженим ланцюгом. 29. Сполука за п.28, де R2 - це водень або -ОН. 30. Сполука за п.29, де сполука має структур у: OH O N N N O N ; N N O N N O F F O . 31. Сполука за п.1, де сполука є енантіомерно чистою. 32. Сполука за п.1, де сполука є діастереомерно чистою. 33. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за п.1 та фармацевтично прийнятний носій. 34. Фармацевтична композиція, що виготовлена шляхом змішування сполуки за п.1 та фармацевтично прийнятного носія. 35. Спосіб виготовлення фармацевтичної композиції, який включає змішування сполуки за п.1 та фармацевтично прийнятного носія. 36. Спосіб лікування суб'єкта, що страждає на афективний розлад, вибраний з групи, яка складається з депресії, великої депресії, біполярного розладу, агорафобії, специфічної фобії, соціальної фобії, обсесивно-компульсивного розладу, посттравматичного стресового розладу, гострого стресового розладу та тривожного розладу, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п.1. 37. Спосіб лікування суб'єкта, що страждає на сечовий розлад, вибраний з групи, яка складається з нетримання сечі, непереборного позиву до сечовипускання, частого сечовипускання, настирливості щодо сечовипускання, ніктурії або енурезу, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п.1. 38. Спосіб лікування суб'єкта, що страждає на розлад харчування, вибраний з групи, яка складається з ожиріння, булімії, нервової булімії або нервової анорексії, який включає введення суб'єктові терапевтично ефективної кількості сполуки за п.1. ; Меланін-концентрувальний гормон (МСН) є циклічним пептидом, що спочатку був виділений зі слизистої лосося (гольця) [Kawauchi et al., 1983]. Пептид, що складається з 17 амінокислот, викликав у риби агрегацію меланіну в меланофорах та інгібував вивільнення АКТГ, діючи як функціональний антагоніст α-МСГ. У пацюків, мишей і людини МСН ссавців (19 амінокислот) високо консервативний, має 100% амінокислотну ідентичність, але його фізіологічна роль чітко не визначена. Повідомлялося, що МСН бере участь у різних процесах, включаючи харчування, водний баланс, енергетичний метаболізм, стан загального порушення ЦНС і уваги, пам'ять і когнітивні функції і психічні розлади [як огляд дивіться Baker, 1991, Baker, 1994, Nahon, 1994, Knigge et al., 1996]. Його роль у харчуванні або регуляції маси тіла була підтверджена [в останній публікації в журналі Nature (Qu et al., 1996)], у якій було показано, що МСН дуже сильно експресується в гіпоталамусі мишей ob/ob у порівнянні з мишами ob/+ та що голодування сприяло підвищенню мРНК МСН як у нормальних мишей, 7 79659 так і в мишей, що страждають на ожиріння, під час голодування. При введенні в бокові шлуночки МСН також стимулює прийом їжі у нормальних пацюків [Rossi et al., 1997]. Також повідомлялося, що МСН викликає функціональний антагонізм поведінкових ефектів α-МСГ [Miller et al., 1993, Gonzalez et al, 1996, Sanchez et al., 1997]; крім того, було показано, що стрес збільшує рівні мРНК ПОМК поряд зі зменшенням рівнів мРНК препроМСН попередника МСН (ррМСН) [Presse et al., 1992]. Таким чином, МСН може служити інтегративним нейропептидом, залученим до стресових реакцій, а також до регуляції харчування і сексуальної активності [Baker, 1991, Knigge et al., 1996]. Хоча біологічні ефекти МСН ймовірно викликаються за допомогою специфічних рецепторів, зв'язувальні сайти МСН не були досі описані. Повідомлялося, ліганд, мічений тритієм ([3Н]-МСН), має специфічне зв'язування у відношенні мембран мозку, але був невідповідним для аналізу насичування, тому ні афінність, ні Вmах не були визначені [Drozdz and Eberle, 1995]. Введення радіоактивного йоду в 13 положенні тирозину приводить до істотного зниження біологічної активності ліганду [дивіться Drozdz and Eberle, 1995]. Навпроти, введення радіоактивного йоду в аналог МСН [Phe13, Tyr 19 ]-MCH дало позитивний результат [Drozdz et al., 1995]; ліганд залишився біологічно активним і мав специфічне зв'язування з різноманітними клітинними лініями, включаючи меланому миші (B16F1, G4F і G4F-7), клітини PC12 і COS. Для клітин G4F-7, KD=0,118нМ і Вmах~1100сайтів/клітину. Важливо, що зв'язування не інгібувалось α-МСГ, але слабко інгібувалось ANF пацюка (Kі=116нМ у порівнянні з 12нМ природного МСН) [Drozdz et al., 1995]. Недавно було описано специфічне зв'язування МСН у трансформованих кератиноцитах [Burgaud et al., 1997] і в клітинах меланоми [Drozdz et al., 1998], у результаті дослідження фотозшиванням було зроблено припущення про те, що рецептором є мембранний білок із середньою молекулярною масою 45-50кД, який можна порівняти з діапазоном молекулярної маси суперродини рецепторів GPCR. Дотепер не проводилися радіоавтографічні дослідження локалізації рецептора МСН за допомогою цього ліганду. Локалізація і біологічна активність пептиду МСН наводить на думку, що модуляція активності рецептора МСН може бути ефективною для багатьох терапевтичних використань. Для можливого клінічного використання самою описаною є роль МСН у харчуванні. МСН експресується в бічній частині гіпоталамуса, ділянці мозку, залученій до регуляції спраги і голоду [Grillon et al., 1997]; останнім часом було показано, що орексини А і В, що є сильними орексигенними агентами, дуже схожі за розташовуванням з МСН у бічній частині гіпоталамуса [Sakurai et al., 1998]. Рівні мРНК МСН у цій ділянці мозку збільшуються в пацюків після 24 годин відсутності харчування [Herve і Fellman, 1997]; після ін'єкції інсуліну спостерігали значне збільшення відносної кількості й інтенсивності фарбування імунореактивного МСН перикаріону і волокон поряд зі значним збільшенням рівня мРНК МСН [Bahjaoui-Bouhaddi et al., 1994]. Зі здатністю 8 МСН стимулювати потребу в їжі у пацюків [Rossi et al., 1997] узгоджується спостереження, що рівні мРНК МСН у гіпоталамусі миші ob/ob, що страждає на ожиріння, регулювалися на підвищення [Qu et al., 1996] і знижувалися в гіпоталамусі пацюків, які одержували лептин, позитивний вплив якого на прийом їжі й масу тіла також був описаний [Sahu, 1998]. МСН можливо діє як функціональний антагоніст меланокортинової системи у випадку його впливу на прийом їжі та на гормональну секрецію ΗΡΑ (гіпоталамо-гіпофізано-адреналова система) [Ludwig et al., 1998]. Усі ці дані наводять на думку щодо ролі ендогенного МСН у регуляції енергетичного балансу та відповіді на стрес і дають підставу для розвитку специфічних сполук, які діють на рецептори МСН, для використання при лікуванні ожиріння і пов'язаних зі стресами розладів. В усі х вида х досліджень, проведених дотепер, головна частина нейронів групи клітин МСН має в значній мірі постійну локалізацію в ділянках бічної частини гіпоталамуса і субталамуса, де вони розташовуються, і може бути частиною деяких, так званих "екстрапірамідних" рухови х ділянок. До них відносяться основні стриато- і палідофугальні шляхи, що включають таламус і кору головного мозку, гіпоталамічні ділянки і реципрокні зв'язки із субталамічним ядром, чорною субстанцією і центрами серединного мозку [Bittencourt et al., 1992]. За своєю локалізацією групи клітин МСН ймовірно можуть бути мостом або механізмом для встановлення зв'язку гіпоталамічної вісцеральної активності з відповідною і погодженою руховою активністю. Клінічно це може мати деяке значення при розгляді можливості залучення цієї системи МСН у р ухові розлади, такі як хвороба Паркінсона і хорея Ґентінгтона, у які, як відомо, залучені екстрапірамідні ділянки. Дослідження зв'язування генів у людини показали, що автентичний локус МСН, розташований на 12 хромосомі (12q23-24), і варіантний локус МСН, розташований на 5 хромосомі (5q12-13) [Pedeutour et al., 1994]. Локус 12q23-24 збігається з локусом, щодо якого на генетичній карті показана аутосомно-домінантна церебелярна атаксія II типу (SCA2) [Auburger et al., 1992, Twells et al., 1992]. Це захворювання полягає в нейродегенеративних розладах, включаючи олівопонтоцеребелярну атрофію. Більш того, ген хвороби Дар'є на генетичній карті розташований у локусі 12q23-24 [Craddock et al., 1993]. Хвороба Дар'є характеризується патологічною адгезією кератиноцитів І і, у деяких родинах, психічними захворюваннями. Маючи на увазі функціональні та нейроанатомічні особливості МСН нервової системи головного мозку пацюка і людини, ген МСН може бути прекрасним рішенням у випадку захворювань SCA2 або Дар'є. Цікаво, що в даному локусі на генетичній карті розташовані захворювання високого соціального значення. Дійсно, використовуючи дослідження зв'язування генів, ген, відповідальний за хронічну або гостру форми спінальних м'язових атрофій, був співвіднесений із хромосомою 5q12-13 [Melki et al., 1990, Westbrook et al., 1992]. Крім того, незалежний ряд свідчень підтвердив перебування головного локусу шизофренії на хромосомі 5q11,2-13,3 [Sherring 9 79659 ton et al., 1988, Bassett et al., 1988, Gilliam et al., 1989]. На підставі вищевказаних досліджень було припущено, що МСН може відігравати роль у нейродегенеративних захворюваннях і емоційних розладах. Припускають, що додатковим терапевтичним застосуванням сполук, пов'язаних з МСН, є ефекти МСН, що спостерігаються в інших біологічних системах. Наприклад, МСН може регулювати репродуктивні функції у самців і самок пацюків. Транскрипти МСН і пептиди МСН були виявлені в ембріональних клітинах яєчок дорослих пацюків, що дало припущення про те, що МСН може брати участь у відновленні стовбурних клітин і/або диференціації ранніх сперматоцитів [Hervieu et al., 1996]. Ін'єкція МСН безпосередньо в серединну предзорову ділянку (МРОА) або вентромедіальне ядро (VMN) стимулювало сексуальну активність самок пацюків [Gonzalez et al., 1996]. У пацюків з вилученими яєчниками, яким вводили естрадіол, МСН стимулювали вивільнення лютеїнзувального гормону (LH), тоді як анти-МСН антисироватка інгібувала вивільнення LH [Gonzalez et al., 1997]. Зона інцерта, що містить велику популяцію тіл клітин МСН, спочатку була ідентифікована як регуляторний сайт передовуляційного збільшення LH [MacKenzie et al., 1984]. Повідомлялося, що МСН впливає на вивільнення пітуітарних гормонів, включаючи АСТН і окситоцин. Аналоги МСН також можуть використовуватися при лікуванні епілепсії. На моделі епілептичних припадків, викликаних PTZ, ін'єкція МСН до початку припадку запобігала активності судорожного припадку, як у пацюків, так і у морських свинок, що означало, що нейрони, що містять МСН, можуть брати участь у нейрональному ланцюзі, що лежить в основі припадку, викликаного PTZ [Knigge and Wagner, 1997]. Також були зроблені спостереження про те, що МСН впливає на поведінкові зв'язки когнітивних функцій. Введення МСН прискорює вгасання реакції пасивного уникнення в пацюків [McBride et al., 1994], що збільшує можливість того, що антагоністи рецептора МСН можуть мати корисний вплив на механізми збереження в пам'яті та/або утримування в пам'яті. Можлива роль МСН у модуляції або сприйнятті болю підтримується щільною іннервацією періакведуктальної сірої речовини (PAG) MCH-позитивними волокнами. Нарешті, МСН може брати участь у регуляції споживання рідини. ICV інфузія МСН бадьорій вівці давала діуретичні, натрійуретичні і калійуретичні зміни у відповідь на збільшення об'єму плазми [Parkes, 1996]. Разом з анатомічними даними про присутність МСН в ділянках мозку, що регулюють гомеостаз рідини, результати показали, що МСН може бути важливим пептидом, залученим у центральний контроль гомеостазу рідини у ссавців. Недавно була опублікована інформація про ідентифікацію рецептора МСН, пов'язаного з Gбілком [Chambers et al., 1999, Saito et al., 1999]. Ці групи ідентифікували МСН як ендогенний ліганд у відношенні людського рецептора-сироти SLC-1, пов'язаного з G-білком [Lakaye et al., 1998]. Повідомлялося, що гомологічний йому рецептор у пацюка (який зараз називають "МСН-1") локалізова 10 ний в ділянках головного мозку пацюка, пов'язаних з харчовою поведінкою (наприклад, дорсомедіальний і вентромедіальний гіпоталамус). Зв'язок між МСН-1 і впливом МСН на харчову поведінку був підсилений останніми даними, отриманими на мишах з подавленим МСН-1. Двома групами незалежно було показано [Marsh et al, 2002, Chen et al, 2002], що задане руйнування гена рецептора МСН-1 (нокаут МСН-1) у мишей, приводило до того, що тварини страждали на гіперфагію, але були худими і мали знижену масу тіла, у порівнянні з диким типом того ж приплоду. Зниження маси тіла зв'язували з підвищенням метаболізму. У кожній групі було показано, що миші з нокаутом МСН-1 стійкі до ожиріння, викликаному режимом харчування, і що вони мають ту ж масу, що і миші того ж приплоду, які знаходяться на звичайному режимі харчування. Нарешті, у літературі були описані синтетичні антагоністи рецептора МСН-1. [Bednarek et al. (2002)] описали синтез високоафінних пептидних антагоністів МСН-1. Більш того, низькомолекулярний антагоніст МСН-1 був [описаний Takekawa et al. (Takekawa et al., 2002)]. Ця сполука, Т-226296, має високу афінність у відношенні рецептора МСН-1 (~5-9нМ для МСН-1 пацюка і людини), і, як був показано, інгібує прийом їжі, викликаний інтрацеребровентрикулярним введенням МСН. Ці дані підтверджують стратегію використання антагоніста рецептора МСН-1 для лікування ожиріння. Крім того, у власних дослідженнях заявників були випробувані антагоністи МСН1 на декількох тваринних моделях, добре відомих як моделі, що прогнозують ефективність сполук у людини, [див. Borowsky, et al., (2002)]. Ці експерименти показують, що антагоністи МСН1 ефективні для лікування ожиріння, депресії, тривожного стану, а також сечових розладів. Як використовується в даному винаході, термін "антагоніст" відноситься до сполуки, яка зв'язується з рецептором і зменшує його активність у присутності агоніста. У випадку рецептора, зв'язаного з G-білком, активація може бути виміряна за допомогою будь-якої придатної системи вторинних месенджерів, що зв'язується з рецептором клітини або тканини, що експресує цей рецептор. Деякими конкретними прикладами, які не є обмежувальними, добре відомих систем вторинних месенджерів є аденілатциклаза, внутрішньоклітинна мобілізація кальцію, активація іон-каналів, гуанілатциклаза і гідроліз фосфоліпідів, що містять інозитол. Навпроти, термін "агоніст" відноситься до сполуки, що зв'язується з рецептором і підвищує його активність, у порівнянні з активністю рецептора у відсутності агоніста. В одному з варіантів здійснення цього винаходу описаний синтез нових сполук, що селективно зв'язуються з людським клональним рецептором меланін-концентрувального гормону-1 (МСН1) у порівнянні з іншими клональними рецепторами, зв'язаними з G-білком та інгібують активацію клональних рецепторів, як це було виміряно за методами in vitro. Методи зв'язування рецептора in vitro, описані далі, проводили за допомогою різних культивованих клітинних ліній, кожна з яких була 11 79659 трасфектована тільки одним клональним рецептором і експресувала його. Більш того, сполуки за цим винаходом також можуть використовуватися при лікуванні патологічних станів, опосередкованих інактивацією рецепторів МСН-1, таких як розлади харчування (ожиріння, булімія і нейрогенна булімія), сексуальні/репродуктивні розлади, депресія, тривожний стан, депресія з тривожним станом, епілептичні припадки, підвищений кровоносний тиск, геморагічний інсульт, застійна серцева недостатність, порушення сну або будь-які стани, при яких може бути ефективним антагонізм до рецептора МСН1. До того ж, сполуки за цим винаходом можуть бути е фективними для зниження маси тіла суб'єкта. Крім того, сполуки за цим винаходом можуть використовуватися при лікуванні сечових розладів. Суть винаходу Цей винахід пропонує сполуки, що мають структур у: де кожний R1 - це незалежно водень; -F; -СІ; Br; -I; -CN; -NO2; С1-С7 алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; С2-С7алкеніл з прямим або розгалуженим ланцюгом; С3-С7циклоалкіл або С 5-С7циклоалкеніл; арил; гетероарил; -N(R5)2; -(CH2)mOR5; -COR 5; CO2R5; -OCOR 5; -CON(R5)2 ; -N(R5)COR 5; N(R5)CON(R5)2; -OCON(R 5)2 або -N(R5)CO2R5; де R2 - це водень; -F; -Cl; -Br; -I; -CN; (CH2)mOR5; -(CH2) mSR5; -NH2 ; С1-С7алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; де R3 - це водень; -F; -Cl; -Br; -I; -CN; (CH2)mOR5; -(CH2)mSR 5; C1-C7алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)р-; де R4 - це С1-С7алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом, С3-С6циклоалкіл, С1-С7алкіл-С 3-С6циклоалкіл; -N(R5)2 або -(CH2)mOR5; де кожний R5 - це незалежно водень; арил; гетероарил або С1-С7 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений арилом або гетероарилом; де кожний R6 - це незалежно водень; С1С7алкіл з прямим або розгалуженим ланцюгом; де кожний R7 - це незалежно водень; феніл або С1-С7алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; де кожний m - це незалежно ціле число від 0 до 5 включно; де n - це ціле число від 1 до 5 включно; де p - це ціле число від 2 до 7 включно; де q - це ціле число від 0 до 2 включно; і 12 де кожний X - це незалежно CR1 або N, за умови, що якщо один X - це N, тоді решта X - це CR1; або їх фармацевтично прийнятні солі. В одному варіанті здійснення винаходу, сполуку вибирають з однієї з специфічних сполук, описаних у "Докладному описі винаходу". У варіанті здійснення цього винаходу сполука є енантіомерно чистою. В іншому варіанті здійснення винаходу сполука є діастереомерно чистою. У подальшому варіанті здійснення сполука є енантіомерно чистою та діастереомерно чистою. Цей винахід також пропонує фармацевтичну композицію, яка включає терапевтично ефективну кількість сполуки цього винаходу і фармацевтично прийнятний носій. Цей винахід далі пропонує фармацевтичну композицію, виготовлену шляхом змішування сполуки цього винаходу та фармацевтично прийнятного носія. Цей винахід також пропонує спосіб виготовлення фармацевтичної композиції, який включає змішування сполуки цього винаходу і фармацевтично прийнятного носія. Винахід далі пропонує спосіб лікування суб'єкта, що страждає на афективний розлад, вибраний з групи, яка складається з депресії, великої депресії, біполярного розладу, агорафобії, специфічної фобії, соціальної фобії, обсесивно-компульсивного розладу, посттравматичного стресового розладу, гострого стресового розладу та тривожного розладу, який включає введення суб'єктові терапевтично ефективної кількості сполуки винаходу. В окремому варіанті здійснення винаходу розлад - це депресія або тривожний стан. Крім того, винахід далі пропонує спосіб лікування суб'єкта, що страждає на сечовий розлад, вибраний з групи, яка складається з нетримання сечі, непереборного позиву до сечовипускання, частого сечовипускання, настирливості щодо сечовипускання, ніктурії або енурезу, який включає введення суб'єктові терапевтично ефективної кількості сполуки винаходу. В окремому варіанті здійснення винаходу розлад - це нетримання сечі. Винахід далі пропонує спосіб лікування суб'єкта, що страждає на розлад харчування, вибраний з групи, яка складається з ожиріння, булімії, нервової булімії або нервової анорексії, який включає введення суб'єктові терапевтично ефективної кількості сполуки винаходу. В окремому варіанті здійснення винаходу розлад - це ожиріння. Докладний опис винаходу Як використано у цьому винаході, термін "гетероарил" позначає п'яти- і шестичленні ненасичені кільця, що можуть містити один або більше атомів кисню, сірки або азоту. Приклади гетероарильних груп включають, проте не обмежуються лише ними, карбазол, фураніл, тієніл, піроліл, оксазоліл, тіазоліл, імідазоліл, піразоліл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тіадіазоліл, піридил, піридазиніл, піримідиніл, піразиніл та триазиніл. Крім того, термін "гетероарил" позначає сконденсовані біциклічні кільцеві системи, що можуть містити один або декілька гетероатомів, таких як кисень, сірка й азот. Приклади таких гетероарильних груп включають, проте не обмежуються 13 79659 лише ними, індолізиніл, індоліл, ізоіндоліл, бензо[b]фураніл, бензо[b]тіофеніл, індазоліл, бензімідазоліл, пуриніл, бензоксазоліл, бензізоксазоліл, бензо[b]тіазоліл, імідазо[2,1-b]тіазоліл, цинолініл, хіназолініл, хіноксалініл, 1,8-нафтиридиніл, птеридиніл, хінолініл, ізохінолініл, фталімідил та 2,1,3бензотіазоліл. Термін "гетероарил" також включає ті хімічні складові, які перелічені вище та які можна замістити одним або більше з наступного: -F, -СІ, Br, -I, CN, -NO2, C1-C7алкіл з прямим або розгалуженим ланцюгом, C1-C7монофторалкіл з прямим або розгалуженим ланцюгом, C1-C7поліфторалкіл з прямим або розгалуженим ланцюгом, С2С7алкеніл з прямим або розгалуженим ланцюгом, С2-С7алкініл з прямим або розгалуженим ланцюгом, С3-С7циклоалкіл, С3-С7монофторциклоалкіл, С3-С7поліфторциклоалкіл, С5-С7циклоалкеніл. Термін "гетероарил" далі включає N-оксиди тих хімічних складових, які перелічені вище та які включають принаймні один атом азоту. У цьому винаході, термін "арил" позначає феніл або нафтил. У цьому винаході, термін "С1-С7алкіл з прямим або розгалуженим ланцюгом" позначає насичений вуглеводень, що має від одного до семи атомів вуглецю, включно, таких як метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-2-пропіл і 2метил-1-пропіл. Подібно до цього, "алкеніл" і "алкініл", відповідно, позначають такі групи, що мають від дво х до семи атомів вуглецю, включаючи подвійний зв'язок та потрійний зв'язок, відповідно, такі як етиніл, пропеніл, бутеніл, етиніл, пропініл та бутиніл. Термін "C3-C7циклоалкіл" позначає моноциклічний вуглецевий цикл, що має від трьох до семи атомів вуглецю, такий як циклопропіл, циклопентил, циклогексил тощо. Термін "С1-С7алкіл-С3С6циклоалкіл" позначає насичений вуглеводневий алкіл, заміщений моноциклічним вуглецевим циклом, який має від трьох до семи атомів вуглецю, приєднаних за допомогою С1-С7алкільної складової, такий як метилциклопропіл, етилциклопентил, н-пропілциклогексил тощо. Винахід пропонує кожний чистий стереоізомер будь-якої зі сполук, описаних тут. Такі стереоізомери можуть включати енантіомери, діастереомери або Ε або Ζ алкенові або імінові ізомери. Винахід також пропонує стереоізомерні суміші, включаючи рацемічні суміші, діастереомерні суміші або Ε/Ζ ізомерні суміші. Стереоізомери можуть бути синтезовані в чистому виді [N ygr6di, Μ.; Stereoselective Synthesis. (1987) VCH Editor Ebel, H. та Asymmetric Synthesis, Volumes 3 В 5, (1983) Academic Press, Editor Morrison, J.] або вони можуть бути виділені за будь-яким з численних способів, таких як кристалізація і методи хроматографії [Jaques, J.; Collet, Α.; Wilen, S.; Enantiomer, Racemates, and Resolutions, 1981, John Wiley and Sons and Asymmetric Synthesis, Vol.2, 1983, Academic Press, Editor Morrison, J]. Крім того сполуки цього винаходу, можуть бути присутніми як енантіомери, діастереомери, ізомери, або дві чи більше сполук можуть бути присутніми, утворюючи рацемічну або діастереомерну суміш. Сполуки за цим винаходом є переважно на 80% чистими, більш переважно на 90% чистими і 14 найбільш переважно на 95% чистими. До цього винаходу відносяться фармацевтично прийнятні солі та комплекси усіх сполук, описаних тут. Кислоти і основи, з яких одержують ці солі, включають, але не обмежуються тільки ними, перелічені тут кислоти і основи. Кислоти включають, але не обмежуються тільки ними, наступні неорганічні кислоти: хлористоводневу кислоту, бромистоводневу кислоту, йодистоводневу кислоту, сірчану кислоту і борну кислоту. Кислоти включають, але не обмежуються тільки ними, наступні органічні кислоти: оцтову кислоту, малонову кислоту, бурштинову кислоту, фумарову кислоту, винну кислоту, малеїнову кислоту, лимонну кислоту, метансульфонову кислоту, бензойну кислоту, гліколеву кислоту, молочну кислоту і мигдалеву кислоту. Основи включають, але не обмежуються тільки ними, амоній, метиламін, етиламін, пропіламін, диметиламін, діетиламін, триметиламін, триетиламін, етилендіамін, гідроксіетиламін, морфолін, піперазин і гуанідин. Цей винахід також відноситься до гідратів і поліморфів усі х описаних тут сполук. В обсяг цього винаходу входять проліки сполук даного винаходу. Звичайно такими проліками являються функціональні похідні сполук за цим винаходом, які легко перетворюються in vivo на необхідну сполук у. Таким чином, у цьому винаході термін "введення" охоплює лікування різних описаних станів конкретно описаною сполукою або сполукою, яка може бути конкретно не описаною, але яка перетвориться на конкретну сполуку in vi vo після введення пацієнту. Звичайні способи вибору й одержання прийнятних пролікових похідних описані, [наприклад, у Design of Prodrugs, ed. H. Bungaard, Elsevier, 1985]. Цей винахід далі відноситься до метаболітів сполук за цим винаходом. Метаболіти включають активні типи сполук, одержувані при введенні сполук за цим винаходом в біологічне середовище. Цей винахід далі пропонує фармацевтичну композицію, яка включає терапевтично ефективну кількість сполуки винаходу та фармацевтично прийнятний носій. В одному варіанті здійснення винаходу кількість сполуки становить від приблизно 0,01мг до приблизно 800мг. В іншому варіанті здійснення кількість сполуки становить від приблизно 0,01мг до приблизно 500мг. У іще іншому варіанті здійснення винаходу кількість сполуки становить від приблизно 0,1мг до приблизно 250мг. В іншому варіанті здійснення кількість сполуки становить від приблизно 0,1мг до приблизно 60мг. У іще іншому варіанті здійснення кількість сполуки становить від приблизно 1мг до приблизно 20мг. У подальшому варіанті здійснення носій є рідиною, а композиція є розчином. В іншому варіанті здійснення носій є твердою речовиною, а композиція є таблеткою. В іншому варіанті здійснення носій є гелем, а композиція є капсулою, супозиторієм або кремом. У подальшому варіанті здійснення сполуку можна виготовити як складову фармацевтично прийнятного трансдермального пластиру. У іще подальшому варіанті здійснення сполуку можна вводити суб'єктові за допомогою аерозолі або інгаляції. Цей винахід також пропонує фармацевтичну композицію, виготовлену шля хом поєднання 15 79659 терапевтично ефективної кількості сполуки цього винаходу та фармацевтично прийнятного носія. Цей винахід пропонує спосіб виготовлення фармацевтичної композиції, який включає поєднання терапевтично ефективної кількості сполуки цього винаходу та фармацевтично прийнятного носія. Твердий носій може містити одну або декілька речовин, що можуть діяти як ендогенні носії (наприклад, поживні речовини або поживні мікроелементи), ароматизатори, змащувальні агенти, солюбілізатори, суспендувальні агенти, наповнювачі, ковзні агенти, ущільнювальні добавки, зв'язувальні агенти або дезінтегратори таблеток; ним також може бути інкапсулювальний матеріал. У порошках носій є дрібнодиспергованою твердою речовиною, що знаходиться в суміші з дрібнодиспергованим активним інгредієнтом. У таблетках активний інгредієнт змішаний з носієм, який має необхідні властивості щодо пресування, у придатних пропорціях і спресований до потрібної форми та розміру. Порошки і таблетки переважно містять до 99% активного інгредієнта. Придатні тверді носії містять, наприклад, фосфат кальцію, стеарат магнію, тальк, сахари, лактозу, декстрин, крохмаль, желатин, целюлозу, полівінілпіролідин, віск з низькою температурою плавлення та іонно-обмінні полімери. Рідкі носії використовуються для одержання розчинів, суспензій, емульсій, сиропів, еліксирів і герметичних композицій. Активний інгредієнт може бути розчинений або суспендований у фармацевтично прийнятному рідкому носії, такому як вода, органічний розчинник, їх суміш або фармацевтично прийнятні олії або жири. Рідкий носій може містити інші придатні фармацевтичні добавки, такі як солюбілізатори, емульгатори, буфери, консерванти, підсолоджувачі, ароматизатори, суспендувальні агенти, загусники, барвники, регулятори в'язкості, стабілізатори або осморегулятори. Придатні приклади рідких носіїв для перорального та парентерального введення включають воду (яка частково містить добавки, описані вище, наприклад, похідні целюлози, переважно розчин карбоксиметилцелюлози натрію), спирти (включаючи одноатомні спирти та багатоатомні спирти, наприклад, гліколі) та їхні похідні та олії (наприклад, фракціоновані кокосову олію й арахісову олію). Для парентерального введення носій також може бути складним етером жирної кислоти, таким як етилолеат або ізопропілміристат. Стерильні рідкі носії використовуються в стерильних рідких композиціях для парентерального введення. Рідкий носій для герметичних композицій може бути галогенованим вуглеводнем або іншим фармацевтично прийнятним диспергатором. Рідкі фармацевтичні композиції, які є стерильними розчинами або суспензіями, можуть використовуватися, наприклад, за допомогою внутрішньом'язової, інтратекальної, епідуральної, інтраперитонеальної або підшкірної ін'єкції. Стерильні розчини можуть також вводитися внутрівенно. Сполуки можуть бути приготовані у виді стерильної твердої композиції, яку можна розчиняти або суспендувати під час введення, використовуючи стерильну воду, фізіологічний розчин або 16 інше придатне стерильне ін'єкційне середовище. Носії призначені для включення до них необхідних та інертних зв'язувальних агентів, суспендувальних агентів, змащувальних речовин, ароматизаторів, підсолоджувачів, консервантів, барвників й покривних речовин. Сполуки можуть вводитися перорально у формі стерильного розчину або суспензії, що містить інші розчинені речовини або суспендувальні агенти (наприклад, достатню кількість фізіологічного розчину або глюкози для надання розчину ізотонічності), солі жовчних кислот, гуміарабік, желатин, сорбітанмонолеат, полісорбат 80 (олеатні естери сорбіту та його ангідриди, сополімеризовані з етиленоксидом) тощо. Сполуку можна також вводити перорально або у формі рідкої або твердої композиції. Композиції, придатні для перорального введення, включають тверді форми, такі як пілюлі, капсули, гранули, таблетки та порошки, та рідкі форми, такі як розчини, сиропи, еліксири та суспензії. Форми, придатні для парентерального введення, включають стерильні розчини, емульсії та суспензії. Оптимальні дози, які слід вводити, може визначити фахівець у галузі, та вони будуть різнитися залежно від певної сполуки, що застосовується, активності препарату, режиму введення та розвитку стану хвороби. Додаткові фактори, що залежать від певного суб'єкта, якого лікують, стануть причиною необхідності відрегулювати дози. Такі фактори включають вік, вагу, стать, режим харчування суб'єкта та час введення. В предметі винаходу за даною заявкою, "терапевтично ефективною кількістю" є будь-яка кількість сполуки, яка при введенні хворому, що страждає захворюванням, у відношенні якого ці сполуки є ефективними, викликає зниження, ремісію або регресію захворювання. В предметі винаходу за даною заявкою, "суб'єктом" є хребетне, ссавець або людина. Цей винахід відноситься до способу лікування суб'єкта з патологією, яка зменшується при зниженні активності рецептора МСН1, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, яка є антагоністом рецептора МСН1, для лікування патології суб'єкта. В окремих варіантах здійснення патологією є порушення регуляції стероїдного гормону або гіпофізарних гормонів, порушення вивільнення епінефрину, шлунковокишковий розлад, серцево-судинний розлад, порушення електролітного балансу, гіпертензія, діабет, респіраторний розлад, астма, порушення репродуктивної функції, імунний розлад, ендокринний розлад, скелетно-м'язове порушення, нейроендокринні порушення, когнітивний розлад, розлад пам'яті, такий як хвороба Альцгеймера, порушення сенсорної модуляції та трансмісії, розлад координації руху, розлад сенсорної інтеграції, розлад моторної інтеграції, розлад дофамінергічної функції, такий як хвороба Паркінсона, розлад сенсорної трансмісії, розлад нюху, розлад симпатичної інервації, афективний розлад, такий як депресія та тривожний розлад, розлад, пов'язаний зі стресом, розлад рідинного балансу, судомні напади, біль, психотична поведінка, така як шизофренія, толерантність до морфіну, опійна наркоманія, 17 79659 мігрень або сечовий розлад, такий як нетримання сечі. Наступний опис депресивних і тривожних розладів приводиться з метою ілюстрації використання сполук за цим винаходом. Визначення депресивних і тривожних розладів, наведені нижче, дані [в Diagnostic and Statistical Manual of Mental Disorders. 4th ed. (DSM-IV; American Psychiatric Association 1994a) або Diagnostic and Statistical Manual of Mental Disorders. 3rd ed. Revised (DSM-III-R; American Psychiatric Association, 1987)]. Додаткова інформація про ці розлади може бути знайдена в наведених посиланнях, а також в інших джерелах, наведених нижче, що включені в цей опис шляхом посилання. Депресивні розлади включають великий депресивний розлад та дистимічний розлад [American Psychiatric Association, 1994a; American Psychiatric Association, 1994b]. Великий депресивний розлад характеризується наявністю одного або декількох великих депресивних епізодів без епізодів манії і гіпоманії. Великий депресивний епізод визначається як виражений і відносно постійний депресивний або дисфоричний настрій, що звичайно впливає на повсякденну діяльність (майже щодня протягом, принаймні, 2 тижнів); він повинен містити в собі, принаймні, 4 симптоми з наступних 8: зміна апетиту, порушення сну, психомоторна загальмованість або ажитація, втрата інтересу до звичайної діяльності або зниження лібідо, підвищена стомленість, відчуття провини або непотрібності, знижена розумова активність або погіршення концентрації та суїцидальні спроби або думки про суїцид [Medical Economics Company, 2002]. До дистимічного розладу відноситься тип депресії, що не є досить важким, щоб відноситися до великого депресивного епізоду, але який триває набагато довше, ніж великий депресивний розлад, без інтенсивних фаз. Вважається, що сполуки за цим винаходом, можуть бути е фективними при лікуванні депресії у пацієнтів з депресією, діагностованою шляхом проведення будь-якого вказаного далі тесту: оцінка депресії за шкалою Гамільтона (HDRS), показники депресії за шкалою Гамільтона, шкала глобальної клінічної оцінки (CGI) тяжкості захворювання. Більш того, вважається, що сполуки за цим винаходом можуть стимулювати поліпшення певних факторів, вимірюваних за цими тестами, таких як бали пунктів HDRS, включаючи показник депресивного настрою, фактор порушення сну і фактор тривоги і тяжкість захворювання за CGI. Також припускають, що сполуки за цим винаходом можуть бути е фективними для профілактики рецидиву великих депресивних епізодів. Тривожні розлади включають панічний розлад, агорафобію з або без панічного розладу, специфічну фобію, соціальну фобію, обсесивно-компульсивний розлад, посттравматичний стресовий розлад, гострий стресовий розлад і генералізований тривожний розлад. Вважається, що сполуки за цим винаходом можуть бути е фективними при лікуванні кожного з цих розладів у пацієнтів, у яких були діагностовані ці розлади. Обсесивно-компульсивний розлад характеризується повторюваними і постійними ідеями, думками, імпульсами або уявними 18 образами (обсесії), що є его-дістонічними та/або повторюваними, цілеспрямованими і навмисними вчинками (компульсії), що сприймаються суб'єктом як надмірні або безглузді (Асоціація американських психіатрів, 1994а). Обсесії й компульсії, що викликають виражений дистрес, займають багато часу або значно впливають на соціальну або професійну діяльність. Вважається, що сполуки за цим винаходом можуть бути ефективними при лікуванні обсесій і компульсій у пацієнтів з обсесивно-компульсивним розладом, діагностованим шляхом проведення відповідних тестів, які включають, але не обмежуються тільки ними: шкала обсесивно-компульсивних симптомів за YaleBrown (YBOCS) (Goodman, 1989) (для дорослих), обсесивно-компульсивна шкала Національного інституту психічного здоров'я OCD (NIMH GOCS), CGI-шкала тяжкості захворювання. Більш того, вважається, що сполуки за цим винаходом можуть бути е фективними у викликанні поліпшення певних факторів, вимірюваних у цих теста х, таких як зниження декількох пунктів у підсумковому показнику YBOCS. Також вважають, що сполуки за цим винаходом можуть бути ефективними для профілактики рецидиву обсесивно-компульсивного розладу. Панічні розлади характеризуються повторюваними раптовими панічними атаками і пов'язаним з ними занепокоєнням про наступні атаки, тривогою про результат або наслідок атак, та/або значною зміною в поведінці, пов'язаною з атаками (American Psychiatric Association, 1994a). Панічна атака визначається як дискретний період інтенсивного страху або дискомфорту, під час якого раптово з'являються і досягають максимуму протягом 10 хвилин чотири (або більше) наступні симптоми: (1) прискорене серцебиття, сильне серцебиття або збільшення серцевого ритму; (2) підвищене потовиділення; (3) тремтіння або дрижання; (4) відчуття утр уднення дихання або ядухи; (5) відчуття асфіксії; (6) біль і дискомфорт у гр удях; (7) нудота або абдомінальний дистрес; (8) відчуття запаморочення, утрати рівноваги, легкості у голові (наближення непритомності) або непритомність; (9) дереалізація (відчуття нереальності того, що відбувається) або деперсоналізації (відчуття того, що це відбувається не з ним); (10) страх втратити контроль над собою; (11) страх смерті; (12) парестезія (відчуття отерплості або поколювання); (13) озноб або відчуття жару. Панічний розлад може бути пов'язаний, а може бути і не пов'язаний, з агорафобією або може бути безпричинним і часто обмежуючим дієздатність страхом при виході на публіку. Також вважається, що сполуки за цим винаходом можуть бути е фективними під час лікування панічного розладу у пацієнтів, яким діагностували панічний розлад на основі частоти виникнення панічних атак або за CGI-шкалою тяжкості захворювання. Також вважається, що сполуки за цим винаходом можуть бути ефективними для викликання поліпшення певних факторів, вимірюваних за цими оцінними тестами, таких як зниження частоти або припинення панічних атак, поліпшення за CGI-шкалою тяжкості захворювання або за CGI-глобальною шкалою поліпшення до 1 (си 19 79659 льне поліпшення), 2 (достатнє поліпшення) або 3 (мінімальне поліпшення). Також вважається, що сполуки за цим винаходом можуть бути е фективними для запобігання рецидиву панічного розладу. Соціальний тривожний розлад, також відомий як соціальна фобія, характеризується явним і постійним страхом перед однією або декількома соціальними ситуаціями або виступом перед публікою, у яких суб'єкт незахищений від незнайомих людей або існує можливість його перебування в центрі уваги (American Psychiatric Association, 1994a). Ситуація, яка викликає страх, майже завжди приводить до занепокоєння, яке може збільшити інтенсивність панічної атаки. Ситуацій, що викликають страх, уникають або долають з величезною тривогою або дистресом. Уникання, неспокійне чекання або дистрес у ситуації(ях), що викликає(ють) страх, значно впливає на звичайне життя суб'єкта, професійну або навчальну діяльність або соціальну активність або відносини, або відзначається важке нездужання, що наближається до фобії. Невеликий ступінь тривоги при публічному виступі або сором'язливість звичайно не потребують психофармакологічного лікування. Вважають, що сполуки за цим винаходом можуть бути ефективними при лікуванні соціальної фобії у пацієнтів із соціальною фобією, діагностованою на підставі кожного з наступних тесті в: шкала оцінки соціальної фобії за Лейбовіцем (Leibowitz) (LSAS), CGI-шкала тяжкості захворювання, оцінка тривоги за шкалою Гамільтона (НАМ-А), оцінка депресії за шкалою Гамільтона (HAM-D), оцінна шкала V для визначення соціальної й професійної діяльності за DSM-IV, шкала II (ICD-10) оцінки непрацездатності Всесвітньої організації охорони здоров'я, Перелік 2 (DAS-2), шкала непрацездатності за Шиханом (Sheehan), шкала непрацездатності за Шнеєром (Schneier), оцінка якості життя Всесвітньої організації охорони здоров'я 100 (WHOQOL-100) або інші тести, описані Bobes, 1998, які включено сюди шляхом посилання. Більш того, вважається, що сполуки за цим винаходом можуть бути е фективними для викликання поліпшення певних факторів, вимірюваних за цими оцінними тестами, такими як зсув від основної лінії в шкалі оцінки соціальної фобії за Лейбовіцем (Leibowitz) (LSAS) або за CGIглобальною шкалою поліпшення до 1 (сильне поліпшення), 2 (достатнє поліпшення) або 3 (мінімальне поліпшення). Також вважається, що сполуки за цим винаходом можуть бути ефективними для запобігання рецидиву соціальної фобії. Генералізований тривожний розлад характеризується надмірною тривогою і занепокоєнням (очікування поганого), що повторюються, принаймні, протягом 6 місяців і над якими, на думку суб'єкта, важко утримувати контроль [American Psychiatric Association, 1994a]. Він має бути пов'язаним з принаймні 3 з наступних 6 симптомів: занепокоєння або відчуття підвищеної збудженості аж до зриву, швидке стомлення, складність сконцентруватися або почуття "порожнечі в голові", дратівливість, м'язове напруження, порушення сну. Діагностичні критерії цього розладу докладно описані в DSM-IV, що включено сюди шляхом посилання [American Psychiatric Association, 1994a]. 20 Вважають, що сполуки за цим винаходом можуть бути е фективними при лікуванні генералізованого тривожного розладу у пацієнтів з цим розладом, діагностованим відповідно до діагностичних критеріїв, описаних у DSM-IV. Більш того, вважається, що сполуки за цим винаходом можуть ефективно знижувати симптоми цього розладу, такі як: надмірне хвилювання й тривога, важко контрольоване занепокоєння, занепокоєння або відчуття підвищеної збудженості аж до зриву, швидке стомлення, складність сконцентруватися або почуття "порожнечі в голові", дратівливість, м'язове напруження або порушення сну. Також вважається, що сполуки за цим винаходом можуть бути ефективними для запобігання рецидиву генералізованого тривожного розладу. При посттравматичному стресовому розладі (PTSD), як визначено в DSM-III-R/IV (Асоціація американських психіатрів, 1987, Асоціація американських психіатрів, 1994а), потрібний вплив травматичного фактора, що включає фактичну або очікувану смерть або серйозне ушкодження, або погрозу стосовно тілесної недоторканності самого суб'єкта або інших людей, і відповідна реакція, що включає сильний страх, безпорадність або жах. Симптоми, що з'являються в результаті дії травматичного фактора, включають переживання цього випадку у виді нав'язливих думок, спогадів або снів і сильний психологічний дистрес і фізіологічну реактивність при натяку на цей випадок; уникання ситуацій, що нагадують про травматичний випадок, нездатність відтворити деталі цього випадку та/або зменшення загальної реакції, що виражається в зниженому інтересі до значимої активності, відчуженості, обмеженні кола переваг або утраті смислу подальшого існування; і симптоми автономної збудженості, включаючи гіпербезсонницю, надмірну старт-реакцію, порушення сну, знижену здатність до концентрування і дратівливість або спалахи роздратування. При діагнозі PTSD симптоми повинні бути присутніми протягом, принаймні, місяця і викликати клінічно значимий дистрес або погіршення соціальної, професійної або інших важливих галузей діяльності. Вважається, що сполуки за цим винаходом можуть бути е фективними при лікуванні PTSD у пацієнтів з PTSD, діагностованим шляхом проведення будь-якого наступного тесту: Шкала клінічної оцінки PTSD частина 2 (CAPS), шкала оцінки впливу травматичної події для підрахунку пацієнтом (IES) [Medical Economics Company, 2002, p.2752]. Більш того, вважається, що сполуки за цим винаходом можуть поліпшува ти бали за шкалами тестів CAPS, IES, тяжкості захворювання за CGI або тесту глобальної клінічної оцінки CGI. Також вважається, що сполуки за цим винаходом можуть бути е фективними для запобігання рецидиву PTSD. У кращому варіанті здійснення об'єктом цього винаходу є спосіб лікування або терапії наступних симптомів: депресивні розлади, тривожні розлади, порушення харчування/маси тіла й сечових розладів. Прикладами депресивних розладів є великий депресивний розлад або дистимічний розлад. Прикладами тривожних розладів є панічний розлад, агорафобія без панічного розладу, специфіч 21 79659 на фобія, соціальна фобія, обсесивнокомпульсивний розлад, посттравматичний стресовий розлад, гострий стресовий розлад і генералізованний тривожний розлад. Прикладами розладів харчування/маси тіла є ожиріння, підвищення ваги, булімія, нервова булімія або нервова анорексія. Приклади сечових розладів включають, проте не обмежуються тільки ними, нетримання сечі при гіперактивному сечовому міхурі, нетримання сечі, часте сечовипускання, часті позиви до сечовипускання (настирливості щодо сечовипускання), ніктурію або енурез. Гіперактивний сечовий міхур та настирливість щодо сечовипускання можуть бути або можуть не бути пов'язаними із простатичною гіперплазією, що починається. Винахід пропонує спосіб модифікації харчової поведінки суб'єкта, який включає введення суб'єктові кількості сполуки за винаходом, яка є ефективною щодо зниження споживання їжі суб'єктом. Винахід також пропонує спосіб лікування розладу харчування у суб'єкта, який включає введення суб'єктові кількості сполуки за винаходом, яка є ефективною для лікування розладу харчування. У варіанті здійснення цього винаходу розлад харчування - це ожиріння, булімія, нервова булімія або нервова анорексія. Цей винахід також відноситься до способу зниження маси тіла суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження маси тіла суб'єкта. Цей винахід також відноситься до способу контролю за ожирінням у суб'єкта, що потребує зниження маси тіла, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження маси тіла суб'єкта. Цей винахід також відноситься до способу контролю за ожирінням у суб'єкта, що мав досвід утрати маси тіла, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для підтримання такої втрати маси тіла у суб'єкта. Цей винахід також відноситься до способу лікування депресії у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування депресії у суб'єкта. Цей винахід також відноситься до способу лікування тривожного розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування депресії та тривожного розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування депресії та тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування великого депресивного розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування великого депресивного розладу у суб'єкта. Цей винахід також відноситься до способу лікування дистимічного розладу в суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування дистимічного розладу у суб'єкта. Цей винахід також відноситься до способу лікування обсесій та компульсій у суб'єкта з обсесивно-компульсивним розладом, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для 22 лікування обсесій та компульсій у суб'єкта. Цей винахід також відноситься до способу лікування панічного розладу з агорафобією або без агорафобії у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування панічного розладу у суб'єкта. Цей винахід також відноситься до способу лікування соціально-тривожного розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування соціально-тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування генералізованого тривожного розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування генералізованого тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування посттравматичного стресового розладу у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування посттравматичного стресового розладу у суб'єкта. Вважається, що сполуки за цим винаходом можуть бути ефективними для лікування ожиріння, включаючи утрату маси й підтримання утрати маси у пацієнтів з ожирінням, діагностованим за однією або декількома наступними системами оцінок: індекс підвищення маси тіла, збільшення окружності талії (індикатор внутрішньоабдомінального жиру), двоенергетична рентгенівська абсорбціометрія (DEXA) і трукальна (андроїд) жирова маса. Крім того, вважають, що сполуки за цим винаходом будуть ефективними викликати поліпшення конкретних факторів, вимірюваних за цими тестами. Вважають, що сполуки за цим винаходом можуть бути ефективними для лікування сечових розладів у пацієнтів з нетриманням або змішаним (з перевагою невідкладного нетримання) нетриманням сечі з декількома небажаними епізодами на тиждень, з декількома епізодами небажаного сечовипускання на день і невеликими об'ємами спорожнювання при сечовипусканні. Більш того, вважається, що сполуки за цим винаходом можуть ефективно поліпшувати певні фактори, вимірювані за цими тестами. Цей винахід також відноситься до способу лікування суб'єкта з біполярним розладом І або II, шизоафективним розладом, когнітивним розладом з депресивним настроєм, розладом особистості, інсомнією, гіперсомнією, нарколепсією, з порушенням циркадного ритму, стражданнями на кошмари, з приступами інтенсивного страху під час сну або з сомнамбулізмом. Цей винахід відноситься до способу лікування гіперактивного сечового міхура з невідкладним нетриманням сечі, з наполегливими та/або частими позивами до сечовипускання у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування гіперактивного сечового міхура у суб'єкта. Цей винахід також відноситься до способу зниження невідкладного нетримання сечі у суб'єкта, що страждає на гіперактивний сечовий міхур, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження невідкладного нетримання сечі у суб'єкта. Цей винахід також відно 23 79659 ситься до способу зниження невідкладного позиву до сечовипускання (настирливості щодо сечовипускання) у суб'єкта з гіперактивним сечовим міхуром, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження невідкладного позиву до сечовипускання у суб'єкта. Крім того, цей винахід відноситься до способу зниження частоти сечовипускання у суб'єкта з гіперактивним сечовим міхуром, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження частоти сечовипускання у суб'єкта. Цей винахід також відноситься до способу лікування суб'єкта, що страждає сечовим розладом, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування сечового розладу у суб'єкта. У деяких варіантах здійснення, сечовим розладом є нетримання сечі, гіперактивний сечовий міхур, непереборні позиви до сечовипускання, часті сечовипускання, невідкладні позиви до сечовипускання (настирливість щодо сечовипускання), ніктурія або енурез. Цей винахід відноситься до способу полегшення симптомів розладу у суб'єкта, який полягає у введенні суб'єкту кількості антагоніста МСН1, е фективного для зниження симптомів, де антагоністом МСН1 є будь-яка зі сполук за цим винаходом. В одному з варіантів здійснення даного винаходу суб'єктом є хребетне, ссавець, людина або собака. В іншому варіанті здійснення сполука вводиться перорально. У ще одному варіанті здійснення сполука вводиться з їжею. У кращому варіанті здійснення цей винахід відноситься до способу лікування наступного: депресії, тривожного розладу, порушення харчування/маси тіла й сечових розладів. Прикладами порушення харчування/маси тіла є ожиріння, булімія або нейрогенна булімія. Приклади сечових розладів включають, але не обмежуються тільки ними, нетримання сечі, гіперактивний сечовий міхур, непереборні позиви до сечовипускання, часті сечовипускання, невідкладні позиви до сечовипускання (настирливість щодо сечовипускання), ніктурія або енурез. Гіперактивний сечовий міхур і невідкладний позив до сечовипускання (настирливість щодо сечовипускання) можуть бути як пов'язані, так і ні, із простатичною гіперплазією, що починається. Цей винахід відноситься до способу модифікування харчової поведінки у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зменшення споживання їжі суб'єктом. Цей винахід також відноситься до способу лікування харчових порушень у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зменшення споживання їжі суб'єктом. В одному з варіантів здійснення цього винаходу харчовим порушенням є булімія, ожиріння або нейрогенна булімія. В одному з варіантів здійснення даного винаходу суб'єктом є хребетне, ссавець, людина або собака. У ще одному варіанті здійснення сполука вводиться з їжею. Цей винахід також відноситься до способу зниження маси тіла у суб'єкта, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для зниження маси тіла у суб'єкта. Цей винахід також 24 відноситься до способу лікування суб'єкта, що страждає депресією, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування депресії у суб'єкта. Цей винахід також відноситься до способу лікування суб'єкта з тривожним розладом, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування суб'єкта, що страждає на депресією і тривожний розлад, який полягає у введенні суб'єкту кількості сполуки за цим винаходом, ефективної для лікування депресії та тривожного розладу у суб'єкта. Цей винахід також відноситься до способу лікування суб'єкта, що страждає великим депресивним розладом, дистимічним розладом, біполярними розладами І і II, шизоафективним розладом, когнітивним розладом з депресивним настроєм, розладом особистості, інсомнією, гіперсомнією, нарколепсією, порушенням циркадного ритму, стражданнями на кошмари, приступами інтенсивного страху під час сну, сомнамбулізмом, обсесивно-компульсивним розладом, панічним розладом з агорафобією або без неї, посттравматичним стресовим розладом, соціальним тривожним розладом, соціальною фобією і генералізованим тривожним розладом. Цей винахід також пропонує спосіб лікування суб'єкта, що страждає на сечовий розлад, який включає введення суб'єктові кількості сполуки цього винаходу, ефективної для лікування сечового розладу у суб'єкта. У деяких варіантах здійснення винаходу сечовий розлад - це нетримання сечі, гіперактивний сечовий міхур, непереборні позиви до сечовипускання, часті сечовипускання, невідкладні позиви до сечовипускання (настирливість щодо сечовипускання), ніктурія або енурез. Цей винахід пропонує сполуки, що мають структур у: де кожний R1 - це незалежно водень; -F; -СІ; Br; -I; -CN; -NCh; C 1-C7алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; С2-С7алкеніл з прямим або розгалуженим ланцюгом; С3-С7циклоалкіл або С 5-С7циклоалкеніл; арил; гетероарил; -N(R5)2; -(CH2)mOR5; -COR 5; CO2R5; -OCOR 5; -CON(R5)2 ; -N(R5)COR 5; N(R5)CON(R5)2; -OCON(R 5)2 або -N(R5)CO2R5; де R2 та R3 - це незалежно водень; -F; -Cl; -Br; -I; -CN; -(CH2)mOR5; -(CH2) mSR5; C1-C7алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)p-; де R4 - це водень; С1-С7алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим 25 79659 ланцюгом; С3-С6циклоалкіл; -N(R5)2 або (CH2)mOR5; де кожний R5 - це незалежно водень; арил; гетероарил або C1-C7алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений арилом або гетероарилом; де кожний R6 - це незалежно водень; C1C7алкіл з прямим або розгалуженим ланцюгом; де кожний R7 - це незалежно водень; феніл або C1-C7алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; де кожний R8 - це водень або C1-C7алкіл з прямим або розгалуженим ланцюгом; де R4 і R8 разом можуть бути -(СН2)r-; де кожний m - це незалежно ціле число від 0 до 5 включно; де n - це ціле число від 1 до 5 включно; де p - це ціле число від 2 до 7 включно; де q - це ціле число від 0 до 2 включно; де кожний X - це незалежно СН або N; де Ζ - це CO; SO2 або може бути відсутнім, або їх фармацевтично прийнятні солі. В одному варіанті здійснення винаходу сполука має структуру: В іншому варіанті здійснення винаходу сполука має структуру: де кожний R1 - це незалежно водень; -F; -СІ; Br; -I; -CN; -NO 2; C 1-C7алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; С2-С7алкеніл з прямим або розгалуженим ланцюгом; С3-С7циклоалкіл або С 5-С7циклоалкеніл; арил; гетероарил; -N(R5)2; -(CH2)mOR5; -COR 5; CO2R5; -OCOR 5; -CON(R5)2 ; -N(R5)COR 5; N(R5)CON(R5)2; -OCON(R 5)2 або -N(R5)CO2R5; де R2 та R3 - це незалежно водень; -F; -Cl; -Br; -I; -CN; -(CH2)mOR5; -(CH2) mSR5; C1-C7алкіл, монофторалкіл, поліфторалкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)p-, де R4 - це C1-C7алкіл, монофторалкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; Сз-С6циклоалкіл, C1-C7алкіл-С 3-С6циклоалкіл; -N(R5)2 або -(CH2)mOR5; де кожний R5 - це незалежно водень; арил; гетероарил або C1-C7алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений арилом або гетероарилом; де кожний R6 - це незалежно водень; C1C7алкіл з прямим або розгалуженим ланцюгом; 26 де кожний R7 - це незалежно водень; феніл або C1-C7алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; де кожний m - це незалежно ціле число від 0 до 5 включно; де n - це ціле число від 1 до 5 включно; де p - це ціле число від 2 до 7 включно; де q - це ціле число від 0 до 2 включно; де X - це СН або N; або її фармацевтично прийнятна сіль. До підкласу винаходу належать сполуки, де кожний R1 - це незалежно водень; C1-C7алкіл з прямим або розгалуженим ланцюгом; -F; -СІ; -Br; I; -CN; -NO 2; C1-C 4алкіл або поліфторалкіл з прямим або розгалуженим ланцюгом; -(CH2)mOR5; COR5; -CO2R 5; -OCOR5; -CON(R 5)2; -N(R5)COR 5 або -N(R5)CON(R5)2; де R2 та R3 - це незалежно водень; -F; -СІ; -Br; -I; -CN; -(CH2)mSR5 ; C1-C7алкіл з прямим або розгалуженим ланцюгом; арил або гетероарил, де арил або гетероарил може бути заміщений одним або більше R1; або де R2 і R3 разом можуть бути -(СН2)p-; де R4 - це C1-C7алкіл з прямим або розгалуженим ланцюгом; С3-С6циклоалкіл; -N(R5)2 або (CH2)mOR5; де кожний R5 - це незалежно водень або С 1-С3 алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; де m - це число від 0 до 3; де n - це число від 1 до 3; де p - це ціле число від 2 до 5 включно; де q - це 0; та де X - це СН. До підкласу винаходу належать сполуки, що мають формулу: В одному варіанті здійснення винаходу сполуки мають наступну стр уктуру: В одному варіанті здійснення винаходу кожний R5 - це незалежно водень або С1-С3алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; R7 - це незалежно водень або C1-C7алкіл з прямим або розгалуженим ланцюгом; та де R4 - це C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу кожний R1 - це незалежно водень; -F; -СІ; -Вr; -І або C1C7алкіл з прямим або розгалуженим ланцюгом; де R2 - це водень або C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення n=2. 27 В одному варіанті здійснення винаходу R1 - це водень; -F; -СІ; -Вr; -І або C1-C7алкіл з прямим або розгалуженим ланцюгом; та R2 - це водень або C1-C7алкіл з прямим або розгалуженим ланцюгом, В одному варіанті здійснення винаходу R2 - це водень. В одному варіанті здійснення винаходу R3 - це ОН. До підкласу винаходу належать сполуки за формулою: В одному варіанті здійснення винаходу R4 - це С3-С6циклоалкіл. В одному варіанті здійснення винаходу R2 та R3 - це незалежно водень; -F; -Вr або C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу R2 та R3 - це незалежно водень або C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу R2 та R3 - це незалежно водень; -F або -Вr. В одному варіанті здійснення винаходу R2 і R3 разом - це -(СН2)р-. В одному варіанті здійснення винаходу сполука має структуру: В одному варіанті здійснення винаходу R5 та R7 - це незалежно водень або C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу кожний R1 - це незалежно водень; -F; -СІ; -Вr; -І або C1C7алкіл з прямим або розгалуженим ланцюгом; та де R2 - це водень або C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу R4 - це C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу сполука має наступну стр уктур у: В одному варіанті здійснення винаходу сполука має наступну стр уктур у: 79659 28 В одному варіанті R2 - це водень або -ОН; де R3 - це феніл, заміщений одною або декількома складовими R1; та q=0. В одному варіанті здійснення винаходу кожний R5 - це незалежно водень або С1-С1алкіл з прямим або розгалуженим ланцюгом, де алкіл може бути заміщений фенілом; R7 - це незалежно водень або C1-C7алкіл з прямим або розгалуженим ланцюгом; та де R4 - це C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення винаходу кожний R! - це незалежно водень; -F; -СІ; -Вr; -І або C1C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті здійснення X - це N. В одному варіанті здійснення X - це CR1. В одному варіанті здійснення R2 - це ОН. В одному варіанті здійснення сполука має наступну стр уктур у: В одному варіанті здійснення R3 - це феніл, заміщений одним або декількома складовими R1; та q=0. В одному варіанті здійснення R5 та R7 - це незалежно водень або C1-C7алкіл з прямим або розгалуженим ланцюгом; та R4 - це C1-C7алкіл з прямим або розгалуженим ланцюгом. В одному варіанті R2 - це водень; C1-C7алкіл з прямим або розгалуженим ланцюгом або -ОН. В одному варіанті здійснення винаходу сполука є енантіомерно чистою. В одному варіанті здійснення винаходу сполука є діастереомерно чистою. В одному варіанті здійснення винаходу сполука є енантіомерно та діастереомерно чистою. Цей винахід також пропонує фармацевтичну композицію, яка включає терапевтично ефективну кількість сполуки цього винаходу та фармацевтично прийнятний носій. Цей винахід далі пропонує фармацевтичну композицію, виготовлену шляхом змішування сполуки цього винаходу з фармацевтично прийнятним носієм. Цей винахід також пропонує спосіб виготовлення фармацевтичної композиції, який включає змішування сполуки цього винаходу з фармацевтично прийнятним носієм. Цей винахід також пропонує спосіб лікування суб'єкта, що страждає на розлад, опосередкований рецептором МСН1, який включає введення суб'єктові терапевтично ефективної кількості сполуки цього винаходу. 29 79659 В одному варіанті здійснення терапевтично ефективна кількість становить від приблизно 0,03 до приблизно 300мг. В одному варіанті здійснення розлад - це депресія, тривожний розлад, ожиріння або непереборний позив до сечовипускання. Цей винахід також пропонує спосіб лікування суб'єкта, що страждає на розлад, вибраний з групи, яка складається з депресії, тривожного розладу, непереборного позиву до сечовипускання або ожиріння, який включає введення суб'єктові терапевтично ефективної кількості сполуки цього винаходу. Цей винахід буде краще зрозумілим з розділу "Експериментальна частина", наведеного далі. Проте фахівцю в даній галузі без зусиль буде зрозуміло, що розглянуті конкретні способи й результати, є просто ілюстративними для даного винаходу, який описано більш докладно у формулі винаходу, що додана до цього опису винаходу. Експериментальна частина І. Способи синтезу для Прикладів Загальні способи: Усі реакції (за винятком ряду проведених паралельно реакцій синтезу) проводили в атмосфері аргону і реактиви, без розчинника або у відповідних розчинниках, поміщали в реакційну судин у за допомогою шприца та канюлі. Дослідження паралельних реакцій синтезу проводили в пробірках (без інертної атмосфери), використовуючи нагрівальні шейкери J-KEM (Saint Louis, МО). Безводні розчинники були придбані в Aldrich Chemical Company і використовувалися такими, якими вони були отримані. Назви зразкам, описаним у даному патенті, були дані, використовуючи програму ACD/Name (версія 4.0. Advanced Chemistry Development Inc., Toronto, Ontario, M5H2L3, Canada). Спектри 1H ЯМР реєстрували при 400МГц, застосовуючи спектрометр Вrьkеr Avance з тетраметилсиланом як внутрішній стандарт. Спектрограми позначили наступним чином: с - синглет; д - дублет; т - триплет; к - квартет; квінтет; секстет; септет; шир - уширений, м - мультиплет. Елементні аналізи виконували у Robertson Microlit Laboratories, Inc. Мас-спектри отримали на приладі Platform II (Fisions) або спектрометрі Quattro Micro (Micromass) з електророзпилювальною (ESMS) іонізацією та вказували МН +. Тонкошарову хроматографію (ТШХ) виконували на скляних пластинах, попередньо покритих силікагелем 60 F254 (0,25мм, EM Separations Tech.). Препаративну тонкошарову хроматографію здійснювали на скляних пластинах, попередньо покритих силікагелем GF (2мм, Analtech). Колонкову флешхроматографію виконували на силікагелі Merck 60 (230-400меш). Точки плавлення (mр) визначили на відкритих капілярних тр убках на апараті Mel-Temp та їх не коректували. Приклади, описані в експериментальній частині лише ілюструють способи, що застосовуються для синтезу антагоністів МСН1. Більш докладний опис кожної реакції представлено процедурами, 30 що слідують за схемами. Додаткові сполуки винаходу можна отримати, застосовуючи способи загального синтезу, описані тут, або шля хом застосування варіантів цих способів. Визначення змінних, описаних у вказаних нижче схемах, надаються у Суті винаходу. Наприклад, змінна R 4 може бути С1-С7алкілом, монофторалкілом або полїфторалкілом з прямим або розгалуженим ланцюгом, С3-С6циклоалкілом, С1-С7алкілом-С 3С6циклоалкілом; -N(R5)2 або -(CH2)mOR5. Крім того, з метою ясності кількість складових (R1) фенілу обмежена до одиниці. Схема 1 (a) LDA/PhNTf2/THF/ -78°С, потім 0°С протягом ночі; (b) Амінофенілборонова кислота/Pd(РРh)4/LіСl/Nа2СО3/DМЕ-Н2О/ кип'ятіння у колбі зі зворотним холодильником протягом 3 годин; (с) 10% Рd/С/Н2/ЕtOН/ кімнатна температура протягом 24-48 годин; (d) Хлорангідрид кислоти, або карбамоїлхлорид, або хлорформіат/луг/THF/ 0°С, потім кімнатна температура протягом 2-3 годин; (e) 4М НСl у 1,4-діоксані/ кімнатна температура протягом 1 години або TFA/CH2Cl2/ кімнатна температура протягом 1-2 годин. Схема 2 (а) Біс(пінаколато)дибор/KОАс/PdСl2dррf/dррf/80°С протягом ночі; (b) K2CO3/PdCl2dppf/DMF/ 80°C протягом ночі; (с) 10% Pd/C/H2/EtOH/ кімнатна температура протягом 24-72 годин; (d) 4М НСl у 1,4діоксані/ кімнатна температура протягом 1 години або TFA/CH2CI2/ кімнатна температура протягом 12 годин; (e) Хлорангідрид кислоти/Еt3N/ТНF/ 0°С, потім кімнатна температура протягом 2-3 годин. 31 79659 Схема 3 (а) Ди-трет-бутилдикарбонат/K2СО3/ЕtOН/ кімнатна температура протягом ночі; (b) Трет-бутил N-(3-бромпропіл)карбамат/K2CO3/NaI/D MF/ 80100°C протягом ночі; (с) 4М НСl у 1,4-діоксані/0°С протягом 1 години або TFA/CH2Cl2/ кімнатна температура протягом 1-2 годин; (d) N-(nбромалкіл)фталімід/K2СО3/NаI/DМF/ 90°С протягом 5годин; (е) N-(nбромалкіл)фталімід/діізопропілетиламін/Вu4NI/діоксан/ 100°С протягом 24 годин; (f) гідрат гідразину/EtOH/ кип'ятять у колбі зі зворотним холодильником протягом 4 годин. Схема 4 32 протягом ночі або діізопропілетиламін/Вu4NI/діоксан/ кип'ятять у колбі зі зворотним холодильником протягом ночі; (с) гідрат гідразину/ЕtOН/ кип'ятять у колбі зі зворотним холодильником протягом 4 годин; (d) хлорангідрид кислоти або карбамоїлхлорид або хлорформіат/луг/ТНF/0°С, потім кімнатна температура протягом 2-3 годин; (e) кислота/сполучний peaгент /DMF/CH2Cl2/ кімнатна температура протягом ночі. Схема 6 (a) HOAc/H 2SO4 / 80°C протягом ночі. Посилання на процедуру: [Clarke, L. F.; Hegarty, A. F.; O'Neill, P. J. Org. Chem. 1992, 57, 362-366]. Схема 7 (а) Н2SО4/15°С/2 години. Посилання на процедуру: [Takahashi, Y.; Yoneda, Ν.; Nagai, Η. Chem. Lett 1985, 1733-1734]. Схема 8 (а) Хлорангідрид кислоти або карбамоїлхлорид або хлорформіат/луг/СН 2Сl2 або THF/ 0°С, потім кімнатна температура протягом 12 годин. Схема 9 (a) NaI/K2CO3/D MF/ 80-100°C протягом ночі або діізопропілетиламін/Вu4NI/діоксан/ 100°С протягом 3 годин; (b) хлорангідрид кислоти/луг/СН 2Сl2/ кімнатна температура протягом 2 годин; (с) кислота/сполучний peaгент /DMF/CH2Cl2/ кімнатна температура протягом ночі. Схема 5 (a) EDC/DMAP/DMF/CH2CI2 / кімнатна температура протягом ночі. Схема 10 (a) PS Карбодіімід/DМАР/D МF/СН2Сl2/ кімнатна температура протягом ночі. (а) фталімід /DЕАD/РРh3/ТНР/ кімнатна температура протягом ночі; (b) NaI/K2CO3/DMF/ 80-100°C 33 79659 Схема 11 34 (а) Н2, Pd/C, EtOH, кімнатна температура протягом 12 годин. Схема 16 (а) (СОСl)2 або SOCl 2; (b) (4S)-(-)-4-ізопропіл-2оксазолідинон/n-ВuLi/ТНF/ -78°С до 0°; (с) LHMDS/THF/ -78°С до 0°/МеІ; (d) LiОН/Н2О2/ТНF/Н2О/ кімнатна температура. Схема 12 (а) Загальні способи сполучання зображено наступним чином: 1,1'-карбонілдіімідазол/СН2СІ2/кімнатна температура протягом ночі або SOCl2/Et3N/CH2Cl2/кімнатна температура протягом ночі, або ВСС/НОВt/луг/СН 2Сl2/ кімнатна температура протягом ночі, або EDCl/DMAP/CH2Cl2/ кімнатна температура протягом ночі, або EDCl/HOBt/Et3N/CH2Cl2/ кімнатна температура протягом ночі, або ізобутилхлорформіат/NМР/СН2Сl2/ -20°С протягом 1 години. Схема 13 (a) EtI/t-BuONa/THF/ кімнатна температура протягом ночі; (b) RCOOH/EDC/DMAP/CH 2Cl2/D MF. Схема 14 (a) Et3N/CH2Cl2/ кімнатна температура протягом 40 хвилин; (b) K 2СО3/NaI/D MF/ 80-100°С протягом ночі. Схема 15 (a) K2CO3/PdCl2dppf/DMF/ 80°C протягом ночі; (b) 10% Pd/C/H2/HOAc/ кімнатна температура протягом 24-72 годин; (с) 4М НСl у 1,4-діоксані/ кімнатна температура протягом 1 години або TFA/CH2Cl2/ кімнатна температура протягом 1-2 годин. Схема 17 (a) DPPA/Et3N/BnOH/толуол, кип'ятять у колбі зі зворотним холодильником протягом ночі; (b) K2CO3/PdCl2dppf/DMF/ 80°C протягом ночі; (с) 10% Pd/C/H 2/EtOАс/ кімнатна температура протягом 2472 годин; (d) 4М НСl у 1,4-діоксані/ кімнатна температура протягом 1 години або TFA/CH2CI2 / кімнатна температура протягом 1-2 годин; (e) ізобутирилхлорид/Еt3N/THF/ 0°С, потім кімнатна температура протягом 2-3 годин. 35 79659 36 Схема 18 (a) KOH/50% ЕtOН(водн)/ кип'ятять у колбі зі зворотним холодильником протягом ночі. Схема 19 Загальні способи синтезу карбонових кислот [YONEZAWA, N.; HINO, Т.; KINUNO, Т.; MATSUKI, Т.; IKED A, Т.; Synth Commun [SYNCAV] 1999, 29 (10), 1687-1695. YAMAZAKI, Т.; SAITO, S.; OHWAD A, Т.; SHUDO, K.; Tetrahedron Lett [TELEAY] 1995, 36 (32), 5749-5752. Patai, S.; Dayagi, S.; J Chem Soc [JCSOA9] 1958, 3058]. [Watanabe, Y.; Kadokura, M.; Mitsudo, Т.; J Chem Soc, Chem Commun [JCCCAT] 1986, 1539]. Дивіться, [наприклад, Brain E.G.; Doyle, F.P.; Hardy, К.; J Chem Soc [JCSOA9] 1962, 1445]. Схема 20 a. P-CH 3PhSO2CI (тозилхлорид), Еt 3N; з наступним ціануванням (KCN, NH4CI); потім НСl, МеОН; b. ціанування (KCN, NH 4Cl); потім НСl, МеОН; c. луг такий як NaH, галоген-СН2(СН2)mСН2галоген; d. КОН, МеОН потім НСl; Дивись, [наприклад, TATARINOVA, V.I.; VASIL'EV, A.A.; PETROSYAN, V.A.; Izv Akad Nauk SSSR, Ser Khim [IASKA6] 1990, (11), 2646-2648. TODO, Y.; TAKAGI, H.; UNO, F.; FUKUOKA, Y.; IKEDA, Y.; TANAKA, K.; SAIKAWA, I.; N ARITA, Η.; Chem Pharm Bull [CPBTAL] 1994,42 (10), 20492054. Jaouen, G.; Me yer, Α.; Simonneaux, G.; J Chem Soc, Chem Commun [JCCCAT] 1975,813. Ann Ν Υ Acad Sci [AN YAA9] 1977, 295, 59. Semmelhack, M.F.; Ann Ν Υ Acad Sci [AN YAA9] 1977, 295, 36]. Схема 21 [Takahashi, Y.; Nagai, H.; Yoneda, N.; Chem Lett [CMLTAG] 1985, 1733]. [Pohmakotr, M.; Phinyocheep, P.; Tetrahedron Lett [TELEAY] 1984, 25 (21), 2249. Trost, B. M.; Salzmann, T. N.; Hiroi, K.; J Am Chem Soc [JACSAT] 1976, 98, 4887. Bockmuhl, M.; Ehrhart, J.; Justus Liebigs Ann Chem [JLACBF] 1948, 561, 52]. Загальна процедура синтезу бічного ланцюга пшеридину (Cхема 1): Трет-бутил4-{[(трифторметил)сульфоніл]окси}3,6-дигідро-1(2Н)-піридинкарбоксилат: n-Бутиллітій (17,6мл, 44,2ммоль, 2,5Μ у гексанах) додали до розчину діізопропіламіну (96,2мл, 44,2ммоль) у безводному THF (40,0мл) при 0°С та отриману суміш перемішували протягом 20 хвилин. Реакційну суміш охолодили до -78°С та трет-бутип 4-оксо1-піперидинкарбоксилат (Aldrich Chemical Company, 40,0ммоль) у THF (40мл) додавали краплями до реакційної суміші, яку потім перемішували протягом 30 хвилин. Tf2NPh (42,0ммоль, 15,0г) у THF (40мл) додавали краплями у реакційну суміш та перемішували при 0°С протягом ночі. Реакційну суміш концентрували в умовах вакууму, знов розчинили у гексанах:EtOAc (9:1), пропустили крізь шар оксиду алюмінію та шар оксиду алюмінію промили гексанами:ЕtOАс (9:1). Об'єднані екстракти концентрували, внаслідок чого отримали 16,5г бажаного продукту, який був забруднений деякою кількістю початкового матеріалу Tf 2NPh. Трет-бутил 4-(3-амінофеніл)-3,6-дигідро-1 (2H)-піридинкарбоксилат: Дегазовану суміш 2Μ 37 79659 водного розчину Nа2СО3 (4,2мл), трет-буткл 4{[(трифторметил)сульфоніл]окси}-3,6-дигідро1(2Н)-піридинкарбоксилату (0,500г, 1,51ммоль), гемісульфату 3-амінофенілборонової кислоти (0,393г, 2,11ммоль), хлориду літію (0,191г, 4,50ммоль) та тетракіс-трифенілфосфінпаладію (0) (0,080г, 0,075ммоль) у диметоксіетані (5мл) нагрівали при температурі дефлегмації протягом 3 годин в інертній атмосфері. Органічний шар охолодженої реакційної суміші відокремили та водний шар промили (3´50мл). Об'єднані органічні розчини висушили та концентрували у вакуумі. Сирий продукт піддали хроматографії (силікагель, гексани:ЕtOАс:дихлорметан =6:1:1 з додаванням 1% ізопропіламіну), внаслідок чого отримали 0,330г бажаного продукту з 81% виходом. ESMS m/e: 275,2 (М+Н)+. Трет-бутил 4-[3-(аміно)феніл]-1піперидинкарбоксилат: Суміш 3,10г трет-бутил 4(3-амінофеніл)-3,6-дигідро-1(2Н)піридинкарбоксилату (11,3ммоль) та 1,0г 10% Pd/C у 200мл етанолу гідрували при кімнатній температурі, застосовуючи балонний спосіб, протягом 2 днів. Реакційну суміш профільтрували крізь Celite (броунмілерит) та промили етанолом. Об'єднані етанолові екстракти концентрували у вакуумі та залишок піддали хроматографії на силікагелі (дихлорметан:метанол:ізопропіламін =95:5:1), внаслідок чого отримали 2,63г бажаного продукту (84%): ESMS m/e: 277,2 (Μ+Н)+. Трет-бутил 4-[3-(ацетиламіно)феніл]-1піперидинкарбоксилат. До розчину 14,6г (52,6ммоль) трет-бутил 4-[3-(аміно)феніл]-1піперидинкарбоксилату та 14,7мл (105ммоль)триетиламіну у 120мл THF при 0°С повільно додавали 4,5мл (63,1ммоль) ацетилхлориду. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин та концентрували у вакуумі. Залишок розчинили у СН 2Сl2 та промили Н2О, а потім сольовим розчином. Органічний шар висушили над MgSO 4 та концентрували у вакуумі, внаслідок чого отримали 16,6г (52,1ммоль, 99%) бажаного продукту: 1H ЯМР (400МГц, CDCI3) δ 7,41-7,20 (м, 3Н), 6,94 (д, 1Н, J=7,5Гц), 4,21 (м, 2Н), 2,75 (м, 2Н), 2,62 (м, 1Н), 2,16 (с, 3Н), 1,78 (м, 2Н), 1,56 (м, 2Н), 1,48 (с, 9Н). N-[3-(4-піперидил)феніл]ацетамід: Розчин НСI у діоксані (4Ν, 5мл) додали у трет-бутил 4-[3(ацетиламіно)феніл]-1-піперидинкарбоксилат (660мг) у безводному дихлорметані (15мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі та концентрували у вакуумі, внаслідок чого отримали сіль НСI бажаного продукту (550мг):1Н ЯМР (400МГц, CDCI3) δ 2,02 (д, J=13,2Гц, 2Н), 2,11-2,45 (м, 5Н), 2,67-2,77 (м, 1Н), 3,00-3,10 (м, 2Н), 3,51 (д, J=10,5Гц, 2Н), 6,94 (д, J=7,5Гц, 1Н), 7,20-7,46 (м, 3Н), 7,60 (с, 1Н). Трет-бутил4-[3-(ізобутириламіно)феніл]-3,6дигідро-1(2Н)-піридинкарбоксилат: Розраховано для C20H28N2О3 +0,175 СНСI3: С, 66,33; Н, 7,77; N, 7,67. Знайдено: С, 66,20; Н, 7,41; N, 7,88; та третбутил 4-[3-(ізобутириламіно)феніл]-1піперидинкарбоксилат: ESMS m/e: 347,2 (Μ+Н)+. Ці проміжні продукти синтезували так, як продемонстровано вищезгаданими способами. 38 2-Метил-N-(4-піперидиніл)феніл]пропанамід: Крізь перемішуваний розчин 2,20г (6,50ммоль) трет-бутил 4-[3-(ізобутириламіно)феніл]-1піперидинкарбоксилату у 100мл 1,4-діоксану при 0°С барботували газоподібний НСI протягом 10 хвилин. Реакційну суміш залишили нагріватися до кімнатної температури та продовжили барботувати газоподібним НСI протягом 1 години. Розчинник видалили в умовах вакууму, залишок розчинили у 50мл води та підлужили до рН=13 шляхом додавання гранул КОН. Водний розчин екстрагували дихлорметаном (3´80мл). Об'єднаний органічний шар висушили (MgSО 4), профільтрували та концентрували у вакуумі. Залишок очистили шляхом колонкової хроматографії (силікагель, 9:1:0,1= дихлорметан:метанол:ізопропіламін), внаслідок чого отримали 0,700г (46% вихід) бажаного продукту: ESMS m/e: 247,2 (Μ+Н)+. Застосовуючи способи, описані вище, далі синтезували наступні проміжні продукти. Трет-бутил 4-[3-(пропіоніламіно)феніл]-1піперидинкарбоксилат: ESMS m/e: 333,4 (Μ+Н)+; N[3-(4-піперидиніл)феніл]пропанамід: ESMS m/e: 233,1 (Μ+Η)+. Трет-бутил 4-{3[(циклопропілкарбоніл)аміно]феніл}-1піперидинкарбоксилат: ESMS m/e: 345,5 (Μ+Н)+; Ν[3-(4-піперидиніл)феніл]циклопропанкарбоксамід: ESMS m/e: 245,0 (Μ+H)+; Ν-[3-(4піперидиніл)феніл]бутанамід: ESMS m/e: 247,3 (Μ+H)+; N,N-диметил-N'-[3-(4піперидиніл)феніл]сечовина: ESMS m/e: 248,2 (Μ+H)+; ізопропіл 3-(4-піперидиніл)фенілкарбамат: ESMS m/e: 263,4 (Μ+H)+; бензил 3-(4піперидиніл)фенілкарбамат: ESMS m/e: 311,3 + (Μ+Η) ; 2-метил-N-[4-(4піперидиніл)феніл]пропанамід: ESMS m/e: 247,1 (Μ+Η)+; N-[4-(4-піперидиніл)феніл]бутанамід: ESMS m/e: 247,2 (Μ+H)+. Загальна процедура синтезу 4арилпшеридинів (Схема 2) Трет-бутил 4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-3,6-дигідро-1(2Н)піридинкарбоксилат: У 50-мл круглодонну колбу, заповнену біс(пінаколато)дибороном (422мг, 1,66ммоль), КОАс (444мг, 4,53ммоль), PdCl2dppf (37,0мг, 3,00моль%) та dppf (25,0мг, 3,00моль%), додали розчин трет-бутип 4{[(трифторметил)сульфоніл]окси}-3,6-дигідро1(2Н)-піридинкарбоксилату (500мг, 1,51ммоль) у 1,4-діоксані (10,0мл) при кімнатній температурі в атмосфері аргону. Суміш нагрівали при 80°С протягом ночі. Після охолодження до кімнатної температури суміш профільтрували крізь Celite та Celite промили ЕtOАс (3´20мл). Фільтрати концентрували в умовах вакууму. Отриманий залишок розчинили у ЕtOАс та промили Н 2О та сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий продукт очистили шляхом флеш-хроматографії (1:9, ЕtOАс:гексан), внаслідок чого отримали трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)3,6-дигідро-1(2Н)-піридинкарбоксилат (355мг, 76%): 1Н ЯМР (400МГц, CDCI3) δ 6,60-6,34 (шир, 1Н), 4,06-3,86 (шир, 2Н), 3,55-3,34 (шир, 2Н), 2,35 39 79659 2,09 (шир, 2Н), 1,46 (с, 9Н), 1,26 (с, 12Н); ESMS m/e:310,4(M+H)+. Спосіб А (С хема 2) N-(3-Бром-4-метилфеніл)-2-метилпропанамід: У розчин 1,0г (5,40ммоль) 3-бром-4-метиланіліну та 0,91мл (6,50ммоль)триетиламіну у 10мл THF при 0°С повільно додавали 0,68мл (6,50ммоль) 2метилпропаноїлхлориду. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин та концентрували у вакуумі. Залишок розчинили у СН2СІ2 та промили Н 2О, а потім сольовим розчином. Органічний шар висушили над MgSO4 та концентрували у вакуумі, внаслідок чого отримали 1,37г (5,35ммоль, 99%) бажаного продукту: ESMS m/e: 255,9 (Μ+Н)+. Застосовуючи способи, описані вище, далі синтезували наступні проміжні продукти. N-(3-Бром-2-метилфеніл)-2-метилпропанамід: ESMS m/e: 255,9 (Μ+H)+. N-(6-Бром-2-піридиніл)-2-метилпропанамід: ESMS m/e: 242,8 (Μ+H)+. Трет-бутил 4-[5-(ізобутириламіно)-2метилфеніл]-3,6-дигідро-1(2Н)піридинкарбоксилат: У 50-мл круглодонну колбу, що містила трет-бутил 4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-3,6-дигідро-1(2Н)піридинкарбоксилат (500мг, 1,62ммоль), K2СО3 (670мг, 4,86ммоль) та PdCl2dppf (0,190ммоль, 155мг), додали розчин N-(3-бром-4-метилфеніл)-2метилпропанамщу (415мг, 1,62ммоль) у DMF (10,0мл) при кімнатній температурі в а тмосфері аргону. Суміш нагрівали до 80°С в атмосфері аргону протягом ночі. Після охолодження до кімнатної температури суміш профільтрували крізь Celite та Celite промили ЕtOАс (3´20мл). Фільтрати промили Н2О (20мл), сольовим розчином (20мл), висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш-хроматографії (20% EtOAc/гексан), внаслідок чого отримали трет-бутил 4-[5(ізобутириламіно)-2-метилфеніл]-3,6-дигідро1(2Н)-піридинкарбоксилат (360мг, 62%): ESMS m/e: 303,0 (М-56+Н)+. Трет-бутил 4-[5-(ізобутириламіно)-2метилфеніл]-1-піперидинкарбоксилат: Суміш третбутил 4-[5-(ізобутириламіно)-2-метилфеніл]-3,6дигідро-1(2Н)-піридинкарбоксилату (335мг, 0,93ммоль) та 10% Pd/C (35,0мг) у ЕtOН (20,0мл) гідрували при кімнатній температурі протягом ночі, застосовуючи балонний спосіб з воднем. Реакційну суміш профільтрували крізь Celite та промили етанолом (3´10мл). Об'єднані екстракти концентрували у вакуумі, внаслідок чого отримали третбутил 4-[5-(ізобутириламіно)-2-метилфеніл]-1піперидинкарбоксилат(335мг, 100%): ESMS m/e: 361,4 (Μ+Н)+. 2-Метил-n-метил-3-(4піперидиніл)феніл]пропанамід: У розчин третбутил 4-[5-(ізобутириламіно)-2-метилфеніл]-1піперидинкарбоксилату (335мг, 0,930ммоль) у СН2СІ2 (10,0мл) додали TFA (10,0мл) при кімнатній температурі. Реакційну суміш перемішували протягом 2 годин та концентрували у вакуумі. Залишок розчинили у 20мл СНСI3/i-РrOН (3:1) та підлужили 5% розчином KОН (10мл). Водний шар 40 екстрагували СНСI3/i-РrOН (3:1, 3´10,мл). Об'єднані органічні екстракти промили сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі, внаслідок чого отримали 2-метил-N-[4-метил-3-(4піперидиніл)феніл]пропанамід (190мг, 78%): ESMS m/e: 261,0 (Μ+Н)+. Застосовуючи способи, описані вище, далі синтезували наступні проміжні продукти. 2-Метил-N[2-метил-3-(4-піперидиніл)феніл]пропанамід: ESMS m/e: 261,3 (Μ+Η)+. 2-Метил-N-[6-(4піперидиніл)-2-піридиніл]пропанамід: ESMS m/e:248,l(M+H)+. Спосіб В (Схема 2) Трет-бутил 4-(2-метокси-5-нітрофеніл)-3,6дигідро-1(2Н)-піридинкарбоксилат: У 250-мл круглодонну колбу, що містила mpem-бутип 4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)-3,6-дигідро1(2Н)-тридинкарбоксилат (3,09г, 10,0ммоль), K2СО3 (4,14г, 30,0ммоль) та PdCl2dppf (419мг), додали розчин 2-бром-4-нітроанізолу (2,30г, 10ммоль) у DMF (10,0мл) при кімнатній температурі в атмосфері аргону. С уміш нагрівали до 80°С в атмосфері аргону протягом ночі. Після охолодження до кімнатної температури, воду (500мл) додали до суміші. Водний шар екстрагували EtOAc (2´200мл) та об'єднані органічні екстракти висушили над K2СО3, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш-хроматографії (20% ЕtOАс/гексан), внаслідок чого отримали трет-бутил 4-(2-метокси-5нітрофеніл)-3,6-дигідро-1(2Н)-піридинкарбоксилат (1,51г, 46%): ESMS m/e: 334,9 (М+Н)+. Трет-бутил4-[5-аміно-2-метоксифеніл]-1піперидинкарбоксилат: Розчин трет-бутил4-(2метокси-5-нітрофеніл)-3,6-дигідро-1(2Н)піридинкарбоксилату (1,30г, 3,90ммоль) та 10% Pd/C (200,0мг) у МеОН:ЕtOАс (1:4, 100мл) гідрували при кімнатній температурі протягом 72 годин, застосовуючи балонний спосіб з воднем. Реакційну суміш профільтрували крізь Celite та промили (3´100мл). Об'єднані органічні фільтрати концентрували у вакуумі, внаслідок чого отримали третбутил 4-[5-аміно-2-метоксифеніл]-1піперидинкарбоксилат (1,00г, 84%): ESMS m/e: 307,2 (Μ+Н)+. Трет-бутил 4-[5-(ізобутириламіно)-2метоксифеніл]-1-піперидинкарбоксилат: 1Н ЯМР (400МГц, CDCI3) δ 7,39 (ад, 1Н, J=8,8, 2,8Гц), 7,25 (шир, 1Н), 6,80 (д, 1Н, J=8,4Гц), 4,23 (шир, 2Н), 3,80 (с, 3Н), 3,07 (тт, 1Н, J=11,8, 4,1Гц), 2,89-2,73 (м, 2Н), 2,49 (септет, 1Н, J=6,7Гц), 1,77 (д, 2Н, J=11,6Гц), 1,64-1,52 (м, 3Н), 1,48 (с, 9Н), 1,25 (д, 6Н, J=6,8Гц). Застосовуючи способи, описані вище, синтезували наступні проміжні продукти. N-[4-метокси-3-(4-піперидиніл)феніл]-2метилпропанамід: ESMS m/e: 277,2 (Μ+Н)+. N-[4фтор-3-(4-піперидиніл)феніл]-2-метилпропанамід: ESMS m/e: 265,2 (Μ+Η)+. N-[2-фтор-5-(4піперидиніл)феніл]-2-метилпропанамід: ESMS m/e: 265,4 (Μ+Η)+. N-[4-фтор-3-(4піперидиніл)феніл]бутанамід: ESMS m/e: 265,2 (Μ+Η)+. N-[2-фтор-5-(4піперидиніл)феніл]бутанамід: ESMS m/e: 265,4 41 79659 (Μ+H)+. N-[4-метокси-3-(4піперидиніл)феніл]бутанамід: 1H ЯМР (400МГц, CD3OD) δ 7,34 (дд, 1Η, J=8,1, 3,3Гц), 7,25 (д, 1Н, J=3,3Гц), 6,82 (д, 1Н, J=8,1Гц), 3,76 (с, 3Н), 3,102,92 (м, 4Н), 2,66 (дт, 2Н, J=12,6,2,6Гц), 2,64-2,56 (м, 1Н), 2,27 (т, 2Н, J=7,4Гц), 1,76-1,44 (м, 6Н), 0,95 (т, 3Н, J=7,4Гц). N-[2-ГІДРОКСИ-5-(4-ПІПЕРИДИНІЛ)ФЕНІЛ]-2МЕТИЛПРОПАН АМІД: Приготували за процедурою для ІУ-[4-метокси-3-(4-піперидиніл)феніл]-2метилпропанаміду, застосовуючи трет-бутилп 4(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-3,6дигідро-1(2//)-піридинкарбоксилат та 4-бром-2нітрофенол, ацилюючи ізобутирилхлоридом: ESMS m/e: 263,4 (М+Н)+. Загальні процедури синтезу N-(nаміноалкілпіперидину (Схема 3) Спосіб А (С хема 3) Трет-бутил 3-бромпропілкарбамат: Розчин 3бромпропіламіну гідроброміду (10,9г, 49,8ммоль), ВОС2О (11,4г, 52,3ммоль) та K2СО3 (20,6г, 149,4ммоль) в етанолі (100мл) перемішували при кімнатній температурі протягом ночі. Осаджені солі видалили шляхом фільтрування та фільтрат концентрували у вакуумі. Залишок розчинили у дихлорметані та промили водою, а потім сольовим розчином. Органічний шар висушили над MgSO4 та концентрували у вакуумі, внаслідок чого отримали 11,2г (46,9ммоль, 94%) бажаного продукту: 1 H ЯМР (400МГц, CDCI3) δ 5,07 (шир, 1Н), 3,31 (т, 2Η, J=6,6Гц), 3,12 (очевидний шир к, 2Н, J=6,0Гц), 1,92 (квінтет, 2Н, J=6,6Гц), 1,30 (с, 9Н). Трет-бутиил-{4-[3-(ацетиламіно)феніл]-1піперидиніл}пропілкарбамат: Суміш N-[3-(4піперидил)феніл]ацетаміду (550мг, 2,1ммоль), трет-бутиил 3-бромпропілкарбамату (550мг, 2,3ммоль), K2СО3 (1,10г, 8,9ммоль), діізопропілетиламіну (1,50мл) та декількох кристалів ΚΙ у діоксані (20мл) нагрівали при температурі дефлегмації протягом 2 днів. Осаджені солі видалили шляхом фільтрування, фільтрат концентрували у вакуумі та сирий продукт піддали хроматографії на силікагелі, внаслідок чого отримали бажаний продукт (340мг; 43%): ESMS m/e: 376,2 (Μ+Н)+. N-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}ацетамід:Трифтороцтову кислоту (1,0мл) додали до розчину трет-бутил 3-{4-[3(ацетиламіно)феніл]-1піперидиніл}пропілкарбамату (340мг) у безводному дихлорметані (10мл) та реакційну суміш перемішували при кімнатній температурі протягом 5 годин. Реакційну суміш підлужили до рН12 шляхом додавання 10% водного розчину КОН, а потім видалили дихлорметан у вакуумі. Водний шар заморозили та ліофілізували, внаслідок чого отримали тверду речовину, яку екстрагували метанолом. Внаслідок видалення розчинника отримали бажаний продукт (120мг) у вигляді олії: 1Н ЯМР (400МГц, CDCI3) δ 7,48 (м, 1Н), 7,38 (д, 1Н, J=7,7Гц), 7,24 (т, 1Η, J=7,7Гц), 6,99 (д, 1Н, J=7,7Гц), 3,11 (д, 2Н, J=11,6Гц),2,84 (т, 2Н, J=6,6Гц), 2,59-2,52 (м, 1Н), 2,50 (т, 2Н, J=6,6Гц), 2,18-2,09 (м, 2Н), 2,13 (с, 3Н), 1,90-1,72 (м,6Н). Застосовуючи способи, описані вище, синтезували наступні додаткові проміжні продукти. 42 N-{3-[1-амінопропіл)-4тперидиніл]феніл}бутанамід. ESMS m/e: 304,3 (М+Н)+. N-{3-[1-(3-амінопропіл)-4-піперидиніл]-4метилфеніл}-2-метилпропанамід. ESMS m/e: 318,3 (М+Н)+. N-{3-[1-(3-амінопропіл)-4-піперидиніл]-4фтор феніл}-2-метилпропанамід. ESMS m/e: 322,4 (Μ+Н)+. N-{6-[1-(3-амінопропіл)-4-піперидиніл]-2піридиніл}-2-метилпропанамід. ESMS m/e: 305,2 (Μ+Н)+. N-{5-[1-(3-амінопропіл)-4-піперидиніл]-2фтор феніл}-2-метилпропанамід. ESMS m/e: 322,4 (Μ+Н)+. ІУ-{5-[1-(3-амінопропіл)-4-піперидиніл]-2фтор феніл}бутанамід. ESMS m/e: 322,3 (Μ+Η)+. Спосіб В (Схема 3) Етап 1: Суміш піперидину 1 (1,00екв., 0,0226ммоль), N-(n-бромалкіл)фталіміду (1,50екв., 0,0338ммоль), Вu4NI (200мг) та діізопропілетиламіну (5,00екв., 0,113ммоль) у діоксані (200мл) нагрівали при 99°С протягом 24 годин. За реакцією спостерігали, використовуючи аналіз ТШХ (95:5, СН2Сl2:метанол). За необхідністю додаткові 0,0113ммоль відповідного бромалкілфталіміду додавали до реакційної суміші та продовжували нагрівати протягом іще 48 годин. Реакційну суміш охолодили до кімнатної температури, солі амонію відфільтрували та розчинник видалили в умовах зниженого тиску. Сирий продукт піддали хроматографії (силікагель), внаслідок чого отримали бажаний Ν-(n-фталімідалкіл)піперидин 2. Етап 2: Зняття захисту з N-(nфталімідалкіл)піперидину з етапу 1 виконували шляхом нагрівання розчину фталімід-захищеного аміну 2 з надлишком гідрату гідразину (10екв.) в етанолі (0,5-1,0М) при 90°С протягом 4 годин. За реакційною сумішшю спостерігали до закінчення реакції за допомогою ТШХ. Після завершення реакції суміш охолодили до кімнатної температури, нерозчинні побічні продукти видалили шляхом фільтрування крізь Celite та фільтрат концентрували у вакуумі. Сирий продукт піддали хроматографії (дихлорметан-метанол-ізопропіламін), внаслідок чого отримали бажаний N-(nаміноалкіл)піперидин 3. Застосовуючи способи, описані вище, синтезували наступні додаткові проміжні продукти. N-(3-{1-[2-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2іл)етил]-4-піперидиніл}феніл)-2-метилпропанамід. ESMS m/e: 420,2 (М+Н)+. N-(3-{1-[3-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2іл)пропіл]-4-піперидиніл}феніл)-2метилпропанамід: ESMS m/e: 434,4 (Μ+Н)+. N-(3-{1-[4-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2іл)бутил]-4-піперидиніл}феніл)-2-метилпропанамід: ESMS m/e: 448,4 (Μ+Н)+. N-(3-{1-[5-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2іл)пентил]-4-піперидиніл}феніл)-2метилпропанамід: ESMS m/e: 462,4 (Μ+Н)+. N-(3-{1-[6-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-2іл)гексил]-4-піперидиніл}феніл)-2метилпропанамід: ESMS m/e: 476,4 (Μ+H)+. Ν-{3-[1-(2-аміноетил)-4-піперидиніл]феніл}-2метилпропанамід: Приготували згідно з Етапом 2 Способу В (Схема 3), застосовуючи N-(3-{1-[2-(1,3діоксо-1,3-дигідро-2Н-ізоіндол-2-іл)етил]-4піперидиніл}феніл)-2-метилпропанамід та гідрат гідразину; ESMS m/e: 290,2 (Μ+Н)+. 43 79659 Застосовуючи способи, описані вище, синтезували наступні додаткові проміжні продукти. N-{3-[1-(3-амінопропіл)-4-піперидиніл]феніл}-2метилпропанамід: ESMS m/e: 304,1 (Μ+Н)+. N-{3[1-(4-амінобутил)-4-піперидиніл]феніл}-2метилпропанамід: ESMS m/e: 318,2 (Μ+Н)+. N-{3[1-(5-амінопентіл)-4-піперидиніл]феніл}-2метилпропанамід: ESMS m/e: 332,2 (Μ+Н)+. Ν-{3[1-(6-аміногексил)-4-піперидиніл]феніл}-2метилпропанамід: ESMS m/e: 346,3 (Μ+H)+. N-{3[1-(3-амінопрогал)-4піперидиніл]феніл)пропанамід: 1H ЯМР (400МГц, CDCI3) δ 7,37-7,29 (м, 2Η), 7,14 (т, 1Н, J=7,9Гц), 6,90 (д, 1H, J=7,9Гц), 3,27 (с, 2H), 3,06-2,97 (м, 2Н), 2,63 (т, 2Н, J=6,8Гц), 2,50-2,26 (м, 6Н), 2,04 (дт, 2Н, J=12,1, 2,7Гц), 1,81 (м, 3Н), 1,80-1,60 (м, 6Н).Л^-{3[1-(3-амінопропіл)-4піперидиніл]феніл}циклопропанкарбоксамід: ESMS m/e: 302,3 (Μ+Η)+. Ν-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-2,2-диметилпропанамід: ESMS m/e: 318,3 (Μ+Η)+. ^-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-3-метилбутанамід: ESMS m/e: 318,3 (Μ+Η)+. N-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-3,3-диметилбутанамід: ESMS m/e: 332,3 (Μ+Η)+. Застосовуючи способи, описані вище, синтезували наступні додаткові проміжні продукти. N'-{3-[1-(3-амінопропіл)-4-піперидиніл]феніл}N,N-диметилсечовина: 1H ЯМР (400МГц, CD3OD) δ 7,36 (с, 1Н), 7,32-7,25 (м 1Н), 7,21 (т, 1H, J=7,9Гц), 6,92 (д, 1H, J=7Гц), 3,33 (с, 6H), 3,17-3,07 (м, 2Н), 2,75 (т, 2Η, J=6,9), 2,58-2,44 (м, 3Н), 2,14 (дт, 2Н, J=11,8, 2,7Гц), 1,93-1,67 (м, 8Н). Iзопропіл 3-[1-(31 амінопропіл)-4-піперидиніл]фенілкарбамат: Η ЯМР (400МГц, CDCI3) δ 7,20 (шир с, 1Н), 7,16 (д, 1Н, J=5,3Гц), 7,08 (т, 1Η, J=8,3Гц), 6,80 (д, 1Н, J=7,4Гц), 4,89-4,79 (м, 1H), 3,21 (квінтет, 1Η, J=1,6Гц), 3,03-2,95 (м, 2Н), 2,61 (т, 2Η, 6,8Гц), 2,462,31 (м, 3Н), 2,01 (дт, 2Н, J=11,7, 2,8Гц), 1,78-1,57 (м, 7Н), 1,19 (д, 6Н, J=6,2Гц). бензил 3-[1-(31 амінопропіл)-4-піперидиніл]фенілкарбамат: H ЯМР (400МГц, CDCI3) δ 7,60-7,30 (м, 9Н), 7,08 (дт, 1Н, J=7,5, 1,4Гц), 5,34 (с, 2Н), 4,09 (квінтет, 1Н, J=5,7Гц), 3,30-3,10 (м, 4Н), 2,65 (т, 2Н, J=7,8Гц), 2,28 (дт, 2Н, J=12, 1,4Гц), 2,07-1,85 (м, 7Н). N-{3-[1(3-амінопропіл)-4-піперидиніл]-4-метоксифеніл}-2метилпропанамід: ESMS m/e: 334,6 (Μ+Н)+. N-{3[1-(3-амінопропіл)-4-піперидиніл]-4метоксифеніл}бутанамід: 1H ЯМР (400МГц, CD3OD) δ 7,46-7,57 (м, 1Η), 6,97 (с, 1Н), 6,77 (д, 1Н, J=8,8Гц), 3,88-3,80 (м, 2Н), 3,78 (с, 3Н), 3,122,74 (с, 4Н), 2,46 (т, 2Н, J=6,6Гц), 2,39 (т, 2Н, J=7,3Гц), 2,07-1,94 (м, 2Н), 1,87-1,44 (м, 9Н), 1,02 (т, 3Н, J=7,4Гц). N-{5-[1-(3-амінопропіл)-4піперидиніл]-2-гідроксифеніл)-2-метилпропанамід: 1 H ЯМР (400МГц, CD3OD) δ 8,12-8,08 (м, 1Н), 7,707,66 (м, 2Н), 7,44 (д, 1Н, J=2,2Гц), 2,79-2,55 (м, 3Н), 2,39-2,28 (м, 3Н), 2,26 (д, 2Н, J=11,6Гц), 1,98 (дт, 2Н, J= 12, 2,5Гц), 1,74-1,53 (м, 6Н), 1,11 (д, 6Н, J=6,8Гц). Загальна процедура для Схеми 4 Етап І N-(3-1[(3R)-3-гідрокси-3-фенілпротл]-4піперидиніл}феніл)-2-метилпропанамід: У 25-мл круглодонну колбу додали (R)-(+)-3-хлор-1-феніл 44 1-пропанол (0,545г, 3,19ммоль, 99% ее, Aldrich Chemical Co.), 2-метил-N-[3-(4піперидиніл)феніл]пропанамід (0,748г, 3,04ммоль), карбонат калію (0,420г, 3,04ммоль), йодид натрію (0,684г, 4,56ммоль) та DMF (6,0мл) при кімнатній температурі. Після перемішування при 100°С протягом 3 годин ТШХ показала, що реакція завершилася. Реакційну суміш охолодили до кімнатної температури та вилили її у воду (50мл) та водний шар екстрагували метиленхлоридом (3´20мл). Об'єднані органічні екстракти промили сольовим розчином (20мл), висушили над Na2SO4 та концентрували в умовах зниженого тиску. Залишок очистили шляхом флеш-хроматографії (1:1 = гексан:етилацетат з 1% ізопропіламіном), внаслідок чого отримали бажаний продукт (1,09г, 94% вихід) у вигляді світло-жовтої твердої речовини: 1Н ЯМР (400МГц, CDCI3) δ 8,10 (с, 1Н), 7,46-7,35 (м, 6Н), 7,27 (м, 2Н), 6,98 (очевидний д, 1Н, J=7,6Гц), 5,02 (очевидний дд, 1Н, J=4,4, 8,1Гц), 3,18 (очевидний дд, 2Н, J=2,5, 12,5Гц), 2,74 (м, 2Н), 2,50 (м, 2Н), 2,30-2,10 (м, 6Н), 1,80 (м, 2Н), 1,25 (д, 6Н, J=7,1Гц); ESMS m/e: 381,2 (М+Н)+. Етап 2: Дивись загальні умови сполучання на Схемах 8-10. Загальна процедура для Схеми 5 Етап 1: 2-[(15)-3-Хлор-1-фенілпропіл]-1H-ізоіндол1,3(2H)-діон: Приготували згідно з загальною процедурою, [описаною у Srebnik, Μ.; Ramachandran, P.V.; Brown, H.C. J. Org. Chem. 1988, 53, 29162920]. Суміш фталіміду (0,147г, 1,0ммоль), (R)-(+)3-хлор-1-феніл-1-пропанолу (0,171г, 1,0ммоль), трифенілфосфіну (0,262г, 1,0ммоль) та діетилазодікарбоксилату (0,174г, 1,0ммоль) у 5,0мл THF перемішували при кімнатній температурі протягом 24 годин. Реакційну суміш концентрували у вакуумі. Залишок промили пентаном (3´50мл) та об'єднані пентанові екстракти концентрували та піддали хроматографії (силікагель, гексани:ЕtOАс = 8:1 як елюент), внаслідок чого отримали бажаний продукт (0,121г, 50%) у вигляді жовтої твердої речовини: 1H ЯМР (400МГц, CDCI3) δ 7,82 (очевидний дд, 2Н, J=2,9Гц), 7,70 (очевидний дд, 2Н, J=2,9Гц), 7,56 (м, 2Н), 7,39-7,27 (м, 3Н), 5,64 (очевидний дд, 1Н, J=7,0, 9,2Гц), 3,57 (м, 2Н), 3,05 (м, 1Н), 2,82 (септет, 1Н, J=7,0Гц); ESMS m/e: 300,1 (Μ+H)+. Етап 2: N-(3-{1-[(3S)-3-(1,3-діоксо-1,3-дигідро-2Нізоіндол-2-іл)-3-фенілпропіл]-4-піперидиніл}феніл)2-метилпропанамід: Суміш карбонату калію (29,2мг, 0,211ммоль), йодиду натрію (47,5мг, 0,317ммоль), 2-метил-N-[3-(4піперидиніл)феніл]пропанаміду (51,8мг, 0,211ммоль) та 2-[(1S)-3-хлор-1-фенілпропіл]-1Hізоіндол-1,3(2H)-діону (63,1мг, 0,211ммоль) у DMF (5,0мл) перемішували при 100°С протягом 3 годин, після чого ТШХ вказала на те, що реакція завершилася. Реакційну суміш охолодили до кімнатної температури, вилили у воду (50мл) та водний шар екстрагували метиленхлоридом (3´30мл). Об'єднані органічні екстракти промили сольовим розчином (30мл), висушили над MgSO 4 та концентрували в умовах зниженого тиску. Сирий продукт очистили шляхом препаративної ТШХ [2,5% NH3 45 79659 (2,0Μ у метанолі) у СНСІ3], внаслідок чого отримали бажаний продукт (74,1мг, 77%) у вигляді густої олії: 1H ЯМР (400МГц, CDCI3); δ 7,83 (очевидний дд, 2Н, J=2,9Гц), 7,69 (очевидний дд, 2Н, J=2,9Гц), 7,56 (очевидний дт, 3Н, J=2,9, 7,3Гц), 7,33 (м, 4Н), 7,21 (т, 1Н, J=7,8Гц), 7,09 (с, 1Н), 6,81 (очевидний д, 1H, J=7,8Гц), 5,49 (очевидний дд, 1Н, J=5,5, 9,5Гц), 2,98 (д, 1Н, J=9,5Гц), 2,87 (м, 2Н), 2,50 (септет, 1Н, J=6,7Гц), 2,40-2,35 (м, 4Н), 1,94 (м, 2Н), 1,70-1,50 (м, 4Н), 1,25 (д, 6Н, J=7,9Гц); ESMS m/e: 510,4 (М+Н)+. Схема 3: Дивись Схему 3/Спосіб В для загальних умов зняття захисту. Схема 4: Дивись загальні умови сполучання на Схемах 8-10. Загальна процедура для Схеми 6 Біс(4-фторфеніл)оцтова кислота. Фторбензол (13,6г, 0,142моль) та гліоксилової кислота моногідрат (2,35г, 0,0255моль) розчинили у теплій оцтовій кислоті (30,0мл). Суміш охолодили на льодяній/водній бані та додавали краплями концентровану сірчану кислоту (20,0мл) протягом 0,5 години. Отриману густу червону суспензію перемішували при 80°С протягом 12 годин, а потім охолодили до кімнатної температури. Воду (300мл) додали та рН довели до 3, додавши гранули гідроксиду калію та 10% розчин КОН. Водний розчин екстрагували етилацетатом (3´100мл), а об'єднані органічні екстракти промили сольовим розчином (100мл) та висушили над сульфатом натрію, профільтрували та концентрували у вакуумі, внаслідок чого отримали бажаний продукт (5,18г, 82%) у вигляді червоної твердої речовини, яку застосовували на наступному етапі без подальшого очищення: 1Н ЯМР (400МГц, CD3OD) δ 9,45 (шир с, 1Н), 7,31-7,25 (м, 4H), 7,06-7,0 (м, 4Н), 5,01 (с, 1Н). Загальна процедура для Схеми 7 Біс(4-метилфеніл)оцтова кислота. У 250-мл круглодонну колбу додали 4,4'-диметилбензгідрол (1,06г, 5,00ммоль) та 97% сірчану кислоту (44,0мл). Суміш охолодили до 15°С на льодяній/водяній бані та мурашину кислоту (12,0мл) додавали краплями через додаткову лійку протягом 0,5 години. Отриманий пінний розчин перемішували при 15°С протягом 2 годин. Додали (300мл) воду та рН довели до 3 шляхом додавання гранул гідроксиду калію та 10% розчину КОН. Водний розчин екстрагували етилацетатом (3´100мл), а об'єднані органічні екстракти промили сольовим розчином (100мл) та висушили над сульфатом натрію, профільтрували та концентрували у вакуумі, внаслідок чого отримали бажаний продукт (0,281г, 26%) у вигляді блідо-жовтої твердої речовини, яку застосовували на наступному етапі без подальшого очищення: 1Н ЯМР (400МГц, CD3OD) δ 7,28-6,99 (м, 8Н), 6,96 (шир с, 1Н), 4,94 (с,1Н), 2,29 (с,6Н). Загальна процедура для Схеми 8 N-[3-(1-{3-[(дифенілацетил)аміно]пропіл}-4піперидиніл)феніл]-2-метилпр0панамід. Суміш 2,2дифенілацетилхлориду (0,300ммоль, 69,2мг), N-{3[1-(3-амінопропіл)-4-піперидиніл]феніл}-2метилпропанаміду (0,250ммоль, 75,8мг) та триетиламіну (0,500ммоль, 50,5мг) розчинили у THF 46 (2,00мл) та суміш збовтували на шейкері Orbital JKEM при кімнатній температурі протягом 12 годин. Реакційну суміш концентрували у вакуумі, а залишок очистили шляхом препаративної ТШХ [силікагель, СН2Сl2:аміак (2,0Μ у метанолі) 100:5], внаслідок чого отримали бажаний продукт (83,3мг, 62% вихід): 1H ЯМР (400МГц, CDCI3) δ 7,51 (с, 1Н), 7,33-7,21 (м, 13Н), 6,94 (м, 2Н), 4,88 (с, 1Н), 3,39 (т, 2Н, J=5,6Гц), 2,93 (д, 2Н, J=11,3Гц), 2,52-2,36 (м, 4Н), 1,97 (т, 2Η, J=11,3Гц), 1,83-1,58 (м, 6Н), 1,24 (д, 6Н, J=7,6Гц); Розраховано для C32H39N3 O2+HCl+0,19CHCl3: С, 69,44; Н, 7,27; N, 7,55. Знайдено: С, 69,44; Н, 7,43; N, 7,43; ESMS m/е: 498,4 (М+Н)+. Загальна процедура для Схеми 9 N-(3-{4-[3-(ізобутириламіно)феніл]-1пвперидиніл}пропіл)-2,2-дифенілпропанамід. Суміш 2,2-дифенілпропіонової кислоти (0,200ммоль, 45,2мг), N-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-2-метилпропанаміду (0,200ммоль, 60,7мг), 1-[3-(диметиламіно)пропіл]3-етилкарбодііміду (EDC, 0,400ммоль, 62,0мг) та 4диметиламінопіридину (5,00мг) розчинили у CH2Cl2/DMF (1,00/0,100мл) та суміш збовтували на шейкері Orbital J-KEM при кімнатній температурі протягом 12 годин. Реакційну суміш концентрували у вакуумі, очистили шля хом препаративної ТШХ [силікагель, СН2Сl2:аміак (2,0Μ у метанолі) 100:5], внаслідок чого отримали бажаний продукт (43,8мг, 42% вихід): 1H ЯМР (400МГц, CDCI3) δ 7,50-7,43 (шир, 1Н), 7,43-7,39 (шир, 1Н), 7,39-7,18 (м, 12Н), 6,89 (д, 1Н, J=7,7Гц), 6,23 (шир, 1Н), 3,423,32 (м, 2Н), 2,85 (д, 2Н, J=10,8Гц), 2,50 (квінтет, 1Н, J=7,4Гц), 2,45-2,36 (м, 1Н), 2,28 (т, 2Н, J=6,4Гц), 1,99 (с, 3Н), 1,96-1,82 (м, 2Н), 1,78-1,60 (м, 4Н), 1,60-1,47 (м, 2Н), 1,23 (д, 6Н, J=7,0Гц); ESMS m/e: 512,4 (Μ+Н)+. Загальна процедура для Схеми 10 Бібліотеку амідів побудували у поліпропіленових 48-лункових планшетах "Reactor Blocks", Robbins. Полістирол-карбодіімідну смолу (PS-CDI) (300мг, 2,00екв., придбану у Argonaut Technologies) розташували у кожній лунці 48лункового планшета "Reactor Blocks". До кожної линки додали амін (0,200ммоль) та карбонову кислоту (0,22ммоль) у 3,00мл СН2Сl2 та DMF (10:1). Reactor Blocks герметично закрили та обертали у печі Robbins (FlexChem) при кімнатній температурі протягом 12 годин. Розчини профільтрували паралельно у приймальні планшети Robbins та смолу промили СН 2Сl2 (2,0мл) та МеОН (1,0мл). Фільтрат та змиви концентрували в умовах зниженого тиску, внаслідок чого отримали бажаний продукт, який проаналізували шляхом 1H Я МР та ESMS. 2-(4-Хлорфеніл)-2-метил-N-(3-{4-[3(пропіоніламіно)феніл-1піперидиніл}пропіл)пропанамід: Приготовили згідно з загальною процедурою, вказаною на Схемі 10, застосовуючи 2-(4-хлорфеніл)-2метилпропанову кислоту та N-{3-[1-(3амінопропіл)-4-піперидиніл]феніл}пропанамід: 1Н ЯМР (400МГц, CDCI3) δ 7,86 (с, 1Н), 7,50 (с, 1Н), 7,34-7,19 (м, 6Н), 6,96 (д, 1Н, J=7,8Гц), 6,72-6,67 (м, 1Н), 3,42 (к, 2Н, J=7,1Гц), 3,31 (к, 3Н, J=5,4Гц), 2,49-2,35 (м, 5Н), 2,08-1,95 (м, 2Н), 1,82-1,74 (м, 47 79659 2Н), 1,71-1,62 (м, 3Н), 1,56 (с, 6Н), 1,24 (т, 3Н, J=7,8Гц); ESMS m/e: 470,3 (М+Н)+. Загальна процедура для Схеми 11 (4S)-3-[(4-фторфеніл)ацетил]-4-ізопротл-1,3оксазолідин-2-он: У розчин (4S)-4-ізопропіл-1,3оксазолідин-2-ону (2,0г, 15,5ммоль) у безводному THF (20мл) при -78°С в атмосфері аргону додали краплями 2,5Μ розчин n-BuLi у гексанах (6,2мл, 15,5ммоль). Після перемішування при -78°С протягом 15 хвилин, додали (4фтор феніл)ацетилхлорид (2,55мл, 18,6ммоль). Отриману реакційну суміш перемішували при 78°С протягом 30 хвилин та при 0°С протягом 15 хвилин, загасили насиченою NH4CI (5мл) та концентрували у вакуумі. Залишок розчинили у EtOAc (100мл) та промили насиченим Nа2СО3, а потім сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш-хроматографії (10%-15% ЕtOАс/гексан), внаслідок чого отримали 2,83г (10,7ммоль, 69%) (4S)-3-[(4фтор феніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону: 1H Я МР (400МГц, CDCI3) δ 7,30-7,25 (м, 2Н), 7,10 (т, 2Η, J=8,5Гц), 4,46-4,41 (м, 1Η), 4,36-4,15 (м, 4H), 2,40-2,28 (м, 1Н), 0,88 (д, 3Н, J=7,6Гц), 0,79 (д, 3Н, J=7,6Гц); ESMS m/e: 266,2 (Μ+Н)+. (4S)-3-[(4-хлорфеніл)ацетил]-4-ізопропіл-1,3оксазолідин-2-он: У розчин (4S)-4-ізопропіл-1,3оксазолідин-2-ону (2,0г, 15,5ммоль) у безводному THF (20мл) при -78°С в атмосфері аргону додали краплями 2,5М розчин n-BuLi у гексанах (6,2мл, 15,5ммоль). Після перемішування при -78°С протягом 15 хвилин додали (4хлорфеніл)ацетилхлорид (2,70мл, 21,8ммоль). Отриману реакційну суміш перемішували при 78°С протягом 30 хвилин, а потім при 0°С протягом 15 хвилин, загасили насиченим NH4CI (5мл) та концентрували у вакуумі. Залишок розчинили у ЕtOАс (100мл) та промили насиченим Na2CO3, а потім сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флешхроматографії (10%-15% ЕtOАс/гексан), внаслідок чого отримали 2,33г (8,29ммоль, 53%) (4S)-3-[(4хлорфеніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону: 1H Я МР (400МГц, CDCI3) δ 7,31-7,22 (м, 4Η), 4,45-4,41 (м, 1Н), 4,35-4,16 (м, 4Н), 2,39-2,29 (м, 1Н), 0,89 (д, 3Н, J=7,2Гц), 0,80 (д, 3Н, J=7,2Гц); ESMS m/e: 282,2 (Μ+Н)+. (4R)-3-[(4-фтopфeнiл)aцeтил]-4-iзoпpoпiл-l,3oкcaзoлiдин-2-oн: У розчин (4R)-4-ізопропіл-1,3оксазолідин-2-ону (5,2г, 40,3ммоль) у безводному THF (100мл) при -78°С в атмосфері аргону додали краплями 2,5М розчин n-BuLi у гексанах (17,0мл, 42,5ммоль). Після перемішування при -78°С протягом 15 хвилин додали (4хлорфеніл)ацетилхлорид (6,34мл, 46,4ммоль). Отриману реакційну суміш перемішували при 78°С протягом 30 хвилин, а потім при 0°С протягом 15 хвилин, загасили насиченим NH4CI (15мл) та концентрували у вакуумі. Залишок розчинили у EtOAc (200мл) та промили насиченим Nа2СО3, а потім сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш 48 хроматографії (10%-15% ЕtOАс/гексан), внаслідок чого отримали 8,35г (31,5ммоль, 78%) (4R)-3-[(4фтор феніл) ацетил]-4-ізопропіл-1,3-оксазолідин-2ону: 1H Я МР (400МГц, CDCl3) δ 7,30-7,25 (м, 2Н), 7,10 (т, 2Η, J=8,5Гц), 4,46-4,41 (м, 1Н), 4,36-4,15 (м, 4Н), 2,40-2,28 (м, 1Н), 0,88 (д, 3Н, J=7,6Гц), 0,79 (д, 3Н, J=7,6Гц); ESMS m/e: 266,1 (М+Н)+. (4R)-3-[(4-xлopфeнiл)aцeτил]-4-iзoпpoпiл-1,3oкcaзoлiдин-2-oн: У розчин (4R)-4-ізопропіл-1,3оксазолідин-2-ону (5,3г, 41,1ммоль) у безводному THF (100мл) при -78°С в атмосфері аргону додавали краплями 2,5М розчин n-BuLi у гексанах (17,0мл, 42,5ммоль). Після перемішування при 78°С протягом 15 хвилин додали (4хлорфеніл)ацетилхлорид (2,70мл, 21,8ммоль). Отриману реакційну суміш перемішували при 78°С протягом 30 хвилин, а потім при 0°С протягом 15 хвилин, загасили насиченим NH4CI (5мл) та концентрували у вакуумі. Залишок розчинили у ЕtOАс (200мл) та промили насиченим Na2СО3, а потім сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флешхроматографії (10%-15% ЕtOАс/гексан), внаслідок чого отримали 6,48г (23,1ммоль, 56%) (4R)-3-[(4хлорфеніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону: 1H Я МР (400МГц, CDCl3) δ 7,31-7,22 (м, 4Н), 4,45-4,41 (м, 1Н), 4,35-4,16 (м, 4Н), 2,39-2,29 (м, 1Н), 0,89 (д, 3Н, J=7,2Гц), 0,80 (д, 3Н, J=7,2Гц); ESMS m/e: 282,1 (Μ+Н)+. (4S)-3-[(2S)-2-(4-фторфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-он: У розчин (4S)-3-[(4фтор феніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону (2,81г, 10,6ммоль) у безводному THF (40мл) при -78°С в атмосфері аргону додавали краплями 1,0М розчин NaHMDS у THF (11,7мл, 11,7ммоль) протягом періоду у 10 хвилин. Після перемішування при -78°С протягом 1 години додали МеІ (3,30мл, 53,0ммоль). Отриману реакційну суміш перемішували при -78°С протягом 1 години, а потім при -40°С протягом 2 годин, загасили НОАс (32ммоль) в етері (20мл), профільтрували крізь Celite. Фільтрат концентрували у вакуумі та залишок розчинили у СН2Сl2 (100мл) та промили водою, а потім сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флешхроматографії (5%-10% ЕtOАс у гексані), внаслідок чого отримали 2,40г (8,60ммоль, 81%) (4S)-3-[(2S)2-(4-фторфеніл)пропаноїл]-4-ізопропіл-1,3оксазолідин-2-ону: 1H Я МР (400МГц, CDCI3) δ 7,347,31 (м, 2Η), 7,02-6,96 (м, 2Н), 5,13 (к, 1Н, J=7,7Гц), 4,38-4,33 (м, 1Н), 4,18-4,13 (м, 2Н), 2,48-2,37 (м, 1Н), 1,49 (д, 3Н, J=7,3Гц), 0,91 (очевидний т, 6Η, J=6,9Гц); ESMS m/е: 280,2 (М+Н)+. (4S)-3-[(2S)-2-(4-хлорфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-он: У розчин (4S)-3-[(4хлорфеніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону (1,07г, 3,81ммоль) у безводному THF (30мл) при -78°С в атмосфері аргону додавали краплями 1,0М розчин NaHMDS у THF (4,20мл, 4,20ммоль) протягом періоду у 10 хвилин. Після перемішування при -78°С протягом 1 години додали МеІ (1,19мл, 19,1ммоль). Отриману реакційну суміш перемішували при -78°С протягом 1 години, а по 49 79659 тім при -40°С протягом 2 годин, загасили НОАс (11,4ммоль) в етері (20мл), профільтрували крізь Celite. Фільтрат концентрували у вакуумі та залишок розчинили у СН2Сl2 (100мл) та промили водою, а потім сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флешхроматографії (5%-10% ЕtOАс у гексані), внаслідок чого отримали 0,68г (2,30ммоль, 60%) (4S)-3-[(2S)2-(4-хлорфеніл)пропаноїл]-4-ізопропіл-1,3оксазолідин-2-ону: 1H ЯМР (400МГц, CDCl3) δ 7,307,23 (м, 4Н), 5,11 (κ, 1Η, J=7,9Гц), 4,35 (квінтет, 1Η, J=3,7Гц), 4,16-4,09 (м, 2Н), 2,46-2,36 (м, 1Н), 1,49 (д, 3Н, J=7,3Гц), 0,91 (очевидний т, 6Н, J=6,9Гц); ESMS m/e: 296,2 (М+Н)+. (4R)-3-[(2R)-2-(4-фторфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-он: У розчин (4R)-3-[(4фтор феніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону (4,24г, 16,0ммоль) у безводному THF (80мл) при -78°С в атмосфері аргону додали краплями 1,0М розчин NaHMDS у THF (17,6мл, 17,6ммоль) протягом періоду у 10 хвилин. Після перемішування при -78°С протягом 1 години додали МеІ (5,0мл, 80,0ммоль). Отриману реакційну суміш перемішували при -78°С протягом 1 години, а потім при 40°С протягом 2 годин, загасили НОАс (48ммоль) в етері (20мл), профільтрували крізь Celite. Фільтрат концентрували у вакуумі та залишок розчинили у СН2Сl2 (200мл) та промили водою, а потім сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш-хроматографії (5%10% ЕtOАс у гексані), внаслідок чого отримали 2,59г (9,28ммоль, 58%) (4R)-3-[(2R)-2-(4фтор феніл)пропаноїл]-4-ізопропіл-1,3-оксазолідин2-ону: 1H ЯМР (400МГц, CDCI3) δ 7,34-7,31 (м, 2Н), 7,02-6,96 (м, 2Н), 5,13 (к, 1Н, J=7,7Гц), 4,38-4,33 (м, 1Н), 4,18-4,13 (м, 2Н), 2,48-2,37 (м, 1Н), 1,49 (д, 3Н, J=7,3Гц), 0,91 (очевидний τ, 6Н, J=6,9Гц); ESMS m/e: 280,2 (Μ+Н)+. (4R)-3-[(2R)-2-(4-хлорфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-он: У розчин (4R)-3-[(4хлорфеніл)ацетил]-4-ізопропіл-1,3-оксазолідин-2ону (2,80г, 9,96ммоль) у безводному THF (80мл) при -78°С в атмосфері аргону додали краплями 1,0М розчин NaHMDS у THF (11,0мл, 11,0ммоль) протягом періоду у 10 хвилин. Після перемішування при -78°С протягом 1 години додали МеІ (1,9мл, 30,0ммоль). Отриману реакційну суміш перемішували при -78°С протягом 1 години, а потім при 40°С протягом 2 годин, загасили НОАс (30,0ммоль) в етері (20мл), профільтрували крізь Celite. Фільтрат концентрували у вакуумі та залишок розчинили у СН2СІ2 (100мл) та промили водою, а потім сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флешхроматографії (5%-10% ЕtOАс у гексані), внаслідок чого отримали 1,58г (5,35ммоль, 54%) (4R)-3-[(2R)2-(4-хлорфеніл)пропаноїл]-4-ізопропіл-1,3оксазолідин-2-ону: 1Н Я МР (400МГц, CDCI3) δ 7,307,23 (м, 4Н), 5,11 (к, 1Н, J=7,9Гц), 4,35 (квінтет, 1Н, J=3,7Гц), 4,16-4,09 (м, 2Н), 2,46-2,36 (м, 1Н), 1,49 (д, 3Н, J=7,3Гц), 0,91 (очевидний τ, 6Н, J=6,9Гц); ESMS m/e: 296,1 (Μ+Η)+. 50 (2S)-2-(4-фторфеніл)пропанова кислота: У розчин (4S)-3-[(2S)-2-(4-фторфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-ону (2,40г, 8,60ммоль) у 160мл THF/H2O (3:1) при 0°С додавали 30% Н2О2 (7,8мл, 68,8ммоль), а потім LiOH (722мг, 17,2ммоль). Отриману суміш перемішували при 0°С протягом 2 годин, а надлишок пероксиду загасили при 0°С 1,5N водним Na2SO3 (51мл). Після забуферення до рН9-10 водним NaHCO3 та випаровування THF допоміжний хіральний оксазолідон виділили шляхом екстракції EtOAc (50мл´3). Водний шар підкислили 3Ν НСI та екстрагували ЕtOАс. Органічний шар промили сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі, внаслідок чого отримали 0,92г (5,47ммоль, 64%) (2S)-2-(4фтор феніл)пропанової кислоти; [α]D =+70° (С=1, МеОН): 1H ЯМР (400МГц, CDCI3) δ 12,2-11,4 (шир, 1Н), 7,31-7,24 (м, 2Н), 7,04-6,97 (м, 2Н), 3,72 (к, 1Н, J=7,3Гц), 1,49 (д, 3Н, J=7,3Гц); ESMS m/e: 167,2 (Μ-H)+. (2S)-2-(4-хлорфеніл)пропанова кислота: У розчин (4S)-3-[(2S)-2-(4-хлорфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-ону (678мг, 2,30ммоль) у 45мл THF/H2O (3:1) при 0°С додали 30% Н2О2 (2,1мл, 18,4ммоль), а потім LiOH (193мг, 4,6ммоль). Отриману суміш перемішували при 0°С протягом 2 годин, а надлишок пероксиду загасили при 0°С 1,5N водним Na2SO3 (15мл). Після забуферення до рН9-10 водним NaHCO3 та випаровування THF допоміжний хіральний оксазолідон виділили шляхом екстракції EtOAc (50мл´3). Водний шар підкислили 3Ν НСI та екстрагували ЕtOАс. Органічний шар промили сольовим розчином, висушили над MgSО4, профільтрували та концентрували у вакуумі, внаслідок чого отримали 0,36г (1,96ммоль, 85%) (2S)-2-(4-хлорфеніл)пропанової кислоти; [α]D=+67° (С=1, МеОН): 1H ЯМР (400МГц, CDCI3) δ 12,2-10,8 (шир, 1Н), 7,32-7,23 (м, 4Н), 3,72 (к, 1Н, J=7,3Гц), 1,50 (д, 3Н, J=7,3Гц); ESMS m/е: 183,2 (М-Н)+. (2R)-2-(4-фторфеніл)пропанова кислота: У розчин (4R)-3-[(2R)-2-(4-фторфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-ону (2,59г, 9,28ммоль) у 160мл THF/H2O (3:1) при 0°С додали 30% Н2О2 (8,4мл, 74,2ммоль), а потім LiOH (780мг, 18,6ммоль). Отриману суміш перемішували при 0°С протягом 2 годин, а надлишок пероксиду загасили при 0°С 1,5N водним Na2SO3 (54мл). Після забуферення до рН9-10 водним NaHCO3 та випаровування THF допоміжний хіральний оксазолідон виділили шляхом екстракції EtOAc (50мл´3). Водний шар підкислили 3Ν НСI та екстрагували ЕtOАс. Органічний шар промили сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі, внаслідок чого отримали 1,43г (8,51ммоль, 92%) (2R)-2-(4фтор феніл)пропанової кислоти; [α]D=-61,5° (С=1,04, МеОН): 1H Я МР (400МГц, CDCI3) δ 12,211,4 (шир, 1Н), 7,31-7,24 (м, 2Н), 7,04-6,97 (м, 2Н), 3,72 (к, 1Н, J=7,3Гц), 1,49 (д, 3Н, J=7,3Гц); ESMS m/e: 167,2 (Μ-H)+. (2R)-2-(4-xлopфeнiл)пpoпанoва кислота: У розчин (4R)-3-[(2R)-2-(4-хлорфеніл)пропаноїл]-4ізопропіл-1,3-оксазолідин-2-ону (1,58г, 5,35ммоль) 51 79659 у45мл THF/H2O (3:1) при 0°С додавали 30% Н2О2 (4,9мл, 42,8ммоль), а потім LiOH (449мг, 10,7ммоль). Отриману суміш перемішували при 0°С протягом 2 годин, а надлишок пероксиду загасили при 0°С 1,5N водним Na2SO3 (31мл). Після забуферення до рН9-10 водним NaHCO3 та випаровування THF допоміжний хіральний оксазолідон виділили шляхом екстракції ЕtOАс (50мл´3). Водний шар підкислили 3Ν НСI та екстрагували EtOAc. Органічний шар промили сольовим розчином, висушили над MgSO4 , профільтрували та концентрували у вакуумі, внаслідок чого отримали 0,97г (5,27ммоль, 98%) (2R)-2-(4хлорфеніл)пропанової кислоти; [α]D=-64,8° (01,05, МеОН): 1H ЯМР (400МГц, CDCI3) δ 12,2-10,8 (шир, 1Н), 7,32-7,23 (м, 4Н), 3,72 {к, 1Н, J=7,3Гц), 1,50 (д, 3Н, J=7,3Гц); ESMS m/e: 183,2 (Μ-Н)+. Загальна процедура для Схеми 12 Як проміжний продукт RCOOH є доступним з комерційних джерел, або альтернативно його можна приготувати з різноманітних проміжних продуктів, відомих фа хівцям у галузі. Наприклад, αзаміщену арилоцтову кислоту можна приготувати шляхом гідролізу відповідних α-заміщених арилацетонітрилів або α-заміщених арилоцтових естерів [Rieu, et al., 1986. Tempahedron 42 (15) 4095-4131 та посилання, що наведені у роботі]. Енантіометрно чисту заміщену арилоцтову кислоту можна приготува ти шля хом асиметричного синтезу або ферментного кінетичного повторного розчинення [Evans, в Asymmetric Synthesis, ed. Morrison 1984. Vol 3, Academic Press, New York; Li, et al., 2001. Tempahedron: Asymmetry 12, 33053312 та посилання, що наведені у роботі]. Енантіометрно чисту α-гідроксикарбонову кислоту можна приготува ти шляхом асиметричного синтезу або кінетичного повторного розчинення [Chang, et al., 1999. Org. Lett. 13 2061-2063; Deng, et al., 2002. J. Am. Chem. Soc. 124 (12) 2870-2871; Bull, et al., 2003. Tempahedron: Asymmetry 14, 1407-1446 та посилання, що наведені у роботі]. Енантіомерна чистота визначається ЯМР або ВЕРХ [Parker, 1991. Chem. Rev. 91 1441-1457 та посилання, що наведені у роботі]. Багато інших способів одержання кислотних проміжних продуктів відомі у лі тературі, та їх можуть застосовува ти фа хівці у галузі для їх одержання. Загальна процедура для Схеми 13 Етап 1 У 25-мл круглодонну колбу помістили етилйодид (1,00ммоль, 156мг), Ν-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-2-метилпропанамід (1,00ммоль, 303мг), трет-бутоксид натрію (2,00ммоль, 192мг) та THF (5,00мл). Суміш збовтували на шейкері Orbital J-KEM при кімнатній температурі протягом 12 годин. Реакційну суміш концентрували у вакуумі та очистили шляхом препаративної ТШХ [силікагель, СН2Сl2:аміак (2,0Μ у метанолі) 100:5], внаслідок чого отримали бажаний продукт (28,5мг, 9% вихід): 1H ЯМР (400МГц, CDCI3) δ 7,47 (с, 1Н), 7,40-7,30 (м, 1Н), 7,23-7,19 (м, 1Н), 7,01-6,95 (м, 2Н), 3,70 (κ, 2Η, J=6,0Гц), 3,10-3,02 (м, 2Η), 2,81-2,75 (м, 2Н), 2,50-2,41 (м, 4Н), 2,09-2,01 (м, 2Н), 1,83-1,67 (м, 6Н), 1,24 (д, 7Н, J=6,0Гц), 1,08 (т, 3Н, J=6,0Гц). 52 Етап 2: Дивись Схему 9. Загальна процедура для Схеми 14 N-(3-бромпропіл)-2,2-дифенiлацетамiд. У перемішуван у суміш 3-бромпропіламіну гідроброміду (2,91г, 13,3ммоль) у 10мл СН 2Сl2 додали 2,8мл триетиламіну (20,0ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин, а потім додали дифенілацетилхлорид (2,56г, 11,1ммоль) та триетиламін (2,8мл, 20ммоль) у СН 2Сl2 (10мл). Реакційну суміш перемішували протягом 40 хвилин при кімнатній температурі, а потім розвели 200мл СН 2Сl2. Розчин промили водною 0,5N НСI (100мл´3), водою (50мл), NaHCO3 (насичений, 100мл) та NaCl (насичений), висушили над MgSO4. Внаслідок видалення розчинника отримали сирий продукт у вигляді світло-жовтої твердої речовини, яку застосовували на наступному етапі без подальшого очищення (3,33г, 91%): 1H ЯМР (400МГц, CDCI3) δ 7,56-7,45 (м, ЮН), 5,88-5,69 (шир, 1Н), 4,92 (с, 1Н), 3,47-3,39 (м, 2Н), 3,35 (т, 2Н, J=6,4Гц), 2,16-1,98 (м, 2Н). N-[4-(1-{3-[(дифенiлацетил)амiно]пропiл}-4пiперидиніл)фенiл]-2-метилпропанамід: Суміш 2метил-N-[4-(4-тперидиніл)феніл]пропанаміду (50,0мг, 2,0ммоль), N-(3-бромпропіл)-2,2дифенілацетамщу (64,2мг, 0,2ммоль), K2СО3 (55,0мг, 4,0ммоль) та Nal (45,0мг, 0,3ммоль) у 2мл DMF перемішували при кімнатній температурі протягом 10 хвилин, а потім нагрівали до 80-90°С протягом 12 годин. Реакційну суміш о холодили до кімнатної температури та очистили шляхом препаративної ТШХ (силікагель, EtOAc/NH 3 (2 Μ у МеОН); 95:5), внаслідок чого отримали N-[4-(1-{3[(дифенілацетил)аміно]пропіл}-4піперидиніл)феніл]-2-метилпропанамід у вигляді безбарвної олії (15,7мг, 32%): ESMS m/e: 498,3 (М+Н)+. Загальна процедура для Схеми 15 N-{3-[4-(3-амінофеніл)-1-піперидиніл]}-2,2дифенілацетамід: У25-мл круглодонну колбу, обладнану балоном з воднем, помістили бензил 3-(1{3-[(дифенілацетил)аміно]пропіл}-4піперидиніл]фенілкарбамат (78,7мг, 0,140ммоль), Pd/C (10моль%, 14,8мг) та етанол (2,00мл) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 12 годин та профільтрували крізь шар Celite. Celite промили метиленхлоридом (3´5мл), а фільтрат концентрували у вакуумі. Залишок очистили шляхом препаративної ТШХ [силікагель, СН2Сl2:аміак (2,0Μ у метанолі) 100:5], внаслідок чого отримали N-{3-[4-(3амінофеніл)-1-піперидиніл]}-2,2-дифенілацетамід: 1 Н ЯМР (400МГц, CDCI3) δ 7,34-7,08 (м, 15Н), 4,59 (с, 1Н), 3,38-3,31 (м, 1Н), 3,24-3,15 (м, 2Н), 2,712,64 (м, 1Η), 2,49-2,28 (м, 3Н), 2,08-1,89 (м, 3Н), 1,84-1,49 (м, 6Н); ESMS m/e: 428,3 (Μ+Н)+. Загальна процедура для Схеми 16 1-бром-2,4-дифтор-5-нітробензол: До суспензії 1-бром-2,4-дифторбензолу (6,0мл, 53,0ммоль) у концентрованій H2SO4 (38,5мл) при 0°С додавали краплями концентровану ΗΝΟ3 (34,0мл), при цьому внутрішню температуру підтримували нижче 20°С. Отриману суміш перемішували протягом 30 хвилин при 0°С, потім повільно виливали у льодяну воду, при цьому сильно перемішуючи. Водну 53 79659 фазу відокремили та екстрагували ЕtOАс. Об'єднані органічні екстракти промили 5% водним КОН та сольовим розчином, висушили над MgSO 4 та концентрували, внаслідок чого отримали 12,2г (51,5ммоль, 97%) 1-бром-2,4-дифтор-5нітробензолу:1Н ЯМР (400МГц, CDCI3) δ 8,39 (т, 1Η, J=7,4Гц), 7,13 (дд, 1H,J=7,7, 10,3Гц). 2-бром-1,3,5-трифтор-4-нітробензол : 1H ЯМР (400МГц, CDCI3) δ 7,05-6,98 (м, 1Н); ESMS m/e: 256,2 (Μ+H)+. 5-бром-2,4-дифторанілін: У розчин 1-бром-2,4дифтор-5-нітробензолу (5,04г, 21,3ммоль) у ЕtOН (100мл), THF (50мл), NH4Cl (насичений) (25мл) та Н2О (25мл) додали порошок заліза (5,0г, 89,5ммоль). Суміш кип'ятили у колбі зі зворотним холодильником протягом 2 годин та профільтрували крізь Celite. Фільтрувальний шар промили ЕtOАс (3´50мл). Фільтрат концентрували та залишок розподілили між ЕtOАс та сольовим розчином. Органічний шар висушили над MgSO4 та концентрували. Внаслідок очищення шляхом флешхроматографії (5-10% EtOAc/Гексан) отримали 2,6г (59%) 5-бром-2,4-дифтораніліну: ESMS m/e: 208,2 (Μ+Н)+. 3-бром-2,4,6-трифторанілін: 1H ЯМР (400МГц, CDCI3) δ 6,85-6,76 (м, 1Н), 3,78-3,51 (шир, 2Н). N-(5-бром-2,4-дифторфент)-2метилпропанамід: У розчин 2,6г (12,6ммоль) 5бром-2,4-дифтораніліну та 2,1мл (15,1ммоль) триетиламіну у 50мл THF при 0°С повільно додавали 1,6мл (15,1ммоль) ізобутирилхлориду. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин та концентрували у вакуумі. Залишок розчинили у ЕtOАс та промили Н 2О, насиченим водним Na2CO3 та сольовим розчином. Органічний шар висушили над MgSO 4 та концентрували у вакуумі, внаслідок чого отримали 3,3г (11,8ммоль, 94%) N-(5-бром-2,4дифторфеніл)-2-метилпропанаміду: ESMS m/e: 278,1 (Μ+Н)+. N-(3-бром-2,4,6-трифторфеніл)-2метилпропанамід: ESMS m/e: 296,3 (Μ+Η)+. трет-Бутил 4-[2,4-дифтор-5(ізобутириламіно)феніл]-3,6-дигідро-1(2Н)піридинкарбоксилат: У 250-мл круглодонну колбу, що містила трет-бутил 4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-3,6-дигідро-1(2Н)піридинкарбоксилат (3,31г, 10,7ммоль), K2СО3 (4,44г, 32,1ммоль) та PdChdppf (870мг, 1,07ммоль), додали розчин N-(5-бром-2,4дифторфеніл)-2-метилпропанаміду (3,28г, 11,8ммоль) у DMF (100мл) при кімнатній температурі в атмосфері аргону. С уміш нагрівали до 80°С в атмосфері аргону протягом ночі, охолодили до кімнатної температури, профільтрували крізь Celite та Celite промили ЕtOАс (3´20мл). Фільтрати промили Н2О (20мл), сольовим розчином (20мл), висушили над MgSO4, профільтрували та концентрували у вакуумі. Сирий матеріал очистили шляхом флеш-хроматографії (10%-20% ЕtOАс/гексан), внаслідок чого отримали 2,4г (6,31ммоль, 59%) трет-бутил 4-[2,4-дифтор-5(ізобутириламіно)феніл]-3,6-дигідро-1(2Н)піридинкарбоксилату: ESMS m/e: 379,3 (Μ-Н)+. 54 трет-Бутил 4-[2,4,6-трифтор-3(ізобутириламіно)феніл]-3,6-дигідро-1(2Н)піридинкарбоксилат: ESMS m/e: 397,6 (Μ-Н)+. трет-Бутил 4-[2,4-дифтор-5(ізобутириламіно)феніл]-1-піперидинкарбоксилат: Розчин трет-бутил 4-[2,4-дифтор-5(ізобутириламіно)феніл]-3,6-дигідро-1(2Н)піридинкарбоксилату (2,40г, 6,31ммоль) і 10% Pd/C (500мг) в ЕtOАс (40,0мл) і МеОН (10,0мл) гідрували (200psi (фун тів на квадратний дюйм)) при кімнатній температурі протягом ночі. Реакційну суміш профільтрували крізь Celite і промили етанолом (3´10мл). Об'єднані екстракти концентрували у вакуумі, внаслідок чого отримали 2,04г (5,34ммоль, 85%) трет-бутил 4-[2,4-дифтор-5(ізобутириламіно)феніл]-1-піперидинкарбоксилату: ESMS m/e: 383,2 (Μ+Н)+. N-[2,4-дифтор-5-(4-піперидиніл)феніл]-2метилпропанамід: У розчин трет-бутип 4-[2,4дифтор-5-(ізобутириламіно)феніл]-1піперидинкарбоксилату (6,54г, 17,1ммоль) в 1,4діоксані (40,0мл) додавали 4М НСI в 1,4-діоксані (160мл) при кімнатній температурі. Суміш перемішували протягом години та концентрували у вакуумі. Залишок розчинили у 100мл Н2О та підлужили 10% розчином КОН (50мл). Водний шар екстрагували СНСI3//-РrОН (3:1, 3´150мл). Об'єднані органічні екстракти промили сольовим розчином, висушили над MgSO4, профільтрували та концентрували у вакуумі, внаслідок чого отримали 4,72г (16,7ммоль, 98%) N-[2,4-дифтор-5-(4піперидиніл)феніл]-2-метилпропанаміду: ESMS m/e: 283,3 (Μ+Н)+. 2-метил-N-[2,4,6-трифтор-3-(1,2,3,6тетрагідро-4-піридиніл)феніл]пропанамід: ESMS m/e: 299,5 (Μ+Η)+. 2-метил-N-[2,4,6-трифтор-3-(4піперидиніл)феніл]пропанамід: ESMS m/e:301,3(M+H)+. Загальна процедура для Схеми 17 Бензил 5-бром-3-піридинілкарбамат: У суспензію 5-бромнікотинової кислоти (20,0г, 99,0ммоль) у толуолі (200мл) додали дифенілфосфорилазид (25,6мл, 118,8ммоль) та Et3N (16,6мл, 118,8ммоль). Після перемішування при кімнатній температурі протягом 30 хвилин додали бензиловий спирт (15,4мл, 148,5ммоль). Суміш перемішували при кімнатній температурі протягом 1 години, потім кип'ятили у колбі зі зворотним холодильником протягом ночі. Холодну реакційну суміш промили Н2О, NаНСО3 та сольовим розчином, висушили над MgSO4 та концентрували. Внаслідок очищення шляхом флеш-хроматографії (15-50% ЕtOАс/Гексан) отримали 22,2г (72,5ммоль, 73%) бензил 5-бром-3-піридинілкарбамату: ESMS m/e: 307,0 (Μ+Н)+. трет-Бутил4-{5-[(фенілметокси)карбоніламіно]3-тридил}-1,2,5,6-тетрагідропіридинкарбоксилат: ESMS m/e: 410,2 (Μ+Н)+. трет-Бутилп 4-(5-аміно-3-піридиніл)-1піперидинкарбоксилат: ESMS m/e: 278,3 (Μ+H)+. трет-Бутил 4-[5-(ізобутириламіно)-3-піридиніл]1-піперидинкарбоксилат: ESMS m/e: 348,3 (Μ+Η)+. 2-метил-N-[5-(4-піперидиніл)-3піридиніл]пропанамід: ESMS m/e: 248,3 (Μ+H)+. Загальна процедура для Схеми 18 55 79659 Біс(4-фторфеніл)(гідрокси)оцтова кислота: До розчину, приготовленого з 10,2г КОН і 50мл 50% EtOH, додали 1,2-біс(4-фторфеніл)-1,2-етандіон (10,0г, 40,6ммоль) і суміш нагрівали при температурі дефлегмації протягом ночі. Після охолоджування до кімнатної температури, суміш промили етером (100мл´2). Водний шар охолодили до 0°С, окислили 12N НСI (20мл) та екстрагували СН 2СІ2 (150мл´2). Об'єднані органічні шари промили сольовим розчином, висушили над MgSO 4, профільтрували та концентрували у вакуумі, внаслідок чого отримали 9,15г (34,7ммоль, 85%) біс(4фтор феніл)(гідрокси)оцтової кислоти: ESMS m/e: 263,2 (Μ-Н)+. Гідрокси[біс(4-метилфеніл)]оцтова кислота: У розчин, який приготували з 10,6г КОН і 50мл 50% EtOH, додали 1,2-біс(4-метилфеніл)-1,2-етандіон (10,0г, 42,0ммоль) і суміш нагрівали при температурі дефлегмації протягом ночі. Після охолодження до кімнатної температури суміш промили етером (100мл´2). Водний шар охолодили до 0°С, підкислили 12N НСI (20мл) та екстрагували СН 2Сl2 (150мл´2). Об'єднані органічні шари промили сольовим розчином, висушили над MgSO 4, профільтрували та концентрували у вакуумі, внаслідок чого отримали 9,56г (37,3ммоль, 89%) гідрокси[біс(4-метилфеніл)]оцтової кислоти: ESMS m/e: 255,3 (Μ-Н)+. Приклад 1 N-{3-[1-(3-{(Біс(4фтор феніл)ацетил]аміно}пропіл)-4піперидиніл]феніл}-2-метилпрoпанамід: Приклад 1 одержали з біс(4-фторфеніл)оцтової кислоти та N{3-[1-(3-амінопротл)-4-піперидиніл]феніл}-2метилпропанаміду згідно з процедурою, показаною на Схемі 9: 1H ЯМР (400МГц, CDCI3) δ 7,63 (с, 1Н), 7,39-7,31 (м, 3Н), 7,29-7,21 (м, 5Н), 7,02-6,96 (м, 4Н), 4,80 (с, 1Н), 3,40 (к, 2Н, J=4,5Гц), 2,94 (д, 2Н, J=10,2Гц), 2,51-2,38 (м, 4Н), 1,97 (дт, 2Н, J=1,8, 10,4Гц), 1,81 (м, 2Н), 1,68 (квінтет, 2Н, J=6,8Гц), 1,59 (м, 3Н), 1,23 (д, 6Н, J=6,9Гц); ESMS m/e: 534,3 (М+Н)+; Розраховано для (сіль НСI) C32H37F 2N3O 2·НСI·0,20 СНСI3: С, 65,11; Н, 6,48; N, 7,07. Знайдено: С, 65,30; Н, 6,50; N, 6,96. Приклад 2 N-{3-[1-(3-{[Біс(4хлорфеніл)ацетил]аміно}пропіл)-4піперидиніл]феніл}-2-метилпропанамід: Приклад 2 одержали з біс(4-хлорфеніл)оцтової кислоти та N 56 {3-[1-(3-амінопротл)-4-піперидиніл]феніл}-2металпропанаміду згідно з процедурою, показаною на Схемі 9: 1H ЯМР (400МГц, CDCI3) δ 7,64 (с, 1Н), 7,34-7,13 (м, 12Н), 4,75 (с, 1Н), 3,41 (к, 2Н, J=4,5Гц), 2,94 (д, 2Н, J=10,2Гц), 2,51-2,40 (м, 4Н), 1,97 (м, 2Н), 1,82 (м, 2Н), 1,68 (квінтет, 2Н, J=6,8Гц), 1,59 (м, 3Н), 1,25 (д, 6Н, J=6,8Гц); ESMS m/e: 566,2 (Μ+Н)+. Приклад 3 N-(3-{4-[3-(ацетиламiно)феніл]-1пiперидинiл}пропіл)-2,2-дифенілацетамід: Приклад 3 одержали з дифенілацетилхлориду тa N-{3-[1-(3амінопропіл)-4-піперидиніл]феніл}ацетаміду згідно з процедурою, показаною на Схемі 8: 1Н ЯМР (400МГц, CDCI3) δ 7,70 (с, 1Н), 7,40 (с, 1Н), 7,327,20 (м, 12Н), 6,96 (т, 1Н, J=4,8Гц), 6,91 (д, 1Н, J=7,6Гц), 4,87 (с, 1Н), 3,39 (дд, 2Н, J=6,0, 12,4Гц), 2,90 (д, 2Н, J=11,6Гц), 2,43 (м, 1Н), 2,36 (т, 2Н, J=6,4Гц), 2,11 (с, 3Н), 1,94 (м, 2Н), 1,76 (д, 2Н, J=12,4Гц), 1,68 (т, 2Н, J=6,8Гц), 1,60 (дд, 2Н, J=1,2, 8,4Гц); ESMS m/e: 470,3 (Μ+Н)+. Приклад 4 N-[3-(1-{3-[(дифенілацетил)аміно]пропіл}-4піперидиніл)-4-метилфеніл]-2-метилпропанамід: Приклад 4 одержали з дифенілацетилхлориду та N-{3-[1-(3-амінопропіл)-4-піперидиніл]-4метилфеніл}-2-метилпропанаміду згідно з процедурою, показаною на Схемі 8: 1H ЯМР (400МГц, CDCI3) δ 7,39-7,23 (м, 12Н), 7,14 (шир, 1Н), 7,08 (д, 1Н, J=8,4Гц), 6,90 (шир, 1Н), 4,91 (с, 1Н), 3,41 (дд, 2Н, J=6,4,12,4Гц), 2,95 (д, 2Н, J=12,4Гц), 2,66 (м, 1Н), 2,47 (м, 1Н), 2,40 (т, 2Н, J=6,4Гц), 2,28 (с, 3Н), 2,03-1,97 (м, 2Н), 1,74-1,62 (м, 6Н), 1,22 (д, 6Н, J=7,2Гц); ESMS m/e: 512,3 (Μ+H)+. Приклад 5 N-[3-(1-{3-[(2,2-дифенілацетил)аміно]пропіл}-4піперидиніл)феніл]бутанамід: Приклад 5 одержали з дифенілацетилхлориду та N-{3-[1-(3амінопропіл)-4-піперидиніл]феніл}бутанаміду згідно з процедурою, показаною на Схемі 8: 1H ЯМР (400МГц, CDCI3) δ 7,49 (с, 1Н), 7,35-7,23 (м, 12Н), 7,20 (с, 1Н), 6,95 (д, 2Н, J=7,6Гц), 4,90 (с, 1Н), 3,41 (дд, 2Н, J=5,6, 11,6Гц), 2,94 (д, 2Н, J=11,6Гц), 2,48 (м, 1Н), 2,40 (т, 2Н, J=6,4Гц), 2,34 (т, 2Н, J=7,2Гц), 1,98 (т, 2Н, J=11,2Гц), 1,82-1,60 (м, 8Н), 1,02 (т, 3Н, J=7,2Гц); ESMS m/e: 498,3 (Μ+Н)+. 57 79659 58 Приклад 6 N-[6-(1-{3-[(дифенiлацетил)аміно]пропiл}-4пiперидиніл)-2-піридиніл]-2-метилпропанамід: Приклад 6 одержали з дифенілацетилхлориду та Ν-{6[1-(3-амінопропіл)-4-піперидиніл]-2-піридиніл}-2метилпропанаміду згідно з процедурою, показаною на Схемі 8: 1H ЯМР (400МГц, CDCI3) δ 8,07 (д, 1Н, J=8,0Гц), 7,71-7,63 (м, 3Н), 7,42-7,23 (м, 10Н), 6,89 (д, 1Н, J=7,6Гц), 4,96 (с, 1Н), 3,41 (дд, 2Н, J=5,6, 7,6Гц), 3,00 (д, 2Н, J=11,6Гц), 2,60 (м, 1Н), 2,47 (т, 2Н, J=6,4Гц), 2,45 (м, 1Н), 2,06-2,01 (м, 2Н), 1,89-1,64 (м, 6Н), 1,13 (д, 6Н, J=6,8Гц); ESMS m/e: 499,3 (Μ+Н)+. Приклад 7 2-(4-хлорфеніл)-2-метил-N-(3-{4-[3(пропюнiламiно)фенiл]-1піперидиніл}пропіл)пропанамід: Приклад 7 одержали з 2-(4-хлорфеніл)-2-метилпропанової кислоти та N-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}пропанаміду згідно з процедурою, показаною на Схемі 10: 1H ЯМР (400МГц, CDCI3) δ 7,86 (с, 1Н), 7,50 (с, 1Н), 7,34-7,19 (м, 6Н), 6,96 (д, 1Н, J=7,8Гц), 6,72-6,67 (м, 1Н), 3,42 (к, 2Н, J=7,1Гц), 3,31 (к, 3Н, J=5,4Гц), 2,49-2,35 (м, 5Н), 2,08-1,95 (м, 2Н), 1,82-1,74 (м, 2Н), 1,71-1,62 (м, 3Н), 1,56 (с, 6Н), 1,24 (т, 3Н, J=7,8Гц); ESMS m/e: 470,3 (М+Н)+. Приклад 8 2-(4-хлорфеніл)-N-(3-{4-[3(ізобутириламіно)феніл]-1-піперидиніл}пропіл)-2метилпропанамід: Приклад 8 одержали з 2-(4хлорфеніл)-2-метилпропанової кислоти та N-{3-[1(3-амінопропіл)-4-піперидиніл]феніл}-2метилпропанаміду згідно з процедурою, показаною на Схемі 9: 1H ЯМР (400МГц, CDCI3) δ 7,53 (с, 1Н), 7,32-7,24 (м, 7Н), 6,91 (д, 1Н, J=7,2Гц), 6,67 (м, 1Н), 3,31 (к, 2Н, J=5,5Гц), 2,92-2,85 (м, 2Н), 2,53 (септет, 1Н, J=6,7Гц), 2,43 (тт, 1Н, J=11,6, 3,0Гц), 2,33 (т, 2Н, J=6,7Гц), 1,91 (дт, 2Н, J=11,7,1,8Гц), 1,78-1,72 (м, 2Н), 1,65-1,59 (м, 2Н), 1,56 (с, 6Н), 1,52-1,45 (м, 2Н), 1,25 (д, 6Н, J=6,7Гц); ESMS m/e: 484,3 (Μ+Н)+; Розраховано для (сіль НСI) C28H38ClN3O2 ·HCL·0,30 CHCL3: C, 61,10; H, 7,12; N, 7,55. Знайдено: С, 60,90; Η, 7,20; Ν, 7,64. Приклад 9 N-{3-[1-(3-{[бром(феніл)ацетил]аміно}пропіл)4-піперидиніл]феніл}-2-метилпропанамід: Приклад 9 одержали з бром(феніл)оцтової кислоти та N-{3[1-(3-амінопропіл)-4-піперидиніл]феніл}-2метилпропанаміду згідно з процедурою, показаною на Схемі 9: ESMS m/e: 500,0 (Μ+Н)+. Приклад 10 N-[3-(1-{3-[(2-бром-2фенілацетил)аміно]пропіл}-4піперидиніл)феніл]пропанамід: Приклад 10 одержали з бром(феніл)оцтової кислоти та N-{3-[1-(3амінопропіл)-4-тперидиніл]феніл}пропанаміду згідно з процедурою, показаною на Схемі 10: ESMS m/e: 486,1 (Μ+Н)+. Приклад 11 N-(3-{4-[3-(ізобутириламіно)феніл]-1піперидиніл}пропіл)-2,2-дифенілгептанамід: Приклад 11 одержали з 2,2-дифенілгептанової кислоти та N-{3-[1-(3-амінопропіл)-4-піперидиніл]феніл}2-метилпропанаміду згідно з процедурою, показаною на Схемі 9: 1H ЯМР (400МГц, CDCI3) δ 7,65 (с, 1Н), 7,45 (с, 1Н), 7,40 (м, 1Н), 7,37-7,19 (м, 1 ЇЙ), 6,88 (д, 1Н, J=7,3Гц), 6,34 (т, 1Н, J=4,5Гц), 3,343,27 (м, 3Н), 2,94-2,87 (м, 2Н), 2,52 (септет, 1Н, J=6,9Гц), 2,46-2,34 (м, 4Н), 2,27 (т, 2Н, J=6,9Гц), 2,00-1,91 (м, 2Н), 1,77-1,69 (м, 2Н), 1,69-1,52 (м, 5Н), 1,30-1,20 (м, 12Н); ESMS m/e: 568,4 (М+Н)+. Приклад 12 N-(3-{4-[3-(ізобутириламіно)фенiл]-1пiперидинiл}пропіл)-2,2-дифенілбутанамід: Приклад 12 одержали з 2,2-дифенілбутанової кислоти та N-{3-[1-(3-амінопропіл)-4-піперидиніл]феніл}-2метилпропанаміду згідно з процедурою, показаною на Схемі 9: 1Н ЯМР (400МГц, CDCI3) δ 7,45 (с, 1Н), 7,44-7,39 (м, 2Н), 7,37-7,28 (м, 8Н), 7,27-7,20 (м, 3Н), 6,89 (д, 1Н, J=7,4Гц), 6,43 (т, 1Н, J=4,5Гц), 3,35-3,27 (м, 2Н), 2,90-2,82 (м, 2Н), 2,51 (септет, 1Н, J=6,8Гц), 2,49-2,35 (м, 4Н), 2,24 (т, 2Н, J=6,3Гц), 1,89 (т, 2Н, J=10,2Гц), 1,75-1,68 (м, 2Н), 1,66-1,58 (м, 2Н), 1,57-1,45 (м, 2Н), 1,24 (д, 6Н, J=6,7Гц), 1,27-1,23 (м, 2Н); ESMS m/e: 526,3 (Μ+Н)+. 59 79659 Приклад 13 N-[3-(1-{3-[(дифенілацетил)аміно]пропіл}-4піперидиніл)феніл]-3-метилбутанамід: Приклад 13 одержали з дифенілацетилхлориду та Ν-{3-[1-(3амінопропіл)-4-піперидиніл]феніл}-3метилбутанаміду згідно з процедурою, показаною на Схемі 8: 1Н ЯМР (400МГц, CDCI3) δ 10,79-10,51 (шир, 1Н), 8,85-8,67 (м, 1Н), 8,01-7,81 (шир, 1Н), 7,70 (д, 1Н, J=7,2Гц), 7,47-7,14 (м, 11Н), 6,89 (д, 1Н, J=7,2Гц), 5,03 (с, 1Н), 3,53-3,26 (м, 4Н), 2,962,80 (м, 2Н), 2,78-2,52 (м, 3Н), 2,44-2,14 (м, 2Н), 2,26 (д, 2Н, J=6,0Гц), 2,14-1,94 (м, 3Н), 1,94-1,76 (м, 2Н), 1,10 (д, 6Н, J=6,4Гц); ESMS m/e: 512,3 (Μ+Н)+; Розраховано для (сіль НСI) C33H42ClN3O2 ·0,60CH2Cl2: C, 67,36; H, 7,27; N, 7,01. Знайдено: С, 67,08; Η, 7,57; Ν, 7,36. Приклад 14 N-[3-(1-{3-[(2-мезитил-2фенілацетил)аміно]пропіл}-4піперидиніл)феніл]пропанамід: Приклад 14 одержали з мезитил(феніл)оцтової кислоти та N-{3-[1(3-амінопропіл)-4-піперидиніл]феніл}пропанаміду згідно з процедурою, показаною на Схемі 9: ESMS m/е: 526,3 (М+Н)+. Приклад 15 2,2-дифеніл-N-(3-4-[3-(пропюніламіно)феніл]1-піперидиніл}пропіл)бутанамід: Приклад 15 одержали з 2,2-дифенілбутанової кислоти та N-{3-[1-(3амінопропіл)-4-піперидиніл]феніл}пропанаміду згідно з процедурою, показаною на Схемі 10: 1H ЯМР (400МГц, CDCI3) δ 7,43-7,38 (м, 1Н), 7,37-7,29 (м, 9Н), 7,28-7,21 (м, 4Η), 6,90 (д, 1Н, J=8,2Гц), 6,43 (т, 1Н, J=4,1), 3,32 (к, 2Н, J=6,5Гц), 2,95-2,89 (м, 2Н), 2,45 (к, 2Н, J=7,9Гц), 2,43-2,35 (м, 3Н), 2,27 (т, 2Н, J=6,5Гц), 2,01-1,92 (м, 2Н), 1,78-1,59 (м, 6Н), 1,24 (т, 3Н, J=7,9Гц), 0,79 (т, 3Н, J=6,5Гц); ESMS m/е: 512,3 (М+Н)+. Приклад 16 N-{3-[1-(3{[(етилсульфаніл)(дифеніл)ацетил]аміно}пропіл)-4піперидиніл]феніл}-2-метилпропанамід: Приклад 16 одержали з (етилсульфаніл)(дифеніл)оцтової кислоти та N-{3-[1-(3-амінопропіл)-4піперидиніл]феніл}-2-метилпропанаміду згідно з 60 процедурою, показаною на Схемі 9: ESMS m/e: 658,6 (Μ+Н)+. Приклад 17 N-[3-(1-{3-[(2,2-дифенілацетил)аміно]пропiл}-4піперидиніл)феніл]циклопропанкарбоксамід: Приклад 17 одержали з дифенілацетилхлориду та N{3-[1-(3-амінопропіл)-4піперидиніл]феніл}циклопропанкарбоксаміду згідно з процедурою, показаною на Схемі 8: 1H ЯМР (400МГц, CDCI3) δ 9,26-9,09 (шир, 1Н), 8,12-7,91 (шир, 1Н), 7,69 (д, 1Н, J=7,2Гц), 7,63-7,42 (шир, 1Н), 7,43-7,12 (м, 11Н), 6,88 (д, 1H, J=7,2Гц), 5,03 (с, 1Н), 3,53-3,27 (м, 4Н), 2,99-2,84 (м, 2Н), 2,842,58 (м, 3Н), 2,40-2,16 (м, 2Н), 2,16-1,98 (м, 2Н), 1,98-1,83 (м, 2Н), 1,78-1,64 (м, 1Н), 1,10-0,97 (м, 2Н), 0,90-0,76 (м, 2Н); ESMS ш/е: 496,3 (М+Н)+. Приклад 18 N-[3-(1-{3-[(дифенілацетил)аміно]пропiл}-4піперидиніл)фенiл]-2,2-диметилпропанамід: Приклад 18 одержали з дифенілацетилхлориду тa N{3-[1-(3-амінопропіл)-4-піпервдиніл]феніл}-2,2диметилпропанаміду згідно з процедурою, показаною на Схемі 8: 1Н ЯМР (400МГц, CDCI3) δ 7,517,41 (с, 1Н), 7,34-7,10 (м, 13Н), 6,99-6,80 (м, 2Н), 4,81 (с, 1Η), 3,40-3,26 (м, 2Н), 2,96-2,78 (м, 2Н), 2,50-2,25 (м, 3Н), 1,98-1,82 (м, 2Н), 1,79-1,68 (м, 2Н), 1,68-1,45 (м, 4Н), 1,23 (с, 9Н); ESMS m/e: 512,3 (М+Н)+. Приклад 19 N-[3-(1-{3-[(дифенілацетил)аміно]пропіл}-4гаперидиніл)феніл]-3,3-диметилбутанамід: Приклад 19 одержали з дифенілацетилхлориду та Ν{3-[1-(3-амінопропіл)-4-піперидиніл]феніл}-3,3диметилбутанаміду згідно з процедурами, показаними на Cхемі 8: 1Н ЯМР (400МГц, CDCI3) δ 10,7310,50 (шир, 1Н), 8,63-8,48 (м, 1Н), 7,97-7,77 (шир, 1Н), 7,70 (д, 1Н, J=7,2Гц), 7,45-7,11 (м, 11Н), 6,89 (д, 1Н, J=7,2Гц), 5,01 (с, 1Н), 3,46-3,26 (м, 4Н), 2,97-2,77 (м, 2Η), 2,77-2,50 (м, 3Н), 2,42-2,17 (м, 2Н), 2,25 (с, 2Н), 2,14-1,94 (м, 2Н), 1,93-1,78 (м, 2Н), 1,00 (с, 9Н); ESMS m/e: 526,4 (Μ+Н)+; Розраховано для (сіль НСI) C34H44ClN3O2·0,31CHCL3: C, 68,77; H, 7,45; N, 7,01. Знайдено: С, 68,51; Η, 7,40; Ν, 7,39. Приклад 20
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted alkylamidopiperidines
Автори англійськоюWETZEL JOHN M., CHEN CHIEN AN, JIANG YU, LU KAI
Назва патенту російськоюЗамещенные алкиламидопиперидины
Автори російськоюВетзель Джон М., Чен Чиен-Ан, Джианг Ю, Лу Кай
МПК / Мітки
МПК: C07D 401/04, C07D 211/26
Мітки: заміщені, алкіламідопіперидини
Код посилання
<a href="https://ua.patents.su/62-79659-zamishheni-alkilamidopiperidini.html" target="_blank" rel="follow" title="База патентів України">Заміщені алкіламідопіперидини</a>
Попередній патент: Спосіб регенерації композиційних матеріалів
Наступний патент: Датчик вологості сипучих матеріалів у потоці
Випадковий патент: Відеоелектронний комплекс для високошвидкісної зйомки балістичних процесів












