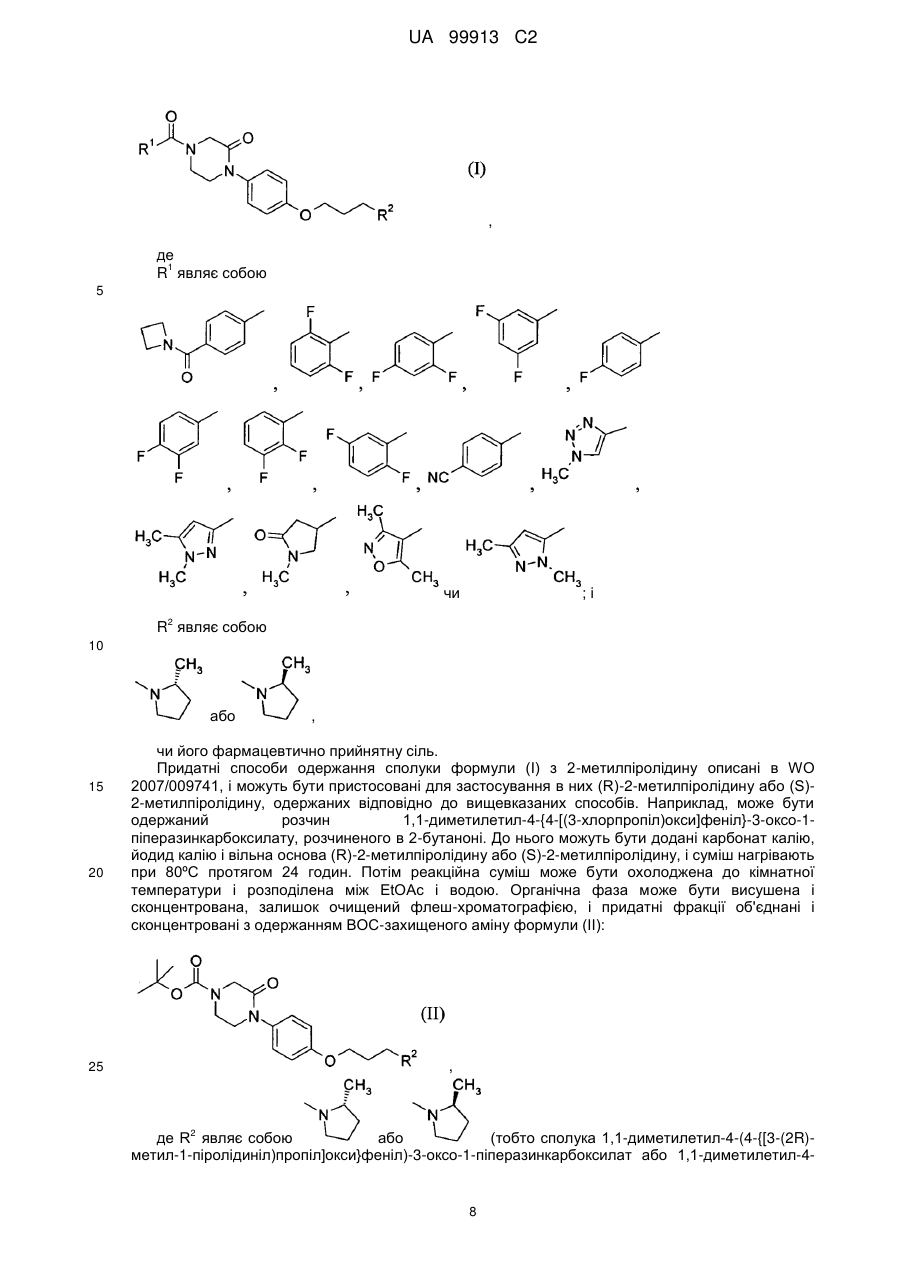
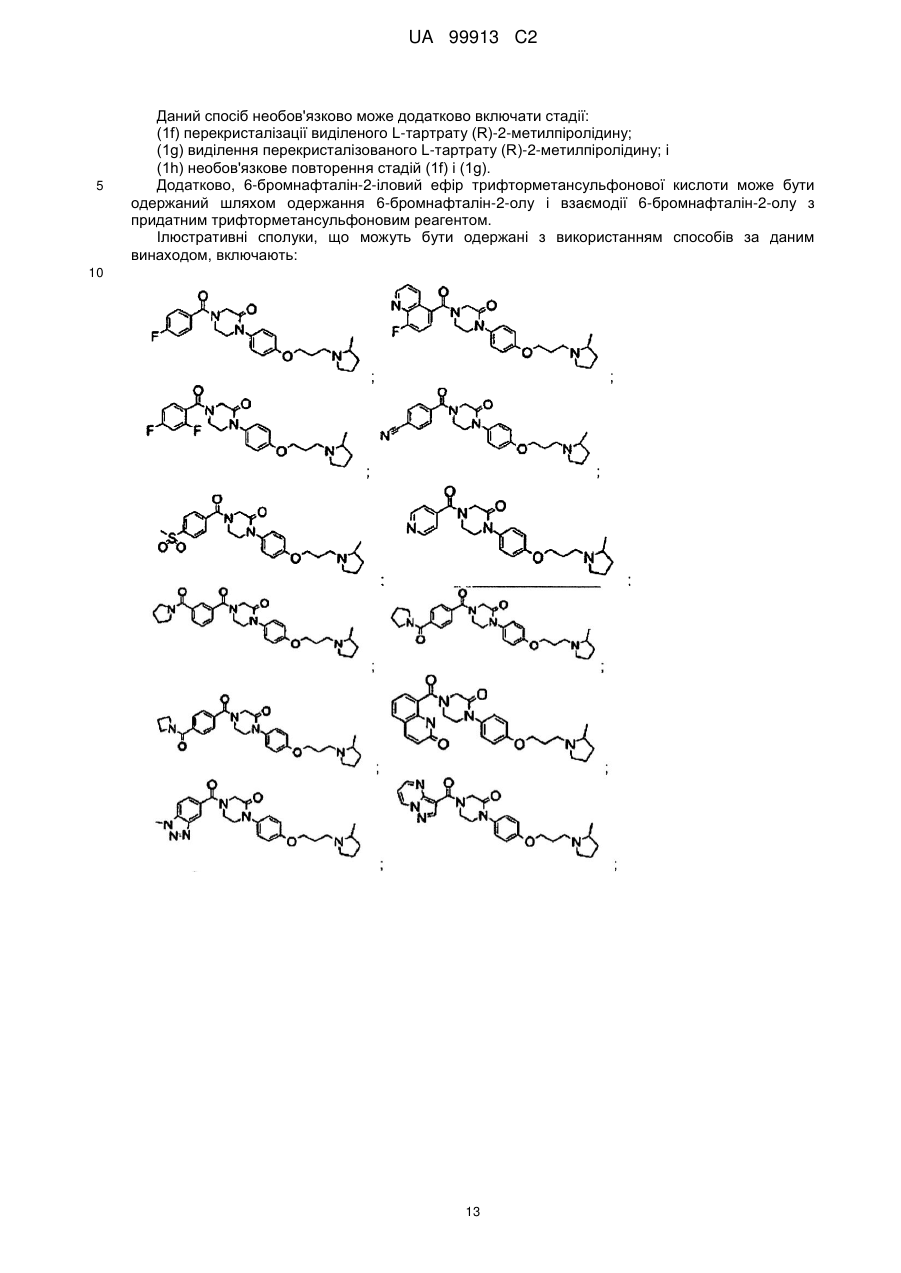
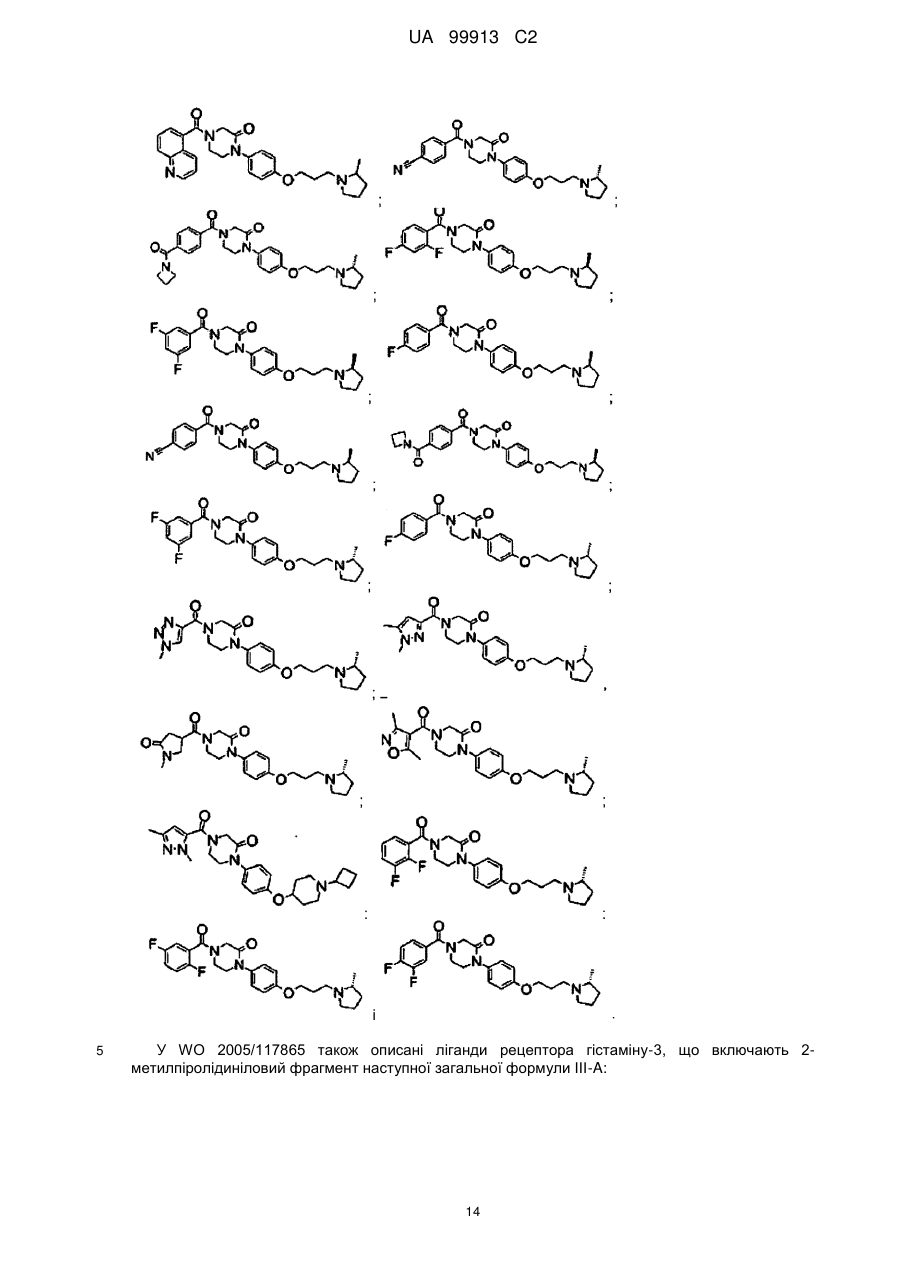
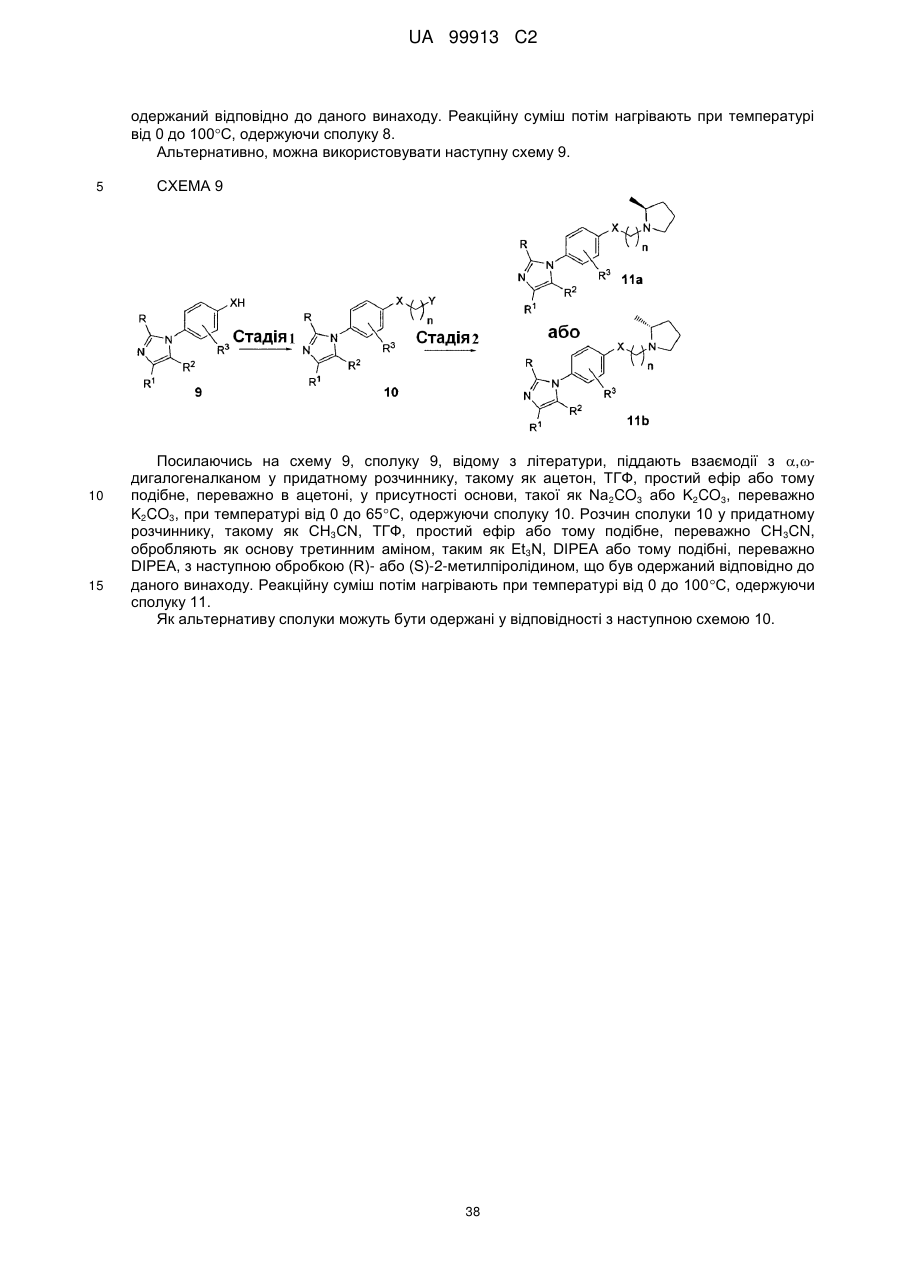
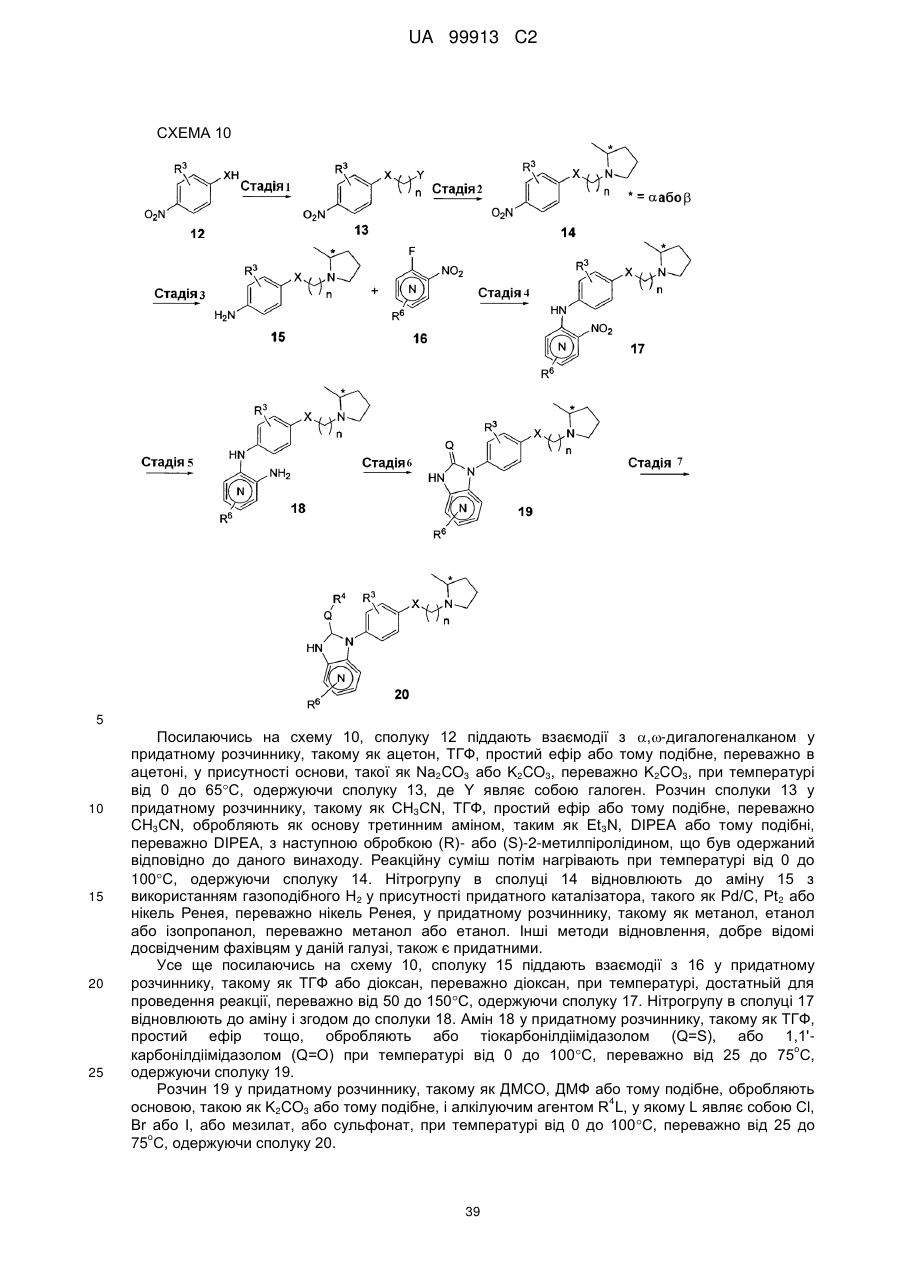
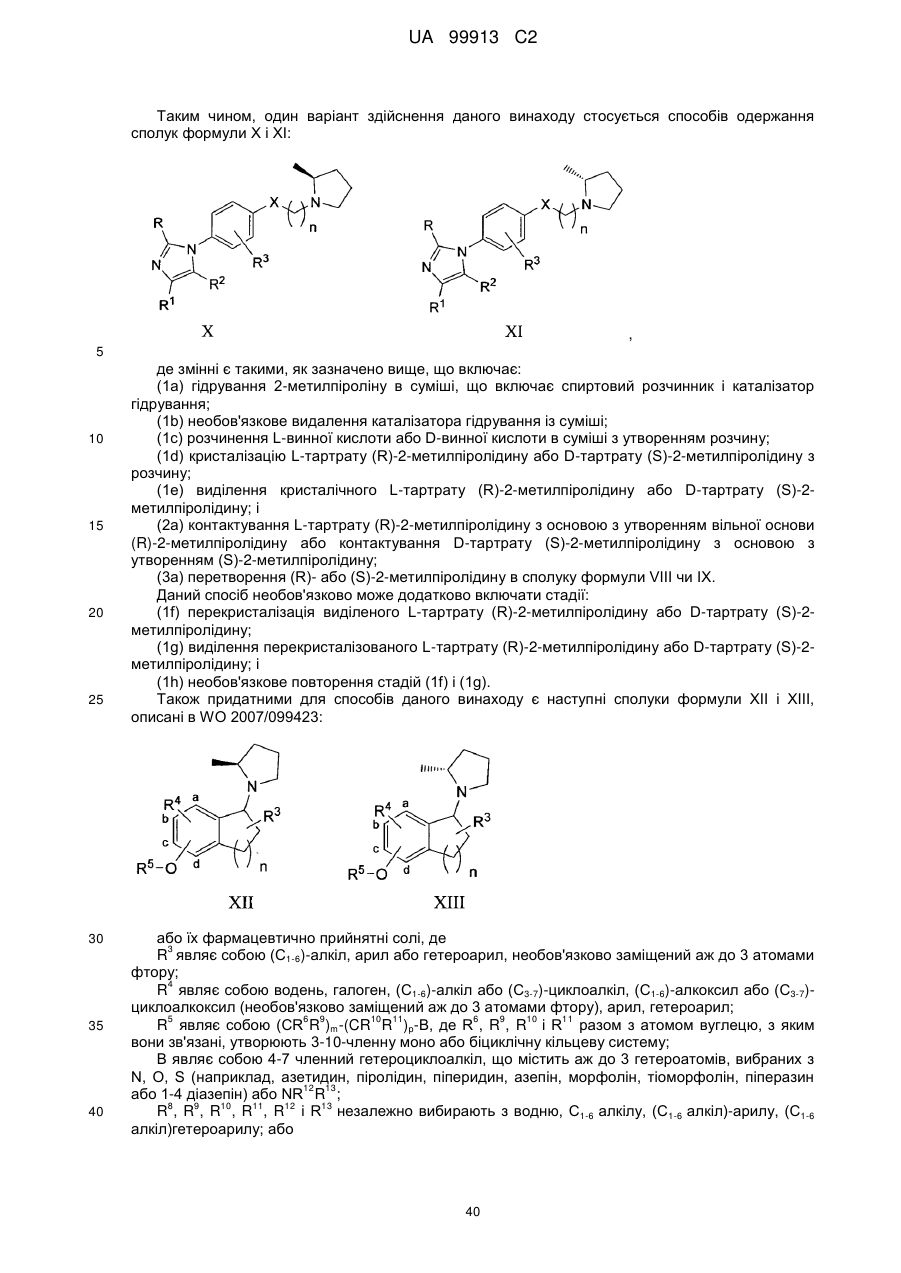
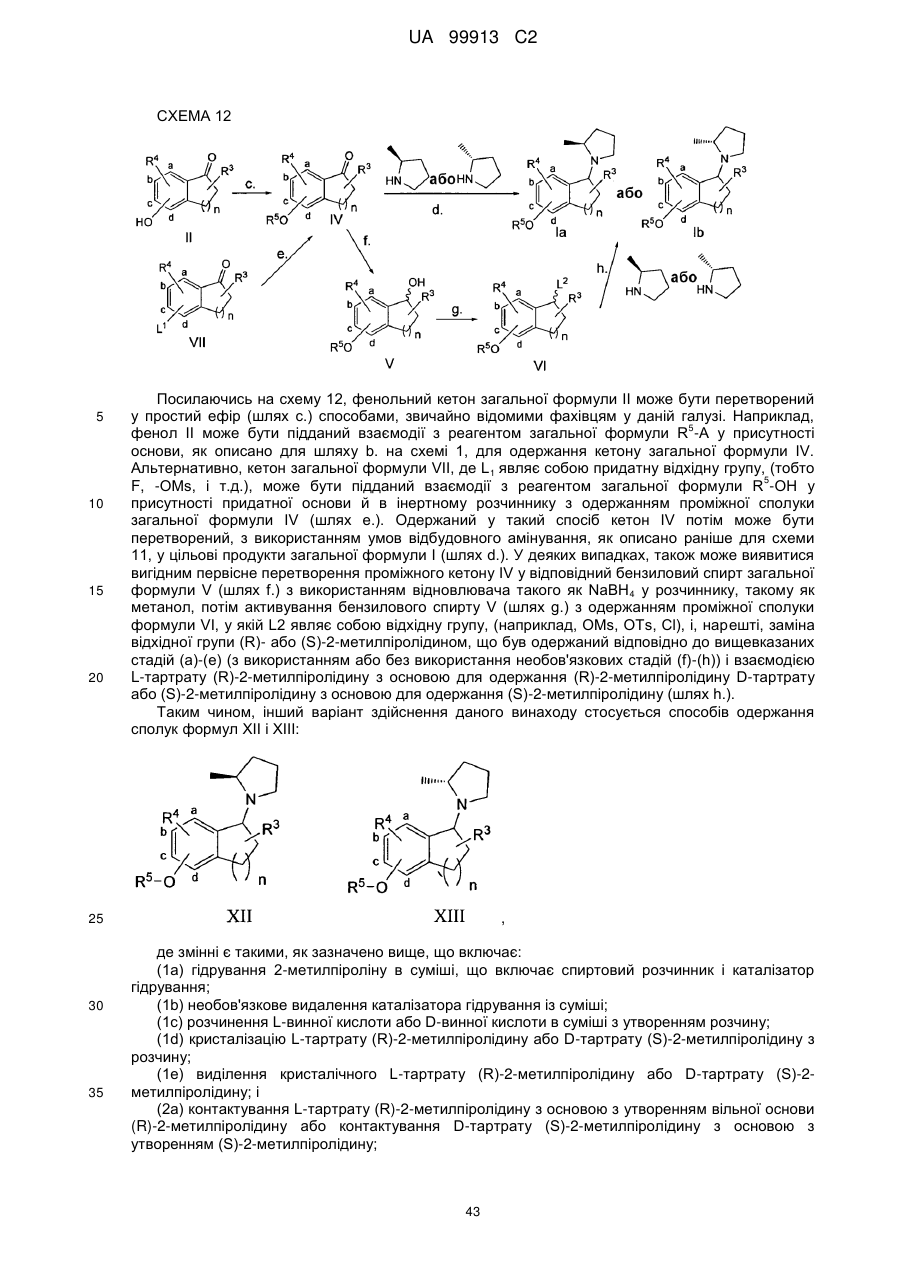
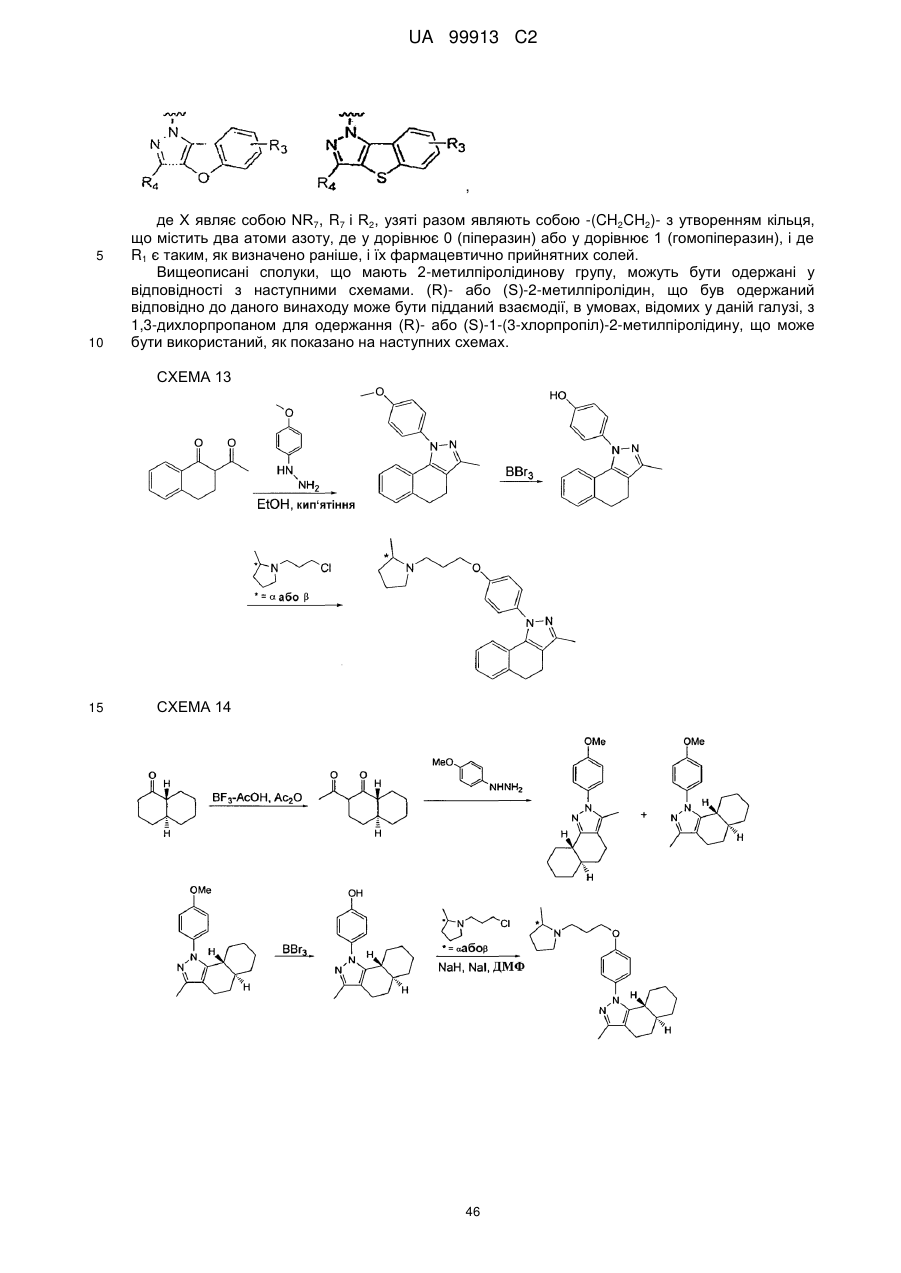
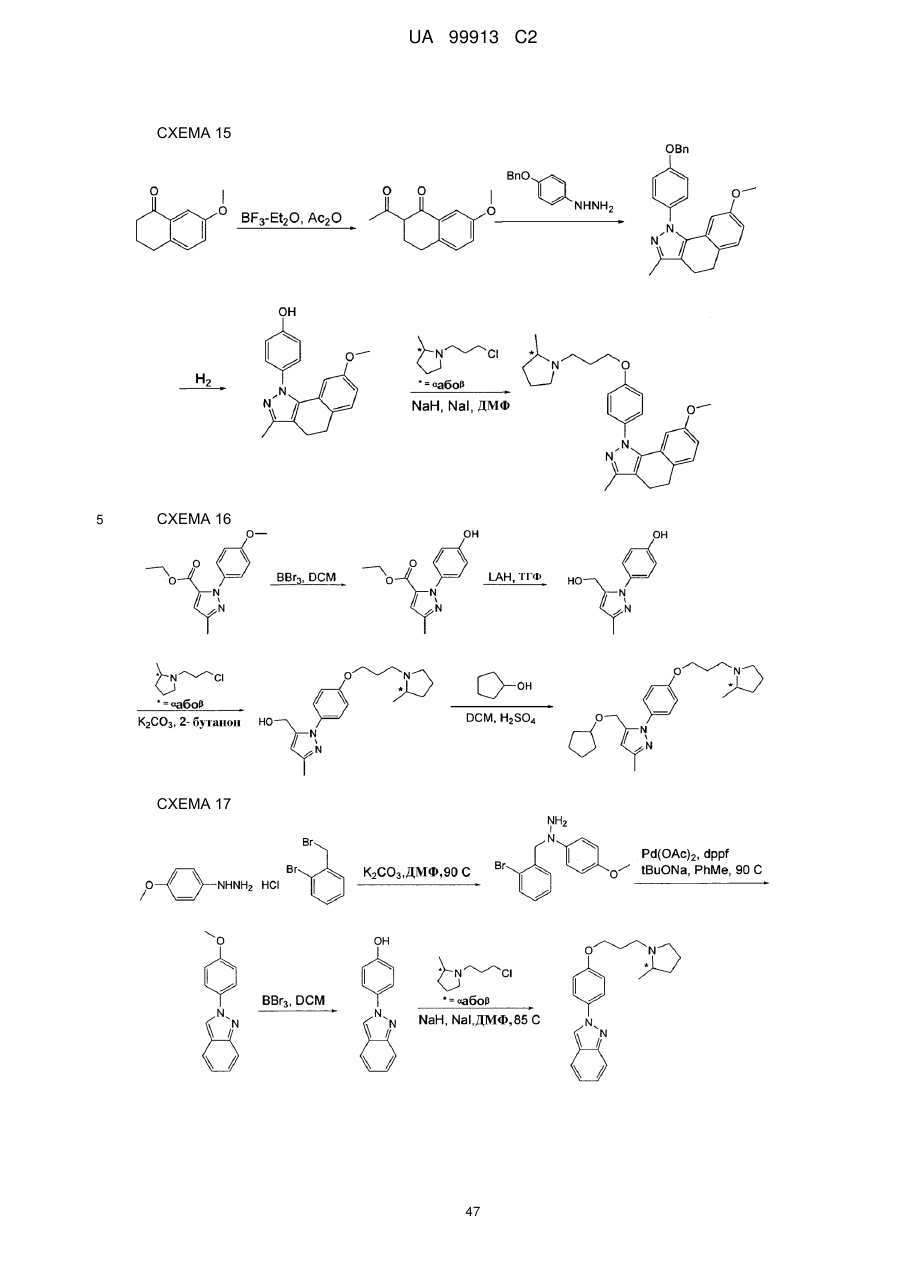
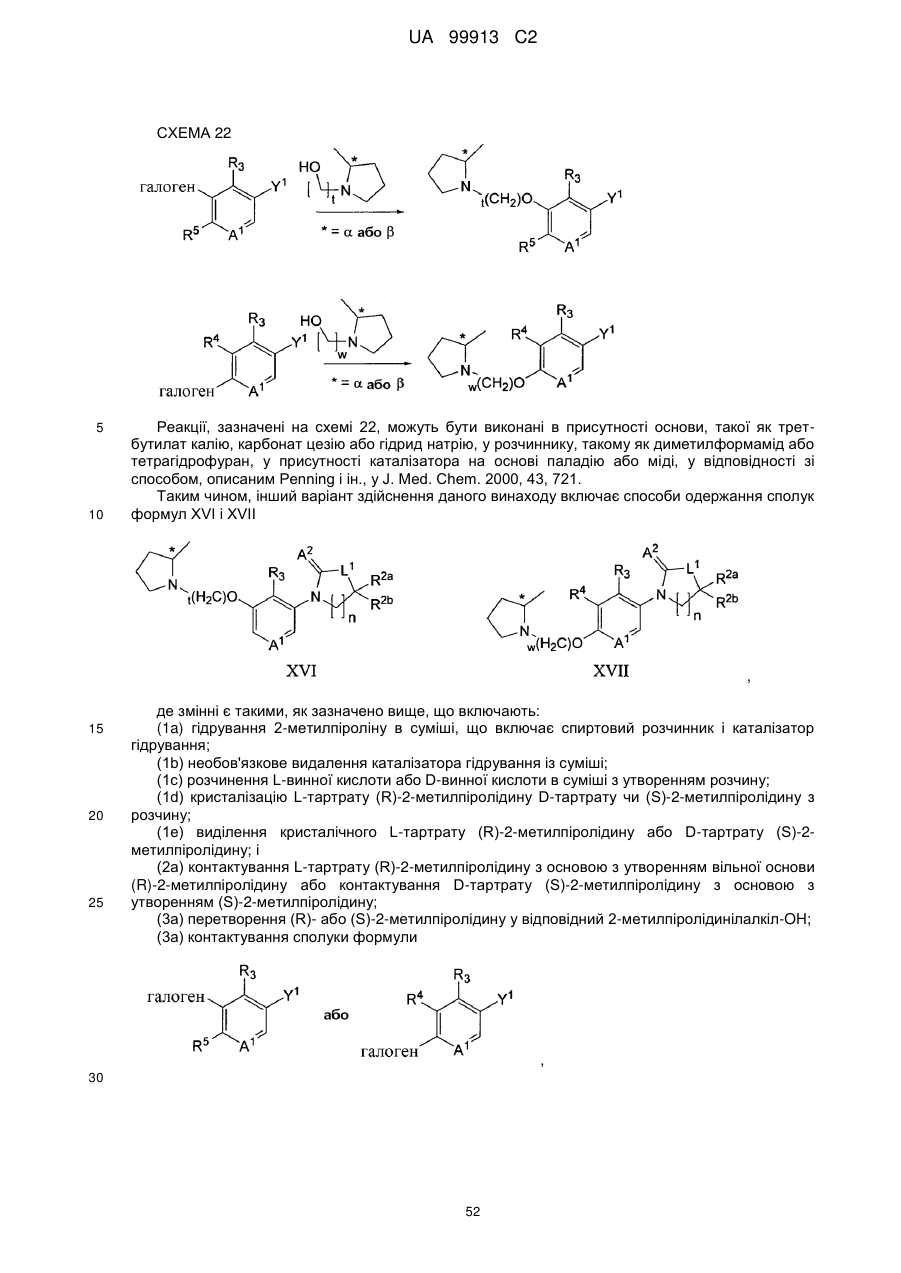
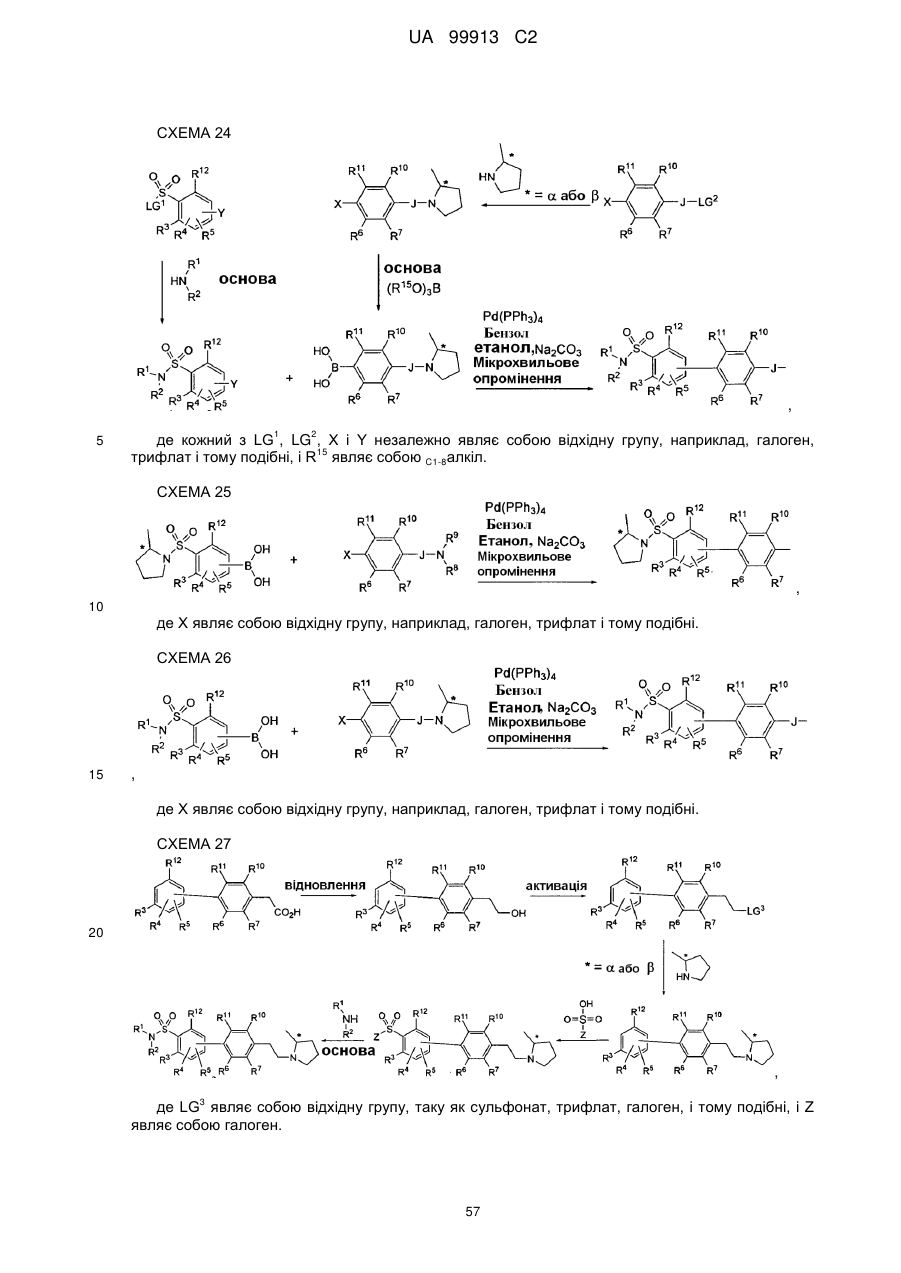
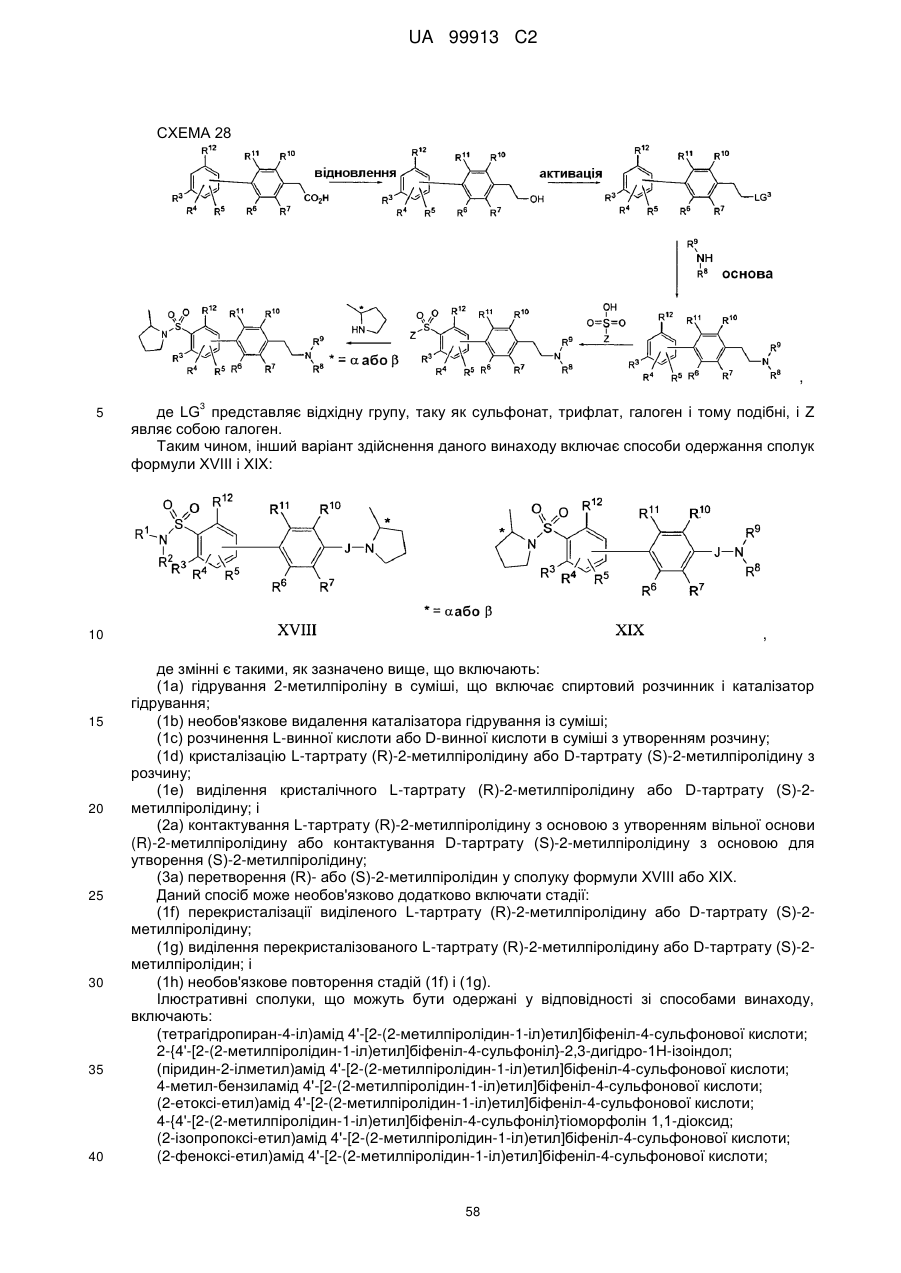
Спосіб одержання 6-{4-[3-((r)-2-метилпіролідин-1-іл)пропокси]феніл}-2н-піридазин-3-ону та його солей
Формула / Реферат
1. Спосіб одержання 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2Н-піридазин-3-ону:
 ,
,
або його фармацевтично прийнятної солі,
в якому здійснюють стадії:
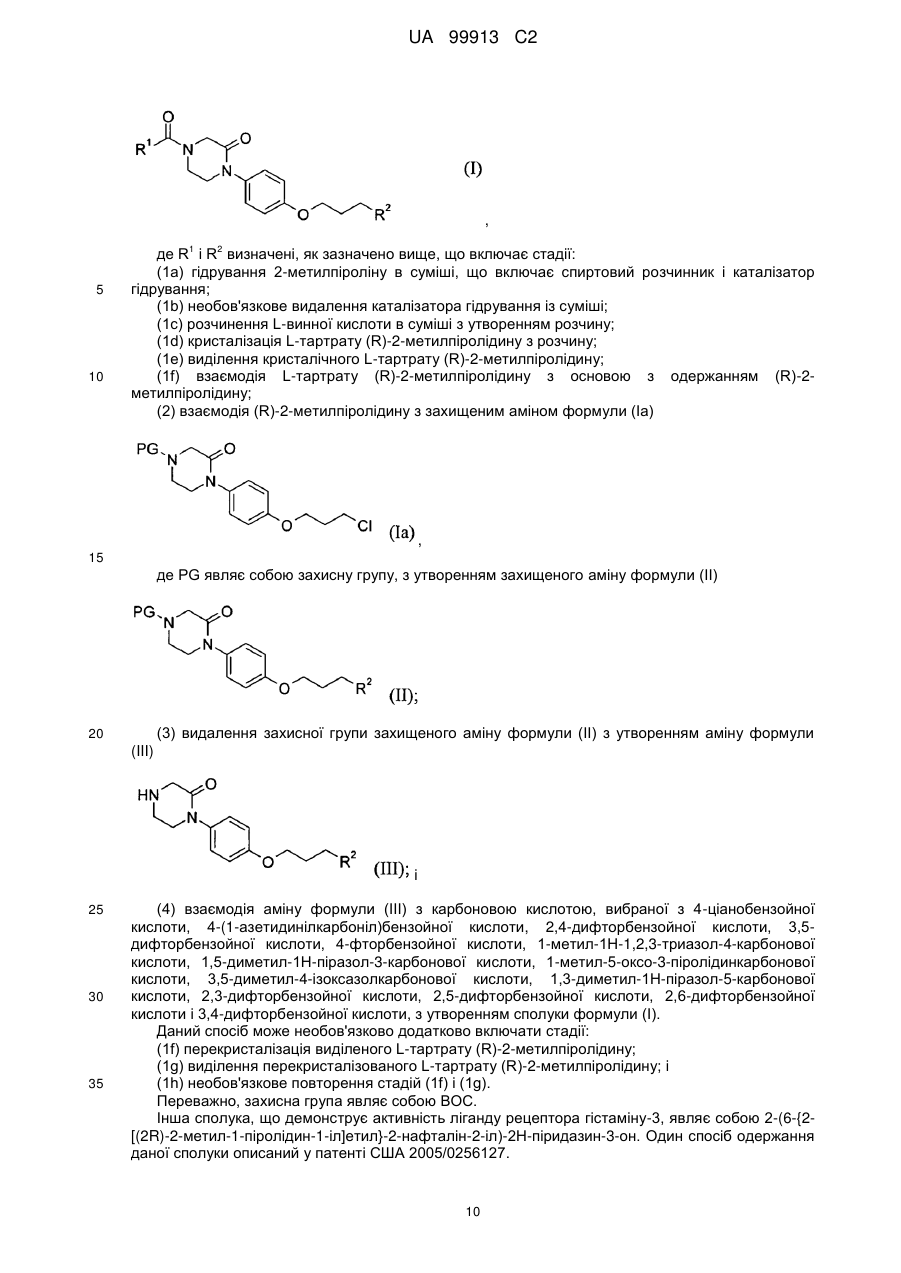
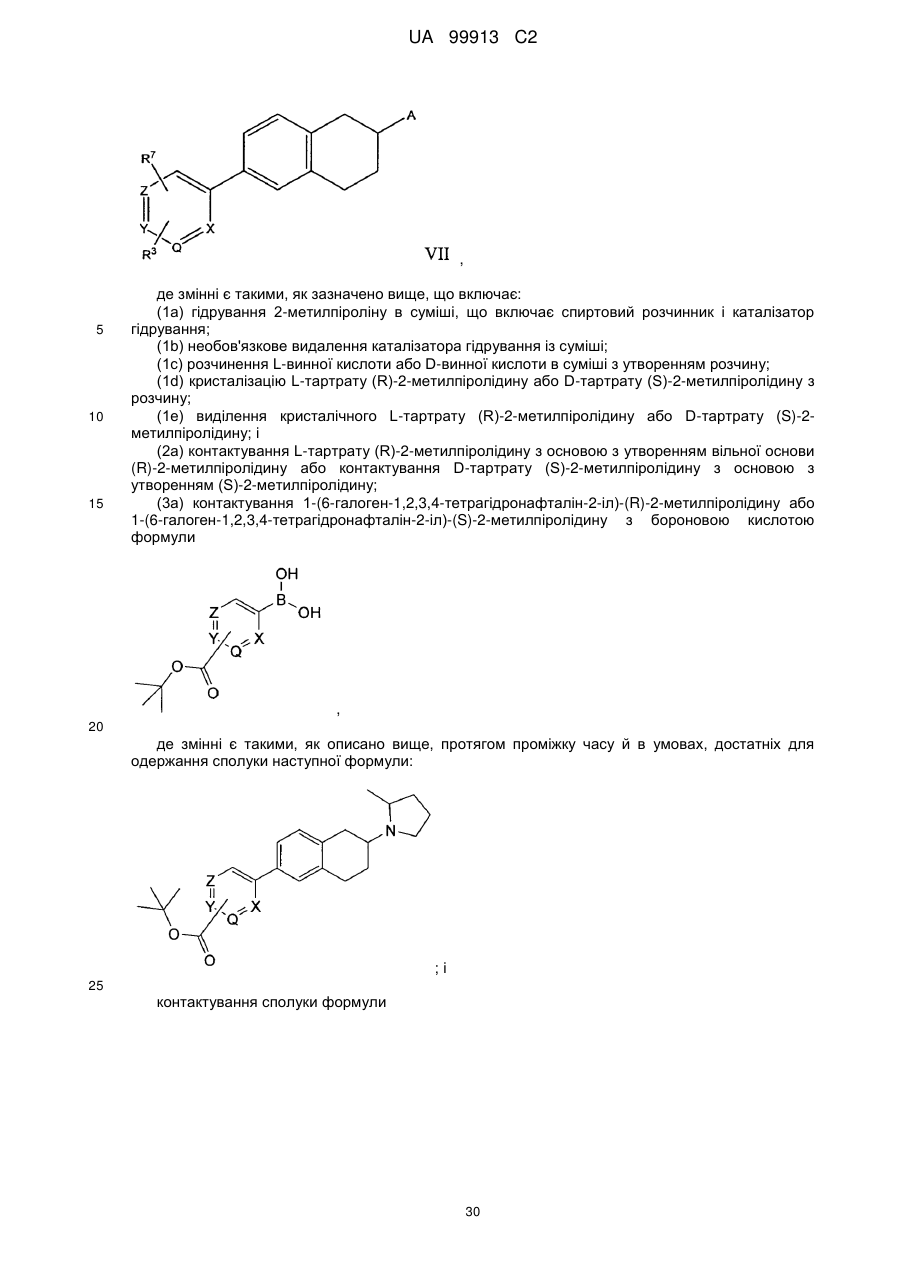
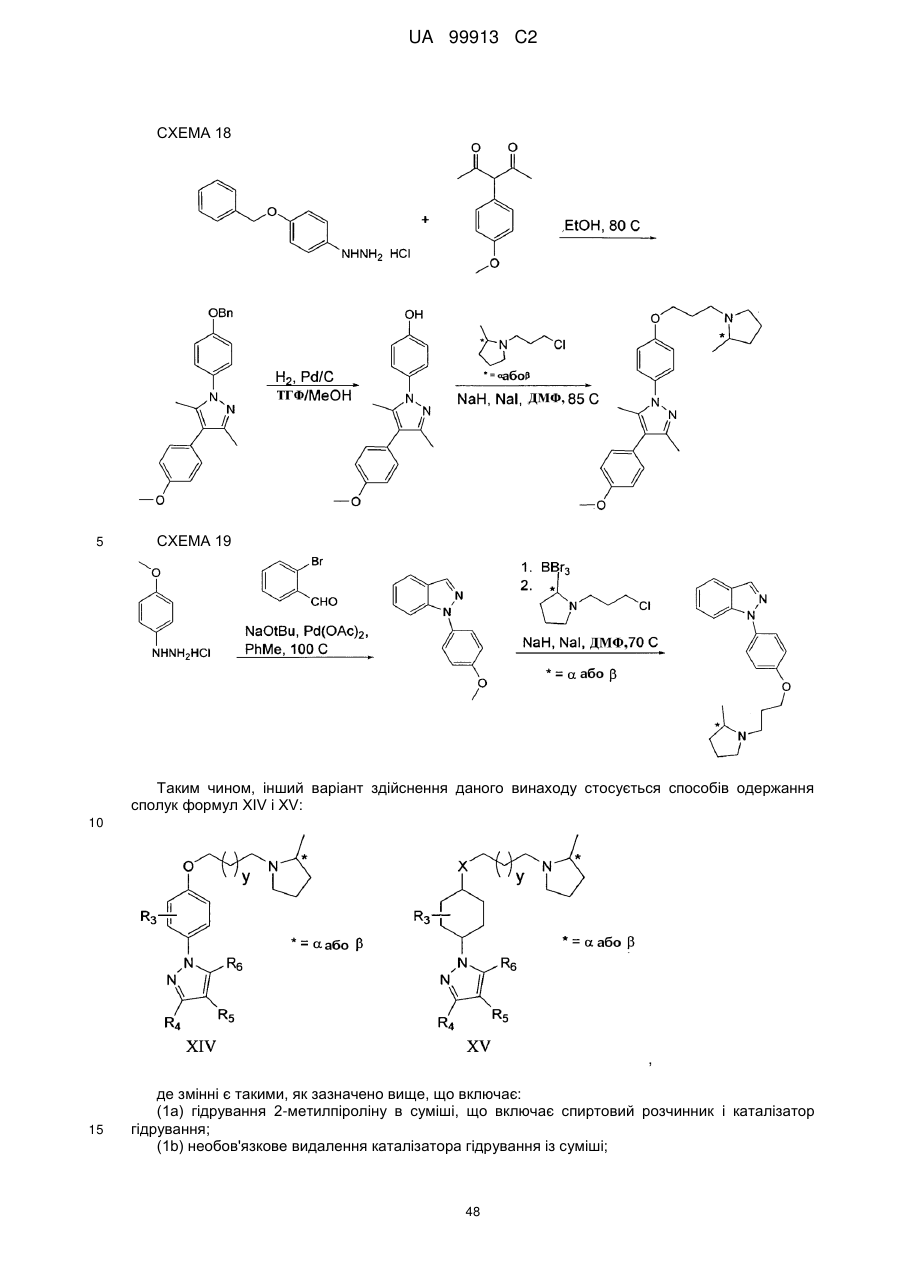
(1а) гідрування 2-метилпіроліну в суміші, яка включає спиртовий розчинник і каталізатор гідрування;
(1b) необов'язково видалення каталізатора гідрування з суміші;
(1с) розчинення L-винної кислоти у суміші з утворенням розчину;
(1d) кристалізації L-тартрату (R)-2-метилпіролідину з розчину;
(1е) виділення кристалічного L-тартрату (R)-2-метилпіролідину; і
(2) взаємодії L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2-метилпіролідину; і
(3) взаємодії (R)-2-метилпіролідину з 6-[4-(3-галогенпропокси)феніл]-2Н-піридазин-3-оном протягом часу і в умовах, достатніх для утворення (R)-6-{4-[3-(2-метилпіролідин-1-іл)пропокси]феніл}-2Н-піридазин-3-ону.
2. Спосіб за п. 1, в якому здійснюють додатково стадію перетворення продукту зі стадії 3 в його HCl-сіль.
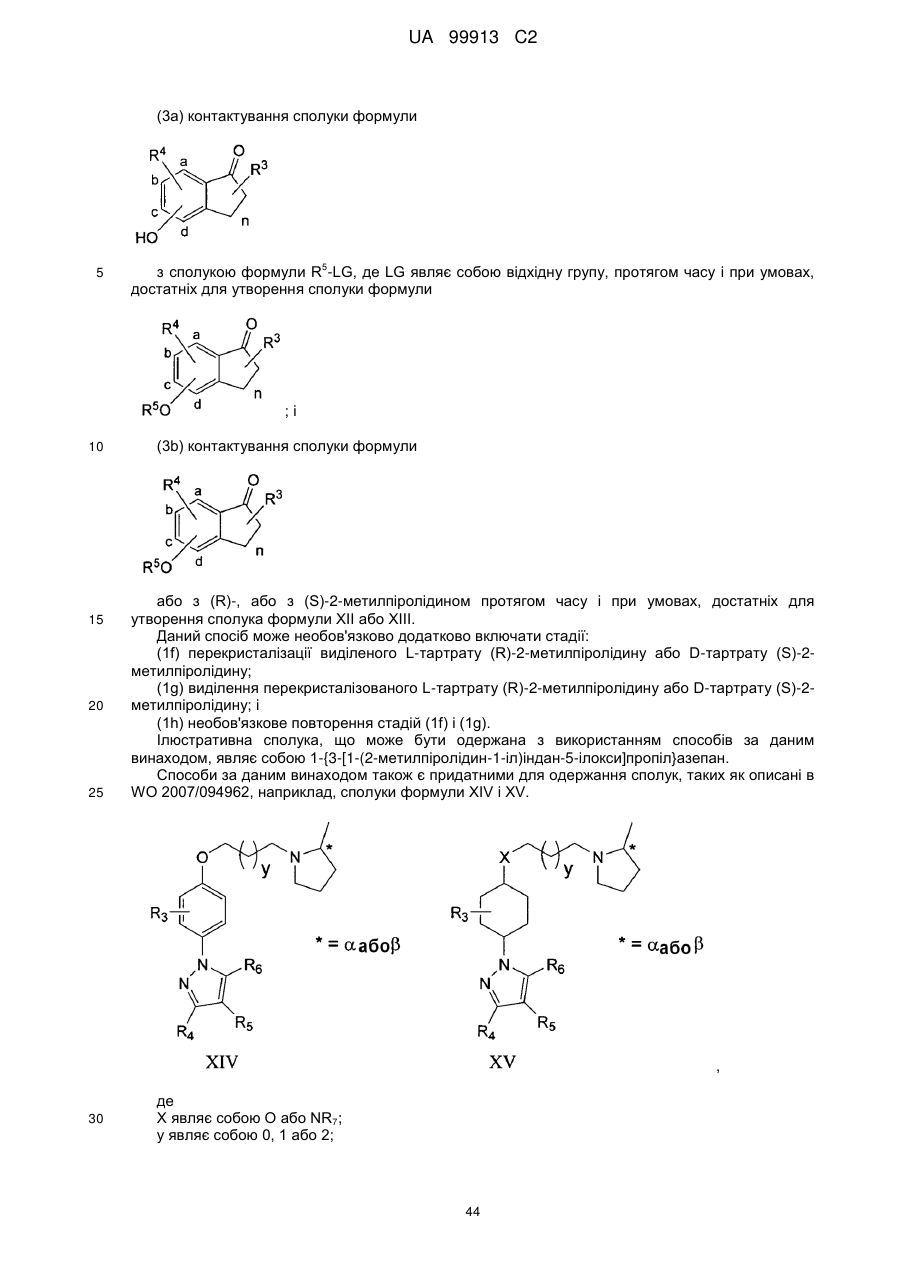
3. Спосіб за п. 1 або 2, де 6-[4-(3-галогенпропокси)феніл]-2Н-піридазин-3-он одержують стадіями, які включають:
(a) контактування 1-(4-гідроксифеніл)етанону з 1,3-дигалогенпропаном, протягом часу і в умовах, достатніх для утворення 1-[4-(3-галогенпропокси)феніл]етанону; і
(b) контактування 1-[4-(3-галогенпропокси)феніл]етанону з гліоксалевою кислотою протягом часу і в умовах, достатніх для одержання 6-[4-(3-галогенпропокси)феніл]-2Н-піридазин-3-ону.
4. Спосіб за п. 1 або 2, в якому здійснюють додатково стадії:
(f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину;
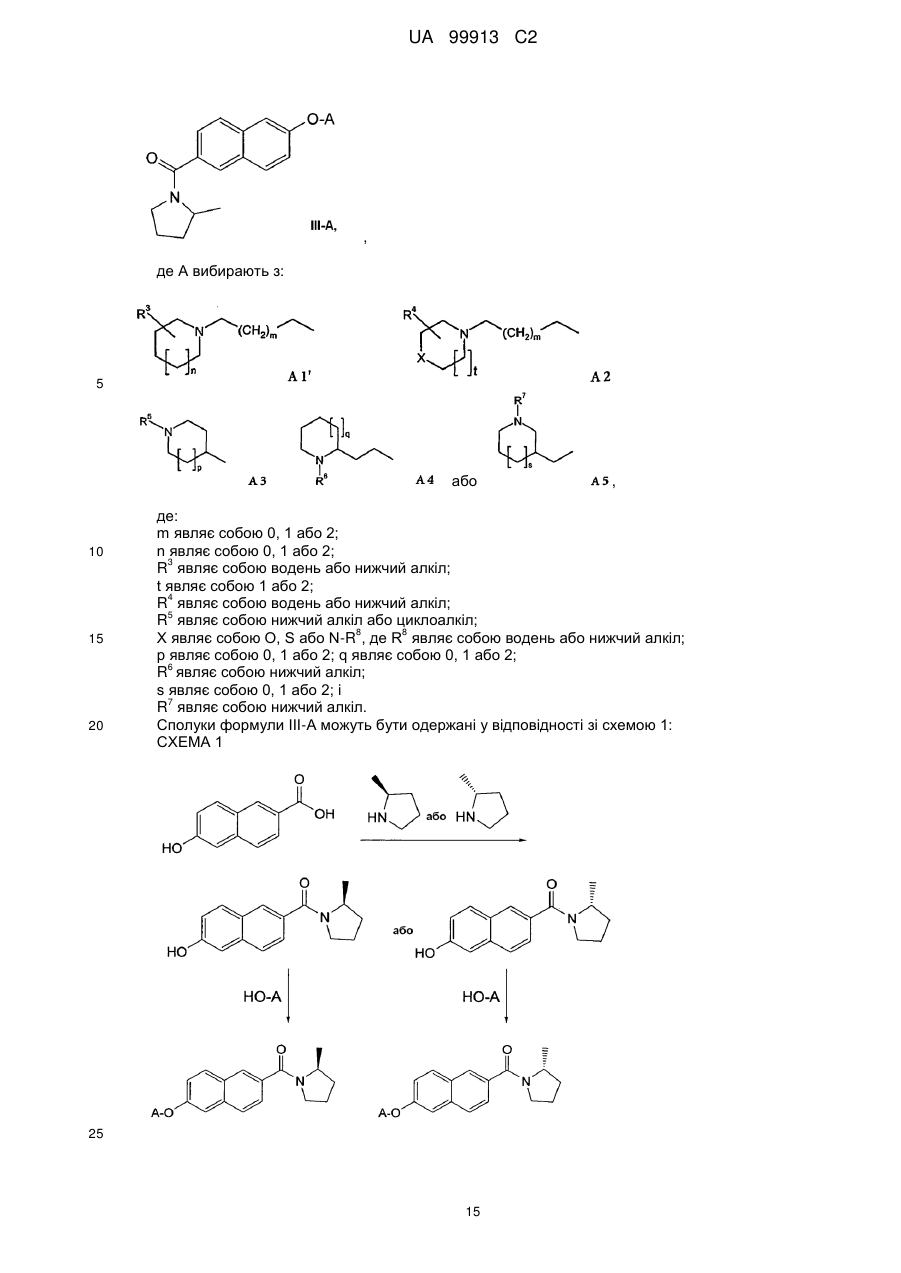
(g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину; і
(h) необов'язково повторення стадій (f) і (g).
5. Спосіб за п. 4, де виділений L-тартрат (R)-2-метилпіролідину має оптичну чистоту, що має щонайменше 50 % ее.
6. Спосіб за п. 1, де каталізатор гідрування являє собою платиновий каталізатор.
7. Спосіб за п. 6, де платиновий каталізатор являє собою 5 % Pt-C.
8. Спосіб за п. 6, де платиновий каталізатор являє собою оксид платини (IV).
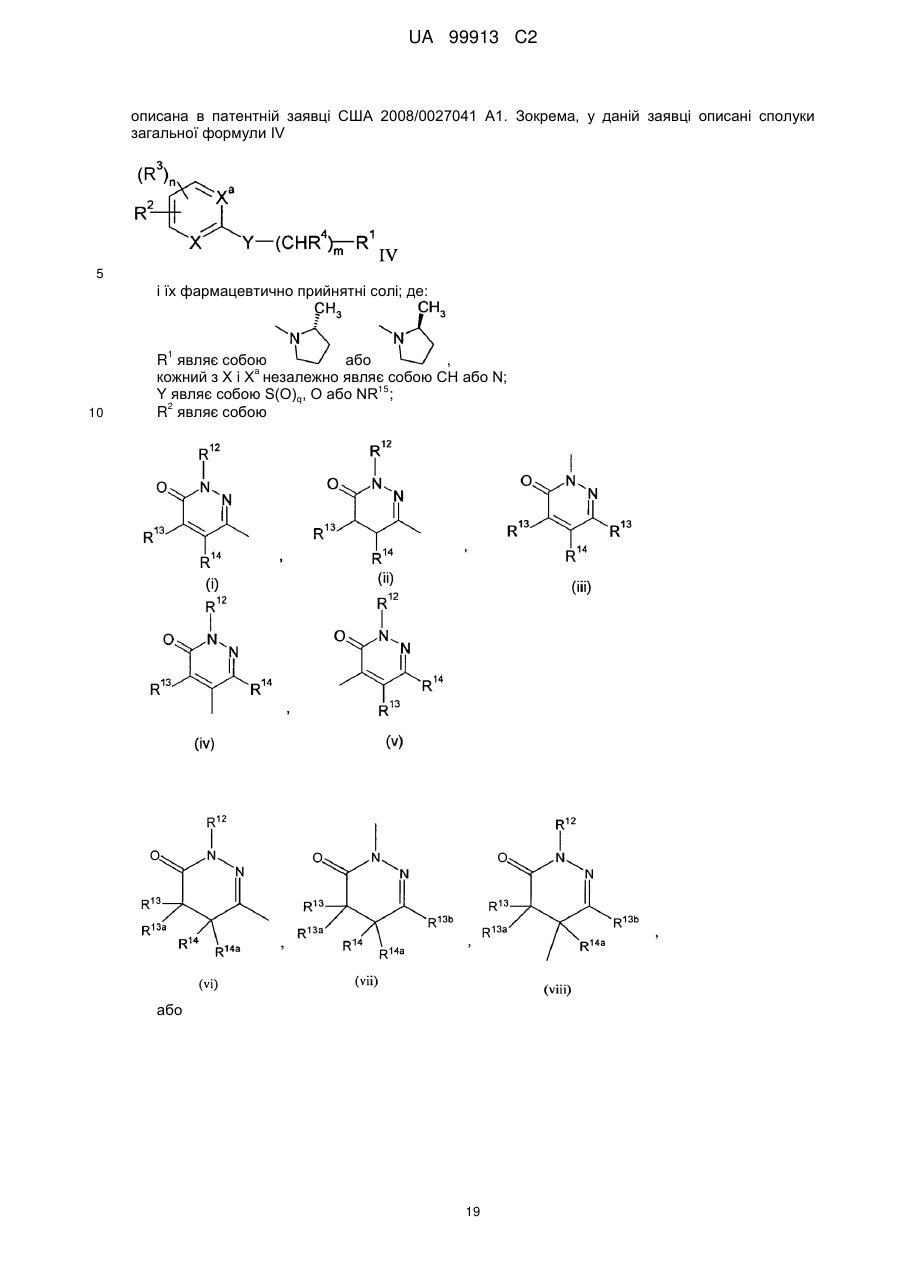
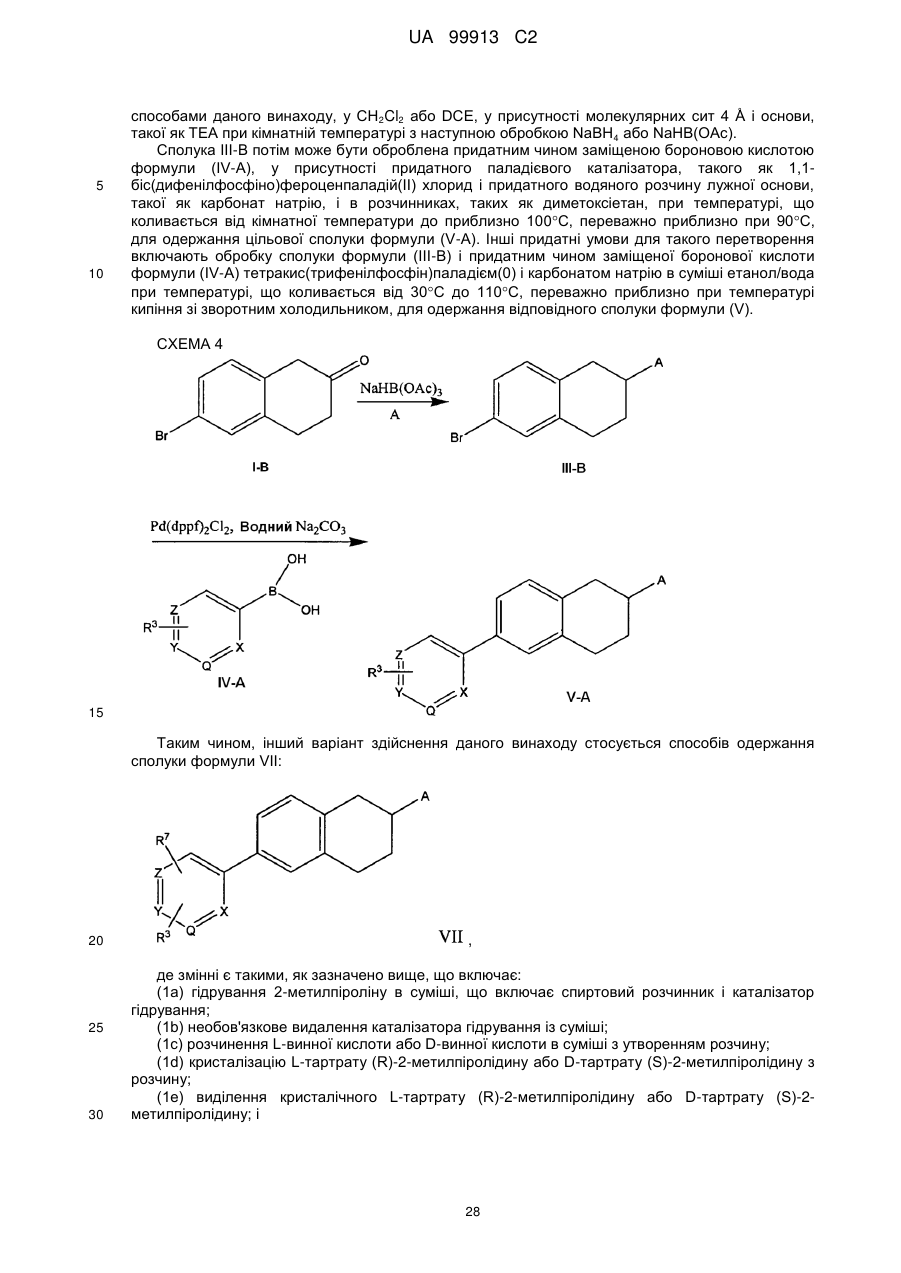
Текст
Реферат: Даний винахід стосується швидкого, безпечного, недорогого і великомасштабного способу одержання 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2Н-піридазин-3-ону та його солей. UA 99913 C2 (12) UA 99913 C2 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 ОПИС ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ Дана заявка заявляє пріоритет попередньої заявки на патент США № 60/927356, поданої 3 травня 2007 р., що цілком включена в даний опис шляхом посилання. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ (R)- і (S)-2-метилпіролідини являють собою вихідні речовини, використовувані при синтезі різних фармацевтичних продуктів. Наприклад, (R)-2-метилпіролідин можна використовувати для одержання багатьох лігандів рецептора H3. З цієї причини існує великий інтерес до розробки недорогих по вартості способів одержання (R)- і (S)-2-метилпіролідинІв. Однак у раніше розроблених способах або використовуються дорогі вихідні речовини, або для їх здійснення необхідна множина стомлюючих синтетичних стадій. Pu і ін. (Org. Process Res. & Dev., 2005, 9, 45-50) описують одержання L-тартрату (R)-2метилпіролідину, основане на дробовій кристалізації рацемічного 2-метилпіролідину в присутності L-винної кислоти. Вартість рацемічного 2-метилпіролідину становить приблизно 20 $ (доларів США) за грам. Van de Kuil і ін. (Recl. Trav. Chim. Pays-Bas, 1994, 113, 267-277) описують чотири (4) стадійний синтез L-тартрату (R)-2-метилпіролідину і D-тартрату (S)-2-метилпіролідину з 2метилпіроліну (зразкова вартість 5 $/грам). Однак спосіб є невигідним з ряду причин. По-перше, у способі потрібно одержання трьох проміжних сполук, дві з яких варто виділяти. Крім того, у способі потрібно виділення проміжної солі HCl за допомогою видалення у вакуумі крижаної оцтової кислоти і надлишку 37% водної хлористоводневої (соляної) кислоти, що являє собою потребуючий багато часу, дорогий і корозійний процес. Більше того, при такому синтезі потрібне виділення проміжної сполуки шляхом двох послідовних флеш-перегонок від гідроксиду калію. Ku і ін. (Tetrahedron, 2006, 62, 4584-4589) описують чотири (4) стадійний синтез гідрохлориду (R)-2-метилпіролідину з N-Boc-L-пролінолу. Спосіб є невигідним з ряду причин. По-перше, у способі потрібне одержання і виділення трьох різних синтетичних проміжних сполук. По-друге, у способі використовується шкідливий для навколишнього середовища розчинник дихлорметан, а також корозійна газоподібна хлористоводнева кислота і фосфорна кислота. По-третє, у способі використовується дорогий йодид літію (зразкова вартість 13 $/грам). Крім того, одержана гідрохлоридна сіль є дуже гігроскопічною. Zhao і ін. (J. Org. Chem., 2006, 71, 4336-4338) описують чотири (4) стадійний синтез бензолсульфонату (R)-2-метилпіролідину з N-Boc-L-проліну. Спосіб є невигідним з ряду причин. По-перше, у способі потрібно одержання і виділення трьох (3) окремих синтетичних проміжних сполук. По-друге, у способі використовуються корозійні реагенти, такі як фосфорна кислота, ефірат трифтористого бору, гідроксид натрію, боргідрид натрію і Супер-Гідрид® (SuperHydride®). Існує необхідність у способі одержання (R)- і (S)-2-метилпіролідинів, що був би нетривалим, безпечним, недорогим, комерційно великомасштабним і який можна було б здійснювати без необхідності виділення множини синтетичних проміжних сполук. КОРОТКИЙ ВИКЛАД СУТНОСТІ ВИНАХОДУ Авторами даної заявки несподівно було встановлено, що L-тартрат (R)-2-метилпіролідину і D-тартрат (S)-2-метилпіролідину можуть бути одержані в двох стадіях з недорогого 2метилпіроліну з використанням некорозійних реагентів без необхідності виділення яких-небудь синтетичних проміжних сполук. В одному варіанті здійснення, даний винахід стосується способу одержання L-тартрату (R)-2-метилпіролідину, що включає стадії: (a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (b) необов'язкове видалення каталізатора гідрування із суміші; (c) розчинення L-винної кислоти в суміші з утворенням розчину; (d) кристалізація L-тартрату (R)-2-метилпіролідину з розчину; і (e) виділення кристалічного L-тартрату (R)-2-метилпіролідину. Переважно каталізатор гідрування являє собою платиновий каталізатор. Переважно платиновий каталізатор являє собою оксид платини (IV). Більш переважно, платиновий каталізатор являє собою 5% Pt-C. Переважно, спиртовий розчинник являє собою суміш етанолу і метанолу. Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні від приблизно 2:1 до приблизно 3:1 (об./об.). Переважно, стадію (a) здійснюють при температурі навколишнього середовища. Переважно, платиновий каталізатор видаляють на стадії (b) шляхом фільтрування. 1 UA 99913 C2 5 10 15 Переважно, виділений L-тартрат (R)-2-метилпіролідину має оптичну чистоту, що має щонайменше 50% ee (енантіомерний надлишок). Необов'язково, процес додатково включає стадії: (f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину; (g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину; і (h) необов'язкове повторення стадій (f) і (g). Необов'язково, спосіб додатково включає стадію взаємодії виділеного перекристалізованого L-тартрату (R)-2-метилпіролідину з основою для одержання (R)-2-метилпіролідину. Переважно, спосіб додатково включає стадію перетворення одержаного L-тартрату (R)-2метилпіролідину у фармацевтичну композицію, переважно в ліганд рецептора H3, переважно 6{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он: В одному варіанті здійснення, даний винахід стосується способу одержання 6-{4-[3-((R)-2метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-ону: , 20 25 30 35 40 45 що включає стадії: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти в суміші з утворенням розчину; (1d) кристалізація L-тартрату (R)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину; і (2) взаємодія L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2метилпіролідину; і (3) взаємодія (R)-2-метилпіролідину з 6-[4-(3-галогенпропокси)феніл]-2H-піридазин-3-оном протягом проміжку часу й в умовах, достатніх для утворення (R)-6-{4-[3-(2-метилпіролідин-1іл)пропокси]феніл}-2H-піридазин-3-ону. Переважно, 6-[4-(3-галогенпропокси)феніл]-2H-піридазин-3-он одержують з використанням наступних стадій: (a) контактування 1-(4-гідроксифеніл)етанону з 1,3-дигалогенпропаном, протягом проміжку часу й в умовах, достатніх для утворення 1-[4-(3-галогенпропокси)феніл]етанону; і (b) контактування 1-[4-(3-галогенпропокси)феніл]етанону з гліоксалевою кислотою протягом проміжку часу й в умовах, достатніх для одержання 6-[4-(3-галогенпропокси)феніл]-2Hпіридазин-3-ону. Даний винахід також стосується способу одержання D-тартрату (S)-2-метилпіролідину, що включає стадії: (a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (b) необов'язкове видалення каталізатора гідрування із суміші; (c) розчинення D-винної кислоти в суміші з утворенням розчину; (d) кристалізація D-тартрату (S)-2-метилпіролідину з розчину; і 2 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 (e) виділення кристалічного D-тартрату (S)-2-метилпіролідину. Переважно каталізатор гідрування являє собою платиновий каталізатор. Переважно платиновий каталізатор являє собою оксид платини (IV). Більш переважно, платиновий каталізатор являє собою 5% Pt-C. Переважно, спиртовий розчинник являє собою суміш етанолу і метанолу. Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні від приблизно 2:1 до приблизно 3:1 (об./об.). Переважно, стадію (a) здійснюють при температурі навколишнього середовища. Переважно, платиновий каталізатор видаляють на стадії (b) шляхом фільтрування. Переважно, виділений L-тартрат (R)-2-метилпіролідину має оптичну чистоту, що становить щонайменше 50% ee. Необов'язково, спосіб додатково включає стадії: (f) перекристалізація виділеного D-тартрату (S)-2-метилпіролідину; (g) виділення перекристалізованого D-тартрату (S)-2-метилпіролідину; і (h) необов'язкове повторення стадій (f) і (g). Необов'язково, спосіб додатково включає стадію взаємодії виділеного перекристалізованого D-тартрату (S)-2-метилпіролідину з основою з одержанням (S)-2-метилпіролідину. Необов'язково, спосіб додатково включає стадію перетворення одержаного D-тартрату (S)-2метилпіролідину в ліганд рецептора H3, переважно 6-{4-[3-((S)-2-метилпіролідин-1іл)пропокси]феніл}-2H-піридазин-3-он: ДОКЛАДНИЙ ОПИС ВИНАХОДУ Визначення Вираз «зразково» стосується діапазону величин 10% від визначеної величини; наприклад, вираз «зразково 50» включає 10% від 50, або від 45 до 55. Термін «спиртовий розчинник» стосується C1-C6алкілового спирту або суміші C1-C6алкілових спиртів. Термін «промисловий масштаб» стосується окремої порції, що становить щонайменше 500 грамів. Термін «кристалізація» стосується процесу, що викликає утворення кристалів. Термін «ліганд рецептора Н3» стосується сполуки, що взаємодіє з рецептором гістаміну Н 3 як антагоніста, агоніста або часткового агоніста. Термін «гетерогенний каталізатор» стосується каталізатора гідрування, що є нерозчинним у спиртовому розчиннику. Термін «гомогенний каталізатор» стосується каталізатора гідрування, що розчинний у спиртовому розчиннику. Термін «каталізатор гідрування» стосується композиції, що придатна для каталізу реакції 2метилпіроліну з воднем з утворенням 2-метилпіролідину. Термін «виділення» стосується відділення компонента (наприклад, реагенту або продукту) із суміші. Термін «оптична чистота» стосується частки одного енантіомера в суміші енантіомерів, і виражається у вигляді енантіомерного надлишку (% ee), що визначають як ((R-S(/(R+S))* 100%, де R і S являють собою відповідні фракції енантіомерів, так що R+S=1. Термін «фармацевтичний продукт» стосується сполуки чи композиції, який можна використовувати для лікування захворювання, хворобливого стану чи порушення в людини. Термін «платиновий каталізатор» стосується каталізатора гідрування, що містить платину. Термін «очищення» стосується підвищення чистоти сполуки. Термін «чистота» стосується відсотків по вазі одного компонента в суміші. Термін «розчин» стосується розчинника, що містить речовину(и), що щонайменше частково розчинена в ньому; і який може містити нерозчинену (наприклад, тверду) речовину(и). 3 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 Усі згадані в даній заявці публікації включені в ній шляхом посилання у всій своїй повноті у всіх цілях. Опис Даний винахід стосується способів одержання L-тартрату (R)-2-метилпіролідину або Dтартрату (S)-2-метилпіролідину, що включає стадії: (a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (b) необов'язкове видалення каталізатора гідрування із суміші; (c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (d) кристалізація L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; і (e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину. Стадія (a) На стадії (а) 2-метилпіролін гідрують у суміші, що включає алкіловий спиртовий розчинник і каталізатор гідрування. 2-метилпіролін, використовуваний у реакції гідрування, може бути одержаний з комерційних джерел (наприклад, Sigma-Aldrich Corp.; St. Louis, MO). Важливим достоїнством даного способу є те, що 2-метилпіролін є менш дорогим, ніж інші вихідні речовини, використовувані для одержання (R)- і (S)-2-метилпіролідину. Каталізатор гідрування, використовуваний у реакції, може бути одержаний з комерційних джерел (наприклад, Sigma-Aldrich Corp.; St. Louis, MO). Каталізатор гідрування може являти собою гомогенний каталізатор або гетерогенний каталізатор. Приклади каталізаторів гідрування включають, але не обмежуються зазначеним, платинові каталізатори. Приклади платинових каталізаторів включають, але не обмежуються зазначеним, платину на вугіллі (Pt/C), оксид платини (IV) і їх суміші. Приклади гомогенних каталізаторів включають, але не обмежуються зазначеним, хлортрис(трифенілфосфін)родій (каталізатор Вілкінсона) і каталізатори, описані в патентах США №№ 4581417, 4631315 і 5670437. Переважно, каталізатор гідрування являє собою оксид платини (IV). Більш переважно, каталізатор гідрування являє собою 5% Pt-C. Спиртовий розчинник, використовуваний у реакції являє собою C 1-C6алкіловий спирт або суміш C1-C6алкілових спиртів. Приклади C1-C6алкілових спиртів включають, але не обмежуються зазначеним, метанол, етанол, ізопропанол і н-бутанол. Переважно, спиртовий розчинник включає етанол. Переважно, спиртовий розчинник включає метанол. Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу. Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні від приблизно 0,5:1 до приблизно 10:1 (об./об.). Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні від приблизно 1:1 до приблизно 5:1 (об./об.). Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні від приблизно 2:1 до приблизно 3:1 (об./об.). Більш переважно, спиртовий розчинник являє собою суміш етанолу і метанолу в співвідношенні приблизно 2,4:1 (об./об.). Спиртовий розчинник може бути присутнім у будь-якій придатній кількості в реакційній суміші на стадії (а). Переважно, спиртовий розчинник становить щонайменше приблизно 50% (ваг./ваг.) реакційної суміші. Більш переважно, спиртовий розчинник становить щонайменше приблизно 70% (ваг./ваг.) реакційної суміші. Більш переважно, спиртовий розчинник становить щонайменше приблизно 90% (ваг./ваг.) реакційної суміші. Більш переважно, спиртовий розчинник становить щонайменше приблизно 95% (ваг./ваг.) реакційної суміші. Примітно, C 1C6алкілові спирти більш легко видаляють з реакційної суміші в порівнянні з оцтовою кислотою. Крім того, C1-C6алкілові спирти не є корозійними. Водень (H2), використовуваний у реакції гідрування може бути доданий до реакційної суміші у вигляді газу, як, наприклад, при проведенні реакції в атмосфері водню, або його можна одержати in situ, як наприклад, при обробці H2PtCl6 або RhCl3 з використанням NaBH4 (див. Brown and Sivasankaran, J. Am. Chem. Soc. 1962, 84, 2828). У деяких варіантах здійснення реакцію гідрування проводять шляхом додавання газоподібного водню до реакційної суміші. У переважних варіантах здійснення гідрування проводять при тиску вище атмосферного. У деяких варіантах здійснення реакцію проводять при одержанні водню in situ. Реакцію гідрування можна проводити при будь-якій придатній температурі. Переважно, реакцію проводять при температурі навколишнього середовища. Перевага даного способу полягає в тому, що реакцію гідрування проводять у некорозійному спиртовому розчиннику. Інша перевага даного способу полягає в тому, що продукт реакції гідрування (тобто 2-метилпіролідин) одержують безпосередньо без необхідності одержання або виділення проміжних сполук, таких як проміжні солі. 4 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія (b) Стадія (b) являє собою необов'язкову стадію. На стадії (b) каталізатор гідрування видаляють з реакційної суміші, одержаної при гідруванні. Переважно, каталізатор гідрування видаляють з реакційної суміші, одержаної при гідруванні, після стадії (a). Переважно, стадію (b) здійснюють перед стадією (d), особливо, коли каталізатор гідрування являє собою гетерогенний каталізатор. Придатні методи видалення каталізатора гідрування включають, але не обмежуються зазначеним, фільтрування, декантацію і центрифугування. У деяких варіантах здійснення каталізатор гідрування видаляють за допомогою фільтрування. Незважаючи на те, що основою каталізаторів гідрування звичайно є дорогоцінні метали, перевага даного винаходу полягає в тому, що каталізатор гідрування може бути вилучений із суміші, підданий рециклізації і повторно використаний у наступних реакціях гідрування (див., наприклад, патент США 5554353 (Schneider et al.); EP 1739104 A1 (Kobayashi et al.); Setty-Fichman, і ін., J Mol. Cat. A: Chem., 1999, 144(1), 159-163. Стадія (c) На стадії (c), L-винну кислоту або D-винну кислоту розчиняють у реакційній суміші, одержаній при гідруванні, з утворенням розчину. Якщо цільовий продукт являє собою (R)-2метилпіролідин, то використовують L-винну кислоту. Якщо цільовий продукт являє собою (S)-2метилпіролідин, то використовують D-винну кислоту. L-винна кислота або D-винна кислота, використовувані в даому способі, можуть бути одержані з комерційних джерел (наприклад, Sigma-Aldrich Corp.; St. Louis, MO). Переважно, розчин, одержаний на стадії (c), є гомогенним. Якщо розчин не є гомогенним (наприклад, містить нерозчинені частки), розчин переважно нагрівають, щоб сприяти розчиненню. Перевага даного способу полягає в тому, що в ньому не потрібне виділення з реакційної суміші 2-метилпіролідину, одержаного реакцією гідрування, перед додаванням винної кислоти. Це робить спосіб більш простим, більш швидким, менш дорогим і маючим менше відходів у порівнянні зі способами, відомими раніше в даній галузі. Стадія (d) На стадії (d) L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину кристалізують з розчину, одержаного на стадії (c). Якщо L-винну кислоту додають на стадії (c), то L-тартрат (R)-2-метилпіролідину кристалізують з розчину на стадії (d). Якщо D-винну кислоту додають на стадії (c), то D-тартрат (S)-2-метилпіролідину кристалізують з розчину на стадії (d). Для кристалізації L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину можна використовувати будь-як придатний спосіб. У деяких варіантах здійснення розчин нагрівають для того, щоб сприяти розчиненню, а потім охолоджують, щоб викликати кристалізацію. Стадія (e) На стадії (e) проводять виділення кристалічного L-тартрату (R)-2-метилпіролідину або Dтартрату (S)-2-метилпіролідину. Якщо L-винну кислоту додають на стадії (c), то L-тартрат (R)-2метилпіролідину кристалізують з розчину на стадії (d) і виділяють на стадії (e). Якщо D-винну кислоту додають на стадії (c), то D-тартрат (S)-2-метилпіролідину кристалізують з розчину на стадії (d) і виділяють на стадії (e). Придатні методи виділення кристалічного L-тартрату (R)-2метилпіролідину або D-тартрату (S)-2-метилпіролідину включають, але не обмежуються зазначеним, фільтрування, декнтування і центрифугування. Перевага даного способу полягає в тому, що продукт може бути виділений за допомогою простого фільтрування. Переважно, Lтартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину виділяють фільтруванням. Варто розуміти, що виділений L-тартрат (R)-2-метилпіролідину ймовірно містить деяку кількість L-тартрату (S)-2-метилпіролідину, і виділений D-тартрат (S)-2-метилпіролідину ймовірно містить деяку кількість D-тартрату (R)-2-метилпіролідину, що буде зменшувати оптичну чистоту виділеного продукту. Переважно, виділений L-тартрат (R)-2-метилпіролідину або D-тартрат (S)2-метилпіролідину має оптичну чистоту, що має щонайменше 40% ee. Більш переважно, виділений L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину мають оптичну чистоту, що має щонайменше 50% ee. Більш переважно, виділений L-тартрат (R)-2метилпіролідину або D-тартрат (S)-2-метилпіролідину має оптичну чистоту, що має щонайменше 55% ee. Необов'язкові додаткові стадії Даний спосіб одержання L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину є виграшним, оскільки в ньому використовуються недорогі і некорозійні реагенти і розчинники, його можна зручно і з невеликими витратами проводити при температурі в діапазоні від 0ºС и 25ºС, для нього необхідне одержання тільки однієї проміжної сполуки, у 5 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 ньому не потрібно виділення проміжних сполук синтезу, припустимо рециркулювання каталізатора, і він приводить до продукту, що може бути виділений простим фільтруванням і потім використаний у наступних способах. Виділений продукт являє собою адитивну сіль винної кислоти і вільної основи (R)- або (S)-2метилпіролідину. При бажанні, сіль може бути перетворена у вільну основу (R)- або (S)-2метилпіролідину. Одержана вільна основа може бути виділена з використанням методів, відомих у даній галузі. Переважно, вільна основа може утворюватися in situ і бути використана на наступній синтетичній стадії без виділення. Описані в даному винаході способи можна використовувати як для виділеної вільної основи 2-метилпіролідину, так і для вільної основи 2метилпіролідину, одержуваного in situ у реакційній суміші. Таким чином, у деяких варіантах здійснення спосіб додатково включає стадію: взаємодії виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з основою для одержання (R)-2-метилпіролідину або (S)-2-метилпіролідину. Придатні основи для використання в даній реакції включають, але не обмежуються зазначеним, гідроксид амонію, гідроксиди лужних металів (наприклад, гідроксид натрію, гідроксид калію), алкіламіни (наприклад, триетиламін, діізопропілетиламін), і їх суміші. Придатні розчинники для використання в даній реакції включають, але не обмежуються зазначеним, діетиловий ефір і дихлорметан. Крім того, вільна основа 2-метилпіролідину може бути одержана з відповідної солі винної кислоти з використанням іонообмінної смоли способами, відомими в даній галузі. Переважно, одержаний L-тартрат (R)-2-метилпіролідину, D-тартрат (S)-2-метилпіролідину, (R)-2–метилпіролідин або (S)-2-метилпіролідин має оптичну чистоту, що становить щонайменше 50% ee. Це означає, що основний енантіомер становить 75% суміші, а мінорний енантіомер - 25% (50% ee = ((0,75-0,25)/(0,75+0,25)*100%). Даний рівень чистоти часто є достатнім для того, щоб використовувати продукт як реагент у наступному синтетичному способі. Наприклад, коли L-тартрат (R)-2-метилпіролідину, що має оптичну чистоту в 50% ee, використовують для одержання сполуки, що має додатковий стереогенний(і) центр(и), реакція буде приводити до суміші діастереомерів, і мінорний(е) діастереомер(и), утворений(і) з (S)-2метилпіролідину, можуть бути вилучені під час звичайного очищення основного(них) діастереомера(ів), утворених з (R)-2-метилпіролідину. Якщо бажаний більш високий рівень оптичної чистоти, одержані L-тартрат (R)-2метилпіролідину або D-тартрат (S)-2-метилпіролідину можуть бути перекристалізовані. Відповідно, у деяких варіантах здійснення спосіб може додатково включати стадії: (f) перекристалізація виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (h) необов'язкове повторення стадій (f) і (g). Стадія (f) На стадії (f) проводять перекристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину, виділеного на стадії (e). Придатні способи перекристалізації виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину включають, але не обмежуються зазначеним, розчинення виділеної солі винної кислоти в придатному розчиннику і потім охолодження розчину, для того щоб викликати кристалізацію. Придатні розчинники для перекристалізації включають, але не обмежуються зазначеним, спиртові розчинники. Переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 70% (об./об.) етанолу і метанол. Більш переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 70% (об./об.) етанолу і метанол у співвідношенні від приблизно 1:1 до приблизно 5:1 (об./об.). Більш переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 70% (об./об.) етанолу і метанол у співвідношенні від приблизно 2:1 до приблизно 3:1 (об./об.). Більш переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 90% (об./об.) етанолу і метанол. Більш переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 90% (об./об.) етанолу і метанол у співвідношенні від приблизно 1:1 до приблизно 5:1 (об./об.). Більш переважно, розчинник для перекристалізації являє собою спиртовий розчинник, що включає щонайменше приблизно 90% (об./об.) етанолу і метанол у співвідношенні від приблизно 1:1 до приблизно 2:1 до приблизно 3:1 (об./об.). Стадія (g) На стадії (g), виділяють перекристалізований L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину. Придатні способи виділення перекристалізованої солі винної кислоти 6 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 включають, але не обмежуються зазначеним, фільтрування, декантацію і центрифугування. Переважно, перекристалізований L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2метилпіролідину виділяють шляхом фільтрування. Піддання солі винної кислоти, виділеної на стадії (е), одній послідовності перекристалізації у відповідності зі стадіями (f) і (g) переважно забезпечує виділений L-тартрат (R)-2метилпіролідину або D-тартрат (S)-2-метилпіролідину, що має оптичну чистоту, що становить щонайменше 80% ee. Більш переважно, L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2метилпіролідину, виділений на стадії (g), має оптичну чистоту, що становить щонайменше 85% ee. Оптична чистота, що становить 85% ee, означає, що основний енантіомер становить більш 92% суміші, а мінорний енантіомер менше 8% (84% ee = ((0,925-0,075)/(0,925+0,075)*100%), що часто є достатньою чистотою для використання в наступних синтетичних способах. Стадія (h) Якщо бажана більш висока оптична чистота, послідовність перекристалізації (тобто стадії (f) і (g)) можна повторити один або більше разів для підвищення оптичної чистоти L-тартрату (R)-2метилпіролідину або D-тартрату (S)-2-метилпіролідину. Після двох перекристалізацій L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину переважно має оптичну чистоту, що становить щонайменше 90% ее. Більш переважно, виділений перекристалізований L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2-метилпіролідину має оптичну чистоту, що становить щонайменше 93% ее. Після трьох (3) перекристалізацій, L-тартрат (R)-2-метилпіролідину або Dтартрат (S)-2-метилпіролідину переважно має оптичну чистоту, що становить щонайменше 95% ее. Більш переважно, виділений перекристалізований L-тартрат (R)-2-метилпіролідину або Dтартрат (S)-2-метилпіролідину має оптичну чистоту, що становить щонайменше 97% ее. Після чотири (4) перекристалізації, L-тартрат (R)-2-метилпіролідину або D-тартрат (S)-2метилпіролідину переважно має оптичну чистоту, що становить щонайменше 98% ее. Вільна основа Необов'язково, спосіб може додатково включати стадію взаємодії виділеного перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з основою для одержання (R)-2-метилпіролідину або (S)-2-метилпіролідину. Придатні основи для використання в даній реакції включають, але не обмежуються зазначеним, гідроксид амонію, гідроксиди лужних металів (наприклад, гідроксид натрію, гідроксид калію), алкіламіни (наприклад, триетиламін, діізопропілетиламін) і їх суміші. Придатні розчинники для використання в даній реакції включають, але не обмежуються зазначеним, діетиловий ефір і дихлорметан. Крім того, вільна основа 2-метилпіролідину може бути одержана з відповідної солі винної кислоти з використанням іонообмінної смоли способами, відомими в даній галузі. Одержана вільна основа може бути виділена з використанням методів, відомих у даній галузі. Переважно, вільна основа може бути одержане in situ і використано на наступній синтетичній стадії без виділення. Способи, описані в даній заявці, застосовні як для виділеної вільної основи 2-метилпіролідину, так і для вільної основи 2-метилпіролідину, одержаного in situ у реакційній суміші. Додаткові сполуки Крім розробки зручних способів одержання (R)- і (S)-2-метилпіролідинів і їх відповідних солей винної кислоти даний винахід також стосується способів введення 2-метилпіролідину в інші сполуки, зокрема, у фармацевтично корисні сполуки. Можна використовувати L-тартрат (R)2-метилпіролідину або D-тартрат (S)-2-метилпіролідину, одержані після стадій (e), (g) або (h). У деяких варіантах здійснення первісна стадія перетворення може полягати в трансформації сольової форми L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину у форму відповідного вільної основи (тобто (R)-2-метилпіролідину або (S)-2-метилпіролідину, відповідно) шляхом взаємодії з основою або іонообмінною смолою. Даний (R)-2-метилпіролідин або (S)-2-метилпіролідин, або виділені, або одержані in situ, потім можна використовувати для одержання ряду фармацевтичних сполук, наприклад, лігандів рецептора гістаміну-3, відомих у даній галузі. Наприклад, (R)-2-метилпіролідин або (S)-2-метилпіролідин, одержані вищевказаними способами, можуть бути перетворені в антагоніст рецептора H 3 і/або зворотний агоніст формули (I): 55 7 UA 99913 C2 , де 1 R являє собою 5 чи ;і 2 R являє собою 10 або 15 20 , чи його фармацевтично прийнятну сіль. Придатні способи одержання сполуки формули (I) з 2-метилпіролідину описані в WO 2007/009741, і можуть бути пристосовані для застосування в них (R)-2-метилпіролідину або (S)2-метилпіролідину, одержаних відповідно до вищевказаних способів. Наприклад, може бути одержаний розчин 1,1-диметилетил-4-{4-[(3-хлорпропіл)окси]феніл}-3-оксо-1піперазинкарбоксилату, розчиненого в 2-бутаноні. До нього можуть бути додані карбонат калію, йодид калію і вільна основа (R)-2-метилпіролідину або (S)-2-метилпіролідину, і суміш нагрівають при 80ºС протягом 24 годин. Потім реакційна суміш може бути охолоджена до кімнатної температури і розподілена між EtOAc і водою. Органічна фаза може бути висушена і сконцентрована, залишок очищений флеш-хроматографією, і придатні фракції об'єднані і сконцентровані з одержанням BOC-захищеного аміну формули (II): , 25 2 де R являє собою або (тобто сполука 1,1-диметилетил-4-(4-{[3-(2R)метил-1-піролідиніл)пропіл]окси}феніл)-3-оксо-1-піперазинкарбоксилат або 1,1-диметилетил-4 8 UA 99913 C2 (4-{[3-(2S)-метил-1-піролідиніл)пропіл]окси}феніл)-3-оксо-1-піперазинкарбоксилат). BOC-захисна група в сполуки формули (II) потім може бути вилучена (наприклад, при взаємодії з трифтороцтовою кислотою) з утворенням аміну формули (III): , 5 2 10 15 20 25 де R являє собою або . Амін формули (III) потім може бути піддіний взаємодії з карбоновою кислотою, вибраної з 4-ціанобензойної кислоти, 4-(1азетидинілкарбоніл)бензойної кислоти, 2,4-дифторбензойної кислоти, 3,5-дифторбензойної кислоти, 4-фторбензойної кислоти, 1-метил-1H-1,2,3-триазол-4-карбонової кислоти, 1,5диметил-1Н-піразол-3-карбонової кислоти, 1-метил-5-оксо-3-піролідинкарбонової кислоти, 3,5диметил-4-ізоксазолкарбонової кислоти, 1,3-диметил-1H-піразол-5-карбонової кислоти, 2,3дифторбензойної кислоти, 2,5-дифторбензойної кислоти, 2,6-дифторбензойної кислоти і 3,4дифторбензойної кислоти з утворенням сполуки формули (I). 1,1-диметилетил-4-{4-[(3-хлорпропіл)окси]феніл}-3-оксо-1-піперазинкарбоксилат, використовуваний для одержання BOC-захищеного аміну формули (II), може бути одержаний шляхом взаємодії 1-бром-3-хлорпропану з 1,1-диметилетил-4-(4-гідроксифеніл)-3-оксо-1піперазинкарбоксилатом, що може бути одержаний шляхом каталітичного гідролізу 1,1диметилетил-3-оксо-4-{4-[(фенілметил)окси]феніл}-1-піперазинкарбоксилату, що може бути одержаний шляхом взаємодії метансульфонілхлориду з 1,1-диметилетил-(2-гідроксіетил)[2оксо-2-({4-[(фенілметил)окси]феніл}аміно)етил]карбаматом, що може бути одержаний 2 1 уведенням BOC-захисної групи в N -(2-гідроксіетил)-N -{4-[(фенілметил)окси]феніл}гліцинамід, що може бути одержаний взаємодією 4-[(фенілметил)окси]аніліну з хлорацетилхлоридом і потім 2-аміноетанолом. Як альтернативу групі BOC можна використовувати інші захисні групи азоту, відомі в даній галузі. Приклади придатних захисних груп азоту описані в Green, T. W.; Wutz, P.G.M. Protective Groups in Organic Synthesis, 2d ed.; John Wiley and Sons: New York, 1991. Таким чином, один варіант здійснення винаходу стосується способу одержання сполуки формули (I): , 30 1 35 40 2 де R і R визначені, як зазначено вище, що включає стадії: (1a) гідрування 2-метилпіроліну у суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти в суміші з утворенням розчину; (1d) кристалізація L-тартрату (R)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину; і (2a) перетворення виділеного L-тартрату (R)-2-метилпіролідину в сполуку формули I. Даний спосіб може необов'язково додатково включати стадії: (1f) перекристалізація виділеного L-тартрату (R)-2-метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). В іншому варіанті здійснення, винахід стосується способу одержання сполуки формули (I): 45 9 UA 99913 C2 , 1 5 10 2 де R і R визначені, як зазначено вище, що включає стадії: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти в суміші з утворенням розчину; (1d) кристалізація L-тартрату (R)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину; (1f) взаємодія L-тартрату (R)-2-метилпіролідину з основою з одержанням (R)-2метилпіролідину; (2) взаємодія (R)-2-метилпіролідину з захищеним аміном формули (Ia) , 15 де PG являє собою захисну групу, з утворенням захищеного аміну формули (II) (3) видалення захисної групи захищеного аміну формули (II) з утворенням аміну формули 20 (III) і 25 30 35 (4) взаємодія аміну формули (III) з карбоновою кислотою, вибраної з 4-ціанобензойної кислоти, 4-(1-азетидинілкарбоніл)бензойної кислоти, 2,4-дифторбензойної кислоти, 3,5дифторбензойної кислоти, 4-фторбензойної кислоти, 1-метил-1Н-1,2,3-триазол-4-карбонової кислоти, 1,5-диметил-1Н-піразол-3-карбонової кислоти, 1-метил-5-оксо-3-піролідинкарбонової кислоти, 3,5-диметил-4-ізоксазолкарбонової кислоти, 1,3-диметил-1Н-піразол-5-карбонової кислоти, 2,3-дифторбензойної кислоти, 2,5-дифторбензойної кислоти, 2,6-дифторбензойної кислоти і 3,4-дифторбензойної кислоти, з утворенням сполуки формули (I). Даний спосіб може необов'язково додатково включати стадії: (1f) перекристалізація виділеного L-тартрату (R)-2-метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Переважно, захисна група являє собою BOC. Інша сполука, що демонструє активність ліганду рецептора гістаміну-3, являє собою 2-(6-{2[(2R)-2-метил-1-піролідин-1-іл]етил}-2-нафталін-2-іл)-2Н-піридазин-3-он. Один спосіб одержання даної сполуки описаний у патенті США 2005/0256127. 10 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-бромнафталін-2-ол може бути оброблений будь-яким придатним трифторметансульфоновим реагентом у присутності органічної основи для одержання 6бромнафталін-2-ілового ефіру трифторметансульфонової кислоти. Прикладами придатних трифторметансульфонових реагентів є, наприклад, ангідрид трифторметансульфонової кислоти, трифторметансульфоніл хлорид, N-фенілтрифторметансульфонімід, трифторметансульфоніл-1H-імідазол, анілід трифторметансульфонової кислоти, 2нітрофеніловий ефір трифторметансульфонової кислоти, 4-нітрофеніловий ефір трифторметансульфонової кислоти. Прикладами органічної основи є, наприклад, триетиламін, діізопропіламін, діізопропілетиламін, 2,6-лутидин, піридин і 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU). Реакція може бути проведена в будь-якому придатному органічному розчиннику. Прикладами придатних розчинників є CH2Cl2, диметиловий ефір (DME) і толуол. Реакція також може бути виконана в двофазних умовах, де використовується неорганічна основа. Наприклад, придатними неорганічними основами є K3PO4, NaHCO3, Na2CO3, NaOH і тому подібні. Переважним розчинником є толуол. Звичайно реакцію проводять у двофазних умовах, наприклад, використовуючи толуол і 30% фосфат калію при низькій температурі. Переважний температурний діапазон для даної реакції становить від приблизно –5ºС до приблизно 0ºС. 6-бромнафталін-2-іловий ефір трифторметансульфонової кислоти перетворять у 2-бром-6вінілнафталін за допомогою реакції з вінілтрифторборатним реагентом. Придатними вінілтрифторборатними реагентами є, наприклад, вінілтрифторборат калію, 2-вініл-4,4,5,5тетраметил-1,3,2-діоксаборолан, дибутилвінілборонат. Реагент використовують у кількості від приблизно 1,0 мольного еквівалента до приблизно 1,5 мольних еквівалентів відносно 6бромнафталін-2-ілового ефіру трифторметансульфонової кислоти. Звичайно реакцію проводять у полярному органічному розчиннику, наприклад, спирті, і в основному розчині, наприклад, у розчині карбонату металу. Перважним розчинником є етанол. Прикладами інших розчинників, які можна використовувати для даної реакції є н-пропанол, ізопропанол, метанол і інші придатні спирти. Карбонат металу переважно являє собою карбонат цезію. Альтернативно, також можна використовувати інші солі, наприклад, Na2CO3 і K3PO4. Кількість карбонату металу для даної реакції становить від приблизно 2 мольних еквівалентів до приблизно 4 мольних еквівалентів відносно 6-бромнафталін-2-ілового ефіру трифторметансульфонової кислоти. Реакцію проводять у присутності паладіевого каталізатора й органічного аміну як основи, наприклад, такої як триетиламін, діізопропіламін і тому подібні. Приклади паладіевих каталізаторів для даної реакції включають, але не обмежуються зазначеним, тетракис(трифенілфосфін)паладій, PdCl2(dppf)2, PdCl2(Ph3P)2 і PdCl2(CH3CN)2. Переважним паладіевим каталізатором є тетракис(трифенілфосфін)паладій. 2-Бром-6-вінілнафталін можна обробити аніоном (R)-2-метилпіролідину, одержаним з використанням н-бутиллітію, для одержання 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2метилпіролідину. Спосіб, описаний у патенті США 2005/0256127, може бути поліпшений за рахунок одержання (R)- і/або (S)-2-метилпіролідину відповідно до вищевказаних способів. 2Бром-6-вінілнафталін потім може бути підданий взаємодії з аніоном (R)-2-метилпіролідину, одержаним за допомогою н-бутиллітію або будь-якої іншої придатної основи, для одержання 1[2-(6-бромнафталін-2-іл)етил]-2R-метилпіролідину. 2-Бром-6-вінілнафталін можна обробити аніоном (R)-2-метилпіролідину, одержаним з використанням н-бутиллітію, для одержання 1-[2(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідину. Переважно, для даної реакції використовують від приблизно 1,2 до приблизно 2,5 мольних еквівалентів (R)-2метилпіролідину. Реакцію звичайно проводять в органічному розчиннику, наприклад, ТГФ, метил-трет-бутиловом ефірі (MTBE), Et2O і DME. Переважним розчинником є тетрагідрофуран (ТГФ). н-бутиллітій додають до розчину в ТГФ (R)-2-метилпіролідину контрольованим чином, звичайно шляхом додавання по краплях. До даного розчину додають розчин у ТГФ 2-бром-6вінілнафталіну. Альтернативно, також є придатним додавання розчину в ТГФ 2-бром-6вінілнафталіну до розчину (R)-2-метилпіролідину і н-бутиллітію. Реакцію проводять при температурі нижче, ніж кімнатна температура, звичайно при температурі, що коливається від приблизно 0ºС до приблизно –20ºС. Використовують від приблизно 0,3 до приблизно 0,7 мольних еквівалентом н-бутиллітію щодо сполуки 2-бром-6-вінілнафталіну. Одержана сполука являє собою 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідин. 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідин потім може бути підданий взаємодії з 2H-піридазин-3-оном для одержання цільової сполуки -2-{6-[2-((R)2-метилпіролідин-1іл)етил]нафталін-2-іл}-2H-піридазин-3-ону, що може бути додатково оброблена для одержання придатної солі. Реакцію проводять з використанням 2H-піридазин-3-ону, 8-гідроксихіноліну, мідного каталізатора в присутності основи. Використовують від приблизно 1,0 до приблизно 1,5 11 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 мольних еквівалентів (2H)-піридазин-3-ону відносно 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2метилпіролідину. Мідний каталізатор може являти собою будь-який придатний мідний каталізатор, наприклад, каталізатор міді (I). Приклади придатних каталізаторів для реакції включають, але не обмежуються зазначеним, порошок міді (0), хлорид міді (I), бромід міді (I), йодид міді (I), оксид міді (I), ацетат міді (I), хлорид міді (II), бромід міді (II), йодид міді (II), оксид міді (II) або ацетат міді (II). Переважний мідний каталізатор являє собою хлорид міді (I). Використовують від приблизно 0,02 до приблизно 1,0 мольного еквівалента мідного каталізатора відносно 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідину. Приклади придатних лігандів для реакції включають, але не обмежуються зазначеним, пдиметиламінопіридин, піридин, 3-піколін, 4-піколін, 8-гідроксихінолін, 7-метил-8-гідроксихінолін, 7-н-пропіл-8-гідроксихінолін, 1,10-фенантролін і 2,2'-дипіридил. Переважний ліганд являє собою 8-гідроксихінолін, що використовують у кількості від приблизно 0,02 до приблизно 2,0 мольних еквівалентів відносно 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідину. Переважно, основа являє собою карбонат металу або алкоксид металу, наприклад, карбонат цезію, карбонат калію, карбонат натрію і трет-бутоксид натрію. Переважна основа являє собою карбонат калію, що використовують у кількості від приблизно 1,0 до приблизно 2,0 мольних еквівалентів відносно 1-[2-(6-бромнафталін-2-іл)етил]-(R)-2-метилпіролідину. Реакцію проводять при підвищеній температурі в полярному органічному розчиннику. Приклади придатних розчинників включають, але не обмежуються зазначеним, N,N-диметилформамід, Nметилпіролідинон, N,N-диметилацетамід, піридин, 3-піколін, 4-піколін і тому подібні. Переважним розчинником є диметилформамід (ДМФ). Звичайно реакцію проводять в атмосфері азоту і реакційну суміш нагрівають при температурі від приблизно 100ºС до приблизно 160ºС. Звичайно реакція може бути проведена протягом від приблизно 10 до приблизно 48 годин. Коли реакція завершується і реакційна суміш охолоджена до 25ºС, додають розчинник, що не змішується з водою, наприклад, етилацетат. Органічний розчин промивають кілька разів насиченим розчином солі, наприклад, 25%-ним розчином NaCl або розчином інший придатної солі. Органічний розчинник сушать і концентрують досуха, одержуючи продукт. Альтернативно, активний агент, 2-(6-{2-[(2R)-2-метил-1-піролідин-1-іл]етил}-2-нафталін-2-іл)2H-піридазин-3-он, може бути одержаний у відповідності зі способами, описаними в патенті США 7153889, поданим 22 жовтня 2003 р. щонайменше наприклад, відповідно до загальних способів і приклада 31, або будь-яким іншим придатним способом для одержання стабільного активного агента. Кратно, наприклад, 6-бром-2-нафтоат відновлюють з використанням BH3-ТГФ для одержання відповідного спирту. 6-бромнафталін-2-іл-метанол обробляють 3(2H)піридазиноном, порошком міді і основою для одержання 2-[6-(2-гідроксіетил)нафталін-2-іл]-2Hпіридазин-3-ону, що активують сульфонатом, таким як тозилат. Одержують (R)-2метилпіролідин, що був одержаний відповідно до вищевказаних стадій (a)-(e), з використанням або без використання необов'язкових стадій (f)-(h) і взаємодією L-тартрату (R)-2метилпіролідину з основою для одержання (R)-2-метилпіролідину, і сульфонат піддають взаємодії з зазначеним (R)-2-метилпіролідином, одержуючи 2-(6-{(2R)2-метил-1-піролідин-1іл]етил}-2-нафталін-2-іл)-2H-піридазин-3-он. Таким чином, один з варіантів здійснення даного винаходу стосується способу одержання 2{6-[2-(2-метилпіролідин-1-іл)етил]нафталін-2-іл}-2H-піридазин-3-ону, що включає стадії: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізація L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2-метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою з утворенням (S)-2-метилпіролідину; (3a) перетворення 6-бромнафталін-2-ілового ефіру трифторметансульфонової кислоти в 2бром-6-вінілнафталін; (3b) взаємодія 2-бром-6-вінілнафталіна з (R)-2-метилпіролідином або (S)-2метилпіролідином у присутності н-бутиллітію для одержання 1-[2-(6-бромнафталін-2-іл)етил]2R-метилпіролідину або 1-[2-(6-бромнафталін-2-іл)етил]-2S-метилпіролідину; і (3c) взаємодія 1-[2-(6-бромнафталін-2-іл)етил]-2-метилпіролідину з 2H-піридазин-3-оном для одержання 2-{6-[2-(2-метилпіролідин-1-іл)етил]нафталін-2-іл}-2H-піридазин-3-ону. 12 UA 99913 C2 5 Даний спосіб необов'язково може додатково включати стадії: (1f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Додатково, 6-бромнафталін-2-іловий ефір трифторметансульфонової кислоти може бути одержаний шляхом одержання 6-бромнафталін-2-олу і взаємодії 6-бромнафталін-2-олу з придатним трифторметансульфоновим реагентом. Ілюстративні сполуки, що можуть бути одержані з використанням способів за даним винаходом, включають: 10 13 UA 99913 C2 і 5 У WO 2005/117865 також описані ліганди рецептора гістаміну-3, що включають 2метилпіролідиніловий фрагмент наступної загальної формули III-A: 14 UA 99913 C2 , де A вибирають з: 5 або 10 15 20 , де: m являє собою 0, 1 або 2; n являє собою 0, 1 або 2; 3 R являє собою водень або нижчий алкіл; t являє собою 1 або 2; 4 R являє собою водень або нижчий алкіл; 5 R являє собою нижчий алкіл або циклоалкіл; 8 8 X являє собою O, S або N-R , де R являє собою водень або нижчий алкіл; p являє собою 0, 1 або 2; q являє собою 0, 1 або 2; 6 R являє собою нижчий алкіл; s являє собою 0, 1 або 2; і 7 R являє собою нижчий алкіл. Сполуки формули III-A можуть бути одержані у відповідності зі схемою 1: СХЕМА 1 25 15 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 55 60 Конденсація карбонових кислот з амінами широко описана в літературі і способи відомі фахівцям у даній галузі (умови реакцій, описані в літературі і переважає для таких реакцій див., наприклад: Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock. John Wiley & Sons, New York, NY. 1999). 6-гідрокси-2-нафтойна кислота може зручним чином бути трансформована у відповідний амід шляхом конденсації з (R)- або (S)-2-метилпіролідином, що був одержаний відповідно до вищевказаних стадій (a)-(e) (з використанням або без використання необов'язкових стадій (f)-(h)) і взаємодією L-тартрату (R)2-метилпіролідину з основою для одержання (R)-2-метилпіролідин. Для ефективності перетворення може бути використаний будь-який придатний конденсуючий агент. Наприклад, так само можуть бути використані для ефективного проведення даного перетворення такі конденсуючи агенти як 1,1'-карбонілдіімідазол (CDI), N,N'-дициклогексилкарбодіїмід (DCC), 1-(3диметиламінопропіл)-3-етилкарбодіїмідгідрохлорид (EDCI), гексафторфосфат 1[біс(диметиламіно)метилен]-1Н-1,2,3-триазоло[4,5-b]піридин-3-оксиду (HATU), 1-гідрокси-1,2,3бензотриазол (HOBT), тетрафторборат O-бензотриазол-1-іл-N,N,N',N'-тетраметилуронію (TBTU) і тому подібні. Не мається визначеного обмеження в природі використовуваного розчинника, за умови, що він не здійснює негативного впливу на реакцію або залучення в неї реагентів і що він може розчиняти реагенти, щонайменше деякою мірою. Приклади придатних розчинників включають: ДМФ, дихлорметан (ДХМ), діоксан, ТГФ і тому подібні. Звичайно разом з конденсуючим агентом використовують основу. Не мається особливого обмеження в природі основи, використовуваної на даній стадії, і будь-яку основу, звичайно використовувану в реакціях даного типу, так само можна використовувати в даному випадку. Приклади таких основ включають триетиламін і діізопропілетиламін, і тому подібні. Реакція може протікати в широкому діапазоні температур, і визначена температура реакції не є вирішальною для даного винаходу. Зручним є проведення реакції при нагріванні від температури навколишнього середовища до температури кипіння зі зворотним холодильником. Час, необхідний для реакції, також може широко змінюватися в залежності від багатьох факторів, особливо від температури реакції і природи реагентів. Однак проміжок часу від 0,5 години до декількох днів звичайно буде достатнім для одержання амідного похідного. Одним з ілюстративних способів одержання (6-гідроксинафталін-2-іл)-(2-метилпіролідин-1іл)метанону є наступний. Суміш 6-гідрокси-2-нафтойної кислоти, тетрафторборату 2-(1Нбензотриазол-1-іл)-1,1,3,3-тетраметилуронію, 2,3 мл N-етилдіізопропіламіну і (R) або (S)-2метилпіролідину, що був одержаний відповідно до вищевказаних способів, одержану в 10 мл ДМФ перемішують протягом 16 годин при кімнатній температурі. Суміш потім концентрують досуха і додають 50 мл етилацетату, 30 мл води і 20 мл водного (10%) NaHCO 3. Водна фаза потім може бути проекстрагована 50 мл етилацетату, і об'єднані органічні шари очищені колоночною хроматографією на силікагелі. Фракції продукту можуть бути сконцентровані досуха і двічі розтерті з 20 мл суміші діетиловий ефір/гептан 1/1, і залишок висушений у вакуумі при 50ºС. Практична реалізація даного способу з використанням (R)-2-метилпіролідину або (S)-2метилпіролідину, одержаного відповідно до описаного в даній заявці способу, буде приводити до (6-гідроксинафталін-2-іл)-(2R-метилпіролідин-1-іл)метанону або (6-гідроксинафталін-2-іл)(2S-метилпіролідин-1-іл)метанону, що потім можна використовувати для одержання лігандів рецептора гістаміну-3. Для одержання лігандів рецептора гістаміну-3, вищевказані (R) або (S) проміжні сполуки піддають взаємодії зі спиртом формули HO-A (де A є таким, як визначено вище) з утворенням простого ефіру. Синтез простих ефірів широко описаний у літературі, і способи відомі фахівцям у даній галузі (реакційні умови, що здійснюють вплив на дані реакції описані в літературі, див., наприклад, у Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition, Richard C. Larock. John Wiley & Sons, New York, NY. 1999). Перетворення може бути проведене шляхом використання реакційних умов, що звичайно застосовуються в так називаній «реакції Міцунобу», що відома фахівцям у даній галузі і широко описана (Hughes, David L. The Mitsunobu reaction. Organic Reactions (New York) (1992), 42, 335-656.) Дані умови включають застосування триалкілфосфіну, такого як трибутилфосфін, трифенілфосфін і тому подібні, і діазосполуки, такої як діетилазодикарбоксилат (DEAD), діізопропілазодикарбоксилат (DIAD) (необов'язково полірозмірно зв'язаний), тетраметилазодикарбоксамід і тому подібні, у розчиннику, звичайно використовуваному в таких перетвореннях, таких як тетрагідрофуран (ТГФ), толуол, дихлорметан і тому подібні. Не мається особливого обмеження в природі використовуваного розчинника за умови, що він не здійснює негативного впливу на реакцію або залучення в неї реагентів і що він може розчиняти реагенти, щонайменше до деякої міри. Реакція може протікати в широкому діапазоні температур, і визначена температура реакції не є 16 UA 99913 C2 5 вирішальною для винаходу. Звичайно придатною є температура від температури навколишнього середовища до температури кипіння зі зворотним холодильником. Час, необхідне для реакції, також може широко змінюватися в залежності від множини факторів, особливо, від температури реакції і природи реагентів. Однак проміжок часу від 0,5 год до декількох днів звичайно буде достатнім для одержання бажаних сполук. Як альтернатива може бути використаний наступний синтетичний підхід: СХЕМА 2 10 15 20 25 30 35 Як показано на схемі 2, вихідний спирт HO-A, де A є таким, як описано вище, піддають взаємодії зі складним метиловим ефіром в умовах реакції Міцунобу з наступним відщіпленням складного ефіру. Проміжно кислоту, що утвориться, потім конденсують з (R)- або (S)-2метилпіролідином, що був одержаний відповідно до вищевказаних стадій (a)-(e) (як з використанням, так і без використання необов'язкових стадій (f)-(h)), і взаємодією L-тартрату (R)-2-метилпіролідину з основою для одержання (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину з основою для одержання (S)-2-метилпіролідину, для одержання цільової сполуки. Придатні агенти, що конденсують, і умови описані вище. Таким чином, один варіант здійснення даного винаходу стосується способу одержання сполуки формули III-A: де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2-метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою для утворення (S)-2-метилпіролідину; (3a) контактування карбонової кислоти наступної формули , 40 17 UA 99913 C2 5 10 або з (R)-, або з (S)-2-метилпіролідином протягом часу й в умовах, достатніх для утворення відповідного аміду нафтолу; і (3b) контактування аміду нафтолу зі спиртом формули HO-A, де A є таким, як описано вище, протягом часу й в умовах, достатніх для одержання відповідного простого ефіру аміду. Даний спосіб необов'язково може додатково включати стадії: (1f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Інший варіант здійснення стосується способу одержання сполук формули III-А: , 15 20 25 де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2-метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою для утворення (S)-2-метилпіролідину; (3a) контактування складного ефіру фенолу наступної формули 30 35 40 45 зі спиртом формули НО-А, де A є таким, як описано вище, протягом часу й в умовах, достатніх для одержання відповідного складного ефіру простого ефіру; і (3b) контактування складного ефіру простого ефіру або з (R)-, або з (S)-2-метилпіролідином протягом часу й в умовах, достатніх для утворення відповідного аміду простого ефіру. Даний спосіб необов'язково може додатково включати стадії: (1f) перекристалізація виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Особливо кращі сполуки, що можуть бути одержані з використанням способів за даним винаходом, включають: (2-метилпіролідин-1-іл)-{6-[2-(1-метилпіролідин-2-іл)етокси]нафталін-2-іл}метанон; [6-(1-ізопропілпіролідин-3-ілокси)нафталін-2-іл]-(2-метилпіролідин-1-іл)метанон; [6-(1-ізопропілпіперидин-4-ілокси)нафталін-2-іл]-(2-метилпіролідин-1-іл)метанон; і [6-(1-ізобутилпіперидин-4-ілокси)нафталін-2-іл]-(2-метилпіролідин-1-іл)метанон. Інша група сполук, що можуть бути одержані з (R)-2-метилпіролідину або (S)-2метилпіролідину, одержаних у відповідності зі способами, описаними в даному винаході, 18 UA 99913 C2 описана в патентній заявці США 2008/0027041 A1. Зокрема, у даній заявці описані сполуки загальної формули IV 5 і їх фармацевтично прийнятні солі; де: 1 10 R являє собою або , a кожний з X і X незалежно являє собою CH або N; 15 Y являє собою S(O)q, O або NR ; 2 R являє собою або 19 UA 99913 C2 , a 5 10 15 2 де: коли обоє X і X являють собою CH, то R знаходиться в мета- або пара-положенні щодо 4 1 групи Y-(CHR )m-R ; і a 2 коли або X, або X являють собою N, то R знаходиться в пара-положенні щодо групи Y4 1 (CHR )m-R ; 3 кожен R являє собою: 21 23 24 21 21 незалежно H, F, Cl, Br, I, OR , NR R , NO2, CN, CF3, С1-C6алкіл, C(=O)R , CO2R або 23 24 C(=O)NR R ; або 3 2 2 коли R знаходиться в орто-положенні відносно R , і R являє собою (i), (ii), (iv), (vi) або (ix), 3 14 то R і R спільно можуть утворювати -(CH2)S-, -CH2Z- , -ZCH2-, -ZCH2CH2- або CH2CH2Z-; де Z 27 являє собою O, S(O)y або NR ; або 3 2 2 3 коли R знаходиться в орто-положенні відносно R , і R являє собою (iv), (v) або (viii), то R і 13 R спільно можуть утворювати -(CH2)S-, -CH2Z-, -ZCH2-, -ZCH2CH2- або CH2CH2Z-; або 3 2 2 3 13 коли R знаходиться в орто-положенні відносно R , і R являє собою (viii), то R і R спільно можуть утворювати -(CH2)S-, -CH2Z-, -ZCH2-, -ZCH2CH2- або CH2CH2Z-; або 3 a 2 коли R знаходиться в орто-положенні відносно X , і R знаходиться в орто-положенні 3 a 2 3 відносно R і мета-положенні відносно X , то R і R спільно можуть утворювати: 20 4 25 30 35 40 21 кожен R незалежно являє собою H, C1-C6 або алкіл OR , де алкільна група необов'язково є 20 заміщеною 1-3 групами R ; 12 R являє собою H, C1-C6алкіл, циклоалкіл, арил, арилалкіл, гетероарил, гетероциклоалкіл, 27 27 C(=O)R або CO2R , де алкільная, циклоалкільная, арильная, арилалкільна, гетероарильна 20 або гетероциклоалкільна група необов'язково є заміщеними 1-3 групами R ; 13 14 кожний з R і R незалежно являє собою H, C1-C6алкіл, арил, арилалкіл C1-C6алкоксил, S(=O)y-C1-C6алкіл, циклоалкіл, гетероциклоалкіл або гетероарил; 13a 13b 13c 14a 13 14 кожний з R , R , R і R незалежно являє собою H, С1-C6алкіл; або R і R , взяті разом з атомами вуглецю, через які вони з'єднані, утворюють конденсоване фенільне, тієнільне, 13b 14 13 піролільне, оксазолільне, піридинільне або C3-C6циклоалкільне кільце; або R і R , або R і 14a 13b 14a 13c 14a R , або R і R , або R і R , взяті разом з атомами вуглецю, через які вони з'єднані, 13 13a 14 14a утворюють конденсоване C3-C6циклоалкільне кільце; або R і R , або R і R , взяті разом з атом вуглецю, до якого вони приєднані, утворюють C3-C8циклоалкільне кільце; за умови, що не 13 14 13b 14 13 14a 13b 14a 13c 14a 13 13a 14 14a більше ніж одна пара з R і R , R і R , R і R , R і R , R і R , R і R , і R і R взята разом з атомами вуглецю, через які вони з'єднані або з якими вони зв'язані, з утворенням кільця; і де конденсоване фенільне, тієнільне, піролільне, оксазолільне, піридинільне або 20 циклоалкільне кільце необов'язково заміщене 1-3 групами R ; 15 25 25 R являє собою H, C1-C6 алкіл, C(=O)R , CO2R ; 20 21 22 23 24 R з кожною появою незалежно являє собою H, F, Cl, Br, I, OR , OR , NR R , NHOH, NO2, 26 CN, CF3, C1-C6 алкіл, необов'язково заміщений OR , C2-C6 алкеніл, C2-C6 алкініл, C3C7циклоалкілC0-C4алкіл, 3-7-членний гетероциклоалкіл0-C4алкіл, феніл, 5- або 6-членний 20 UA 99913 C2 21 5 10 15 20 25 30 35 40 45 50 55 60 21 21 23 24 гетероарилС0-C4алкіл, арилалкіл, (=О), C(=O)R , CO2R , ОC(=О)R , C(=O)NR R , 27 21 27 21 23 24 27 21 21 NR C(=O)R , NR C(=O)OR , OC(=O)NR R , NR C(=S)R або S(O)q ; 21 кожен R незалежно являє собою H, C1-C6алкіл, арил або арилалкіл; 22 кожен R незалежно являє собою залишок амінокислоти після видалення гідроксильної групи від карбоксильної групи; 23 24 23 24 кожен R і R незалежно вибирають з H, C1-C6алкілу й арилу, або R і R , разом з атомом азоту, з яким вони з'єднані, утворюють 3-7 членне гетероциклічне кільце, необов'язково заміщене =О; 25 R являє собою C1-C6алкіл, арил або алкіларил; 26 R являє собою H, C1-C6алкіл, арил або алкіларил; 27 R являє собою H або C1-C6алкіл; 1 m являє собою 1, 2, 3, 4 або 5, коли R з'єднаний з атомом азоту, і m являє собою 0, 1, 2, 3, 1 4 або 5, коли R з'єднаний за допомогою атома вуглецю; n являє собою 1, 2 або 3; q являє собою 0, 1 або 2; s являє собою 1, 2 або 3; і y являє собою 0, 1 або 2. Конкретні приклади таких сполук, що можуть бути одержані з використанням способів одержання 2-метилпіролідину за даним винаходом, включають: 2-метил-6-{4-[(R)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{3,5-дифтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-метил-2H-піридазин-3-он; 6-{3-хлор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-метил-2H-піридазин-3-он; 2,6-диметил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-метил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-метил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-2H-піридазин-3-он; 2-(6-метилпіридин-2-іл)-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3он; 2-(3-метилпіридин-2-іл)-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3он; 6-метил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-2H-піридазин-3-он; 6-метил-2-(3-метилпіридин-2-іл)-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2Hпіридазин-3-он; 6-метил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-тіофен-3-іл-2H-піридазин-3-он; 5-{4-[3-((S)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-2H-піридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-5-піридин-2-іл-4,5-дигідро-2H-піридазин-3он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-5-піридин-2-іл-2H-піридазин-3-он; 2-(2-фтор-етил)-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{3-фтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 4-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он; 4-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-метил-4-{3-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2,5,6,7-тетрагідроциклопента[d]піридазин-1-он; 2-ізопропіл-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-[3-((R)-2-метилпіролідин-1-іл)пропокси]-5-(6-оксо-1,6-дигідро-піридазин-3-іл)бензонітрил; 2-(2-гідроксіетил)-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[(S)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{3-метокси-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піримідин-2-іл-2H-піридазин-3-он; 6-{6-[3-((R)-2-метилпіролідин-1-іл)пропокси]піридин-3-іл}-2H-піридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-(2,2,2-трифтор-етил)-4,5-дигідро-2Hпіридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-(2,2,2-трифтор-етил)-2H-піридазин-3-он; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.2.0]окт-4-ен-2-он; 4-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2,4a,5,6,7,7aгексагідроциклопента[d]піридазин-1-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он; 4,4-диметил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3он; 21 UA 99913 C2 6-{3-фтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он; 5,5-диметил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-4,5-дигідро-2H-піридазин-35 он; 6-{3,5-дифтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{3,5-дибром-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{3,5-дифтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3он; 10 15 20 25 30 35 40 45 50 55 60 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он, рацемат; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он, діастереомер; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он, діастереомер; 6-{(R)-2-метил-4-[3-(2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-он; 2-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-6-феніл-2H-піридазин-3-он; 6-метил-2-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-фталазин-1-он; 2-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-6-піридин-3-іл-2H-піридазин-3-он; 3-метил-4-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-6H-ізоксазолo[3,4-d]піридазин-7он; 8-[3-((R)-2-метилпіролідин-1-іл)пропокси]-5,6-дигідро-2H-бензо[h]цинолін-3-он; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-етил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 8-[3-(2-метилпіролідин-1-іл)пропокси]-4,4a,5,6-тетрагідро-2H-бензо[h]цинолін-3-он; 6-{2-метокси-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{2-фтор-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-2H-піридазин-3-он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4-піридин-2-іл-4,5-дигідро-2H-піридазин-3он; 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4-піридин-2-іл-2H-піридазин-3-он; 8-[3-((R)-2-метилпіролідин-1-іл)пропокси]-5,6-дигідро-3H-бензо[f]цинолін-2-он; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-метоксиметил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-{4-[(S)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-{4-[(R)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-{3,5-дибром-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 2-метоксиметил-5-{2-метил-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3он; 5-{2-метил-4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 4-метокси-2-метоксиметил-5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин3-он; 5-метокси-2-метоксиметил-4-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин3-он; 5-метокси-4-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[3-((S)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-он; 5-{4-[(S)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4ен-2-он; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-он, індивідуальний ізомер; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-он, індивідуальний ізомер; 6-{4-[2-гідрокси-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[(S)-2-гідрокси-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; 6-{4-[(R)-2-гідрокси-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; і 6-циклопропіл-2-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он; або їх стереоізомерну форму, суміш стереоізомерних форм або фармацевтично прийнятну сіль. 22 UA 99913 C2 5 10 15 20 Переважними серед них є сполуки, вибрані з групи, що складається з: 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2-піридин-2-іл-2H-піридазин-3-ону; 6-{4-[(S)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-ону; 4,4-диметил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3ону; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-ону; 5-{4-[(S)-2-метил-3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4ен-2-ону; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-ону; 5-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-3,4-діазабіцикло[4.1.0]гепт-4-ен-2-ону; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-ону, одного діастереомеру; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-ону, одного діастереомеру; 5-метил-6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-4,5-дигідро-2H-піридазин-3-ону; і 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-ону; або їх стереоізомерних форм, суміші стереоізомерних форм або фармацевтично прийнятних солей. Особливо переважними серед зазначених сполук є 6-{4-[3-((R)-2-метилпіролідин-1іл)пропокси]феніл}-2H-піридазин-3-он або його стереоізомерна форма, суміш стереоізомерних форм або фармацевтично прийнятна сіль. Дана сполука може бути одержана з (R)-2метилпіролідину, одержаного відповідно до вищевказаних способів. На схемі 3 показаний ілюстративний спосіб одержання 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2Hпіридазин-3-ону. 25 СХЕМА 3 30 35 40 45 У відповідності зі схемою 3 на стадії 1 суміш 1-(4-гідроксифеніл)етанону і 3-бром-1хлорпропану в CH3COCH3 нагрівають при 65С протягом ночі. Суміш фільтрують, промивають ацетоном і концентрують досуха. Неочищений продукт розчиняють у CH2Cl2 і промивають насиченим розчином NaHCO3, розчином NaCl і сушать над Na2SO4. Концентрування досуха у вакуумі приводить до продукту. Суміш продукту зі стадії 1 і моногідрату гліоксалевої кислоти перемішують у 15 мл оцтової кислоти при 100С протягом 2 годин. Розчинник упарюють, до залишку додають воду і охолоджують до 0С, додаючи при цьому концентрований водяний NH 4OH до рН 8. До даної суміші додають гідразингідрат і нагрівають при 100С протягом 1 години. Одержана тверда речовина може бути відфільтрована і промита водою. Неочищена речовина може бути розчинена в суміші CH2Cl2/Мео і очищена колоночною хроматографією з використанням від CH2Cl2 до 10 % MeOH у CH2Cl2. Суміш продукту зі стадії 2, K2CO3, 100 мг Na і гідрохлориду R-2-метилпіролідину в ацетонітрилі нагрівають при 80С протягом 2 днів. Реакційну суміш потім фільтрують, промивають CH2Cl2 і концентрують. Залишок розчиняють у CH 2Cl2 і промивають насиченим розчином NaHCO3, насиченим NaCl, сушать над Na2SO4 і концентрують. Залишок може бути очищений градієнтною хроматографією ISCO з використанням від 100% CH 2Cl2 до суміші 5% MeOH:95% CH2Cl2 у 2-амінопропані і потім суміші 10% MeOH:90% CH2Cl2 у 2-амінопропані, 23 UA 99913 C2 5 одержуючи продукт. Вільна основа продукту може бути перетворена в HCl-сіль шляхом розчинення в МеОН і додавання 0,5 н HCl у EtOH, з наступним розпарюванням розчинника і кристалізацією із суміші MeOH:Et2O. Таким чином, один варіант здійснення даного винаходу стосується способів одержання сполуки формули IV: , 10 15 20 25 30 35 зокрема, (R)- або (S)-6-{4-[3-(2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-ону, де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2-метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою з утворенням (S)-2-метилпіролідину; (3a) контактування 1-(4-гідроксифеніл)етанону з 1,3-дигалогенпропаном протягом часу і при умовах, достатніх для утворення 1-[4-(3-галогенпропокси)феніл]етанону; (3b) контактування 1-[4-(3-галогенпропокси)феніл]етанону з гліоксалевою кислотою протягом часу й в умовах, достатніх для одержання 6-[4-(3-галогенпропокси)феніл]-2Hпіридазин-3-ону; і (3c) контактування 6-[4-(3-галогенпропокси)феніл]-2H-піридазин-3-ону або з (R), або з (S)-2метилпіролідином протягом часу й в умовах, достатніх для утворення відповідного (R)- або (S)6-{4-[3-(2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-ону. Даний спосіб необов'язково може додатково включати стадії: (1f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Більш звичайно, вищевказана методологія може бути адаптована для одержання сполук, описаних у заявці на патент США 2008/0027041 A1, за допомогою забезпечення сполуки формули V: 40 45 разом з гідрохлоридом (R) або (S)-2-метилпіролідину, одержаним відповідно до вищевказаної методології, K2CO3 і Na у CH3CN і виділення продукту. Наступний варіант здійснення винаходу стосується способів одержання сполуки формули IV: 24 UA 99913 C2 , 5 10 15 20 де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2- метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою з утворенням (S)-2-метилпіролідину; (3a) перетворення (R)-2-метилпіролідину або (S)-2-метилпіролідину в сполуку формули IV. Даний спосіб необов'язково може додатково включати стадії: (1f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Ілюстративні сполуки, що можуть бути одержані відповідно до даних способів, включають (R)- або (S)-6-{4-[3-(2-метилпіролідин-1-іл)пропокси]феніл}-2H-піридазин-3-он: 25 30 35 40 Переважно, сполука являє собою 6-{4-[3-((R)-2-метилпіролідин-1-іл)пропокси]феніл}-2Hпіридазин-3-он. Наступна група лігандів рецептора гістаміну-3, що може бути одержана з використанням (R) або (S)-2-метилпіролідину, одержаного відповідно до описаного в даній заявці способу, описаного в WO 2006/059778. Дані сполуки включають сполуки загальної формули VI: і їх фармацевтично прийнятні солі; де Y являє собою (R) або (S) 2-метилпіролідин; 1 кожен R незалежно являє собою атом водню, гідроксильну групу, атом галогену, нижчу алкільну групу, нижчу галогеналкільну групу, нижчу алкоксильну групу, нижчу галогеналкоксильну групу, групу нижчий алкокси-нижчий алкіл або групу нижчий галогеналкокси-нижчий алкіл; р указує на ціле число від 0 до 4; 25 UA 99913 C2 2 R являє собою гідроксильну групу, атом галогену, нижчу алкільну групу, нижчу галогеналкільну групу, нижчу алкоксильну групу, нижчу галогеналкоксильну групу, групу нижчий алкокси-нижчий алкіл або групу нижчий галогеналкокси-нижчий алкіл; або 2 5 R являє собою групу формули або формули (III-2) , де A являє собою сполуку формули (III-1) , 3 10 15 20 25 30 35 40 45 де R являє собою атом водню або циклоалкільну групу, необов'язково заміщену нижчою алкільною групою, нижчою галогеналкільною групою, циклоалкільною групою, атомом галогену 4 або гідроксильною групою, і R являє собою атом водню, гідроксильну групу, атом галогену, нижчу алкільну групу, нижчу галогеналкільну групу, нижчу алкоксильну групу, нижчу галогеналкоксильну групу, групу нижчий алкокси-нижчий алкіл чи групу нижчий галогеналкоксинижчий алкіл; m указує на 0 або 1; n указує на 0, 1 або 2; і 1 4 кожний з X -X незалежно являє собою атом вуглецю, необов'язково заміщений нижчою алкільною групою, нижчою алкоксильною групою, нижчою галогеналкоксильною групою або атомом галогену. Конкретні розкриті сполуки в рамках даної групи, що можуть бути одержані відповідно до описаного в даному винаході способу, включають: 1-метил-4-{4-[3-((2S)-2-метил-1піролідиніл)пропокси]феніл}-2(1Н)-піридон; і 1-метил-4-{4-[3-((2R)-2-метил-1піролідиніл)пропокси]феніл}-2(1H)-піридон. Такі сполуки можуть бути одержані шляхом забезпечення проміжної сполуки формули (VI), де Y являє собою Cl, і взаємодії сполуки з (R)- або (S)-2-метилпіролідином, одержаним відповідно до вищевказаної методології, K2CO3 і Na у CH3CN і виділення продукту, головним чином, як описано вище для сполук за US 2008/0027041 A1. Таким чином, інший варіант здійснення даного винаходу стосується способів одержання сполуки формули VI: , де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (2a) контактування L-тартрату (R)-2-метилпіролідину з основою з утворенням вільної основи (R)-2- метилпіролідину або контактування D-тартрату (S)-2-метилпіролідину з основою з утворенням (S)-2-метилпіролідину; (3a) контактування сполуки формули VI, де Y являє собою Cl, або з (R)-, або з (S)-2метилпіролідином протягом часу й в умовах, достатніх для утворення відповідного аміду. Даний спосіб необов'язково може додатково включати стадії: 26 UA 99913 C2 5 10 15 20 25 30 35 40 45 50 (1f) перекристалізації виділеного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; (1g) виділення перекристалізованого L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і (1h) необов'язкове повторення стадій (1f) і (1g). Ще одна заявка, у якій описані ліганди рецептора гістаміну-3, що містять 2метилпіролідиновий фрагмент, це WO 2007/105053. У даній заявці описане одержання сполук наступної формули VII: , де A являє собою (R) або (S) 2-метилпіролідин; Z, Y, Q, X незалежно являють собою азот або вуглець; 3 R являє собою водень, (C1-C8)алкіл, (З1-З8)алкокси, галоген, 5-6-членний арил, 5-6-членний 4 5 гетероарил, гідроксил, метиленгідроксил, -(C=O)NR R і S(O)p(C1-C4)алкіл, де p являє собою 1 або 2; 4 5 де R і R незалежно вибирають із групи, що складається з: водню; (C1-C8)алкілу необов'язково заміщеного 1-4 галогенами; (C1-C8)алкільної групи, необов'язково заміщеної замісником, вибраним із групи, що складається з OH, від 1 до 4 (C 1C4)алкілу, (C3-C7)циклоалкілу, (C1-C4)діалкіламіно, (C6-C10)арилу, необов'язково заміщеного галогеном і необов'язково заміщеного (C6-C10)арилокси, необов'язково заміщеним 1-2 галогенами, і 5-10-членного гетероарилу, необов'язково заміщеного (C6-C10)арильною групою і необов'язково заміщеного 1-3 (C1-C4)алкільними групами; (C3-C7)циклоалкілу; (C6-C14)арилу; (C2-C3)алкіл-O-(C1-C3)алкілу, необов'язково заміщеного (C1-C3)алкілом; -(C1-C3)алкіл-C(=O)O(C1-C3)алкілу; 3-8-членного гетероциклоалкілу, необов'язково заміщеного однією або декількома (С1-C4)алкілкарбонільними групами; (C6-C14)арилсульфонілу, необов'язково заміщеного одним або декількома (C1-C2)алкілами; 5-10-членного гетероарилу; і (C6-C14)арил-(C0-C4)алкілен-O-(C0C4)алкілу, де кожний (C0-C4)алкіл і кожний (C0-C4)алкілен є необов'язково заміщеним 1-4 (C14 5 C4)алкілами; або необов'язково R і R , разом з азотом, з яким вони з'єднані, утворюють 4-6членне гетероциклічне кільце, де один з вуглеців зазначеного гетероциклічного кільця, що відділений щонайменше двома атомами від зазначеного азоту в зазначеному гетероциклічному 6 6 кільці, необов'язково замінений на O або NR , у даному випадку R являє собою водень, (C1C3)алкіл або -C(=O)(C1-C3)алкіл; і де зазначене гетероциклічне кільце є необов'язково заміщеним галогеном, (C1-C3) алкілом або гідроксилом; 7 R являє собою водень; 3 7 або необов'язково R і R разом із двома суміжними атомами в кільці, включаючи Z, Y, Q і X, з якими вони зв'язані, утворює 5-6-членне гетероциклічне кільце; де один з вуглеців зазначеного гетероциклічного кільця, що відділений щонайменше двома атомами від зазначеного азоту в 8 8 зазначеному гетероциклічному кільці, необов'язково замінений на O або NR ; де R являє собою водень або (C1-C3)алкіл. Схема 4 ілюструє спосіб одержання сполук, що мають основну структуру формули VII, де A, 3 R , Y, Q, Z і X визначені, як зазначено вище. Посилаючись на наведену нижче схему 4, сполука (III-B) може бути одержано обробкою сполуки бромтетралону формули (I-B) (R) або (S) 2метилпіролідином, одержаним відповідно до описаного вище способу, і придатним відновлючачем, таким як NaHB(OAc)3 у розчиннику, такому як CH2Cl2 або DCE, і при температурі, що коливається від –5С до кімнатної температури, переважно приблизно при кімнатній температурі, для одержання цільової сполуки формули (III-B). Інші придатні відновлювачі для даної реакції включають NaCNBH3 або NaBH4, у розчинниках, таких як MeOH або EtOH. Інші придатні умови для такого перетворення включають обробку відповідного тетралону формули (I-B) (R)- або (S)-2-метилпіролідином, одержаним у відповідності зі 27 UA 99913 C2 5 10 способами даного винаходу, у CH2Cl2 або DCE, у присутності молекулярних сит 4 Å і основи, такої як ТЕА при кімнатній температурі з наступною обробкою NaBH4 або NaHB(OAc). Сполука III-B потім може бути оброблена придатним чином заміщеною бороновою кислотою формули (IV-A), у присутності придатного паладієвого каталізатора, такого як 1,1біс(дифенілфосфіно)фероценпаладій(II) хлорид і придатного водяного розчину лужної основи, такої як карбонат натрію, і в розчинниках, таких як диметоксіетан, при температурі, що коливається від кімнатної температури до приблизно 100С, переважно приблизно при 90С, для одержання цільової сполуки формули (V-A). Інші придатні умови для такого перетворення включають обробку сполуки формули (III-B) і придатним чином заміщеної боронової кислоти формули (IV-A) тетракис(трифенілфосфін)паладієм(0) і карбонатом натрію в суміші етанол/вода при температурі, що коливається від 30С до 110С, переважно приблизно при температурі кипіння зі зворотним холодильником, для одержання відповідного сполуки формули (V). СХЕМА 4 15 Таким чином, інший варіант здійснення даного винаходу стосується способів одержання сполуки формули VII: 20 25 30 , де змінні є такими, як зазначено вище, що включає: (1a) гідрування 2-метилпіроліну в суміші, що включає спиртовий розчинник і каталізатор гідрування; (1b) необов'язкове видалення каталізатора гідрування із суміші; (1c) розчинення L-винної кислоти або D-винної кислоти в суміші з утворенням розчину; (1d) кристалізацію L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2-метилпіролідину з розчину; (1e) виділення кристалічного L-тартрату (R)-2-метилпіролідину або D-тартрату (S)-2метилпіролідину; і 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing 6-{4-[3-((r)-2-methylpyrrolidine-1-yl)-propoxy]-phenyl}-2h-pyridazin-3-one and salts thereof
Автори англійськоюChristie, Michael, Petraitis, Joseph, J.
Назва патенту російськоюСпособ получения 6-{4-[3-((r)-2-метилпирролидин-1-ил)пропокси]фенил}-2н-пиридазин-3-она и его солей
Автори російськоюКристи Майкл, Петрейтис Джозеф Дж.
МПК / Мітки
МПК: C07D 403/12, C07D 207/06
Мітки: солей, спосіб, 6-{4-[3-((r)-2-метилпіролідин-1-іл)пропокси]феніл}-2н-піридазин-3-ону, одержання
Код посилання
<a href="https://ua.patents.su/65-99913-sposib-oderzhannya-6-4-3-r-2-metilpirolidin-1-ilpropoksifenil-2n-piridazin-3-onu-ta-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 6-{4-[3-((r)-2-метилпіролідин-1-іл)пропокси]феніл}-2н-піридазин-3-ону та його солей</a>
Попередній патент: Носій аутентичності
Наступний патент: Спосіб застосування антагоністів вазопресину із засобами антрациклінової хіміотерапії для зниження кардіотоксичності
Випадковий патент: Спосіб підсилення цегляного простінка цегляною сорочкою