Кристалічна форма поліциклічної сполуки
Номер патенту: 110604
Опубліковано: 25.01.2016
Автори: Філд Р. Скотт, Петрейтіс Джозеф, Кресс Майкл, Курвуаз'є Лоран, Хі Лінлі, Крісті Майкл, Маурі Дейл Р., Холтіванджер Р. Кертіс, Джейкобс Мартін Дж., Бірлмейєр Стефен, Маккін Роберт Е., Язданіан Мехран
Формула / Реферат
1. Кристалічна форма сполуки I, яка має формулу:
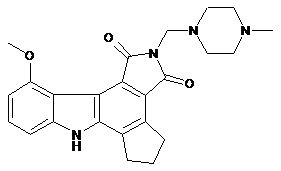 , I
, I
де кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить наступні піки: 4,32 ± 0,2 градуса 2-тета, 6,07 ± 0,2 градуса 2-тета, 8,55 ± 0,2 градуса 2-тета, 12,07 ± 0,2 градуса 2-тета і 15,37 ± 0,2 градуса 2-тета.
2. Спосіб отримання кристалічної форми сполуки I за п. 1, в якому здійснюють:
a) розчинення сполуки I в розчиннику;
b) фільтрування отриманого в результаті розчину;
с) часткову відгонку розчинника при додаванні антирозчинника для осадження сполуки I;
d) додаткове упарювання отриманої в результаті суспензії при додаванні додаткової кількості антирозчинника для зниження об'єму розчинника, що застосовується на стадії a);
е) нагрівання суспензії для досягнення повного перетворення;
f) охолоджування;
g) збирання продукту за допомогою фільтрації; і
h) сушіння.
3. Фармацевтична композиція, що містить кристалічну форму сполуки I за п. 1 і один або більше фармацевтично прийнятних носіїв.
4. Фармацевтична композиція за п. 3, яка додатково містить аморфну сполуку I.
5. Спосіб отримання сполуки I
 , Сполука І
, Сполука І
в якому здійснюють взаємодію сполуки А
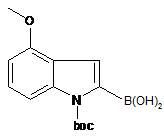 Сполука А
Сполука А
з 1-циклопентен-1-іловим ефіром 1,1,1-трифторметансульфонової кислоти з отриманням сполуки В
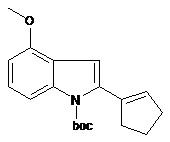 Сполука В.
Сполука В.
6. Спосіб отримання сполуки I
 , Сполука І
, Сполука І
в якому здійснюють взаємодію сполуки С
 Сполука С
Сполука С
з малеімідом з отриманням сполуки D
 Сполука D.
Сполука D.
Текст
Реферат: Альтернативні кристалічні форми сполуки І, відтворювані способи їх отримання і способи лікування пацієнтів з їх застосуванням. UA 110604 C2 (12) UA 110604 C2 UA 110604 C2 5 10 15 20 25 30 35 40 45 ГАЛУЗЬ ТЕХНІКИ, ЯКОЇ СТОСУЄТЬСЯ ДАНИЙ ВИНАХІД Даний винахід стосується композицій, які містять нові форми поліциклічної сполуки (яка називається в даному винаході сполукою I), відтворюваних способів її отримання і фармацевтичних композицій, які містять сполуку I. РІВЕНЬ ТЕХНІКИ ДАНОГО ВИНАХОДУ Активні фармацевтичні інгредієнти (API) можна отримати у вигляді ряду різних форм, наприклад, у вигляді хімічних похідних, сольватів, гідратів, співкристалів або солей. API можуть також бути аморфними, можуть мати різні кристалічні поліморфні форми або можуть існувати в різних сольватованих або гідратованих станах. Змінюючи форму API, можна змінювати його фізичні властивості. Наприклад, кристалічні поліморфні форми звичайно мають різну розчинність, так що більш термодинамічно стабільна поліморфна форма є менш розчинною, ніж менш термодинамічно стабільна поліморфна форма. Поліморфні форми можуть також відрізнятися по властивостях, таких як стабільність, біодоступність, структура, тиск парів, густина, колір і коефіцієнт стиснення. Відповідно, зміна кристалічного стану API являє собою один з багатьох шляхів для зміни його фізичних і фармакологічних властивостей. Полі(АДФ-рибозна) полімераза (PARP, яка також називається полі(АДФ-рибозна) синтетаза, або PARS) являє собою ядерний фермент, який каталізує синтез полі(АДФ-рибозних) ланцюгів з + NAD у відповідь на розриви одноланцюжкової ДНК як частину процесу репарування ДНК (de Murcia, G; de Murcia, J.M. Poly(ADP-ribose) polymerase: а molecular nick-sensor. Trends Biochem. Sci. 1994, 19,172-176; Alvarez-Gonzalez, R.; Pacheco-Rodriguez, G; Mendoza-Alvarez, H. Enzymology of ADP-ribose polymer synthesis. Mol. Cell. Biochem. 1994, 138, 33). Була висунена гіпотеза, що низькомолекулярні інгібітори PARP можуть грати потенційну роль в терапевтичному лікуванні нейродегенеративних захворювань, раку і інших пов'язаних з PARP і кіназою захворювань. Специфічна інгібуюча PARP сполука, яка має хімічне позначення 4,5,6,7-тетрагідро-11метокси-2-[(4-метил-1-піперазиніл)метил]-1H-циклопента[a]піроло[3,4-c]карбазол-1,3(2H)-діон, може бути придатна для лікування пухлин грудей і яєчника і в поєднанні з хіміотерапією або радіотерапією для лікування інших стійких до лікарських засобів видів раку. Дана сполука представлена наступною формулою (I): і називається в даному винаході "сполукою I". Патент США 7122679 і 2006/0276497 описує сполуку I і її застосування. Різні форми сполуки I мають різні температури плавлення, розчинність або швидкість розчинення; дані фізичні властивості, або окремо або в комбінації, можуть впливати, наприклад, на біодоступність. У світлі потенційних переваг альтернативних форм API існує необхідність у виявленні і отриманні альтернативних форм сполуки I. СУТЬ ДАНОГО ВИНАХОДУ Описані різні форми сполуки I, а також способи їх отримання. Наприклад, в даному винаході описані дві поліморфні форми безводних кристалічних форм (форми A 0 і B0), три поліморфні форми кристалічних моногідратних форм (HA0, HC0 і HD0) і дев'ять сольватів (S20, S30, S40, S50, S60, S70, S90, S100 і S120). Також описані фармацевтичні композиції, що містять одну або більше з даних форм, а також фармацевтичні композиції, що додатково містять аморфну форму сполуки I (As). Також описані фармацевтичні композиції, що містять одну або більше з даних форм, а також способи лікування, що використовують дані композиції. Існують різні шляхи застосування фармацевтичних композицій даного винаходу, включаючи, але не обмежуючись, посилення протипухлинної активності радіації або хіміотерапевтичних засобів, які пошкоджують ДНК, (Griffin, R.J.; Curtin, N.J.; Newell, D.R.; Golding, B.T.; Durkacz. B.W.; Calvert, A.H. The role of inhibitors of poly(ADP-ribose) polymerase as resistance-modifying agents in cancer therapy. Biochemie 1995, 77, 408). 1 UA 110604 C2 5 10 15 20 25 30 35 40 45 50 55 60 КОРОТКИЙ ОПИС КРЕСЛЕНЬ На Фіг. 1 представлена рентгенівська порошкова дифрактограма (XRPD) форми A 0. На Фіг. 2 представлена рентгенівська порошкова дифрактограма (XRPD) форми B 0. На Фіг. 3 представлена рентгенівська порошкова дифрактограма (XRPD) форми HA0. На Фіг. 4 представлена рентгенівська порошкова дифрактограма (XRPD) форми HC 0. На Фіг. 5 представлена рентгенівська порошкова дифрактограма (XRPD) форми HD 0. На Фіг. 6 представлена рентгенівська порошкова дифрактограма (XRPD) форми S20. На Фіг. 7 представлена рентгенівська порошкова дифрактограма (XRPD) форми S3 0. На Фіг. 8 представлена рентгенівська порошкова дифрактограма (XRPD) форми S4 0. На Фіг. 9 представлена рентгенівська порошкова дифрактограма (XRPD) форми S50. На Фіг. 10 представлена рентгенівська порошкова дифрактограма (XRPD) форми S6 0. На Фіг. 11 представлена рентгенівська порошкова дифрактограма (XRPD) форми S7 0. На Фіг. 12 представлена рентгенівська порошкова дифрактограма (XRPD) форми S90. На Фіг. 13 представлена рентгенівська порошкова дифрактограма (XRPD) форми S10 0. На Фіг. 14 представлена рентгенівська порошкова дифрактограма (XRPD) форми S12 0. На Фіг. 15 представлена рентгенівська порошкова дифрактограма із змінною температурою (VT-XRPD) форми A0. На Фіг. 16 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА, TGA) форми A0. На Фіг. 17 представлений регулярний графік ізотерми при динамічній сорбції парів (ДСП, DVS) форми A0. На Фіг. 18 показані рентгенівські порошкові дифрактограми (XRPD) форми A 0 перед і після аналізу за допомогою динамічної сорбції парів (ДСП). На Фіг. 19 представлений нерегулярний графік ізотерми при динамічній сорбції парів (ДСП) форми A0. На Фіг. 20 представлений інфрачервоний спектр з Фур'є-перетворенням (FTIR) форми A0. На Фіг. 21 представлений раманівський спектр форми A0. На Фіг. 22 представлена рентгенівська порошкова дифрактограма із змінною температурою (VT-XRPD) форми B0. На Фіг. 23 представлене накладення термограми диференціальної скануючої калориметрії (ДСК, DSC) і термограми термогравіметричного аналізу (ТГА) форми B0. На Фіг. 24 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми HA0. На Фіг. 25 представлений графік ізотерми при динамічній сорбції парів (ДСП) форми HA 0. На Фіг. 26 представлений інфрачервоний спектр з Фур'є-перетворенням (FTIR) форми HA0. На Фіг. 27 представлений раманівський спектр форми HA0. На Фіг. 28 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми HC0. На Фіг. 29 представлений регулярний графік ізотерми при динамічній сорбції парів (ДСП) HC0. На Фіг. 30 показані рентгенівські порошкові дифрактограми (XRPD) форми HC 0 перед і після аналізу за допомогою динамічної сорбції парів (ДСП). На Фіг. 31 представлений нерегулярний графік ізотерми при динамічній сорбції парів (ДСП) форми HC0. На Фіг. 32 представлений інфрачервоний спектр з Фур'є-перетворенням (FTIR) форми HC0. На Фіг. 33 представлений раманівський спектр HC0. На Фіг. 34 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми HD0. На Фіг. 35 представлений регулярний графік ізотерми при динамічній сорбції парів (ДСП) форми HD0. На Фіг. 36 показані рентгенівські порошкові дифрактограми (XRPD) форми HD 0 перед і після аналізу за допомогою динамічної сорбції парів (ДСП). На Фіг. 37 представлений нерегулярний графік ізотерми при динамічній сорбції парів (ДСП) форми HD0. На Фіг. 38 представлений інфрачервоний спектр з Фур'є-перетворенням (FTIR) форми HD0. На Фіг. 39 представлений раманівський спектр HD0. На Фіг. 40 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S20. На Фіг. 41 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S30. 2 UA 110604 C2 5 10 15 20 25 30 На Фіг. 42 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) S40. На Фіг. 43 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S50. На Фіг. 44 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S60. На Фіг. 45 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S70. На Фіг. 46 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S90. На Фіг. 47 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S100. На Фіг. 48 представлене накладення термограми диференціальної скануючої калориметрії (ДСК) і термограми термогравіметричного аналізу (ТГА) форми S120. На Фіг. 49 показане накладення рентгенівських порошкових дифрактограм (XRPD) форми A 0 після подрібнення. На Фіг. 50 показане накладення рентгенівських порошкових дифрактограм (XRPD) форми HC0 і HD0 після подрібнення протягом 15 хвилин. На Фіг. 51 представлена термограма диференціальної скануючої калориметрії (ДСК) форми HC0 і HD0 після подрібнення протягом 15 хвилин. ДОКЛАДНИЙ ОПИС ДАНОГО ВИНАХОДУ У ході даної роботи було виявлено існування ряду форм сполуки I. Отримання і опис даних форм розкрите в даному винаході. Спектральні дані, які стосуються даних форм, показані на Фіг. 1-51. Більш конкретно, було виявлено існування ряду різних фізичних форм сполуки I. Були виявлені дві поліморфні форми безводних кристалічних форм сполуки I (форми A0 і B0) і три поліморфні форми кристалічних моногідратних форм (HA0, HC0 і HD0). Букви А і В присвоюють даним безводним формам і гідратам, наприклад, з буквою Н попереду для позначення гідратних форм. Напис знизу '0' присвоюється додатково для позначення форм вільної основи. Крім того, в даному винаході описано дев'ять сольватів сполуки I (S2 0, S30, S40, S50, S60, S70, S90, S100 і S120). Також розкриті фармацевтичні композиції, які містять одну або більше з даних форм, а також фармацевтичні композиції, які додатково містять аморфну форму сполуки I (A s). Характерні XRPD піки для форми A0 перераховані в наступній таблиці 1. Параметри дифракційної рентгенограми форми A0 показані на Фіг. 1. 35 Таблиця 1 XRPD піка для форми A0 Пік № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Кут [°2-тета] 4,32 6,07 8,55 9,54 12,07 12,78 13,48 15,37 18,09 19,09 23,77 24,16 24,54 27,41 Міжплощинна відстань [ангстрем] 20,42 14,55 10,34 9,26 7,33 6,92 6,56 5,76 4,90 4,65 3,74 3,68 3,62 3,25 Інтенсивність [%] 100 99 79 44 69 31 11 80 40 17 5 7 6 7 Характерні XRPD піки для форми B0 перераховані в наступній таблиці 2. Параметри дифракційної рентгенограми форми B0 показані на Фіг. 2. 3 UA 110604 C2 Таблиця 2 XRPD піка для форми В0 Пік № 1 2 3 4 5 6 7 8 9 10 11 12 Кут [°2-тета] 7,16 7,89 10,55 10,77 15,81 16,54 18,53 19,27 21,20 24,04 24,61 24,65 Міжплощинна відстань [ангстрем] 12,33 11,20 8,38 8,21 5,60 5,35 4,78 4,60 4,19 3,70 3,62 3,61 Інтенсивність [%] 36 100 6 22 7 28 6 9 18 6 17 16 Характерні XRPD піки для форми HA0 перераховані в наступній таблиці 3. Параметри дифракційної рентгенограми форми HA0 показані на Фіг. 3. 5 Таблиця 3 XRPD піка для форми HA0 Пік № 1 2 3 4 5 Кут [°2-тета] 7,59 15,12 16,06 17,94 23,89 Міжплощинна відстань [ангстрем] 11,64 5,85 5,52 4,94 3,72 Інтенсивність [%] 100 7,88 6,36 5,41 7,95 Характерні XRPD піки для форми HC0 перераховані в наступній таблиці 4. Параметри дифракційної рентгенограми форми HC0 показані на Фіг. 4. Таблиця 4 XRPD піка для форми HC0 Пік № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Кут [°2-тета] 7,49 8,36 8,71 14,54 15,00 15,46 16,48 16,69 17,39 18,73 19,79 20,69 23,36 23,53 24,59 25,42 26,04 Міжплощинна відстань [ангстрем] 11,79 10,56 10,15 6,09 5,90 5,73 5,37 5,31 5,10 4,73 4,48 4,29 3,81 3,78 3,62 3,50 3,42 10 4 Інтенсивність [%] 10,37 100 22,84 8,62 12,97 5,78 7,79 14,92 31,23 9,00 8,55 7,10 5,86 5,43 43,43 13,96 5,27 UA 110604 C2 Характерні XRPD піки для форми HD0 перераховані в наступній таблиці 5. Параметри дифракційної рентгенограми форми HD0 показані на Фіг. 5. Таблиця 5 XRPD піка для форми HD0 Пік № 1 2 3 5 Кут [°2-тета] 7,60 8,99 15,16 Міжплощинна відстань [ангстрем] 11,62 9,83 5,84 Інтенсивність [%] 100 5,05 11,66 Характерні XRPD піки для форми S20 перераховані в наступній таблиці 6. Параметри дифракційної рентгенограми форми S20 показані на Фіг. 6. Таблиця 6 XRPD піка для форми S20 Пік № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 10 Кут [°2-тета] 8,56 9,80 10,62 11,04 12,68 14,64 16,07 17,18 17,23 19,75 22,24 23,02 23,31 27,06 27,85 Міжплощинна відстань [ангстрем] 10,32 9,02 8,32 8,01 6,98 6,04 5,51 5,16 5,14 4,49 3,99 3,86 3,81 3,29 3,20 Інтенсивність [%] 58,9 58,8 26,8 54,2 31,8 61,0 81,0 37,5 43,7 50,9 100,0 99,5 22,8 55,8 42,6 Характерні XRPD піки для форми S30 перераховані в наступній таблиці 7. Параметри дифракційної рентгенограми форми S30 показані на Фіг. 7. Таблиця 7 XRPD піка для форми S30 Пік № 1 2 3 4 5 6 7 8 9 10 11 Кут [°2-тета] 6,70 7,61 8,67 10,29 11,57 13,36 15,02 16,80 16,85 17,33 25,20 Міжплощинна відстань [ангстрем] 13,19 11,61 10,19 8,59 7,64 6,62 5,89 5,27 5,26 5,11 3,53 Інтенсивність [%] 54,7 12,5 100,0 13,3 16,7 23,3 11,7 30,8 22,1 7,1 7,1 Характерні XRPD піки для форми S40 перераховані в наступній таблиці 8. Параметри дифракційної рентгенограми форми S40 показані на Фіг. 8. 15 5 UA 110604 C2 Таблиця 8 XRPD піка для форми S40 Пік № 1 2 3 4 5 6 7 8 Кут [°2-тета] 7,95 8,42 8,60 13,92 17,20 21,07 21,30 24,46 Міжплощинна відстань [ангстрем] 11,12 10,49 10,28 6,36 5,15 4,21 4,17 3,64 Інтенсивність [%] 9,3 100,0 21,9 17,4 14,1 5,9 6,4 17,3 Характерні XRPD піки для форми S50 перераховані в наступній таблиці 9. Параметри дифракційної рентгенограми форми S50 показані на Фіг. 9. Таблиця 9 XRPD піка для форми S50 Пік № 1 2 3 4 Кут [°2-тета] 4,46 7,67 8,86 11,71 Міжплощинна відстань [ангстрем] 19,80 11,51 9,97 7,55 Інтенсивність [%] 28,9 100,0 31,3 14,5 5 Характерні XRPD піки для форми S60 перераховані в наступній таблиці 10. Параметри дифракційної рентгенограми форми S60 показані на Фіг. 10. Таблиця 10 XRPD піка для форми S60 Пік № 1 2 3 4 5 6 7 8 9 10 10 Кут [°2-тета] 8,36 8,68 11,10 15,42 16,21 16,94 17,25 17,39 23,31 26,27 Міжплощинна відстань [ангстрем] 10,57 10,18 7,97 5,74 5,46 5,23 5,14 5,10 3,81 3,39 Інтенсивність [%] 19,7 100,0 46,3 15,7 21,6 33,2 14,7 29,0 71,4 23,7 Характерні XRPD піки для форми S70 перераховані в наступній таблиці 11. Параметри дифракційної рентгенограми форми S70 показані на Фіг. 11. Таблиця 11 XRPD піка для форми S70 Пік № 1 2 3 4 Кут [°2-тета] 4,50 7,70 8,90 11,76 Міжплощинна відстань [ангстрем] 19,62 11,47 9,93 7,52 6 Інтенсивність [%] 35,4 100,0 42,3 15,6 UA 110604 C2 Характерні XRPD піки для форми S90 перераховані в наступній таблиці 12. Параметри дифракційної рентгенограми форми S90 показані на Фіг. 12. Таблиця 12 XRPD піка для форми S90 Пік № 1 2 3 4 5 5 Кут [°2-тета] 8,34 8,67 16,68 17,33 24,57 Міжплощинна відстань [ангстрем] 10,59 10,19 5,31 5,11 3,62 Інтенсивність [%] 100,0 23,0 7,2 8,5 39,3 Характерні XRPD піки для форми S100 перераховані в наступній таблиці 13. Параметри дифракційної рентгенограми форми S100 показані на Фіг. 13. Таблиця 13 XRPD піка для форми S100 Пік № 1 2 3 4 5 6 10 Кут [°2-тета] 4,45 7,62 8,79 11,62 15,84 17,67 Міжплощинна відстань [ангстрем] 19,83 11,59 10,06 7,61 5,59 5,02 Інтенсивність [%] 42,6 100,0 43,4 14,7 11,3 12,9 Характерні XRPD піки для форми S120 перераховані в наступній таблиці 14. Параметри дифракційної рентгенограми форми S120 показані на Фіг. 14. Таблиця 14 XRPD піка для форми S120 Пік № 1 2 3 4 5 6 7 8 9 10 15 20 Кут [°2-тета] 7,63 7,67 8,63 9,00 14,78 17,13 17,39 17,99 18,15 24,46 Міжплощинна відстань [ангстрем] 11,58 11,51 10,24 9,82 5,99 5,17 5,09 4,93 4,88 3,64 Інтенсивність [%] 100 92 12 55 10 12 11 33 10 60 Відповідно, в одному аспекті даний винахід стосується кристалічної форми сполуки I, яка являє собою форму A0, форму B0 або їх суміш. У наступному аспекті кристалічна форма являє собою форму A0. У іншому аспекті кристалічна форма являє собою форму B 0. У наступному аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, яка містить один або більше з наступних піків: 4,32, 6,07, 8,55, 12,07 і/або 15,37±0,2 градуса 2-тета. У іншому аспекті кристалічна форма має порошкову рентгенівську дифрактограму, в основному як зображено на Фіг. 1. У додатковому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 7,16, 7,89, 10,77, 16,54 і/або 21,20±0,2 градуса 2-тета. У іншому аспекті кристалічна форма має порошкову рентгенівську дифрактограму, в основному як зображено на Фіг. 2. 7 UA 110604 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наступний аспект даного винаходу стосується кристалічної форми сполуки I, яка являє собою форму HA0, форму HC0, форму HD0 або їх суміш. У іншому аспекті кристалічна форма являє собою форму HA0. У наступному аспекті кристалічна форма являє собою форму HC 0. У додатковому аспекті кристалічна форма являє собою форму HD 0. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 7,59, 15,12, 16,06, 17,94 і/або 23,89±0,2 градуса 2-тета. У наступному аспекті кристалічна форма має порошкову рентгенівську дифрактограму, в основному як зображено на Фіг. 3. У додатковому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 8,36, 8,71, 16,69, 17,39 і/або 24,59±0,2 градуса 2-тета. У іншому аспекті кристалічна форма має порошкову рентгенівську дифрактограму, в основному як зображено на Фіг. 4. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 7,60, 8,99 і/або 15,16±0,2 градуса 2-тета. У наступному аспекті, кристалічна форма має порошкову рентгенівську дифрактограму, в основному як зображено на Фіг. 5. Ще інший аспект даного винаходу стосується кристалічної форми сполуки I, яка являє собою форму S20, форму S30, форму S40, форму S50, форму S60, форму S70, форму S90, форму S100, форму S120 або їх суміш. У наступному аспекті кристалічна форма являє собою форму S2 0. У іншому аспекті кристалічна форма являє собою форму S3 0. У додатковому аспекті кристалічна форма являє собою форму S40. У наступному аспекті кристалічна форма являє собою форму S50. У ще додатковому аспекті кристалічна форма являє собою форму S6 0. У іншому аспекті кристалічна форма являє собою форму S70. У наступному аспекті кристалічна форма являє собою форму S90. У іншому аспекті кристалічна форма являє собою форму S10 0. У наступному аспекті, кристалічна форма являє собою форму S120. У наступному аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 8,56, 14,64, 16,07, 22,24 і/або 23,02±0,2 градуса 2-тета. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 6,70, 8,67, 13,36, 16,80 і/або 16,85±0,2 градуса 2-тета. У додатковому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 8,42, 8,60, 13,92, 17,20 і/або 24,46±0,2 градуса 2-тета. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 4,46, 7,67, 8,86 і/або 11,71±0,2 градуса 2-тета. У додатковому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 8,68, 11,10, 16,94, 17,39 і/або 23,31±0,2 градуса 2-тета. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 4,50, 7,70, 8,90 і/або 11,76±0,2 градуса 2-тета. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 8,34, 8,67, 16,68, 17,33 і/або 24,57±0,2 градуса 2-тета. У додатковому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 4,45, 7,62, 8,79, 11,62 і/або 17,67±0,2 градуса 2-тета. У іншому аспекті кристалічна форма характеризується порошковою рентгенівською дифрактограмою, що містить один або більше з наступних піків: 7,63, 7,67, 9,00, 17,99 і 24,46±0,2 градуса 2-тета. Додатковий аспект даного винаходу стосується способу отримання кристалічної форми сполуки I, яка являє собою форму A0, що включає стадії (a) суспендування сполуки I у вуглеводнях (таких як гептан або толуол); (b) охолоджування отриманої в результаті суспензії; (с) фільтрування отриманої в результаті суспензії і (d) сушіння залишку на фільтрі. У одному аспекті сполуку I суспендують в 26-45 об'ємах гептану. У іншому аспекті сполуку I суспендують в 45 об'ємах гептану. У додатковому аспекті стадію (a) здійснюють при 79-83 °C. У іншому аспекті стадію (a) здійснюють при 85 °C. У ще іншому аспекті стадію (a) здійснюють протягом 24-48 годин. У наступному аспекті стадію (a) здійснюють протягом 45 годин. У іншому аспекті стадію (b) здійснюють при температурі 30-65 °C. У іншому аспекті стадію (b) здійснюють при 65 °C. У додатковому аспекті стадію (d) здійснюють при кімнатній температурі протягом 0,33-3 годин. У іншому аспекті стадію (d) здійснюють при кімнатній температурі протягом трьох годин. Наступний аспект даного винаходу стосується способу отримання кристалічної форми сполуки I, яка являє собою форму A0, що включає стадії (a) розчинення сполуки I в розчиннику; (b) фільтрування отриманого в результаті розчину; (с) часткової відгонки розчинника при додаванні антирозчинника для осадження сполуки I; (d) додаткового упарювання отриманої в 8 UA 110604 C2 5 10 15 20 25 30 35 40 45 50 55 60 результаті суспензії при додаванні додаткової кількості антирозчинника для зниження об'єму розчинника, що застосовується на стадії (a); (е) нагрівання суспензії для досягнення повного перетворення в форму A0; (f) охолоджування; (g) збирання продукту за допомогою фільтрації і (h) сушіння. У наступному аспекті стадію (a) здійснюють, застосовуючи 27-35 об'ємів THF. У іншому аспекті стадію (a) здійснюють, застосовуючи 30 об'ємів THF. У наступному аспекті розчин, що отримується на стадії (a), можна необов'язково обробляти секвестрантом металів або вугіллям. У ще наступному аспекті стадія фільтрації (b) включає одну або обидві з наступних стадій: (i) фільтрування для видалення секвестранта металів і (ii) полірувальне фільтрування через 1-мікроннийвбудовуваний картриджний фільтр. У наступному аспекті розчинник, присутній на стадії (с), упарюють до 60-90 % його первинного об'єму. У додатковому аспекті стадію (с) здійснюють, застосовуючи вуглеводень (такий як гептан) як антирозчинник. У іншому аспекті стадію (d) здійснюють до того, як залишається 5 % по об'єму THF. У іншому аспекті стадію (е) здійснюють при температурі приблизно 90-96 °C. У додатковому аспекті стадію (е) можна необов'язково пропускати. У іншому аспекті суспензію струшують протягом приблизно 3-5 годин. У наступному аспекті стадію (f) здійснюють при температурі навколишнього середовища (25±5 °C). У додатковому аспекті фільтрацію стадії (g) здійснюють, застосовуючи сухий інертний газ. У іншому аспекті стадію (h) здійснюють при температурі аж до 80 °C. У іншому аспекті залишкову воду і/або розчинник(и) видаляють азеотропно. Інший аспект даного винаходу стосується фармацевтичної композиції, що містить форму A0, форму B0, форму HA0, форму HC0 або форму HD0 або їх суміш. Наступний аспект стосується способу лікування раку, який включає стадію введення потребуючому лікування пацієнту терапевтично ефективної кількості фармацевтичної композиції, що містить форму A0, форму B0, форму HA0, форму HC0 або форму HD0 або їх суміш. У додатковому аспекті даний винахід стосується способу лікування раку, що включає стадію введення потребуючому лікування пацієнту терапевтично ефективної кількості фармацевтичної композиції, що містить форму A0. ТЕРМІНОЛОГІЯ Термін "аморфний", як застосовують в даному винаході, стосується відсутності характерної форми кристала або кристалічної структури. Термін "антирозчинник", як застосовують в даному винаході, стосується розчинника, в якому сполука є в основному нерозчинною. Термін "кристалічний", як застосовують в даному винаході, стосується молекул або площин зовнішніх поверхонь, які мають регулярно повторювану структуру. Термін "кристалічна форма", як застосовують в даному винаході, стосується твердої хімічної сполуки або суміші сполук, яка забезпечує характеристичною діаграмою піків при аналізі порошковою рентгенівською дифракцією; вона включає, але не обмежується цим, поліморфні форми, сольвати, гідрати, співкристали і десольватовані сольвати. Термін "поліморфний" або "поліморфізм" визначають як можливість щонайменше двох кристалічних структур для однієї і тієї ж хімічної молекули. Термін "розчинена речовина", як застосовують в даному винаході, стосується речовини, розчиненої в іншій речовині, звичайно компоненту розчину, присутньому в невеликій кількості. Термін "розчин", як застосовують в даному винаході, стосується суміші, що містить щонайменше один розчинник і щонайменше одну сполуку, щонайменше частково розчинену в розчиннику. Термін "сольват", як застосовують в даному винаході, стосується кристалічної речовини, яка містить в кристалічній структурі молекули розчинника. Термін "розчинник", як застосовують в даному винаході, стосується речовини, звичайно рідини, яка здатна повністю або частково розчиняти іншу речовину, звичайно тверду речовину. Розчинники для здійснення на практиці даного винаходу включають, але не обмежуються, воду, оцтову кислоту, ацетони, ацетонітрил (ACN), бензиловий спирт, 1-бутанол, 2-бутанол, 2бутанон, бутиронітрил, трет-бутанол, N-бутилацетат, хлорбензол, хлороформи, циклогексан, 1,2-дихлоретан (DCE), дихлорметан (DCM), дибутиловий ефір діетиленгліколю (DGDE), діізопропіламін (DIPA), діізопропіловий ефір (DIPE), 1,2-диметоксіетан (DE), Ν,Νдиметилацетамід (DMA), 4-диметиламінопіридин (DMAP), Ν,Ν-диметилформамід (DMF), диметилсульфоксид, 1,4-діоксан, етиленглікольдиметиловий ефір, етанол, етилацетат, етилдіізопропіламін, етиленгліколь, етилформіат, мурашину кислоту, гептани, ізобутиловий спирт, ізопропілацетат (IPAC), ізопропіловий спирт (IPA), ізопропіламін, літійдіізопропіламід (LDA), метанол, метоксибензол (MTB), метилацетат, метилетилкетон (MEK), метилізобутилкетон (MIK), 2-метилтетрагідрофуран, метил трет-бутиловий ефір (MTBE), 1:1 формамід:вода; 1:1 N-метилпіролідинон (NMP):вода; 2-пентанон, 3-пентанон, 1-пентанол, 1,2пропандіол, 2-пропанол (IPA), 1-пропанол, пропанонітрил, пропіленкарбонат, 1,2 9 UA 110604 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропіленгліколь (PG), піридин, тетрагідрофуран (THF), тетрагідропіран (THP), толуол, триетиламін, ксилол, їх суміші і подібні. Дані розчинники розділяють на п'ять класів відповідно до їх функціональної групи: Клас 1: "протонні" або розчинники (кислоти Льюїса), які подають водневий зв'язок, включаючи бензиловий спирт, етанол, IPA, метанол і воду; Клас 2: розчинники (основи Льюїса), які акцептують водневий зв'язок, включаючи ацетон, 1,4-діоксан, DMF, етилацетат, MEK, MTBE, THF і воду; Клас 3: полярні апротонні розчинники, які має більш прийнятний термін "негідроксильні розчинники", включаючи ацетонітрил, DMA, DMF і DMSO; Клас 4: хлоровуглеводневі розчинники, які включають хлороформ; Клас 5: вуглеводневі розчинники, і насичені і ненасичені, включаючи н-гептан, толуол, п-ксилол і ксилол. Термін "терапевтично ефективна кількість", як застосовують в даному винаході, стосується кількості, якої необхідно, як визначено, для надання передбачуваного фізіологічного ефекту і пов'язаного з вказаним лікарським засобом, як виміряно згідно з традиційними фармакокінетичним способами і методиками, для вказаного шляху введення. Прийнятні і конкретні терапевтично ефективні кількості може легко визначити лікуючий фахівець, що встановлює діагноз, як фахівець в даній галузі техніки, застосуванням загальноприйнятих способів. Ефективна доза буде змінюватися в залежності від ряду чинників, включаючи тип і стадію захворювання або розладу, загальний стан здоров'я конкретного пацієнта, відносну біологічну ефективність вибраної сполуки, склад активного агента з прийнятними допоміжними речовинами і шлях введення. Звичайно кристалічні форми будуть вводити при більш низьких дозах з поступовим збільшенням до досягнення необхідного ефекту. Якщо не встановлено інакше, проценти, вказані в даному описі, являють собою проценти мас./мас.(w/w). Термін "фармацевтично прийнятні допоміжні речовини", як застосовують в даному винаході, включає будь-які і всі розчинники, диспергатори, покриття, антибактеріальні і протигрибкові агенти, агенти, які додають ізотонічності, і агенти, які затримують всмоктування, і подібні. Застосування даних середовищ і агентів для фармацевтично активних речовин є добре відомим в даній галузі техніки, наприклад, описується в Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro, A. R., Ed.; Lippincott Williams & Wilkins: Philadelphia, PA, 2000. За винятком випадків, коли будь-яке загальноприйняте середовище або агент є несумісним з активним інгредієнтом, передбачається його застосування в терапевтичних композиціях. Додаткові активні інгредієнти можна також вводити в композиції. Для терапевтичних цілей кристалічні форми даного винаходу можна вводити будь-яким способом, який приводить в результаті до контакту активної лікарської речовини з місцем її дії в організмі суб'єкта. Кристалічні форми можна вводити будь-яким загальноприйнятим способом, придатним для застосування в поєднанні з фармацевтичними засобами, або у вигляді окремих терапевтичних засобів або в комбінації з іншими терапевтичними засобами, такими як, наприклад, анальгетики. Кристалічні форми даного винаходу переважно вводити в терапевтично ефективних кількостях для лікування захворювання і розладів, описаних в даному винаході, у суб'єкта, який потребує лікування. При терапевтичному або профілактичному застосуванні кристалічні форми даного винаходу можна вводити будь-яким шляхом, яким звичайно вводять лікарські засоби. Дані шляхи введення включають внутрішньоочеревинний, внутрішньовенний, внутрішньом'язовий, підшкірний, інтратекальний, інтратрахеальний, інтравентрикулярний, пероральний, букальний, ректальний, парентеральний, інтраназальний, трансдермальний або внутрішньошкірний. Введення може бути системним або локалізованим. Кристалічні форми, описані в даному винаході, можна вводити в чистій формі, змішаній з іншими активними інгредієнтами або змішаній з фармацевтично прийнятними нетоксичними допоміжними речовинами або носіями. Оральні композиції будуть звичайно містити інертний носій, який є розріджувачем, або носій, придатний для вживання в їжу. Фармацевтично сумісні зв'язувальні агенти і/або допоміжні речовини можна включати як частину композиції. Таблетки, пілюлі, капсули, пастилки і подібні можуть містити будь-який з наступних інгредієнтів або сполук аналогічної природи: зв'язувальний агент, такий як мікрокристалічна целюлоза, трагакантова камедь або желатин; допоміжна речовина, така як крохмаль або лактоза, диспергатор, такий як альгінова кислота, примогель або кукурудзяний крохмаль; мастильний агент, такий як стеарат магнію; регулятор сипкості, такий як колоїдний діоксид кремнію; підсолоджувач, такий як сахароза або сахарин; або ароматизатор, такий як перцева м'ята, метилсаліцилат або апельсиновий ароматизатор. Коли стандартною лікарською формою є капсула, вона може містити на додачу до речовин вищезгаданого типу рідкий носій, такий як жирне масло. Крім того, стандартні лікарські форми можуть містити різні інші речовини, які змінюють фізичну форму лікарської форми, наприклад, покриття з цукру, шелак або кишковорозчинні агенти. Крім 10 UA 110604 C2 5 10 15 20 25 30 35 40 45 50 55 60 того, сироп може містити на додачу до активних сполук сахарозу як підсолоджувач і певні консерванти, барвники, фарбувальні речовини і ароматизатори. Альтернативні препарати для введення включають стерильні водні або неводні розчини, суспензії і емульсії. Прикладами неводних розчинників є диметилсульфоксид, спирти, пропіленгліколь, поліетиленгліколь, рослинні олії, такі як оливкова олія, і складні ін'єктовані органічні ефіри, такі як етилолеат. Водні носії включають суміші спиртів і води, буферні середовища і соляний розчин. Внутрішньовенні середовища включають підкріплювачі середовища і поживних речовин, електролітні підкріплювачі, такі як підкріплювачі на основі розчину Рінгера з декстрозою, і подібні. Можуть також бути присутніми консерванти і інші добавки, такі як, наприклад, протимікробні речовини, антиоксиданти, хелатоутворювальні речовини, інертні гази і подібні. Переважні способи введення кристалічних форм ссавцем включають внутрішньоочеревинну ін'єкцію, внутрішньом'язову ін'єкцію і внутрішньовенне вливання. Різні рідкі склади є можливими для даних способів доставки, включаючи соляний розчин, спирт, DMSO і розчини на основі води. Концентрація може змінюватися в залежності від дози і об'єму, які треба доставити, і може знаходитися в діапазоні від приблизно 1 до приблизно 1000 мг/мл. Інші складові рідких складів можуть включати консерванти, неорганічні солі, кислоти, основи, буфери, поживні речовини, вітаміни або інших фармацевтичних агентів, такі як анальгетики або додаткові інгібітори PARP і кіназ. ВИМІРЮВАЛЬНЕ ОБЛАДНАННЯ Порошкова рентгенівська дифракція (XRPD) XRPD рентгенограми реєстрували на PANalytical X' Pert Pro дифрактометрі, застосовуючи Cu Kα випромінювання при 40 кВ і 40 мА. Кремнієвий стандарт застосовували для перевірки настройки рентгенівської трубки. Зразок притискували до кварцової пластини на нульовому рівні в алюмінієвому фіксаторі. Стандартні знімки порошкової рентгенограми отримують від приблизно 2 до 40° 2θ з 0,0080° розміром кроку і 96,06-секундним часом рахунку, що приводило в результаті до швидкості розгортки 0,5°/хв. Для даних монокристалічних досліджень відібрані кристали покривають паратоновим маслом і швидко заморожують на Oxford diffraction CCD дифрактометрі (Xcalibur S, з Sapphire детектором). Дані збирають за допомогою способів з детектором зі стандартною зоною. Структури вирішують і уточнюють за допомогою SHELXTL пакету програм. Програмне уточнення методом Рітвельда параметрів монокристала на основі отриманої XRPD рентгенограми добре узгоджується з не нез'ясовними піками. Порошкова рентгенівська дифракція зі змінною температурою (VT-XRPD) Дослідження із змінною температурою проводили в атмосфері азоту з Anton Paar TTK450 камерою для температурних випробувань з комп'ютерним контролем за допомогою Anton Paar TCU100 пристрою для контролю температури. Застосовували дві схеми вимірювання, обмежену і безперервну. У обмеженому режимі вимірювання здійснювали тільки тоді, коли TK450 камера досягала необхідної температури. У безперервному режимі зразок нагрівали при швидкості 10 °C/хвилина, і отримували швидкі скани при зміні температури. Після досягнення необхідної температури зразок охолоджували при швидкості 30 або 35 °C/хвилина і отримували більш повільні скани при 25 °C. Температури вибирали на основі ДСК результатів. Диференціальна скануюча калориметрія (ДСК) Криві нагріву отримували, застосовуючи Perkin-Elmer Sapphire ДСК пристрій, забезпечений автоматичним пробовідбірником, керований Pyris програмним забезпеченням версії 6.0, калібрований індієм перед аналізом. Тверді зразки 1-11 мг зважували в 20 мкл відкритих алюмінієвих кюветах для зразків. Потім ДСК кювету продували азотом, і температуру підвищували від 0° до 275 °C при швидкості 10 °C/хвилина. Термогравіметричний аналіз (ТГА) Криві нагріву отримували, застосовуючи Perkin-Elmer Pyris 1 TGA пристрій, керований Pyris програмним забезпеченням версії 6.0, калібрований моногідратом оксалату кальцію. ТГА зразки між 1-15 мг перевіряли на процентну втрату ваги при нагріванні від 25° до 400 °C з швидкістю 10 °C/хв. в печі, що продувається гелієм при приблизно 50 мл/хв. Динамічна сорбція парів (ДСП) Експерименти з гравіметричною сорбцією парів здійснювали, застосовуючи DVS-HT пристрій (Surface Measurement Systems, London, UK). Даний пристрій вимірює поглинання і втрату парів гравіметрично, застосовуючи реєструючі вагу ультрамікроваги з ваговим розділенням ±0,1 мкг. Парціальний тиск парів (±1,0 %) навколо зразка контролюють змішенням насиченого і сухого потоків газу-носія, застосовуючи електронні регулятори масової витрати. Необхідну температуру підтримують в діапазоні ±0,1 °C. 11 UA 110604 C2 5 10 15 20 Зразки (10-25 мг) вміщують в DVS-HT пристрій при необхідній температурі. Проводять два типи експериментів з динамічною сорбцією парів: 1. Зразок спочатку сушать в потоці сухого повітря (
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel forms of a multicyclic compound
Автори англійськоюBierlmaier, Stephen, Christie, Michael, Courvoisier, Laurent, Field, R. Scott, Haltiwanger, R. Curtis, He, Linli, Jacobs, Martin J., Kress, Michael, Mckean, Robert, E., Mowrey, Dale R., Petraitis, Joseph, Yazdanian, Mehran
Автори російськоюБирлмейер Стефен, Кристи Майкл, Курвуазье Лоран, Филд Р. Скотт, Холтиванджер Р. Кертис, Хи Линли, Джейкобс Мартин Дж., Кресс Майкл, Маккин Роберт Е., Маури Дейл Р., Петрейтис Джозеф, Язданиан Мехран
МПК / Мітки
МПК: A61K 31/407, A61P 25/28, C07D 487/04
Мітки: поліциклічної, кристалічна, сполуки, форма
Код посилання
<a href="https://ua.patents.su/66-110604-kristalichna-forma-policiklichno-spoluki.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма поліциклічної сполуки</a>
Попередній патент: Уніфікована упаковка і спосіб її виготовлення
Наступний патент: Застосування toll-подібного рецептора і агоніста toll-подібного рецептора для лікування раку
Випадковий патент: Пристрій агломераційного одержання металургійної сировини