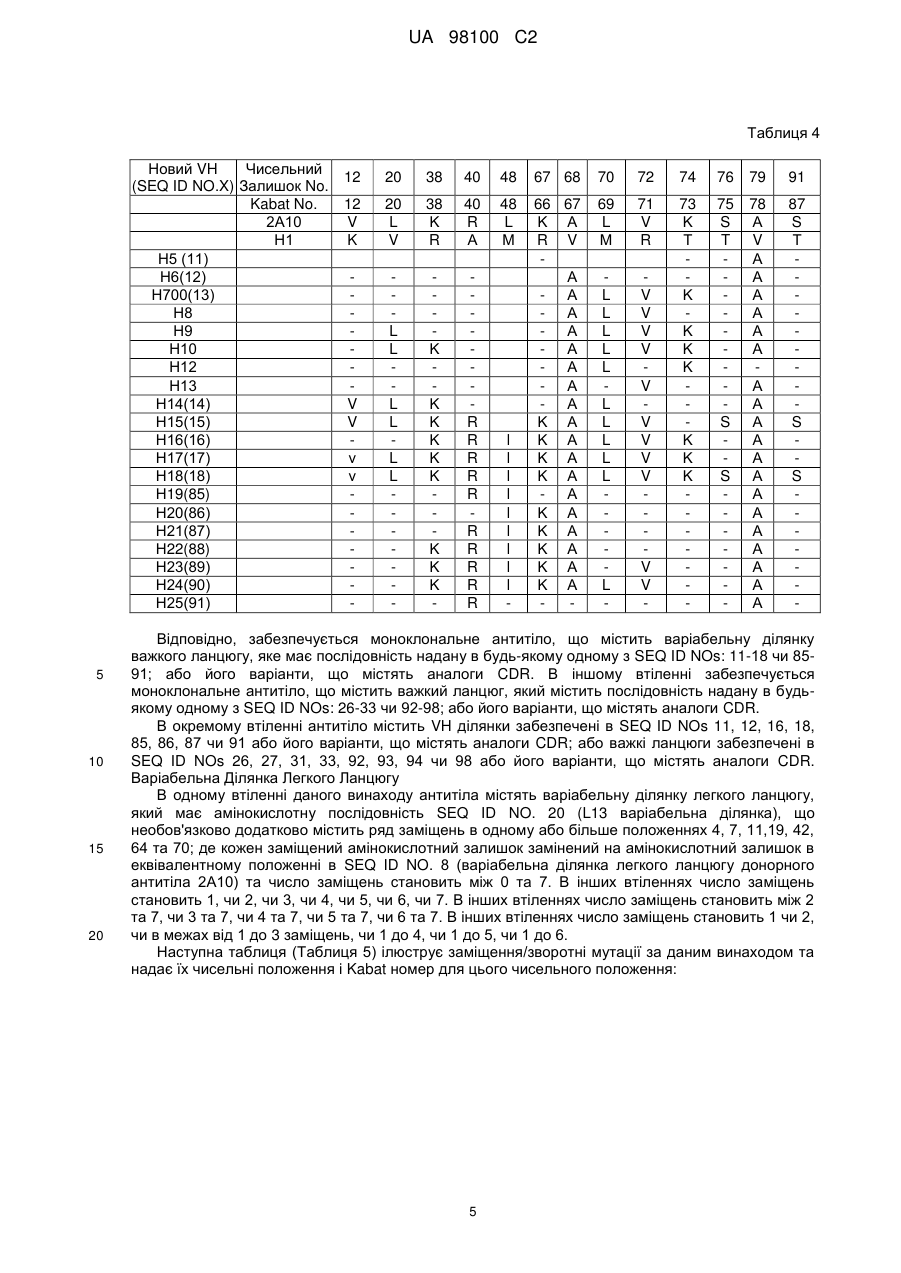
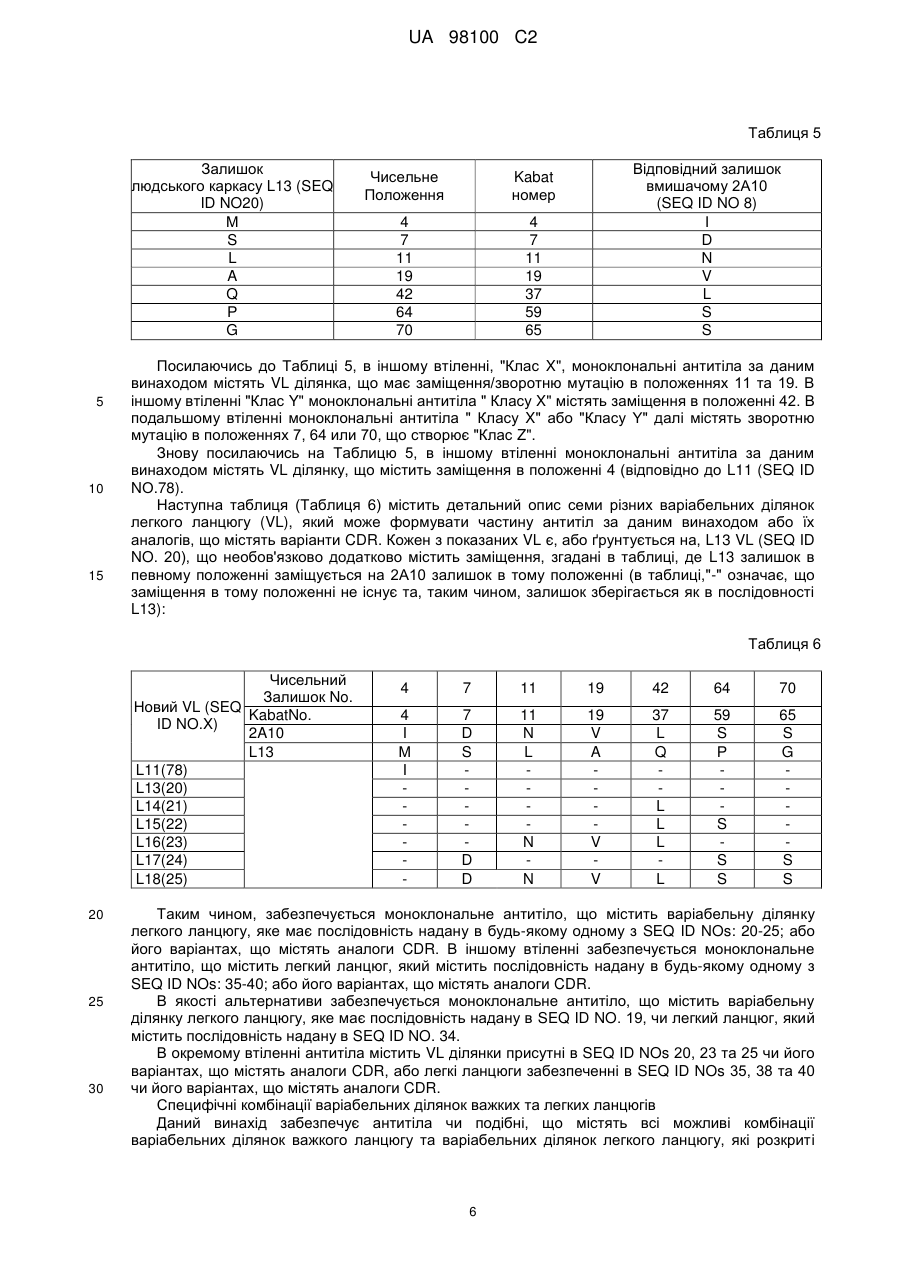
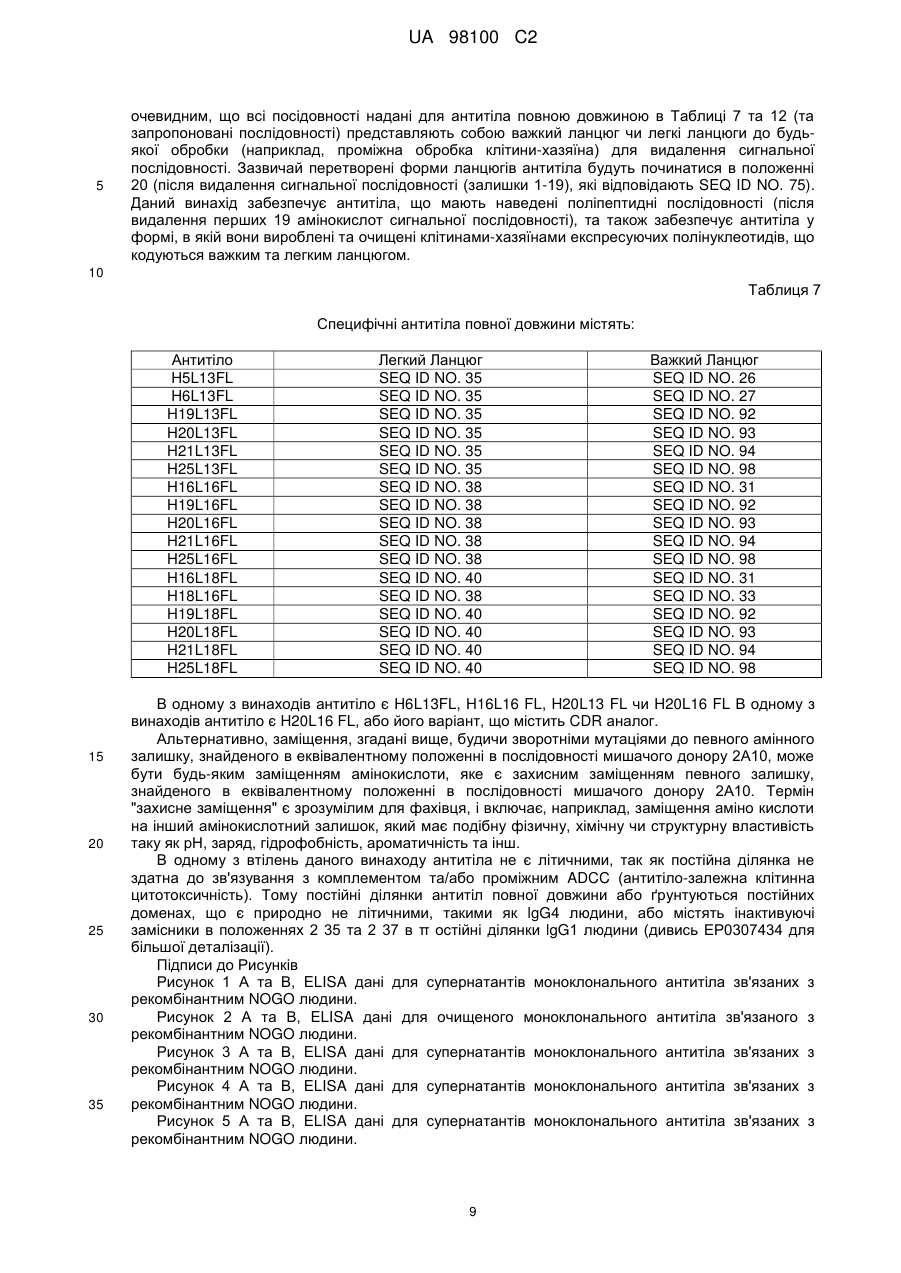
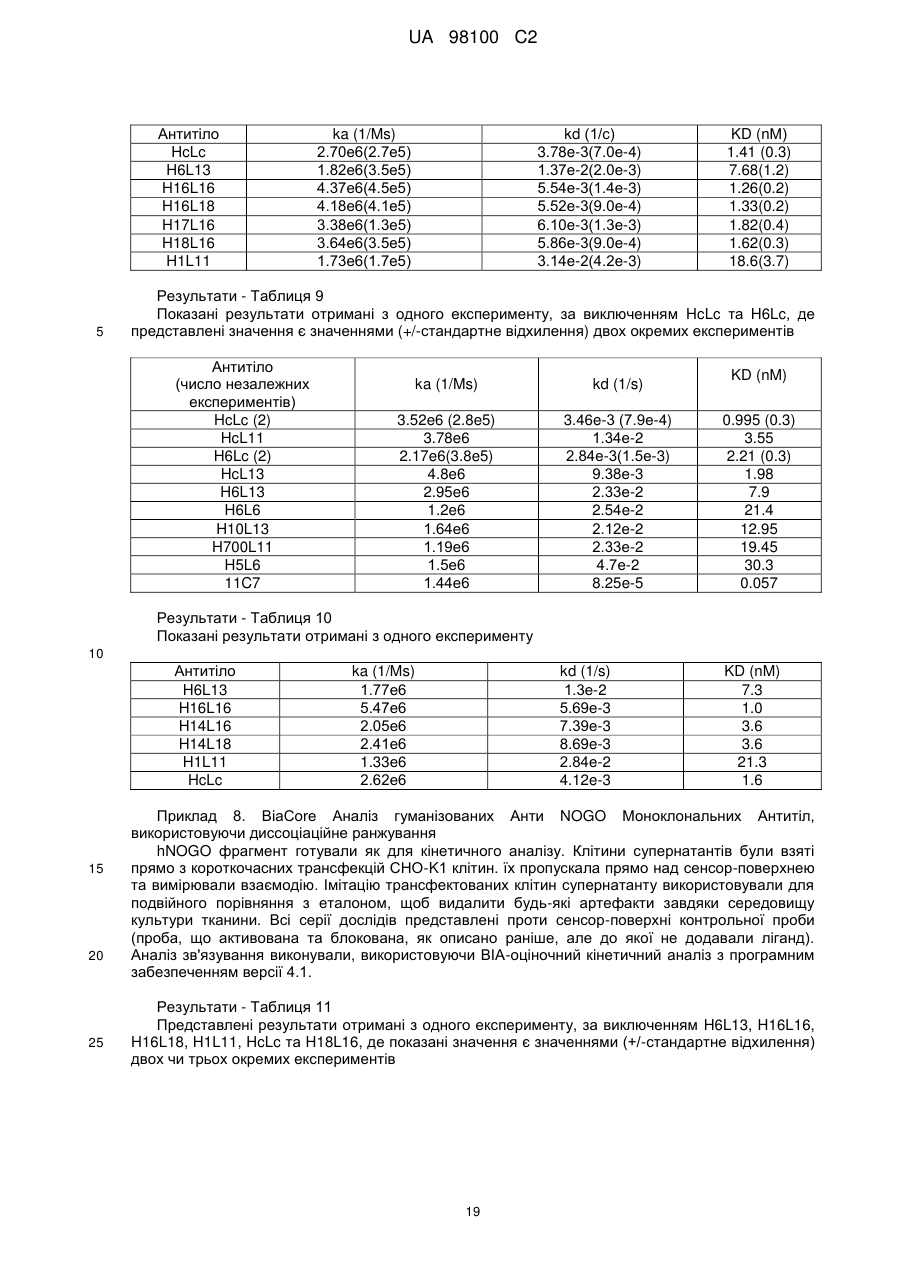
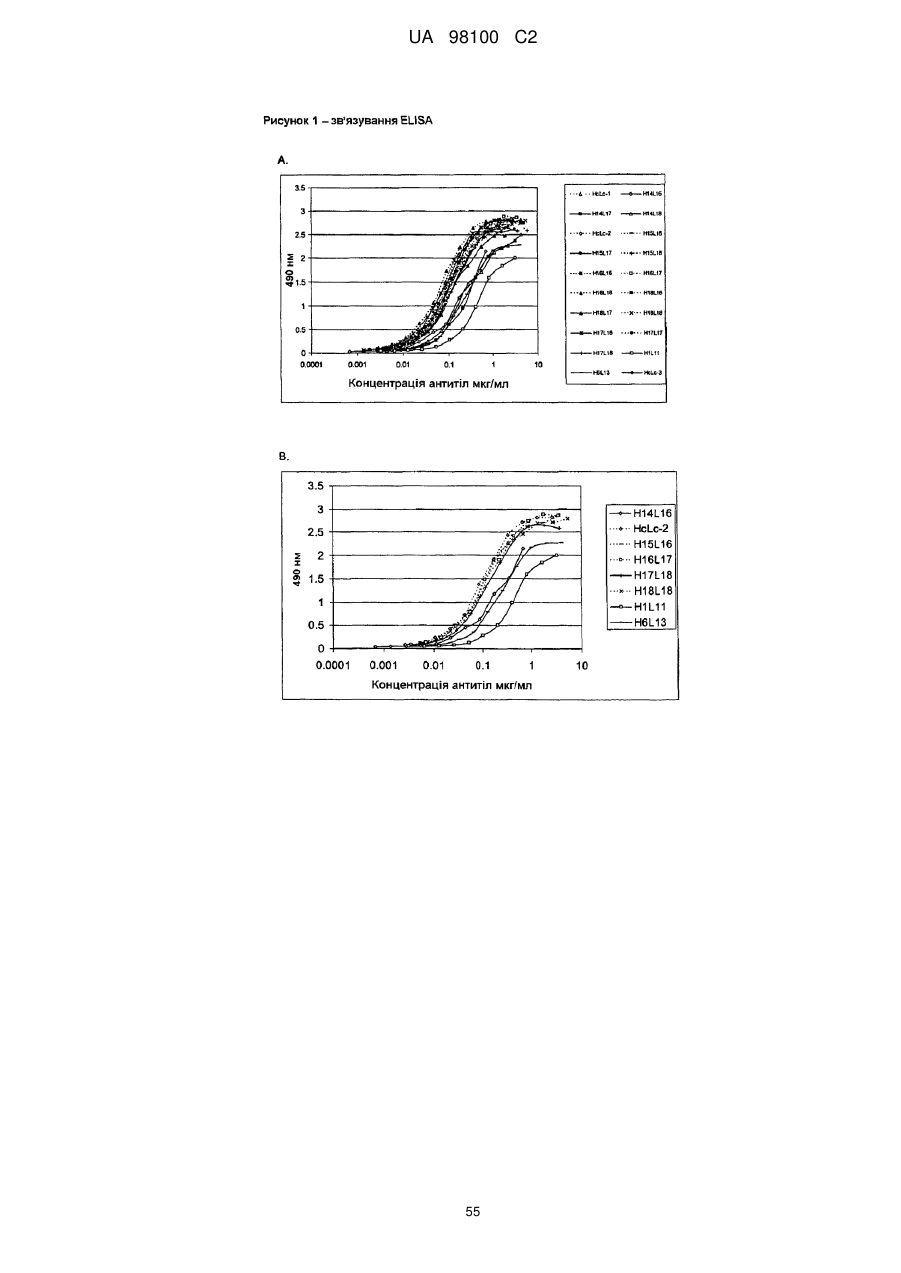
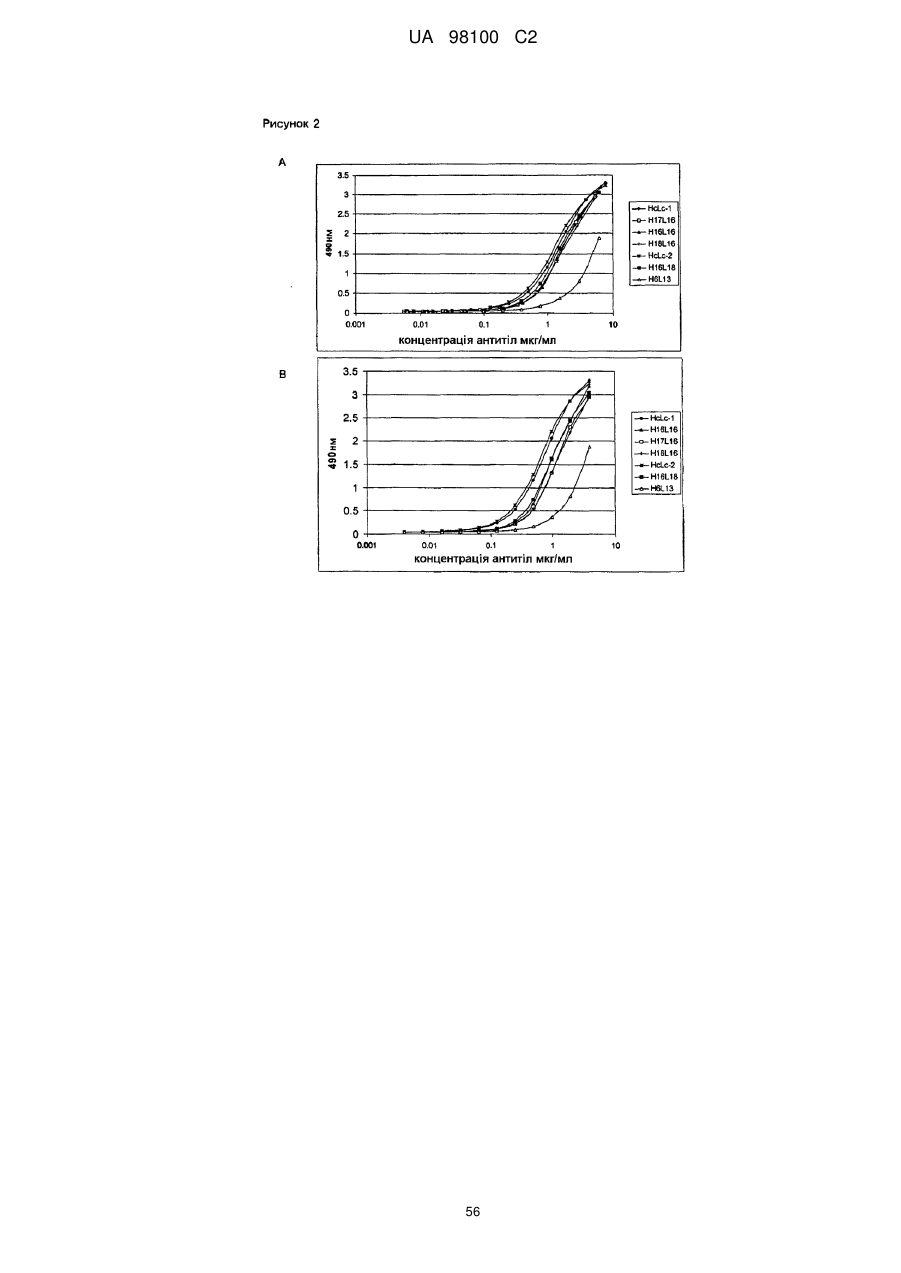
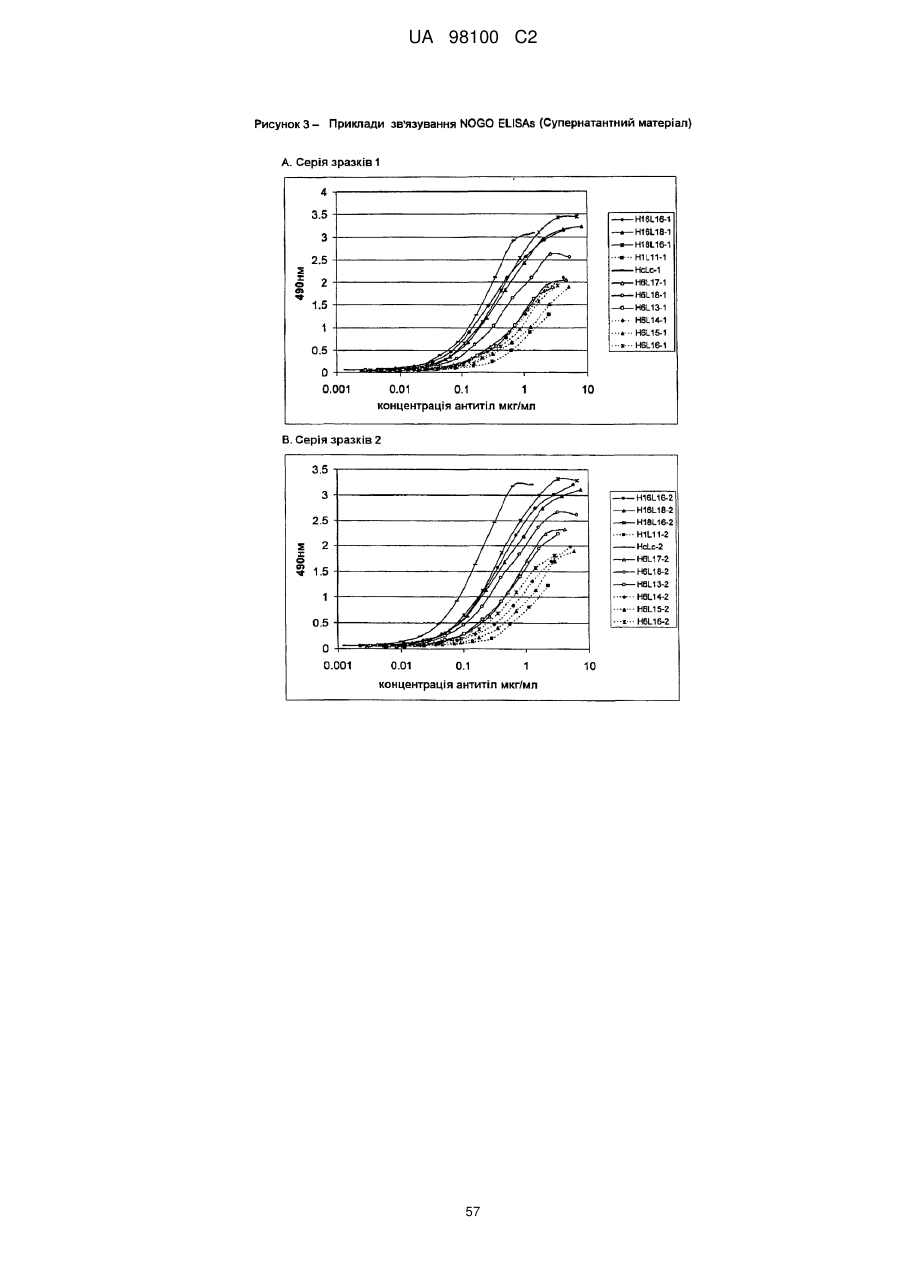
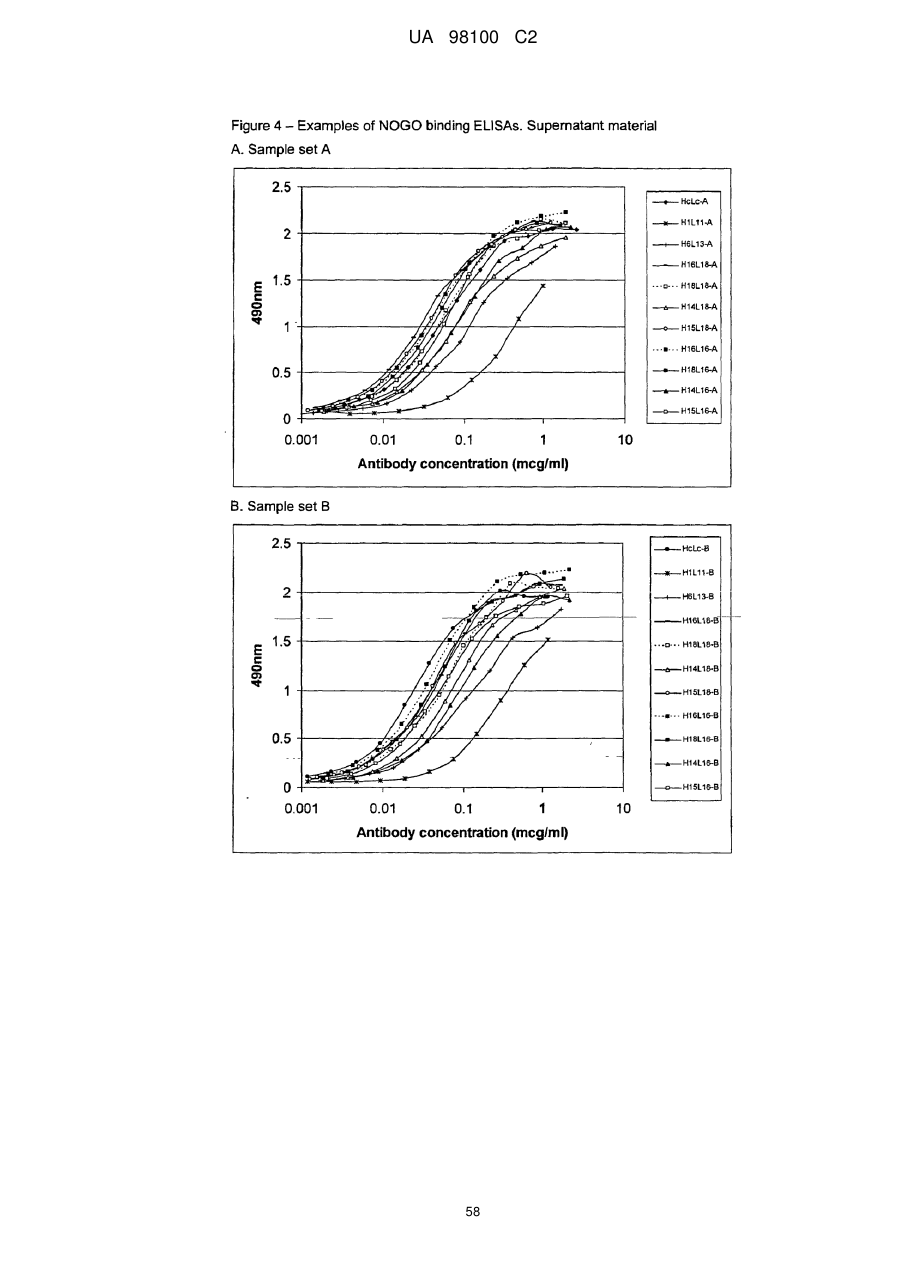
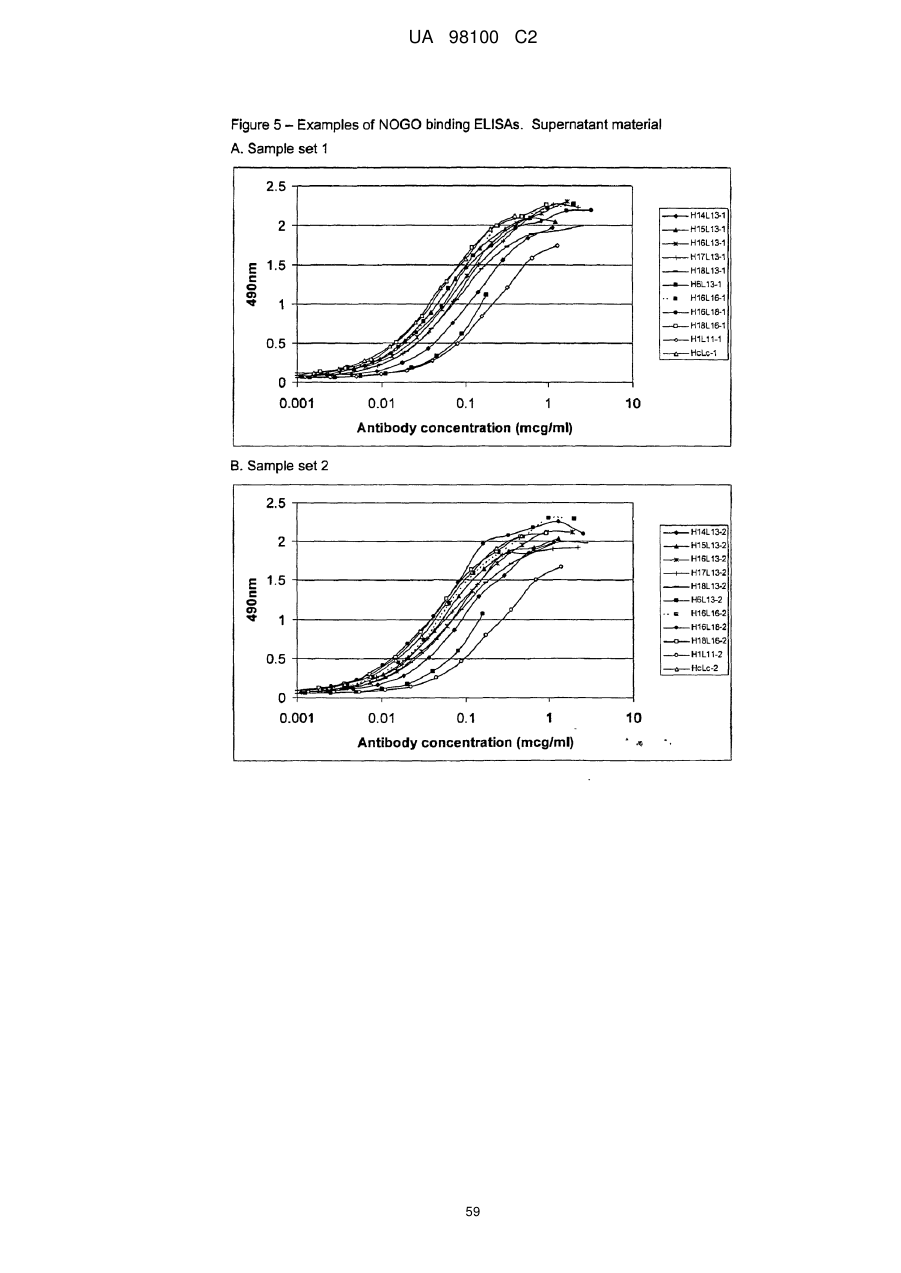
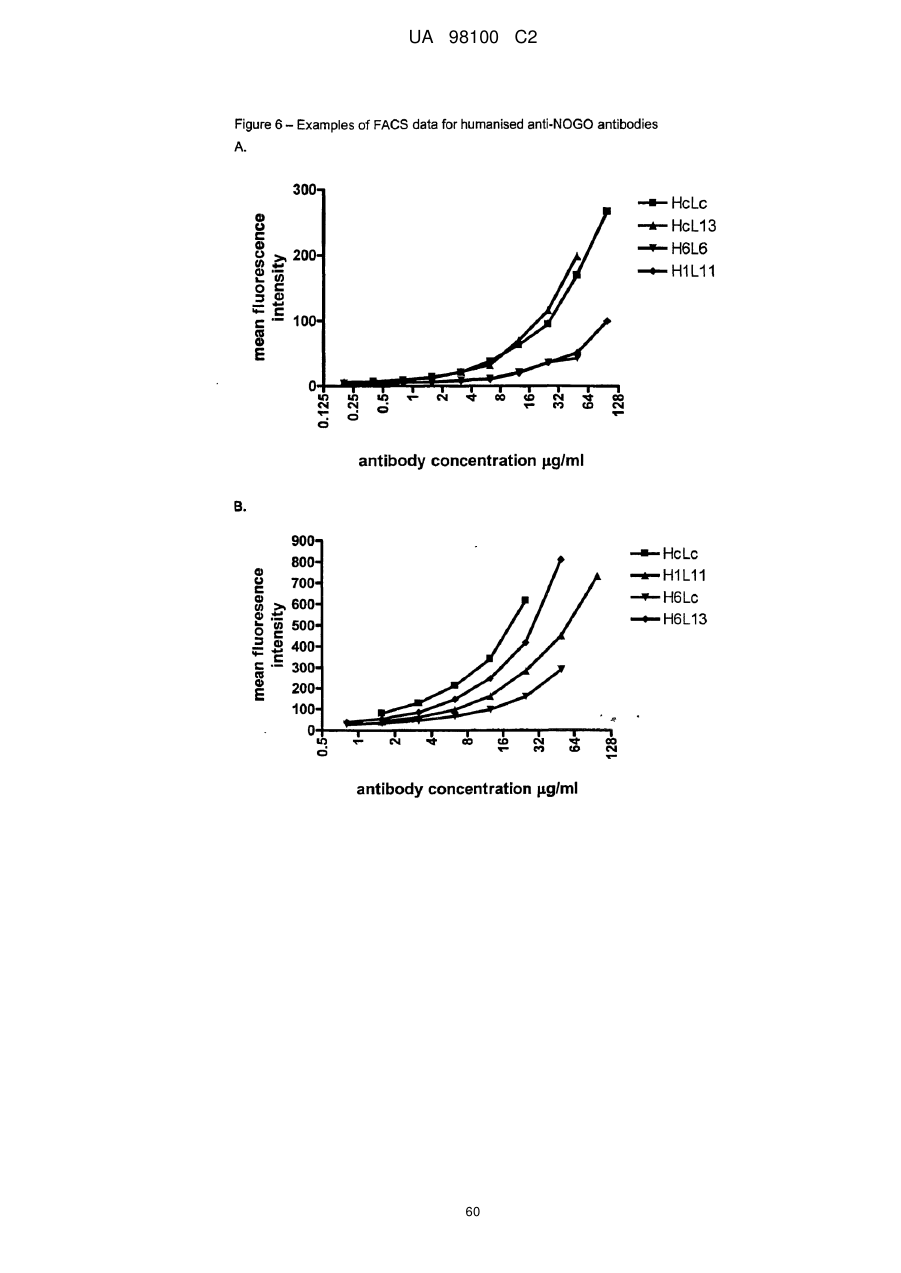
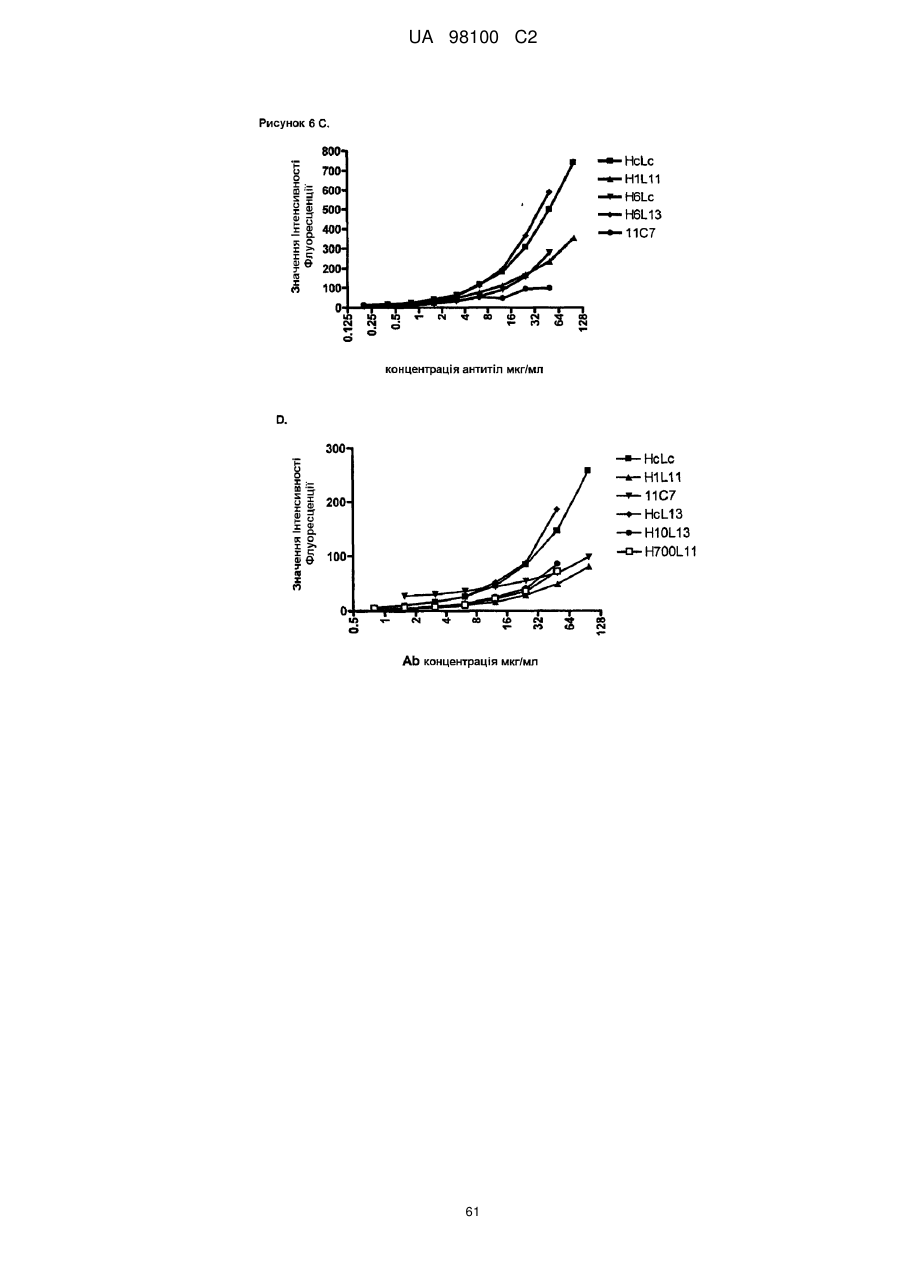
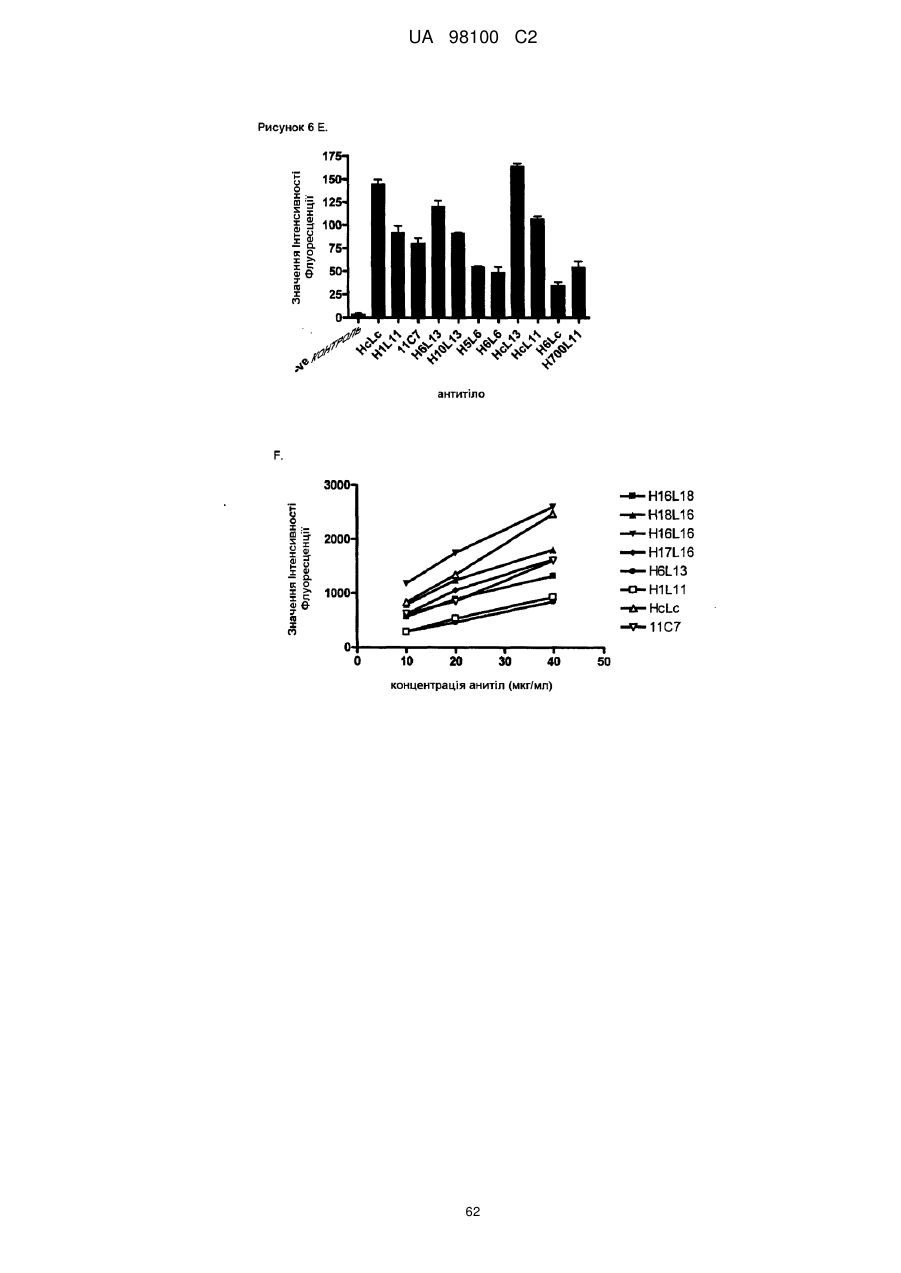
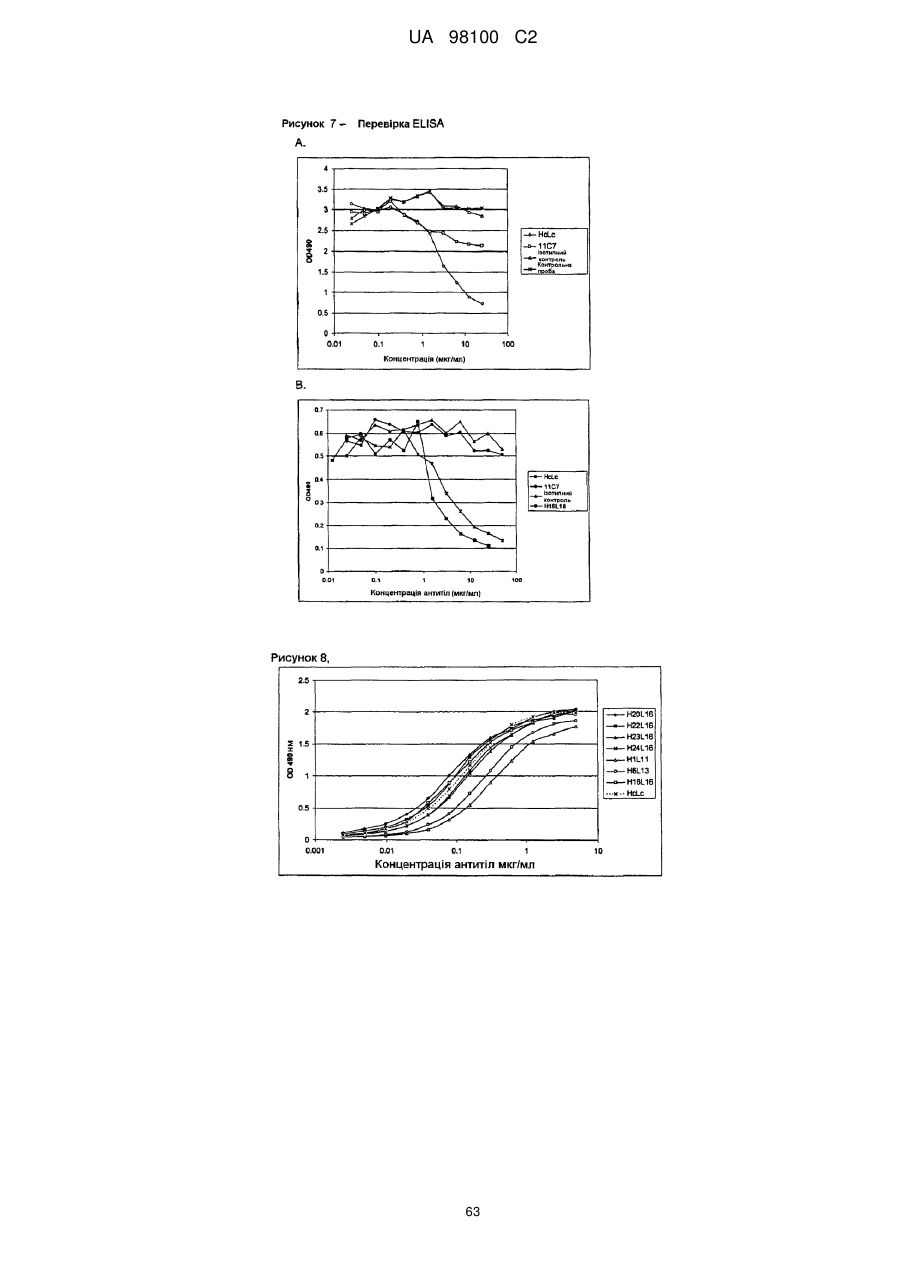
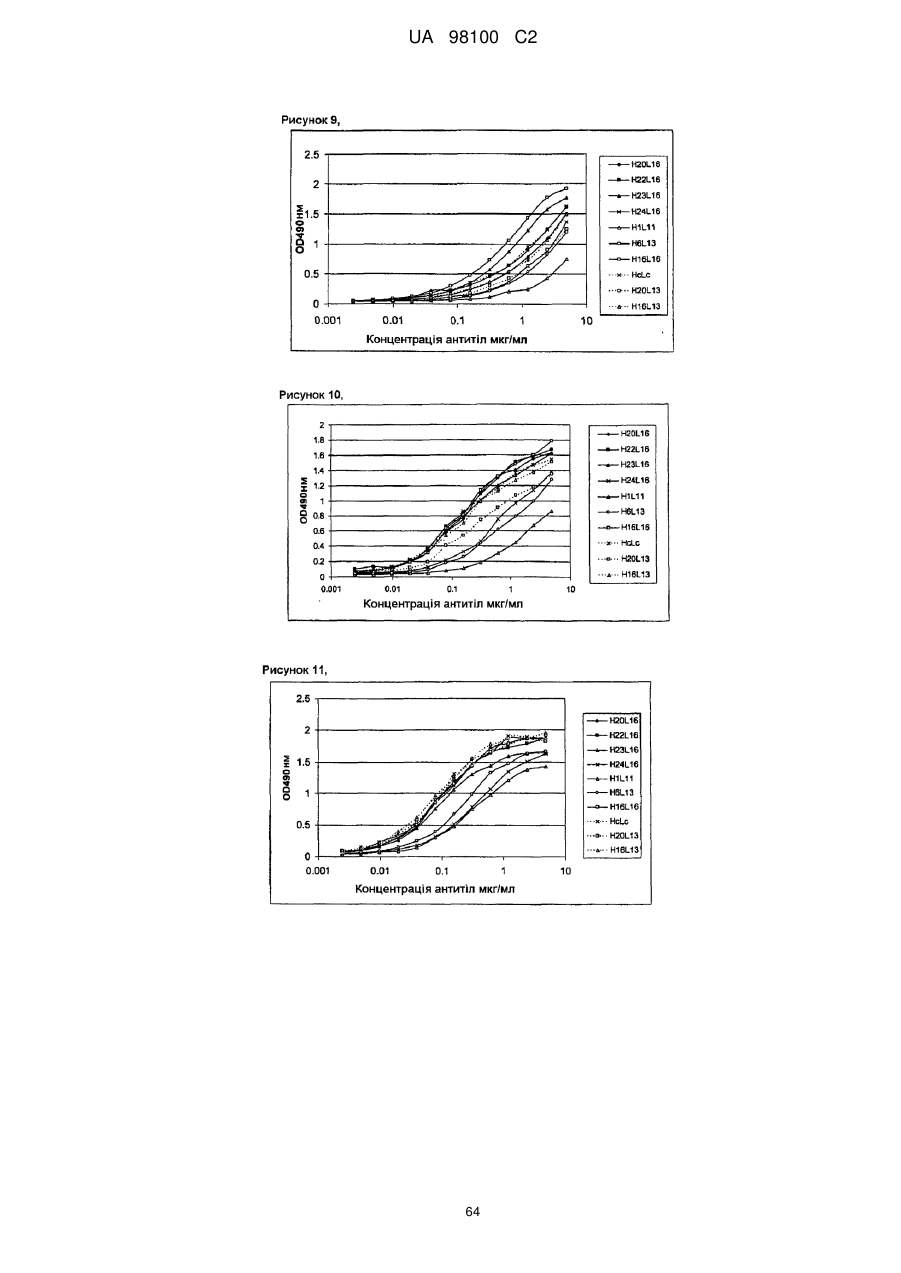
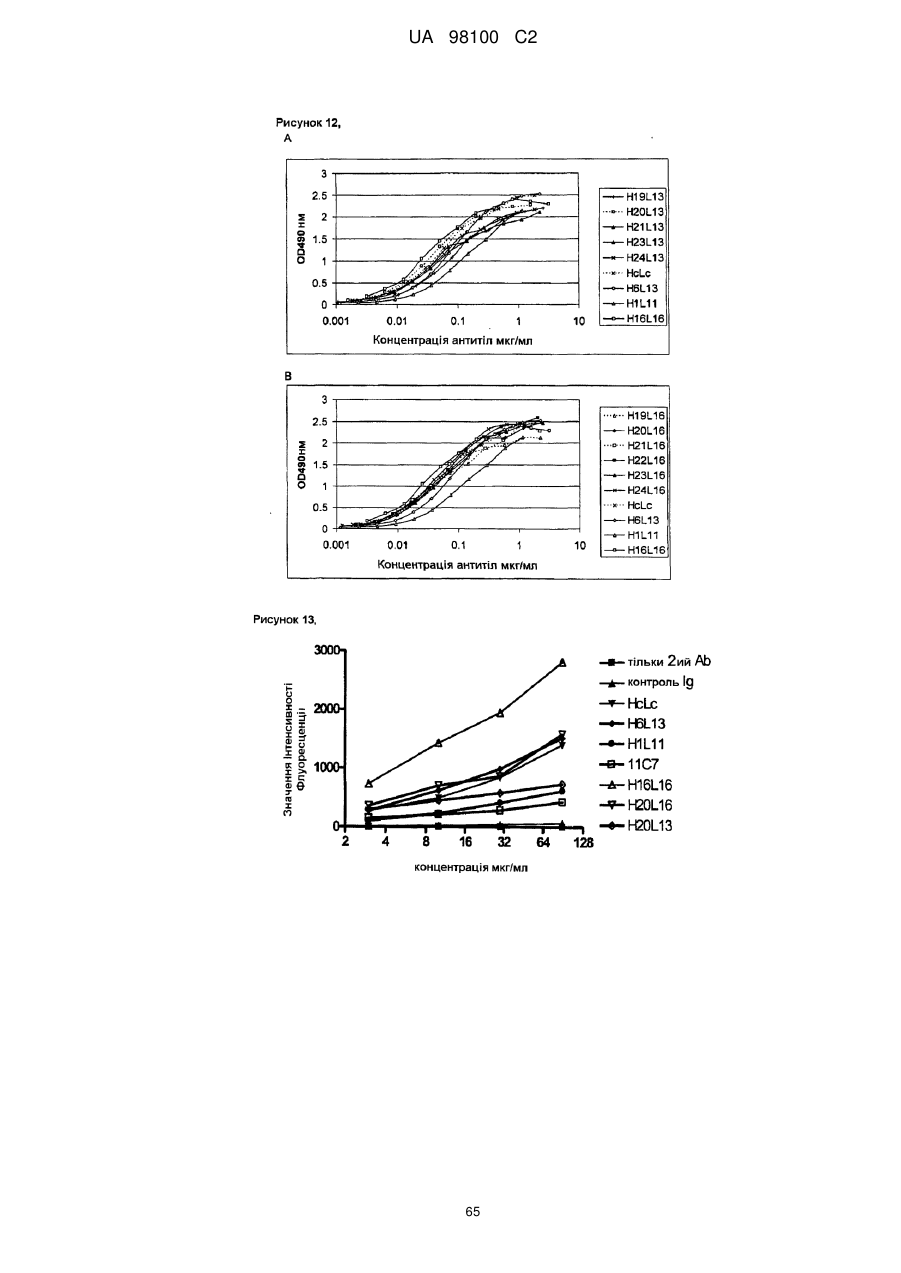
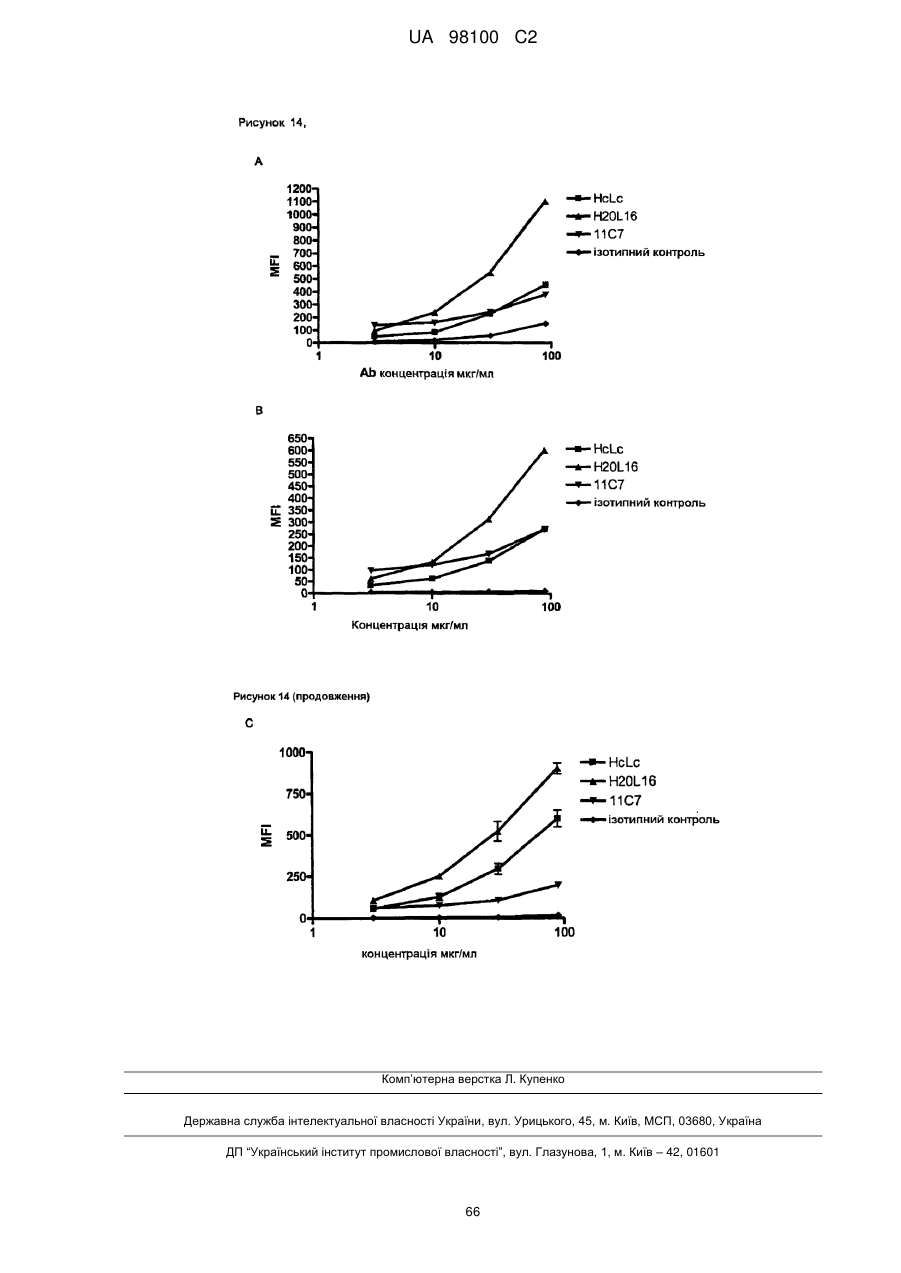
Гуманізоване моноклональне антитiло, яке зв’язується з та нейтралізує людський nogo
Номер патенту: 98100
Опубліковано: 25.04.2012
Автори: Вілсон Пол, Амблі Пол Ендрю, Макадам Рус, Елліс Джонатан Генрі, Прінйоха Рабіндер, Левіс Алан Пітер, Юссаін Фархана
Формула / Реферат
1. Гуманізоване моноклональне антитіло, яке зв'язується з та нейтралізує людський NOGO, при цьому антитіло включає варіабельну ділянку важкого ланцюга, що має амінокислотну послідовність SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:89 або SEQ ID NO:90, та варіабельну ділянку легкого ланцюга, що має амінокислотну послідовність SEQ ID NO:23 або SEQ ID NO:25, або його варіант, що включає аналог ділянки, яка визначає компліментарність (CDR) вказаного антитіла, де вказаний варіант зберігає зв’язувальну специфічність та нейтралізуючу здатність антитіла, з якого він походить.
2. Моноклональне антитіло згідно з пунктом 1, що включає VH та VL ділянки, вибрані з наступного списку:
H20L16 (SEQ ID NO:86 + SEQ ID NO:23); H22L16 (SEQ ID NO:88 + SEQ ID NO:23); H23L16 (SEQ ID NO:89 + SEQ ID NO:23); H24L16 (SEQ ID NO:90 + SEQ ID NO:23); H20L18 (SEQ ID NO:86 + SEQ ID NO:25); H22L18 (SEQ ID NO:88 + SEQ ID NO:25); H23L18 (SEQ ID NO:89 + SEQ ID NO:25); H24L18 (SEQ ID NO:90 + SEQ ID NO:25).
3. Фармацевтична композиція, що включає анти-NOGO антитіло або його функціональний фрагмент згідно з пунктом 1 або 2, разом з фармацевтично прийнятним розріджувачем або носієм.
Текст
Реферат: Винахід належить до гуманізованого моноклонального антитіла, яке зв'язується з та нейтралізує людський NOGO, та фармацевтичної композиції, що його містить. UA 98100 C2 (12) UA 98100 C2 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до імуноглобулінів, зокрема антитіл, що зв'язуються з NOGO та нейтралізують його активність, полінуклеотидів, що кодують такі антитіла, фармацевтичних композицій, що містять зазначені антитіла та використання таких антитіл в лікуванні та/або профілактиці неврологічних захворювань. Інсульт є основною причиною смерті та непрацездатності в Західному Світі. Не існує апробованої терапії лікування інсульту іншої, ніж тканинний плазміноген (t-РА), який повинен вводитись протягом 3 годин після нападу з наступним комп'ютерним томографічним (СТ) скануванням, щоб не допустити крововилив. На сьогоднішній день більшість терапевтичних агентів направлені на лікування гострого інсульту (тобто нейропротекцію), переважно містять таргетування глутаматних рецепторів та зниження потоків їх відомих шляхів поширення сигналів, повинні включатися в швидку смерть клітини. Однак, на сьогоднішній день ці стратегії виявилися неуспішними в клінічних випробуваннях та часто поєднувалась з побічними ефектами, що обмежують дозу (Hill & Hachinski, The Lancet, 352 : (suppl III) 10-14 (1998)). Тому існує потреба в нових підходах, направлених на амеліорацію загибелі клітини, що спричиняється зупинкою кров'яного потоку. Нейропротекція -це можливість лікування попередити чи амеліорувати втрату нейронних клітин у відповідь на інсульт чи процес захворювання. Це може бути досягнуто таргетуванням нейронів прямо або опосередковано попередженням загибелі гліальних (включаючи олігодендроцити) клітин. В багатьох пацієнтів спостерігається, вслід за появленням симптомів нападу, деяке спонтанне функціональне відновлення, яке підтверджує, що мозок має (хоча обмежену) здатність до загоєння та/або реконструкції після ураження. Агенти, що мають здатність посилювати це відновлення, дозволяють зробити втручання значно пізніше (потенціально декілька діб) після нападу церебральної ішемії. Агенти, які можуть демонструвати як гостру нейропротекцію, так і посилювати функціональне відновлення, можуть забезпечити значні переваги над сьогоденними потенційними нейропротектними стратегіями. На сьогоднішній день механізм, що лежить в основі, функціонального . відновлення невідомий. Проростання ушкоджених чи неушкоджених аксонів було запропоноване як один з можливих механізмів. Однак, хоча вивчення in vivo показало, що лікування ушкодження спинного мозку або інсульту з нейротрофічними факторами приводить до посилення функціонального відновлення та ступеню пророщення аксонів, це не підтвердило прямий зв'язок між ступенем пророщення аксонів та величиною функціонального відновлення (Jakeman, et al. 1998, Exp. Neurol. 154: 170-184, Kawamata et al. 1997, Proc Natl Acad. Sci. USA., 94:8179-8184, Ribotta, et al. 2000, J Neurosci. 20: 5144-5152). До того ж, проростання аксону вимагає життєздатного нейрону. При захворюваннях таких як інсульт, які супроводжуються поширеною загибеллю клітин, підвищення функціонального відновлення запропоноване даним постінсультним агентом може відбуватися через інші механізми, ніж пророщення аксонів, такі як диференціація ендогенних стовбурових клітин, активація резервних шляхів, зміни в рецепторному розподіленні або збудження нейронів чи глії (Fawcett & Asher, 1999, Brain Res. Bulletin, 49: 377-391, Horner & Gage, 2000, Nature 407 963-970). Обмежена можливість центральної нервової системи (CNS) до регенерації після ушкодження може відбуватися завдяки молекулам з CNS середовища, що має інгібуючий вплив на пророщення аксонів (ріст аксону нервової клітини) такий як мієліновий протеїн NOGO (Sato S. et al (1989) Biochem. Biophys. Res. Comm. 163,1473-1480; McKerracher L et al (1994) Neuron 13, 805-811; Mukhopadhyay G et al (1994) Neuron 13, 757-767; Torigoe К and Lundborg G (1997) Exp. Neurology 150, 254-262; Schafer etal (1996) Neuron 16, 1107-1113; W09522344; WO9701352; Prinjha R et al (2000) Nature 403, 383-384; Chen MS et al (2000) Nature 403, 434-439; GrandPre Τ et al (2000) Nature 403, 439-444; US005250414A; WO200005364A1; WO0031235). Три форми NOGO людини були ідентифіковані: NOGO-A, що має1192 амінокислотних залишків (GenBank accession no. AJ251383); NOGO-B, сплайс-варіант, який має недостачу залишків від 186 до 1004 в припустимому зовнішньо клітинному домені (GenBank accession no. AJ251384) та коротший сплайс-варіант, NOGO-C, який також має нестачу залишків від 186 до 1004 та також коротший сплайс-варіант, альтернативний аміно термінальний домен (GenBank accession no. AJ251385) (Prinjha et al (2000) supra). Інгібування CNS подавляючих протеїнів таких як NOGO може забезпечити терапевтичні методи, щоб амеліорувати нейроні ушкодження та стимулювати нейрону регенерацію та ріст, таким чином, відновлення, що потенційно супроводжуються, з нейронними ушкодженями, такими як ті, що відбуваються при інсульті. Приклади таких NOGO інгібіторів можуть включати малі молекули, пептиди та антитіла. Антитіла зазвичай містять два важких ланцюги зв'язані разом дисульфідними зв'язками та двома легкими ланцюгами. Кожен легкий ланцюг приєднаний до відповідного важкого ланцюгу 1 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 дисульфідними зв'язками. Кожен важкий ланцюг на одному кінці містить варіабельний домен, який слідує за рядом постійних доменів. Кожен легкий ланцюг на одному кінці містить варіабельний домен, а на іншому постійний домен. Варіабельний домен легкого ланцюгу є орієнтованим зі варіабельним доменом важкого ланцюгу. Постійний домен легкого ланцюгу є орієнтованим з першим постійним доменом важкого ланцюгу. Постійні домени в легкому та важкому ланцюгах напряму не призводять до зв'язування антитіла з антигеном. Варіабельні домени кожної пари легкого та важкого ланцюгів утворюють антиген зв'язаний сайт. Варіабельні домени на легкому та важкому ланцюгах мають однакову основну структуру та кожен домен містить чотири каркасні ділянки, чиї послідовності є відносно збереженими, поєднаними трьома компліментарніо детермінуючими ділянками (CDR), часто згадувані як гіперваріабельні ділянки. Чотири каркасні ділянки в значній мірі приймають бета-листову конформацію та CDR формують петельне поєднання, та в деяких випадках, формуючи частину бета-листової структури. CDR утримуються в безпосередній близькості каркасними ділянками та з CDR інших доменів приймають участь у формуванні антиген зв'язаного сайту. CDR та каркасні ділянки антитіл можуть бути визначеними за посиланням на Kabat et al ("Sequences of proteins of immunological interest" US Dept. of Health and Human Services, US Government Printing Office, 1987). Повідомлялось, що мишаче моноклональне, IN-1, який виведений проти NI220/250, а мієліновий протеїн, який є потенційним інгібітором росту аксонів нервової клітини (і як згодом буде показано, є фрагментом NOGO-A), стимулюють аксональну регенерацію (Caroni, P and Schwab, ME (1988) Neuron 1 85-96; Schnell, L and Schwab, ME (1990) Nature 343 269-272; Bregman, BS et al (1995) Nature 378 498-501 and Thallmair, Μ et al (1998) Nature Neuroscience 1 124-131). Також повідомлялось, що NOGO-A є мішенню для IN-1 (Chen et al (2000) Nature 403 434-439). Введення IN-1 Fab фрагменту або гуманізованого IN-1 щурам, які піддавалися перерізу спинного мозку, посилювало відновлення (Fiedler, Μ et al (2002) Protein Eng 15 931-941; Brosamle, С et al (2000) J. Neuroscience 20 8061-8068). Моноклональні антитіла, які зв'язані з NOGO описані в WO 04/052932 та WO2005028508. В WO 04/052932 розкрите мишаче антитіло 11С7, яке приєднане до певних форм NOGO людини з високою аффіністю. Бажано, виділити та вдосконалити додатковотерапевтично корисні моноклональні антитіла, що зв'язані з, та інгібують активність, NOGO людини. Процес нейродегенерації лежить в основі багатьох неврологічних захворювань/розладів, що включають, але не обмежуються, гострі захворювання такі як інсульт (ішемічний чи геморрагічний), травматичне ушкодження мозку та ушкодження спинного мозку, а також хронічні захворювання, включаючи хворобу Альцгеймера, лобно-скроневу деменцію (тауопатії), периферійну невропатію, хворобу Паркінсону, хворобу Крейцфельда-Якоба (CJD), шизофренію, аміотрофічний латеральний склероз (ALS), розсіяний склероз, хвороба Хантінгтона, численні склерози та міозит з включеннями. Послідовність антиNOGO моноклонального антитіла можуть бути корисними в лікуванні цих хвороб/розладів. Такі антитіла для лікування вище згаданих хвороб/розладів передбачаються даним винаходом та детально описані нижче. WO 2005/061544 розкриває високу аффінність моноклональних антитіл, включаючи мишаче моноклональне антитіло 2А10, та його гуманізований варіант H1L11. Даний винахід стосується ряду моноклональних антитіл, що зв'язуються з NOGO людини. Дана заявка надає посилання до великого числа SEQ ID, які зведені в Таблиці 12, з фактичними послідовностями, наведеними в кінці цього документу. Мишаче антитіло 2А10 зв'язується з NOGO людини з високою аффінністю та зв'язується з формами NOGO, які представляються лініями клітин людини з високою аффінністю. 2А10 були успішно гуманізовані в минулому (H1L11, який містить варіабельну ділянку Н1 важкого ланцюгу (SEQ ID NO. 77) та варіабельну ділянку L11 легкого ланцюгу (SEQ ID NO. 78)). Даний винахід також стосується гуманізованих моноклональних антитіл, які утримують високе співвідношення аффінності чи мають еквівалентну аффінность донорного антитіла (2А10) до NOGO людини. Зокрема, антитіла за даним винаходом мають високий ступінь зв'язування до NOGO людини як в рекомбінованій формі, як експресовані в бактеріальній клітині (такій як ЕСоІі), так і також в формі, що експресована лінією клітин нейробластоми людини (наприклад, лінія клітин нейробластоми людини IMR32). З метою забезпечення гуманізованих варіантів 2А10, автори даного винаходу ідентифікували ряд ключових амінокислотних залишків в каркасній послідовності варіабельних ділянок 2А10, які, як вважається, є важливими в оптимальному підтриманні зв'язуючої аффінності до NOGO людини. Варіабельна ділянка важкого ланцюгу (VH) 2A10 забезпечується в SEQ ID NO. 7; варіабельна ділянка легкого ланцюгу (VL) 2A10 забезпечується в SEQ ID NO. 8. Гібридні важкі та легкі ланцюги, що містять мишачі варіабельні ділянки та людські постійні 2 UA 98100 C2 5 10 ділянки забезпечуються в SEQ ID NO 9 та 10 відповідно (комбінація двох гібридних ланцюгів називається HcLc). Фахівець зрозуміє, що SEQ ID NO 9 та 10 представляють важкий ланцюг чи легкі ланцюги до будь-якої обробки (наприклад, клітина-хазяїн опосередкованої обробки) для видалення сигнальної послідовності. Зазвичай π ерероблені форми л анцюгів антитіл будуть починатися з положенні 20 (після видалення сигнальної послідовності) для SEQ ID N0.9; та будуть починатися з положенні 21 для SEQ ID N0. 10. З контексту даного винаходу вся повнодовжинні послідовності важкого та легкого ланцюгу будкть забезпечуватись включеною сигнальною послідовністю (яка для всіх інших повнодовжинних послідовностей, що не є SEQ ID NOs 9 та 10, відповідно до SEQ ID N0.75). Для фахівця є очевидним, що вироблене лінією клітин антитіло трансформоване генним кодуванням будь-якого з цих важких та легких ланцюгів повної довжини, не включало б цю сигнальну послідовність. Таблиця 1 CDR важкого ланцюгу 2А10 є: CDR Н1 Н2 Н3 Відповідно до Kabat SYWMH(SEQIDNO:1) NINPSNGGTNYNEKFKS NO:2) GQGY (SEQ ID NO:3) (SEQ ID Таблиця 2 CDR легкого ланцюгу 2А10: CDR L1 L2 L3 15 20 25 30 35 40 Відповідно до Kabat RSSKSLLYKDGKTYLN (SEQ ID NO:4) LMSTRAS (SEQ ID NO:5) QQLVEYPLT (SEQ ID NO:6) CDR ідентифікувались згідно з Kabat (Kabat et al. (1991) "Sequences of proteins of immunological interest"; Fifth Edition; US Department of Health and Human Services; NIH publication No 91-3242). CDR переважно - це як визначено Kabat, але наступними принципами структури протеїну та складання як визначено Chothia та Lesk, (Chothia et al., (1989) "Conformations of immunoglobulin hypervariable regions"; Nature 342, p877-883), буде прийнято до уваги, що додаткові залишки можуть також розглядатись як частина зв'язаної ділянки антигену та є, таким чином, охопленими даним винаходом. VH та VL домени Н1 та L11 раніше описані в WО 2005/061544 та є результатом CDR, згаданої в таблицях 1 та 2, привитої до людських варіабельних ділянок з високою гомологією до донорного антитіла 2А10, кожна привита конструкція додатковомістить оборотні мутації в Kabat положення 93 та 94 (для Н1 VH) чи 4, 45 та 46 (для L11 VL). 2А10 антитіло є здатним до зв'язування з NOGO людини, та також зв'язується з NOGO мавп-мармазеток (Marmoset) та щура, та вважається, що нові гуманізовані антитіла за даним винаходом будуть зберігати цю властивість. Наприклад, моноклональне антитіло, що містить Н20 та L16 варіабельні ділянки (дивись нижче для детального розгляду) зв'язані з NOGO мавпмармазеток, а також щура, яванських макак (Cynomolgus) та NOGO білячої мавпи (Squirrel monkey). Послідовність фрагментів NOGO-A мавп-мармазеток надана в SEQ ID NO. 113. Антитіла, які містять CDR, в Таблиці 1 та 2 обумовлені даним винаходом. Також охопленими даним винаходом є ант итіла, що включають аналоги цих CDR. Варіабельна Ділянка Важкого Ланцюгу (VH) В одному з втілень даного винаходу антитіла містять варіабельну ділянку важкого ланцюгу, що має амінокислотну послідовність SEQ ID NO. 77 (Н1 варіабельна ділянка), додатково містить ряд заміщень в одному або більше положеннях 12, 20, 38, 40, 48, 67, 68, 70, 72, 74, 76, 79 та 91; де кожен заміщений амінокислотний залишок замінюється на амінокислотний залишок в еквівалентному положенні в SEQ ID NO 7 (варіабельна ділянка важкого ланцюгу донорного антитіла 2А10) та число заміщень становить між 1 та 13. В інших втіленнях число заміщень становить 1, чи 2, чи 3, чи 4, чи 5, чи 6, чи 7, чи 8, чи 9, чи 10, чи 11, чи 12, чи 13. В інших втіленнях число заміщень становить від 2 до 13, чи 3 до 13, чи 4 до 13, чи 5 до 13, чи 6 до 13, чи 7 до 13, чи 8 до 13, чи 9 до 13, чи 10 до 13 чи 11 до 13, чи 12 до 13. В інших втіленнях число 3 UA 98100 C2 5 10 15 20 25 30 35 заміщень становить 1 чи 2, чи в межах від 1 до 3 заміщень, чи 1 до 4, чи 1 до 5, чи 1 до 6, чи 1 до 7, чи 1 до 8, чи 1 до 9, чи 1 до 10, чи 1 до 11, чи 1 до 12 заміщень. В цьому контексті заміщення, що описуються, є еквівалентними поняттю "зворотня мутація", де амінокислотні залишки людського каркасу в специфічних положеннях всередині Н1 послідовності є зворотньо мутованими до амінокислотних залишків в еквівалентному положенні всередині послідовності донорного антитіла 2А10. За виключенням окремо встановлених обставин, коли числове положення амінокислотного залишку знайденого всередині специфічної послідовності згадується в цьому документі, наприклад, "положення 12", мається на увазі, що фахівець визначає першу амінокислоту як положення "1" послідовності та рахує з положення один й ідентифікує амінокислоту, яка знаходиться в потрібному положенні, в цьому прикладі це дванадцятий амінокислотний залишок в послідовності. Фахівець помітить, що ця нумераційна система не відповідає нумераційній системі Kabat, яка часто використовується для амінокислотних положень всередині послідовностей антитіл. Наступна таблиця (Таблиця 3) ілюструє заміщення/зворотню мутацію за даним винаходом та надає їх чисельні положення і Kabat номер для цього чисельного положення: Посилаючись на Таблицю 3, моноклональні антитіла в одному з втілень даного винаходу включають заміщення/зворотню мутацію в чисельному положенні 79 для формування антитіл "Класу А". Було знайдено, що для оптимальної зв'язуючої аффінності пара амінокислотних залишків в положеннях 48 та 68, повинні бути І та А відповідно (як вони існують в 2А10) або Μ Ta V відповідно (як вони існують в Н1). Таким чином, знову π осилаючись наТаблицю 3, в іншому втіленні, "Клас В", моноклональне антитіла містить заміщення в положеннях 79, 48 та 68. В ще одному втіленні ("Клас С") моноклональні антитіла "Класу А" чи "Класу В" додатково містять заміщення в положеннях 40 та/або 67. В ще одному втіленні моноклональні антитіла " Класу С" за даним винаходом додатково включають заміщення в положеннях 38, 72 чи 70, формуючи антитіла "Клас D". В ще одному втіленні моноклональні антитіла " Класу D" додатково включають заміщення в одному чи більше положень 12, 20,74, 76 або 91 ("Клас Е"). Наступна таблиця містить детальний опис 20 різних варіабельних ділянок важкого ланцюга (VH), який може формувати частину антитіл за даним винаходом. Кожен з виявлених VH ґрунтується на Н1 VH (SEQ ID NO. 77) з подальшим включенням заміщень, згаданих в таблиці (Таблиця 4), де Н1 залишок в існуючому положенні заміщується на залишок 2А10 в тому положенні (в таблиці,"-" означає, що не існує заміщення в тому положенні, та, таким чином, залишок зберігається як в послідовності Н1): 4 UA 98100 C2 Таблиця 4 Новий VH Чисельний (SEQ ID NO.X) Залишок No. Kabat No. 2А10 Н1 Н5 (11) Н6(12) Н700(13) Н8 Н9 Н10 Н12 Н13 Н14(14) Н15(15) Н16(16) Н17(17) Н18(18) Η19(85) Н20(86) Н21(87) Н22(88) Н23(89) Н24(90) Н25(91) 5 10 15 20 12 20 38 40 48 67 68 70 72 74 76 79 91 12 V K 20 L V 38 Κ R 40 R Α 48 L Μ 69 L Μ 71 V R V V ν ν L L L L L L Κ Κ Κ Κ Κ Κ Κ Κ Κ R R R R R R R R R R 66 67 Κ Α R V Α - Α - Α - Α - Α - Α - Α - Α Κ Α Κ Α Κ Α Κ Α - Α Κ Α Κ Α Κ Α Κ Α Κ Α L L L L L L L L L L L V V V V V V V V V V V 73 Κ Τ Κ Κ Κ Κ Κ Κ Κ 75 S T S S 78 Α V Α Α Α Α Α Α Α Α Α Α Α Α Α Α Α Α Α Α Α 87 S Τ S S l l l l l l l l l Відповідно, забезпечується моноклональне антитіло, що містить варіабельну ділянку важкого ланцюгу, яке має послідовність надану в будь-якому одному з SEQ ID NOs: 11-18 чи 8591; або його варіанти, що містять аналоги CDR. В іншому втіленні забезпечується моноклональне антитіло, що містить важкий ланцюг, який містить послідовність надану в будьякому одному з SEQ ID NOs: 26-33 чи 92-98; або його варіанти, що містять аналоги CDR. В окремому втіленні антитіло містить VH ділянки забезпечені в SEQ ID NOs 11, 12, 16, 18, 85, 86, 87 чи 91 або його варіанти, що містять аналоги CDR; або важкі ланцюги забезпечені в SEQ ID NOs 26, 27, 31, 33, 92, 93, 94 чи 98 або його варіанти, що містять аналоги CDR. Варіабельна Ділянка Легкого Ланцюгу В одному втіленні даного винаходу антитіла містять варіабельну ділянку легкого ланцюгу, який має амінокислотну послідовність SEQ ID NO. 20 (L13 варіабельна ділянка), що необов'язково додатково містить ряд заміщень в одному або більше положеннях 4, 7, 11,19, 42, 64 та 70; де кожен заміщений амінокислотний залишок замінений на амінокислотний залишок в еквівалентному положенні в SEQ ID NO. 8 (варіабельна ділянка легкого ланцюгу донорного антитіла 2А10) та число заміщень становить між 0 та 7. В інших втіленнях число заміщень становить 1, чи 2, чи 3, чи 4, чи 5, чи 6, чи 7. В інших втіленнях число заміщень становить між 2 та 7, чи 3 та 7, чи 4 та 7, чи 5 та 7, чи 6 та 7. В інших втіленнях число заміщень становить 1 чи 2, чи в межах від 1 до 3 заміщень, чи 1 до 4, чи 1 до 5, чи 1 до 6. Наступна таблиця (Таблиця 5) ілюструє заміщення/зворотні мутації за даним винаходом та надає їх чисельні положення і Kabat номер для цього чисельного положення: 5 UA 98100 C2 Таблиця 5 Залишок людського каркасу L13 (SEQ ID NO20) Μ S L A Q Ρ G 5 10 15 Чисельне Положення 4 7 11 19 42 64 70 Відповідний залишок вмишачому 2А10 (SEQ ID NO 8) І D N V L S S Kabat номер 4 7 11 19 37 59 65 Посилаючись до Таблиці 5, в іншому втіленні, "Клас X", моноклональні антитіла за даним винаходом містять VL ділянка, що має заміщення/зворотню мутацію в положеннях 11 та 19. В іншому втіленні "Клас Y" моноклональні антитіла " Класу X" містять заміщення в положенні 42. В подальшому втіленні моноклональні антитіла " Класу X" або "Класу Υ" далі містять зворотню мутацію в положеннях 7, 64 или 70, що створює "Клас Z". Знову посилаючись на Таблицю 5, в іншому втіленні моноклональні антитіла за даним винаходом містять VL ділянку, що містить заміщення в положенні 4 (відповідно до L11 (SEQ ID NО.78). Наступна таблиця (Таблиця 6) містить детальний опис семи різних варіабельних ділянок легкого ланцюгу (VL), який може формувати частину антитіл за даним винаходом або їх аналогів, що містять варіанти CDR. Кожен з показаних VL є, або ґрунтується на, L13 VL (SEQ ID NO. 20), що необов'язково додатково містить заміщення, згадані в таблиці, де L13 залишок в певному положенні заміщується на 2А10 залишок в тому положенні (в таблиці,"-" означає, що заміщення в тому положенні не існує та, таким чином, залишок зберігається як в послідовності L13): Таблиця 6 Чисельний Залишок No. Новий VL (SEQ KabatNo. ID NO.X) 2A10 L13 L11(78) L13(20) L14(21) L15(22) L16(23) L17(24) L18(25) 20 25 30 4 7 11 19 42 64 70 4 I Μ I 7 D S D D 11 N L N N 19 V A V V 37 L Q L L L L 59 S Ρ S S S 65 S G S S Таким чином, забезпечується моноклональне антитіло, що містить варіабельну ділянку легкого ланцюгу, яке має послідовність надану в будь-якому одному з SEQ ID NOs: 20-25; або його варіантах, що містять аналоги CDR. В іншому втіленні забезпечується моноклональне антитіло, що містить легкий ланцюг, який містить послідовність надану в будь-якому одному з SEQ ID NOs: 35-40; або його варіантах, що містять аналоги CDR. В якості альтернативи забезпечується моноклональне антитіло, що містить варіабельну ділянку легкого ланцюгу, яке має послідовність надану в SEQ ID NO. 19, чи легкий ланцюг, який містить послідовність надану в SEQ ID NO. 34. В окремому втіленні антитіла містить VL ділянки присутні в SEQ ID NOs 20, 23 та 25 чи його варіантах, що містять аналоги CDR, або легкі ланцюги забезпеченні в SEQ ID NOs 35, 38 та 40 чи його варіантах, що містять аналоги CDR. Специфічні комбінації варіабельних ділянок важких та легких ланцюгів Даний винахід забезпечує антитіла чи подібні, що містять всі можливі комбінації варіабельних ділянок важкого ланцюгу та варіабельних ділянок легкого ланцюгу, які розкриті 6 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 вище. Також розглянуті в тих комбінаціях, та комбінаціях приведених нижче, є згаданими специфічними послідовностями або такими аналогах, що містять варіанти природно зустічающогося CDR. Антитіла за даним винаходом містять варіабельну ділянку важкого ланцюгу та варіабельну ділянку легкого ланцюгу. В одному втіленні антитіла містить: (a) Варіабельну ділянку важкого ланцюгу, яка містить амінокислотну послідовність SEQ ID NO. 77 (Н1 варіабельна ділянка), що далі містить ряд заміщень в одному або більше з положень 12, 20, 38,40, 48, 67, 68, 70, 72, 74, 76, 79 та 91; де кожен заміщений амінокислотний залишок заміщується на амінокислотний залишок в еквівалентному положенні в SEQ ID NO 7 (варіабельна ділянка важкого ланцюгу донорного антитіла 2А10) та число заміщень становить між 1 та 13. В інших втіленнях число заміщень становить 1, чи 2, чи 3, чи 4, чи 5, чи 6, чи 7, чи 8, чи 9, чи 10, чи 11, чи 12, чи 13; та (b) варіабельна ділянка легкого ланцюгу відбирається з SEQ ID NOs 20-25 чи 78. Конкретні втілення складають антитіла, що містять наступні комбінації варіабельних ділянок важкого та легкого ланцюгів: H1L13 (SEQ ID 77 + SEQ ID 20), H5L13 (SEQ ID 11 + SEQ ID 20), H6L13 (SEQ ID 12 + SEQ ID 20), H14L13 (SEQ ID 14 + SEQ ID 20), H15L13 (SEQ ID 15 + SEQ ID 20), H16L13 (SEQ ID 16 + SEQ ID 20), H17L13 (SEQ ID 17 + SEQ ID 20), H18L13 (SEQ ID 18 + SEQ ID 20), I H19L13 (SEQ ID 85 + SEQ ID 20), H20L13 (SEQ ID 86 + SEQ ID 20), H21L13 (SEQ ID 87 + SEQ ID 20), H22L13 (SEQ ID 88 + SEQ ID 20), H23L13 (SEQ ID 89 + SEQ ID 20), H24L13 (SEQ ID 90 + SEQ ID 20), H25L13 (SEQ ID 91 + SEQ ID 20), H700L13 (SEQ ID 13 + SEQ ID 20), H1L16 (SEQ ID 77 + SEQ ID 23), H5L16 (SEQ ID 11 + SEQ ID 23), H6L16 (SEQ ID 12 + SEQ ID 23), H14L16 (SEQ ID 14 + SEQ ID 23), H15L16 (SEQ ID 15 + SEQ ID 23), H16L16 (SEQ ID 16 + SEQ ID 23), H17L16 (SEQ ID 17 + SEQ ID 23), H18L16 (SEQ ID 18 + SEQ ID 23), H19L16 (SEQ ID 85 + SEQ ID 23), H20L16 (SEQ ID 86 + SEQ ID 23), H21L16 (SEQ ID 87 + SEQ ID 23), H22L16 (SEQ ID 88 + SEQ ID 23), H23L16 (SEQ ID 89 + SEQ ID 23), H24L16 (SEQ ID 90 + SEQ ID 23), H25L16 (SEQ ID 91 + SEQ ID 23), H700L16 (SEQ ID 13 + SEQ ID 23), H1L18 (SEQ ID 77 + SEQ ID 25), H5L18 (SEQ ID 11 + SEQ ID 25), H6L18 (SEQ ID 12 + SEQ ID 25), H14L18 (SEQ ID 14 + SEQ ID 25), H15L18 (SEQ ID 15 + SEQ ID 25), H16L18 (SEQ ID 16 + SEQ ID 25), H17L18 (SEQ ID 17 + SEQ ID 25), H18L18 (SEQ ID 18 + SEQ ID 25), H19L18 (SEQ ID 85 + SEQ ID 25), H20L18 (SEQ ID 86 + SEQ ID 25), H21L18 (SEQ ID 87 + SEQ ID 25), H22L18 (SEQ ID 88 + SEQ ID 25), H23L18 (SEQ ID 89 + SEQ ID 25), H24L18 (SEQ ID 90 + SEQ ID 25), H25L18 (SEQ ID 91 + SEQ ID 25), H700L18 (SEQ ID 13 + SEQ ID 25). Іншими втіленнями є антитіла, що містять наступні комбінації варіабельних ділянок важкого та легкого ланцюгів: H1L14(SEQ ID 77 + SEQ ID 21), H5L14 (SEQ ID 11 + SEQ ID 21), H6L14 (SEQ ID 12 + SEQ ID 21), H14L14 (SEQ ID 14 + SEQ ID 21), H15L14 (SEQ ID 15 + SEQ ID 21), H16L14 (SEQ ID 16 + SEQ ID 21), H17L14 (SEQ ID 17 + SEQ ID 21), H18L14 (SEQ ID 18 + SEQ ID 21), H19L14 (SEQ ID 85 + SEQ ID 21), H20L14 (SEQ ID 86 + SEQ ID 21), H21L14 (SEQ ID 87 + SEQ ID 21), H22L14 (SEQ ID 88 + SEQ ID 21), H23L14 (SEQ ID 89 + SEQ ID 21), H24L14 (SEQ ID 90 + SEQ ID 21), H25L14 (SEQ ID 91 + SEQ ID 21), H700L14 (SEQ ID 13 + SEQ ID 21), H1L15 (SEQ ID 77 + SEQ ID 22), H5L15 (SEQ ID 11 + SEQ ID 22), H6L15 (SEQ ID 12 + SEQ ID 22), H14L15 (SEQ ID 14 + SEQ ID 22), H15L15 (SEQ ID 15 + SEQ ID 22), H16L15 (SEQ ID 16 + SEQ ID 22), H17L15 (SEQ ID 17 + SEQ ID 22), H18L15 (SEQ ID 18 + SEQ ID 22), H19L15 (SEQ ID 85 + SEQ ID 22), H20L15 (SEQ ID 86 + SEQ ID 22), H21L15 (SEQ ID 87 + SEQ ID 22), H22L15 (SEQ ID 88 + SEQ ID 22), H23L15 (SEQ ID 89 + SEQ ID 22), H24L15 (SEQ ID 90 + SEQ ID 22), H25L15 (SEQ ID 91 + SEQ ID 22), H700L15 (SEQ ID 13 + SEQ ID 22), H1L17 (SEQ ID 77 + SEQ ID 24), H5L17 (SEQ ID 11 + SEQ ID 24), H6L17 (SEQ ID 12 + SEQ ID 24), H14L17 (SEQ ID 14 + SEQ ID 24), H15L17 (SEQ ID 15 + SEQ ID 24), H16L17 (SEQ ID 16 + SEQ ID 24), H17L17 (SEQ ID 17 + SEQ ID 24), H18L17 (SEQ ID 18 + SEQ ID 24), H19L17 (SEQ ID 85 + SEQ ID 24), H20L17 (SEQ ID 86 + SEQ ID 24), H21L17 (SEQ ID 87 + SEQ ID 24), H22L17 (SEQ ID 88 + SEQ ID 24), H23L17 (SEQ ID 89 + SEQ ID 24), H24L17 (SEQ ID 90 + SEQ ID 24), H25L17 (SEQ ID 91 + SEQ ID 24), H700L17 (SEQ ID 13 +SEQ ID 24). Подальші втілення складають антитіла, що містять наступні комбінації варіабельних ділянок важкого та легкого ланцюгів: H1L6 (SEQ ID 77 + SEQ ID 19), H5L6 (SEQ ID 11 + SEQ ID 19), H6L6 (SEQ ID 12 + SEQ ID 19), H14L6 (SEQ ID 14 + SEQ ID 19), H15L6 (SEQ ID 15 + SEQ ID 19), H16L6 (SEQ ID 16 + SEQ ID 19), H17L6 (SEQ ID 17 + SEQ ID 19), H18L6 (SEQ ID 18 + SEQ ID 19), H19L6 (SEQ ID 85 + SEQ ID 19), H20L6 (SEQ ID 86 + SEQ ID 19), H21L6 (SEQ ID 87 + SEQ ID 19), H22L6 (SEQ ID 88 + SEQ ID 19), H23L6 (SEQ ID 89 + SEQ ID 19), H24L6 (SEQ ID 90 + SEQ ID 19), H25L6 (SEQ ID 91 + SEQ ID 19), H700L6 (SEQ ID 13+SEQ ID 19), H5L11 (SEQ ID 11 + SEQ ID 78), H6L11 (SEQ ID 12 +SEQ ID 78), H14L11 (SEQ ID 14 + SEQ ID 78), H15L11 (SEQ ID 15 + SEQ ID 78), H16L11 (SEQ ID 16 + SEQ ID 78), H17L11 (SEQ ID 17 + SEQ ID 78), H18L11 (SEQ ID 18 + SEQ ID 7 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 78), H19L11 (SEQ ID 85 + SEQ ID 78), H20L11 (SEQ ID 86 + SEQ ID 78), H21L11 (SEQ ID 87 + SEQ ID 78), H22L11 (SEQ ID 88 + SEQ ID 78), H23L11 (SEQ ID 89 + SEQ ID 78), H24L11 (SEQ ID 90 + SEQ ID 78), H25L11 (SEQ ID 91 + SEQ ID 78), H700L11 (SEQ ID 13 + SEQ ID 78). В одному з втілень антитіла містить наступні варіабельні області Важкого та Легкого ланцюгів H6L13, H16L16, H20L13 чи H20L16 або такі варіанти , що містять аналоги CDR, що зустрічається в природі. В одному з втілень антитіла містить H20L16 або такий аналог, що включає варіант природно зустічающогося CDR. Неушкоджені Антитіла Далі, винахід також стосується гуманізованого антитіла, яке зв'язане з та нейтралізує NOGO, переважно NOGO людини, переважніше NOGO-A людини. Більш специфічно стосується гуманізованого антитіла, що містить варіабельну ділянку важкого ланцюгу, як описано тут, та варіабельну ділянку легкого ланцюгу як описано тут. Гуманізовані антитіла за даним винаходом зв'язуються з NOGO людини зі співставимою аффінністю, що і з мишачим донорним антитілом 2А10 чи його гібридною версією (HcLc). В одному з втілень, зв'язування антитіла за даним винаходом з NOGO має константу аффінністі (KD, як виміряна за методикою ВіаСоге) з 10-кратним надлишком 2А10, та в іншому винаході, константа аффінністі є при трьох чи дво -кратному надлишку 2А10, в іншому винаході, константа аффінністі не відрізняється від 2А10 (чи 2А10 HcLc). В іншому винаході, константа аффінністі є при трьох чи двох -кратному надлишку з того 2А10 та дисоціація (kd) є в 10 кратному, чи трьох-кратному, чи двох -кратному надлишку 2А10, в іншому винаході, дисоціація не відрізняється від 2А10 (чи 2А10 HcLc). Метод вимірювання константи аффінністі та дисоціації антитіла був би зрозумілий для фахіця, однак, метод кінетичного аналізу ВіаСоrе наведений в Прикладі 5 цього документу є ілюстративним в цьому відношенні. Наприклад, константа аффінністі та дисоціація 2А10 як виміряно за ВіаСоrе кінетичним аналізом в області 1нМ та 1.84 -3 х10 (kd 1/s) відповідно; в такій же пробі антитіла одного з втілень даного винаходу буде мати -2 константу аффінністі меншу ніж 8-10 нМ та 1.84x10 В подібному способі аналізу гібридного -3 -3 2А10 антитіла, HcLc, отримаємо константу аффінністі близько 1 - 2 нМ та 2 х10 - 4 х10 (kd 1 /s) відповідно. В типових втіленнях, антитіла винаходу є IgG класу, більш типово lgG1 чи lgG4 людини, з ктипом легкого ланцюгу людини. Додатково втілення винаходу забезпечує фармацевтичну композицію, що містить антиNOGO антитіло за даним винаходом або його функціональний фрагмент разом з фармацевтично прийнятним розріджувачем чи носієм. В подальших втіленнях даного винаходу забезпечується метод лікуванні чи профілактики інсульту (особливо ішемічний інсульт) та інші неврологічні захворювання, а саме хвороба Альцгеймера чи розсіяний склероз, у людини, який включає введення згаданій людині, що потребує цього, ефективної кількості анти-NOGO антитіла винаходу чи його функціональних фрагментів. В іншому втіленні, винахід забезпечує використання анти-NOGO антитіла винаходу або його функціональних фрагментів в виготовленні ліків для лікування чи профілактики інсульту (особливо ішемічного інсульту) та інших неврологічних захворювань, а саме хвороби Альцгеймера чи розсіяного склерозу. В подальшому втіленні, даний винахід забезпечує спосіб інгібування нейродегенерації та/або стимулювання функціонального відновлення у людини, пацієнт уражений, чи з ризиком розвитку, інсультом (особливо ішемічним інсультом) або іншими неврологічними захворюваннями, а саме хвороби Альцгеймера чи розсіяного склерозу, який включає введення згаданій людині, що потребує цього, ефективної кількості анти-NOGO антитіла винаходу чи його функціонального фрагменту. В ще одному втіленні, винахід забезпечує використання анти-NOGO антитіла винаходу або його функціональних фрагментів в виготовленні ліків для інгібування нейродегенерації та/або стимулювання функціонального відновлення у людини, пацієнт вражений, чи є ризик розвитку, інсультом та іншими неврологічними захворюваннями, а саме хвороби Альцгеймера чи розсіяного склерозу. В іншому втіленні даного винаходу забезпечується використання антиNOGO антитіл за даним винаходом в способі лікування, чи у виготовленні медикаментів для лікування, травматичного ушкодження нерву, таких як ушкодження спинного мозку або інші травматичні ушкодження нервової системи. Інші втілення та переваги даного винаходу описані далі в детальному описі та його переважні втілення. В одному з втілень антитіла повною довжиною є такими, що містять легкі ланцюги SEQ ID NOs 34-40 та важкі ланцюги SEQ ID NOs 92-98; та в особливості легкі ланцюги SEQ ID NOs 35, 38 или 40 й важкі ланцюги SEQ ID NOs 92, 93, 94 или 98. Для фахівців в даній галузі є 8 UA 98100 C2 5 очевидним, що всі посідовності надані для антитіла повною довжиною в Таблиці 7 та 12 (та запропоновані послідовності) представляють собою важкий ланцюг чи легкі ланцюги до будьякої обробки (наприклад, проміжна обробка клітини-хазяїна) для видалення сигнальної послідовності. Зазвичай перетворені форми ланцюгів антитіла будуть починатися в положенні 20 (після видалення сигнальної послідовності (залишки 1-19), які відповідають SEQ ID NO. 75). Даний винахід забезпечує антитіла, що мають наведені поліпептидні послідовності (після видалення перших 19 амінокислот сигнальної послідовності), та також забезпечує антитіла у формі, в якій вони вироблені та очищені клітинами-хазяїнами експресуючих полінуклеотидів, що кодуються важким та легким ланцюгом. 10 Таблиця 7 Специфічні антитіла повної довжини містять: Антитіло H5L13FL H6L13FL H19L13FL H20L13FL H21L13FL H25L13FL H16L16FL H19L16FL H20L16FL H21L16FL H25L16FL H16L18FL H18L16FL H19L18FL H20L18FL H21L18FL H25L18FL 15 20 25 30 35 Легкий Ланцюг SEQ ID NO. 35 SEQ ID NO. 35 SEQ ID NO. 35 SEQ ID NO. 35 SEQ ID NO. 35 SEQ ID NO. 35 SEQ ID NO. 38 SEQ ID NO. 38 SEQ ID NO. 38 SEQ ID NO. 38 SEQ ID NO. 38 SEQ ID NO. 40 SEQ ID NO. 38 SEQ ID NO. 40 SEQ ID NO. 40 SEQ ID NO. 40 SEQ ID NO. 40 Важкий Ланцюг SEQ ID NO. 26 SEQ ID NO. 27 SEQ ID NO. 92 SEQ ID NO. 93 SEQ ID NO. 94 SEQ ID NO. 98 SEQ ID NO. 31 SEQ ID NO. 92 SEQ ID NO. 93 SEQ ID NO. 94 SEQ ID NO. 98 SEQ ID NO. 31 SEQ ID NO. 33 SEQ ID NO. 92 SEQ ID NO. 93 SEQ ID NO. 94 SEQ ID NO. 98 В одному з винаходів антитіло є H6L13FL, H16L16 FL, H20L13 FL чи H20L16 FL В одному з винаходів антитіло є H20L16 FL, або його варіант, що містить CDR аналог. Альтернативно, заміщення, згадані вище, будичи зворотніми мутаціями до певного амінного залишку, знайденого в еквівалентному положенні в послідовності мишачого донору 2А10, може бути будь-яким заміщенням амінокислоти, яке є захисним заміщенням певного залишку, знайденого в еквівалентному положенні в послідовності мишачого донору 2А10. Термін "захисне заміщення" є зрозумілим для фахівця, і включає, наприклад, заміщення аміно кислоти на інший амінокислотний залишок, який має подібну фізичну, хімічну чи структурну властивість таку як рН, заряд, гідрофобність, ароматичність та інш. В одному з втілень даного винаходу антитіла не є літичними, так як постійна ділянка не здатна до зв'язування з комплементом та/або проміжним ADCC (антитіло-залежна клітинна цитотоксичність). Тому постійні ділянки антитіл повної довжини або ґрунтуються постійних доменах, що є природно не літичними, такими як lgG4 людини, або містять інактивуючі замісники в положеннях 2 35 та 2 37 в π остійні ділянки lgG1 людини (дивись ЕР0307434 для більшої деталізації). Підписи до Рисунків Рисунок 1 А та В, ELISA дані для супернатантів моноклонального антитіла зв'язаних з рекомбінантним NOGO людини. Рисунок 2 А та В, ELISA дані для очищеного моноклонального антитіла зв'язаного з рекомбінантним NOGO людини. Рисунок 3 А та В, ELISA дані для супернатантів моноклонального антитіла зв'язаних з рекомбінантним NOGO людини. Рисунок 4 А та В, ELISA дані для супернатантів моноклонального антитіла зв'язаних з рекомбінантним NOGO людини. Рисунок 5 А та В, ELISA дані для супернатантів моноклонального антитіла зв'язаних з рекомбінантним NOGO людини. 9 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 Рисунок 6, від А до F, FACS дані для очищеного моноклонального антитіла зв'язаного з NOGO людини, що виділені клітинами нейробластоми людини. Рисунок 7, Порівняння ELISA результатів. Рисунок 8, ELISA дані для моноклональних антитіл зв'язаних з рекомбінантним NOGO людини. Рисунок 9, ELISA дані для моноклональних антитіл зв'язаних з рекомбінантним NOGO людини. Рисунок 10, ELISA дані для моноклональних антитіл зв'язаних з рекомбінантним NOGO людини. Рисунок 11, ELISA дані для моноклональних антитіл зв'язаних з рекомбінантним NOGO людини. Рисунок 12 А та В, ELISA дані для моноклональних антитіл зв'язаних з рекомбінантним NOGO людини. Рисунок 13, FACS дані для очищеного моноклонального антитіла зв'язаного з NOGO людини, що виділені клітинами нейробластоми людини. Рисунок від 14 А до С, FACS дані для очищеного моноклонального антитіла зв'язаного з NOGO людини, що виділені клітинами нейробластоми людини. Антитіла винаходу, зазвичай, мають структуру природнього антитіла або його функціонального фрагменту. Тому антитіло може включати антитіло повної довжини, (Fab )2 фрагмент, Fab фрагмент, димер легкого ланцюгу чи димер важкого ланцюгу. Антитіло може бути lgG1, lgG2, lgG3, чи lgG4; чи IgM; IgA, IgE чи IgD чи його модифікований варіант. Постійний домен важкого ланцюгу антитіла відповідно може бути відібраним. Постійний домен легкого ланцюгу може бути каппа або лямбда постійний домен. До того ж, антитіло може включати модифікації всіх класів, наприклад, IgG димери, Fc мутанти, що не довші за зв'язок Fc рецептори чи проміжні Clq зв'язування. Антитіло може також бути гібридним антитілом типу описаного в WO86/01533, який містить антигензв'язуючу ділянку та ділянка не-імуноглобуліну. Антиген зв'язуюча ділянка - це варіабельний домен легкого ланцюгу чи варіабельний домен важкого ланцюгу антитіла. Зазвичай, антиген зв'язуюча ділянка містить варіабельний домен як легкого так і важкого ланцюгу. Ділянка не-імуноглобуліну з'єднується на її С кінці з антиген зв'язуючої областю. Ділянка не-імуноглобуліну є, зазвичай, не-імуноглобуліновим протеїном та може бути ензимом, токсином чи протеїном, що має відому зв'язуючу специфічність. Дві ділянки цього типу гібридного антитіла може бути поєднана через розщеплюєму послідовність лінкеру. Імуноадгезини, що мають CDR як вище описано, також розглядаються даним винаходом. Постійна ділянка відбирається згідно до вимог функціональності. Зазвичай lgG1 демонструватиме літичну здібність через зв'язування з комплементом та/або буде посередником ADCC (антитіло-залежна клітинна цитотоксичність). LgG4 буде надана перевага, якщо вимагається нецитотоксичне блокування антитіла. Однак, lgG4 антитіла можуть демонструвати нестабільність в продуціюванні, тому, як правило, більш стабільні lgG1 можуть бути більш кращими для модифікування. Запропоновані модифікації описані в ЕР0307434 заявлені модифікації містять в положеннях 235 та 237. Тому винахід забезпечує літичну чи нелітичну форму антитіла згідно з винаходом. В одному з втілень антитіло винаходу становить повну довжину (тобто, тетраметр, що містить два важких та два легких ланцюги) нелітичного lgG1 антитіла, що містить VH або VL послідовності описані вище. В іншому втіленні ми забезпечуємо повну довжину нелітичного lgG1 антитіла, що містить VHs з SEQIDNOs 11, 12, 16, 18 чи 85, 86, 87 чи 91; та VLs з SEQ ID NOs 20, 23 чи 25. В подальшому втіленні, винахід забезпечує полінуклеотиди, що кодують розкриті важкі чи легкі ланцюги чи варіабельні ділянки. Наприклад, винахід забезпечує полінуклеотиди, що кодують VH, яка має послідовність, що міститься в SEQ ID NOs 45-52, 99-105 та VL ділянок, які мають послідовність, що міститься в SEQ ID NOs 53-59. "NOGO" стосується будь-якого NOGO поліпептиду, включаючи варіантні форми. Це включає, але не обмежує, NOGO-A, що містить 1192 амінокислотних залишки (GenBank доступ no. AJ251383); NOGO-B, варіант сплайсирування, якому не вистачає залишків 186 до 1004 в зовнішньо клітинному домені, що припускається (GenBank доступ no. AJ251384) та коротший варіант сплайсирування, NOGO-C, якому також не вистачає залишків 186 до 1004 та також має меншу, альтернативний аміно термінальний домен (GenBank доступ no. AJ251385) (Prinjha et al (2000) вище). Всі посилання до "NOGO", тут мається на увазі, містять будь-який та всі варіантні форми NOGO такі як NOGO-A, та означають описані варіанти сплайсирування, за виключенням специфічної форми. 10 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Нейтралізування" та його граматичні варіанти стосується інгібування, або загального або часткового, функцій NOGO, включаючи його зв'язування з нейронами та інгібування росту нейронів. Терміни Fv, Fc, Fd, Fab, чи F(ab)2 використовують в їх стандартних значеннях (дивись, наприклад, Harlow et al., Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory, (1988)). "Гібридне антитіло" стосується типу сконструйованого антитіла, яке містить варіабельну ділянку, що природно зустрічається (легкий ланцюг та важкий ланцюг), отриману з донорного антитіла, в асоціації з постійними ділянками легкого та важкого ланцюгів, виведених з акцепторного антитіла. "Гуманізоване антитіло" стосується сконструйованого антитіла, яке має свою CDR, отриману з донорного імуноглобуліну не-людини, частин залишившихся імуноглобулін-похідних, молекули, що є виведеними з одного (чи більше) імуноглобуліну(ів) людини. До того ж, залишки носіїв каркасу можіть бути змінені для захисту аффінності зв'язування (дивись, наприклад, Queen et al., Proc. Natl Acad Sci USA, 86:10029-10032 (1989), Hodgson et al., Bio/Technology, 9:421 (1991)). Відповідне акцепторне антитіло людини може бути одним з відібраних зі стандартної бази даних, наприклад, КАВАТ® бази даних, Los Alamos бази даних, та Swiss Protein бази даних, гомологією до нуклеотиду та амінокислотних послідовностей донорного антитіла. Антитіло людини характеризоване гомологією до каркасних ділянок донорного антитіла (на амінокислотній основі) може бути відповідним, щоб забезпечити постійну ділянку важкого ланцюгу та/або варіабельна каркасна ділянка важкого ланцюгу, для введення донора CDR. Відповідне акцепторне антитіло, здатне віддати постійну або варіабельну каркасну ділянки легкого ланцюгу, може бути відібраним таким же способом. Необхідно зазначити, що акцепторне антитіло важкого та легкого ланцюгів не повинно походити з одного й того ж акцепторного антитіла. Попередній спосіб описує декілька шляхів виготовлення таких гуманізованих антитіл - дивись, наприклад, ЕР-А-0239400 та ЕР-А-054951 Термін "донорне антитіло" стосується антитіла (моноклонального, та/або рекомбінанта), яке робить вклад амінокислотною послідовністю своїх варіабельних ділянок, CDR, або іншими функціональними фрагментами, або його аналогами до першого імуноглобулінового, для того щоб забезпечити кодуючи ділянку зміненого імуноглобуліну, і, як результат, виділене змінене антитіло з антигенною специфічністю, та нейтралізування при знаків активності донорного антитіла. Термін "акцепторне антитіло" стосується антитіла (моноклонального, та/або рекомбінанта) гетерологічного до донорного антитіла, яке робить вклад всіма (чи будь-якою частиною, але переважно всією) амінокислотними послідовностями, кодуючи свої каркасні ділянки важкого та/або легкого ланцюгу та/або свої постійні ділянки важкого та/або легкого ланцюгу до першого імуноглобулінового партнера. Переважно, антитіло людини є акцепторним антитілом. "CDR" визначається як амінокислотна послідовність ділянки визначення компліментарності антитіла, яке є гіперваріабільними ділянками важкого та легкого ланцюгів імуноглобуліну. Дивись, наприклад, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В варіабельній частині імуноглобуліну існує три важких ланцюги та три легких ланцюги CDR (чи CDR ділянки). Таким чином, "CDR", як використано тут, стосується всіх трьох важких ланцюгів CDR, або всіх трьох легких ланцюгів CDR (чи як всіх важких так і всіх легких ланцюгів CDR, якщо відповідні). Структура та конформація протеїну антитіла може означати, що інші залишки вважаються частиною антигензв'язуючої ділянки та були б зрозумілими для фахівця. Дивись, наприклад, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p877-883. CDR забезпечують більшість контактних залишків для зв'язування антитіла до антигену чи епітопу. CDR, в інтересах винаходу, є виділеними з варіабельної послідовності важкого та легкого ланцюгів донорного антитіла, та містять аналоги природно існуючих CDR, аналоги яких також розділяють чи зберігають ті ж самі антиген зв'язуючі специфічності, та/або нейтралізують здатність як донорного антитіла з якого вони виведені. "Функціональний фрагмент" - це часткова варіабельна послідовність важкого чи легкого ланцюгу (наприклад, другорядна делеція в аміно чи карбокси кінцях варіабельної ділянки імуноглобуліну), який зберігає ту ж саму антиген зв'язуючу специфічність або подібну нейтралізуючу здатність як і антитіло, з якого цей фрагмент виведено. "Аналог" - це амінокислотна послідовність, модифікована що найменше однією амінокислотою, де згадана модифікація може бути хімічною або заміщенням, або перегрупуванням декількох амінокислот (тобто, не менше ніж 10), така модифікація дозволяє амінокислотній послідовності зберегти біологічні характеристики, наприклад, специфічність антигену та високу аффінність, не модифікованої послідовності. 11 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід також включає використання Fab фрагментів чи F(ab')2 фрагментів виведених з mAbs за даним винаходом, направлених проти NOGO. Fab фрагмент містить повний легкий ланцюг та аміно кінцеві частини важкого ланцюгу; та F(ab')2 фрагмент є фрагментом, утвореним двома Fab фрагментами зв'язаними дисульфід ними зв'язками. Fab фрагменти та F(ab')2 фрагменти можуть бути отримані стандартними способами, наприклад, розщеплення mAb на відповідні протеолітичні ензими, папаїн та/або пепсин, або рекомбінантними методами. Fab та F(ab')2 фрагменти є корисними самі по собі як терапевтичні чи профілактичні, та як донори послідовностей, включаючи варіабельні ділянки, та CDR послідовності корисні в формуванні рекомбінанту чи гуманізованих антитіл як описано тут. В подальших втіленнях винаходу ми забезпечуємо дитіла (бівалентні чи біспецифічні), тритіла, тетратіла та інші мультивалентні види scFV протеїну, що мають один чи більше CDR, як описано вище, зв'язані з та нейтралізують NOGO функцію. В ще подальших втіленнях, антитіло винаходу може прикріплятись до нього додатковим агентом. Наприклад, методика техніки рекомбінанти DNA може бути використана для виготовлення сконструйованого антитіла винаходу, в якому Fc фрагмент чи СН2-СН3 домен молекули антитіла повної довжини заміщується на ензим чи іншу молекулу здатну до детекції (тобто, поліпептидна ефекторна чи репортерна молекула). Антитіла за даним винаходом можуть бути отримані виготовленням стандартного вектора експресії чи рекомбінантної плазміди встановленням цих кодуючих послідовностей для антитіла в діючих асоціаціях зі стандартним регуляторним контролем послідовностей, здатним до контролювання реплікації та експресії в, та/або виділення з, клітини-хазяїна. Регуляторні послідовності містять промотор послідовностей, наприклад, CMV промотор, та сигнальні послідовності, які можеть бути виведені з інших відомих антитіл. Таким же чином, вектор другої експресії може бути виготовленим, маючи DNA послідовність, яка кодує комплементарне антитіло легкого чи важкого ланцюгу· Переважно цей вектор другої експресії є ідентичним до першого, за виключенням, настільки, що стосується кодуючої послідовністі та здатністі до відбору маркерів, і таким же чином гарантує, по можливості, що кожен поліпептидний ланцюг є функціонально представленим. В якості альтернативи, кодуюча послідовність важкого та легкого ланцюгу для зміненого антитіла може належати до одинарного вектору. Відібрана клітина-хазяїн котрансфектується стандартними методиками як з першим так і з другим векторами (або просто трансфектується одинарним вектором), щоб створити трансфектовану клітину-хазяїна винаходу, що включає обидва рекомбінантні чи синтетичні легкі та важкі ланцюги. Трансфектована клітина потім культурується стандартними методиками для виготовлення сконструйованого антитіла винаходу. Антитіло, яке включає асоціацію як рекомбінантного важкого ланцюгу τ ак і/або л егкого ланцюгу, с крінінгується з культури в ідповідною пробою аналізу, таким як ELISA чи RIA. Подібні стандартні методики можуть використовуватись для створення інших змінених антитіл та молекул. Відповідні вектори для стадій клонування та субклонування, використані в методах, та структурі композицій за даним винаходом можуть бути відібрані одним з прийомів, відомих з рівня техніки. Наприклад, може бути використана стандартна pUC серія векторів клонування. Один вектор, pUC19, є комерційно доступним продукованим кіньми, такий як Amersham (Buckinghamshire, United Kingdom) чи Pharmacia (Uppsala, Sweden). До того ж, будь-який вектор, який здатний до швидкої реплікації, має надлишок місць клонування та генів, що селектуються (наприклад, стійкість до антибіотику), та легко маніпулюються, можуть бути використані для клонування. Подібно, вектори, використані для експресії антитіл, можуть бути відібрані одним з прийомів, відомих з рівня техніки, з будь-якого стандартного вектору. Вектори також містять селектовані регуляторні послідовності (такі як CMV чи RSV промотори), які орієнтують реплікацію та експресію гетерологічних ДНК послідовностей у відібраних клітинах-хазяїнах. Ці вектори містять вище описані ДНК послідовності, які кодують антитіла чи зміненої кодуючої ділянки імуноглобуліну. До того ж, вектори можуть об'єднувати селектовані імуноглобулінові послідовності, модифіковані введенням сайтів бажаної рестрикції для швидкої маніпуляції. Вектори експресії можуть також характеризуватись генами відповідними для посилення експресії гетерологічних ДНК послідовностей, наприклад, ген редуктази дигідрофолату с савців (DHFR). Інші кращі векторні послідовності містять полі А сигнальну послідовність, таку як з бичого гормону росту (BGH) та послідовність промотора бетаглобіну (betaglopro). Вектори експресії корисні тут можуть бути синтезовані за добре відомими методиками прийомів, відомих з рівня техніки. Компоненти таких векторів, наприклад, реплікони, гени відбору, енхансери, промотори, сигнальні послідовності та т.д., можуть бути отримані з комерційних або природних джерел чи 12 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 синтезовані за відомими методиками для використання в направленій експресії та/або виділенні продукту рекомбінанту ДНК у відібраному хазяїні. Інші прийнятні вектори експресії, багато типів з яких відомі з рівня техніки, для ссавцевої, бактеріальної, комашиної, дріжджової та грибкової експресії може також бути відібрана для цієї мети. Даний винахід також охоплює лінію клітин трансфектовану з рекомбінантним плазмідом, що містить кодуючі послідовності антитіл або його змінених молекул імуноглобуліну. Кпітини-хазяїні корисні для клонування та інших маніпуляцій з цими клонуючими векторами також є стандартними. Однак, більш охоче, клітини з різних штамів E. соlі використовують для реплікації векторів клонування та інших стадій в структурі змінених антитіл цього винаходу. Придатні клітини-хазяїні чи лінії клітин для експресії антитіла винаходу є переважно клітинами ссавців, такими як NSO, Sp2/0, CHO (наприклад, DG44), COS, клітина фібробласти (наприклад, 3Т3), та клітини мієломи, та краще СНО або клітина мієломи. Клітини людини можуть бути використані, таким чином даючи можливість молекулі бути модифікованою з глікозильованим типом людини. В якості альтернативи, можуть бути використані інші лінії клітин еукаріотів. Відбір придатних клітин-хазяїнів ссавців та методів для трансформації, вирощування, ампліфікації, скрінінгу та вироблення продукту та очистки є відомими з рівня техніки. Дивись, наприклад, Sambrook et al., наведені вище. Бактеріальні клітини можуть виявитись корисними як клітини-хазяїні, придатні для експресії рекомбінанта Fabs за даним винаходом (дивись, наприклад, Pluckthun, Α., Immunol. Rev., 130:151-188 (1992)). Однак, завдяки тенденції протеїнів, експресованих в бактеріальних клітинах, бути в розвернутій чи неправильно згорнутій формі чи в не глікозильованій формі, будь-який рекомбінант Fab, вироблений в бактеріальній клітині мав би бути скрінінгованим для збереження антигеном здатності зв'язування. Якщо молекула, експресована бактеріальною клітиною, була вироблена в належно згорнутій формі, то бактеріальна клітина була б прийнятним хазяїнем. Наприклад, різні штами Е. соlі використані для експресії є добре відомими як клітини-хазяїні в галузі біотехнології. Різні штами В. subtilis, Streptomyces, і нших бацил та т.д. можуть бути використано в цьому методі. Фахівцям відомо, що штами дріжджових клітин, також є придатними як клітини-хазяї, а також клітини комах, наприклад Drosophila та Lepidoptera та вірусні експресійні системи. Дивись, наприклад, Miller et al., Genetic Engineering, 8:277-298, Plenum Press (1986) та посилання наведені тут. Основні методи, за якими вектори можуть бути створені, методи трансфекції потребують для вироблення клітин-хазяїнів за винаходом та методи вирощування необхідні для виготовлення антитіла за винаходом з такої клітини-хазяїна всі є стандартними методиками. Зазвичай, метод вирощування за даним винаходом є метод вирощування без сироватки, як правило вирощування клітин без сироватки в суспензії. Більш того, виготовлені, антитіла винаходу можуть бути очищені від вмісту культури клітин згідно до стандартної методики, відомої з рівня техніки, включаючи висадження сульфату амонію, аффінну хроматографію на колонці, хроматографію на колонці, гель електрофорез і т.д. Такі методики наведені в прийомах, відомих з рівня техніки, та не обмежують цей винахід. Наприклад, приготування змінених антитіл описані в WO 99/58679 та WO 96/16990. Ще інший метод експресії антитіл може використовувати експресію в трансгенній тварині, такий як описаний в U. S. Patent No. 4,873,316. Це відноситься до експресійної системи, використовуючи промотор тваринного казеїну, який, коли трансгенно введений ссавцям, дозволяє самкам виробляти в молоці потрібний рекомбінантний протеїн. В подальшому втіленні винаходу, забезпечується метод вироблення антитіла винаходу, метод, який включає стадію вирощування клітини-хазяїна, трансформованої чи трансфектованої з легким та/або важким ланцюгом вектора кодування антитіла винаходу та відновлення антитіла, виготовленого таким чином. У відповідності до даного винаходу забезпечується метод виготовлення анти-NOGO антитіла за даним винаходом, який специфічно зв'язує та нейтралізує активність NOGO-A людини, метод, який включає стадії: (a) надання важкого ланцюгу першого вектора кодування антитіла; (b) надання легкого ланцюгу другого вектора кодування антитіла; (c) трансформування клітини-хазяїна ссавця (наприклад, СНО) зі згаданим першим та другим векторами; (d) вирощування клітини-хазяїна стадії (с) в умовах прийнятних для виділення антитіла зі згаданою клітиною-хазяїнем в згаданому культуральному середовищі; (e) відновлення виділеного антитіла стадії (d). 13 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одного разу експресоване прийнятним методом, антитіло потім досліджується на in vitro активність, використовуючи відповідний аналіз. На даний момент стандартні формати ELISA аналізу використовують для оцінки якісного та кількісного зв'язування антитіла з NOGO. До того ж, інші in vitro аналізи також можуть використовуватись для перевірки нейтралізуючої ефективності попереднього до додаткового клінічного вивчення людини, виконаного для визначення стійкості антитіла в тілі, не дивлячись на звичайні механізми відбору. Терапевтичні агенти цього винаходу можуть бути введені як профілактичні чи при проявах випадок/ряд клінічних симптомів інсульту, чи у випадку необхідності. Доза та тривалість лікування корелює до відносної тривалості циркуляції молекул за даним винаходом в людині, та може регулюватись одним з прийомів, відомих з рівня техніки, що залежить від умови проведення лікування та загального стану здоров'я пацієнта. Розглядається, що повторювані дози (наприклад, раз на тиждень чи раз на два тижні) занадто розтягнуті на період часу (наприклад, від чотирьох до шести місяців) можливо необхідні, щоб досягти максимальну терапевтичну ефективність. Методика введення терапевтичного агенту винаходу може бути будь-яким прийнятним шляхом, який доставляє агент до хазяїна. Антагоністи й антитіла, та фармацевтичні композиції винаходу є особливо корисним для парентерального введення, тобто підшкірно, інтратекально, інтраперитонально, внутрішньом'язово, внутрівенно, чи інтраназально, з яких має особливу перевагу внутрівенний.. Терапевтичні агенти винаходу можуть готуватись як фармацевтичні композиції, що містять ефективну кількість антагоністу чи антитіла винаходу як активного інгредієнту в фармацевтично прийнятному носію. В профілактичному агенті винаходу, надається перевага водній суспензії чи розчину, що містить конструйоване антитіло, краще буферованому з фізіологічним рН, в формі готовій для введення. Композиції для парентерального введення зазвичай будуть включати розчин антагоністу чи антитіла винаходу чи їх коктейль, розчинений в фармацевтично прийнятному наповнювачі, переважно водний наповнювач. Можуть використовуватись різні водні наповнювачі, наприклад, 0.9% розчин солі, 0.3% розчин гліцину, і т.д. Ці розчини є стерильними та не міститимуть макрочастки матерії. Ці розчини можуть бути стерилізованими за стандартними, методиками стерилізації (наприклад, фільтрація). Композиції можуть містити фармацевтично прийнятні допоміжні речовини, як необхідність для наближення до фізіологічних умов, такі як рН регулюючі та буферуючі агенти, т.д. Концентрація антагоністу чи антитіла винаходу в таких фармацевтичних композиціях може змінюватися в широких межах, тобто, зазвичай, від менших ніж 0.5%, чи по крайній мірі близько 1%, до майже 15 чи 20% по вазі та будуть спочатку відібрані ґрунтуючись на об'ємах рідини, в'язкості, т.д., згідно до часткової модифікації, обраного способу введення. Таким чином, фармацевтична композиція винаходу для внутрішньом'язового введення могла б бути приготовлена з вмістом від 1 нг до 100 мг в 1 мл стерильної буферованої води, наприклад, від 50 нг до 30 мг або більш прийнятно, від 5 мг до 25 мг, антагоністу чи антитіла винаходу. Подібним чином, фармацевтична композиція винаходу для внутрівенного введення могла готуватись так, щоб містити в стерильному розчині Рінгера, об'ємом близько 250 мл, від 1 до 30, та краще від 5 мг до 25 мг конструйованого антитіла винаходу. Діючі методи приготування композиції для парентерального введення є добре відомими чи будуть очевидними фахівцям, та описані більш детально в, наприклад, Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pennsylvania. Для приготування композицій антитіл винаходу для внутрівенного введення дивись Lasmar U and Parkins D "The formulation of rd Biopharmaceutical products", Pharma. Sci.Tech.today, page 129-137, Vol.3 (3 April 2000), Wang, W "Instability, stabilisation and formulation of liquid protein Pharmaceuticals", Int. J. Pharm 185 (1999) 129-188, Stability of Protein Pharmaceuticals Part A and В ed Ahem T.J., Manning M.C., New York, NY: Plenum Press (1992), Akers.M.J. "Excipient-Drug interactions in Parenteral Formulations", J.Pharm Sci 91 (2002) 2283-2300, Imamura, К et al "Effects of types of sugar on stabilization of Protein in the dried state", J Pharm Sci 92 (2003) 266-274,Izutsu, Kkojima, S. "Excipient crystalinity and its protein-structure-stabilizing effect during freeze-drying", J Pharm. Pharmacol, 54 (2002) 10331039, Johnson, R, "Mannitol-sucrose mixtures-versatile formulations for protein lyophilization", J. Pharm. Sci, 91 (2002) 914-922. Ha,Ε Wang W, Wang Y.j. "Peroxide formation in polysorbate 80 and protein stability", J. Pharm Sci, 91, 2252-2264,(2002) повний зміст, якого зареєстрований тут посиланнями та до якого читач більш точно направляється. Перевага надається, коли терапевтичний агент винаходу, в процесі фармацевтичного приготування, знаходиться в формах одиничної дози. Відповідна терапевтично ефективна доза може бути легко визначена за тими з прийомів, що відомі з рівня техніки. Щоб ефективно лікувати інсульт та інші неврологічні захворювання у людини, одна доза для парентерального 14 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення становитиме аж до 700 мг на 70 кг живої ваги антагоністу чи антитіла цього винаходу, краще внутрівенно чи внутрішньомускульно. Такі дози можуть, якщо необхідно, готуватись у відповідний проміжок часу вибраний, відповідно, лікарем. Як розкрито в прикладах, дані винахідники здатні продемонструвати позитивний ефект функціонального відновлення у щурів, коли антитіла винаходу були введені внутрівенно. Антитіла, описані тут, можуть бути ліофілізованими для збереження та відновленими в прийнятному середовищі перед використанням. Ця методика, як показало, є ефективною зі стандартними імуноглобулінами та можуть бути використані методики ліофілізації, що відомі з рівня техніки, та відновлення. Антитіла винаходу можуть бути також використані в комбінації (тобто, одночасно, послідовно чи окремо) з нейротрофічним фактором таким як фактор росту нерва (NGF), наприклад, нейротрофічний фактор, що виділяється мозком (BDNF), анти-запальні агенти такі як кортикостероїди, та /або tPA. Комбінації NOGO антитіла винаходу та, наприклад, tPA, може визначатися в моделі МСАО чотирьох серій, наведених в прикладах нижче. В іншому втіленні, винахід забезпечує фармацевтичну композицію, що включає анти-NOGO антитіло за даним винаходом чи його функціональний фрагмент та фармацевтично прийнятний носій для лікування та профілактики інсульту та інших неврологічних захворювань. В ще подальшому втіленні, винахід забезпечує фармацевтичну композицію, що містить анти-NOGO антитіло за даним винаходом чи його функціональний фрагмент та фармацевтично прийнятний носій для інгібування нейродегенерації та/або стимулювання функціонального відновлення у людей пацієнтів, що страждають, чи мають ризик розвитку, від інсульту чи інших неврологічних захворювань. Винахід далі забезпечує метод лікування або профілактики інсульту (особливо ішемічний інсульт) чи інших неврологічних захворювань/розладів, особливо хвороби Альцгеймера, у людини, який включає введення згаданій людині, що цього потребує, ефективної кількості антиNOGO антитіла чи його функціонального фрагменту. Антитіла винаходу можуть використовуватись в методах лікування до уповільнення чи призупинці прогресування та/або нападу хвороби Альцгеймера на додаток до (або як альтернатива до) встановленого лікування хвороби у людей-пацієнтів. Далі винахід забезпечує використання анти-NOGO антитіла, чи його функціонального фрагменту, в приготуванні ліків для лікування чи профілактики інсульту та інших неврологічних захворювань/розладів, особливо хвороби Альцгеймера. Винахід забезпечує метод інгібування нейродегенерації та/або стимулювання функціонального відновлення у людей пацієнтів, що страждають, чи мають ризик розвитку, від інсульту чи інших неврологічних захворювань/розладів, особливо хвороби Альцгеймера, який включає введення зазначеній людині, що цього потребує, ефективної кількості анти-NOGO антитіла чи його функціонального фрагменту. До того ж, винахід забезпечує використання анти-NOGO антитіла, чи його функціонального фрагменту, в приготуванні медикаменту для інгібування нейродегенерації та/або стимулювання функціонального відновлення у людини пацієнта, що страждає від, чи мають ризик розвитку, інсульту та інших неврологічних захворювань/розладів, особливо хвороби Альцгеймера. Винахід далі забезпечує метод лікування або профілактики інсульту чи інших неврологічних захворювань/розладів, особливо хвороби Альцгеймера, у людини, що включає стадію парентерального введення терапевтично ефективної кількості анти-NOGO антитіла. Переважно анти-NOGO антитіло вводиться внутрівенно. Неврологічні захворювання чи розлади, як використовували вищезгадано, включають, але не обмежуються, травматичне ушкодження мозку, ушкодження спинного мозку, лобно-скроневу деменцію (тауопатії), периферійну невропатію, хворобу Паркінсону, хворобу Хантінгтона, розсіяний склероз та особливо хворобу Альцгеймера. Винахід також забезпечує метод стимулювання пророщування аксонів, що включає стадію контактування аксону людини з анти-NOGO антитілом. Цей метод може виконуватись in-vitro або in-vivo, краще коли метод виконується in-vivo. Тому, в подальшому втіленні забезпечується використання анти-NOGO антитіл винаходу, у формі для внутрівенного введення, у виробництві медикаментів д ля лікування і нсульту (особливо ішемічного інсульту), ушкодження мозку, ушкодження спинного мозку, лобноскроневої деменції (тауопатії), периферійної невропатії, хвороби Паркінсону, хвороби Хантінгтона, розсіяного склерозу та особливо хвороби Альцгеймера у людини пацієнта. Тому, в подальшому втіленні забезпечується спосіб лікування інсульту (особливо ішемічного інсульту), ушкодження мозку, ушкодження спинного мозку, лобно-скроневої деменції (тауопатії), периферійної невропатії, хвороби Паркінсону, хвороби Хантінгтона, розсіяного склерозу та 15 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 особливо хвороби Альцгеймера у людини пацієнта, спосіб, який включає внутрівенне введення терапевтично ефективної кількості анти-NOGO антитіла винаходу. В подальшому втіленні даного винаходу забезпечується спосіб стимулювання пророщення аксону нейронів в центральній нервовій системі людського суб'єкту (наприклад, пацієнту), метод, який включає введення (наприклад, внутрівенне введення) терапевтично ефективної кількості анти-NOGO антитіла (наприклад, анти-NOGO антитіло, що включає CDR як четверта серія, наведена тут). В подальшому втіленні даного винаходу забезпечується використання анти-NOGO антитіла (наприклад, анти-NOGO антитіло, що містить CDR як четверта серія, наведена тут) у виробництві ліків для внутрівенного введення для лікування інсульту (особливо ішемічного інсульту), ушкодження мозку, ушкодження спинного мозку, лобно-скроневої деменції (тауопатії), периферійної невропатії, хвороби Паркінсону, хвороби Хантінгтона, розсіяного склерозу та особливо хвороби Альцгеймера у людини пацієнта. В подальшому втіленні винаходу забезпечується спосіб процесів регенерації аксону в нейронах центральної нервової системи у людини пацієнта, що страждає від (або має схильність до) інсульту (особливо ішемічного інсульту), ушкодження мозку, ушкодження спинного мозку, лобно-скроневої деменції (тауопатії), периферійної невропатії, хвороби Паркінсону, хвороби Хантінгтона, розсіяного склерозу та особливо хвороби Альцгеймера, метод, який включає стадію введення which method comprises the step of administering (наприклад, внутрівенно) терапевтично ефективної кількості анти-NOGO антитіла за даним винаходом. В подальшому втіленні винаходу забезпечується використання анти-NOGO антитіла за даним винаходом у виробництві фармацевтичної композиції, яка вводиться внутрівенно, для процесів регенерації аксону в нейронах центральної нервової системи у людини пацієнта, що страждає від (або має схильність до) інсульту (особливо ішемічного інсульту), ушкодження мозку, ушкодження спинного мозку, лобно-скроневої деменції (тауопатії), периферійної невропатії, хвороби Паркінсону, хвороби Хантінгтона, розсіяного склерозу та особливо хвороби Альцгеймера. Термін "функціональне відновлення", який тут використаний означає моторне та/або сенсорне та/або поведінкове покращення у суб'єкта з наступним, наприклад, ішемічним випадком чи ушкодженням чи серією клінічних симптомів. Функціональне відновлення у людей може оцінюватись інструментами розробленими для визначення елементарних неврологічних функцій, таких як моторна стійкість, сприйняття та координація, когнітивні функції, такі як пам'ять, мова та здатність до наступних напрямків, та функціональна здатність, така як повсякденна активність чи діюча активність. Відновлення елементарної неврологічної функції може вимірюватись інструментами, такими як NIH Stroke Scale (NIHSS), відновлення когнітивної функції може вимірюватись нейропсихологічними тестами, такими як Boston Naming Test, Trailmaking Tests, and California Verbal Learning Test, та повсякденна активність може вимірюватись інструментами такими як ADCS/ADL (Alzheimer's Disease Clinical Studies/Activities of Daily Living) визначення чи the Bristol Activities of Daily Living Scale, всі тести та визначення відомі з рівня техніки. Приклад 1, Структура та експресія гуманізованих анти-NOGO антитіл Мишачі та Гуманізовані VH та VL структурні компоненти готували de novo зборкою накладання олігонуклеотидів, що включає рестрикцію сайтів для клонування в Rid та Rln векторів експресії ссавців, а також сигнальної послідовності людини. Hind III та Spe І сайти рестрикції вводили до каркасу VH домену, що містить САМРАТН-1Н сигнальну послідовность, для клонування в RId, який містить людську у1 мутовану постійну ділянку. Hind III та BsiWI сайти рестрикції вводили до каркасу VL домену, що містить САМ PATH-1Η сигнальну послідовность, для клонування в Rln, який містить людську каппа постійну ділянку. САМРАТН-1 Η сигнальна послідовність: MGWSCIILFLVATATGVHS (SEQ.I.D.NO:82) Паралельно, гібридна версія 11С7 була генерована (дивись WO04/052932). Варіабельна послідовність важкого домену (виведена з WO04/052932 Seq ID 43) та варіабельна послідовність легкого домену (виведена з WO04/052932 Seq ID 44) готували de novo зборкою накладання олігонуклеотидів. Hind III та Spel сайти рестрикції вводили до каркасу VH домену для клонування в Rid, що містить людську у1 мутовану постійну ділянку. Hindlll та BsiWI сайти рестрикції вводили до каркасу VL домену для клонування в Rln, який містить людську каппа постійну ділянку. Приклад 2, Експресія антитіла в СНО клітинах RId та Rln плазміди кодування важкого та легкого ланцюгів, відповідно, були тимчасово котрансфектовані в СНО клітини та експресовані в меншому ступені чи більшому ступені для 16 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 55 60 виготовлення антитіла. Альтернативно, такі ж плазміди були ко-трансфектовані в СНО клітини електропорацією та, використовуючи вільне від нуклеозидів середовище, виділяли стабільну полікпональну популяцію клітин, що експресують відповідне антитіло. В деяких випадках аналізували антитіло, що міститься в супернатантах, в інших випадках, рекомбінантне антитіло відновлювали та очищували афінною хроматографією на Protein A sepharose. Приклад 3, Гуманізоване анти-NOGO антитіло зв'язане з NOGO GST-людський NOGO-A56 (SEQ ID: 76) з концентрацією 1мкг/мл в PBS був покритий в Nunc Immunosorp планшетах(100мкп на лунку) при 4°С всю ніч. Лунки промивали одноразово TBS + 0.05% Tween (TBST) потім інкубували 2% розчином BSA в ТВЗТдля блокування неспецифічно з'язуючих сайтів при кімнатній температурі протягом 1 години. Антитіла розбавили в TBST + 2% BSA до концентрації 10мкг/мл та 1/2 розчинів зробили з цього. Антитіла додали до лунок в парі та інкубували при кімнатній температурі протягом 1 години. Лунки тричі промили TBST потім інкубували з кон'югатом анти-людської каппа пероксидази (1:2000) протягом 1 години. Лунки тричі промили TBST та потім інкубували з 100мкл на лунку субстрату OPD пероксидази (Sigma) протягом 10 хвилин. Кольорову реакцію зупинили додаванням 25мкл концентрованої H2SО4. Оптичну густину при 490 нм вимірювали використовуючи планшет рідер. Значення, прочитані з лунок, що не містили антитіла, вважалися фоновими та віднімались. Рисунки 1-5 ілюструють дозо-залежне зв'язування гуманізованих антитіл в порівнянні з химерами (показана HcLc, яка є химерою 2А10 (що містить 2А10 миші VH (SEQ ID NO. 7) та VL (SEQ ID NO.8) та IgG постійні ділянки людини)) до NOGO-A56 людини (дивись Приклад 6 для детального розгляду) в ELISA аналізі. Y-вісь показує виміряна оптична густина (0D) при 490 нм, кількісне вимірювання антитіла фіксували в лунках. Х-вісь показує використану концентрацію антитіла (мкг/мл) на лунку в кожній точці даних. Антитільна речовина, використана в Рисунках 1,3,4 та 5, була генерована з малим ступенем тимчасових трансфекцій. Рівні IgG людини в супернатанті вимірювали методом ELISA (Приклад 4). Для рисунку 2, використаний матеріал був очищеним антитілом (дивись приклад 2) генерованим або системою поліклональної експресії або великим ступенем тимчасових трансфекцій. В цих випадках, IgG рівні вимірювали методом ELISA та за оптичною густиною. В іншому експерименті, антитільний матеріал (в формі культури СНО клітин супернатанту) генерували з малим ступенем тимчасових трансфекцій (в трьох екземплярах) для наступних гуманізованих антитіл: H16L16, H17L16, H18L16, H16L18 та химерне (гібридне) антитіло HcLc. Результати цього експерименту узгоджуються з даними, представленими на Рисунках 1-5 за виключенням H17L16, що виконувались меншою лункою ніж показаною на Рисунках 1А та Рисунку 2. Поки це спостереження не могло бути пояснене, як зазначалось, що висновки протирічать іншим експериментам з супернатантним матеріалом (дивись Рисунок 1 А) та експерименту, що використовував очищений Η 17L16 матеріал (Рисунок 2), обидва експерименти показали, що H17L16 демонструє співставиме зв'язування з іншими оптимізованими варіантами. Приклад 4, Протокол визначення кількості антитіла Nunc Immunosorp планшети були накриті з фіксованим антитілом Н19 (козиний антилюдський IgG ланцюг, Sigma #13382) з концентрацією 2мкг/мл в Бікарбонатному буфері (Sigma #С3041) та інкубовані протягом ночі при 4°С. Планшети промивали двічі розчином TBS, що містить 0.05% Tween20 (TBST) та блокували 200 мкл TBST, що містить 2% BSA (буфер блоків), протягом 1 години при кімнатній температурі. Планшети промивали двічі розчином TBST. Супернатанти культури ткані, що містять антитіло, були титровані поперек планшету з 2кратним кроком розведення в буфері блоків та інкубовані при кімнатній температурі протягом 1 години. Планшети промивали тричі розчином TBST. HRP кон'юговане антитіло Н23 (козиний анти-людський каппа ланцюг, Sigma #A7164) розбавляли 1:2000 в TBST та додали 100 мкл до кожної лунки. Планшети інкубували при кімнатній температурі протягом 1 години. Планшети промивали тричі розчином TBST та розвивали зі 100мкл Fast-OPD субстрату (Sigma #P9187). Кольорова реакція тривала протягом дозволеного періоду 5-10 хвилин, після чого ELISA була зупинена додаванням 25мкл 3М H2SО4. Поглинання при 490 нм було зчитане з планшету та концентрація антитіла визначена за посиланнями до стандартної кривої. Приклад 5, Протокол ELISA конкуренції антитіла GST-людини NOGO-A56 (SEQ ID: 76) at 0.1-1.0 мкг/мл PBS був накритий в Nunc Immunosorp планшетах (100мкл на лунку) при 4°С протягом ночі чи при 37°С протягом 1 години. Лунки промивали тричі PBS потім інкубували з 1% розчином BSA в PBS (буфер блоків) для блокування сайтів неспецифічного зв'язування при кімнатній температурі протягом 2 годин. Паралельно приготували 50:50 суміш антитіл. Мишаче антитіло 2А10 додавали до кінцевої концентрації або 0.5 або 1.0 мкг/мл в буфері блоків. Химерні (гібридні) антитіла (мишачі 17 UA 98100 C2 5 10 15 20 25 30 35 40 45 50 варіабельні ділянки клоновані на мутованій постійній ділянки lgG1 Fc людини) додавали до кінцевої концентрації 0-25мкг/мл в буфері блоків. Буфер блоків був видалений з планшетів та 100мкл 50:50 суміші антитіл додавали протягом 1 години при кімнатній температурі. Лунки промивали тричі PBS, потім інкубували з 100мкл кон'югату пероксидази з поліклональними анти-мишачими імуноглобулінами кроля (розбавленими 1:2000 в буфері блоків, DakoCytomation #P0260) протягом 1 години при кімнатній температурі. Лунки промивали тричі PBS та потім інкубували з 100мкл на лунку OPD субстрату пероксидази (Sigma #Р9187) чи ТМВ субстрату (Sigma #T8665) протягом 10-30 хвилин. Кольорова реакція була зупинена додаванням 25мкл концентрованої H2SO4. Оптичну густину при 490 нм (OPD) чи 450 нм (ТМВ) вимірювали, використовуючи планшетний рідер. В першому експерименті (Рисунок 7А), планшети накривали GST-людини NOGO-A56 з концентрацією 0.5мкг/мл в PBS протягом ночі при 4°С та планшети проявляли ТМВ субстратом. В цьому експерименті, мишаче антитіло 2А10 оцінювали в комбінації з HcLc (химерна (гібридна) форма 2А10), 11С7, контролювали ізотоп химерного (гібридного) антитіла та контрольну пробу. В другому експерименті (Рисунок 7В), планшети накривали GST-людини NOGO-A56 з концентрацією 0.5мкг/мл в PBS при 37°С протягом 1 години та планшети проявляли OPD субстратом. В цьому експерименті, мишаче антитіло 2А10 оцінювали в комбінації з HcLc, 11C7, контролювали ізотипта очищували H16L18 антитіло. Приклад 6. Виготовлення NOGO-A Фрагменту (NOGO-A56, SEQ.I.D.NO:76) Кодування сДНК послідовністі амінокислот 586-785 (MQESLYPAAQLCPSFEESEATPSPVLPDIVMEAPLNSAVPSAGASVIQPSSSPL EASSVNYESIKHEPENPPPYEEAMSVSLKKVSGIKEEIKEPENINAALQETEAPYI SIACDLIKETKLSAEPAPDFSDYSEMAKVEQPVPDHSELVEDSSPDSEPVDLFS DDSIPDVPQKQDETVMLVKESLTETSFESMIEYENKE - SEQ.I.D.NO76) of NOGO-A людини клонували в BamHI-Xhol сайти pGEX-6P1, щоб генерувати GST-мічений химерний протеїн позначений NOGO-A56. Плазмід був експресований в BL21 клітини в 2XTY середовищі з концентрацією 100мкг/мл ампіциліну з наступною індукцією з IPTG до 0.5 мМ при 37° С протягом 3 годин. Клітинні осади розчинили під дією ультразвуку та химерний протеїн очищували, використовуючи Glutathione-sepharose (Amersham Pharmacia) з наступними інструкціями виробників. Очищений протеїн був елюйованим, використовуючи відновлений глутатіон та екстенсивно діалізованим проти PBS, кількісно визначений, використовуючи BSA стандарти та BioRad кумаси основного протеїнового аналізу, а потім зберігали в аліквотах при 80С. Example 7. BlaCore Аналіз гуманізованого Анти NOGO Монокпональних Антитіл Кінетику зв'язування очищеного анти-NOGO моноклональних антитіл (mAb) з рекомбінантно експресованим NOGO-A людини (GST-людини NOGO-A56) аналізували, використовуючи Віасоrе3000 біосенсор. hNOGO-A фрагмент готували як зазначено далі: Метод hNOGO (GST-людини NOGO-A56) іммобілізували до СМ5 фрагменту сполученням з первинним аміном, використовуючи Biacore Wizard програму, розроблену для рівнів мішеней іммобілізації. СМ5 сенсор-поверхня була активована протіканням розчину 50мМ N-гідроксисукциніміду (NHS) та 200мМ N-етил-N'-диметиламінопропил карбоніду (EDC). Потім hNOGO в буфері ацетату натрію, pH 5.0 чи pH 4.5, пропускали над фрагментом та іммобілізували. Після того, як іммобілізації повністю пройшла будь-які активовані естери, що ще залишилися, були блокованими введенням 1M розчину етан аміну гідрохлориду, до pH8.5. Анти-NOGO mAbs розбавляли в HBS-EP (10мМ HEPES, pH 7.4, 150мМ NaCI, 3мМ EDTA, та 0.005% P-20 сурфактанту) та проводили вивчення зв’язування в діапазоні визначених концентрацій антитіла. Всі серії дослідів представлені проти сенсор-поверхні контрольної проби (проба, що активована та блокована, як описано раніше, але до якої не додавали ліганд). Аналіз зв’язування виконували, використовуючи BIA-оціночний кінетичний аналіз з програмним забезпеченням версії 4.1. Biacore аналіз інших антитіл винаходу суттєво слідував тому ж протоколу, який тут описаний. Результати - Таблиця 8 Значення (+/- стандартне відхилення) чотирьох окремих експериментів 55 18 UA 98100 C2 Антитіло HcLc H6L13 H16L16 H16L18 H17L16 H18L16 H1L11 5 kd (1/с) 3.78e-3(7.0е-4) 1.37е-2(2.0е-3) 5.54е-3(1.4е-3) 5.52е-3(9.0е-4) 6.10е-3(1.3е-3) 5.86е-3(9.0е-4) 3.14е-2(4.2е-3) ka (1/Ms) 2.70е6(2.7е5) 1.82е6(3.5е5) 4.37е6(4.5е5) 4.18е6(4.1е5) 3.38е6(1.3е5) 3.64е6(3.5е5) 1.73е6(1.7е5) KD (nМ) 1.41 (0.3) 7.68(1.2) 1.26(0.2) 1.33(0.2) 1.82(0.4) 1.62(0.3) 18.6(3.7) Результати - Таблиця 9 Показані результати отримані з одного експерименту, за виключенням HcLc та H6Lc, де представлені значення є значеннями (+/-стандартне відхилення) двох окремих експериментів Антитіло (число незалежних експериментів) HcLc (2) HcL11 H6Lc (2) HcL13 H6L13 H6L6 H10L13 H700L11 H5L6 11C7 KD (nM) ka (1/Ms) kd (1/s) 3.52e6 (2.8e5) 3.78e6 2.17e6(3.8e5) 4.8e6 2.95e6 1.2e6 1.64е6 1.19е6 1.5е6 1.44е6 3.46e-3 (7.9е-4) 1.34е-2 2.84е-3(1.5е-3) 9.38е-3 2.33е-2 2.54e-2 2.12е-2 2.33е-2 4.7е-2 8.25e-5 0.995 (0.3) 3.55 2.21 (0.3) 1.98 7.9 21.4 12.95 19.45 30.3 0.057 kd (1/s) 1.3е-2 5.69е-3 7.39е-3 8.69e-3 2.84е-2 4.12e-3 KD (nM) 7.3 1.0 3.6 3.6 21.3 1.6 Результати - Таблиця 10 Показані результати отримані з одного експерименту 10 Антитіло H6L13 H16L16 H14L16 H14L18 H1L11 HcLc 15 20 25 ka (1/Ms) 1.77е6 5.47е6 2.05е6 2.41е6 1.33е6 2.62е6 Приклад 8. ВіаСоrе Аналіз гуманізованих Анти NOGO Моноклональних Антитіл, використовуючи диссоціаційне ранжування hNOGO фрагмент готували як для кінетичного аналізу. Клітини супернатантів були взяті прямо з короткочасних трансфекцій СНО-K1 клітин. їх пропускала прямо над сенсор-поверхнею та вимірювали взаємодію. Імітацію трансфектованих клітин супернатанту використовували для подвійного порівняння з еталоном, щоб видалити будь-які артефакти завдяки середовищу культури тканини. Всі серії дослідів представлені проти сенсор-поверхні контрольної проби (проба, що активована та блокована, як описано раніше, але до якої не додавали ліганд). Аналіз зв'язування виконували, використовуючи ВІА-оціночний кінетичний аналіз з програмним забезпеченням версії 4.1. Результати - Таблиця 11 Представлені результати отримані з одного експерименту, за виключенням H6L13, H16L16, H16L18, H1L11, HcLc та H18L16, де показані значення є значеннями (+/-стандартне відхилення) двох чи трьох окремих експериментів 19 UA 98100 C2 Антитіло (число незалежних експериментів) H14L13 H15L13 H16L13 H17L13 H18L13 H6L13(x3) H16L16(x3) H16L18(x3) H1L11(хЗ) HcLc(x2) H15L16 H14L16 H18L16(x2) H14L18 H15L18 H18L18 H6L17 H6L18 H6L14 H6L15 H6L16 5 10 15 20 25 30 35 kd (1/s) 1.38e-2 9.65e-3 9.07e-3 9.31e-3 9.07e-3 1.73e-2(4 8e-3) 6.64e-3 (9.2e-4) 6.09e-3 (7.4e-4) 4.03e-2(1.8e-2) 3.76e-3(7.1e-4) 6.04e-3 8.9e-3 6.87e-3 (7.5e-4) 8.35e-3 5.94e-3 5.8e-3 1.58e-2 1.06e-2 4.57e-2 2.11e-2 1.14e-2 Приклад 9, FACS Аналіз гуманізованих Анти NOGO Монокпональних Антитіл Клітини нейробластоми IMR32 людини ресуспендували в FACS фарбованому буфері (PBS + 6 4% теплого інактивованого FCS) з густиною 10 клітин на мл. 100мкл цієї суспензії переносили до лунок круглодонного мікропланшету з 96 лунками. 100мкл "Fix & Perm" Середовища A (Caltag Laboratories, GAS001S-100) додали до кожної лунки та планшет інкубували при кімнатній температурі протягом 15 хвилин. Клітини гранулювали, двічі промивали в FACS забарвлюючому буфері. Наступне промивання, клітини ресуспендували в 50 мкл розчину очищених анти-NOGO антитіл чи ізотипно підібраного контрольного антитіла з концентрацією 2Х кінцевої концентрації (0-200 мкг/мл в FACS забарвлюючому буфері). Додавали 50мкл "Fix & Perm" Середовища В (Caltag Laboratories GAS002S-100) та планшет інкубували на льоду протягом 1 години. Клітини двічі промивали в FACS забарвлюючому буфері до ресуспендування в 100 мкл розчину РЕ кон'югованого анти-людського у1 специфічного козиного F(ab')2 (Sigma Р-8047) при розбавленні 1/50 або 1/100. Клітини інкубували протягом 1 години на льоду. Клітини гранулювали та тричі промивали в FACs забарвлюючому буфері та клітини ресуспендували в 100мкл того ж самого буферу. 100мкл "Fix & Perm" Середовища В додали до фіксованих клітин для експериментів показаних на Рисунках 6 та 13. 100мкл BD CellFIX додали фіксованих клітин для експериментів показаних на Рисунку 14. Ступінь забарвлення визначали проточною цитометрією, використовуючи Becton Dickinson FACScan проточну цитометрію. Ізотип підібрані контролі використовували як зазначено. Результати показані на Рисунка 6 А - F. Всі представлені дані ілюструють, що HcLc антитіло (з 2А10) дає сильний сигнал в цьому FACS аналізі, який показує сильне зв'язування з експресованими NOGO клітинами людини. Дані також демонструють, що гуманізовані версії цієї химери можуть зберігати цю властивість. H20L16 антитіло послідовно переважає 11С7 в цьому аналізі, поки 2А10 химерне (гібридне) антитіло, та інші його гуманізовані версії, послідовно або переважає 11С7 в цьому аналізі або співставимий з ним. Приклад 10. Додавання гуманізованих анти -NOGO монокпональних антитіл Наступні методики описані в Прикладах 1 та 2, виготовляли ряд додаткових монокпональних антитіл. Зв'язуючу активність цих антитіл аналізували методами BIAcore, ELISA та FACS. 10.1 ВІАсоrе Ґрунтуючись на методологіях описаних в Прикладі 7, дані по додатковим анти-NOGO антитілам показані в таблицях 13, 14 ,15 та 17 нижче (очищений антитільний матеріал) та таблиця 16 (супернатантний матеріал). Результати - Таблиця 13 20 UA 98100 C2 Представлені результати отримані з одного експерименту. В цьому експерименті, значення, отримане для H16L16, було не типовим до значень отриманих в інших експериментах (типова показуючи KD(nM) близько 1 (дивись таблиці 8 та 10)). Анитіло HcLc H20L16 H22L16 H23L16 H24L16 H6L13 H1L11 H16L16 ka(1/Ms) 2.6е6 4.4е6 4.9е6 1.9е6 1.9е6 2.2е6 1.4е6 1.2е6 kd (1/s) 4.4е-3 7.3е-3 6.9е-3 6.4е-3 6.9е-3 1.4е-2 3.1е-2 4.0е-3 KD(nM) 1.7 1.7 1.47 3.8 3.7 6.4 22.3 3.4 5 Результати - Таблиця 14 Представлені результати отримані з одного експерименту. Антитіло H1L11 H6L13 HcLc H20L16 H22L16 H23L16 H24L16 10 kd (1/s) 2.82e-2 1.57е-2 3.5е-3 8.47е-3 7.67е-3 5.87e-3 5.72e-3 KD (nМ) 21.0 7.76 1.42 1.61 1.32 1.99 2.49 Результати - Таблиця 15 Представлені результати отримані з одного експерименту. Антитіло H1L11 H6L13 HcLc H22L16 H16L13 H20L13 15 kа (1/Ms) 1.34е6 2.02е6 2.46е6 5.24е6 5.83е6 2.95е6 2.3е6 ka (1/Ms) 1.19Е6 1.91Е6 2.32Е6 5.69Е6 4.76Е6 5.25Е6 kd (1/s) 2.19E-2 1.55E-2 3.69E-3 7.59E-3 1.21E-2 1.6E-2 KD (nM) 18.4 8.1 1.59 1.33 2.53 3.06 Результати - Таблиця 16 Представлені результати отримані з одного експерименту. Дані диссоциаційного ранжування базуються на супернантальному матеріалі обмеженої короткочасної трансфекції. 21 UA 98100 C2 Антитіло H23LC H24LC HcLc H22LC H20LC H16L18 H21LC H16L16 H24L16 H19Lc H23L16 H20L16 H22L16 H19L16 H23L13 H24L13 H20L13 H21L13 H19L13 H16L13 H1L11 5 Таблиця 17 Результати отримані з 12 незалежних серій дослідів. Представлені дані - це значення та стандартне відхилення 12 серій дослідів Антитіло H20L16 HcLc 10 15 20 25 30 диссоциація: kd (1/с) 3.42Е-03 3.83Е-03 3.92Е-03 4.67Е-03 5.07Е-03 5.66Е-03 5.69Е-03 5.77Е-03 5.85Е-03 5.95Е-03 6.06Е-03 7.18Е-03 7.78Е-03 8.73Е-03 9.56Е-03 9.96Е-03 1.20Е-02 1.20Е-02 1.30Е-02 1.38Е-02 1.96Е-02 Kа 5.43е6(1.77е5) 3.92е6(4.74е5) kd 1.02е-2(1.56е-3) 7.54е-3(1.90е-3) KD(nM) 1.86(0.16) 1.90(0.18) Ґрунтуючись на методологіях, описаних в Прикладі 3, додаткові дані по NOGO антитілам показані на Рисунках 8-11. В деяких з цих експериментів, використовували різні концентрації покриття антигена (0.1-1.0мкг/мл) Результати - Рисунок 8. NOGO антиген покритий при 1.0мкг/мл Результати - Рисунок 9. NOGO 5+6 антиген покритий при 0.1мкг/мл Результати - Рисунок 10. NOGO антиген покритий при 0.5мкг/мл Результати - Рисунок 11. NOGO антиген покритий при 1.0мкг/мл Результати: Рисунок 12А та В, GST-людини NOGO A56 антиген покритий при 1.0мкг/мл. Зв'язуючий ELISA супернатантного матеріалу з обмеженої короткочасної трансфекції. 10.3 Внутріклітинний FACS Ґрунтуючись на методологіях, описаних в Прикладі 9, додаткові FACS дані показані на Рисунку 13. Додаткові дані показані на Рисунку 14 А - С. Рисунок 14А представляє по одній точці даних для кожного зразку. Рисунки 14А та 14В представляють середні значення дубльованих зразків. Приклад 11, Зворотній формат ВіаСоrе Аналізу гуманізованих Анти NOGO Моноклональних Антитіл Кінетики зв'язування очищених анти-NOGO моноклональних антитіл (mAb) до рекомбінантно експресованих NOGO-A людини (GST-людини NOGO-A56) аналізували, використовуючи ВіасогеТ100. Фрагменти готували як зазначено далі: Method Biacore™ кінетичний аналіз гуманізованих NOGO антитіл виконували, використовуючи Протеїн А пастку антитіл-кандидатів. Коротко, Протеїн А іммобілізували на СМ5 фрагменті сполученням з первинним аміном, використовуючи стандартні методики сполучення, оптичні густини близько 3000-4000 резонансних одиниць (RU's), використовуючи майстер іммобілізації притаманний програмному забезпеченню. Гуманізоване антитіло потім пропускали над поверхнею Протеїну А та захватували на рівнях близько 200-400 RU's, після періоду стабілізації, NOGO 5+6 GST людини пропустили над поверхнею захваченого антитіла при 22 UA 98100 C2 5 певних концентраціях та отримали зв'язуючі сенсограми. Кислотна регенерація (100мМ Н3РO4 чи 10мМ розчин Гліцину з рН 1.5) призвела до повного видалення захваченого антитіла з поверхні Протеїну А, та значно не відновила зв'язуючі ємності поверхні. Всі криві двічі порівняні з введенням буферу замість NOGO 5+6 GST людини та дані приводили до 1:1 моделі зв'язування, використовуючи глобальні параметри приведення в Biacore оцінюючому програмному забезпеченні Т100 v1.1. Всі експерименти виконували на приладі Т100. Таблиця 18 - Представлені результати - це значення та стандартні відхилення 5 чи 6 незалежних серій дослідів Антитіло H20L16 HcLc 11С7 Kа 1.01е6(1.35е5) 1.38е6(3.70е5) 2.85е5(4.06е4) kd 3.13е-4(2.79е-5) 5.69е-4(1.54е-4) 1.17е-4(1.22е-5) KD (nМ) 0.31(0.036) 0.41(0.062) 0.42(0.065) 10 Коротко зведені послідовності NOGO антитіла (Таблиця 12) Опис 2А10, CDR-H1 2А10, CDR-H2 2А10, CDR-H3 2А10, CDR-L1 2А10, CDR-L2 2А10, CDR-L3 2A10.VH (мишача) 2A10.VL (мишача) Химерний (гібридний) важкий ланцюг Не Химерний (гібридний) легкий ланцюг Lс 2А10 VH гуманізована структура Н5 2А10 VH гуманізована структура Н6 2А10 VH гуманізована структура Н700 2А10 VH гуманізована структура Н14 2А10 VH гуманізована структура Н15 2А10 VH гуманізована структура Н16 2А10 VH гуманізована структура Н17 2А10 VH гуманізована структура Н18 2А10 VL гуманізована структура L6 2А10 VL гуманізована структура L13 2А10 VL гуманізована структура L14 2А10 VL гуманізована структура L15 2А10 VL гуманізована структура L16 2А10 VL гуманізована структура L17 2А10 VL гуманізована структура L18 2А10 важкий ланцюг гуманізованої структури Н5 2А10 важкий ланцюг гуманізованої структури Н6 2А10 важкий ланцюг гуманізованої структури Н700 2А10 важкий ланцюг гуманізованої структури H14 2A10 важкий ланцюг гуманізованої структури Н15 2А10 важкий ланцюг гуманізованої структури Н16 Ідентифікатор послідовності амінокислотна Полінуклеотидна послідовність послідовність 1 2 3 4 5 6 7 41 8 42 9 10 44 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 26 60 27 61 28 62 29 63 30 64 31 23 43 65 UA 98100 C2 Продовження Таблиці 12 2А10 важкий ланцюг гуманізованої структури Н17 2А10 важкий ланцюг гуманізованої структури Н18 2А10 легкий ланцюг гуманізованої структури L6 2А10 легкий ланцюг гуманізованої структури L13 2А10 легкий ланцюг гуманізованої структури L14 2А10 легкий ланцюг гуманізованої структури L15 2А10 легкий ланцюг гуманізованої структури L16 2А10 легкий ланцюг гуманізованої структури L17 2А10 легкий ланцюг гуманізованої структури L18 Campath лідуюча послідовність Амінокислоти 586-785 NOGO А людини (NOGO-А56) 2А10 VH гуманізована структура Н1 2А10 VL гуманізована структура L11 2А10 важкий ланцюг гуманізованої структури Н1 2А10 легкий ланцюг гуманізованої структури L11 2А10 VH гуманізована структура Н19 2А10 VH гуманізована структура Н20 2А10 VH гуманізована структура Н21 2А10 VH гуманізована структура Н22 2А10 VH гуманізована структура Н23 2А10 VH гуманізована структура Н24 2А10 VH гуманізована структура Н25 2А10 важкий ланцюг гуманізованої структури Н19 2А10 важкий ланцюг гуманізованої структури Н20 2А10 важкий ланцюг гуманізованої структури Н21 2A10 важкий ланцюг гуманізованої структури Н22 2А10 важкий ланцюг гуманізованої структури Н23 2А10 важкий ланцюг гуманізованої структури Н24 2А10 важкий ланцюг гуманізованої структури Н25 32 33 67 34 68 35 69 36 70 37 71 38 72 39 73 40 74 75 76 77 78 81 82 79 83 80 84 85 86 87 88 89 90 91 99 100 101 102 103 104 105 92 106 93 107 94 108 95 109 96 110 97 111 98 24 66 112 UA 98100 C2 25 UA 98100 C2 26 UA 98100 C2 27 UA 98100 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHumanized monoclonal antibody that binds and neutralizes human nogo
Автори англійськоюEllis Jonathan Henry, Hamblin, Paul, Andrew, Hussain Farhana, Lewis, Alan, Peter, Mcadam Ruth, Prinjha Rabinder, Wilson, Paul
Назва патенту російськоюГуманизированное моноклональное антитело, которое связывается с человеческим nogo и нейтрализует его
Автори російськоюЭллис Джонатан Генри, Амбли Пол Эндрю, Юссаин Фархана, Левис Алан Питер, Макадам Рус, Принйоха Рабиндер, Вилсон Пол
МПК / Мітки
МПК: C12N 15/13, C07K 16/18, A61K 39/395, A61P 25/28
Мітки: антитіло, людський, зв'язується, моноклональне, яке, нейтралізує, гуманізоване
Код посилання
<a href="https://ua.patents.su/68-98100-gumanizovane-monoklonalne-antitilo-yake-zvyazuehtsya-z-ta-nejjtralizueh-lyudskijj-nogo.html" target="_blank" rel="follow" title="База патентів України">Гуманізоване моноклональне антитiло, яке зв’язується з та нейтралізує людський nogo</a>
Попередній патент: Вакцина, що містить альфа-токсоїд c. perfringens
Наступний патент: Пристрій для вентиляції проходки штреків під час роботи підземного комбайна
Випадковий патент: Спосіб генетичної діагностики неалкогольної жирової хвороби печінки