Спосіб одержання різнометалічних комплексів ванадію
Номер патенту: 103796
Опубліковано: 25.11.2013
Автори: Павлюк Марія Василівна, Кокозей Володимир Миколайович, Маханькова Валерія Григорівна
Формула / Реферат
Спосіб одержання різнометалічних комплексів ванадію шляхом використання оксиду ванадію (V) з перехідним металом та N-, O-донорним комплексоутворюючого реагенту в присутності солі амонію, який відрізняється тим, що взаємодію проводять з металом в присутності солі амонію органічної природи, наприклад ацетату або оксалату амонію.
Текст
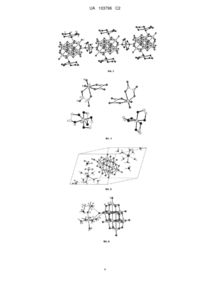
Реферат: Винахід стосується технологій синтезу координаційних сполук, зокрема, різнометалічних комплексів на основі ванадію. Спосіб одержання шляхом використання оксиду ванадію (V) з перехідним металом та N-, O-донорним комплексоутворюючого реагенту в присутності солі амонію. Взаємодію проводять з металом в присутності солі амонію органічної природи, наприклад ацетату або оксалату амонію. UA 103796 C2 (12) UA 103796 C2 UA 103796 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується розробки ресурсозберігаючих, мало- або безвідходних технологій синтезу координаційних сполук, зокрема різнометалічних комплексів на основі ванадію, які можуть бути застосовані як каталізатори промислового органічного синтезу. Відомий спосіб одержання різнометалічних комплексів ванадію шляхом взаємодії солі одного металу з метаванадатом амонію в присутності комплексоутворюючого реагенту [1]. Недоліком відомого способу є його багатостадійність. Найбільш близьким за технічною суттю до запропонованого можна вважати спосіб синтезу гетероядерних комплексів, який полягає у взаємодії одного металу та оксиду другого металу з сіллю амонію та комплексоутворюючим реагентом у відповідному розчиннику [2]. У відомому способі використовують солі амонію неорганічної природи (хлорид, бромід або ціанат амонію). Спроби одержати різнометалічні комплекси ванадію зазначеним способом приводять до утворення двох комплексів окремих металів. Таким чином, відомий спосіб не є придатним для синтезу різнометалічних комплексів ванадію. В основу винаходу поставлено задачу розробки нового способу, придатного для одержання нових різнометалічних комплексів на основі ванадію. Таким чином, технічний результат запропонованого рішення полягає у створенні нового способу одержання різнометалічних комплексів ванадію. Поставлена задача вирішується шляхом взаємодії оксиду ванадію (V) з перехідним металом та N-, O-донорним комплексоутворюючим реагентом в присутності солі амонію органічної природи, наприклад ацетату або оксалату амонію. При цьому, в порівнянні з найближчим аналогом, принципово змінюється функція солі амонію. Якщо в способі за найближчим аналогом сіль амонію виконує основну функцію і входить до складу комплексу, то у запропонованому способі сіль амонію виконує допоміжну функцію і до складу комплексу не входить. Саме така сукупність суттєвих ознак є необхідною і достатньою для досягнення технічного результату, який полягає у створенні нового способу одержання різнометалічних комплексів ванадію. Синтез різнометалічних комплексів ванадію в лабораторних умовах проводять, як правило, у плоскодонному реакторі з мішалкою та нагрівачем. У реактор вносять наважки вихідних речовин, доливають розчинник, додають комплексоутворюючий реагент і реакційну суміш нагрівають при 30-100 °C та постійному перемішуванні при вільному доступі кисню повітря до закінчення реакції. Цільовий продукт вилучають з реакційної суміші відомими прийомами. Приклади реалізації способу. Приклад 1. Синтез (Н3О)2(Н2en)[Сu(en)2(Н2O)2][V10O28]·3Н2O В реактор вносять 0,02 г (0,3 ммоль) порошку міді, 0,27 г (1,5 ммоль) оксиду ванадію(У), 0,43 г (3 ммоль) амоній оксалату моногідрату, 0,04 мл етилендіаміну (0,6 ммоль), 20 мл води та нагрівають при постійному перемішуванні і температурі 90-100 °C протягом 15 хв. Кристали світло-коричневого кольору, придатні для рентгеноструктурного аналізу, випадають з одержаного розчину через 1 добу. Вихід 0,13 г (32 % за ванадієм). Знайдено, %: Сu=4,9; V=37,9; С = 7,1; Н = 3,3; N=8,1. Розраховано, %: Сu=4,69; V=37,58; С = 7,09; Н = 3,42; N=8,27. Кристалічна будова (H3O)2(H2en)[Cu(en)2(H2O)2][V10O28]·3H2O. Комплекс має катіон-аніонну 2+ 6будову (Фіг. 1), в основі якої лежать катіони [Cu(en) 2(H2O)2] та аніони [V10O28] , що поєднуються в тривимірний каркас за рахунок водневих зв'язків. Купрум має (4+2) координацію. Аксіальні позиції займають дві молекули води, а екваторіальні - чотири атоми нітрогену від двох бідентатно-хелатно координованих молекул етилендіаміну. Координаційним поліедром купруму(II) є видовжена тетрагональна біпіраміда, а ванадію - викривлений октаедр. Приклад 2. Синтез (Н3О)2[{Cu(en)2(H2O)}2V10O28]·3H2O У реактор вносять 0,02 г (0,3 ммоль) порошку міді, 0,22 г (1,2 ммоль) оксиду ванадію(У), 0,1г (0,6 ммоль) молібдатної кислоти, 0,43 г (3 ммоль) амоній оксалату моногідрату, 0,04 мл етилендіаміну (0,6 ммоль), 20 мл води та нагрівають при постійному перемішуванні і температурі 90-100 °C протягом 45 хв. Кристали темно-коричневого кольору, придатні для рентгеноструктурного аналізу, випадають з одержаного розчину через 1 добу. Вихід 0,11 г (51 % за міддю). Знайдено, %: Сu=9,7; V=36,1; С = 6,6; Н = 3,2; N=7,8. Розраховано, %: Сu=8,75; V=35,06; С = 6,61; Н = 3,33; N=7,71. Кристалічна будова (H3O)2[{Cu(en)2(H2O)}2V10O28]·3H2O. Комплекс також має катіон-аніонну будову і містить гетерометалічний аніон 2[{Cu(en)2(H2O)}2(V10O28)] (Фіг. 2), який утворюється за рахунок поєднання двох фрагментів 24 {Cu(en)2(H2O)} у аксіальних позиціях декаванадат-аніоном. Другу аксіальну позицію у 2+ фрагментах {Cu(en)2(H2O)} займають молекули води. Дві молекули етилендіаміну 1 UA 103796 C2 5 10 15 20 25 30 35 40 45 50 55 координовані до кожного атома купруму в екваторіальних позиціях. Координаційним поліедром купруму(П) є видовжена тетрагональна біпіраміда, а ванадію - викривлений октаедр. Приклад3. Синтез [{Сu(еn)2}3(V10О28)]·3Н2О. У реактор вносять 0,06 г (0,9 ммоль) порошку міді, 0,27 г (1,5 ммоль) оксиду ванадію(У), 0,31 г (4 ммоль) ацетату амонію, 0,24 г дигідрохлориду етилендіаміну (1,8 ммоль), приливають 20 мл ДМФА та нагрівають при постійному перемішуванні і температурі ЗО-50 °C протягом 20 хв. Для одержання кристалів, придатних для рентгеноструктурного аналізу, осад, що утворюється, перекристалізовують з води. Вихід 0,09 г (19 % за ванадієм). Знайдено, %: Сu=12,5; V=32,9; С = 9,2; Н = 3,5; N=10,5. Розраховано, %: Сu=12,20; V=32,60; С = 9,22; Н = 3,48; N=10,76. Кристалічна будова [{Сu(en)2}3(У10O28)] 3Н2O. Комплекс має полімерну ланцюгову будову, яка реалізується за рахунок місткової функції 2+ фрагментів [Cu(en)2] (Фіг. 3). Екваторіальні позиції в оточенні атомів купруму займають чотири 24 атоми нітрогену двох молекул етилендіаміну. Один фрагмент [Cu(en) 2] є містковим між декаванадат-аніонами, координаційним поліедром купруму є тетрагональна біпіраміда. 2+ Два фрагменти [Cu(en)2] мають квадратно-пірамідальне оточення, причому п'яту, аксіальну, позицію займають атоми оксигену декаванадату. Приклад 4. Синтез [Co(en)3][VO2(C2O4)2] 3H2O. В реактор вносять 0,07 г (1,2 ммоль) порошку кобальту, 0,22 г (1,2 ммоль) оксиду ванадію(V), 0,34 г (2,4 ммоль) амоній оксалату моногідрату, 0,48 г гідрохлориду етилендіаміну (3,6 ммоль), 20 мл води та нагрівають при постійному перемішуванні і температурі 90-100 °C протягом 8 год. Кристали яскраво-оранжевого кольору, придатні для рентгеноструктурного аналізу, випадають з одержаного розчину протягом 3-4 діб. Вихід 0,19 г (33 % за кобальтом). Знайдено, %: Со = 10,3; V=9,3; С = 21,3; Н = 5,6; N=15,3. Розраховано, %: Со = 10,67; V=9,22; С = 21,75; Н = 5,48; N=15,22. Кристалічна будова [Co(en)3][VO2(C2O4)2] 3H2O. 3+ Комплексна сполука має катіон-аніонну будову і складається з катіонів [Cо(еn)3] та аніонів 3 [V10O28] " (Фіг. 4), які за рахунок водневих зв'язків поєднуються в тривимірний каркас. Октаедричне координаційне оточення кобальту(III) утворене шістьма атомами нітрогену трьох 3бідентатно-хелатно координованих молекул етилендіаміну. Аніон [VO 2(C2О4)2] має типову будову: координаційним поліедром ванадію є октаедр, утворений шістьма атомами кисню двох оксо-груп та двох бідентатно-хелатно координованих оксалатних груп. Приклад 5. Синтез (NH4)2[Co(H2O)6]2[V10O28]·4H2O. В реактор вносять 0,02 г (0,3 ммоль) порошку кобальту, 0,27 г (1,5 ммоль) оксиду ванадію(У), 0,231г (3 ммоль) ацетату амонію, 0,068 г (0,9 ммоль) амінооцтової кислоти, 20 мл води та нагрівають при постійному перемішуванні і температурі 70-90 °C протягом 1 год. Кристали темно-зеленого кольору, придатні для рентгеноструктурного аналізу, випадають з одержаного розчину в результаті висолювання ізопропанолом протягом доби. Вихід ОД г (49 % за кобальтом). Знайдено, %: Со = 8,4; V=35,7; Н = 2,7; N=1,9. Розраховано, %: Со = 8,42; V=36,40; Н = 2,88; N=2,00. Кристалічна будова (NH4)2Co(H2O)6]2[V10O28]·H2O. Комплексна сполука має катіон-аніонну будову (Фіг. 5), в основі якої лежать катіони 2+ 6[Cо(Н2О)6] та аніони [У10О28] . Октаедричне оточення кобальту(II) утворюють шість молекул води (середні значення довжин зв'язків Cо-O складають 2.052 Å та є звичайними для такого 6типу комплексів). Будова аніону [V10O28] є типовою. Приклад 6. Синтез (Н3О)2[Мn(β-НАlа)(Н2О)5]2[V10О28]·2Н2О В реактор вносять 0,02 г (0,3 ммоль) порошку мангану, 0,27 г (1,5 ммоль) оксиду ванадію(У), 0,231 г (3 ммоль) ацетату амонію, 0,08 г (0,9 ммоль) 2-амінопропанової кислоти (β-НАlа), 20 мл води та нагрівають при постійному перемішуванні і температурі 70-90 °C протягом 1,5 год. Кристали оранжевого кольору, придатні для рентгеноструктурного аналізу, випадають з одержаного розчину протягом доби. Вихід 0,13 г (29 % за манганом). Знайдено, %: Мn=7,0; V=33,5; С = 4,7; Н = 3,1; N=1,9. Розраховано, %: Мn=7,32; V=33,92; С = 4,80; Н = 3,09; N=1,87. Кристалічна будова (Н3О)2[Мn(β-НАlа)(Н2О)5]2[V10О28]·2Н2О Комплексна сполука має катіон2+ 6аніонну будову (Фіг. 6), в основі якої лежать катіони [Мn(β-НАlа)(Н2О)5] та аніони [V10C28] . Октаедричне оточення мангану(П) утворюють п'ять атомів оксигену від молекул води (середні значення довжин зв'язків Мn-0 складають 2.192 А та є звичайними для такого типу комплексів) 6та атом оксигену монодентатно координованої амінокислоти. Будова аніону [V 10O28] є типовою. 2 UA 103796 C2 5 Таким чином, спосіб, що пропонується, є технологічно більш простим, бо не потребує складного обладнання, високих температур і тиску та тривалого часу. Отже, винахід має новизну, промислову придатність та винахідницький рівень. Джерела інформації: 1. Polyhedron.-2008.-V. 27, P. 641-647. 2. Спосіб прямого синтезу гетеро ядерних комплексів (варіанти). Патент UA 33649 A, 2001. Бюл. №3. ФОРМУЛА ВИНАХОДУ 10 Спосіб одержання різнометалічних комплексів ванадію шляхом використання оксиду ванадію (V) з перехідним металом та N-, O-донорним комплексоутворюючого реагенту в присутності солі амонію, який відрізняється тим, що взаємодію проводять з металом в присутності солі амонію органічної природи, наприклад ацетату або оксалату амонію. 3 UA 103796 C2 4 UA 103796 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C01G 31/00
Мітки: ванадію, різнометалічних, спосіб, одержання, комплексів
Код посилання
<a href="https://ua.patents.su/7-103796-sposib-oderzhannya-riznometalichnikh-kompleksiv-vanadiyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання різнометалічних комплексів ванадію</a>
Попередній патент: Спосіб прокатки рейок, пристрій для прокатки рейок і рейка, виготовлена відповідно до зазначеного способу
Наступний патент: Електрофільтр для очистки вибухонебезпечного газу
Випадковий патент: Вальцьова дробарка