Спосіб одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону
Номер патенту: 110005
Опубліковано: 26.10.2015
Автори: Черненко Віталій Миколайович, Десенко Сергій Михайлович, Гладков Євгеній Станіславович, Афанасіаді Людмила Михайлівна
Формула / Реферат
Спосіб одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону формули
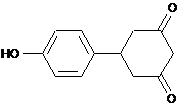 ,
,
який відрізняється тим, що проводять реакцію дезалкілування 5-[4-(метокси)феніл]-1,3-циклогександіону з йодоводневою кислотою у середовищі оцтової кислоти при кип'ятінні до повного відділення йодистого метилу протягом 4,5-5 годин, продукт виділяють додаванням води.
Текст
Реферат: Пропонується спосіб одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону UA 110005 C2 (12) UA 110005 C2 O HO O, що включає реакцію дезалкілування 5-[4-(метокси)феніл]-1,3-циклогександіону з йодоводневою кислотою у середовищі оцтової кислоти при кип'ятінні до повного відділення йодистого метилу протягом 4,5-5 годин. Продукт виділяють додаванням води. Технічне рішення дозволяє значно підвищити вихід продукту, зменшити тривалість технологічного процесу, виключити застосування легкозаймистих, вогненебезпечних і токсичних розчинників. UA 110005 C2 Винахід належить до області органічної хімії, а саме, до способу одержання 5-[4(гідрокси)феніл]-1,3-циклогександіону формули І O HO O.I 5 10 Наявність діонового фрагмента в структурі різних органічних сполук припускає можливість використання таких речовин як лікарських і біологічно активних препаратів. Так, деякі із відомих структур зі структурою урацилу виявляють антибактеріальну і протигрибкову [US Pat. appl. 1086129 (1993), РСТ Jnt. appl. WO 94 17076; A. Ganngjee et al., J. Med. Chem., 42, 2667 (1999)] активності. Відомий спосіб одержання структурного аналога 5-[4-(бензилокси)феніл]-1,3циклогександіону формули II [заявка РСТ/ЕР № 2006/026024 А2, А61К 31/5513; А61К 31/14]. Спосіб складається із двох стадій і здійснюється за схемою: O 1) (CH3)3COK; 2) NaOH/H2O O O O NaOH O O CH3 O II 15 . 20 25 30 35 40 На першій стадії суміш 2-бензилоксибензальдегіду, ацетону і 5 % водного розчину гідроксиду натрію (NaOH) перемішують 7 днів. Відфільтровують білий осад, промивають водою, сушать. Вихід складає (98,9 %). На другій стадії еквімолярні кількості тpeт-бутоксидукалію і діетилмалонату розчиняють у абсолютному етанолі. До суміші додають продукт, одержаний на першій стадії, у абсолютному етанолу. Реакційну масу нагрівають 12 годин. Етанол упарюють, осад нагрівають у 2М водного розчину гідроксиду натрію (NaOH) протягом 2 годин, охолоджуючи у льодовій бані, суміш нагрівають 4 години. Утворюється 2 шари, водний шар декантують. Масло крісталізують при кімнатній температурі і екстрагують ефіром. Ефірний шар сушать над безводним сульфатом натрію (Na2SO4), упарюють ефір і одержують 5-[4-(бензилокси)феніл]-1,3-циклогександіон. Вихід складає (72,2 %). Загальний вихід з урахуванням виходів на кожній технологічній стадії складає 71 %. Загальний час синтезу складає приблизно 190 годин (не враховуючи процесів декантації, екстрації, упарювання, охолодження у льодовій бані). Недоліками відомого способу є тривалий двостадійний процес з виділенням продуктів на кожній стадії, використання абсолютного етанолу і вогненебезпечного розчинника - ефіру. 5-[4-(Бензилокси)феніл]-1,3-циклогександіон описано авторами як проміжний продукт у синтезі бензодіазепінів, що використовують у фармацевтичних композиціях для різних призначень, зокрема, як інгібіторів вірусу гепатиту С. Відомий спосіб одержання структурного аналога 5-(2-бромфеніл)-3-гідроксициклогекс-2енону формули III [Заявка США № 2007/0027150 А1; А61К 31/5377; А61К 31/517, C07D 413/02; C07D 403/02]. Ця сполука є проміжним продуктом у синтезі 2-амінохінозолін-5-онів, які використовуються при лікуванні широко розповсюджуваних клінічних хвороб. Спосіб складається із двох стадій і реалізується за наступною схемою: 1 UA 110005 C2 O Br Br O 1) NaOMe/MeOH; 2) NaOH/H2O NaOH/H2O Br OH CH3 O III . 5 10 15 20 25 30 На першій стадії суміш 2-бромбензальдегіду, ацетону у воді перемішують на магнітній мішалці, нагрівають до 65 °С, додають 1 % водний розчин гідроксиду натрію (NaOH). Реакційну масу продовжують перемішувати при цій температурі протягом 1,5 години, охолоджують до кімнатної температури і нейтралізують до рН6 концентрованою соляною кислотою (НСl). Реакційну суміш розділяють етилацетатом. Органічний шар рідини сушать над безводним сульфатом магнію (MgSO4), фільтрують, переганяють під вакуумом, одержуючи 4-(2бромфеніл)бут-3-ен-2-ону (вихід складає 36 %) у вигляді жовтого масла. На другій стадії розчиняють металічний натрій у безводному метанолі. Одержаний метилат натрію краплями додають до метилацетоацетату протягом 20 хвилин. Реакційну суміш нагрівають до 50 °C і додають 4-(2-бром-феніл)-бут-3-ен-2-он у метанолі краплями протягом 30 хвилин, продовжують нагрівання при цій температурі 1 годину і додають воду. Метанол відганяють, приливають 6М водний розчин гідроксиду натрію (NaOH), суміш нагрівають при 80 °C 1 годину. Охолоджують до кімнатної температури, приливають толуол. Водний шар відділяють, нагрівають при 100 °C і додають краплями соляну кислоту протягом 30 хвилин, нагрівають при перемішуванні 1 годину, охолоджують. Твердий осад відфільтровують, промивають водою, сушать у вакуумі. Розтирають з ефіром і одержують 83 % 5-(2-бромфеніл)3-гідроксициклогекс-2-енону білого кольору. Загальний вихід з урахуванням виходів на кожній технологічній стадії складає 30 %. Загальний час синтезу складає приблизно 11 годин (не враховуючи декількох охолоджень розчину до кімнатної температури, екстрації, перегонки під вакуумом, сушку у вакуумексикаторі). Недоліками відомого способу є тривалий двостадійний процес з застосуванням металічного натрію, безводного метанолу (токсичного розчинника). Крім того, використання легкозаймистих розчинників (ефіру, толуолу, метанолу) обмежує використання відомого способу в лабораторних і виробничих умовах. Відомий спосіб одержання структурного аналога - 5-[4-(гідрокси)феніл]-1,3-циклогександіону формули IV [P.Papadakis, J. Amer. Chem. Soc, 67, 1799-1800 (1945)]. Спосіб одержання сполуки IV здійснюється за схемою: 2 UA 110005 C2 CH3 OH O O O CH2(COOEt)2 Ac2O/HCl Ac2O EtOOC O H3C O O O HCl/H2O HO O O 15 20 25 30 35 40 O H3C O I 10 O NaOH/H2O O O 5 COOEt і складається із 4-х стадій. На першій стадії 2-гідроксибензальдегід ацилюється оцтовим ангідридом у сухому піридині протягом 2 годин при 0 °C. Реакційну суміш видержують при кімнатній температурі 2 дні (48 годин), додають льодяну воду і енергійно перемішують. Органічний шар (у вигляді масла) тричі промивають холодною водою, сушать і переганяють. Одержують 4-ацетоксибензальдегід з Т.кип. 266-268 °C. На другій стадії одержаний 4-ацетоксибензальдегід, етилмалонат і оцтовий ангідрид (в еквімолярних кількостях) насичують сухим хлороводнем (НСlгаз) при 0 °C. Реакційну суміш охолоджують до кімнатної температури і видержують 8 днів (192 години), після чого пропускають через розчин сухе повітря протягом 6 годин. Розчин нагрівають до 210 °C при звичайному тиску, залишок фракціонують у вакуумі (температура 176 °C, тиск 0,6 мм рт. ст.) у приймач, який охолоджується сумішшю сухого льоду і ацетону. Дистилят являє собою в'язкий розчин і блискучі пластинки кристалів. Кристали відфільтровують, промивають ефіром, перекристалізовують із спирту. Одержаний етил 4-ацетоксибензальмалонат має Т.пл 67-68 °С. На третій стадії еквімолярні кількості діетилового ефіру 4-ацетокси-бензальмалонової кислоти, етилацетоацетату і етилату натрію у абсолютному спирті нагрівають 1 годину, потім видержують суміш протягом декількох днів (конкретно автори не вказують кількість днів). Утворений кристалічний осад у воді має лужний показник на лакмус. При обробці кристалічної речовини розбавленою оцтовою кислотою випадають жовті кристали, які кип'ятять у етилацетаті з активованим вугіллям, фільтрують і охолоджують у холодильнику. Кристали відфільтровують і перекристалізовують із етилового спирту. Температура плавлення 1-(4ацетоксифеніл)-2,6-дикарбоксицикло-гексан-3,5-діону складає 209-210 °C. На четвертій стадії продукт, одержаний на попередній стадії, обробляють соляною кислотою (НСl), видержують 14 годин. Суміш нагрівають 3 години, додають гідроксид натрію (NaOH) і витримують при кімнатній температурі 2 дні (48 годин). Потім додають соляну кислоту (НСl), нагрівають 1 годину, фільтрують гарячий розчин і охолоджують. Кристали, що утворилися, перекристалізовують із етанолу, а потім із киплячої води. Одержують 5-[4-(гідрокси)феніл]-1,3циклогександіон з т.пл 186-187 °C. Вихід 3,5 г (40 %). Загальний час синтезу складає приблизно 14 днів (315 годин) без урахування численних операцій - перегонка, фільтрування, промивка, перекристалізація, охолодження і т. ін. Недоліками відомого способу є дуже тривалий процес, багатостадійність, вакуумна перегонка, використання сухих розчинників - піридину і етанолу, токсичного оцтового ангідриду, вогненебезпечного ефіру, ацетону, сухого льоду для охолодження речовини. Крім того, зазначимо, що авторами не наведено виходів на перших трьох початкових стадіях синтезу. Тому вихід кінцевого продукту було розраховано лише на кінцевій технологічній стадії. Задача винаходу полягає у розробці доступного способу одержання 5-[4-(гідрокси)феніл]1,3-Циклогександіону, в якому за рахунок зміни умов синтезу і вихідних речовин можна 3 UA 110005 C2 5 10 15 20 25 30 спростити процес, скоротити його тривалість і кількість технологічних стадій, зменшити витрати розчинників, виключити використання низькотемпературних хладогентів. Рішення поставленої задачі забезпечується тим, що в способі одержання 5-[4(гідрокси)феніл]-1,3-циклогександіону, згідно винаходу, проводять реакцію дезалкілування 5-[4(метокси)феніл]-1,3-циклогександіону з йодоводневою кислотою в середовищі оцтової кислоти при кип'ятінні до повного відділення йодистого метилу протягом 4,5-5 годин, продукт виділяють додаванням води. Хімічну структуру сполуки формули І легко модифікувати, використовуючи різні алкілзаміщені 5-арилциклогексан-1,3-діону. Так, застосовуючи похідні 5-арилциклогексан-1,3діону, що містять алкоксигрупи різної природи, у різних положеннях та кількостях, є можливість розширити асортимент перспективних речовин - проміжних напівпродуктів синтезу лікарських препаратів, біологічно активних сполук та сполук, що можуть бути використані у різних галузях науки та техніки. У способі, що заявляється, оцтова кислота (досить поширений розчинник у реакціях дезалкілування) виконує функцію висококиплячого розчинника (у сполученні з йодоводневою кислотою) кислотного характеру, що сприяє швидкому відділенню йодистого метилу під час реакції. Крім того, температура кипіння оцтової кислоти (т.кип 115 °C) забезпечує прискорене протікання хімічної реакції, що, в свою чергу, приводить до значного скорочення часу синтезу до 4,5-5 годин. Час реакції є оптимальним, що визначено експериментальним шляхом, та дозволяє повністю відділити йодистий метил, що, в свою чергу, є мірою повноти проходження процесу. Слід зазначити, що йодистий метил, який виділяється у процесі реакції, є цінним метилюючим агентом та може використовуватися в інших хімічних перетвореннях. У таблиці наведено порівняльні характеристики способу, що заявляється, і способіваналогів сполук. У способі, що заявляється, 5-[4-(гідрокси)феніл]-1,3-циклогександіон одержують одностадійним методом шляхом кип’ятіння 5-[4-(метокси)феніл]-1,3-циклогександіону з йодоводневою кислотою у середовищі оцтової кислоти до повного відділення йодистого метилу (наприклад, з застосуванням насадки Діна-Старка), що займає приблизно 4,5-5 годин. Реакційну масу упарюють до об'єму 100 мл і додають воду. Осад відфільтровують і перекристалізовують. Вихід сполуки формули І складає 75 % (у способі-прототипі 40 %). Приклад. Одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону. O H3C O +HI O HO -CH3I O 35 40 45 50 I O Розчиняють 30 г (0,138 моль) 5-[4-(метокси)феніл]-1,3-циклогексан-діону у 100 мл оцтовій кислоті та 50 мл йодоводневої кислоти (НІ). Суміш кип'ятять з насадкою Діна-Старка до повного відділення 8 мл йодистого метилу (приблизно 5 годин). Реакційну суміш упарюють до об'єму 100 мл та додають 200 мл води. Осад відфільтровують та перекристалізовують із води з активованим вугіллям. Вихід 19,4 г (75 %). Т.пл = 185-188 С. Структуру 5-[4-(гідрокси)феніл]-1,3-циклогександіону підтверджено спектральними даними. 1 Спектри ядерного магнітного резонансу (ЯМР Н ) виміряно на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеродиметил-сульфоксиду (ДМСО-d6), внутрішній стандарт тетраметилсилан (у розчинах дейтеродиметилсульфоксиду (ДМСО-d6) 5-[4-(гідрокси)феніл]-1,3цикло-гександіон знаходиться у енолній таутомерній формі); 5 (м.ч.): 9.27 (2Н, у.с, 20Н), 7,156,60 (4Н, м, АrН), 5,24 (1Н, с, СН), 3,15 (1Н, м, СН), 2,06-3,05 (4Н, м, (СН2)2). Дані таблиці і опису корисної моделі показують, що спосіб, що заявляється, має ряд суттєвих переваг і дозволяє: - зменшити кількість технологічних стадій до однієї; - значно зменшити тривалість процесу до 4,5-5 годин; - підвищити вихід до 75 % і якість кінцевого продукту; - виключити застосування хладагенту і вогненебезпечних розчинників; - використовувати один з продуктів реакції (йодистий метил) для інших хімічних процесів; - здешевити вартість кінцевого продукту. 4 UA 110005 C2 Таблиця Застосування Розчинник легкозаймистих, Кількіст Триваліс Очищення проміжних і для Вихід, % вогненебезпечних і ь стадій ть, годин кінцевих продуктів перекрист токсичних алізації розчинників Спосіб, що Перекристалізація 1 4,5-5 75 Вода Оцтова кислота заявляється кінцевого продукту Спосіб 40 (P.Papadakis (Вихід Перегонка у вакуумі (на Піридин, оцтовий , J. Amer. наведен перших трьох стадіях), ангідрид, НСІ(газ), 4 315 Етанол Chem. Soc, о на перекристалізація ефір, абсолютний 67, 1799останній (на стадіях 2-4) етанол 1800 (1945)) стадії) Спосіб за [заявка Екстракція кінцевого 2 190 71 Ефір Ацетон, ефір РСТ/ЕР № продукту 2006/026024] Спосіб за Перегонка під вакуумом [заявка США (на першій стадії), Металічний натрій, № 2 11 30 Ефір перекристалізація ацетон, метанол 2007/002715 кінцевого продукту 0] ФОРМУЛА ВИНАХОДУ Спосіб одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону формули 5 O HO O, 10 який відрізняється тим, що проводять реакцію дезалкілування 5-[4-(метокси)феніл]-1,3циклогександіону з йодоводневою кислотою у середовищі оцтової кислоти при кип'ятінні до повного відділення йодистого метилу протягом 4,5-5 годин, продукт виділяють додаванням води. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5-[4-(hydroxy)phenyl]-1,3-cyclohexanedione
Автори англійськоюChernenko Vitalii Mykolaiovych, Hladkov Yevhenii Stanislavovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения 5-[4-(гидрокси)фенил]-1,3-циклогександиона
Автори російськоюЧерненко Виталий Николаевич, Гладков Евгений Станиславович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07C 39/17, C07C 37/055
Мітки: 5-[4-(гідрокси)феніл]-1,3-циклогександіону, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/7-110005-sposib-oderzhannya-5-4-gidroksifenil-13-ciklogeksandionu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-[4-(гідрокси)феніл]-1,3-циклогександіону</a>
Попередній патент: Система регулювання по висоті вугільної стругової установки і вугільна стругова установка
Наступний патент: Спосіб одержання графеноподібного германану
Випадковий патент: Спосіб безперервного розливання металів та сплавів











