Bеtа-фенілетиламід 2-оксисукцинанілової кислоти, який проявляє анаболічну, імуномоделюючу активність та інгібує клітинну ланку аутоімунітету до інсулінпродукуючого апарату
Номер патенту: 19059
Опубліковано: 25.12.1997
Автори: Мерзликін Сергій Іванович, Горбенко Наталія Іванівна, Божко Тетяна Степанівна, Кириченко Олександр Анатолійович, Самохіна Лідія Іванівна, Черних Валентина Франковна, Слишков Володимир Васильович, Панченко Ольга Миколаївна, Шевченко Людмила Євгенівна, Чувурін Олександр Вікторович, Полторак Вікторія Віталіївна, Бриндак Олег Іванович, Дроговоз Світлана Мефодіївна, Тур Марина Юріївна, Мороз Віра Василівна, Натаров Валерій Володимирович, Сальникова Сталіна Іванівна, Блох Костянтин Олегович, Дроговоз Валерій Валентинович, Макуріна Валентина Іванівна
Формула / Реферат
b-фенилэтиламид 2-оксисукцинанило-вой кислоты формулы
проявляющий анаболическую, иммуномоду-лирующую активность и ингибирующий клеточное звено аутоиммунитета к инсулинпродуцирующему аппарату.
Текст
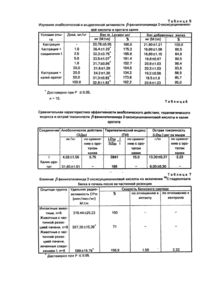
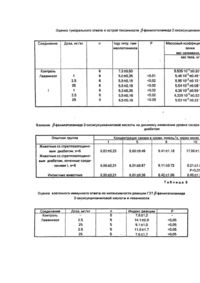
Изобретение относится к области синтеза биологически активных соединений, конкретно к синтезу bфенилэтиламида 2-оксисукцинаниловой кислоты формулы I Указанное соединение проявляет высокую анаболическую, иммуномодулирующую активность и ингибирует клеточное звено аутоиммунитета к инсулинпродуцирующему аппарату, что позволяет использовать его в качестве нестероидного анаболика без андрогенного эффекта, а также для лечения сахарного диабета путем подавление аутоиммунных реакций в инсулярном аппарате поджелудочной железы. Цель изобретения - создание эффективного низкотоксичного нестероидного анаболика, сочетающего иммуномодулирующую и стимулирующую регенераторные процессы в инсулин продуцирующем аппарате поджелудочной железы активности. Поставленная цель достигается новым веществом формулы I, полученным встречными синтезами как в реакции нуклеофильного присоединения b-фенилэтиламина к имидам 2-окси-, 2-ацетоксисукцинаниловых кислот, аминолизом метилового эфира 2-ок-сисукцинаниловой кислоты, так и гидролизом b-фенилэтиламида 2-ацетоксисукцинаниловой кислоты Синтезированное соединение - белое кристаллическое вещество, устойчивое при обычных условиях хранения, растворимое в спиртах, диоксане, ДМ ФА, нерастворимое в воде. Строение соединения подтверждено данными полного элементного анализа, ходом встречного синтеза, определением ИК-, УФ-, ФМР-спектроскопических и термогравиметрических характеристик (табл. 1-4). Индивидуальность соединения контролировалась определением хроматографических констант. Пример 1. Способ А. К раствору 2.33 г (0,01 М) N-имида 2-ацетоксисукцинаниловой кислоты в 20 мл 50%-ного изопропанола приливают 1,4 мл (0,01 М) Д-фенилэтиламина и 2,8 мл (0,02 М) триэтиламина. Через 24 ч реакционную массу разбавляют водой (1:1) и подкисляют HCI (1:1) до рН =5. Выпавший осадок отфильтровывают, сушат. Выход 2,46г(79%). Кристаллизуют из изопропанола в атмосфере углекислого газа. Способ Б. К раствору 1,91 г (0,01 Μ) Ν-имида о-оксисукцинаниловой кислоты в 10 мл изопропанола приливают 1,4 мл (0,011 М) b-фенилэтиламина и 1,4 мл (0,01 М) триэтиламина. Через 24 ч реакционную массу разбавляют водой (1:2) и подкисляют HCI (1:1) до рН = 5. Выпавший осадок отфильтровывают, сушат. Выход 2,55 г (85%). Способ В. К раствору 2,11 г.(0,01 М) метилового эфира о-оксисукцинаниловой кислоты в 15 мл изопропанола приливают 1,4 мп (0,011 М) b-фенилэтиламина и 1,4 мл (0,01 М) триэтиламина. При температуре примерно 40-50°С выдерживают 24 ч. Реакционную массу разбавляют водой (1:2) и подкисляют НС1 (1:1) до рН = 5. Выпавший осадок отфильтровывают, сушат. Выход 2,18 г (70%). Способ Г. 3,55 г (0,01 М) b-фенилэтила-мида 2-ацетоксисукцинаниловой кислоты растворяют в 20 мл 50%-ного изопропанола, добавляют 1,4 мл (0,01 М) триэтиламина. Через 24 ч разбавляют водой (1:1), подкисляют HCI (1:1) до рН = 5. Выпавший осадок отфильтровывают , сушат. Вы ход 2,33 г (75%). Фармакологические испытания показали, что соединение I обладает высокой анаболической и иммуномодулирующей активностью, стимулирует регенераторные процессы в инсулярном аппарате поджелудочной железы, проявляет низкую токсичность. Анаболическую и андрогенную активность соединения I оценивались на неполовозрелых трехнедельного возраста гонадэктомированных крысах-самцах популяции Вистар массой 50 г. Пример 2. Кастрацию проводили per serotum под гексеналовым наркозом (1%-ный раствор 60 мг/кг внутрибрюшинно). Излучаемое вещество вводили в дозах 1,0, 2,5, 5,0, 10,0 и 20 *мг/кг в течение семи дней, начиная со дня кастрации. Вещество вводили вн утрижелудочно в одно и тоже время суток в виде водной суспензии с твином-80 (1 капля на дозу). Контрольная группа крыс получала равный объем водной суспензии с твином-80. В качестве препарата сравнения использовали калия оротат в дозах 20,0, 50,0 и 100 мг/кг, который также вводили внутрижелудочно в течение 7 дней. Животных содержали на обычном пищевом рационе. На 8-й день точно через 24 ч после последнего введения вещества опытных и контрольных животных декапитировали и . выделяли musculus lovatoranl и добавочные половые железы semenls veslcll et ventrlculus prostata. Выделенные органы тщательно очищали от жира и связок, просушивали на фильтровальной бумаге и взвешивали на торсионных весах. Во избежание большой ошибки опыта не разделяли вес вентеральной простаты и семенных пузырьков. Полученный прирост массы тесторганов пересчитывали на 100 г массы тела животных и выражали в процентах к контролю, принятому за 100%. Всего было поставлено 14 серий опытов. В каждую серию брали по 10 животных. Исследование вещества в нескольких дозах позволило рассчитывать среднеэффективную дозу (ЭДбо) по графическому методу Я.И. Хаджая. Статистическую обработку результатов проводили с помощью коэффициента Стыодента (табл. 6). Установлено, что соединение I стимулирует прирост массы мышцы перинеального комплекса, являющейся органом-мишенью в тестировании анаболической активности (табл. 5). Под влиянием калий оротата также наблюдается увеличение массы мышцы перинеального комплекса, однако более выражен этот процесс с увеличением дозы референс-препарата до 100 мг/кг. Результаты исследований показывают, что соединение, I (ЭД50 = 4,68 ± 1,56 мг/кг) по анаболическому действию превосходит активность калия оротата (ЭД50 = 31,60 ± 1,61 мг/кг) в 6,75 раза. Андрогенной активности, т.е. способности стимулировать рост добавочных половых желез у кастрированных крыс-самцов, вещество I и калия оротат не проявляли (табл. 5). Вместе с тем, учитывая данные о возможном подъеме уровня тестостерона в крови животных в течение первых дней после кастрации, с целью более корректного обоснования и подтверждения выявленного анаболического эффекта были поставлены опыты на животных с экспериментальной острой белковой дистрофией, моделируемой частично резекцией печени, так как известно, что способность вещества корригировать белковый обмен в условиях экспериментального нарушения является достоверным подтверждением анаболической активности. Пример 3. У 20 половозрелых крыс популяции Вистар массой 150-180 г под барбамиловым наркозом (0,5%-ный раствор 10 мг/кг внутрибрюшинно) в асептических условиях после лапаротомии из брюшной полости извлекали левую и медиальную доли печени. Сосудистый ствол перевязывали кетгуто вой лигатурой и доли печени удаляли. Экстирпации подлежало 70% массы печени животного. В день операции и в последующие 3 сут десяти животным с частичной сегментоэктомией печени внутрижелудочно вводили вещество I в дозе (ЭД50) анаболической активности - 5 мг/кг. Остальные восемь животных служили контролем. На 4-е сут после частичной резекции печени в период максимальной выраженности нарушений белково-синтетических процессов вводили по 150 μ сі на 100 г массы животного 14С-гидролизата белка хлореллы 1,48 ГБк/мг атом С (ЧССР). Через 2 ч крыс декапитировали, выделяли печень. Навеску Т0,0 мг печени гомогенизировали с 10%-ной трихлоруксусной кислотой. Дальнейшую обработку гомогената проводили по D.Kenel. Радиоактивность пробы определяли в сцинтилляторе ЖС-107 на счетчике LS-7000 "Bekman". Количественное определение белка в пробах проводили на фильтрах с применением амида черного и рассчитывали по калибровочной кривой. Анализ данных (табл. 7) показывает, что вещество I достоверно стимулирует процесс включения 14Сбелкового гидролизата в печень, нарушенный у гепатэктомированных крыс. Лечение животных соединением I приводит к повышению скорости белкового синтеза в печени в 2,22 раза по сравнению с контролем ив 1,59 раза по сравнению с интактными здоровыми крысами, так как удельная радиоактивность белков печени у меченых животных повышается на 59%. Изучение токсичности соединений проводили на аутбредных белых мышах массой 18-20 г популяции Вистар обоего пола. Вещество вводили мышам в дозах из расчета 2000, 4000, 5000, 6000, 7000, 8000. 9000, 10000, 12000 и 15000 мг/мг массы тела животного перорально в виде водной суспензии с Твином-80 путем одно-, дву-, трехкратного введения. Наблюдение за животными проводили в течение двух недель. Значение LD50 рассчитывали методом пробит-анализа по В.Б. Прозоровскому. Установлено, что LD50 для ве щества I составила 13300 мг/кг. По классификации К.К.Сидорова соединение I относится к практически нетоксичным. Среднесмертельная доза калия оротата составила 6000± 300 мг/кг, что в 2,2 раза превышает токсичность соединения I. Преимущество анаболического эффекта соединения I перед оротатом калия также наглядно при рассмотрении терапевтического индекса - (LD50 : ЭД50). Так, широта терапевтического эффекта по анаболическому действию соединения І в 15 раз выше, чем оротата калия (табл. 6). Пример 4. Исследование иммуномодулирующей активности соединения 1 проводили на 77 половозрелых мышах-самцах гибридах F1 (СВА x C57BL6). Гуморальный иммунный ответ оценивали по титру циркулирующи х гемагглютининов в сыворотке крови, который учитывали через 7 дней после внутрибрюшинной инъекции тимусзависимого антигена (0,2 мл 30%ной взвеси эритроцитов барана). Водный раствор препарата вводили внутрижелудочно ежедневно в течение 7 дней, начиная со дня иммунизации в дозах 1, 2,5 и 25 мг/кг. Контрольные животные по аналогичной схеме получали растворитель. В качестве стандартного иммуномодулятора использовали левамизол в испытываемых дозах (табл. 8). С целью изучения воздействия исследуемого вещества 1 на клеточный иммунный ответ воспроизводили феномен гиперчустви тельности замедленного типа (ГЗТ). Соединение I и левамизол вводили внутрижелудочно в дозах 2,5 мг/кг и 25 мг/кг в течение 6 дней, начиная со дня сенсибилизации (табл. 9). Полученный цифровой материал отработан с применением критерия Стьюдента. В результате экспериментальных исследований установлено, что использование соединения І в дозах 1,0, 2,5 и 25 мг/кг в течение 7 дней приводит к достоверному снижению титра циркулирующи х гемагглютининов в сыворотке крови по сравнению с контролем. Общая масса селезенки подопытных животных при этом не снижается, что свидетельствует об отсутствии цитотоксического эффекта соединения (табл. 8). Продолжительное исследование левамизола в аналогичных дозах также оказывает иммунодепрессивное действие. При этом .степень иммунодепрессии соединения I не отличается от таковой левамизола. Следует отметить, что увеличение дозы испытуемого вещества приводит к снижению иммуномодулирующего эффекта. Таким образом, можно предположить, что соединения I имеют узкий диапазон эффективных доз. Анализ показателей клеточного иммунитета выявил, что соединение I вызывает достоверную индукцию реакции (ГЗТ) в дозе 2,5 мг/кг аналогично левамизолу, однако по силе иммуностимуляции несколько уступает последнему. Сравнительное исследование токсичности на мышах при пероральном введении показывает, что вещество I обладает (LD50 = Ί3300 мг/кг) в 63 раза меньшей токсичностью, чем левамизол (LD50 = 210 ±20 мг/кг). На основании полученных данных можно сделать вывод, что соединение I подобно левамизолу может оказывать как иммунодепрессивный, так и иммуностимулирующий эффект на организм в зависимости от схемы введения препарата и экспериментальной модели, на которой проводится исследование. По иммунодепрессивному действию соединение I не уступает левамизолу, проявляя в 63 раза меньшую токсичность. Пример 5. Высокое иммуномодулирующее действие соединения I подтверждено на модели аутоиммунной полиэндокринопатии при оценке клеточного иммунитета на органном уровне по wltebskl. В этой модели аутоиммунный процесс развивается в поджелудочной, щитовидной и половых железах. Экспериментальную полиэндокринопатию у крыс популяции Вистар вызывали введением гомогената щитовидной железы человека. Железы, взятые после оперативного вмешательства, гомогенизировали в двойном объеме 0,9%-ного раствора хлорида натрия. Гомогенат инкубировали 16-18 ч при 4°С, центрифугировали при 2000 об./мин 15 мин. Надосадочную жидкость использовали в качестве антигена. Последний вводили в хвост крысы на расстоянии 1,5 см от его основания в дозе 0,05 мл с равным количеством полного адъюванта Фрейнда. Животных иммунизировали четырехкратно с интервалом в одну неделю. Введение соединения 1 и левамизола начинали через неделю после последней иммунизации крыс в течение 6 дней. Забой животных производили через 1 сут после последнего введения вещества под фторотановым наркозом. Поджелудочные железы немедленно извлекали, фиксировали в 10%-ном растворе нейтрального формалина, делали гистологические препараты, которые изучали под световым микроскопом. Гистологически в островковом аппарате поджелудочной железы выявлены следующие изменения. Контроль. Поджелудочная железа. Аутоиммунный инсулит (АИИ). Из 10 островков в трех АИИ 3-4-й степени тяжести, в трех АИИ 1-2-й степени тяжести. Дистрофия различной степени выраженности во всех клетках островка Лангерганса. В основном гидропическая дистрофия. Левамизол. Поджелудочная железа АИИ. Из 30 островков в 21 явления АИИ 3-4-й степени тяжести. Поражена также экзокринная часть железы, дистрофические изменения от зернистой дистрофии вплоть до распада клеток экзокринной части, очаги лимфоцеллюлярной инфильтрации (имеются признаки панкреатита). В островках имеются дистрофические изменения практически во всех клетках различной степени выраженности от 2-й до 4-й АИИ, что свидетельствует о развитии аутоиммунного процесса в экзокринной части (аутоиммунный панкреатит) и в островковом аппарате (аутоиммунный инсулит) поджелудочной железы. Соединение I. Поджелудочная железа. Аутоиммунный инсулит отсутствуе т. В инсулярном аппарате в 7-8 из 30 b-клеток наблюдается опустошением цитоплазмы. В некоторых островках выявляются митозы в βклетках. Наблюдается стимуляция экзокринной части железы. Концевые отделы желез эндокринной части заполнены жидким коллоидом. В островках, где выявляются митозы, повышена васкуляризация. В ядрах /5клеток выявлены равномерно расположенные глыбки хроматина. В некоторых островках наблюдается гиперплазия клеток, все они небольших размеров, с интенсивно окрашенным ядром, с узким ободом цитоплазмы. В некоторых клетках выявляются митотические изменения в ядре. . Как следует из эксперимента, препарат левамизол не только не подавляет развитие аутоиммунного процесса в инсулярном аппарате поджелудочной железы, но и при его применении развиваются дистрофические изменения в клетках островкового аппарата. Эти данные говорят о том, что левамизол как иммуномодулятор нельзя применять при лечении сахарного диабета. Напротив, у животных, леченных соединением I, наблюдается мощное подавление аутоиммунных процессов в инсулярном аппарате. Кроме того, под влиянием соединения I наблюдаются выраженные регенераторные процессы с восстановлением структуры инсулинпродуцирующего аппарата поджелудочной железы. Известно, что препарат никотинамид в дозе 500 мг/кг, т.е. в 100 раз большей, чем соединение I, также стимулирует регенераторные процессы в островковом аппарате поджелудочной железы панкреатэктомированных животных. Ввиду того, что параллельные исследования вещества не проводили, авторы не настаивают на защите этого вида активности для соединения I. Ингибирующее влияние на клеточное звено аутоиммунитета к инсулинпродуциру-ющему аппарату соединения I подтверждено на модели стрептозатоцинового диабета аутоиммунного генеза. Пример 6. Стрептозотоциновый диабет моделировали на мышах мутантной линии C57BL/KsJY гетерозиготных по гену db(diabetes) путем внутрибрюшинного введения стрептозотоцина (Upjohn, USA) в дозе 40 мг/кг массы тела ежедневно на протяжении 5 дней. Стрептозотоцин вводили животным в течение 3 мин после разведения в цитратном буфере рН - 4,5 из расчета 0,1 мл смеси на 10 г массы тела. Контрольной группе мышей параллельно вводили цитратный буфер в аналогичном объеме. Динамику гликемии определяли через 5, 8, 10,12 и 15 сут после первого введения стрептозотоцина. Уровень глюкозы в крови определяли ортотолуидиновым способом. Вещество I животные получали перо-рал ьно на 5, 10 и 15-е сут в дозе 5 мг/кг после первого введения стрептозотоцина. На 15-е сут эксперимента животных декантировали под хлороформным наркозом, извлекали поджелудочные железы, фиксировали их в формалине и жидкости Буэна. Уже к 10-му дню эксперимента у нелеченых животных резко возрастал базальтовый уровень сахара в крови до 17,96± ± 1,06 ммоль/т, тогда как уровень глюкозы при лечении соединением I оставался в пределах контроля (8,21 ± 1,04 ммоль/т), т.е. в 2,26 раза ниже, чем у животных со стрепто-зотоциновым диабетом (табл. 10). В конце опыта на 15-й день уровень сахара в крови у нелеченых животных составил 31,08 ± 3,71 ммоль/л, тогда как при введении вещества і он был значительно ниже -18,69 ±2,90 ммоль/л. Наблюдается достоверная задержка развития диабета в эксперименте при лечении животных соединением I. Гистологический контроль поджелудочной железы позволил выявить следующие изменения. Поджелудочная железа. Стрептозотоциновый диабет. Контроль. АИИ 3-4-й степени тяжести. В большинстве островков массивные разрушения в b-клетках, отсутствуют b-клетки без дистрофических изменений. Поджелудочная железа. Стрептозотоциновый диабет. Соединение I. АИИ отсутствуе т. В островках на 5060 b-клеток выявляются 3-5 С явлениями дистрофии различной степени выраженности. Наряду с этим выявляются крупные β-кпетки с интенсивно окрашенной цитоплазмой, большим интенсивно окрашенным ядром. Наряду с этими изменениями выявляются островки, представленные мелкими и среднего калибра клетками, имеющими округлое интенсивное окрашенное ядро с дисперсным хроматином, окруженное ободом разной степени эозинофильности цитоплазмы. В таких островках выявляются клетки с явлениями митоза. Таким образом, и в этой модели соединение I проявляет высокое иммуномодулирующее действие, направленное на защиту инсулярного аппарата от аутоиммунной агрессии, и стимулирует регенераторные процессы в островках поджелудочной железы. Пример 7. Влияние соединения I на артериальное давление, сердечную деятельность, частоту и амплитуду дыхательных движений исследовали в острых опытах на кошках обоего пола весом 3,0-3,5 кг, наркотизированных этаминал-натрием (50 мг/кг). Для предупреждения свертываемости крови внутривенно вводили гепарин из расчета 1000 ЕД/кг. Артериальное давление регистрировали в общей сонной артерии с помощью манометра Людвига на движущей ленте кимографа. Одновременно с помощью писчика капсулы Марея записывали частоту и амплитуду дыха тельных движений. Сердечные ритмы регистрировали на теплочувствительной диаграммной ленте портативного электрокардиографа ЭКП-04. Соединение вводили в бедренную вену в виде 5%-ной тонкой суспензии на стерильном физрастворе, стабилизированной Твином-80. В каждую серию брали по 5 животных. Результаты статистически достоверы. Соединение I даже в дозе 50 мг/кг существенного влияния на артериальное давление, частоту и амплитуду ды хательных движений не оказывает. Функциональных изменений сердечной деятельности не наблюдалось. Пример 8. Изучение влияния соединения I на выделительную функцию почек проводили на белых крысах-самцах популяции Вистар массой 160-200 г по методу Е.Б. Берхина. Все животные были разделены на 3 группы (по 7 крыс в каждой). Животные первой группы служили контролем, Крысам второй группы за 30 мин до водной нагрузки внутрибрюшинно вводили соединение ! в дозе 50 мг/кг в виде 5%-ной тонкой водной суспензии, стабилизированной Твином-80. Животным третьей группы за 30 мин до водной нагрузки вводили в препарат сравнения - гипотиазид в дозе 50 мг/кг. Затем все животные получали водную нагрузку из расчета 1 мл на 20 г массы тела животного. Мочу собирали через каждый час в течение 4 ч. Результаты полученных данных показывают, что соединение I даже в дозе 50 мг/кг не оказывает существенного влияния на выделительную функцию почек. В результате проведенных фармакологических исследований /3фенилэтиламида 2-оксисукцинаниловой кислоты установлено, что соединение I: по анаболическому действию превосходит активность калия оротата в 6,75 раза, обладая в 2,2 раза меньшей токсичностью и в 15 раз большей широтой терапевтического действия; обладает высоким иммуномодулирующим действием, причем в зависимости от дозы и схемы введения может показывать как иммунодепрессивный, так и иммуностимулирующий эффект; по имму но депрессивному действию не уступает левамизолу, обладая в 63 раза меньшей токсичностью; вызывает подавление аутоиммуной агрессии в островко-вом аппарате поджелудочной железы при аутоиммуном инсулине в отличие от левами-зола, который не только не устраняет патологию, но и вызывает дистрофические изменения в клетках инсулярного аппарата; стимулирует регенераторные процессы в инсулинпродуцирующем аппарате поджелудочной железы; не оказывает существенного влияния на уровень артериального давления, функциональное состояние сердечной деятельности, частоту и амплитуду дыхательных движений; не влияет на выделительную функцию почек. * W__
ДивитисяДодаткова інформація
Назва патенту англійськоюBeta- phenyl ethyl amide of 2-oxysuccynanyl acid, revealing anabolic, immune-modulating activity and inhibiting cell link auto immunity to apparatus producing insulin
Автори англійськоюChuvurin Oleksandr Viktorovych, Natarov Valerii Volodymyrovych, Salnikova Stalina Ivanivna, Merzlikin Serhii Ivanovych, Samokhina Lidiia Ivanivna, Moroz Vira Vasylivna, Drohovoz Valerii Valentynovych, Makurina Valentyna Ivanivna, Drohovoz Svitlana Mefodiivna, Poltorak Viktoriia Vitaliivna, Bryndak Oleh Ivanovych, Kyrychenko Oleksandr Anatoliiovych, Blokh Kostiantyn Olehovych, Bozhko Tetiana Stepanivna, Horbenko Nataliia Ivanivna, Chernykh Valentyna Frankivna, Slyshkov Volodymyr Vasyliovych, Tur Maryna Yuriivna, Panchenko Olha Mykolaivna, Shevchenko Liudmyla Yevhenivna
Назва патенту російськоюBеtа-фенилэтиламид 2-оксисукцинаниловой кислоты, проявляющий анаболическую, иммуномоделирующую активность и ингибирующий клеточное звено аутоиммунитета к инсулинпродуцирующему аппарату
Автори російськоюЧувурин Александр Викторович, Натаров Валерий Владимирович, Сальникова Сталина Ивановна, Мерзликин Сергей Иванович, Самохина Лидия Ивановна, Мороз Вера Васильевна, Дроговоз Валерий Валентинович, Макурина Валентина Ивановна, Дроговоз Светлана Мефодиевна, Полторак Виктория Витальевна, Бриндак Олег Иванович, Кириченко Александр Анатолиевич, Блох Константин Олегович, Божко Татьяна Степановна, Горбенко Наталия Ивановна, Черных Валентина Франковна, Слышков Владимир Васильевич, Тур Марина Юрьевна, Панченко Ольга Николаевна, Шевченко Людмила Евгеньевна
МПК / Мітки
МПК: A61P 37/02, A61P 3/00, A61K 31/165, C07C 235/74
Мітки: анаболічну, клітинну, активність, кислоти, аутоімунітету, 2-оксисукцинанілової, проявляє, апарату, інгібує, ланку, bеtа-фенілетиламід, імуномоделюючу, інсулінпродукуючого
Код посилання
<a href="https://ua.patents.su/7-19059-beta-feniletilamid-2-oksisukcinanilovo-kisloti-yakijj-proyavlyaeh-anabolichnu-imunomodelyuyuchu-aktivnist-ta-ingibueh-klitinnu-lanku-autoimunitetu-do-insulinprodukuyuchogo-aparatu.html" target="_blank" rel="follow" title="База патентів України">Bеtа-фенілетиламід 2-оксисукцинанілової кислоти, який проявляє анаболічну, імуномоделюючу активність та інгібує клітинну ланку аутоімунітету до інсулінпродукуючого апарату</a>