Спосіб одержання похідних оксадіазолалкілпурину або їх фармацевтично прийнятних кислотно-адитивних солей (варіанти)
Номер патенту: 26368
Опубліковано: 30.08.1999
Автори: Дебрецені Лоранд, Ковач Габор, Корбонітш Дежьо, Мартон Йєньо, Готтшеген Агнеш, Кьормьоці Петер, Варгаі Золтан, Болеховскі Андреа, Віраг Шандор, МАРМАРОШІ Каталін, Хорват Габор, Антуш Шандор, Гергелі Віра, Тардош Ласло, Хейа Гергелі, Мінкер Еміль
Формула / Реферат
1. Способ получения производных оксадиазолалкилпурина общей формулы (l) или их фармацевтически приемлемых кислотно-аддитивных солей,
где A означает C1-C1-алкилен,
R1 означает C1-C4-алкил, окси(C1-C4)алкил, хлор(C1-C4)алкил, карбокси(C1-С4)-алкил, циклогексил, фенил, карбоксифенил, бензил, диметоксибензил, аминоалкил общей формулы
где n = 1 - 3,
R2 и R3 означают C1-C4-алкил, или, вместе с атомом азота, с которым они связаны, образуют пиперидиновое или морфолиновое кольцо,
отличающийся тем, что амидоксим общей формулы (ll)
где A имеет вышеуказанные значения,
подвергают взаимодействию с низшим алкиловым эфиром карбоновой кислоты общей формулы (lll)
где R1 имеет вышеуказанные значения,
при нагревании в среде органического растворителя в присутствии этилата щелочного металла или гидроксида щелочного металла с последующим выделением целевого соединения в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли.
2. Способ получения производных оксадиазолалкилпурина общей формулы (l) или их фармацевтически приемлемых кислотно-аддитивных солей,
где A означает C1-C4-алкилен,
R1 означает C1-C4-алкил, окси(C1-C4)алкил, хлор(C1-C4)алкил, карбокси(C1-C4)алкил, циклогексил, фенил, карбоксифенил, бензил, диметоксибензил, аминоалкил общей формулы
где n = 1 - 3,
Рг и R3 означают C1-C4-алкил, или, вместе с атомом азота, с которым они связаны, образуют пиперидиновое или морфолиновое кольцо,
отличающийся тем, что амидоксим общей формулы (ll)
где A имеет вышеуказанные значения,
подвергают взаимодействию с галогенангидридом или ангидридом карбоновой кислоты общей формулы (lll)
где R1 имеет вышеуказанные значения,
и полученное при этом промежуточное соединение общей формулы (lV)
где A и R1 имеют вышеуказанные значения,
выделяют и/или подвергают циклизации путем дегидратации при нагревании с последующим выделением целевого соединения в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли, или, при необходимости, полученное соединение общей формулы (l), в которой R1 означает хлор(C1-C4)алкил подвергают взаимодействию с амином формулы HNR2R3, с последующим выделением соединения общей формулы (l), в которой R1 означает вышеуказанный аминоалкил, в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли.
Текст
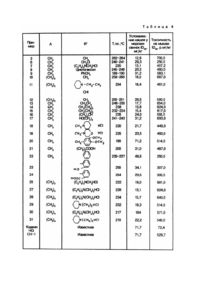
Изобретение относится к способам получения новых производных оксадиазолалкилпурина общей формулы (l): где A означает (C1-C4)-алкилен, R1-(C1-C4)-алкил, окси(низший алкил), хлор(низший алкил), карбокси(низший алкил), циклогексил, фенил, оксифенил, карбоксифенил, бензил, диметоксибензил, аминоалкил общей формулы: где n целое число от 1 до 3, R2 и R3 означают (C1-C4)-алкил, или вместе с атомом азота, с которым они связаны образуют пиперидиновое или морфолиновое кольцо, или их фармацевтически приемлемых кислотно-аддитивных солей. Соединения общей формулы (l) обладают действием, успокаивающим кашель при заболеваниях органов дыхания и могут найти применение в медицинской практике. Алкильные группы могут быть с прямой цепью или разветвленные. Диметоксибензильной группой является предпочтительно 3,4-диметоксибензил. Фармацевтически приемлемые соли соединений общей формулы (l) могут представлять кислые аддитивные соли, образованные с неорганическими кислотами (например соляная кислота, серная кислота, фосфорная кислота) или с органическими кислотами, как карболовые кислоты или сульфокислоты, как уксусная кислота, виннокаменная кислота, малеиновая кислота, молочная кислота, лимонная кислота, аскорбиновая кислота, бензойная кислота, оксибензоилбензойная кислота, никотиновая кислота, метансульфокислота, толуолсульфокислота и т.д. При заболеваниях органов дыхания с давних времен применяют для лечения имеющиеся в природе вещества и их производные. Соединения с остовом морфина особенно широко распространены для этой цели. Самым известным успокаивающим кашель средством является кодеин. Однако эти не оказывающие специфического влияния на центральную нервную систему вещества имеют много нежелательных побочных действий. Опасным побочным действием кодеина является блокирующее дыхание действие. В последние десятилетия стремились создать такие успокаивающие кашель средства, побочное действие которых небольшое и даже не появляется при терапевтических дозах. Определенные типы содержащих 1,2,4-оксадиазоловое кольцо соединений принадлежат к группе вышеуказанных новых успокаивающих кашель средств (например, оксоламин и преноклиазин). Круг содержащих 1,2,4-оксадиазольное кольцо средств был недавно расширен такой новой группой соединений, в которой 1,2,4-оксадиазольное кольцо к атому азота в 7-положении содержащего пуриновый остов теофиллина соединено через алкильную цепь. Эти соединения, наряду с успокаивающим кашель действием, показывают значительные улучшающие дыхание и бронхолитические действия и имеют выгодную токсичность. Указанные соединения получают путем взаимодействия соответствующих производных оксимов с карбоновыми кислотами или их производными (l). Задачей настоящего изобретения является разработка способа получения новых производных оксадиазолалкилпурина, которые еще больше повышают вышеуказанные терапевтически благоприятные действия. Поставленная задача решается предлагаемым способом получения соединений вышеприведенной общей формулы (l), заключающимся в том, что амидоксим общей формулы (ll): где A имеет вышеуказанные значения, подвергают взаимодействию с низшим алкиловым эфиром карбоновой кислоты общей формулы lll: где R1 имеет вышеуказанные значения, при нагревании в среде органического растворителя в присутствии этилата щелочного металла или гидроокиси щелочного металла с последующим выделением целевого соединения в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли. По другому варианту соединения общей формулы (l) получают п утем взаимодействия амидоксима общей формулы (ll) с галоидангидридом или ангидридом карбоновой кислоты формулы (lll). Полученное при этом промежуточное соединение общей формулы (lV): выделяют и/или подвергают циклизации путем дегидратации при нагревании с последующим выделением целевого соединения в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли. При необходимости полученное соединение общей формулы (l), в которой R1 означает хлор (низший алкил) подвергают взаимодействию с амином: где R2 и R3 означают (C1-C4)-алкил, или вместе взятые с атомом азота, с которым они связаны, образуют пиперидиновое или морфолиновое кольцо, с последующим выделением соединения общей формулы (l), где R 1 аминоалкил где n - целое число от 1 до 3, R2 и R3 имеют выше указанные значения в виде основания или в виде фармацевтически приемлемой кислотно-аддитивной соли. При осуществлении способа по первому варианту процесс ведут при нагревании, предпочтительно 50 150°C, особенно при точке кипения растворителя и/или разбавителя. В качестве органических растворителей и/или разбавителей используют содержащие 1 - 4 атома углерода спирты, амиды N-алкил-кислоты (как диметилформамид), ароматические углеводороды (например, бензол, хлорбензол, предпочтительно толуол или ксилол). В случае применения неполярных растворителей целесообразно удалять образованную воду и спирт азеотропной перегонкой. Время реакции колеблется от 1/2 до 24ч в зависимости от используемых растворителей и температуры проведения процесса. По второму варианту способа ацилирование проводят с ангидридом кислоты или с галоидангидридом кислоты, особенно с соответствующим хлорангидридом кислоты - в присутствии органического растворителя и/или разбавителя. В качестве реакционной среды могут применяться предпочтительно ацетон, пиридин, бензол, диметилформамид или - в случае ангидридов - избыток ангидрида, содержащие 2 - 4 атома углерода простые диалкиловые эфиры, диоксан, галогенированные углеводороды, предпочтительно дихлорметин или хлороформ. Если в качестве ацилирующего средства применяют галоидангидриды кислоты, целесообразно использовать неорганические или органические связывающие кислоту средства. Для этой цели применяются неорганические соединения (карбонаты щелочных и щелочноземельных металлов, например карбонат натрия, калия или кальция, бикарбонаты), как бикарбонат натрия (или органического соединения) как третичные амины, предпочтительно пиридин (или триэтиламин). Если применяют ацилирующие средства, которые содержат основную R1-гр уппу, образованное промежуточное соединение общей формулы (lV) может служить связывающим кислоту средством. Ацилирование и циклизацию при втором варианте можно осуществлять при 50 - 150°, особенно при 90 110°C. При втором варианте способа образование 1,2,4-оксадиазольного кольца осуществляют пиролизом, проведенным в присутствии или при отсутствии полярных органических растворителей и/или воды или неполярных растворителей в качестве растворителей и/или разбавителей. Замыкание кольца соединения общей формулы (lV) можно проводить предпочтительно при оптимальной величине pH 6 - 8, которую можно установить при помощи неорганических или органических веществ (преимущественно карбоната натрия или триэтиламина). Применение буферного раствора Бриттона - Робинсона оказалось особенно выгодным. Замыкание кольца водорастворимых соединений общей формулы (lV) можно выгодно осуществлять в воде при pH 7. Используемые в вариантах способа в качестве исходного сырья амидоксимы 3-метил-ксантин-7-илалканкарбоновой кислоты общей формулы (ll) можно получить известным образом превращением соответствующи х нитрилов 3-метил-ксантин-7-ил-карбоновой кислоты с гидроксиламином, при нагревании в метаноле или этаноле или в водном растворе метанола или этаноле. Соединения общей формулы (l) и (lV), в которых R1 обозначает галоидный алкил, можно получать известным образом из соответствующи х хлорангидридов галогеналканкарбоновой кислоты и амидоксимов общей формулы (ll). Соединения общей формулы (l), в которых представляет аминоалкил, кроме первого варианта можно получать известным образом предпочтительно также из соединений общих формул (l) и (lV), в которых обозначает галоидный алкил, проведенным с соответствующими аминами замещением или замещением и циклизацией. Было найдено, что полученные новые соединения общей формулы (l) оказывают исключительно сильное успокаивающее кашель действие. При изучении зависимостей между химической структурой и биологическим действием пришли к неожиданному результату, что в соединениях общей формулы (l) пуриновое кольцо сильнее потенцирует успокаивающее кашель действие 1,2,4-оксидиазольного остова, чем метилзамещенные в 1-положении аналогичные соединения. Новые соединения, полученные по изобретению общей формулы (l) отличаются от описанных в [1] производных теофиллинаоксадиазола отсутствием метиловой группы у азота в 1-положении пуринового каркаса. Это действие является неожиданным потому, что хорошо известно, что теофиллин по своей биологической активности превосходит теобромин. Тот факт, что в проявлении неожиданно сильного и исключительно высокого успокаивающего кашель действия решающую роль играет 1,2,4-оксадиазоловое кольцо, доказывается проведенными с соединениями общей формулы (ll) сравнительными опытами. Соединения общей формулы (ll) в которых пуриновый каркас идентичен с таким же пуриновым каркасом соединений общей формулы (l), но 1,2,4оксадиазоловое кольцо не замкнуто - практически не показывают никакой успокаивающей кашель активности. Успокаивающее кашель действие новых соединений по изобретению общей формулы (l) такое сильное, что эти соединения превосходят в несколько раз не только известные вышеупомянутые успокаивающие кашель производные 1,2,4-оксадиазола, но и кодеин. Терапевтическая ценность соединений полученных по изобретению поддерживается очень благоприятной токсичностью. На основании проведенных на крысах и кроликах опытов соединения общей формулы (l), имеющие каркас морфина, успокаивающие кашель средства - в противоположность не показывают никакого блокирующего дыхание действия, а оказывают даже благоприятное бронхолегочное действие. Для подкрепления вышеизложенного в табл.1 приведены для сравнения полученные со следующим тестсоединениями результаты: 3,7-дигидро-3-метил-7-[(5-метил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-дион (соединение №1, см. пример 3) самый простой представитель соединений общей формулы (l); два эталонных соединения с 1,2,4-оксадиазоловым каркасом, кодеин и декстрометорфан (эталонные соединения с морфиновым каркасом), исходное вещество общей формулы (ll) 2-(3-метил-ксантин-7-ил)-ацетамидоксим. Определяют успокаивающее кашель действие, оказанное на вызванный впрыскиванием 15% - ной лимонной кислоты кашель, через час после перорального назначения тест-соединения, и полученные величины ID50 (мг/кг) указаны в табл.1. (Метод: Arzneimittel-Forschung 617 - 621/1966/). Из табл.1 видно, что при оральном назначении тест-соединение общей формулы (l) (соединение №1) по абсолютной интенсивности успокаивающего кашель действия значительно превосходит примененные в качестве эталонного соединения тест-соединения №2 - 4 и 6. Производное ксантиниламидоксима №5 практически не имеет никаких успокаивающих кашель свойств. Как видно из табл. 2, соединение №1 при оральном назначении оказывает продолжительное успокаивающее кашель действие. Пример 1. 35,0г (0,25моль) 3-метилксантина (Chem. Ber 83, 209 (1950) растворяют в 81,4мл (0,25моль) 10% ного раствора гидроокиси натрия, кристаллизация происходит в течение нескольких минут. Воду отгоняют при пониженном давлении, а следы удаляют азеотропной перегонкой с толуолом. Остаток суспендируют в 350мл диметилформамида, после чего при 100°C при перемешивании добавляют по каплям раствор 18,9г (0,25моль) хлорацетонитрила и 80мл диметилформамида. Реакционную смесь перемешивают еще один час при 100°C, фильтруют в горячем состоянии, осадок (хлористый натрий) промывают горячим диметилформамидом и соединенные растворы сгущают досуха при пониженном давлении. Остаток растирают с 100мл ацетона, кристаллы фильтруют и основательно промывают ацетоном. Полученный таким путем 7-цианрметил-3-метилксантин можно непосредственно перерабатывать дальше, точка плавления: 285 - 287°C. Пример 2. К раствору 3,2г гидроксиламин-гидрохлорида и 36мл воды добавляют частями 2,5г карбоната натрия. К полученному таким путем раствору добавляют 10,0г 7-цианометил-3-метилксантина и 30мл этанола. Реакционную смесь перемешивают 3ч при 80°C и затем охлаждают. Осажденный 2-(3-метил-ксантин-7-ил)ацетамидоксидоксим фильтруют и промывают небольшим количеством холодной воды. Выход: 11,0г, 86%. Точка плавления выше 320°. 1Н-ядерный магнитный резонанс (DMSO-d6): 3 ,35 (S, 3Н, 3-Ме); 4,85 (S, 2H, NCH2-),8,03 (S, 1Н, 8Н); 9,79 (S, 1Н, N-OH); 11,21 (bS, 1H, 1-NH). Пример 3. Смесь образованного из 6,76г натрия и 290мл безводного этанола раствора этилата натрия, 35,0г 2-(3-метил-ксантин-7-ил)-ацетамидоксима и 43,0мл этилацетата нагревают до кипения при перемешивании в течение 4 часов. Реакционную смесь фильтруют в горячем состоянии и фильтрат сгущают при пониженном давлении. Остаток растворяют в 200мл воды. Величину pH раствора устанавливают до 7 при помощи 10% - ной соляной кислоты. Осажденный продукт фильтруют, и дважды кристаллизуют из воды. Получают 18,0г 3,7дигидро-3-метил-7-[(5-метил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-диона, точка плавления: 262 - 264°C. 1 Н-ядерный резонанс (DMSO-d6): 2,57 (S, 3Н, 5-Ме); 3,37 (S, 3Н, 3-Ме); 5,66 (S, 2Н1-CH2); 8,18 (S,1H, 6Н); 11,19 (bS, 1H, 1Н). Пример 4. Раствор 2-(3-метил-ксантин-7-ил)-ацетамидоксима и 45,0мл уксусного ангидрида перемешивают при 140°C в течение 10мин. Охлажденный раствор разбавляют водой до 10 - кратного объема и перемешивают в течение 30мин. Осажденный 0-ацетил-2-(3-метил-ксантин-7-ил)-ацетамидоксим фильтруют и промывают небольшим количеством метанола. Получают 3,60г продукта с точкой плавления выше 220°C при разложении. 1Н-ядерный магнитный резонанс (DMSO - O6); 2,01 (S, 3Н, OAc), 3,34 (S, 3Н, 3 Ме), 4,97 (S, 2H, NCH2-), 6,70 (bS, 2Н, NH2), 8,07 (S, 1H, 6H), 11,24 (bS, 1H, 1-NH). Пример 5. 2,0г 0-ацетил-2-(3-метил-ксантин-7-ил)-ацетамидоксима перемешивают в смеси 160мл буферного раствора Бриттона - Робинсона (pH 7) и 200мл диметилформамида при 95°C в течение 6ч. Реакционную смесь сгущают при пониженном давлении. После кристаллизации остатка из воды получают 1,22г 3,7-дигидро-3-метил7-[(5-метил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-диона, точка плавления 262 - 264°C. Пример 6. Раствор 2,38г 2-(3-метил-ксантин-7-ил)-ацетамидоксима в 40мл безводного ацетона ацилируют в присутствии 0,86г бикарбоната натрия при помощи раствора 1,13г хлорацетилхлорида и 5,0мл ацетона. Получают 2,1г 0-хлорацетил-2-(3-метил-ксантин-7-ил)-ацетамидоксима. Продукт суша т до постоянного веса при 105°C и при давлении 133Ра в течение 40мин. Остаток кристаллизуют из метанола. Получают 1,6г 3,7-дигидро-3метил-7-[(5-хлорметил-1,2,4-оксадиазол-3-ил)метил]-1Н-пурин-2,6-диона. Пример 7. a) Смесь 1,5г 3-[(метил-ксантин-7-ил)метил]-5-хлорметил-1,2,4-оксадиазола, 10мл диэтиламина и 10мл толуола нагревают на водяной бане в течение 8час при перемешивании в снабженной магнитной мешалкой закрытой колбе. Реакционную смесь сгущают, остаток промывают водой, растворяют в 5мл горячего этанола и осветляют при помощи активного угля. Гидрохлорид получают из этанольного раствора обработкой хлористым водородом и кристаллизуют из воды. Получают 1,4г 3,7-дигидро-3-метил-7-[(5-диэтиламинометил-1,2,4оксадиазол-3-ил)-метил]-1Н-пурин-2,6-дион-гидрохлорида. b) 1,41г полученного по примеру 7 0-хлорацетил-2-(3-метил-ксантин-7-ил)-ацетамидоксима смешивают по каплям в 15мл толуола при сильном перемешивании с 1,5мл диэтиламина. Реакционную смесь нагревают до кипения в течение 8ч и после этого сгущают. Остаток промывают водой. Гидрохлорид образуют в этаноле и кристаллизуют из воды. Получают 1,2г 3,7-дигидро-3-метил-7-[(5-диэтиламинометил-1,2,4-оксадиазол-3-ил)метил]-1Н-пурин-2,6-дион-гидрохлорида. c) 2,38г 2-(3-метил-ксантин-7-ил)-ацетамидоксима превращают в 20мл пиридина с 3,0г диэтиламиноацетилхлорида при перемешивании, при температуре, не превышающей 20°C. Реакционную смесь нагревают на водяной бане 2ч и сгущают. Остаток промывают водой. Гидрохлорид получают в этанольном растворе и кристаллизуют из воды. Получают 2,1г 3[(3-метил-ксантин-7-ил)-метил]-5-диэтиламино-метил-1,2,4оксадиазол-гидрохлорида. d) Смесь 2,38г 2-(3-метил-ксантин-7-ил)-ацетамидоксима, 200мл толуола, 1,36г этилата натрия и 3,46г простого этилового эфира b-диэтиламинопропионовой кислоты нагревают до кипения в течение 12ч при перемешивании в снабженной водоотделителем колбе. Реакционную смесь сгущают при пониженном давлении, устанавливают величину pH до 7, осадок промывают водой и сушат. Гидрохлорид образуют в этаноле. Получают 2,0г 3,7-дигидро-3-метил-7-[(5-диэтиламинометил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-дионгидрохлорида. Пример 8. 2,38г 2-(3-метил-ксантин-7-ил)-ацетамидоксима в 25мл этанола нагревают до кипения в течение 20ч при перемешивании с раствором 0,45г натрия в 25мл этанола и с 3,12г сложного этилового эфира циклогексанкарбоновой кислоты. Реакционную смесь сгущают, остаток смешивают с водой и устанавливают величину pH до 7. Остаток кристаллизуют из водного этанола. Получают 2,61г 3,7-дигидро-3-метил-7-[(5циклогексил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-диона, с точкой плавления 245 - 248°C. Пример 9. 2,38г 2-(3-метил-ксантин-7-ил)-ацетамидоксима превращают описанным в примере 8 способом с 3,28г сложного этилового эфира фенилуксусной кислоты и этилата натрия в этаноле. Получают 2,7г 3,7-(дигидро3-метил-7-[(5-бензил-1,2,4-оксадиазол-3-ил)метил]-1Н-пурин-2,6-диона. Пример 10. 2,52г амидоксима 3-(3-метил-ксантин-7-ил)-пропионовой кислоты в 4,0мл этилацетата нагревают до кипения в течение 5ч с раствором 0,46г натрия и 25мл этанола. Реакционную смесь фильтруют в горячем состоянии, фильтрат выпаривают, остаток обрабатывают 20мл воды и устанавливают величину pH до 7. Осадок кристаллизуют из воды. Получают 1,7г 3,7-дигидро-3-метил-7-[2-(5-метил-1,2,4-оксадиазол-3-ил)-этил-1-ил]-1Нпурин-2,6-диона с точкой плавления 258 - 260°C. Пример 11. Смесь 2,52г амидоксима 3-(3-метил-ксантин-7-ил)-пропионовой кислоты 25мл толуола, 1,12г распыленной гидроокиси калия и 3,70г сложного этилового эфира b-пиперидино-пропионовой кислоты нагревают до кипения в течение 10ч при перемешивании в снабженной водоотделителем колбе. Реакционную смесь сгущают. Остаток обрабатывают водой, устанавливают величину pH до 7, осажденный осадок промывают водой, образуют гидрохлорид в этаноле. Получают 2,6г 3,7-дигидро-3-метил-7-{2-[5-[2-пиперидино-этан-1-ил)-1,2,4оксадиазол-3-ил)-этан-1-ил}-1Н-пурин-2,6-дион-гидрохлорида. Пример 12. Раствор 2,66г амидоксима 4-(3-метил-ксантин-7-ил)-масляной кислоты в 4,0мл этилацетата нагревают до кипения в течение 6ч с раствором 0,46г натрия и 25мл этанола. Реакционную смесь обрабатывают описанным в примере 3 способом. Получают 1,8г 3,7-дигидро-3-метил-7-[3-(5-метил-1,2,3-оксадиазол-3-ил)пропан-1-1-ил]-1Н-пурин-2,6-диона. Примеры 13 - 31. Перечисленные в табл.3 соединения получают по способу, аналогичному выше указанным примерам. В табл.3 указаны № примера, значение символов A и R1 и метод. Пример 32. Успокаивающее кашель действие соединений, полученных по изобретению определяют на морских свинках при пероральном назначении. Скрипинговые испытания проводили наиболее простым методом, т.е. внутримышечно на мышах. Кашель вызывали ингаляцией спрея с содержанием 15% - ной лимонной кислоты. Величину ID50 (Inhibitory dose 50) определяли по дозе, которая могла продлить период времени до первого приступа кашля в три раза на 50% тестируемых животных. Каждую дозу испытывали на 10 животных. Основной период времени измеряли 24ч перед экспериментами. Математические расчеты осуществляли с помощью Litchfield-Wilcoxon-комьютера. Средства, успокаивающие кашель, широко используются в терапии. В качестве контрольного использовали кодеингидрохлорид и 3,7-дигидро-1,3-диметил-7-[(5-метил-1,2,4-оксадиазол-3-ил)-метил]-1Н-пурин-2,6-дион (CH170), содержащий пуриновую стр уктур у и кольцо оксадиазола; химически это соединение наиболее близко соединениям, полученным по изобретению. Токсичность определяли также на мышах ip-введением. Результаты испытаний даны в табл.4. В ней также даны точки плавления новых соединений. Из табл.4 можно видеть, что два контрольных соединения (в некоторых случаях) оказывают одинаковое успокаивающее кашель действие, а большинство новых соединений по изобретению оказывают гораздо более сильное действие. Сравнение результатов испытаний новых производных пурина по примеру 3 (A=CH 2, =CH3) и химически очень близкого известного соединения CH170 дало совершенно неожиданный результат, позволяющий сделать вывод, что замена метиловой группы на атоме азота пуринового кольца на атом водорода повышает успокаивающее кашель действие более, чем в пять раз. Как уже указывалось, это усиление действия является неожиданным также и потому, что теофилин и его производные (которые содержат метиловую группу на атоме азота пуринового кольца) оказывают гораздо более сильное действие, чем теобромин и его производные (у которых атом азота пуринового кольца не имеет заместителей). Содержание активного вещества, полученного по изобретению, в фармацевтических препаратах составляет между около 0,1 и 100%, предпочтительно около 1 - 30%. Ежедневная доза составляет около 2 - 2000мг, в зависимости от вида назначения, от возраста и от веса пациента и т.д. Источники информации 1. Патент Венгрии №190377, кл. C07D473/08, 1984.
ДивитисяДодаткова інформація
Автори англійськоюKorbonits Dejio, Minker Emil, Vargai Zoltan, Heiia Gergeli, Kovac Gabor, Gottsegen Agnes, Antus Sandor, Virag Sandor, Marton Yenyo, Marmarosi Katalin, Debreceni Lorand, Tardos Lazslo, Kormoci Peter, Gergeli Vira, Horval Gabor
Автори російськоюКорбонитш Деже, Минкер Эмиль, Варгаи Золтан, Хейа Гергели, Ковач Габор, Готтшеген Агнеш, Антуш Шандор, Вираг Шандор, Мартон Йене, Мармароши Каталин, Дебрецени Лоранд, Тардош Ласло, Кермеци Петер, Гергели Вира, Хорват Габор
МПК / Мітки
МПК: A61K 31/52, C07D 271/06, A61P 11/14, C07D 473/04
Мітки: кислотно-адітивних, спосіб, прийнятних, оксадіазолалкілпурину, одержання, похідних, солей, фармацевтично, варіанти
Код посилання
<a href="https://ua.patents.su/7-26368-sposib-oderzhannya-pokhidnikh-oksadiazolalkilpurinu-abo-kh-farmacevtichno-prijjnyatnikh-kislotno-aditivnikh-solejj-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних оксадіазолалкілпурину або їх фармацевтично прийнятних кислотно-адитивних солей (варіанти)</a>
Попередній патент: З’єднання труб
Наступний патент: Спосіб конверсії вуглеводнів паровим риформінгом та установка для його здійснення
Випадковий патент: Гарбузово-молочний концентрат киселю