3r,5s-(+)-7-[4-(4-фторфеніл)-2,6-діізопропіл-5-метоксиметилпірид-3-іл]-3,5-дигідроксигептенова кислота як інгібітор біосинтезу холестерину
Номер патенту: 26428
Опубліковано: 30.08.1999
Автори: АНГЕРБАУЕР Рольф, ШМІДТ Дельф, Томас Гюнтер, Хюбш Вальтер, Петцінна Дітер, БІШОФФ Хільмар, Фай Петер, ФІЛІПС Томас
Формула / Реферат
3R,5S-(+)-7-[4-(4-фторфенил)-2,6-диизопропил-5-метоксиметилпирид-3-ил]-3,5-дигидроксигептеновая кислота формулы
в эритро-(E)-конфигурации в виде физиологически переносимой соли металла в качестве ингибитора биосинтеза холестерина.
Текст
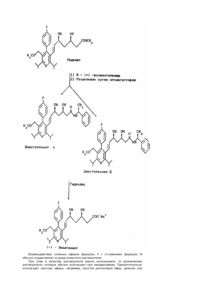
Изобретение относится к замещенным пиридином диоксигептеновым кислотам, в частности к новой 3R,5S-(+)-7-[4-(4-фторфенил)-2,6-диизопропил-5метоксиметилпирид-3-ил]-3,5-диоксигептеновой кислоте в эритро-(E)-конфигурации в виде физиологически переносимой соли металла, служащей в качестве ингибитора биосинтеза холестерина. Известны замещенные пиридином диоксигептеновые кислоты, в частности рацемический сложный метиловый эфир 7-[4-(4-фторфенил)-2,6-диизопропил-5метоксиметилпирид-3-ил]-3,5-диоксигептеновой кислоты в эритро-(E)-конфигурации (см. EP 325130 A2, кл. C07D213/65, 19889). Задачей изобретения является получение новой замещенной пиридином диоксигептеновой кислоты, являющейся лучшим ингибитором биосинтеза холестерина, чем указанное известное соединение. Поставленная задача решается 3R,5S-(+)-7-[4-фторфенил)-2,6-диизопропил-5метоксиметилпирид-3-ил]-3,5-гептеновой кислотой формулы I в эритро-(E)-конфигурации в виде физиологически переносимой соли металла. Предпочтительными солями металла являются соли натрия, калия, магния или кальция. Предлагаемое соединение указанной формулы I получают путем взаимодействия рацемического сложного эфира формулы II где R1 - низший алкил или бензил, с(+) - энантиомерным амином формулы III где R2 - низший алкил, незамещенный или замещенный гидроксильной группы, R3 - атом водорода, атом галогена, низший алкил или низший алкоксил, разделения получаемой при этом смеси соответствующи х диастереомерных амидов формулы (IV) путем хроматографии или кристаллизации с получением желаемого диастереомера, который подвергают гидролизу до получения чистого энантиомера. Способ поясняется следующей схемой. Взаимодействие сложных эфиров формулы II с (+)-аминами формулы III обычно осуществляют в среде инертного растворителя. При этом в качестве растворителя можно использовать те органические растворители, которые обычно используют при амидировании. Предпочтительно используют простые эфиры, например, простой диэтиловый эфир, диоксан или тетрагидрофуран, или хлорированные углеводороды, например, метиленхлорид или хлороформ, или диметилформамид. Особенно предпочтительно, однако, соответствующий амин формулы III используют в избытке, в случае необходимости, в среде тетрагидрофурана или диоксана в качестве растворителя. Взаимодействие обычно осуществляют при 0°C - 100°C, предпочтительно 20 80°C, и атмосферном давлении. Однако возможно также осуществление гидролиза при пониженном или повышенном давлении. При осуществлении взаимодействия оказалось выгодным использование амина или в качестве растворителя в особенно большом избытке, или, при использовании дальнейшего растворителя, в избытке до 10 раз. Гидролиз диастереомерных амидов формулы IV осуществляют обычными методами, например, путем обработки амидов основаниями или кислотами в среде инертного растворителя. При этом в качестве инертного растворителя можно использовать воду и/или органические растворители. В качестве органических растворителей предпочтительно используют спирты, например, метанол, этанол, пропанол или изопропанол, или простой эфир, например, простой диэтиловый эфир, диоксан или тетрагидрофуран. Особенно предпочтительно используют воду или смесь воды со спиртом. Для осуществления гидролиза можно использовать неорганические или органические кислоты. Предпочтительно используют соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфокислоту или толуолсульфокислоту. В качестве основания для гидролиза амидов можно использовать обычные неорганические основания, например гидроокись натрия или калия, метанолат или этанолат натрия или калия или карбонат натрия или калия. В случае фенэтиламидов гидролиз предпочтительно осуществляют в этанольной соляной кислоте, а в случае фенилглицианоамидов - натровым щелоком, в случае необходимости, в присутствии спирта. Гидролиз диастереомерных амидов формулы IV осуществляют обычно при 0 150°C, предпочтительно 20 - 100°C, и атмосферном давлении. Однако возможно также осуществление гидролиза при пониженном или повышенном давлении. Кроме того, целевой продукт можно также получать путем разделения соответствующего рацемата известными методами хроматографии. Получение соединений формулы I иллюстрируется следующими примерами. Пример 1. Натриевая соль 3R,5S-(+)-эритро-(E)-7-[4-(4-фторфенил)-2,6диизопропил-6-метоксиметилпирид-3-ил]-3,5-диоксигепт-6-еновой кислоты 4,7г (10ммоль) сложного метилового эфира эритро-(E)-4-фторфенил)-2,6диизопропил-5-метоксиметилпирид-3-ил)-3,5-диоксигепт-6-еновой кислоты растворяют в 20мл Rмл R-(+)-фенилэтиламина и нагревают при 40°C в течение 72ч. Реакционный раствор выливают в 150мл воды и добавлением 1н. соляной кислоты раствор доводят до значения pH 4. Затем несколько раз экстрагируют простым диэтиловым эфиром. Объединенные органические экстракты промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и сгущают. После предварительной очистки путем хроматографии на силикагеле (величина зерен 63 - 200мкм, элюент: смесь сложного этилового эфира уксусной кислоты и петролейного эфира в объемном соотношении 4 : 6 до 6 : 4) разделяют путем хроматографии на силикагеле величины зерен 15мкм (элюент: смесь сложного этилового эфира уксусной кислоты и петролейного эфира в объемном соотношении 1 : 1). Выход: 2,1г (37,4% теории) диастереомера АI формулы и 1,5г (26,6% теории) диастереомера БI формулы 2,1г (3,7ммоль) диастереомера АI растворяют в 70мл 15% - ного этанола и после добавления 13мл 1н. соляной кислоты нагревают с обратным холодильником в течение 48ч. После охлаждения надосадочный раствор фильтруют и остаток несколько раз размешивают с этанолом. Объединенные этанольные растворы сгущают и остаток поглощают в 50мл воды и 50мл дихлорметана. Добавлением 1н. соляной кислоты раствор доводят до значения pH 3,5 и затем раствор несколько раз экстрагируют дихлорметаном. Объединенные органические растворы сушат над сульфатом натрия и сгущают. Остаток поглощают в 50мл смеси тетрагидрофурана и воды в соотношении 1 : 1, и добавлением 1н. натриевого щелока раствор доводят до значения pH 7,5. Тетрагидрофуран удаляют путем упаривания на ротационном испарителе, и остающийся водный раствор лиофилизуют. Сырой продукт лиофилизации очищают путем хроматографии на силикагеле (элюент: смесь ацетонитрила и воды в объемном соотношении 30 : 70). В результате сушки вымораживанием фракций получают 850г (48% теории) целевого продукта. 1 Р-ЯМР (DMCO-d 6): d (частей на миллион) = 1,0 (м, 1Н); 1,28 (д, 6Н); 1,3 (м, 1Н); 1,75 (дд, 1Н); 3,07 (с, 3Н); 3,2 - 3,4 (м, 3Н); 3,52 (м, 1Н); 4,02 (м, 2Н); 5,28 (дд, 1Н); 6,17 (д, 1Н); 7,1 - 7,3 (м, 4Н). Показатель вращения (этанола): [a]D20 =24,1° (C = 1,0). Вариант Б. 418г (0,88моль) сложного метилового эфира эритро-(E)-7-[4-(4-фторфенил)-2,6диизопропил-5-метоксиметилпирид-3-ил]-3,5-диоксигепт-6-еновой кислоты и 360г (2,6моль) S-(+)-фенилглицинола растворяют в 1л абсолютного тетрагидрофурана и нагревают при температуре 50°C в течение 96ч. После охлаждения до комнатной температуры добавляют 1л воды, добавлением 5н. соляной кислоты раствор доводят до значения pH 4, и трижды экстрагируют, каждый раз используя 400мл простого диэтилового эфира. Объединенные органические фазы промывают 400мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия и сгущают на ротационном испарителе. Остаток (500г сырого продукта) в двух порциях предварительно разделяют путем хроматографии на колонке, наполненной примерно 1,8кг силикагеля (элюент: смесь сложного этилового эфира уксусной кислоты и петролейного эфира в объемном соотношении 8 : 2). Получают 350г предварительно очищенного сырого продукта, почти исключительно состоящего из двух диастереомерных амидов. Предварительно очищенный сырой продукт в 7 порциях по 50г разделяют путем хроматографии на силикагеле величины зерен 20мкм (колонка длиной 63см и диаметром 7см). Выход 195 (38,2% теории) диастереомера А2 формулы не выделяют в чистом виде, однако, его получают в качестве сырого продукта при промывке колонок. 195г (0,34моль) чистого диастереомера А2 растворяют в 1л этанола и после добавления 1,2л 1н. натрового щелока нагревают с обратным холодильником в течение ночи. После охлаждения до комнатной температуры надосадочный раствор удаляют декантированием, и масляный остаток трижды размешивают с этанолом, каждый раз используя 50мл этанола. Растворы объединяют и сгущают, и остаток поглощают в 500мл воды и 500мл метиленхлорида. Добавлением 1н. соляной кислоты раствор доводят до значения pH 3,5, и затем органическую фаз у удаляют, и водную фазу трижды экстрагируют метиленхлоридом, каждый раз используя 400мл метиленхлорида. Объединенные органические фазы сушат над сульфатом натрия и сгущают. Оста ток поглощают в 100мл тетрагидрофурана, и раствор разбавляют добавлением 500мл воды. Добавлением 1н. натрового щелока раствор доводят до значения pH 7,5, тетрагидрофуран удаляют путем упаривания на ротационном испарителе, и остающийся водный раствор лиофилизуют. Получают 142г сырого продукта лиофилизации, который с целью обессоливания в 27 порциях по 5г и 2 порциях по 3,5г дальше очищают и обессоливают путем хроматографии на силикагеле величиной зерен 30мкм (колонка длиной 40см и диаметром 3см, элюент: смесь ацетонитрила и воды в объемном соотношении 30 : 70). Все фракции объединяют, ацетонитрил упаривают на ротационном испарителе и водный остаток подвергают лиофилизации. Выход 102г (62,5% теории) целевого продукта, имеющего ту же характеристику, что и целевой продукт, полученный по варианту А. Как уже указывалось, предлагаемое соединение проявляет намного лучшую активность в качестве ингибитора биосинтеза холестерина, чем известное рацемическое соединение формулы Для оценки данной активности определяют способность соединений к торможению редуктазы 3-окси-3-метилглутарилсоэнзима А следующим образом. Самцов крыс массой 300 - 400г в течение 11 дней кормили порошковым кормом типа альтромина, содержащим 40г холестирамина на кг корма. Животным отрезали голову, затем удаляли почки, которые подали на лед. Почки измельчали и трижды гомогенизировали в 3 объемных частя х буфера с pH 7,2, содержащего 0,1молярную сахарозу, 0,05-молярный хлорид калия, 0,04-молярный бифосфат калия (смеси K2HPO4 и KH2PO4), 0,03-молярную этилендиаминтетрауксусную кислоту, 0,002-молярный дитиотреит. Затем подвергали центрифугированию в течение 15мин и остаток удаляли. Надосадочную жидкость центрифугировали в течение 75мин при 100000g. Осадок поглощали в 1/4 части указанного буфера, повторно гомогенизировали и затем опять центрифугировали в течение 60мин. Осадок поглощали в пятикратном объеме указанного буфера, гомогенизировали и для хранения замораживали при -78°C. Для определения активности исследуемые соединения и стандартное вещество мевинолин растворяли в диметилформамиде при давлении 5об.% 1н. гидроокиси натрия и для осуществления опыта использовали по 10мкл раствора, содержащего каждое вещество в разных концентрациях. Сперва соединения инкубировали вместе с энзимом при 37°C в течение 20мин. Для осуществления опыта использовали смесь в количестве 0,380мл, содержащую 4мкмоль глюкоза-6фосфа та, 1,1мг альбумина сыворотки крупного рогатого скота, 2,1мкмоль дитиотреита, 0,35мкмоль b-никотинаминадениндинуклеотидфосфата, 1 единицу глюкоза-6-фосфатдегидрогеназы, 35мкмоль указанной смеси бифосфатов калия со значением pH 7,2, 20мкл препарата энзима и 56нмоль 3-окси-3-метилглутарил соэнзима A (глутарил-3-14C) с удельной активностью 100000 распадов в минуту. Инкубировали в течение 60мин при 37°C. Затем реакцию заканчивали добавлением 300мкл 0,25-молярной соляной кислоты. По окончании дополнительной инкубации в течение 60мин при 37°C центрифугировали, и 600мкл надосадочной жидкости подают на колонку размером 0,7 ´ 4см, наполненную 5хлориданионитом величиной зерен 100 - 200меш. Дополнительно промывали 2мл дистиллированной воды, к продукту очистки и промывочной воде добавляли 3мл сцинтилляционной жидкости и считывали в сцинтилляционном счетчике. Величины КТ50 (концентрация вещества, обеспечивающая 50% - ное торможение) определяли с помощью интраполяции на основе торможения в % и концентрации соединения. Для определения относительной ингибирующей активности величину КТ50 стандартного вещества мевинолина взяли за 100 и сравнивали с одновременно определяемой величиной КТ50 обоих исследуемых соединений. Таким образом определяли относительную активность обоих исследуемых соединений по сравнению со стандартным веществом, относительная активность которого равна 1. В результате данного опыта выявлено, что относительная активность предлагаемого соединения составляет 110, тогда как известное соединение проявляет относительную активность, равную 30. С учетом результатов описанного опыта рекомендуется давать предлагаемое соединение в количестве 0,1мкг/кг массы тела.
ДивитисяДодаткова інформація
Автори англійськоюAngerbauer Rolf, Fey Peter Dr, Huebsch Walter, PHILIPS Thomas, Bischoff Chilmar, Petzinna Dieter, Schmidt Delf, Thomas Gunter
Автори російськоюАнгербауэр Рольф, Фай Петер, Хюбш Вальтер, ФИЛИПС Томас, Бишофф Хильмар, Петцинна Дитер, Шмидт Дельф, Томас Гюнтер
МПК / Мітки
МПК: C07D 213/55
Мітки: біосинтезу, інгібітор, холестерину, 3r,5s-(+)-7-[4-(4-фторфеніл)-2,6-діізопропіл-5-метоксиметилпірид-3-іл]-3,5-дигідроксигептенова, кислота
Код посилання
<a href="https://ua.patents.su/7-26428-3r5s-7-4-4-ftorfenil-26-diizopropil-5-metoksimetilpirid-3-il-35-digidroksigeptenova-kislota-yak-ingibitor-biosintezu-kholesterinu.html" target="_blank" rel="follow" title="База патентів України">3r,5s-(+)-7-[4-(4-фторфеніл)-2,6-діізопропіл-5-метоксиметилпірид-3-іл]-3,5-дигідроксигептенова кислота як інгібітор біосинтезу холестерину</a>
Попередній патент: Піридил-або піримідилвмісні похідні піперазину або 1,4-діазациклогептану, або їх фармакологічно активні кислотно-адитивні солі, що мають психотропну дію
Наступний патент: Пристрій для скріплення залізничної рейки на підрейковій опорі
Випадковий патент: Машина для контактного стикового зварювання