Фармацевтична композиція, що містить як активний компонент похідне циклоспорину
Номер патенту: 34454
Опубліковано: 15.03.2001
Автори: Ріхтер Фрідріх, ФОНДЕРШЕР Джекі Френсіс, МАЙЗЕР Армін
Текст
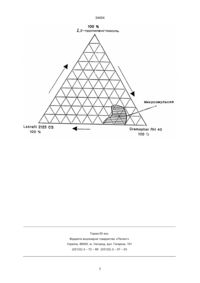
1. Фармацевтическая композиция, включающая в качестве активного компонента производное циклоспорина и в качестве среды-носителя – трансэтерифицированное этоксилированное растительное масло, отличающаяся тем, что в качестве производного циклоспорина она содержит [3'-deзокси-3'-оксо-MeBmt]1-[Val]2 - Циклоспорин, среда-носитель содержит дополнительно гидрофильную фазу и поверхностно-активное вещество, а указанная фармацевтическая композиция находится в форме микроэмульсионного концентрата, предшествующего микроэмульсии и обеспечивающего образование микроэмульсии типа масло в воде. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что она содержит трансэтерифицированное этоксилированное растительное масло в количестве от 10 до 85 мас. % от массы среды-носителя, поверхностно-активное вещество в количестве от 5 до 80 мас. % от массы среды-носителя и гидрофильную фазу в количестве от 10 до 50 мас. % от массы среды-носителя. 3. Фармацевтическая композиция по п.2, отличающаяся тем, что она содержит трансэтерифицированное этоксилированное растительное масло в количестве от 15 до 70 мас. % от массы среды-носителя, поверхностно-активное вещество в количестве от 10 до 70 мас. % от массы сре C2 (54) ФАРМАЦЕВТИЧНА КОМПОЗИЦIЯ, ЩО МIСТИТЬ ЯК АКТИВНИЙ КОМПОНЕНТ ПОХIДНЕ ЦИКЛОСПОРИНУ 34454 Настоящее изобретение касается фармацевтического состава, имеющего в качестве активной составляющей производное циклоспорина, которое применяется при лечении синдрома множественной лекарственной устойчивости. В частности данное изобретение относится к фармацевтическому составу, который содержит в качестве активного ингредиента [3'-дезокси-3'-оксоMeBmt]1-[Val]2-Циклоспорин. Устойчивость опухолевых клеток к химиотерапевтическим препаратам является основной причиной неудач химиотерапии. Одной из форм устойчивости к химиотерапевтическим препаратам является "множественная лекарственная устойчивость", когда опухолевые клетки становятся полностью невосприимчивыми к большинству химиотерапевтических препаратов, таких как: алкалоиды, антрациклины, актиномиксин-D, адриамицин и колхицин. Синдром множественной лекарственной устойчивости во многих работах связывали с чрезмерной выраженностью трансмембранных гликопротеинов, называемых Р-гликопротеинами (Рgр). Было отмечено, что циклоспорины устраняют синдром множественной лекарственной устойчивости, в частности эффективным оказался [3'-дезокси-3'-оксо-MeBmt]1[Val]2-Циклоспорин [1]. Циклоспорины составляют класс структурно обособленных, циклических поли-N-метилированных ундекапептидов, в большинстве случаев обладающих фармацевтической, в частности, иммуносупрессивной, противовоспалительной и/или антипаразитной активностью, в большей или меньшей степени. Циклоспорины в основном совершенно нерастворимы в воде. Следовательно, проблемы возникают в разработке фармацевтически приемлемого носителя, который бы позволил доставить лекарство в достаточно высокой концентрации для его удобного применения и который позволил бы эффективную и стойкую абсорбцию лекарства организмом. Отдельные циклоспорины также представляют очень специфичные проблемы в отношении их введения, в частности при применении галеновых форм. Ряд специфических проблем также возникает в связи с биологической пригодностью лекарств и разнообразием в реакциях пациентов на дозы. Это относится и к соединению [3'-дезокси-3'-окco-MeBmt]1 -[Val]2-Циклоспорин , это вещество приводит к определенным трудностям при применении содержащих его галеновых форм. Что касается общих проблем лекарственных форм циклоспоринов, известны [2] галеновые формы, содержащие циклоспорины, которые представляют собой микроэмульсии или микроэмульсионные преконцентраты. Эти формы состоят из гидрофильной, липофильной фаз и поверхностно-активного вещества. Приводятся следующие компоненты гидрофильной фазы: транскутол, гликофурол и 1,2-пропиленгликоль. Отмечено, что цепочка триглицеридов жирных кислот средней длины подходит для липофильной фазы. Продукты реакции натуральные или гидрогенезированных растительных масел и этиленгликоля предлагаются как поверхностно-активные вещества. Однако не затронуты [2] пробле мы образования лекарственной формы [3'-дезокси-3'-оксо-MeBmt]1-[Val]2-Циклоспорина, который является более липофильным, чем большинство других циклоспоринов. Неожиданно было обнаружено, что могут быть получены устойчивые лекарственные формы, содержащие [3'-дезокси-3'-оксо-MeBmt]1[Val]2-Циклоспорин в качестве активного компонента, который имеет хорошую биологическую пригодность и хорошие характеристики вариабилности между пациентами. Таким образом, данное изобретение предлагает фармацевтическую композицию, которая в качестве активного ингредиента содержит [3'дезокси-3'-оксо-MeBmt]1-[Val]2-Циклоспорин, среду-носитель, включающую в себя (1) гидрофильную фазу, (2) трансэтерифицированное этоксилированное растительное масло и (3) поверхностно-активное вещество. Желательно, чтобы эта композиция была в форме микроэмульсии или в форме микроэмульсионного преконцентрата. Эта композиция обнаруживает неожиданно высокую биологическую пригодность (в два раза более высокую по сравнению с общепринятой формой Циклоспорина) и, следовательно, доза [3'-дезокси-3'-оксо-MeBmt]1-[Val]2-Циклоспорина, которую требуется принять, может быть уменьшена. Композиция также удобна для использования и обеспечивает эффективную и стойкую абсорбцию [3'-дезокси-3'-оксо-MeBmt]1-[Val]2-Циклоспорина организмом. Композиция в частности эффективна при лечении синдрома множественной лекарственной устойчивости, например, у онкологических больных, подвергшихся химиотерапии. Предпочтительно, чтобы композиция была в форме "микроэмульсионного преконцентрата", в частности в виде микроэмульсии o/w (масло в воде). Однако, композиция может быть и в форме микроэмульсии, которая дополнительно содержит и водную фазу, лучше всего воду. "Микроэмульсионный преконцентрат", обозначает в данном описании лекарственную форму, которая спонтанно образует микроэмульсию в водной среде, например в воде, или в желудочном соке после перорального приема лекарства. Составление такой микроэмульсии желательно для решения вышеуказанных проблем. "Микроэмульсия" является неопалесцирующей или несущественно опалесцирующей коллоидной дисперсией, которая образуется спонтанно или по большей части спонтанно, когда ее компоненты приходят в соприкосновение. Микроэмульсия термодинамически стабильна и содержит дисперсные частицы размером менее, чем 2000 Ǻ. Обычно микроэмульсия состоит из капелек или частиц, имеющих диаметр менее, чем 1500 Ǻ; чаще всего от 100 до 1000 Ǻ. Более подробную характеристику можно найти в [2]. "Фармацевтическая композиция" представляет собой композицию, в которой отдельные компоненты или ингредиенты сами по себе являются фармацевтически приемлемыми и, если предусматривается особая форма применения, они пригодны или приемлемы для такой формы применения. 2 34454 Трансэтерифицированное этоксилированное растительное масло может составлять от 10 до 85 % от веса среды-носителя; предпочтительно от 15 до 70% веса, более предпочтительно от 20 до 60% и еще более предпочтительно приблизительно 20% от веса. Поверхностно-активное вещество составляет от 5 до 80% от веса среды-носителя; предпочтительно от 10 до 70% от веса, более предпочтительно от 20 до 60% от веса и еще более предпочтительно около 60% от веса. Гидрофильная фаза может составлять от 10 до 50% от веса среды-носителя; предпочтительно от 15 до 40% от веса, более предпочтительно от 20 до 30% от веса и еще более предпочтительно около 20% от веса. Гидрофильная фаза может быть выбрана из транскутола (который имеет формулу C2H5-[О(CH2)2]2-ОН), гликофурола (известного также как тетрагидрофурфурилового спирта полиэтиленгликолевый эфир) и 1,2-пропиленгликоля или смеси их, но предпочтительнее всего 1,2-пропиленгликоль. Гидрофильная фаза может кроме того включать гидрофильные со-компоненты, как например этиловый спирт. Эти со-компоненты присутствуют в основном при частичном замещении других компонентов гидрофильной фазы. Хотя использование этилового спирта в композициях не является существенным, замечено, что это имеет преимущества, когда композиция готовится на мягком желатине (инкапсулированная форма). Из-за этого улучшаются свойства хранения, в частности уменьшается риск выпадения в осадок циклоспорина в результате инкапсуляции. Таким образом, стабильность при нахождении в оболочке может быть продлена при применении этанола или какого-либо другого со-компонента в качестве добавочного компонента гидрофильной фазы. Этанол может составлять от 0 до 60% веса гидрофильной фазы; предпочтительно от 20 до 55% веса и еще более предпочтительно около 55% веса. Желательно, чтобы активный ингредиент составлял от 5 до 15% веса композиции; еще лучше около 10%. Подходящее трансэтерифицированное этоксилированное растительное масло может быть получено при реакции различных природных растительных масел (например: маисового, орехового, миндального, арахисового, оливкового, соевого, подсолнечного, сафлорового, пальмового масла или их смеси) с полиэтиленгликолем, который имеет средний молекулярный вес от 200 до 800, в присутствии соответствующего катализатора. Эти способы известны [3] и описаны примеры. Трансэтерифицированное этоксилированное кукурузное масло особенно пригодно для этого. Наиболее известны и коммерчески доступны трансэтерифицированные этоксилированные растительные масла под торговым названием Labrafil [4] . Примерами являются Labrafil M 2125 CS (полученный из кукурузного масла и имеющий кислотное число менее, чем около 2, число омыления от 155 до 175, величину HLB от 3 до 4 и иодное число от 90 до 110) и Labrafil М 194 CS (полученный из орехового масла и имеющий кис лотное число около 2, число омыления от 145 до 175 и иодное число от 60 до 90). Может быть также использован Labrafil М 2130 CS (который является продуктом этерификации C12-18 глицерида и полиэтиленгликоля и имеет температуру плавления от 35 до 40°С, кислотное число менее, чем около 2, число омыления от 185 до 200 и иодное число менее, чем 3). Предпочтительно использовать трансэтерифицированное этоксилированное растительное масло Labrafil М 2125 CS, который может быть получен из Gattefossé, SaintPriest Cedek, France. Поверхностно-активное вещество может состоять из продуктов реакции натурального или гидрогенезированного касторового масла и окиси этилена. Натуральное или гидрогенезированное касторовое масло может вступать в реакцию с окисью этилена в молярных отношениях в диапазоне от 1:35 до 1:00; с возможным удалением компонента полиэтиленгликоля из продуктов реакции. Коммерчески доступны такие различные поверхностно-активные вещества. Особенно подходит полиэтиленгликоль-гидрогенезированное касторовое масло, известное под торговым названием Cremophor. Особенно подходит Cremophor RH 40, который имеет число омыления от 50 до 60, кислотное число менее, чем около 1, содержание воды по Фишеру менее, чем 60 около 2%, nD от 1,453 до 1,457 и HLB от 14 до 16; Cremophor RH60, который имеет число омыления от 40 до 50, кислотное число менее, чем 1, иодное число менее, чем около 1, содер25 жание воды по Фишеру от 4,5 до 5,5%, nD от 1,453 до 1,457 и HLB от 15 до 17; и Cremophor EL, который имеет молекулярный вес около 1630 (по паровой осмометрии), число омыления от 65 до 70, кислотное число около 2, иодное число от 25 28 до 32 и nD около 1,471. Могут быть также использованы подобные или идентичные продукты под торговым названием Nikkol (например НСО-40 и НСО-60), Мареg (например Мареg CO-40h), Incorocas (например Incorocas 40) и Tagat (например Tagat RH 40). Эти поверхностно-активные вещества также описаны [4]. Поверхностно-активные вещества могут быть также выбраны из эфиров полиоксиэтилен сорбитановых жирных кислот, таких как моно- и три-лаурил, пальмитил-, стеарил- и олеил эфиры. Примерами имеющихся в продаже эфиров являются эфиры, известные под торговым названием Tween ([4], стр. 1300-1304), в частности Tween-60 (полиоксиэтилен(20) сорбитанмоностеарат) и Tween-80 (полиоксиэтилен(20) сорбитаинмоноолеат). Лучше всего использовать в качестве поверхностно-активного вещества Cremophor RH 40. Композиции также могут включать в себя другие добавки и ингредиенты, например антиоксиданты (такие как оскорбил пальмитат, бутил гидрокси анизол (ВНА), бутил гидрокси толуол (ВНТ) и токоферолы) и/или консервирующие вещества. Эти добавки или ингредиенты могут составлять от 0,05 до 1% от общего веса компо 3 34454 зиции. Композиции могут также включать подслащивающие или ароматизирующие вещества в количестве до 2,5 или 5% веса композиции. Наиболее подходящим антиоксидантом является aтокоферол (витамин Е) . Композиции проявляют особенно полезные свойства при пероральном применении; например в отношении консистенции и высокого уровня биологической применимости, полученных при стандартных испытаниях. Эти испытания выполнены на здоровых людях с использованием неспецифичес-моноклонального набора для определения уровня [3'-дезокси-3'-оксо-MeBmt]1-[Val]2Циклоспорина. Результаты показали, что может быть получена по меньшей мере на 170% более высокая переносимость у млекопитающих и примерно на 200% выше у людей (по сравнению с имеющейся в продаже пероральной формой Циклоспорина). Это означает, что дозировка, которая должна быть применена, может быть уменьшена по сравнению с имеющейся в продаже пероральной формой. Эти композиции также обладают способностью меньше взаимодействовать с пищей, чем имеющаяся в продаже пероральная форма Циклоспорина; особенно с пищей, богатой жиром. Более того, при применении данных композиций изменения фармакокинетических параметров в субъекте и у разных субъектов могут быть значительно ниже, чем у имеющихся в продаже пероральных форм Циклоспорина. Особенно могут быть уменьшены различия между фармакокинетическими параметрами при приеме пищи и без приема пищи, или даже между дневным и ночным временем абсорбции. Таким образом, фармакокинетические параметры, например абсорбция и показатели крови становятся на удивление более предсказуемыми и проблемы в назначении с ошибочной абсорбцией могут быть ограничены или уменьшены. Кроме того композиция совместима с тенсидными материалами, например с желчными солями, которые присутствуют в желудочно-кишечном тракте. То есть композиция полностью дисперсна в водной системе, содержащей такие натуральные тенсиды и способна, таким образом, создавать микроэмульсионные системы in situ (непосредственно на месте применения), которые стабильны и не дают преципитации активного ингредиента или другого нарушения тонкой структуры. Функция композиции при пероральном назначении остается в значительной степени независимой и/или неизменной при присутствии или отсутствии желчных солей в какой-либо промежуток времени или для какого-либо человека. Композиции составляют предпочтительно в штучной дозированной форме, например заключая их в оболочки капсул для перорального применения. Капсульные оболочки могут быть мягкими или твердыми желатиновыми оболочками. Если композиции приготавливают в виде штучных дозированных форм, каждая штучная доза должна содержать от 10 до 200 мг 3'-дезокси-3'-оксоMeBmt]1-[Val]2-Циклоспорина, более предпочтителен в дозировках между 10 и 150 мг; например 15, 20, 25, 50 или 100 мг [3'-дезокси-3'-оксоМеBmt]1-[Val]2-Циклоспорина. Такие штучные до зированные формы пригодны для применения от 1 до 5 раз в день в зависимости от особых терапевтических задач, фазы лечения и т.п. Однако, если требуется, композиция может быть приготовлена в виде питьевого раствора и включать в себя воду или другую водную систему, чтобы микроэмульсионная система была пригодна для питья. Полезность композиций можно наблюдать в стандартных клинических тестах [1] при использовании доз от 200 до 1800 мг в день на 75 кг для взрослых и в стандартных тестах на животных. Возросшую биологическую пригодность активного ингредиента, обеспечиваемую такой композицией, можно наблюдать в стандартных тестах на животных как это описано на примере 13 и в клинических испытаниях . Оптимальная доза, которая назначается отдельному больному, должна быть тщательно рассчитана лечащим врачом по индивидуальной реакции, при этом метаболизм [3'-дезокси-3'-окco-MeBmt]1-[Val]2 -Циклоспорин может варьировать. Желательно проверять величины циклоспорина в сыворотке крови радиоиммунным анализом, анализом с моноклональными антителами или другими соответствующими стандартными средствами. Дозы [3'-дезокси-3'-оксиMeBmt]1-[Val]2-Циклоспорин для лечения множественной лекарственной устойчивости в основном находятся в диапазоне от 200 мг до 1800 мг в день для взрослого человека 75 кг весом, предпочтительно 300-1500 мг, при оптимальной суточной дозе около 500 мг. Удовлетворительные результаты получены при назначении около 500 мг в день в форме пяти капсул, содержащих каждая по 100 мг или десяти капсул по 50 мг каждая. Кроме того, изобретение также включает в себя способ приготовления фармацевтической композиции, которая описана выше, что включает в себя доставку (1) гидрофильной фазы, (2) трансэтерифицированного этоксилированного растительного масла и (3) поверхностно-активного вещества в однородной смеси в соответствующих пропорциях компонентов (1), (2) и (3) и добавление активного ингредиента. Если необходимо, композиция может быть выполнена в виде единичной дозированной формы, например, в виде желатиновых капсул, наполненных композицией. В некоторых случаях дополнительные компоненты или добавки, в частности, со-компоненты гидрофильной фазы, например, этанол, могут быть смешаны с компонентами (1), (2) и (3) при добавлении или после добавления активного ингредиента. В композицию может быть добавлено достаточное количество воды или водного разбавителя для получения микроэмульсии. Реализация изобретения описана только в виде примера со сылкой на рисунок. На чертеже показаны графически три направления изменения концентраций наиболее пригодных компонентов среды-носителя, которые дают микроэмульсионные преконцентраты при постоянной концентрации активного ингредиента равной 10% и этанола - 15%. Лекарствен 4 34454 ные формы, обозначенные внутри заштрихованной зоны, спонтанно образуют микроэмульсии в водной среде. Лекарственные формы, попадающие за пределы заштрихованной зоны, образуют другие дисперсные системы в водной среде, например, эмульсии. Следующие примеры иллюстрируют некоторые предпочтительные формы изобретения. Таблица 1: Примеры 1-4 Ингредиенты/Примеры 1 2 3 4 Активный ингредиент 100 мг 100 мг 100 мг 100 мг Абсолютный этанол 105 мг 150 мг 100 мг 150 мг Labrafil М 2125 CS 150 мг 150 мг 640 мг 150 мг 1,2-пропиленгликоль 95 мг 75 мг 80 мг 150 мг Cremophor RH 40 525 мг 525 мг 80 мг 450 мг 1 мг 1 мг 1 мг 1 мг 1001 мг 1001 мг 1001 мг 1001 мг a -токоферол Tween-80 Всего Таблица 2: Примеры 5-8 Ингредиенты/Примеры 5 6 7 8 Активный ингредиент 100 мг 100 мг 100 мг 100 мг Абсолютный этанол 100 мг 100 мг 100 мг 100 мг Labrafil М 2125 CS 160 мг 240 мг 160 мг 320 мг 1,2 пропиленгликоль 80 мг 80 мг 160 мг 80 мг Cremophor RH-40 560 мг 480 мг 480 мг 400 мг 1 мг 1 мг 1 мг 1 мг 1001 мг 1001 мг 1001 мг 1001 мг a -токоферол Tween-80 Всего Таблица З: Примеры 9-12 Ингредиент/Примеры 9 10 11 12 Активный ингредиент 100 мг 100 мг 100 мг 100 мг Абсолютный этанол 100 мг 100 мг 100 мг 100 мг Labrafil М 2125 CS 160 мг 240 мг 480 мг 560 мг 1,2-пропиленгликоль 160 мг 160 мг 160 мг 80 мг Cremophor RH-40 1 мг 1 мг 1 мг 1 мг Tween-80 480 мг 400 мг 160 мг 80 мг Всего 1001 мг 1001 мг 1001 мг 1001 мг a-токоферол Для приготовления композиции тщательно смешивают Labrafil М 2125 CS, Cremophor RH 40 (или Tween) и полипропиленгликоль, а затем дегазируют. Затем суспендируют в смесь [3'-дезокси-3'-окco-MeBmt]1 - [Val]2-Циклоспорин и снова дегазируют. Затем к смеси добавляют этанол. PEG(полиэтиленгликоль)-гидрогенезированное касторовое масло возможно необходимо слабо подогреть (т.е. приблизительно до 30°С), пока оно не станет прозрачной жидкостью. Полученная композиция пригодна для перорального при менения как питьевой раствор или в мягких желатиновых капсулах, содержащих мерное количество, например 1 мл композиции. Композиции набивают в капсулы и запечатывают с помощью Quali-Seal оборудования. Стабильность Капсулы упаковывают в двухстороннюю алюминиевую упаковку и хранят при 5°С, 25°С (при 50% влажности) и 30°С (при 65% влажности). Капсулы проверяются после 6 и 12 месяцев. Никаких изменений внешнего вида и содержи 5 34454 мого капсул не наблюдается. Следовательно капсулы очень стабильны. Образец 13: Биологическая пригодность для собак. Биофармацевтические свойства композиции примера 1 сравниваются с имеющимся в продаже Циклоспорином ( Ciclosporin) в мягких желатиновых капсулах. Эги формы сравнивают после перорального применения 7 собакам самцам гончей породы при ' перекрестных назначениях. Фармакокинетический профиль активного ингредиента определяли в цельной крови на протяжении 24 часов. Определялась площадь под кривой концентрации крови в зависимости от времени (AUC), Сmах и Tmax. Использовали дозы активного ингредиента от 50 мг до 350 мг; у 2 собак по 50 мг и у 5 собак по 350 мг. Композиция X (коммерческая форма, мягкая желатиновая капсула) Ciclosporin 11% веса Labrafil 32% веса Этанол 11% веса Кукурузное масло 46% веса Введение лекарства: В опыте использовали 7 собак самцов гончей породы весом около 12 кг каждая. За 20 ч до приема лекарства пищу убирали, но животным позволяли свободно подходить к воде вплоть до начала эксперимента. Дозы вводили животным через зонд, рано утром (приблизительно в 8.00), с последующим применением 20 мл 0,9%-го раствора NaCI. В течение трех часов после приема лекарства животным снова разрешали свободно подходить к воде и пище. Между 2 введениями лекарства одному и тому же животному необходим перерыв в одну неделю . Анализ крови: Пробы крови в количестве 2 мл (или 5 мл для холостой пробы) брали из головной вены (или из вены передней конечности) стерильной иглой (диаметр около 1,2 мм) в 5 мл пластмассовую пробирку, содержащую ЕДТА. Пробы брали перед введением лекарства и через 15 минут, 30 минут, 45 минут, через 1 час, 1,5 часа, 2 часа, 3 часа, 4 часа, 6 часов, 8 часов, 12 часов и 24 часа после перорального приема лекарства. Пробы крови хранят при -20°С пока не закончится испытание лекарства. Пробы крови анализируются неспецифическим радиоиммунологическим методом (RA). Площади под кривыми концентрации лекарства в крови в зависимости от времени (AUC) рассчитывали по правилу трапеции. Выполнен анализ отклонений(CV), значения AUC, Сmах и Тmах сравнивали статически по тесту Tukey. Полученные результаты показаны в следующей таблице. Таблица 4 AUC, Cmax и Тmах в исследованиях на собаках Образец Доза AUC Cmax Tmаx (мг) (0-24 час) (нг/мл ) (час) X 350 10851 1299 2,00 X 50 1926 477 1 ,25 1 350 18040 2092 1 ,00 1 50 4139 602 1 ,25 Заключение: Композиция примера 1 имеет значительно более высокую биологическую пригодность (фактор 1.7 при дозе 350 мг и фактор 2.1 при дозе 50 мг), чем коммерческая (мягкие желатиновые капсулы Циклоспорина). Литература: 1. Публикации Европейского патента № 296122. 2. Заявка на английский патент 2222770 А. 3. Патент США 3288824. 4. H.Fiedler, Lexikon der Hilfsstoffe, 3rd edition, val 2, page 707, pp. 1300-1304. 6 34454 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 7
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition containing cyclosporin derivative as an active ingredient
Автори англійськоюMEINZER ARMIN, RICHTER FRIEDRICH, VONDERSCHER JACKY FRANCIS
Назва патенту російськоюФармацевтическая композиция, которая содержит как активный компонент производное циклоспорина
Автори російськоюМайзер Армин, Рихтер Фридрих, Фондэршер Джеки Френсис
МПК / Мітки
МПК: A61K 9/107, A61K 38/08
Мітки: активний, похідне, містить, компонент, циклоспорину, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/7-34454-farmacevtichna-kompoziciya-shho-mistit-yak-aktivnijj-komponent-pokhidne-ciklosporinu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить як активний компонент похідне циклоспорину</a>
Попередній патент: Спосіб підвищення електричної стабільності міокарду
Наступний патент: Пептид, який має активність антагоніста бомбезину, фармацевтична композиція на його основі і спосіб лікування раку у ссавців
Випадковий патент: Заміщені бензоїлом фенілаланінаміди, способи їх одержання, проміжна сполука, гербіцидний засіб та спосіб боротьби з небажаним ростом рослин