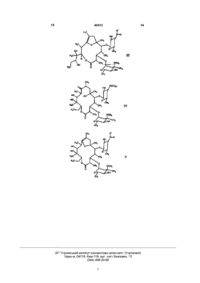
Похідні [(1’r),2r,3s,4s,5r,6r,9r,11r,12r,14r]-11-(1′-гідроксипропіл)-2,4,6,8,11,14-гексаметил-10,13,15-триоксатрицикло[9.2.1.1.9.6]пентадекан-1-ону, спосіб їх одержання та лікарські засоби, що містять ці сполуки
Номер патенту: 44310
Опубліковано: 15.02.2002
Автори: Фіннер Еміль, Екхоут Крістіан, Хьолтьє Дагмар, Пройшофф Улф
Формула / Реферат
1. Похідні [(1'R),2R,3S,4S,5R,6R,9R,11R,12R,14R]-11-(1'-гідроксипропіл)-2,4,6,8,11,14-гексаметил-10,13,15-триоксатрицикло[9.2.1.1.9.6]пентадекан-1-ону загальної формули (І):
де R1 означає метил або водень,
та їх стабільні та фізіологічно придатні солі.
2. Сполуки по п. (1), які відрізняються тим, що R1 означає метил.
3. Лікарський засіб, що містить фармакологічно ефективну кількість сполуки по п. 1 та звичайні фармацевтичні допоміжні речовини та/або носії.
4. Спосіб одержання похідних [(1'R),2R,3S,4S,5R,6R,9R,11R,12R,14R]-11-(1'-гідроксипропіл)-2,4,6,8,11,14-гексаметил-10,13,15-триоксатрицикло[9.2.1.1.9.6]пентадекан-1-ону загальної формули (І):
де R1 означає метил або водень,
та їх стабільні та фізіологічно придатні солі, які відрізняються тим, що похідні [2R(2'R,3'R),3S,4S,5R,6R,10R,11R]-11-(2',3'-дигідроксипент-2'-іл)-2,4,6,8,10-пентаметил-12,13-діоксадицикло[8.2.1]тридец-8-ен-1-ону загальної формули (II):
де R1 має вищевказане значення,
шляхом обробки кислотою переводять у сполуку формули (І) та, у випадку необхідності, у одержану сполуку формули (І), де R1 означає водень, вводять метильний залишок R1 або від одержаної сполуки формули (І), де R1 означає метил, відокремлюють метильний залишок R1, та, у випадку необхідності, вільні сполуки формули (І) переводять в їх стабільні солі або солі переводять у вільні сполуки формули (І).
Текст
ПОХІДНІ [(1'R),2R,3S,4S,5R,6R,9R,1R,12R, 4R] 11-(1'-пдроксипропіл)-2,4,6,8,11,14-гексаметил10,13,15-триоксатрицикло[9 2 1 1 96]пентадекан1-ону загальної формули (І) 1 R означає метил або водень, а їх стабільні та фізіологічно придатні солі, які відрізняються тим, нх СН(СН 3 ), що ПОХІДНІ [2R(2'R,3'R),3S,4S,5R, 6R,10R,11R]-11-(2',3l-flHriflpoKCHneHT-2l-in)-2,4,6,8, 10-пентаметил-12,13-дюксадицикло[8 2 1]тридец8-ен-1-ону загальної формули о нх О CO де R1 означає метил або водень, та їх стабільні та фізіологічно придатні солі 2 Сполуки по п (1), які відрізняються тим, що R1 означає метил 3 Лікарський засіб, що містить фармакологічно ефективну КІЛЬКІСТЬ сполуки по п 1 та звичайні фармацевтичні ДОПОМІЖНІ речовини та/або носи 4 Спосіб одержання похідних [(1'R),2R,3S,4S, 5R, 6R,9R,11R,12R,14R]-11-(1'-riflpoKCHnponin) - 2,4, 6,8,11,14 - гексаметил-10,13,15 - триоксатрицикло[9 2 1 1 96]пентадекан-1-ону загальної формули (І) Даний винахід стосується нових N-заміщених [(1'R), 2R, 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14R]-11 де R1 має вищевказане значення, шляхом обробки кислотою переводять у сполуку формули (І) та, у випадку необхідності, у одержану сполуку формули (І), де R1 означає водень, вводять метильний залишок R1 або від одержаної сполуки формули (І), де R1 означає метил, відокремлюють метильний залишок R1, та, у випадку необхідності, ВІЛЬНІ сполуки формули (І) переводять в їх стабільні солі або солі переводять у ВІЛЬНІ сполуки формули (І) (1'-пдроксипропіл)-3-[(2,6-дідезокси-3-С-метил-3О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[3,4,6-три 44310 дексози-3-аміно-[3-О-ксилогексопіранозіл)окси]2,4,6,8,11,14-гсксаметил-10,13,15-триоксацик96 ло[9 2 1 1 ]-пентадекан-1-онам з агонистичними мотилину властивостями та їх солям, а також до вміщуючих ці сполуки фармацевтичним композиціям та способу одержання цих сполук Запропоновані згідно винаходу сполуки становлять собою ПОХІДНІ І\І-дезметил-І\І-ізопропілспіроацеталя еритроміцину А з звуженим циклом Антібютік ерітроміцин А, як відомо, поряд з своїми антібіотичними діями має також небажану для антібіотіків шлукново-кішечну другорядну дію, у тому числі значне збільшення контракційної активності у шлукново-кішечній області з спазмами шлунку та кішечнику, нудоти, рвоти та діареї Було здійснено декілько спроб змінити ерітроміцин Атак, щоби одержати ПОХІДНІ, уякихантибітична дія практична відсутня, але, досягається дія, що впливає на рухливість шлукново-кішечного тракту 3 епропейської завки на патент 0550895 ВІДОМІ ПОХІДНІ г\І-дезметил-г\І-ізопропілеритроміцину А з звуженим циклом, що мають ефективні у відношенні шлукново-кішечного тракту, агонистичні мотиліну властивості В основу даного винаходу покладена задача одержання нових, перорально ефективних похідних ерітроміцину А з звученим циклом без антибіотичної дії та з такими, що надають задовільний вплив на рухливість шлукново-кішечного тракту властивостям під час покращеного профілю дії У даний час доведено, що нові ПОХІДНІ N-дезметил-ІЧ-ізопропіл-спіроацеталя еритроміцину А з звуженим циклом володіють селективними, агонистичними мотилину властивостями та стимулюють рухливість шлукново-кішечного тракту задовільним чином, а також діють зусилюючи тонус нижнього езофагусного сфінктеру та тонус шлунку Завдяки їх дії запропоновані згідно винаходу речовини придатні для лікування порушень рухливості у шлукново-кішечного тракту та при цьому відрізняються хорошою стабільністю Даний винахід таким чином стосується нових похідних [(1'R), 2R, 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14R|-11 -(1 '-п дроксипропіл)-2,4,6,8,11 14-гексаметил-10,13,15-триоксацикло-[9 2 1 1 9 ]-пентадекан1-она загальної формули (І) (див формулу (І)), де R' значить метил або водень, та їх стабільні та фізіологічно придатні солі В особливості задовільною є сполука формули (І), де R' значить метил Сполуки формули (І) можливо одержати тим, що відомим чином ПОХІДНІ [2R, (2'R, 3'R) 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14^-11-(2113'-діпдроксипект2'іл)-2,4,6,8,10-пентаметил-12,13-дюксабіцікло [8 2 1]тридец-8-ен-1-она загально формули (II) (див формулу (II)), де R' має вищенаведене значення, шляхом обробки кислотою переводять сполуки формули (І), де R1 за необхідності, в одержану сполуку формули (І), де R1 значить водень, вводять метильний залишок R1, або від одержаного сполучення формули (І), де R1 значить метил, відщеплюють залишок R , та, при необхідності, ВІЛЬНІ сполуки формули (І) переводять в їх стабільні солі або солі переводять у ВІЛЬНІ сполуки формули (І) Сполуки формули (І) одержують з сполук формули (II) шляхом каталізируємої протонами внутрімолекулярної спіроциклізацм Спіроліклізацію здійснюють відомим чином шляхом обробки кислотою, переважно, у водному середовищі, при низьких значення рН, наприклад, при значеннях рН саме більше 3, цілеспрямованіше при значення рН від 1,5 до З У якості кислот можливо одержувати інертні у відношенні до інших функціональних груп сполук формули (І) та формули (II) водорозчинені неорганічні та органічні кислоти Необхідно уникати зниження значення рН найде 1, щоби не відбувалися другорядні реакції гідролізу Придатними реакційними середовищами є, наприклад, водний розчин соляної кислоти або водний розчин оцетної кислоти, переважно, реакція циклізації відбувається у водному розчині соляної кислоти при кімнатній температурі Одержана сполука формули (І), де R1 значить водень, при необхідності, можливо додатково відомим чином алкілірувати з одержанням ВІДПОВІДНО N-метильноі сполуки Алкілірування можливо здійснювати відомим чином шляхом взаємодії з метилгалогенидом або як відновлювальне алкілірування шляхом взаємодії з формальдегідом у відновлювальних умовах та можливо проводити, наприклад, в умовах, що вказані для алкілірування сполук формули (III) Від сполуки формули (І), де R1 значить метил, додатково можливо відокремити, при необхідності, метильний залишок R1 Деметилірування можливо здійснювати відомим чином шляхом обробки сполуки галогенидом, в особливості йодом та/або бромом, в інертному розчиннику у присутності придатної основи У якості основ придатні, наприклад, алкоголяти лугового залізу, гідрооксиди лугових заліз та солі лугових заліз слабких органічних кислот Сполуки формули (І) можливо відомим чином виділяти з реакційної суміші та очищувати Солі приєднання кислоти звичайним чином можливо переводити відомим чином у фармакологічно придатні солі 3 метою запобіганні другорядних реакцій гідролізу необхідно використовувати для солезбирання тільки еквівалентні КІЛЬКОСТІ КИСЛОТ У ЯКОСТІ фармацевтично придатних солей сполук формули (І) придатні, наприклад, їх солі з неорганічними кислотами, як наприклад, вугільна кислота, галогенводяні кислоти, в особливості соляна кислота, або з органічними кислотами, як, наприклад, низші аліфатичні моно- або дікарбонові кислоти, як малеїнова, фумарова, молочна, винна або оцетна кислоти У випадку утворюючогося за рахунок реакції спіроціклізацм хірального центру, атому вуглероду у положенні 8, можуть получатися дві епімерні форми, так що можливі два ізоміри сполук формули (І), даний винахід включає суміш ізомерів, так і чисті ізомерні сполуки формули (І) Під час реакції циклізації утворюється суміш ізомерів Чисті ІЗОМІри з цієї суміші можливо виділяти відомим чином шляхом звичайних способів розділення, наприклад, шляхом хроматографічного розділення ВИХІДНІ сполуки формули (І) ВІДОМІ З ЕР-А-0 550895 та їх можливо одержати описаними там способами, так, сполуки формули (II) можливо 44310 одержати способом, у якому в сполуки загальної формули (III) (див формулу (III)), 1 де R має вищевказане значення, відомим чином вводять ізопропільний залишок Для введення ізопропільного залишку сполуки формули (III) можливо алікілірувати відомим чином, переважно, алкілірування здійснюють як відновлююче алкілірування відомим чином шляхом взаємодії сполук формули (III) з ацетоном у відновлюючих умовах, наприклад, сполуки формули (III) можливо вводити у взаємодію з ацетоном у присутності відновителя, як, наприклад, комплексна сполука гідриду бору, як натрійціаноборпдрід, натрійацетоксиборпдрід або натрійбропдрід За бажанням, алікілірування, у особливості тих сполук фор1 мули (III), де R значить метил, можливо здійснювати також шляхом взаємодії з ізолропілгалогенидом, особливо ізопропілюдідомабоїзопропіл сульфатом, або складним ефіром ізопропілсульфокислоти, сульфокислоти Необхідно алікілірування здійснювати в інертному в умовах реакції органічному розчиннику 3 метою алкілірування може служити у якості розчинника, наприклад, залишок ацетону Далі, у якості розчинника придатні також прості ЦИКЛІЧНІ ефіри, яктетрапдрофуран або діоксан, ароматичні вуглеводи, як толуол, або також низші спирти Алкілірування можливо проводити при температурах від кімнатної до температури кипіння розчинника Під час алкілірування за допомогою ізопропільного похідного, наприклад, ізопропілгалогениду, як ізопропілійдід, необхідно працювати у присутності основи, як наприклад, карбонатлугового заліза аботретичний органічний амін За бажанням, у одержану сполуку формули (II), де R1 значить водень, можливо вводити метильний залишок R1 або від одержаного сполучення формули (II), де R1 значить метил, можливо відомремити метильний залишок R1 Такого роду метилірування та деметилірування можливо здійснювати відомимчином, наприклад, в умовах, що описують для введення або відщеплення метальної групи у сполуках формули (І) Сполуки формули (III) можливо одержувати відомими способами, виходячи з ерггроміцину А формули (IV) (див формулу IV) Так ерітроміцин А спочатку відомим чином, наприклад, згідно способу DE-OS 2154032, можливо моно- або дідеметилірувати шляхом взаємодії з галогеном, переважно, з йодом, в інертному розчиннику у присутності придатної основи У якості основ придатні, наприклад, алкоголяти, гідроксиди та карбонатилугового заліза та солілугового заліза слабких карбонових кислот, як, наприклад, ацетати або припюнати лугового заліза Можливо використовувати від 1 до 10 еквівалентів галогену у розрахунку на КІЛЬКІСТЬ деметиліруемого ерітроміцину 3 метою монодеметилюнування у якості основ, переважно, використовують гідроксиди та/або солі лугового заліза КІЛЬКІСТЬ ОСНОВ, переважно, вибирають так, щоби забезпечувалося значення рН в області 5 - 9 У якості розчинників придатні метанол, прості ЦИКЛІЧНІ ефіри, як діоксан або тетрапдрофуран, діметилформамід або суміші вказаних розчинників з водою Монодеметилірування необхідно здійснювати при температурах від кімнатної до 50°С Реакцію можливо прискорювати шляхом опромінення свгглом, наприклад, свгглом з довжиною волни вище 290нм ртутної лампи низького тиску з фільтром з кварцу або жаростійкого скла (наприклад, марки Піркс ®) Дідеметилірування (видалення двох метальних)груп, переважно, здійснюють у абсолютному низшому спирті, наприклад, як метанол, у присутності ВІДПОВІДНОГО алкоголяту лугового заліза при температурах від 0 до 10°С За бажанням, для одержання дідеметиліруваного продукту можливо також виходити з вже монодеметиліруваного (з одною видаленою метальною групою) продукту Моно- або дідеметиліруваний ерітроміцин А відомим чином шляхом м'якої обробки кислотою можливо переводити у ВІДПОВІДНИЙ Mono- або дідеметиліруваний 8,9-анпдроерітроміцин-А-6,9-полукеталь загальної формули (V) (див формулу (V)), де R1 значить водень або метил Полукеталь можливо одержати, наприклад, шляхом обробки органічної кислоти, як лимонна, мурашкова або льодяна оцента кислота, або розбавленою неорганічною кислотою при температурах від кімнатної до приблизно 50С У сполуках формули (V) відомим чином шляхом внутрімолекулярної трансплантації можливо здійснювати вивчення 14-членноголактонового циклу ерггромізацм скелету до 12-членноголактонового кільця з утворенням ВІДПОВІДНИХ сполук формули (III) 3 цією метою сполуки формули (V) нагрівають відомим чином у низшому спирті у присутності основи, наприклад, при температурах від 40 до 70СА, переважно при температурі кипіння реакційної суміші У якості основи особливо придатні карбонати лугового заліза, також органічні основи, яктретичні аміни, особливо третичні низші алкіламіни При цьому зуження циклу конфігурації хіральних центрів не змінюється Нові сполуки формули (І) та їх фізіологічно придатні солі є такими, що становлять інтерес фармакологічними властивостями, в особливості агонистичними мотиліну, що стимулює рухливість шлунково-кішечного тракту властивостями При цьому вони характеризуються задовільним профілем дії з хорошою оральною активністю Вони не мають антибіотичної дії та володіють високим селективних родством з рецепторами мотиліну, утой час як в агонистичних ефективних мотиліну діапазонах доз не проявляють практично ніякого релевантного родства до інших рецепторів у шлунковокішечному тракті, як адреналінов, ацетилхолінів, пстаншні або серотонинові Сполуки характеризуються неочікувано хорошою переносимістю печінкою, що дозволяє їх застосовувати на протязі тривалого часу Для того, щоби забезпечити правильне переварювання спожитого харчу, у здоровому стані діють одночасно автономна нервова система тагормони шлунково-кішечного тракту, щоби створити правильну скорочувальність шлунково-кішечного тракту не тільки після прийому іжи, але і у випадку пустого шлунково-кішечного тракту Мотилін становить собою відомий шлунково-кішечний пептидний гормон, який стимулює рухливість шлунково 8 ру, 1,5% бичого сивороточного альбуміну, Юммоль хлориду магнію, рН = 8,0), разом з ЮОмкл йодируваного мотиліну, розбавленого у буферному розчині Б (Юммоль ТРИС-НСІ-буферу, 1% бичого смивороточного альбуміну, рН = 8) (кінцева концентрація 50пмоль), шкубують на протязі 60 хвилин при температурі ЗОС Реакцію шляхом додавання 3,2мл холодного буферного розчину Б, пов'язаний та незв'язаний мотилін відокремлюють один від другого шляхом центрифупрування у вигляді осаду, залишок промивають буферним розчином Б та підраховують число імпульсів у гам Maрахунку Вивчення витіснення здійснюють шляхом додавання збільшуючих кількостей досліджуємої речовини в інкубаційне середовище У якості розчинів досліджуємих речовин використовують водні розчини, котрі одержують шляхом придатної о розбавлення 60 х 10 -4М водних основних (вихідних) розчинів Важко розчинені у воді досліджуємі речовини спочатку розчиняють у 60%-ному етанолі, та цей розчин розбавлюють такою КІЛЬКІСТЮ ВОДИ, щоби у досліджуємому розчині концентрація етанолу не перевищувала 1,6 об'ємних % 3 одержаних результатів дослідження визначають концентрацію ІК50 відповідної тестуємої сполуки, котра викликає 50%-не подавления специфічного зв'язування йодируваного мотиліну з рецепторами мотиліну 3 цієї концентрації розраховують ВІДПОВІДНІ пІК500-значення Згідно даному методу, для речовини прикладу 1 визначають пІК50-значення, що рівне 7,85 44310 кішечного тракту та індукує рухливість у всьому шлунково-кішечному тракті натощак, а також після прийому їжі Сполуки формули (І) мають мотиліноподібну фізіологічну дію тим, що вони ефективні у якості агонистів для рецепторів мотилину Так, сполуки формули (І) діють значно вираженим стимулюючим впливом шлунково-кішечної області та у нижньому сфінктері харчоводу В особливості вони викликають прискорення звільнення шлунку, підвищення тонусу шлунка та тривале підвищення тонусу в покої езофагусного сфінектеру На основі свого мотилиноподібного профіля дії речовини придатні для лікування хвороб, котрі пов'язані з порушеннями рухливості шлунково-кішечному тракті та/або відтоком харчової кишиці з шлунку у харчовід Так, сполуки формули (І), наприклад, показані під час парезу шлунка різного походження, порушеннях тонусу шлунка, порушеннях звільнення шлунку тагастроезофагального відтоку, дісперсм та післяопераційних порушень рухливості Ефективні у відношенні шлунково-кішечного тракту властивості сполуки формули (І) можливо підтвердити фармакологічними стандартними методами досліджень in vitro і in vivo Опис методів дослідження 1 Визначення здатності досліджуємих сполук пов'язується з рецепторами мотиліну Родство сполуки формули (IU) до рецепторів мотиліну визначають in vitro під час використання фракції тканевогогомогенізату з порожними брюхами кролика Визначають витіснення радіактивно маркіруваного йодируваного мотиліну з зв'язку мотилін-рецегтгор досліджуємими сполуками Вивчення зв'язування рецептору здійснюють згідно модифікації метода Бормана та інш (Borman та інш , Regylatory Peptides, 15, 143 - 153 (1986) 3 метою одержання маркірування за допомогою 125 І-мотиліну, мотилін відомим чином, наприклад, аналогічно методу, що описаний Bloom та інш (Scand J Gastroenterol 11,47-52(1976)), ферментативне йодирують при використанні лактопероксидази З метою одержання використаної у тесті фракції гомогениїзату з порожнини брюха кролика вивільнену від слизистих оболонок порожнину пазухи змільчують та гомогенизують у десятикратному об'ємі холодного розчину буферу для гомогенізації (50ммоль ТРИС-НСІ-буфера, 250ммоль цукорози, 25ммоль хлориду калію, Юммоль хлориду магнію, рН = 7,4) з додатком інгібіторів йодоцетаміда, Імкмоль пепстатшу, 0,1ммоль метилсульфонилхлоріду, 0,1г/л інпбггору на протязі 15 секунд з числом оборотів 1500 у хвилину гомогенизат потім центрифугують на протязі 15 хвилин при ЮООд, одержаний залишок промивають чотирьохкратно розчином буферу для гомогенизацм та, насамкінець, знову суспендирують у 0,9%-ному розчині хлориду натрію (в об'ємі, що ВІДПОВІДНИЙ п'ятикратній масовій КІЛЬКОСТІ порожнини пазухи) Таким чином одержана тканева фракція, котра називається "сира мембранна композиція", використовується з метою дослідження Для дослідження назв'язування, 200мкл сирої мембранної фракції (0,5 - 1мг протишу) у 400мкл буферного розчину А (50ммоль ТРИС-НС1-буфе 2 Визначення in vivo впливу речовини на тонус шлунка Тонус шлунка грає важливу роль під час звільнення шлунку Підвищений тонус шлунка сприяє прискореному звільненню шлунку Вплив речовини на тонус шлунку визначають на гончих собаках за допомогою баростату, котрий, пов'язаний з пластиковим мешечком у шлунку собаки та дозволяє вимірювати об'єм та тиск у шлунку собаки За допомогою баростату визначають об'єм шлунку при постійному тиску у шлунку або тиск у шлунку при постійному об'ємі шлунка Під час підвищення тонусу шлунку при визначеному тиску встановлюють зменшений об'єм шлунку та підвищений тиск при визначеному об'ємі У тест-моделі, що використовується з метою дослідження тонусу шлунку, викликаєме речовинами, визначають вимірювання об'єму шлунку, що викликається речовинами, при постійному тиску Шлунок піддослідної тварини розслаблюється за рахунок отримання ЛІПІДІВ, тонус шлунку знижується, завдяки чому об'єм шлунку ВІДПОВІДНО збільшується У якості міри дії речовини, що підвищують тонус шлунку, вимірюють зменшення збільшеного за рахунок введення ЛІПІДІВ об'єма шлунку у %, викликаєме підвищенням тонусу шлунку після введення речовини У цій тест-моделі речовина прикладу 1 при максимально переносимій дозі викликає зменшення збільшеного після введення ЛІПІДІВ об'єму шлунку на 69% На основі свого впливу у шлунково-кішечному тракті сполуки формули (І) придатні у гастроентерологи у якості лікарського засобу для більш великих ссавців, особливо людей, для профілактики та лікування порушень рухливості шлунково-кішечно 44310 го тракту Використовані дози можуть бути індивідуально різноманггними та, таким чином, можуть змінюватись в залежності від роду стану, що треба вилікувати та форми введення Наприклад, парентерально вводимі лікарськи форми у загальному вміщують менше активної речовини, ніж орально вводимі препарати У загальному, для введення більш великим ссавцям, в особливості людям, придатні лікарськи форми з КІЛЬКІСТЮ активної речовини від 1 до ЮОмг на одну дозу У якості лікарського засобу сполуки формули (І) можуть знаходитися разом з звичайними фармацевтичними допоміжними речовинами у галогенових композиціях, як наприклад, таблетки, капсули, суппозиторм або розчини Ці готові лікарськи форми можливо одержати звичайними способами з використанням звичайних твердих носив, як наприклад, лактоза, крохмаль або тальк, або рідких розчинників, як наприклад, вода, жирні олії або рідкі парафіни, та при використанні фармацевтично звичайних допоміжних речовин, наприклад, як порофори для таблеток, агенти розчинення або консерванти Приклади, що наведені нище, повинні ретельніше пояснити винахід, але ніяким чином не обмежувати його об'єму застосування Приклад 1 [(1'R), 2R, 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14R]11 -(1 '-Гідроксипропіл)-3-х(2,6-дідезокси-3-С-метил3-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,6тридезокси-3-(М-метил-г\І-ізопропіламіно)-р-О-ксилогексопіразоліл)окси]-2,4,6,8,11 14-гексаметил10,13,15-три-оксацикло-[9 2Л 1 9 ]-пентадекан-1-он (суміш ізомерів сполуки формули (І), R1 = метил) Одержання N-дезметилерггроміцину А 20г Ерггроміцину А (27,2ммоль) та 11,2г (136, 2ммоль) ацетату натрію розчиняють у 200мл суміші метанолу з водою у відношенні 8 2 Розчин нагрівають до 47°С Потім додають 6,9г (136,2ммоль) йоду рН-Значення підтримують рівним 8 - 9 шляхом додавання розбавленого водного розчина гідроксиду натрію Після ЗГОДИН реакційну суміш з метою обробки виливають з 1л води та 20мл розчина гідроксиду аммонію Реакційну суміш екстрапрують етилацетатом, органічний екстракт промивають водою, що містить гідроксид амонію та концентрують Одержаний після видалення розчинника сирий продукт перекристалізовують з суміші ацетону з розчином гідроксиду аммонію у відношенні 50 З Т п л 143-148°С Б) Одержання М-дезметил-8,9-анпдроерггроміцин-А-6,9-полукеталя (сполука формули (V), R1 = метил) 21г Одержаного на стадії А) продукту розчиняють у НОмлльодяної оцетної кислоти, та розчин перемішують на протязі 1 години при кімнатній температурі Потім, З метою обробки, реакційну суміш при охолодженні льодом прикраплюють до 400мл концентрованого розчина гідроксиду аммонію Реакційну суміш екстрапрують етилацетатом, органічний екстракт а промивають водою, та розчинник видаляють Одержуємий у вигляді залишка сирий продукт перекристалізовують спочатку з ефіру та потім з метанолу Одержують 14г чистого продукту з Т п л 145°С 10 В) Одержання [2R (2'R, 3'R), 3S, 4S, 5R, 6R, і 11 R]-11 -(2 , 3'-діпдроксипент-2'-іл)-3-(2,6-дідезокси3-С-метил-3-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,6-тридезокси-3-метил-аміно)-[3-О-ксило~ гексопіразоліл)окси]-2,4,6,8,10-пентаметил-12,13дюксацикло [8 2 1]тридец-8-ен-1-она (сполука формули (III), R1 — метил) 9,4г (13,4ммоль) Одержаного на стадії Б) продукту разом х 1,9г (13,4) карбонату калію у метанолі кип'ятять з зворотним холодильником на протязі 2,5годин 3 метою обробки реакційну суміш концентрують, розбавляють водою та екстрагують етилацетатом Одержуємий після видалення розчинника сирий продукт перекрастилізовують з ізопропанолу Одержують 7,1г чистого продукту з Т пл 2 199 - 200°С, величина оптичного обертання [а] °о = -31,6 (с = 1, метанол) Г) Одержання [2R (2'R, 3R), 3S, 4S, 5R, 6R, 10R, 11R]-11-(2', 3'-діпдроксипент-2'іл)-3-[(2,6-дідезокси-3-С-метил3-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,6тридезокси-3-(г\І-метил-І\І-ізопропіламшо)-р-О-ксилогексо-піразоліл)окси]-2,4,6,8,10-пентаметил12,13-дюксабіцикло-[8 2 1]-тридец-8-ен-1-она (сполука формули (III), R1 = метил) 2г (2,8ммоль) Одержаного на стадії В) продукту розчиняють у метанолі та значення рН розчина встановлюють рівним шляхом додавання розбавленої соляної кислоти До розчину додають 2г молекулярного ситу (алюмосілікат кальцію, діаметр пор 4 А), ацетон у залишку та 0,4г (6,4ммоль) ціаноборпдриду натрію Реакційну суміш перемішують на протязі 12годин 3 метою обробки, відфільтровують від молекулярного ситу, фільтрат концентрують, змішують з водою та екструпрують етилацетатом Одержуємий у вигляді залишку після концентрирування етил ацетатного екстракту сирий продукт очищують шляхом колоночної хроматографії на сілікагелі (елюїручий засіб суміш етилацетату з метанолом у відношенні 95 5) Одержують 1,4г очищеного продукту з Т пл 130 - 134°С, величина оптичного оберту [а] °о = -32,8°С Д) Одержання цільової сполуки 30г Одержаного на стадії Г) продукту вносять у 2250мл води При перемішуванні до суміші прикраплюють концентровану соляну кислоту впритул до досягнення рН, що рівний 2 - 3 Потім реакційну суміш перемішують на протязі 7 годин при кімнатній температурі 3 метою обробки, до реакційної суміші додають концентрований розчин амміака впритул до досягнення значення рН, рівного 11 Після ЦЬОГО реакційну суміш екстрапрують діхлорметанолом Органічний екстракт концентрують Одержуємий після концентрирування діхлорметанового екстракту сирий продукт очищують шляхом перекристалізації з ацетонггрілу Одержують 19,6 цільової сполуки з Т пл 181 - 183°С, величина оптичного обертання [а]2°о = -52,2°С Розділення ізомерів Ізоміри розділяють шляхом полупрепаративної високоефективної рідинної хроматографії з розмірами 300мм (висоти) х 7,8мм (внутрішній діаметр) фірми ВОТЕРС Використовують колонку з зверненою фазою "Symmetry-Prep (R)"C 18 (7мкм) У якості елюїруючого засобу служить суміш з 600мл водного 0.05М розчину КН2РО4 з рН-значенням = 6,0 11 44310 12 (встановлюють за допомогою 1М розчина NaOH) гою колоночної хроматографії на сілікагелі Одерта 400мл ацетонітрілу жують 0,5 очищеного продукту з Т пл 147 - 155°С 2 Величина оптичного обертання [а] °о = -26,2°С При часі стримування 5,2 хвилини одержують 8R-i3OMip Б) Одержання цільової сполуки При часі стримування 6,8 хвилини одержують 1г Вищеодержаного продукту вводять у взає8S-i3OMip модію згідно описаному у прикладі 1Д) способу Одержують 0,47г цільової сполуки з N пл 201 Приклад 2 2 209С, оптичного обертання [а] °о = -45,8°С [(1'R), 2R, 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14R]11-(1'-Гідроксипропіл)-3-[(2,6-дідезокси-3-С-метилПриклад 1 3-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,6[(1'R), 2R, 3S, 4S, 5R, 6R, 9R, 11R, 12R, 14R]тридезокси-3-(М-ізопропіламіно)-[3-і-ксилогексопі11-(1'-Гідроксипропіл)-3-[(2,6-дідезокси-3-С-метилразоліл)окси]-2,4,6,8,11,14-гексаметил-10,13,153-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,696 три-оксацикло-[9 2 1 1 ]-пентадекан-1-он (суміш тридезокси-3-(г\І-метил-г\І-ізопропіламіно)-р-О-ксиізомерів сполуки формули (І), R1 = водень) логе ксопіразоліл)окси|-2,4^6,8,11,14-гексаметил9 6 10,13,15-триоксацикло-[9 2 1 1 ]-пентадекан-1-он А) Одержання (=суміш ізомерів сполуки формули (І), R1 = метил) [2R (2'R, 3'R), 3S, 4S, 5R, 6R, 10R, 11R]-11-(2', 20мг 3'-діпдроксипент-2'-іл)-3-[(2,6-дідезокси-3-С-метил3-О-метил-а-І_-рібо-гексопіранозіл)окси]-5-[(3,4,6тридезокси-3-(М-13опропшам5но)-[3-О-ксилогексокукурудзяний крохмаль 60мг піразоліл)окси]-2,4,6,8,10-пентаметил-12,13-дюксалактоза 135мг біцикло-[8 2 1]-тридец-8-ен-1-она желатин (у вигляді 10%-го розчину) бмг Суміш з 7,3 метилату натрію та 500мл метанолу в атмосфері азоту охолоджують до 0°С Потім Активна речовина, кукурудзяний крохмаль та прикраплюють розчин 20г одержаного у прикладі лактозу концентрують за допомогою 10%-ного роз1 Г) сполуки формули (II) (R1 = метил) у ЮОмл мечину желатину Пасту змільчують, та одержаний танолу Після ЦЬОГО порціями додають 34,1г йоду гранулят наносять на придатний пропускають чета реакційну суміш на протязі 24-х годин витримурез машину для зброблення (дроблення) та у смеють при температурі 0-5°С 3 метою обробки, реасителі змішують з наступними допоміжними речокційну суміш вносять у розчин 58г тиосульфату навинами трію та 48мл концентрованого розчина амміаку у 1,5л води Водну фазу екеструпрують чотирьохкра5мг тальк тно по ЮОмл хлороформ Об'єднані органічні фа5мг стереат магнію зи промивають один раз за допомогою суміші з 9мг кукурудзяний крохмаль 5мл концентрованого розчина амміака та ЮОмл води, сушать над сульфатом натрію та концентрута після цього пресують у таблетки масою по ють Одержуємий залишок очищують за допомо240мг п 13 44310 14 ДП "Український інститут промислової власності "(Укрпатент) Україна, 04119, Киів-119, вул сім'ї Хохлових, 15 (044) 456-20-90
ДивитисяДодаткова інформація
Автори англійськоюProishoff Ulf, FINNER, Emil
Автори російськоюПройшофф Ульф, Финнер Эмиль
МПК / Мітки
МПК: A61K 31/70, A61K 31/7048, A61K 31/7042, C07H 17/08, A61P 1/00, A61P 43/00
Мітки: одержання, 1'r),2r,3s,4s,5r,6r,9r,11r,12r,14r]-11-(1'-гідроксипропіл)-2,4,6,8,11,14-гексаметил-10,13,15-триоксатрицикло[9.2.1.1.9.6]пентадекан-1-ону, лікарські, сполуки, засоби, похідні, містять, спосіб
Код посилання
<a href="https://ua.patents.su/7-44310-pokhidni-1r2r3s4s5r6r9r11r12r14r-11-1-gidroksipropil-24681114-geksametil-101315-trioksatriciklo921196pentadekan-1-onu-sposib-kh-oderzhannya-ta-likarski-zasobi-shho-mistyat-ci-spolu.html" target="_blank" rel="follow" title="База патентів України">Похідні [(1’r),2r,3s,4s,5r,6r,9r,11r,12r,14r]-11-(1′-гідроксипропіл)-2,4,6,8,11,14-гексаметил-10,13,15-триоксатрицикло[9.2.1.1.9.6]пентадекан-1-ону, спосіб їх одержання та лікарські засоби, що містять ці сполуки</a>
Попередній патент: Спосіб хімічної інфільтрації в паровій фазі для ущільнення пористих волокнистих заготовок, розташованих кільцеподібно штабелями
Наступний патент: Дисковий фільтр
Випадковий патент: Навісне розпушувальне обладнання