Спосіб одержання енантіомерно чистих сполук імідазолілу та енантiомерно чиста кисла адитивна сіль імідазолілу
Номер патенту: 48947
Опубліковано: 16.09.2002
Автори: Жан-Маартен Вербеек, Паулюс Франціскус Корнеліс ван дер Мей
Формула / Реферат
1. Способ получения энантиомерно чистого соединения имидазолила общей формулы (I):
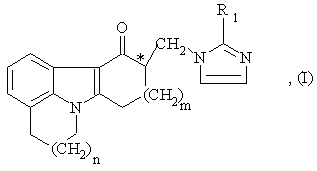
где n = 0 или 1,
m = 1 или 2,
R1 - водород, метил или этил и
С* - хиральный центр,
а также его фармацевтически приемлемой кислой аддитивной соли;
а) путем добавления карбоновой кислоты в оптически активной форме к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизующейся кислой аддитивной соли указанной смеси энантиомеров соединения I, обогащенной по одному энантиомеру, от маточной жидкости, обогащенной по другому энантиомеру;
б) после обогащения кристаллизующейся кислой аддитивной соли по нежелательному энантиомеру путем последующего отделения смеси энантиомеров в маточной жидкости от указанной оптически активной карбоновой кислоты с последующим добавлением рацемической смеси указанной карбоновой кислоты к раствору полученной смеси изомеров I и отделением кристаллизирующейся кислой аддитивной соли указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости;
в) произвольно перекристаллизуют продукт до достижения нужной степени энантиометрной чистоты;
г) затем преобразуют эту кислую аддитивную соль целевого энантиомера в целевое энантиомерно чистое соединение имидазолила общей формулы (I) или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве указанной карбоновой кислоты используют пироглутаминовую кислоту.
2. Способ получения энантиомерно чистого соединения имидазолила общей формулы (I) по п.1, в котором n, m, R1 и С* имеют те же значения, что в п.1,
а также его фармацевтически приемлемой кислой аддитивной соли;
а) путем добавления оптически активной карбоновой кислоты к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизующейся кислой аддитивной соли из указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости;
б) произвольно перекристаллизуют продукт до достижения нужной степени энантиометрной чистоты;
в) преобразования полученной кислой аддитивной соли в целевое энантиомерно чистое соединение имидазолила общей формулы (I)или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве оптически активной карбоновой кислоты используют D-пироглутаминовую кислоту.
3. Способ получения энантиомерно чистого соединения имидазолила общей формулы (I) по п.1, в котором n, m, R1 и С* имеют те же значения, что в п.1,
а также его фармацевтически приемлемой кислой аддитивной соли;
а) путем добавления карбоновой кислоты в оптически активной форме к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизующейся кислой аддитивной соли из указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости;
б) с последующим отделением смеси энантиомеров в маточной жидкости от указанной карбоновой кислоты, добавлением рацемической смеси указанной карбоновой кислоты, отделением кристаллизующейся кислой аддитивной соли указанной смеси энантиомеров соединения I, обогащенной по целевому энантиомеру, от маточной жидкости;
в) произвольно перекристаллизуют продукт до достижения нужной степени энантиометрной чистоты;
г) преобразования полученной кислой аддитивной соли в целевое энантиомерно чистое соединение имидазолила общей формулы (I)или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве карбоновой кислоты используют пироглутаминовую кислоту, а в качестве ее оптически активной формы-L-форму указанной карбоновой кислоты.
4. Способ по любому из пп.1-3, в котором получают соединение формулы (I), где
n = 1,
m = 1,
R1- метил и
атом С* имеет R-конфигурацию.
5. Способ по любому из пп.1-4, отличающийся тем, что пироглутаминовую кислоту в оптически активной форме вводят в количестве от 0,2 до 1,5 эквивалента в расчете на исходную рацемическую смесь.
6. Способ по любому из предшествующих пунктов, отличающийся тем, что кристаллизацию проводят в спиртовом растворителе.
7. Способ по п.6, отличающийся тем, что кристаллизацию проводят в метаноле или этаноле.
8. Способ по любому из пп.1-7, отличающийся тем, что маточную жидкость или смесь маточных жидкостей после отделения кристаллизующейся кислой аддитивной соли подвергают последующей обработке путем (I) расщепления растворенной кислой аддитивной соли с получением раствора смеси энантиомеров соединения имидазолила формулы (I) по п.1 с пониженным содержанием целевого энантиомера и (II) последующего преобразования указанного раствора в рацемическую смесь под действием основания.
9. Способ по п.8, отличающийся тем, что для рацемизации применяют неорганическое основание, предпочтительно гидроксид щелочного металла.
10. Кислая аддитивная соль энантиомерно чистого соединения имидазолила общей формулы (I) по п.1, где n, m, R1 и С* имеют те же значения, что в п.1, с D-пироглутаминовой кислотой.
11. Кислая аддитивная соль энантиомерно чистого соединения имидазолила общей формулы (I) по п.1, где n, m, R1 и С* имеют те же значения, что в п.4, с D-пироглутаминовой кислотой.
12. Кислая аддитивная соль энантиомерно чистого соединения имидазолила общей формулы (I) представленной в п.1, где n, m, R1 и С* имеют те же значения, что в п.1 и L-пироглутаминовой кислотой.
13. Кислая аддитивная соль энантиомерно чистого соединения имидазолила общей формулы (I) представленной в п.1, где n, m, R1 и С* имеют те же значения, что в п.4 и L-пироглутаминовой кислотой.
14. Способ по любому из пп.1-9, отличающийся тем, что соединение общей формулы (I) выделяют в качестве его гидрохлорида моногидрата.
15. Соединение общей формулы (I) как описано в п.1, где n, m, R1 и С* имеют те же значения, как приведено в пункте 1, в качестве его гидрохлорида моногидрата.
16. Соединение общей формулы (I) как описано в п.1, где n, m, R1 и С* имеют те же значения, как приведено в пункте 4, в качестве его гидрохлорида моногидрата.
Текст
Способ получения энантиомерно чистого соединения имидазолила общей формулы (I) R О (і) хеш где п = 0 или 1, m = 1 или 2, Ri - водород, метил или этил и С* - хиральный центр, а также его фармацевтически приемлемой кислой аддитивной соли, а) путем добавления карбоновой кислоты в оптически активной форме к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизующейся кислой аддитивной соли указанной смеси энантиомеров соединения I, обогащенной по одному энантиомеру, от маточной жидкости, обогащенной по другому энантиомеру, б) после обогащения кристаллизующейся кислой аддитивной соли по нежелательному энантиомеру путем последующего отделения смеси энантиомеров в маточной жидкости от указанной оптически активной карбоновой кислоты с последующим добавлением рацемической смеси указанной карбоновой кислоты к раствору полученной смеси изомеров I и отделением кристаллизирующейся кислой аддитивной соли указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости, в) произвольно перекристаллизуют продукт до достижения нужной степени энантиометрной чистоты, г) затем преобразуют эту кислую аддитивную соль целевого энантиомера в целевое энантиомерно чистое соединение имидазолила общей формулы (I) или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве указанной карбоновой кислоты используют пироглутаминовую кислоту 1 Способ получения энантиомерно чистого соединения имидазолила общей формулы (І) по п 1, в котором n, m, Ri и С* имеют те же значения, что в п 1, а также его фармацевтически приемлемой кислой аддитивной соли, а) путем добавления оптически активной карбоновой кислоты к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизующейся кислой аддитивной соли из указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости, б) произвольно перекристаллизуют продукт до достижения нужной степени энантиометрной чистоты, в) преобразования полученной кислой аддитивной соли в целевое энантиомерно чистое соединение имидазолила общей формулы (І)или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве оптически активной карбоновой кислоты используют Dпироглутаминовую кислоту 1 Способ получения энантиомерно чистого соединения имидазолила общей формулы (І) по п 1, в котором n, m, Ri и С* имеют те же значения, что в п 1, а также его фармацевтически приемлемой кислой аддитивной соли, О 00 З 48947 а) путем добавления карбоновой кислоты в оптижидкостей после отделения кристаллизующейся чески активной форме к раствору рацемической кислой аддитивной соли подвергают последуюсмеси вышеуказанного соединения I с последующей обработке путем (I) расщепления растворенщим отделением кристаллизующейся кислой адной кислой аддитивной соли с получением расдитивной соли из указанной смеси, обогащенной твора смеси энантиомеров соединения по целевому энантиомеру, от маточной жидкости, имидазолила формулы (І) по п 1 с пониженным б) с последующим отделением смеси энантиомесодержанием целевого энантиомера и (II) послеров в маточной жидкости от указанной карбоновой дующего преобразования указанного раствора в кислоты, добавлением рацемической смеси укарацемическую смесь под действием основания занной карбоновой кислоты, отделением кристал9 Способ по п 8, отличающийся тем, что для лизующейся кислой аддитивной соли указанной рацемизации применяют неорганическое основасмеси энантиомеров соединения I, обогащенной ние, предпочтительно гидроксид щелочного мепо целевому энантиомеру, от маточной жидкости, талла в) произвольно перекристаллизуют продукт до 10 Кислая аддитивная соль энантиомерно чистого достижения нужной степени энантиометрной чиссоединения имидазолила общей формулы (I) по тоты, п 1, где n, m, Ri и С* имеют те же значения, что в п 1, с D-пироглутаминовой кислотой г) преобразования полученной кислой аддитивной соли в целевое энантиомерно чистое соединение 11 Кислая аддитивная соль энантиомерно чистого имидазолила общей формулы (1)или его фармасоединения имидазолила общей формулы (I) по цевтически приемлемую кислую аддитивную соль, п 1, где n, m, Ri и С* имеют те же значения, что в отличающийся тем, что в качестве карбоновой п 4, с D-пироглутаминовой кислотой кислоты используют пироглутаминовую кислоту, а 12 Кислая аддитивная соль энантиомерно чистого в качестве ее оптически активной формы-1_-форму соединения имидазолила общей формулы (I) указанной карбоновой кислоты представленной в п 1, где n, m, Ri и С* имеют те же значения, что в п 1 и L-пироглутаминовой ки4 Способ по любому из пп 1-3, в котором получаслотой ют соединение формулы (I), где 13 Кислая аддитивная соль энантиомерно чистого п = 1, соединения имидазолила общей формулы (I) ш= 1, представленной в п 1, где n, m, Ri и С* имеют те Rr метил и же значения, что в п 4 и L-пироглутаминовой киатом С* имеет R-конфигурацию слотой 5 Способ по любому из пп 1-4, отличающийся тем, что пироглутаминовую кислоту в оптически 14 Способ по любому из пп 1-9, отличающийся активной форме вводят в количестве от 0,2 до 1,5 тем, что соединение общей формулы (I) выделяют эквивалента в расчете на исходную рацемическую в качестве его гидрохлорида моногидрата смесь 15 Соединение общей формулы (I) как описано в 6 Способ по любому из предшествующих пунктов, п 1, где n, m, Ri и С* имеют те же значения, как отличающийся тем, что кристаллизацию провоприведено в пункте 1, в качестве его гидрохлоридят в спиртовом растворителе да моногидрата 7 Способ по п 6, отличающийся тем, что кри16 Соединение общей формулы (I) как описано в сталлизацию проводят в метаноле или этаноле п 1, где n, m, Ri и С* имеют те же значения, как 8 Способ по любому из пп 1-7, отличающийся приведено в пункте 4, в качестве его гидрохлоритем, что маточную жидкость или смесь маточных да моногидрата Настоящее изобретение относится к способу получения энантиомерно чистого соединения имидазолила, а также кислой аддитивной соли этого соединения 4,5,6,8,9,10-гексагидро-10-[(2-метил-1 Нимидазол-1-ил)метил-11Н-пиридо[3,2,1]к]карбазол-11 -он известен из Европейского патента № 0297651 и заявки № 0601345 В первой публикации описаны общий класс соединений, включая вышеуказанное соединение имидазолила и гомологичные ему соединения, их получение и применение в качестве 5-НТ антагонистов Во второй заявке речь идет о применении соединения, выбранного из этого типа, для лечения некоторых заболеваний Различные биологически активные вещества, применяемые в фармакологических составах для лечения людей или животных, содержат в своей молекулярной структуре хиральный центр, что порождает оптический изомеризм Специалистам хорошо известно, что часто лишь один из энан тиомеров обладает необходимой биологической активностью Наличие в составе или композиции другого оптического антипода может вызвать или усилить некоторые побочные явления и причинить вред реципиенту, т е организму человека или животного Поэтому считается все в большей степени желательным вводить биологически активное вещество в виде по существу чистого энантиомера, который наиболее ярко проявляет необходимую биологическую активность Вот почему разделение рацемата на составляющие его энантиомеры часто является важной стадией в технологии изготовления фармакологически активных веществ Установлено, что R-(-)-3HaHTH0Mep вышеуказанного соединения имидазолила, известный также под тривиальным названием цилансетрон, особенно полезен в составах, приведенных в Европейской заявке № 0601345 Поэтому желательно разработать способ отделения R-энантиомера от рацемата 48947 По существу известны три способа разделения рацематов на соответствующие энантиомеры Первый из них - разделение на основе различий в физических свойствах, например в кристаллической структуре, -применяется лишь изредка Более поздний способ разделения предусматривает введение энзимов с целью селективной химической модификации энантиомера в рацемате с последующим отделением модифицированного энантиомера от немодифицированного Третий, наиболее распространенный способ разделения заключается в реакции с промышленно выпускаемым оптически активным реактивом с получением диастереомеров, обладающих различными физическими свойствами Полученные таким путем диастереомеры можно разделить, например, кристаллизацией, после чего выделить нужный энантиомер химической обработкой Специалистам хорошо известно, что разделение энантиомеров путем приготовления диастереомеров - весьма сложная задача Даже опытные исследователи находят, что некоторые соединения не поддаются химическому разделению как отдельными разделяющими агентами, так и их сочетаниями при различных условиях реакции Как правило, исследователи в области разделения энантиомеров начинают опыты с использования тех реактивов и условий реакции, которые ранее уже показали свою эффективность при разделении подобных соединений Наиболее распространенный способ разделения рацематов вышеописанных соединений имидазолила заключается в реакции с какой-либо оптически активной кислотой с последующим разделением полученных диастереомеров, предпочтительно кристаллизацией В Европейской заявке № 0297651 описано применение (+)ди-0,0'-птолуил-О-винной кислоты По всей видимости, эта оптически активная карбоновая кислота оптимальна для разделения подобных рацематов, поскольку та же кислота использовалась и для разделения химически близкого соединения имидазолила - 1,2,3,9-тетрагидро-9-метил-3-[(2метил-1 Н-имидазол-1 -ил)метил]-4Н-карбазол-4она, или ондансетрона (см , например, патент Нидерландов 190373, пример XX) Это особенно примечательно с учетом того обстоятельства, что разделение с помощью (+)-ди-О,О'-п-толуил-0винной кислоты связано с рядом недостатков, например, с использованием малоэффективного растворителя - смеси диметилформамида с водой Раствор, разбавленный такой смесью, экономически невыгоден или даже неприемлем Более того, как растворитель диметилформамид обладает такими общеизвестными недостатками, как высокая точка кипения и заметная токсичность (подозревается канцерогенность) Наряду с вышеуказанной оптически активной ди-О,О'-п-толуил-0-винной кислотой промышленно выпускается ряд хиральных дикарбоновых, хиральных сульфоновых и хиральных монокарбоновых кислот, например, дибензоил-Ьвинная, Lвинная, L-яблочная, D-камфор-Ю-сульфоновая, D-хинная, 2,3 4,6-ди-О-изопропилиден-2-кето-І_ гулоновая, L-миндальная, R-2-(4гидроксифенокси) пропионовая кислоты и (-)-1,3,2диоксофосфоринан-5,5-диметил-2-гидрокси-4фенил-2-оксид Однако, как будет показано в примерах, эти либо никак не способствуют осаждению аддитивной соли одним из энантиомеров, либо не обогащают один из энантиомеров в осадке Задачей настоящего изобретения является создание экономичного способа получения энантиомерно чистых соединений имидазолила, отвечающего следующим требованиям а) использование эффективного растворителя и ведение реакции без разбавления, б) легкость регенерации дорогостоящей хиральной кислоты Поставленная задача достигается тем, что способ получения энантиомерно чистого соединения, имидазолила общей формулы где п = 0 или 1 m = 1 или 2 Ri - водород, метил или этил, и С* - хиральный центр, а также его фармакологически приемлемой кислой аддитивной соли, в котором а) добавляют карбоновую кислоту в оптически активной форме к раствору рацемической смеси вышеуказанного соединения I с последующим отделением кристаллизованной кислой аддитивной соли указанной смеси энантиомеров соединения I, обогащенной одним из энантиомеров, от маточной жидкости, обогащенной другим энантиомером, б) после обогащения кристаллизованной кислой аддитивной соли нежелательным энантиомером отделяют смесь энантиомеров в маточной жидкости от указанной оптически активной карбоновои кислоты с последующим добавлением рацемической смеси указанной карбоновои кислоты к раствору полученной смеси изомеров I и отделением кристаллизованной кислой аддитивной соли указанной смеси, обогащенной по целевому энантиомеру, от маточной жидкости, в) произвольно перекристаллизовывают продукт до достижения нужной степени энантиомерной чистоты, г) затем преобразуют эту кислую аддитивную соль целевого энантиомера в целевое энантиомерно чистое соединение имидазолила общей формулы I или его фармацевтически приемлемую кислую аддитивную соль, отличающийся тем, что в качестве указанной карбоновои кислоты используют пироглутаминовую кислоту Когда образующаяся кислая аддитивная соль обогащается по целевому энантиомеру, ее можно 48947 выделить и после доведения до нужной степени энантиомерной чистоты путем последующей обработки преобразовать в целевое энантиомерно чистое соединение имидазола или его фармацевтически приемлемую кислую аддитивную соль Для удобства такая прямая кристаллизация целевого энантиомера предпочтительна Когда кислая аддитивная соль, образованная при добавлении оптически активной пироглутаминовой кислоты, обогащается нежелательным энантиомером, используется прием взаимного разделения (Ehel, E L , Wilen, S Н and Mander, L N в сб Stereochemistry or Organic Compaunds, John Wiley & Sons, Inc , New York (1994), 325) Он заключается в том, что после первой стадии разделения, на которой кислая аддитивная соль обогащается нежелательным энантиомером, оптически активную пироглутаминовую кислоту удаляют из сухого осадка, полученного из маточной жидкости, например, путем экстракции растворителем - системой дихлорметан - вода Затем осуществляют вторую стадию, добавляя рацемическую пироглутаминовую кислоту в раствор полученной смеси изомеров I, что приводит к кристаллизации кислой аддитивной соли целевого энантиомера С учетом того обнаруженного нами (см примеры) обстоятельства, что химически близкое соединение имидазолила ондастерон - нельзя выделить в его оптических антиподах с помощью активной пироглутаминовой кислоты, удивительно то, что вышеуказанный целевой энантиомер общей формулы I легко выделить с помощью пироглутаминовой кислоты в оптически активной форме, после чего при желании добавить рацемическую пироглутаминовую кислоту, при соблюдении вышеуказанных требований Неожиданным оказался и тот факт, что пироглутаминовая кислота столь благотворно воздействует на разделение рацемата соединения имидазолила формулы I, с учетом весьма посредственных результатов применения множества других разделяющих агентов Энантиомерно чистое соединение имидазолила в соответствии с настоящим изобретением относится к оптически активным соединениям, имеющим избыток энантиомера (ИЭ) свыше 90% Кристаллическую кислую аддитивную соль целевого энантиомерно чистого соединения имидазолила, получаемую в соответствии с изобретением, можно преобразовать в чистый собственно энантиомер приемами, хорошо известными в расщеплении солей Как правило, можно проводить расщепление под действием какого-либо основания, получая свободное энантиомерно чистое имидазолильное основание При желании указанное имидазолильное основание можно перевести в фармацевтически приемлемую кислую аддитивную соль путем обработки кислотой - соляной, малеиновой или иной, как описано в Европейской заявке №601345 Настоящее изобретение относится, в частности, и к способу получения цилансетрона, т е энантиомерно чистого соединения имидазолила общей формулы I, где т и п оба равны 1, Ri - метил, и атом С* имеет R-конфигурацию Процесс кристаллизации, т е отдаления кри 8 сталлизующейся кислой аддитивной соли целевого энантиомера или, по меньшей мере, рацемата, обогащенного целевым энантиомером, предпочтительно осуществляют в спиртовом растворителе В качестве спиртовых растворителей для процесса кристаллизации можно использовать метанол и этанол В способе в соответствии с изобретением используемая оптически активная кислота D-пироглутаминовая [Р-2-пирролидон-5карбоновая кислота] при прямой кристаллизации и L-пироглутаминовая кислота [Э-2-пирролидон-5карбоновая кислота] при взаимном разделении цилансетрона предпочтительно вводится в количестве от 0,2 до 1,5 эквивалента в расчете на исходную рацемическую смесь Отношение объема растворителя к количеству энантиомеров в разделяемой смеси может варьироваться в достаточно широких пределах При прямой кристаллизации отношение количества растворителя к количеству энантиомеров может составлять от около 3 1 до 15 1 (отношение между объемом растворителя и массой энантиомеров в нем) Предпочтительно это отношение составляет от около 5 1 до около 10 1 В предпочтительном варианте осуществления изобретения объем растворителя и масс энантиомеров соотносится как 7 1 При взаимном разделении отношение количества растворителя к количеству энантиомеров составляет около 3 1 до 15 1 на первой стадии и от 5 1 до 15 1 на второй стадии Предпочтительно оно равно от около 5 1 до около 10 1 на первой стадии и от 7 1 до 12 1 на второй стадии В предпочтительном варианте осуществления изобретения объем растворителя и масс энантиомеров соотносится как около 7 1 на первой стадии и 10 1 на второй стадии Раствор, содержащий энантиомеры, можно получить путем растворения смеси энантиомеров в растворителе Обычно растворение осуществляют при температуре от около 25°С до 80°С, предпочтительно от около 50°С до около 60°С Кристаллизацию можно проводить при температуре от около -20°С до +20°С, но обычно ее осуществляют при температуре от около -10°С до около 0°С Впрочем, выход целевого энантиомера остается неудовлетворительным теоретически менее 50% от исходного рацемата В качестве дополнительного признака настоящего изобретения нами установлено, что маточную жидкость или смесь маточных жидкостей от процессов кристаллизации можно подвергать дополнительной обработке, включая стадию рацемизации, что позволяет повысить общий выход целевого энантиомера до более 50% в результате последующей кристаллизации, как описано выше Следовательно, настоящее изобретение относится также к описанному выше способу, отличающемуся тем, что маточную жидкость или смесь маточных жидкостей после отделения кристаллической кислой аддитивной соли подвергают последующей обработке путем (I) отщепления растворенной кислой аддитивной соли с образованием раствора смеси энантиомеров соединения имидазолила общей формулы I, как представлено выше, содержащей пониженное количество целе 48947 вого энантиомера, и (II) последующего преобразования указанного раствора в рацемическую смесь под действием основания В случае взаимного разделения кислую аддитивную соль, обогащенную нежелательным энантиомером, можно при желании добавить к маточной жидкости или их смеси В качестве основания при рацемизации предпочтительно служит неорганическое основание, например гидрооксид щелочного металла После вышеописанной рацемизации восстановленный рацемат можно вновь подвергнуть указанному процессу кристаллизации с применением оптически активной пироглутаминовой кислоты, при желании с последующим вводом рацемической пироглутаминовой кислоты с целью обеспечить дополнительный выход энантиомерно чистого соединения имидазолила При желании маточную жидкость или смесь маточных жидкостей от этой кристаллизации можно вновь рацемировать и т д и т п , тем самым можно заметно увеличить общий выход целевого энантиомера Технологически и экономически целесообразно добавлять восстановленный рацемат к исходному рацемату при следующей обработке с тем, чтобы в конечном счете практически исключить потери сырья Кислая аддитивная соль энантиомерно чистого соединения имидазолила общей формулы І, в частности цилансетрона и D-пиролутаминовой кислоты, обладает существенной новизной Таким образом, настоящее изобретение относится также к этой кислой аддитивной соли, которую можно получить вышеописанным способом кристаллизации Далее изобретение будет описано более подробно со ссылками на нижеследующие конкретные примеры Пример 1 Получение (Р)-(-)-4,5,6,8,9,10-гексагидро-10-[2метил-1 Н-имидазол-1 -ил)метил]-11 Н-пиридо[3,2,1-jk]-Kap6a3on-11-OH гидрохлорида моногидрата (цилансетрона) прямым разделением 25,00г (RS)-4,5,6,8,9,10-reKcarHflpo-10-[(2-Me™-|-1Hимидазол-1-ил)метил]-11Н-пиридо-[3,2,1-]к]карбазол-11 -она и 10,11 г Р-2-пирролидон-5карбоновой кислоты (D-пироглутаминовой кислоты) в 175мл метанола нагревают до 50°С Полученную суспензию диастереомерных солей перемешивают 1 час при этой температуре Смесь охлаждают до 0°С и перемешивают 1 час при этой температуре Твердую фазу отсасывают, промывают холодным метанолом и сушат Выход 25,91г Процесс кристаллизации повторяют еще дважды с расходом метанола 5мл на 1г получаемой соли в первый раз и 10мл во второй раз Выход 11,9 г Маточные жидкости от трех этапов кристаллизации сливают вместе и используют на новой стадии 10,00г полученной соли перемешивают 15 мин с 200мл воды, 50мл дихлорметана и 6,00г бикарбоната натрия После разделения фаз водную фазу дважды экстрагируют 25мл дихлорметана Дихлорметановые фазы сливают и упаривают досуха Полученное сухое вещество растворяют в 10 60мл изопропанола и добавляют к раствору 2,5мл концентрированной соляной кислоты при комнатной температуре Перемешивают 1 час и отсасывают образовавшееся твердое вещество, промывают холодным изопропанолом и петролеиным эфиром в отношении 40 65 и сушат Выход целевого соединения 7,93г (ИЭ 94%) Точка плавления 219°С [a] D 2 5 = -6,9 (С = 1,8, метанол) Пример 2 Получение (Р)-(-)-4,5,6,8,9,10-гексагидро-10-[2метил-1 Н-имидазол-1 -ил)метил]-11 Н-пиридо[3,2,1 -jkJ-карбазол-И -она гидрохлорида моногидрата (цилансетрона) взаимным разделением 25,00г(РЗ)-4,5,6,8,9,10-гексагидро-10[(2-метил-1Нимидазол-1-ил)метил]-11Н-пиридо-[3,2,1-]к]карбазол-11 -она и 10,11 г 3-2-пирролидон-5карбоновой кислоты (L-пироглутаминовой кислоты) в 175мл метанола нагревают до 50°С Полученную суспензию диастереометрических солей перемешивают 1 час при этой температуре Смесь охлаждают до 0°С и перемешивают 1 час при этой температуре Твердое вещество отсасывают, промывают холодным метанолом и сушат Выход 18,5г Метанол выпаривают из маточной жидкости Остаток перемешивают 15 мин с 200мл воды, 50мл дихлорметана и 6,00г бикарбоната натрия После разделения фаз водную фазу дважды экстрагируют 25мл дихлорметана Дихлорметановые фазы сливают и упаривают досуха Полученное сухое вещество (11,50г) и 4,75г РЗ-пирролидон-5карбоновой кислоты (D, L-пироглутаминовой кислоты) растворяют в 115мл метанола и нагревают с обратным холодильником Раствор охлаждают до комнатной температуры и перемешивают при ней 1 час Отсасывают образовавшееся твердое вещество, промывают холодным метанолом и сушат Выход 6,00г (ИЭ 97%) 5,00г полученной таким образом соли перемешивают 15 мин со 100мл воды, 25мл дихлорметана и 3,00г бикарбоната натрия После разделения фаз водную фазу дважды экстрагируют 12,5мл дихлорметана Дихлорметановые фазы сливают и упаривают досуха Полученное сухое вещество растворяют в 30мл изопропанола К раствору добавляют 1,25мл концентрированной соляной кислоты при комнатной температуре После 1 ч перемешивания полученное твердое вещество отсасывают, промывают холодным изопропанолом и петролеиным эфиром 1 в отношении 40 65 и сушат Выход целевого соединения 3,95г (ИЭ 98%) Точка плавления 219°С Пример 3 Рацемизация слитых маточных жидкостей до (R,S)-(-)-4,5,6,8,9,10-reKcarHflpo-10-[(2-Me™-|-1Hимидазол-1-ил)метил]-11Н-пиридо-[3,2,1-]к]карбазол-11-она и извлечение второго сбора Rэнантиомера прямым разделением Метанол выпаривают из слитых маточных жидкостей по примеру 1 Остаток перемешивают с 250мл воды, 100мл дихлорметана и 10,00г бикарбоната натрия После разделения фаз водную фазу экстрагируют 50мл дихлорметана Дихлорметановые фазы сливают и упаривают 11 12 Дополнительный выход целевого соединения -3,12г(ИЭ95%) Точка плавления -219°С Таким же образом можно рацемизировать и кристаллизировать (прямым или взаимным разделением) маточные жидкости по примеру 2 в смеси с кислой аддитивной солью, обогащенной по нежелательному энантиомеру Пример 4 Попытки разделения R,S-1,2,3,9-TeTparnflpo-9метил-3-[(2-метил-1 Н-имидазол-1 -ил)метил]-4Нкарбазол-4-она (ондасетрона) 0,50г (R,S)-1,2,3,9тетрагидро-9-метил-3-[(2-метил-1 Н-имидазол-1 ил)метил]-4Н-карбазол-4-она и 0,22г R-2пирролидон-5-карбоновой кислоты нагревают в 5,0мл метанола до 50°С Полученный светлый раствор охлаждают до 0°С за 30 мин После 1 ч перемешивания при 0°С полученные кристаллы отсасывают, промывают холодным метанолом и сушат Выход - 0,02г Высокоэффективная жидкостная хроматография показывает отношение R/S 1 1 Это означает, что обогащение не имеет места Опыт повторяют в тех же условиях, но вместо 5,0мл метанола берут 1,5мл Выход - 0,12г Отношение R/S также составляет 1 1 48947 досуха Полученное твердое вещество растворяют в 90мл метанола и 20мл воды С целью рацемизации добавляют раствор 20г гидроксида калия в 5мл воды После 30 мин перемешивания реакционную смесь нейтрализуют 2N соляной кислоты К этому раствору добавляют 500мл воды Водно-метанольную фазу экстрагируют 100мл дихлорметана, затем дважды по 50мл Слитые дихлорметановые фазы упаривают досуха К полученному сухому веществу добавляют 6,1 г R-2 пирролидон-5-карбоновой кислоты и 75г метанола Температуру поднимают до 50°С Полученную суспензию диастереомерных солей перемешивают 1 час при этой температуре Смесь охлаждают до 0°С и перемешивают 1 час при этой температуре Твердое вещество отсасывают, промывают холодным метанолом и сушат Выход аддитивной соли - 7,49г Этот процесс кристаллизации повторяют еще дважды с расходом метанола на 1г получаемой соли 5мл в первом случае и 10мл во втором случае Выход - 4,97г Полученную соль перемешивают 15 мин со 100мл воды, 25мл дихлорметана и 3,00г бикарбоната натрия После разделения фаз водную фазу дважды экстрагируют 15мл дихлорметана Слитые дихлорметановые фазы упаривают досуха Полученное сухое вещество растворяют в 30мл изопропанола К этому раствору добавляют 1,3мл концентрированной соляной кислоты при комнатной температуре После 1 ч перемешивания полученное твердое вещество отсасывают, промывают холодным изопропанолом и петролейным эфиром в отношении 40 65 и сушат Пример 5 Сравнительные опыты По процедуре, описанной в примере 1, исследуют выделение цилансетрона из рацемата с применением ряда промышленно выпускаемых оптически активных кислот Полученные результаты приведены в прилагаемой таблице Из этих результатов можно заключить следующее Вывод только применение Dпироглутаминовой кислоты ^-2-пирролидон-5карбоновой кислоты) позволяет добиться требуемого обогащения по R-энантиомеру Таблица Кислота Ди-О-О' -р-толуил-О-винная кислота Ди-О-О'-р-толуил-І_-винная кислота Дибензоил-Ьмоногидрат винной кислоты L-винная кислота L-яблочная кислота D-камфор-і 0-моногидрат сульфоновой кислоты D-хинная кислота 2,3 4,6 -Ди-О-изопропилиден-2-кето-1_кулоновая кислота L-миндальная кислота ^)-2-(4-гидрокси-фенокси)-пропионовая кислота (-)-1,3,2-Диоксифосфоринон-5,5-диметил-2гидрокси-4-(фенил)-2-оксид R-2-пиppoлидoн-5-кapбoнoвaя кислота 96% этанол 1, R = S і, R = S 100% этанол 1,R
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparation of enantiomerically pure imidazolyl compounds and enantiomerically pure acid additive salt of imidazolyl
Назва патенту російськоюСпособ получения энантиомерно чистых соединений имидазолила и энантиомерно чистая кислая адитивная соль имидазолила
МПК / Мітки
МПК: C07D 471/06, A61P 43/00, C07D 487/06, A61K 31/41, A61K 31/435, C07D 233/54
Мітки: одержання, сполук, енантіомерно, адитивна, імідазолілу, сіль, спосіб, чистих, чиста, кисла
Код посилання
<a href="https://ua.patents.su/7-48947-sposib-oderzhannya-enantiomerno-chistikh-spoluk-imidazolilu-ta-enantiomerno-chista-kisla-aditivna-sil-imidazolilu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання енантіомерно чистих сполук імідазолілу та енантiомерно чиста кисла адитивна сіль імідазолілу</a>
Попередній патент: Засіб “фладекс” для лікування дерматозів
Наступний патент: Рідке паливо для двигуна внутрішнього згоряння
Випадковий патент: Лікувально-профілактичний комплекс











